线粒体是细胞通过有氧呼吸将化学能转化为ATP直接为细胞供能的重要场所,主要通过氧化磷酸化和三羧酸循环进行[1]。与氧化磷酸化相关的酶位于线粒体内膜上,主要由5种复合体组成,这5种复合体构成线粒体的呼吸电子传递链,对植物呼吸作用及能量的代谢发挥着重要作用。因此,呼吸速率能宏观反映植物能量代谢水平[2]。
当线粒体中复合体活性变化时,会导致线粒体整体功能的异常,致使细胞无法满足生长发育的需求,导致细胞质雄性不育的发生[3]。在红麻[4]、胡萝卜[5]、水稻[6]、辣椒[7]等作物中,都表现出CMS不育系的呼吸速率低于保持系的趋势。呼吸作用的目的是制造ATP,植物细胞绝大部分ATP由线粒体内ATP合成酶合成。ATP合成酶功能的执行,需要利用由复合体Ⅰ、Ⅱ、Ⅳ构成的NADH呼吸链,或者由复合体Ⅱ、Ⅲ、Ⅳ构成的FADH2呼吸链提供质子浓度梯度[8-9]。在花药发育过程中,不育系呼吸作用三羧酸循环、电子传递、氧化磷酸化等过程异常,造成ATP含量降低和线粒体功能紊乱,最终导致CMS的发生[10]。研究表明,玉米WF9-CMS-C、WF9-CMS-S、WF9-CMS-T复合体Ⅱ活性和可育材料WF9间存在差异[11],海岛棉不育系H276A中复合体Ⅳ和复合体Ⅴ活性显著降低[12],红麻不育系UG93A中复合体Ⅴ活性显著低于保持系和恢复系[13]。前人通过玉米同质异核不育系C黄早四、C478、C48-2的线粒体蛋白质组学分析,发现了大量与线粒体能量代谢相关的差异蛋白质,进一步揭示了小孢子发育过程中能量的供给不足是导致花粉败育的主要原因,同时CMS-C的败育还可能涉及细胞凋亡、细胞结构破坏等因素[14]。
K932S为四川正红生物技术有限责任公司新育成的一个玉米细胞质雄性不育材料,前期通过细胞学观察、恢复专效性分组鉴定以及胞质特异引物PCR扩增,鉴定了该材料属于CMS-C,并且从二分体时期开始败育[15]。本研究以同质异核雄性不育系K932S、K169S、近等基因恢复系K932R和保持系K169为试验材料,测定花药发育不同时期线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ的活性,比较不同核背景对不育细胞质线粒体复合体活性的影响及其与正常细胞质间的差异,以期明确与败育紧密相关的复合体,为进一步在生理生化水平上解析玉米CMS-C败育机理提供参考。
1 材料和方法
1.1 试验材料与种植
供试材料为同质异核玉米C型不育系K932S、K169S、近等基因恢复系K932R和保持系K169。其中,K932S来源于K932MS姊妹交群体中的不育株;K932R为K932MS姊妹交群体中的可育株通过多代自交育成的近等基因恢复系;K169为正常可育自交系,K169S为K932S与K169杂交,通过回交10代以上获得的同质异核雄性不育系。由四川正红生物技术有限责任公司(简称公司)提供。
2019年春季,在公司成都双流育种基地种植K932MS姊妹交群体20行,K169S 、K169和K932R各10行。试验行长3.0 m,行距0.8 m,窝距0.5 m,每行7窝,种植密度50 000株/hm2。其中K932MS群体3粒/窝,不匀苗;其余材料3叶一心期间苗,每窝留2苗。田间管理同一般大田生产。
1.2 试验方法
采用植物线粒体呼吸链复合体酶联免疫分析试剂盒对败育前(花粉母细胞时期)、败育时(二分体时期)以及败育后(四分体时期)玉米花药的5个线粒体复合体活性进行测定,3次重复,详细操作参照说明书进行。
田间取样:在材料生长至7~8叶时,开始用刀片轻轻划开茎部顶端,用镊子夹出雄穗,迅速放入2 mL EP中并将EP管放入冰盒。于-80 ℃保存,使用时在干冰上剥离花药,并根据花药镜检和花药长度判断花药发育时期(表1)。
表1 花药发育时期及特征
Tab.1 Anther development period and characteristics
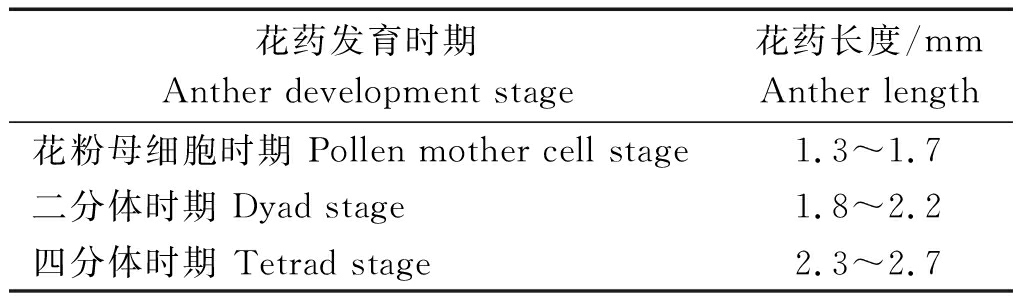
花药发育时期Anther development stage花药长度/mmAnther length花粉母细胞时期 Pollen mother cell stage1.3~1.7二分体时期 Dyad stage1.8~2.2四分体时期 Tetrad stage2.3~2.7
1.3 数据分析
利用SPSS 20软件对不同材料在花药发育不同时期的复合体活性进行方差分析,LSD法进行多重比较。以3次重复均值作柱状图进行比较。
2 结果与分析
2.1 方差分析结果
将各线粒体复合体活性方差分析结果列于表2。由表2可知,各复合体活性在材料间,发育时期间,材料×时期互作间差异均达到极显著水平,因此可进一步进行多重比较分析。
表2 线粒体复合体活性方差分析(均方值)
Tab.2 Analysis of variance for mitochondrial complex activity(MS)
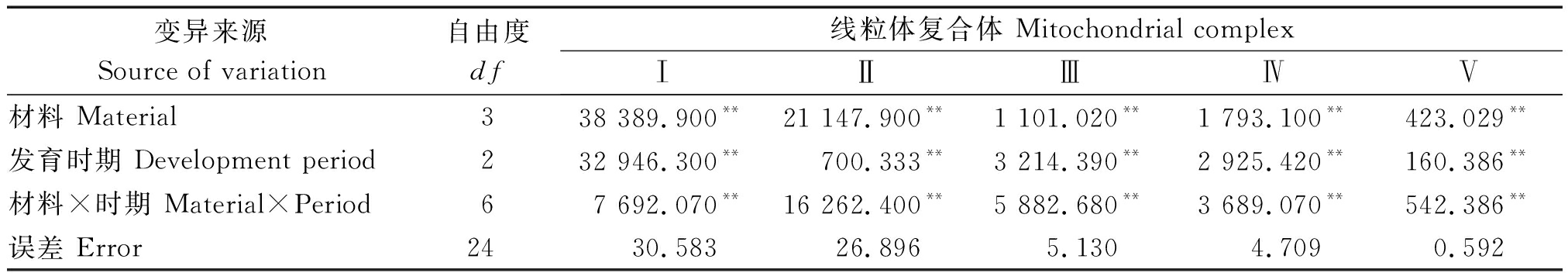
变异来源Source of variation自由度df线粒体复合体 Mitochondrial complexⅠⅡⅢⅣⅤ材料 Material338 389.900**21 147.900**1 101.020**1 793.100**423.029**发育时期 Development period232 946.300**700.333**3 214.390**2 925.420**160.386**材料×时期 Material×Period67 692.070**16 262.400**5 882.680**3 689.070**542.386**误差 Error2430.58326.8965.1304.7090.592
注:*和**分别代表 0.05、0.01 水平下差异显著性。
Note:* and **mean significant at the 0.05 and 0.01 probability levels respectively.
2.2 线粒体复合体Ⅰ活性比较
线粒体复合体Ⅰ(NAD),是线粒体电子传递链上的第一个复合体,在能量代谢过程中发挥着首要的作用。如图1所示,在花药发育过程中,2个不育系K932S和K169S及恢复系K932R中复合体I活性呈逐渐增高的趋势,而保持系K169中呈先高后低再升高的趋势,且4个材料间均存在显著差异。在花粉母细胞时期和四分体时期,不育系K932S显著低于恢复系K932R,不育系K169S显著低于保持系K169,且K169核背景的2个材料都显著高于K932核背景下的2个材料。而在败育的关键时期二分体时期,不育系K932S显著低于恢复系K932R、但不育系K169S显著高于保持系K169。说明复合体I活性的差异并非与花粉败育直接相关。
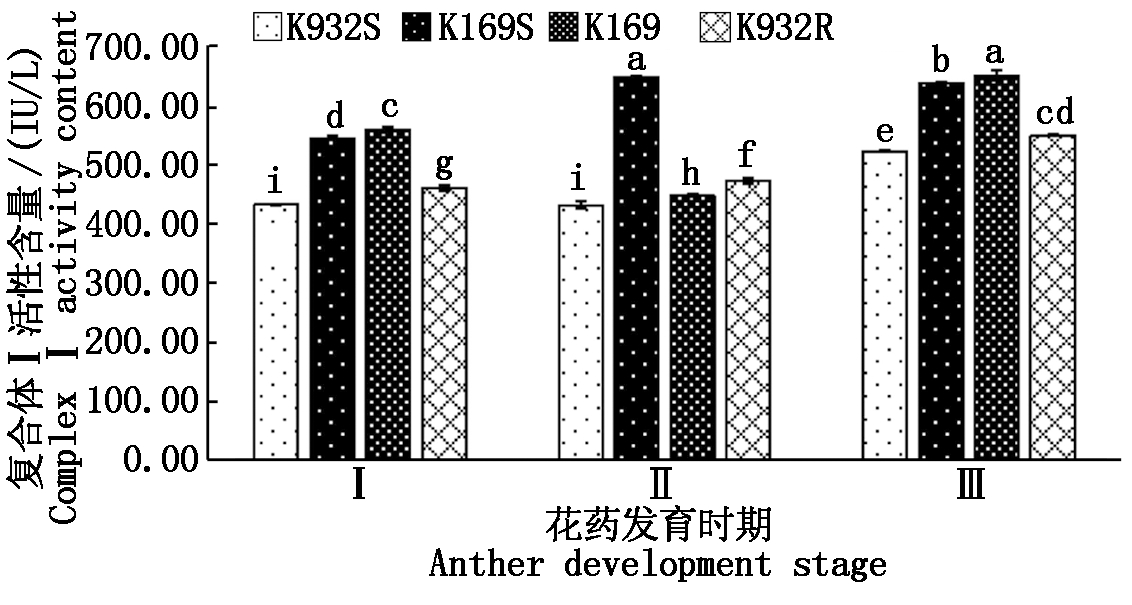
Ⅰ、Ⅱ和Ⅲ分别表示花药发育的花粉母细胞时期、二分体时期和四分体时期;图中小写英文字母表示0.05显著水平。图2-5同。
Ⅰ,Ⅱ and Ⅲ refer to the pollen mother cell stage,dyad stage and tetrad stage of anther development,respectively;lowercase represent significance level of P < 0.05.The same as Fig.2-5.
图1 4个材料线粒体复合体Ⅰ活性比较
Fig.1 Comparison of mitochondrial complex Ⅰ
activity of 4 materials
2.3 线粒体复合体Ⅱ活性比较
在玉米线粒体中,不存在编码复合体Ⅱ亚基基因(SDH),复合体Ⅱ由核基因编码,但在线粒体中执行功能。由图2可知,在花药发育过程中,不育系K932S和保持系K169中复合体Ⅱ活性呈先低后高再低的趋势,而不育系K169S和恢复系K932R则刚好相反。在花粉母细胞时期,不育系K932S显著低于恢复系K932R,K169S显著高于保持系K169,但在二分体时期正好相反;而在四分体时期,仅表现出不育系K169S显著高于保持系K169。说明二分体时期不育胞质复合体Ⅱ活性显著降低可能与花粉败育直接相关。
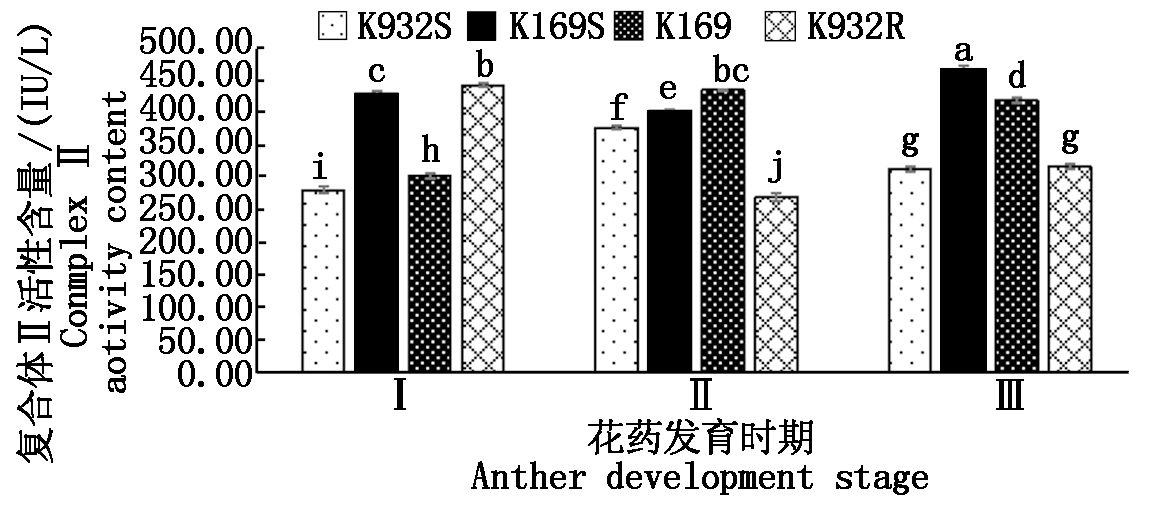
图2 4个材料线粒体复合体Ⅱ活性比较
Fig.2 Comparison of mitochondrial complex Ⅱ
activity of four materials
2.4 线粒体复合体Ⅲ活性比较
如图3所示,在花药发育过程中,不育系K932S和保持系K169中复合体Ⅲ活性呈先低后高再低的趋势,不育系K169S中呈逐渐增高的趋势,而恢复系K932R中呈逐渐降低的趋势。在花粉母细胞时期,不育系K932S显著低于恢复系K932R,不育系K169S显著低于保持系K169,而在四分体时期刚好相反。在二分体时期,不育系K932S显著高于恢复系K932R,但不育系K169S显著低于保持系K169,说明复合体Ⅲ活性变化可能与花粉败育直接相关。
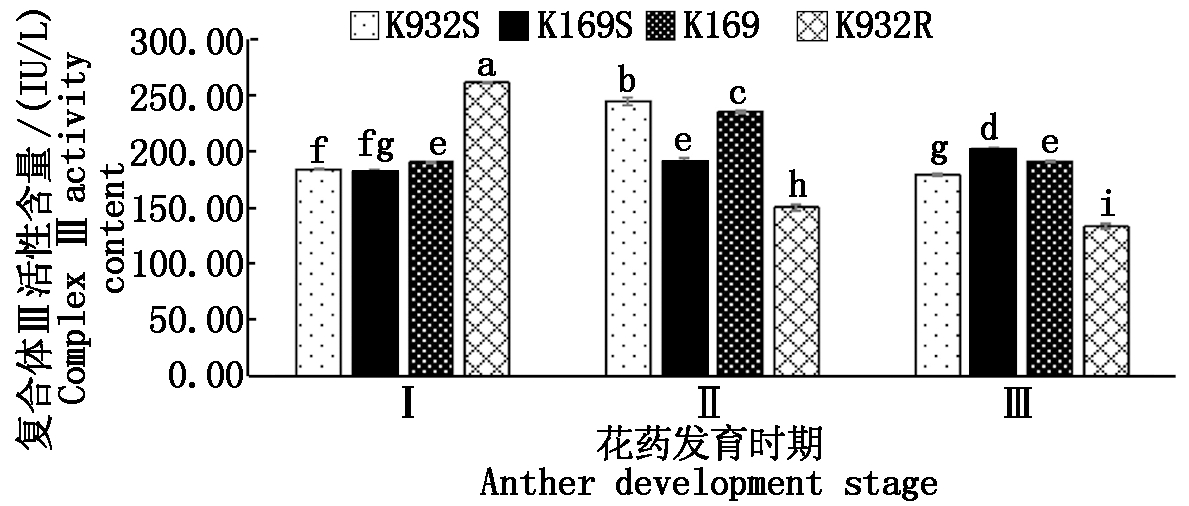
图3 4个材料线粒体复合体Ⅲ活性比较
Fig.3 Comparison of mitochondrial complex Ⅲ
activity of four materials
2.5 线粒体复合体Ⅳ活性比较
复合体Ⅳ(COX)是线粒体电子传递链中最后一个酶复合体,也称为末端氧化酶,是线粒体的内膜标志酶。如图4所示,在花药发育过程中,不育系K932S复合体Ⅳ活性呈逐渐降低的趋势,不育系K169S和恢复系K932R呈先低后高再低的趋势,而保持系K169中呈逐渐增高的趋势。在花粉母细胞时期,不育系K932S显著高于恢复系K932R,不育系K169S显著高于保持系K169,而在四分体时期,则正好相反。但在二分体时期,仅表现出不育系K169S显著高于保持系K169。说明复合体Ⅳ活性的改变与该胞质的育性不是直接相关的。
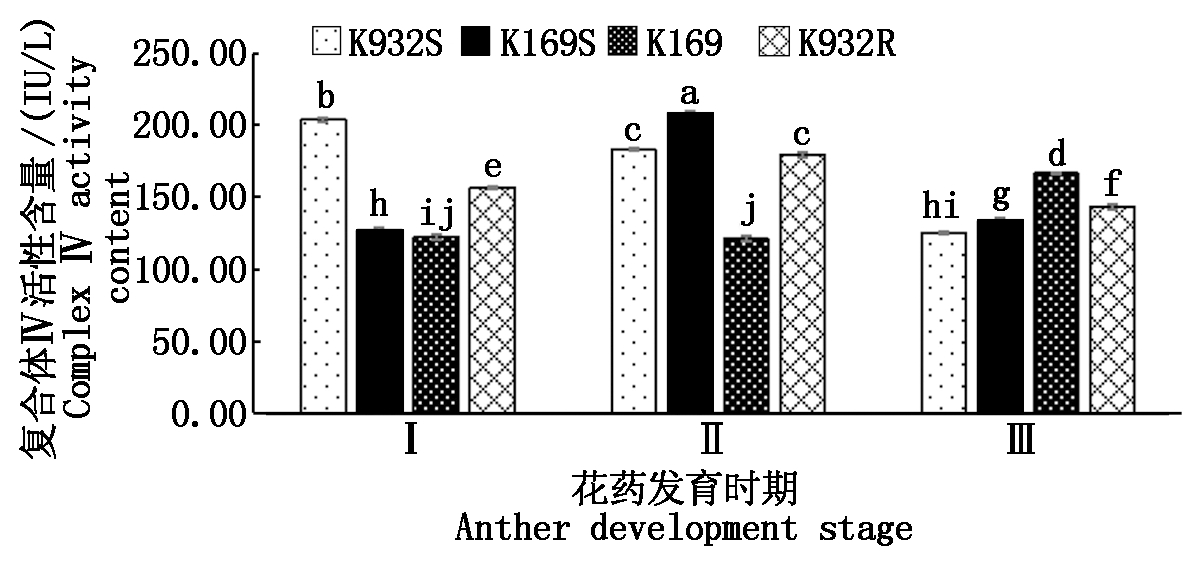
图4 4个材料线粒体复合体Ⅳ活性比较
Fig.4 Comparison of mitochondrial complex Ⅳ
activity of four materials
2.6 线粒体复合体Ⅴ活性比较
线粒体复合体Ⅴ是线粒体氧化磷酸化的关键酶,在能量代谢中发挥着重要作用。由图5可知,在花药发育过程中,2个不育系中复合体Ⅴ活性呈先高后低再高的趋势,而保持系和恢复系则相反。在花粉母细胞时期,不育系K932S显著高于恢复系K932R,不育系K169S显著高于保持系K169,而二分体时期则刚好相反;但在四分体时期,不育系K932S显著高于恢复系K932R,不育系K169S显著低于保持系K169。说明复合体V活性的改变可能与该胞质的育性直接相关。
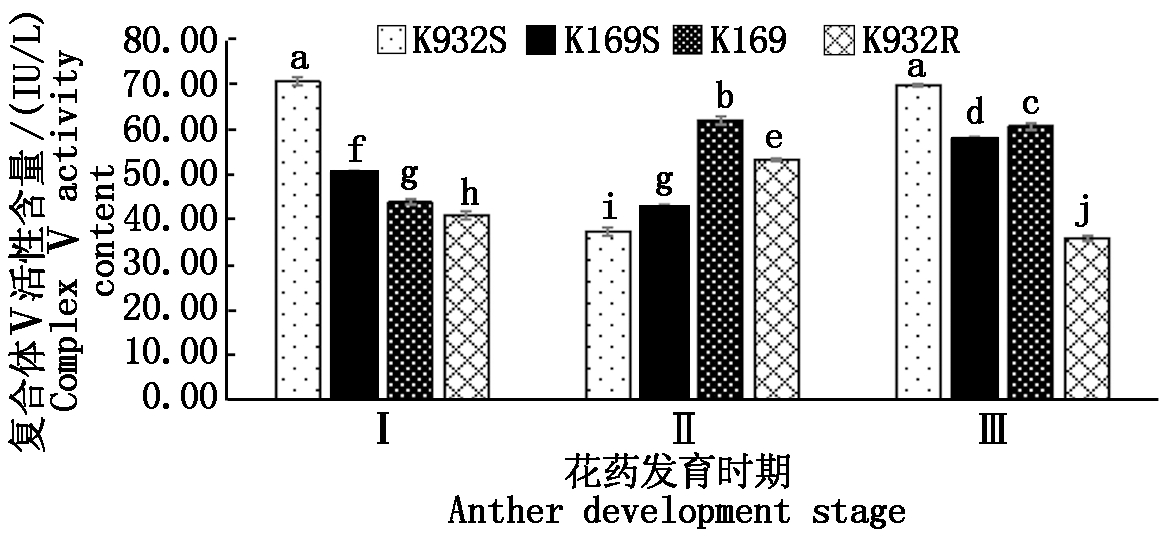
图5 4个材料线粒体复合体V活性比较
Fig.5 Comparison of mitochondrial complex Ⅴ
activity of four materials
3 讨论
植物开花繁殖过程中需要消耗大量能量,线粒体复合体活性降低,会导致线粒体代谢功能下降,必然会减少花药中的能量产生,造成供能不足,而这种能量供求不平衡则会导致CMS的发生[16]。孔祥军[12]研究海岛棉CMS不育系H276A及其保持系H276B花药线粒体5个复活体活性时发现,败育关键时期四分体时期复合体Ⅳ和Ⅴ的活性在保持系中显著高于不育系,复合体Ⅱ和Ⅲ活性在保持系中低于不育系,而复合体Ⅰ活性在两材料间没有明显差异。Watson等[11]以玉米3种类型不育系WF9-CMS-C、WF9-CMS-S、WF9-CMS-T和可育系WF9的幼苗以及减数分裂前、减数分裂时以及减数分裂后的花药为材料研究发现,复合体Ⅱ活性不育系显著低于保持系,认为这可能是导致败育的原因。在棉花[17]和不结球白菜[18]等作物中,不育系的复合体Ⅱ活性显著低于保持系。刁勇[13]研究红麻CMS不育系UG932A及其保持系UG93B、恢复系花药线粒体复合体Ⅴ活性时发现,单核期和双核期不育系显著低于恢复系及其保持系。杜坤[19]研究甘蓝型油菜CMS不育系SaNa-lA及其保持系SaNa-lB线粒体活性,发现花药败育关键时期(四分体时期)线粒体复合体V活性不育系显著低于保持系。
本研究发现,在花药发育过程中,除花粉母细胞时期复合体Ⅱ、Ⅳ外,其余时期不育细胞质中复合体Ⅰ、Ⅱ、Ⅳ活性在K169核背景下显著高于K932,绝大多数时期复合体Ⅲ、Ⅴ的活性在K932核背景下显著高于K169,但随着育性恢复基因的引入,可改变部分时期不育细胞质不同线粒体复合体的活性。周国昌[15]通过细胞学观察发现,不育系K932S败育从二分体时期开始,绒毡层径向膨大液泡化,小孢子发育畸形,并最终解体消失。线粒体要成功执行其功能,除了各复合体独立完成自身的功能外,还必须依赖于各复合体间的密切配合。线粒体复合体Ⅱ主要功能是将还原型黄素腺嘌呤二核苷酸(Flavine adenine dinucleotide reduced,FADH2)中的电子传递给泛醌(Ubiquinone,UQ);线粒体复合体Ⅲ则是将UQH2中的电子传递给细胞色素C并有质子泵出;线粒体复合体Ⅴ则是将ADP转化为ATP,直接为植物的生长发育提供能量[20]。当线粒体中的复合体活性异常时,会导致线粒体整体功能的异常,致使细胞无法满足生长发育的需求,从而导致细胞质雄性不育的发生[3]。本研究中,在二分体时期不育细胞质复合体Ⅰ和Ⅳ显著高于正常可育胞质,复合体Ⅱ、Ⅲ和Ⅴ则相反。据此推测,在花药发育不同时期,核背景对玉米CMS-C不同线粒体复合体活性均有显著影响;相同核背景下,二分体时期不育细胞质复合体Ⅱ、Ⅲ、Ⅴ活性比正常细胞质显著降低,可能与CMS-C花药败育密切相关。
[1] Henze K,Martin W. Essence of mitochondria[J].Nature,2003,426(6963):127-128. doi:10.1038/426127a.
[2] 郝岗平,陈敏,杨清. 植物线粒体与细胞质雄性不育研究进展[J].植物学通报,2003,20(5):549-557. doi:10.3969/j.issn.1674-3466.2003.05.005.
Hao G P,Chen M,Yang Q. Progress of study on plant mitochondria and cytoplasmic male sterility[J].Chinese Bulletin of Botany,2003,20(5):549-557.
[3] Budar F,Touzet P,De Paepe R. The nucleo-mitochondrial conflict in cytoplasmic male sterilities revisited[J].Genetica,2003,117(1):3-16. doi:10.1023/A:1022381016145.
[4] 周琼,周瑶瑶,唐向民,周瑞阳,李春瑶. 红麻细胞质雄性不育系与保持系花药活性氧代谢差异比较[J].广西植物,2013,33(4):443-448. doi:10.3969/j.issn.1000-3142.2013.04.003.
Zhou Q,Zhou Y Y,Tang X M,Zhou R Y,Li C Y. Comparative research of reactive oxygen species metablisms of the CMS line and the maintainer lines in Kenaf(Hibiscus cannabinus)anther[J].Guihaia,2013,33(4):443-448.
[5] 周凯,司龙亭,张琪. 萝卜细胞质雄性不育系与保持系光合特性和呼吸特性的比较试验[J].北方园艺,2007(6):3-5. doi:10.3969/j.issn.1001-0009.2007.06.002.
Zhou K,Si L T,Zhang Q. The comparative research of the photosynthesis and the respiration of the CMS lines and the maintainer lines of radish[J].Northern Horticulture,2007(6):3-5.
[6] 张明永,梁承邺,黄毓文,刘鸿先.水稻细胞质雄性不育系与保持系的呼吸途径比较[J].植物生理学报,1998,24(1):55-58.
Zhang M Y,Liang C Y,Huang Y W,Liu H X. Comparison of respiratory pathways of CMS and its maintainer rice(Oryza sativa L.)[J].Plant Physiology Journal,1998,24(1):55-58.
[7] 邓明华,文锦芬,邹学校,何长征,刘志敏,周群初. 辣椒核质互作雄性不育系与保持系呼吸速率研究[J].云南农业大学学报,2009,24(1):22-25. doi:10.3969/j.issn.1004-390X.2009.01.005.
Deng M H,Wen J F,Zou X X,He C Z,Liu Z M,Zhou Q C. A study on respiration rates in cytoplasmic male-sterile lines and their maintainer lines of Capsicum annuum L[J].Journal of Yunnan Agricultural University,2009,24(1):22-25.
[8] 严志祥. 紫稻细胞质雄性不育系水稻线粒体呼吸链初步研究[D].武汉:武汉大学,2009.
Yan Z X. Study on mitochondrial respiratory chain of zidao type cytoplasmic male sterility rice(Oryza sativa L.)[D].Wuhan:Wuhan University,2009.
[9] Walker J E,Arizmendi J M,Dupuis A,Fearnley I M,Finel M,Medd S M,Pilkington S J,Runswick M J,Skehel J M.Sequences of 20 subunits of NADH:ubiquinone oxidoreductase from bovine heart mitochondria:Application of a novel strategy for sequencing proteins using the polymerase chain reaction[J].Journal of Molecular Biology,1992,226(4):1051-1072. doi:10.1016/0022-2836(92)91052-Q.
[10] Schnable P S,Wise R P.The molecular basis of cytoplasmic male sterility and fertility restoration[J].Trends in Plant Science,1998,3(5):175-180. doi:10.1016/S1360-1385(98)01235-7.
[11] Watson C V,Nath J,Nanda D. Possible mitochondrial involvement in mechanism of cytoplasmic male sterility in maize(Zea mays L.)[J].Biochemical Genetics,1977,15(11/12):1113-1124.doi:10.1007/BF00484501.
[12] 孔祥军. 海岛棉H276A雄性不育的细胞学与分子生物学基础研究[D].南宁:广西大学,2017.doi:10766/d.Y3352141.
Kong X J. Studies on cytology and molecular biology of male sterility line H276A in Gossypium barbadense[D].Nanning:Guangxi University,2017.
[13] 刁勇.红麻UG93细胞质雄性不育相关基因的筛选、克隆及表达分析[D].南宁:广西大学,2016.doi:10.7666/d.Y3088037.
Diao Y.Screening,cloning and expression analysis of mitochondrial genes related to CMS UG93 in kenaf[D].Nanning:Guangxi University,2017.
[14] 向杰. 玉米C型细胞质雄性不育的线粒体差异蛋白质分析[D].雅安:四川农业大学,2010.
Xiang J. Analysis of differential mitochondrial proteins from CMS-C maize[D].Yaan:Sichuan Agricultural University,2010.
[15] 周国昌. 玉米雄性不育系K932S的遗传分析[D].雅安:四川农业大学,2018.
Zhou G C. Genetic Analysis of male sterility line K932S in maize[D].Yaan:Sichuan Agricultural University,2018.
[16] Sheoran I S,Sawhney V K.Proteome analysis of the normal and Ogura(ogu)CMS anthers of Brassica napus to identify proteins associated with male sterility[J].Botany,2010,88(3):217-230. dio:10.1139/B09-085.
[17] 黄晋玲. 棉花晋A细胞质雄性不育系的遗传研究[D].太谷:山西农业大学,2003.
Huang J L. Genetie study on Jin A cytoplasmic male sterile line in cotton(Gossypium)[D].Taigu:Shanxi Agricultural University,2003.
[18] 袁建玉. 不结球白菜CMS新种质细胞学及生理生化特性研究[D].南京:南京农业大学,2005.doi:10.7666/d.Y749126.
Yuan J Y. Study on cytomorphology and characteristies of physiology and biochemistry in the new CMS line of non-heading Chinese cabbage[D].Nanjing:Nanjing Agricultural University,2005.
[19] 杜坤. 甘蓝型油菜细胞质雄性不育系SaNa-1A败育的细胞学和分子基础[D].扬州:扬州大学,2016.
Du K. Cytology and molecular analysis on sterile mechanism of SaNa-1A CMS in Brassica napus[J].Yangzhou:Yangzhou University,2016.
[20] 王秀珍,滕晓月,阎隆飞,周人纲. 玉米及高粱花药中三磷酸腺苷(ATP)含量与细胞质雄性不育的关系[J].作物学报,1986,12(3):177-181. doi:10.3321/j.issn:0496-3490.1986.03.005.
Wang X Z,Teng X Y,Yan L F. The relationship between the ATP content in anthers of maize and sorghum and cytoplasmic male-sterility[J].Acta Agronomica Sinica,1986,12(3):177-181.
