巨须裂腹鱼(Schizothorax macropogon)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、裂腹鱼属(Schizothorax),俗称胡子鱼、巨须弓鱼,主要分布于青藏高原雅鲁藏布江中游各大干支流[1]。近些年由于人类活动干预、所处青藏高原生态环境脆弱等诸多因素,巨须裂腹鱼的种群资源量已大幅萎缩,已被列入中国物种红色名录“濒危”等级[2]。目前有关巨须裂腹鱼的文献报道主要集中在细胞遗传学[3]、生物地理学[4-5]、发育生物学[6]、肌肉质构特性[7]、分子遗传特性[8-10]、渔业资源状况和保护生物学[11-15]以及行为生理学[16-17],关于巨须裂腹鱼生化遗传特性的报道仅见魏玉众等[18],为进一步丰富巨须裂腹鱼生化遗传学的研究内容,本研究借助聚丙烯酰胺凝胶垂直板电泳对巨须裂腹鱼5种组织进行同工酶电泳分析,旨在为制定巨须裂腹鱼种质标准和资源保护利用的研究积累基础资料。
1 材料和方法
1.1 试验材料
试验用巨须裂腹鱼于2014年采自西藏自治区拉萨市曲水县,总共30尾,随机抽取其中4尾,其体质量为530.1~680.6 g。
1.2 制备组织酶液
参照张涛等[19]的方法制备组织酶液。
1.3 电泳方法
借助聚丙烯酰胺凝胶垂直电泳进行同工酶分析,电泳前所有样品稍微解冻,移取2 μL甘油-溴酚蓝与20 μL解冻上清液样品混合均匀后点样。乳酸脱氢酶(LDH)(酶编号:1、1、1、27)采用不连续浓度凝胶系统,浓缩胶和分离胶的浓度分别为3%和6.5%;苹果酸脱氢酶(MDH)(1、1、1、37)采用连续浓度凝胶系统,浓度为7%。在4 ℃条件下进行电泳,电泳缓冲系统采用Tris-甘氨酸系统,电泳缓冲液pH值8.3。恒压电泳,初始电压设为280 V,30 min后将电压调至220 V,待溴酚蓝条带跑出胶底停止电泳。
1.4 染色和成像
乳酸脱氢酶和苹果酸脱氢酶的染色和成像参照张涛等[20]的方法。将经过漂洗的凝胶轻轻平放在自制灯箱上,并用索尼数码相机(日本,DSC-H50)拍照。
1.5 绘制模式图
参照张涛等[20]的方法。
1.6 酶带的命名
以自阴极向阳极方向泳动最快的酶带编为1号,其余依次编为2号、3号、4号、5号…
2 结果与分析
2.1 巨须裂腹鱼乳酸脱氢酶LDH的表达情况
巨须裂腹鱼5种组织乳酸脱氢酶LDH的表达情况见图1,4尾样本鱼心脏中共检出7条LDH酶带,其中的LDH2~LDH7为4尾样本鱼的共有酶带,1号样本鱼比其余3尾样本鱼少1条LDH酶带,2号、3号和4号样本鱼均检出7条LDH酶带,1号样本鱼LDH酶带活性比其他3尾鱼弱,3号样本鱼和4号样本鱼的LDH1~LDH6活性最强,2号样本鱼居中。4尾样本鱼眼晶状体中共检测到10条LDH酶带,2号样本鱼的LDH酶带数最多,为10条;3号和4号样本鱼的LDH酶带数最少,为6条;1号样本鱼LDH酶带数为7条,LDH6~LDH10和LDH 4为4尾样本鱼的共有酶带,LDH1~LDH4酶带的活性相对比其他几条酶带弱。除了2号样本鱼和4号样本鱼的肌肉中分别检测到7,6条LDH酶带外,其余2尾样本鱼的肌肉中均检测到5条LDH酶带,LDH3~LDH7为4尾样本鱼的共有酶带,其活性强于LDH1和LDH2。4尾样本鱼肝脏中共检测到12条LDH酶带。1号样本鱼和2号样本鱼的肝脏中分别检测出9,8条LDH酶带,3号样本鱼和4号样本鱼的肝脏中都有11条LDH酶带检出,LDH7~LDH12为4尾样本鱼的共有酶带,LDH8~LDH12的活性较强,其他LDH酶带活性均较弱。4尾样本鱼的肾脏中也检测到12条LDH酶带,LDH2~LDH8为4尾样本鱼的共有酶带,LDH4~LDH8活性相对较强,尤其LDH4更为明显,1号样本鱼中未检测到LDH9~LDH12。

A、B、C、D、E分别表示心脏、眼睛晶状体、肌肉、肝脏和肾脏的LDH酶谱;1-4泳道分别表示不同个体酶谱。
A,B,C,D,E show electrophoretograms of LDH isozymes expressed in heart,eyes,muscle,liver and
kidney respectively;1-4 show the zymograms of different individuals.
图1 巨须裂腹鱼LDH电泳图谱
Fig.1 Electrophoretogram of LDH isozymes expressed in Schizothorax macropogon
2.2 巨须裂腹鱼苹果酸脱氢酶MDH的表达情况
巨须裂腹鱼5种组织苹果酸脱氢酶MDH的表达情况见图2,4尾样本鱼心脏中共检测到8条MDH酶带,1号样本鱼的MDH酶带数最多,共有8条,3号样本鱼的MDH酶带数最少,仅4条,其余2尾样本鱼各5条,2号样本鱼MDH酶带活性相对较强,MDH1~MDH4为4尾样本鱼的共有酶带,4尾样本鱼MDH4的活性均较强,3号样本鱼未检测到MDH8。4尾样本鱼的肾脏中共检测到9条MDH酶带,1号样本鱼MDH酶带数最多,3号样本鱼MDH酶带数最少,两者分别为7,4条,1号样本鱼的MDH酶带活性相对较弱,各样本鱼MDH3~MDH5活性相对较强,MDH1~MDH2为4尾样本鱼的共有酶带。4尾样本鱼MDH在肝脏组织中着色相对比其他组织深,4尾样本鱼肝脏中共检测到5条MDH酶带,仅1号样本鱼未检测到MDH2,MDH1和 MDH3~MDH5为4尾样本鱼肝脏中的共有酶带,其中尤以MDH3和MDH4活性较强。MDH在4尾样本鱼肌肉组织中的着色程度相对较其他4种组织浅,4尾样本鱼肌肉中共检测到4条MDH酶带,1号和3号样本鱼均检测到3条MDH酶带,其余2尾样本鱼均检测到4条MDH酶带,MDH2~MDH4为4尾样本鱼的共有酶带,4尾样本鱼中尤以3号样本鱼各MDH酶带表达活性程度相对较弱。4尾样本鱼眼晶状体中共检出4条MDH酶带,4号样本鱼中MDH酶带数最少,仅2条,2号样本鱼和4号样本鱼眼晶状体中MDH酶带数最多,均检测到4条,1号样本鱼MDH酶带数居中,检测到有3条MDH酶带表达,MDH2为4尾样本鱼的共有酶带,4尾样本鱼中MDH4表达活性相对较弱。
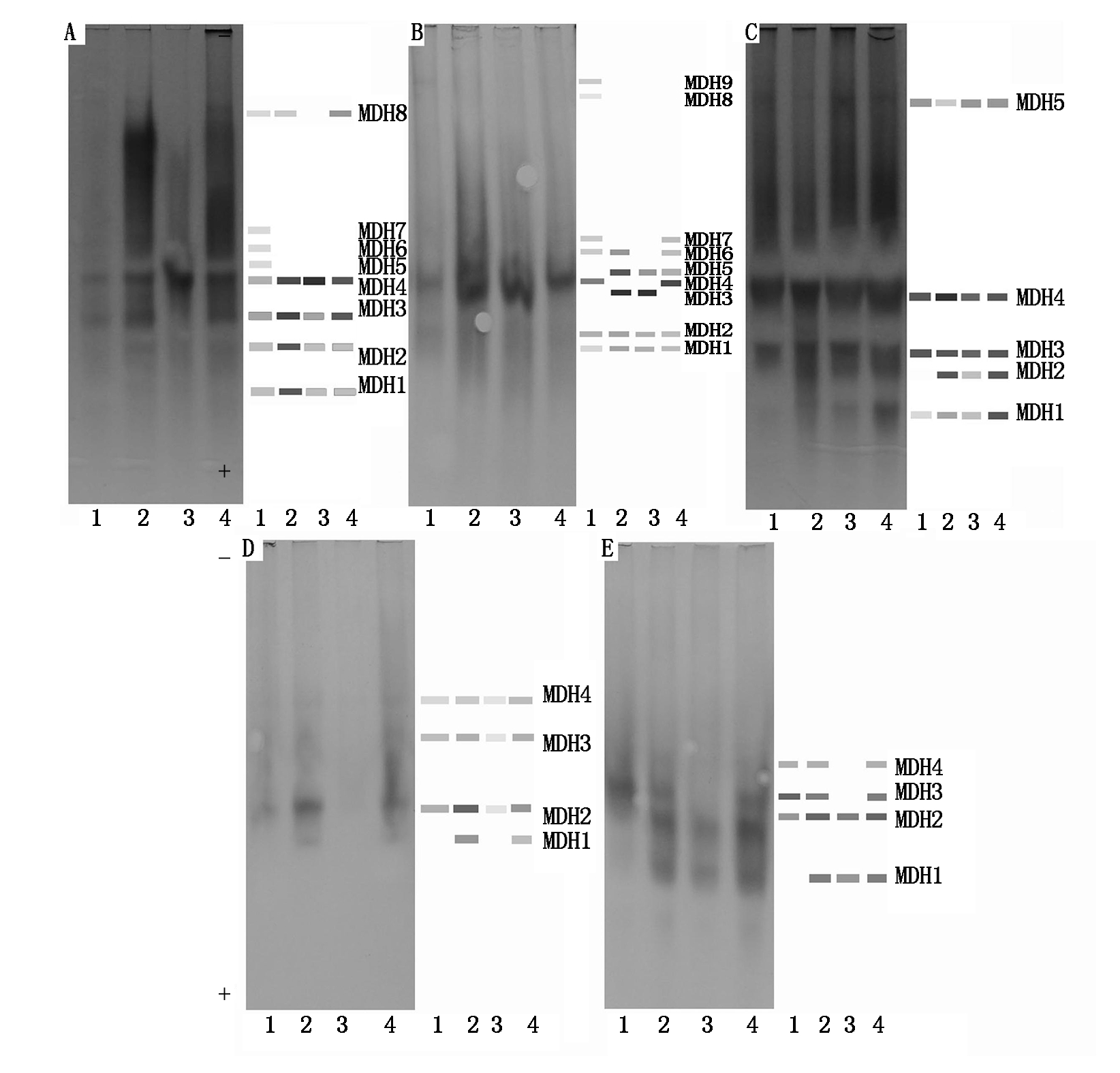
A、B、C、D、E分别表示心脏、肾脏、肝脏、肌肉和眼睛晶状体的MDH酶谱;1-4泳道分别表示不同个体酶谱。
A,B,C,D,E show electrophoretograms of MDH isozymes expressed in heart,kidney,liver,muscle and
eyes,respectively;1-4 show the zymograms of different individuals.
图2 巨须裂腹鱼MDH电泳图谱
Fig.2 Electrophoretogram of MDH isozymes expressed in Schizothorax macropogon
3 讨论
3.1 巨须裂腹鱼同工酶表达的组织特异性和个体差异性
本研究表明:乳酸脱氢酶和苹果酸脱氢酶在巨须裂腹鱼各组织中的表达都具有组织特异性,主要体现在两点:①同种同工酶在有的组织中表达,在有的组织中不表达;②同工酶在不同组织中表达的酶带数以及活性程度不同。造成这种组织特异性表达的原因可能是由于受遗传基因调控的影响,不同类型的同工酶在胚胎发育和细胞分化过程中起到的调控作用不同,也就决定不同组织在先天发育时就具有组织特异性,如LDH同工酶在胚胎发育和细胞分化中具有显著的分化调控模式,表现出高度的发育和组织特异性[21];另一方面同工酶的表达除了受遗传基因调控外,还受到代谢的调控,也就决定了某些同工酶仅在特定的器官或组织中表达[22]。不同组织同工酶表达的活性强弱不同,可能是不同组织行使不同的生理功能导致这一现象,因而造成组织或器官间同类同工酶在含量和活性表达上的不同[23],以巨须裂腹鱼肝脏MDH为例,图2中肝脏MDH着色程度明显比其他4种组织深,与肝脏具有消化、分泌和解毒等多种功能有关。
另一方面,相同组织同种同工酶在巨须裂腹鱼不同个体间表达的酶带数和活性程度不同,呈现出多态性,这种个体差异性现象也见于其他裂腹鱼的研究中,如李晓莉等[24]的研究表明,酯酶在齐口裂腹鱼(Schizothorax prenanti)不同个体脾脏中表达的酶带数不同,苹果酸脱氢酶在其不同个体肌肉中表达的位点存在差异。安苗等[25]的研究表明,乳酸脱氢酶在乌江上游四川裂腹鱼(Schizothorax kozlovi)和昆明裂腹鱼(Schizothorax grahami)不同个体肌肉中表达的酶带数不同、苹果酸脱氢酶在上述2种裂腹鱼不同个体肌肉、肝脏、尾鳍和性腺表达的酶带数都不同。造成这种现象的原因可能是不同个体发育阶段、生理状态以及对环境条件的适应需求使同工酶的表达具有个体差异性[26-27]。
3.2 巨须裂腹鱼LDH和MDH与已报道裂腹鱼属鱼类的比较
关于裂腹鱼属鱼类的同工酶已有一些报道[8,24-25,28-32],裂腹鱼属的各种鱼类相同组织中LDH和MDH的表达的酶带数存在差异,如昆明裂腹鱼[28-29]和齐口裂腹鱼[30-31]的心脏LDH和MDH酶带数不同,同时存在即使酶带数相同,但酶带的表达活性程度存在差异,如细鳞裂腹鱼(Schizothorax chongi)[32]和齐口裂腹鱼[30]的心脏LDH虽然酶带数相同,但酶带表达活性程度不同,产生这种差异的原因是生物学分类上不同种鱼类的生化遗传特性不同,从这一角度进一步佐证了同工酶可以作为鉴定不同种鱼类包括亲缘关系较近的种。通过本研究与已报道裂腹鱼属鱼类的同工酶研究结果,可以作为鉴定巨须裂腹鱼与昆明裂腹鱼、齐口裂腹鱼、四川裂腹鱼等裂腹鱼属鱼类的参考依据。养殖鱼类种质检验标准中也把同工酶作为种质鉴定的指标之一[33],也体现在众多鱼类的种质标准中。
本研究与魏玉众等[18]的研究结果存在差异,产生这种差异的原因可能来自两方面,一方面不同个体相同组织同工酶表达存在个体差异性,这种差异性除与上述不同发育阶段、生理状态等有关外,不排除与雌雄性别差异有关的可能性,这种性别差异导致同工酶个体差异亦体现在乌苏里拟鲿(Pseudobagrus ussuriensis)的研究中[34],本研究未区分雌雄个体去研究同工酶的表达差异,究竟是否由于雌性性别差异导致同工酶的个体差异尚需进一步研究。另一方面,也可能与同工酶样品的制备、凝胶浓度或者电泳条件不同有关。在同工酶样品制备时尽可能避免受其他组织或个体样品污染导致的假象,可将样品鱼麻醉放血后置碎冰上再采集组织样品,避免组织受到血液污染,采集组织样品后可用预冷的生理盐水洗去残留血污、脂肪块等杂质,采集不同种组织或个体时手术器械须洗净或更换其他干净的工具,避免交叉污染。凝胶浓度不同决定类似“分子筛”分孔径不同,电泳时通过不同孔径“分子筛”的酶蛋白状况有差异,反映在电泳图谱上出现不同的酶带数,这种现象也出现在其他鱼类同工酶的研究中,如黄尾鲴(Xenocypris davidi)[35-36]、翘嘴鲌(Culter alburnus)[37-38]等。从另一角度看,巨须裂腹鱼同工酶明显的个体差异性可能是其漫长的进化过程中适应特殊生境的需要,一定程度上需具有丰富的遗传多样性和较大的变异性,毕竟雅鲁藏布江位处青藏高原,海拔高、水温低、氧气含量相对稀薄、气候多变、水域生产力低下,属生态脆弱区域,境内鱼类区系结构简单,抗干扰能力弱,表现出对生境高度适应和依赖的特点[39-40]。
LDH同工酶是迄今研究最深入的同工酶之一,通常由LDH-A、LDH-B 2个基因编码,形成分别由B4、AB3、A2B2、A3B和A4编码的经典5条带,LDH-C基因只在特定组织中表达,通常与物种有关,对鲤形目鱼类而言认为LDH-C基因编码的酶只存在于肝脏中表达[41],可称为“肝带”,一般向阴极迁移[42]。本研究中巨须裂腹鱼的LDH同工酶多于经典的5条带,可能与其作为四倍体鱼类存在重复基因的表达有关[3],或者存在共显性的等位基因或复等位基因的表达导致酶带数增多,也可能由于同工酶自身的特点即蛋白质受翻译后的化学修饰导致表达的酶带数增多。肝脏中有LDH-C基因的表达,电泳行为上表现为靠近阴极,与鲤形目鱼类中LDH-C基因只在其肝脏中表达的观点相符。
[1] 西藏自治区水产局. 西藏鱼类及其资源[M].北京:中国农业出版社,1995:114-115.
Fisheries Bureau of Tibet Autonomous Region.Fish and fish resources in Tibet,China [M].Beijing:China Agriculture Press,1995:114-115.
[2] 汪松,解焱. 中国物种红色名录(第二卷):脊椎动物(上册)[M].北京:高等教育出版社,2009:1-891.
Wang S,Xie Y. China species red list(Vol Ⅱ:Vetebrates,Part Ⅰ)[M].Beijing:Higher Education Press,2009:1-891.
[3] 武云飞,康斌,门强,吴翠珍. 西藏鱼类染色体多样性的研究[J].动物学研究,1999,20(4):258-264. doi:10.3321/j.issn:0254-5853.1999.04.004.
Wu Y F,Kang B,Men Q,Wu C Z. Chromosome diversity of Tibetan fishes[J].Zoological Research,1999,20(4):258-264.
[4] 曹文宣,陈宜瑜,武云飞,朱松泉. 裂腹鱼类的起源和演化及其与青藏高原的隆起关系[M].北京:科学出版社,1981:118-130
Cao W X,Chen Y Y,Wu Y F,Zhu S Q. Origin and evolution of Schistostomes and their relationship with the uplift of the Qinghai-Tibet Plateau[M].Beijing:Science Press,1981:118-130.
[5] 朱挺兵,陈亮,杨德国,马波,李雷. 雅鲁藏布江中游裂腹鱼类的分布及栖息地特征[J].生态学杂志,2017,36(10):2817-2823. doi:10.13292/j.1000-4890.201710.037.
Zhu T B,Chen L,Yang D G,Ma B,Li L. Distribution and habitat character of Schizothoracinae fishes in the middle Yarlung Zangbo River[J].Chinese Journal of Ecology,2017,36(10):2817-2823.
[6] 刘海平,刘孟君,刘艳超. 西藏巨须裂腹鱼早期发育特征[J].水生生物学报,2019,43(2):367-378. doi:10.7541/2019.046.
Liu H P,Liu M J,Liu Y C. Characteristics of early development of Schizothorax macropogon in Xizang autonomous region,China[J].Acta Hydrobiologica Sinica,2019,43(2):367-378.
[7] Chen M Q,Tan M,Liu H P. Texture analyses of two Schizothoracinae fishes in Tibet Autonomous Region,China[J].Acta Hydrobiologica Sinica,2018,42(6):1224-1231. doi:10.7541/2018.150
[8] 产久林,姜华鹏,刘一萌,胡星星,王丛丛,许强华. COⅠ和16S rRNA 基因在高原裂腹鱼物种鉴定中的应用[J].水生态学杂志,2015,36(4):98-104. doi:10.15928/j.1674-3075.2015.04.014.
Chan J L,Jiang H P,Liu Y M,Hu X X,Wang C C,Xu Q H. Application of COⅠ and 16S rRNA gene for identification of Tibetan Plateau Schizothorax species[J].Journal of Hydroecology,2015,36(4):98-104.
[9] Zhu Y X,Chen Y,Cheng Q Q,Qiao H Y,Chen W M. The complete mitochondrial genome sequence of Schizothorax macropogon(Cypriniformes:Cyprinidae)[J].Mitochondrial DNA,2013,24(3):237-239. doi:10.3109/19401736.2012.752478.
[10] 周建设,张驰,刘海平,马波,王万良,曾本和,牟振波. DNA条形码在西藏水系裂腹鱼亚科鱼类鉴定中的研究[J].淡水渔业,2019,49(1):33-41. doi:10.13721/j.cnki.dsyy.2019.01.006.
Zhou J S,Zhang C,Liu H P,Ma B,Wang W L,Zeng B H,Mou Z B. Studies on identification of Schizothoracinae population in Tibet water system by DNA barcode[J].Freshwater Fisheries,2019,49(1):33-41.
[11] 朱秀芳,陈毅峰. 巨须裂腹鱼年龄与生长的初步研究[J].动物学杂志,2009,44(3):76-82. doi:10.3969/j.issn.0250-3263.2009.03.012.
Zhu X F,Chen Y F. Preliminary study on the age and growth characteristics of Schizothorax macropogon[J].Chinese Journal of Zoology,2009,44(3):76-82.
[12] 王晨,杨秋实,刘清杨,刘香江,霍斌,张敏,李大鹏. 水文变化对巴松措食物网结构及碳来源的影响[J].淡水渔业,2020,50(4):99-107. doi:10.13721/j.cnki.dsyy.2020.04.014.
Wang C,Yang Q S,Liu Q Y,Liu X J,Huo B,Zhang M,Li D P. Effect of hydrologic changes on the structure and carbon source of the food web in Lake Basomtso[J].Freshwater Fisheries,2020,50(4):99-107.
[13] Shao J,Ma B S,Yang X,Xie C X,Huo B,Wei Q W. Length-weight and length-length relationships of three endemic fish species from the Yarlung Tsangpo River,China[J].Journal of Applied Ichthyology,2016,32(6):1-3. doi:10.1111/jai.13195.
[14] Huo T B,Li L,Wang J L,Zhou J S,Zhang C,Gong J H,Ma B. Length-weight relationships for six fish species from the middle of the Yalu Tsangpo River,China [J].Journal of Applied Ichthyology,2015,31(5):956-957. doi:10.1111/jai.12830.
[15] 李钊,朱峰跃,刘明典,王起,刘绍平,段辛斌. 怒江上游裸腹叶须与的年龄结构与生长特性[J].淡水渔业,2019,49(4):42-49. doi:10.13721/j.cnki.dsyy.2019.04.007.
Li Z,Zhu F Y,Liu M D,Wang Q,Liu S P,Duan X B. Age structure and growth characteristics of Ptychobarbus Kaznakovi in the upper Nujiang River[J],Freshwater Fisheries,2019,49(4):42-49.
[16] Hou Y,Cai L,Wang X,Chen X,Zhu D,Johnson D,Shi X. Swimming performance of twelve Schizothoracinae species from five rivers[J].Journal of Fishery Biology,2018(92):2022-2028. doi:10.1111/jfb.13632.
[17] 涂志英,袁喜,王从锋,许晓蓉,刘德富,黄应平. 亚成体巨须裂腹鱼游泳能力及活动代谢研究[J].水生生物学报,2012,36(4):682-688. doi:10.3724/SP.J.1035.2012.00682.
Tu Z Y,Yuan X,Wang C F,Xu X R,Liu D F,Huang Y P. Swimming capability and activity metabolism of subadult Schizothorax macropogon[J].Acta Hydrobiologica Sinica,2012,36(4):682-688.
[18] 魏玉众,张桂蓉,霍斌,谢从新,陈生熬. 雅鲁藏布江中游6种裂腹鱼乳酸脱氢酶同工酶的比较研究[J].淡水渔业,2017,47(5):3-8. doi:10.3969/j.issn.1000-6907.2017.05.001.
Wei Y Z,Zhang G R,Huo B,Xie C X,Chen S A.A comparative study on lactate dehydrogenase isozymes in six species of Schizothoracinae[J].Freshwater Fisheries,2017,47(5):3-8.
[19] 张涛,周剑光,吴金平,陈建武,何力. 达氏鲟幼鱼形态特征及其同工酶电泳分析[J].中国渔业质量与标准,2018,8(5):9-17. doi:10.3969/j.issn.2095-1833.2018.05.002.
Zhang T,Zhou J G,Wu J P,Chen J W,He L. Morphological characteristics and electrophoretic analysis of isozymes in juvenile Acipenser dabryanus[J].China Fishery Quality and Standards,2018,8(5):9-17.
[20] 张涛,甘金华,陈建武,周剑光,张林,何力. 斑点叉尾鮰形态观察及其两种同工酶的电泳分析[J].中国渔业质量与标准,2019,9(6):57-64. doi:10. 3969/j. issn. 2095-1833. 2019. 06. 007.
Zhang T,Gan J H,Chen J W,Zhou J G,Zhang L,He L. Morphological characteristics and electrophoretic analysis of two kinds of isozymes from Ietalurus Punetaus[J].Chinese Fishery Quality and Standards,2019,9(6):57-64.
[21] 张娟,王红叶,蔡焰值,卢涛,秦晓燕. 中华倒刺鲃同工酶组织特异性研究[J].湖北农业科学,2011,50(24):5206-5210. doi:10.3969/j.issn.0439-8114.2011.24.054.
Zhang J,Wang H Y,Cai Y Z,Lu T,Qin X Y. Study on the isozymic tissue specificity of Spinibarbus sinensis[J].Hubei Agricultural Sciences,2011,50(24):5206-5210.
[22] 林文燕,翁朝红,杨江东,李伟文,孙敏,冯宇月. 中国鲎同工酶组织器官特异性表达[J].集美大学学报(自然科学版),2010,15(5):333-337. doi:10.3969/j.issn.1007-7405.2010.05.003.
Lin W Y,Weng C H,Yang J D,Li W W,Sun M,Feng Y Y. The specific expression of isozymes in different tissues of Chinese horseshoe crab(Tachypleus tridentatus)[J].Journal of Jimei University(Natural Science),2010,15(5):333-337.
[23] 张涛,陈建武,何力. 尖裸鲤5种组织乳酸脱氢酶和苹果酸脱氢酶的电泳分析[J].华北农学报,2018,33(S1):89-93. doi:10. 7668/hbnxb. 2018. S1. 015.
Zhang T,Chen J W,He L. Electrophoretic analysis on lactate dehydrogenase(LDH)and malate dehydrogenase(MDH)in five different tissues of Oxygymnocypris stewartii[J].Acta Agriculturae Boreali-Sinica,2018,33(S1):89-93.
[24] 李晓莉,许映芳,方耀林,陶玲,李谷,詹会强. 齐口裂腹鱼染色体核型和同工酶初步研究[J].淡水渔业,2010,40(1):34-39. doi:10.3969/j.issn.1000-6907.2010.01.006.
Li X L,Xu Y F,Fang Y L,Tao L,Li G,Zhan H Q. Preliminary study on chromosome and isozyme of Schizothorax prenanti[J].Freshwater Fisheries,2010,40(1):34-39.
[25] 安苗,范家佑,黄保信,冯连华. 乌江上游四川裂腹鱼和昆明裂腹鱼5种同工酶的比较[J].贵州农业科学,2010,38(1):111-115. doi:10.3969/j.issn.1001-3601.2010.01.034.
An M,Fan J Y,Huang B X,Feng L H. Comparison of five isozymes in Schizothorax kozlovi and Schizothorax grahami in Up-streams of Wujiang river[J].Guizhou Agricultural Sciences,2010,38(1):111-115.
[26] 余敏,杨正荣,曾琳,王黎青,范伟,赖建华,谭德勇. 云南高背鲫鱼不同组织同工酶分析[J].动物学杂志,2006,41(6):97-103. doi:10.3969/j.issn.0250-3263.2006.06.016.
Yu M,Yang Z R,Zeng L,Wang L Q,Fan W,Lai J H,Tan D Y. The isozymes in different tissues of Carassius auratus from Yunnan Province[J].Chinese Journal of Zoology,2006,41(6):97-103.
[27] 张龙岗,刘羽清,朱树人,杨玲,付佩胜,朱永安. 乌鳢和杂交鳢4种同工酶的比较研究[J].长江大学学报(自科版),2017,14(18):33-36. doi:10.16772/j.cnki.1673-1409.2017.18.009.
[28] 胡思玉,陈永祥,赵海涛,王俊. 昆明裂腹鱼不同组织乳酸脱氢酶同工酶研究[J].贵州农业科学,2010,38(2):140-142. doi:10.3969/j.issn.1001-3601.2010.02.043.
Hu S Y,Chen Y X,Zhao H T,Wang J. Study on lactate dehydrogenase isoenzyme in different tissues of shizothorax grahami[J].Guizhou Agricultural Sciences,2010,38(2):140-142.
[29] 胡思玉,陈永祥,赵海涛,王俊. 昆明裂腹鱼同工酶组织特异性研究[J].毕节学院学报,2011,29(4):100-105. doi:10.3969/j.issn.1673-7059.2011.04.019.
Hu S Y,Hu S Y,Chen Y X,Zhao H T,Wang J. Research on the tissue specificity of isozymes of shizothorax graham[J].Journal of Bijie University,2011,29(4):100-105.
[30] 晁珊珊,宫佳琦,刀筱芳,郑玉才,杨裴芃,杨发龙,林亚秋. 齐口裂腹鱼及草鱼乳酸脱氢酶和苹果酸脱氢酶同工酶的比较研究[J].水产科学,2013,32(8):467-470.
Chao S S,Gong J Q,Dao X F,Zheng Y C,Yang P P,Yang F L,Lin Y Q. Comparison of LDH and MDH isozymes in Schizothorax pregnanti and grass carp Ctenopharyngodon idellus[J].Fisheries Science,2013,32(8):467-470.
[31] 胡思玉,彭垠,赵海涛,陈永祥. 四川裂腹鱼同工酶研究[J].湖北农业科学,2015,54(18):4540-4543. doi:10.14088/j.cnki.issn0439-8114.2015.18.037.
Hu S Y,Peng Y,Zhao H T,Chen Y X. Study on isoenzymes of Schizothorax kozlovi[J].Hubei Agricultural Sciences,2015,54(18):4540-4543.
[32] 段彪,刘鸿艳. 细鳞裂腹鱼同工酶组织特异性研究[J].西南大学学报(自然科学版),2010,32(6):27-30.
Duan B,Liu H Y. Study on isozymic tissue-specificity in Schizothorax chongi Fang[J].Journal of Southwest University (Natural Science),2010,32(6):27-30.
[33] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 养殖鱼类种质检验 第13部分:同工酶电泳分析:GB/T 18654.13-2008[S].北京:中国标准出版社,2008.
[34] 潘伟志,尹洪滨,孙中武,葛学亮,柯冬蕾. 乌苏里拟鲿(Pseudobagrus ussuriensis)同工酶分析[J].东北林业大学学报,2006,34(6):66-69. doi:10.3969/j.issn.1000-5382.2006.06.026.
Pan W Z,Yin H B,Sun Z W,Ge X L,Ke D L. Isozyme of Pseudobagrus ussuriensis in Heilongjiang water system[J].Journal of Northeast Forestry University,2006,34(6):66-69.
[35] 张燕萍,徐先栋,章海鑫,李彩刚. 黄尾鲴6种同工酶的组织特异性研究[J].中国农学通报,2016,32(35):10-14.
Zhang Y P,Xu X D,Zhang H X,Li C G. Six kinds of isozymes in different tissues of Xenocypris davidi[J].Chinese Agricultural Science Bulletin,2016,32(35):10-14.
[36] 姚桂桂,刘凯,谢楠,冯晓宇. 黄尾鲴不同组织中LDH同工酶的研究[J].2016,44(15):135-137. doi:10.3969/j.issn.0517-6611.2016.15.047.
Yao G G,Liu K,Xie N,Feng X Y. Study on LDH isozyme in different tissues of Xenocypris davidi[J].Journal of Anhui Agricultural Science,2016,44(15):135-137.
[37] 朱华平,黄樟翰,卢迈新. 翘嘴红鲌和海南红鲌同工酶的比较研究[J].大连水产学院学报,2003,18(3):175-179. doi:10.3969/j.issn.1000-9957.2003.03.004.
Zhu H P,Huang Z H,Lu M X. A comparative study on isozymes of Erythroculter ilishaeformis Bleeker and Erythroculter recurviceps Richardson[J].Journal of Dalian Fisheries University,2003,18(3):175-179.
[38] 杨玲,李宁,孟庆磊. 黄河翘嘴红鲌同工酶组织特异性研究[J].山东师范大学学报(自然科学版),2015,30(4):99-103.doi:10.3969/j.issn.1001-4748.2015.04.023.
Yang L,Li N,Meng Q L. Study on isozymes tissue specificity of Erythroculter ilishaeformis[J].Journal of Shandong Normal University (Natural Science),2015,30(4):99-103.
[39] 朱挺兵,胡飞飞,龚进玲,王旭歌,杨德国,李雷. 澜沧江西藏段鱼类优先保护等级评价[J].淡水渔业,2021,51(2):40-46. doi:10.13721/j.cnki.dsyy.2021.02.005.
Zhu T B,Hu F F,Gong J L,wang X G,Yang D G,Li L. Quantitative assessment of the priority conservation of fishes in the Tibet reach of the Lancang River,China[J].Freshwater Fisheries,2021,51(2):40-46.
[40] 金洪宇,李雷,金星,王念民,马清芝,尹家胜,马波. 雅鲁藏布江下游墨脱江段黄斑褶鮡的年龄结构与生长特征[J].淡水渔业,2020,50(2):10-17. doi:10.3969/j.issn.1000-6907.2020.02.002.
Jin H Y,Li L,Jin X,Wang N M,Ma Q Z,Yin J S,Ma B. Age and growth of Pseudecheneis sulcatus in lower reach of Yarlung Zangbo River of medog County reach[J].Freshwater Fisheries,2020,50(2):10-17.
[41] 朱蓝菲. 几种鲤科鱼类及杂种的乳酸脱氢酶同工酶的比较[J].水生生物学集刊,1982,7(4):539-545.
Zhu L F. Comparative studies on lactate dehydrogenase isozymes in some cyprinid fishes and their hybrids[J].Acta Hydrobiological Sinica,1982,7(4):539-545.
[42] 蒋晓华,昝瑞光. 云南滇池高背鲫鱼乳酸脱氢酶(LDH)同工酶发育遗传学分析[J].1996,9(4):53.
Jiang X H,Zan R G. Analysis on the developmental genetics of lactate dehydrogenase isozymes in Dianchi high-back gructian carp(Carassius Auratus)in Yunnan[J].Southwest China Journal of Agricultural Science,1996,9(4):53.
