精子活力测定是研究精子生理特性的主要内容,也是评价精子质量的重要指标。良好的精子活力是进行受精以及提高受精率的基础,精子活力下降将严重影响胚胎发育[1]。研究不同水环境因子(盐度、碱度、温度等)对鱼类精子活力的影响,对了解不同鱼类精子的生理特性及提高人工繁育效果具有重要的参考价值。目前,国内外学者对不同鱼类精子活力的研究已有诸多报道。国内学者徐敏等[2]和丁辰龙等[3]研究了盐度、碱度及葡萄糖对大鳞鲃(Luciobarbus capito)精子活力的影响;顾正选和丁诗华[4]研究了盐度和pH值对齐口裂腹鱼(Schizothorax prenanit)精子活力的影响;郑学斌等[5]研究了pH、不同化学溶液(KCl、NaCl、MgCl2和CaCl2)及葡萄糖对马口鱼(Opsariichthys bidens)精子活力的影响;乔志刚等[6]报道了pH值和温度对黄河鲇(Silurus asotus)精子活力的影响。国外学者Gárriz等[7]报道了水环境中的某些金属可以降低银汉鱼(Odontesthes bonariensis)的精子活力及其受精率;Dzyuba等[8]报道了环境温度对尼罗罗非鱼(Oreochromis niloticus)精子活力的影响。
我国有盐碱地99 130 khm2,其中盐碱水域45 870 khm2,约占全国湖泊总面积的55%[9-10]盐碱水具有高碳酸盐碱度![]() 和
和![]() 高pH值、离子组成复杂等理化特点,大部分水域不能被农业和生活直接利用,处于荒置状态。生产实践证明,以渔治碱是开发利用盐碱水域的有效途径,然而耐盐碱品种匮乏及配套养殖技术落后是制约盐碱水开发利用的主要限制因素。因此,培育耐盐碱、品质优的水产新养殖种是加快盐碱水开发利用进程的重要前提。
高pH值、离子组成复杂等理化特点,大部分水域不能被农业和生活直接利用,处于荒置状态。生产实践证明,以渔治碱是开发利用盐碱水域的有效途径,然而耐盐碱品种匮乏及配套养殖技术落后是制约盐碱水开发利用的主要限制因素。因此,培育耐盐碱、品质优的水产新养殖种是加快盐碱水开发利用进程的重要前提。
瓦氏雅罗鱼隶属于鲤形目、鲤科、雅罗鱼亚科的雅罗鱼属,亦称东北雅罗鱼,俗称华子鱼、滑鱼、白鱼。主要分布于我国黑龙江流域、黄河、辽河及内陆淡水及盐碱湖泊[11-14]。瓦氏雅罗鱼具有极强的盐碱耐受力,是内蒙古高盐碱湖泊-达里诺尔湖(碱度53.57 mmol/L,pH值 9.69)的主要经济鱼类之一[15]。了解和掌握其繁殖生物学特性对开发利用这一优异种质资源,加快盐碱水域开发利用,拓宽养殖空间,具有重要的生态、经济和社会效益。
本研究不同NaCl 盐度、NaHCO3碱度和pH值对瓦氏雅罗鱼精子活力及其受精率的影响,筛选瓦氏雅罗鱼精子活力最强及受精率最高的盐度、碱度及pH值适宜范围,为瓦氏雅罗鱼人工繁育和耐盐碱新品种培育提供理论依据和科学指导。
1 材料和方法
1.1 亲鱼来源
达里诺尔湖瓦氏雅罗鱼(Leuciscus waleckii)自交F2,4龄(平均体质量(140.33±5.83)g,平均体长(20.10±2.16)cm),于黑龙江水产研究所呼兰实验站室外土池饲养。
1.2 试验设计
1.2.1 不同NaCl盐度溶液的配置 不同盐度的溶液用国产分析纯NaCl(天津致远化学试剂有限公司)和去离子水配置,设为1‰,2‰,3‰,4‰,5‰,6‰,7‰,8‰共8个梯度。配置好的溶液用YSI水质分析仪(YSI,美国)测定水体盐度,每个梯度重复3次。
1.2.2 不同NaHCO3碱度溶液的配置 不同碱度的溶液用国产分析纯NaHCO3(天津市凯通化学试剂有限公司)和去离子水配置,梯度设置参考徐敏[2]等的研究结果,设为0(对照组),10,20,30,40,50,60,70 mmol/L共8个梯度,配制好的溶液用盐酸滴定法标定,pH值由梅特勒-托利多pH计(SevenCompact,德国)测定。每个梯度重复3次。
1.2.3 不同pH值溶液的配置 不同值pH值溶液用国产分析纯NaOH(天津市凯通化学试剂有限公司)HCl 2种溶液配置,梯度设置参照顾正选等[4]的研究结果,pH值由梅特勒-托利多pH计(SevenCompact,德国)测定,共设置7个梯度,pH 5.0、pH 5.5、pH 6.0、pH 6.5、pH 7.0、pH 7.5和pH 8.0。每个梯度重复3次。
1.3 精液和卵子采集
室外土池饲养的达里诺尔湖瓦氏雅罗鱼每年4月中下旬开始进行人工繁殖。选取健康,体表鳞片完整、成熟度较好的亲鱼雌雄各10尾,采用药物促黄体生成素释放激素类似物LHRH-A(5 μg/kg)和地欧酮马来酸盐DOM(5 mg/kg)进行人工催产,其中雄鱼剂量减半。室内水温13~16 ℃,效应时间为24~30 h。当雌雄个体出现产卵迹象时,分别将亲鱼麻醉,用干毛巾擦干腹部、生殖孔、腹鳍、臀鳍上的水珠,从腹鳍向臀鳍方向轻轻地顺势挤压腹部两侧,采集卵子和精液。由于瓦氏雅罗鱼精液较少,可用移液器枪头从生殖孔吸取精液,放入2 mL的离心管中。采集精液时尽量避免血液、尿液和粪便污染,成熟度较好的精液呈乳白色。将采集的卵子和精液于干燥的容器内盛放,避光保存于4 °C的冷藏箱中备用。
1.4 不同处理组精子活力的观察及时长测定
用移液枪吸取10 μL的精液于1.5 mL离心管中,加入50 μL生理盐水稀释,再用干净的解剖针蘸取少许精液于载玻片中,放在10×4倍显微镜下,分别取10 μL不同处理组和各个梯度的NaCl溶液、NaHCO3溶液和pH溶液激活精子,与此同时,按下秒表计时并观察不同水体下精子的运动情况。试验期间室内温度为(16±1)℃。精子活力的等级划分参照谭中林等[16]的报道,具体指标测定的方法和标准参考王信海等[17]的报道(略加改进)。精子激烈运动时间(Drastic movement)为在显微镜下精子呈“旋涡”状态,无法看清精子的运动路线;快速运动时间(Rapid movement)为在显微镜下能看清楚精子的运动路线;精子寿命(Life span)为从精子激活开始到90%精子停止原地颤动所需要的时间。
1.5 人工授精及受精率的测定
取少量精液覆盖到卵子上,用干净羽毛搅拌1 min使精液与卵子充分混匀,再将卵子拨入盛有约150 mL的各组试验液的培养皿(60 mm×90 mm)中,每组约100~150粒受精卵,黏附在培养皿底部发育,8 h后待发育至囊胚后期镜检统计受精率[17]。
1.6 数据分析
试验所得数据均用SPSS 26软件进行统计学分析。所有数据以![]() 表示,采用Duncan方法进行多重比较以检验其差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
表示,采用Duncan方法进行多重比较以检验其差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同NaCl盐度对瓦氏雅罗鱼精子活力的影响
由表1可知,盐度在0~4‰,瓦氏雅罗鱼精子激烈运动、快速运动时间及寿命呈逐渐上升趋势。在盐度4‰,激烈运动时间、快速运动时间和寿命达到最长,分别为(66.73±1.73)s,(117.11±7.65)s,(252.79±11.41)s,且与其他处理组具有显著性差异(P<0.05)当盐度大于4‰,3个参数呈下降趋势,当盐度为8‰,精子无激烈运动和快速运动(表1),用胶头滴管滴一滴去离子水(约50 μL)使盐度稀释小于4‰,显微镜下精子恢复剧烈运动和快速运动。
表1 不同NaCl盐度对瓦氏雅罗鱼精子活力的影响
Tab.1 Effects of different NaCl salinity solutions on sperm motility of Amur ide
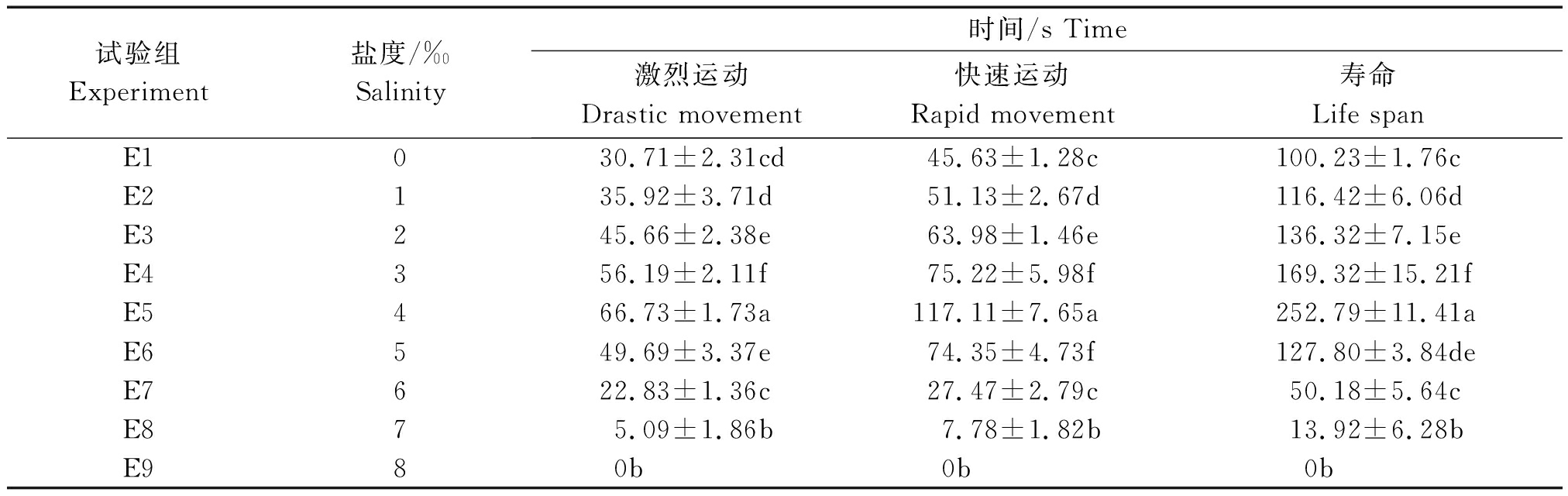
试验组Experiment盐度/‰Salinity时间/s Time激烈运动Drastic movement快速运动Rapid movement寿命Life spanE10 30.71±2.31cd45.63±1.28c100.23±1.76cE21 35.92±3.71d51.13±2.67d116.42±6.06dE3245.66±2.38e63.98±1.46e136.32±7.15eE4356.19±2.11f75.22±5.98f169.32±15.21fE5466.73±1.73a117.11±7.65a252.79±11.41aE6549.69±3.37e74.35±4.73f127.80±3.84deE7622.83±1.36c27.47±2.79c50.18±5.64cE87 5.09±1.86b7.78±1.82b13.92±6.28bE98 0b0b0b
注:同列数据的不同字母代表有显著差异性(P<0.05)。表2-3同。
Note:Different letters of the same column represent significant difference(P<0.05).The same as Tab.2-3.
2.2 不同NaHCO3碱度对瓦氏雅罗鱼精子活力的影响
由表2可知,当碱度在0~50 mmol/L时,精子激烈运动、快速运动时间及寿命随碱度增加而延长。碱度为0 mmol/L,激烈运动和快速运动时间及寿命最短,分别为(30.71±2.31)s,(45.63±1.28)s,(100.23±2.76)s;当碱度增加到50 mmol/L,这3个参数均达到最大值,分别为(56.02±2.98)s,(85.63±2.31)s,(179.20±5.77)s,并且与其他处理组均存在显著性差异(P<0.05);当碱度>50 mmol/L,3个参数呈下降趋势(表2)。
表2 不同NaHCO3碱度溶液对瓦氏雅罗鱼精子活力的影响
Tab.2 Effects of different NaHCO3 alkalinity on sperm motility of Amur ide
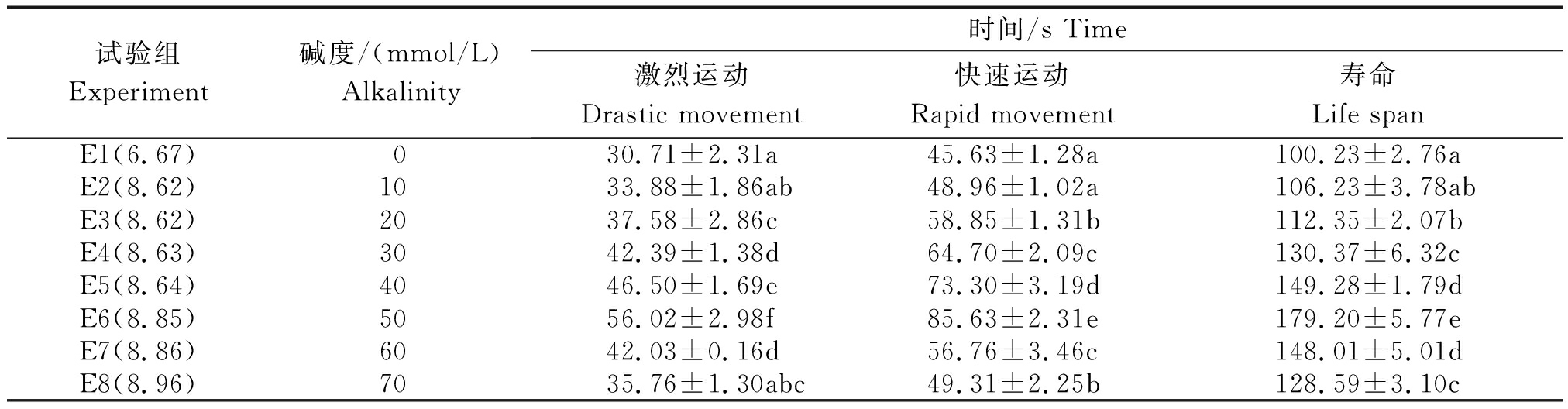
试验组Experiment碱度/(mmol/L)Alkalinity时间/s Time激烈运动Drastic movement快速运动Rapid movement寿命Life spanE1(6.67)030.71±2.31a45.63±1.28a100.23±2.76aE2(8.62)1033.88±1.86ab48.96±1.02a106.23±3.78abE3(8.62)2037.58±2.86c58.85±1.31b112.35±2.07bE4(8.63)3042.39±1.38d64.70±2.09c130.37±6.32cE5(8.64)4046.50±1.69e73.30±3.19d149.28±1.79dE6(8.85)5056.02±2.98f85.63±2.31e179.20±5.77eE7(8.86)6042.03±0.16d56.76±3.46c148.01±5.01dE8(8.96)7035.76±1.30abc49.31±2.25b128.59±3.10c
2.3 不同pH值溶液对瓦氏雅罗鱼精子活力的影响
由表3可知,瓦氏雅罗鱼精子在pH 值5.0~8.0均能存活。在pH值5.0~7.0,精子剧烈运动、快速运动时间及寿命随pH值的升高而延长;在pH值7.0达到最大,分别为(45.66±3.65)s,(82.39±3.10)s,(146.14±2.91)s ,并与其他处理组具有显著性差异(P<0.05);当pH值大于7.0,3个参数呈下降趋势(表3)。
表3 不同pH值溶液对瓦氏雅罗鱼精子活力的影响
Tab.3 Effects of different pH solutions on sperm motility of Amur ide
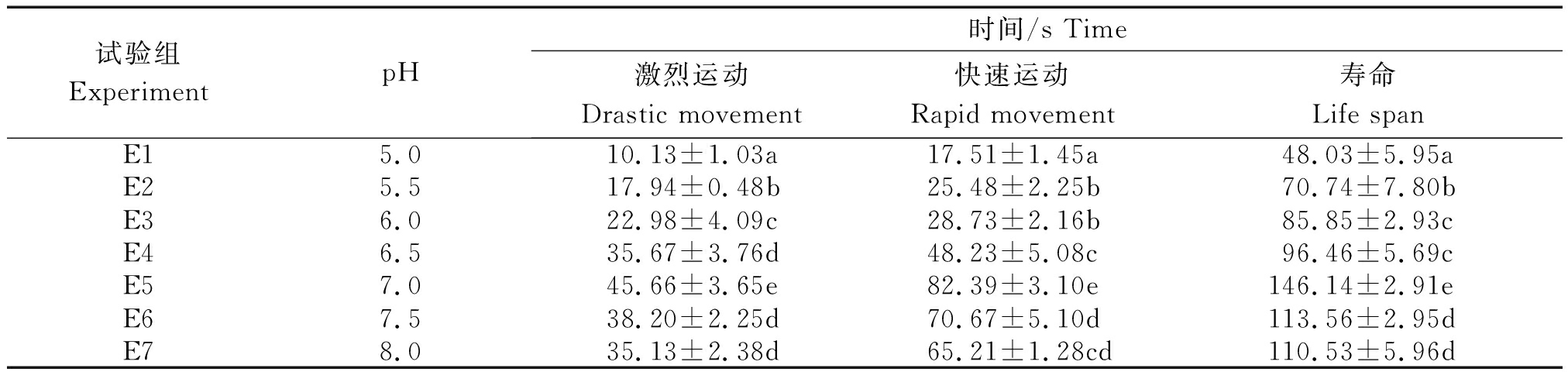
试验组ExperimentpH时间/s Time激烈运动Drastic movement快速运动Rapid movement寿命Life spanE15.010.13±1.03a17.51±1.45a48.03±5.95aE25.517.94±0.48b25.48±2.25b70.74±7.80bE36.022.98±4.09c28.73±2.16b85.85±2.93cE46.535.67±3.76d48.23±5.08c96.46±5.69cE57.045.66±3.65e82.39±3.10e146.14±2.91eE67.538.20±2.25d70.67±5.10d113.56±2.95dE78.035.13±2.38d65.21±1.28cd110.53±5.96d
2.4 不同盐度对瓦氏雅罗鱼受精率的影响
瓦氏雅罗鱼受精卵在不同盐度胁迫下,均可正常发育,随着盐度的增加,胚盘与腔体间隙有增大的趋势(图1)。

图1 不同盐度胁迫下瓦氏雅罗鱼8 h胚胎的状态
Fig.1 The status of embryos of Amur ide under different salinity stress at 8 h
由图2可知,瓦氏雅罗鱼的受精率在盐度(去离子水对照)为0最高,达到95%,且与其他组具有显著性差异(P<0.05)。在1‰~4‰受精率逐渐上升,在盐度为4‰最高,为84%。当盐度大于4‰,受精率呈逐渐下降趋势。
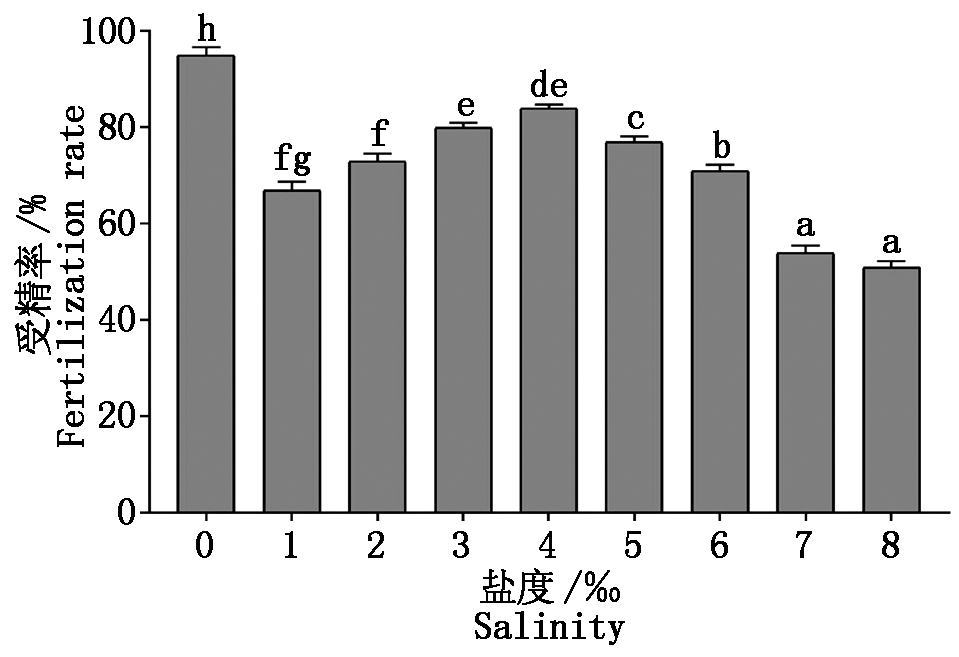
不同小写字母代表处理间差异显著(P<0.05)。图4,6同。
Different lowercase letters represent significant differences
between treatments(P<0.05).The same as Fig.4.6.
图2 不同盐度溶液下瓦氏雅罗鱼的受精率
Fig.2 Fertilization rate of Amur ide in
different salinity solution
2.5 不同碱度对瓦氏雅罗鱼受精率的影响
由图3可知,瓦氏雅罗鱼在碱度为10~60 mmol/L,随着碱度的增加,胚盘与腔体间隙逐渐增加,胚盘大小与对照组无明显差异;当碱度增加至70 mmol/L,胚胎显著膨胀。

图3 不同碱度胁迫下瓦氏雅罗鱼胚胎8 h的状态
Fig.3 The status of embryos of Amur ide under different alkalinity stress at 8 h
由图4可知,瓦氏雅罗鱼受精率在碱度(去离子水对照)为0最高,达到95%,且与其他组具有显著性差异(P<0.05)。碱度在10~30 mmol/L受精率逐渐上升,30 mmol/L达到最高,为71%。当碱度>30 mmol/L,受精率呈下降趋势。
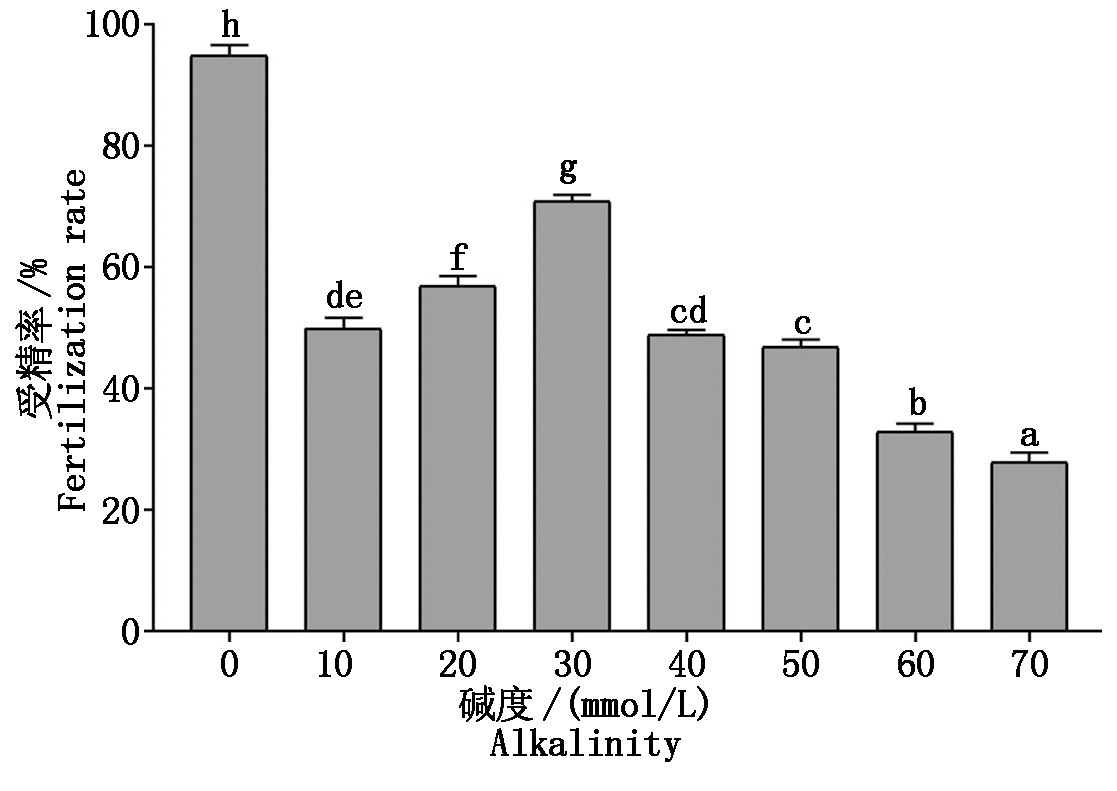
图4 不同碱度溶液下瓦氏雅罗鱼的受精率
Fig.4 Fertilization rate of Amur ide in
different alkalinity solution
2.6 不同pH值对瓦氏雅罗鱼受精率的影响
瓦氏雅罗鱼胚胎在pH值5.0~7.5,随着pH值的升高胚盘与腔体间隙有增大的趋势,但与对照组无显著性差异,当pH值为8胚胎显著膨胀(图5)。
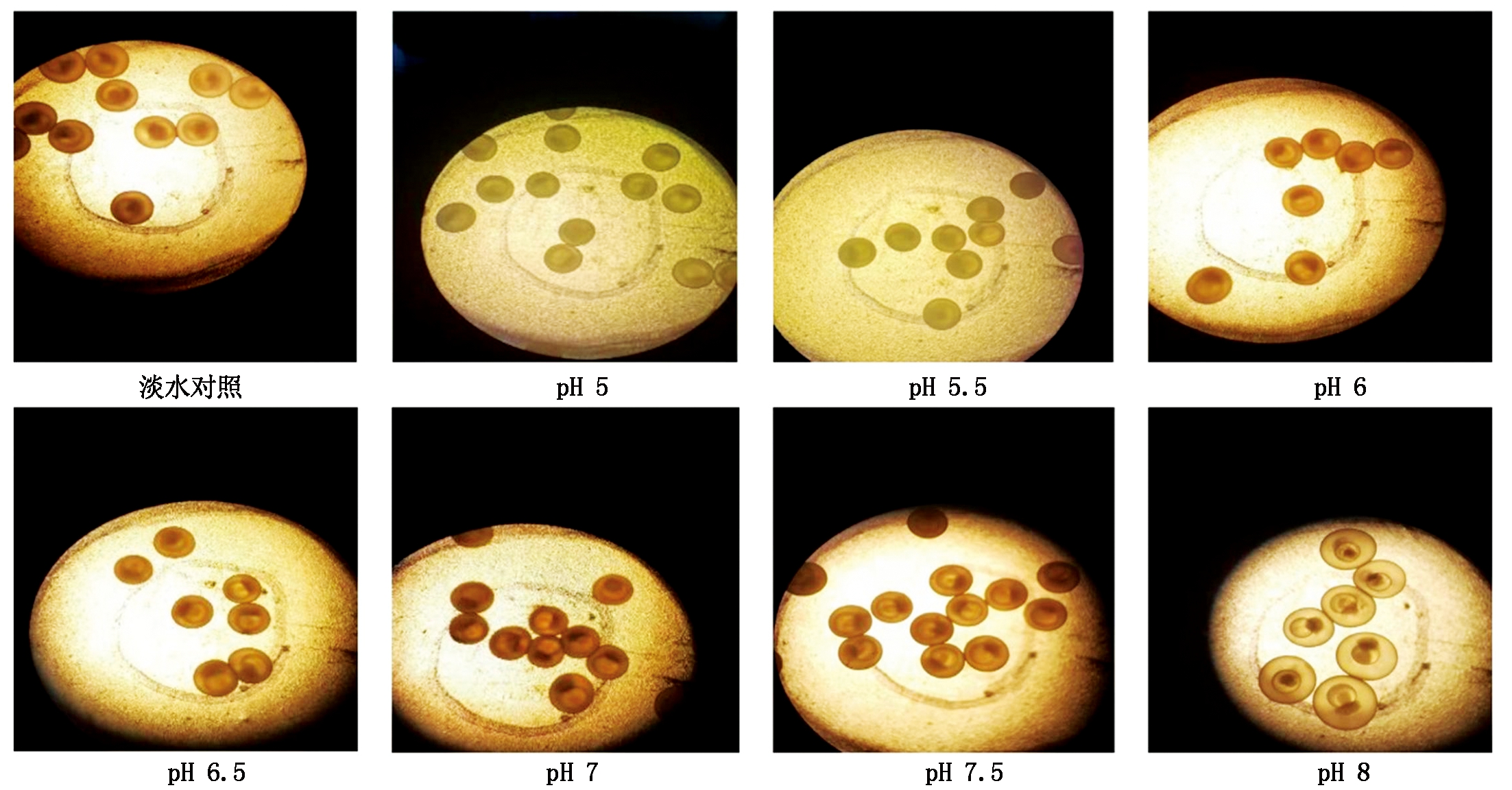
图5 不同pH值胁迫下瓦氏雅罗鱼8 h胚胎的状态
Fig.5 The status of embryos of Amur ide under different pH value stress at 8 h
由图6可知,瓦氏雅罗鱼受精率,在pH值5.0~6.5受精率逐渐呈上升趋势,在pH值6.5最高,为98%,在pH值6.5~8.0,逐渐下降,在pH值8.0最低,为32%且与其他组具有显著性差异(P<0.05)。
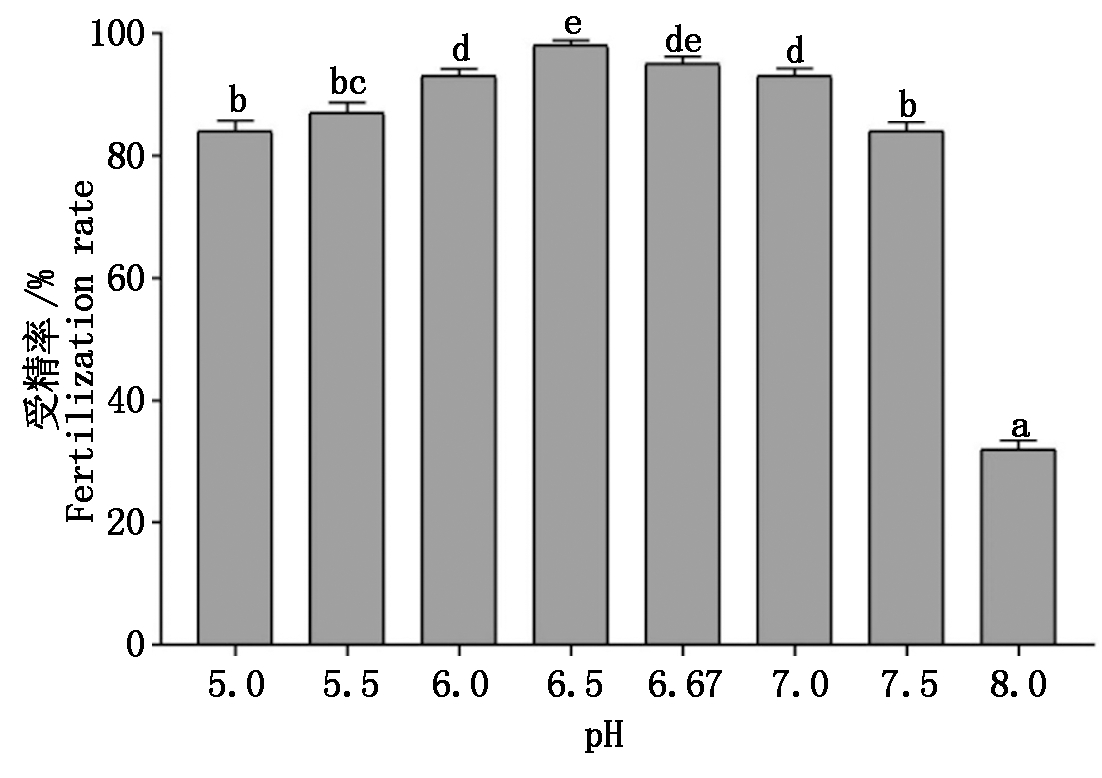
图6 不同pH值溶液下瓦氏雅罗鱼的受精率
Fig.6 Fertilization rate of Amur ide in
different pH solution
3 讨论
耐盐碱鱼类通常洄游到淡水河道产卵,如达里诺尔湖瓦氏雅罗鱼、青海湖裸鲤(Gymnocypris przewalskii)、珠星三块鱼(Tribolodonha konensis)及三块鱼(Tribolodon brandti)[18-21],表明水体中的盐碱度对鱼类的繁殖行为有较大影响。研究盐度、碱度及pH值对鱼类精子活力的影响,将有助于揭示水生生物耐盐碱的范围,并对提高盐碱水域养殖鱼类的成活率和拓宽盐碱水域养殖空间具有重要指导意义。
3.1 NaCl盐度对瓦氏雅罗鱼精子活力的影响
盐度通过离子和渗透压作用改变鱼类精子细胞内ATP酶的活性,对鱼类精子活力产生影响[22]。低盐度环境中,精子内ATP的产生和消耗在一定时间内可达到一致,因而精子能够维持较长的寿命;高盐度环境中,ATP酶活性被抑制,从而抑制精子活力[23]。本研究发现盐度为0~4‰,瓦氏雅罗鱼精子激烈运动时间、快速运动时间和寿命呈逐渐上升趋势,且在盐度为4‰,精子激烈运动时间、快速运动时间和寿命最长,并且与其他处理组均存在显著性差异,表明达里诺尔湖瓦氏雅罗鱼精子的最适盐度为4‰,这与方正鲫(Carassius auratus)和大鳞鲃(Barbus capito)4‰的最适盐度结果一致,也与齐口裂腹鱼(Schizothorax prenanti)和鲥鱼(Tenualosa reevesii)5‰的最适盐度相近。在盐度为4‰~8‰,这3个参数整体呈下降趋势。其中盐度8‰,显微镜下只观察到3%~5%的精子原地颤动,未观察到激烈运动和快速运动;经过35~45s后,通过复加去离子水稀释,则发现大部分精子由原地颤动转入激烈运动和快速运动,表明达里诺尔湖瓦氏雅罗鱼在盐度为8‰,精子活力即受到抑制,这与徐敏等[2]研究的结果一致,即方正鲫和大鳞鲃的盐度大于8‰时,精子活力受到明显的抑制。
3.2 NaHCO3碱度对瓦氏雅罗鱼精子活力的影响
鱼类精子活力的激活与pH、K+、Mg2+、Na+、Ca2+等密切相关[5,24-26]。NaHCO3通过其分解产物(HCO3-和CO2)参与这些离子的运输而对鱼类精子活力产生重要影响[5]。研究发现,将虹鳟(Oncorhynchus mykiss)和大马哈鱼(Oncorhynchus keta)精子从精巢中转入含HCO3-浓度较高的人造精浆中,HCO3-与精子细胞内的4-AP(K+通道阻滞剂)反应,减弱了4-AP对K+通道的阻断作用,使原本不运动的精子获得动力被激活,证明HCO3-对精子活力有促进作用[7]。本研究通过比较不同NaHCO3碱度刺激下的精子活力,发现随碱度增加,精子激烈运动和快速运动时间及寿命均相应延长。其中碱度50 mmol/L,这3个参数达到最大值,且与淡水对照组碱度0 mmol/L存在显著差异(P<0.05),表明达里诺尔湖瓦氏雅罗鱼长期生活在碱度高达50 mmol/L左右的水域中,其精子具有较强的耐高碱特性。但Tanaka等[27]对日本鳗鲡(Anguilla japonica)精子活力的研究发现,随着NaHCO3浓度增加(0~50 mmol/L),日本鳗鲡精子的激活率逐渐下降,推测NaHCO3中游离的CO2通过抑制精子细胞内CO2的扩散,阻止精子线粒体氧化磷酸化作用,从而抑制精子活力。而徐敏等[2]对松浦镜鲤(Cynipus carpio)、方正鲫和大鳞鲃精子活力的研究发现,HCO3-对精子活力的促进或抑制作用不明显。上述这些结果的差异性,可能与研究对象长期所处的栖息生境以及自身的生物学特性不同有关。
3.3 pH值对瓦氏雅罗鱼精子活力的影响
鱼类精子在精巢和精原液中几乎是不活动的,只有被释放到体外并且处于适宜的pH值环境才可被激活[28]。研究表明,大多数鱼类精子在中性或偏碱性的溶液中活力及受精率均较高,为7.0~9.0[29-30]。虹鳟精子活力和受精率在pH值为9.0最高[31],斜带石斑鱼(Epinephelus coioides)其精子活力在pH值6.5~8.7最高[32],长鳍篮子鱼(Siganus canaliculatus)精子活力在pH值8.0,均获得最高活力和最长激烈运动时间[33];齐口裂腹鱼[4]在pH值7.0左右,活性最强。本研究发现,瓦氏雅罗鱼精子在pH值5.0~8.0均能存活,但在pH值7.0,精子剧烈运动、快速运动时间和寿命达到最大,且与其他处理组具有显著性差异(P<0.05),该结果与其他鱼类的研究结果相似,即在中性或偏碱性环境中,精子活力最强。
在不同碱度试验中,精子活力最强的溶液pH值为8.85,而在不同pH值试验中精子活力最强时溶液pH值为7.0,这种pH值的差异可能与溶液离子成分不同有关。NaHCO3碱度试验中所产生的pH值主要是由![]() 离子水解产生,鱼类精浆中Na+、K+、Cl-构成精子内外的渗透压,参与精子活力的调控[33]。高浓度的K+对鱼类精子活力有抑制作用,而Na+ 可以克服K+的抑制作用[34],在雄鱼生殖道中,薄壁细胞分泌的促性腺激素可以诱导K+分泌到精液,并吸收Na+,使精液中K+浓度升高、Na+浓度降低,从而使精子在精液中处于静息状态[35]。笔者认为,在不同NaHCO3碱度试验中,
离子水解产生,鱼类精浆中Na+、K+、Cl-构成精子内外的渗透压,参与精子活力的调控[33]。高浓度的K+对鱼类精子活力有抑制作用,而Na+ 可以克服K+的抑制作用[34],在雄鱼生殖道中,薄壁细胞分泌的促性腺激素可以诱导K+分泌到精液,并吸收Na+,使精液中K+浓度升高、Na+浓度降低,从而使精子在精液中处于静息状态[35]。笔者认为,在不同NaHCO3碱度试验中,![]() 离子减弱了4-AP对K+通道的阻断作用,同时高浓度的Na+又克服了K+的抑制作用,共同对精子活性有促进作用。因此,在NaHCO3碱度试验中精子活力最强时pH值在8.0左右,而不同pH值试验中,精子活力最强时pH值在7.0左右,这也可能与瓦氏雅罗鱼长期生活在高碳酸盐碱度的环境有关,具体原因还有待进一步的研究。
离子减弱了4-AP对K+通道的阻断作用,同时高浓度的Na+又克服了K+的抑制作用,共同对精子活性有促进作用。因此,在NaHCO3碱度试验中精子活力最强时pH值在8.0左右,而不同pH值试验中,精子活力最强时pH值在7.0左右,这也可能与瓦氏雅罗鱼长期生活在高碳酸盐碱度的环境有关,具体原因还有待进一步的研究。
3.4 不同盐度、碱度、pH值对瓦氏雅罗鱼受精率的影响
精子活力和受精率紧密相关,精子必须具备一定的活力才能得到比较高的受精率。在盐碱水环境中,盐度、碱度和pH值是评价盐碱水质条件的重要指标,不同鱼类繁殖时的最适盐度、碱度以及pH值范围亦存在很大差异。如大鳞鲃[36]在盐度低于3.2‰、碱度低于14.32 mmol/L胚胎成活率较高;卡拉白鱼(Chalcalburnus chalcoides)在盐度1~3‰、碱度0~10 mmol/L内适合受精,其适宜的盐度范围比精子活力适宜的盐度范围3‰~5‰要低[17]。本研究瓦氏雅罗鱼受精率较高的盐度范围在0~4‰,这与精子活力在盐度4‰最强基本一致;pH值为6.0~7.0受精率均在93%以上,这与pH值为7.0精子活力最强同样具有很高的相关性;受精率较高的碱度范围为0~30 mmol/L,而精子活力最强时的碱度为50 mmol/L,这与碱度对鱼类卵子和胚胎发育破坏力强显著相关。可以看出,较低的盐度和碱度可以显著提升瓦氏雅罗鱼胚胎的受精率,这与徐伟等[36]和王信海等[17]的研究结果相似,同时也与耐盐碱鱼类洄游到淡水河道产卵的繁殖生物学特性相符。
综上,基于对不同盐度、碱度和pH值对瓦氏雅罗鱼精子活力及其受精率的分析结果,建议在开展瓦氏雅罗鱼全人工繁殖及杂交育种过程中,尽量选择盐度在0~4‰,碱度为0~30 mmol/L,pH值6.0~7.0的盐碱水体或淡水中进行,可以获得较高的受精率及苗种成活率。
[1] 程琳,徐革锋,黄天晴,谷伟,史秀兰,刘晨斌,王炳谦. 游离氨基酸对褐鳟和金鳟精子活力的影响[J].东北农业大学学报,2019,50(10):47-53,62.doi:10.19720/j.cnki.issn.1005-9369.2019.10.006.
Cheng L,Xu G F,Huang T Q,Gu W,Shi X L,Liu C B,Wang B Q. Effect of free amino acids on sperm motility of Brown trout(Salmo trutta)and Golden trout(Oncorhynchus mykiss)[J].Journal of Northeast Agricultural University,2019,50(10):47-53,62.
[2] 徐敏,杨建,姜海峰,耿龙武,徐伟. NaCl盐度和NaHCO3碱度对鲤、鲫和大鳞鲃的精子活力及其受精率的影响[J].中国水产科学,2014,21(4):720-728.doi:10.3724/SP.J.1118.2014.00720.
Xu M,Yang J,Jiang H F,Geng L W,Xu W. Effects of NaCl salinity and NaHCO3 alkalinity on the sperm motility and fertilization rate of Cynipus carpio,Carassius auratu gibelio and Barbus capitos[J].Journal of Fishery Sciences of China,2014,21(4):720-728.
[3] 丁辰龙,王宣朋,李康,覃宝利,叶建勇,蔺玉华. NaCl、KCl和葡萄糖对大鳞鲃精子活力的影响[J].天津师范大学学报(自然科学版),2018,38(6):32-35,57. doi:10.19638/j.issn1671-1114.20180607.
Ding C L,Wang X P,Li K,Qin B L,Ye J Y,Lin Y H. Effects of NaCl,KCl and glucose on the sperm motility of Barbus capito[J].Journal of Tianjin Normal University (Natural Science Edition),2018,38(6):32-35,57.
[4] 顾正选,丁诗华. pH值及不同百分浓度NaCl溶液对齐口裂腹鱼精子活力的影响[J].西南大学学报(自然科学版),2017,39(7):72-76. doi:10.13718/j.cnki.xdzk.2017.07.011.
Gu Z X,Ding S H. Influence of pH and different concentrations of NaCl solution on Schizothorax prenanit sperm vitality[J].Journal of Southwest University (Natural Science Edition),2017,39(7):72-76.
[5] 郑学斌,张清科,朱咏梅,竺俊全. 几种环境因子对马口鱼精子活力的影响[J].生物学杂志,2018,35(6):74-78. doi:10.3969/j.issn.2095-1736.2018.06.074.
Zheng X B,Zhang Q K,Zhu Y M,Zhu J Q. Effects of several environmental factors on the motility of sperm in Opsariichthys bidens[J].Journal of Biology,2018,35(6):74-78.
[6] 乔志刚,刘淑琰,沈方方. 鲇精子超微结构及pH、温度对其精子活力的影响[J].大连海洋大学学报,2016,31(6):602-606.doi:10.16535/j.cnki.dlhyxb.2016.06.003.
Qiao Z G,Liu S Y,Shen F F. Ultrastructure of spermatozoon and effects of pH and temperature on spermatozoon motility in oriental sheatfish Silurus asotus[J].Journal of Dalian Ocean University,2016,31(6):602-606.
[7] G rriz
rriz  ,Miranda L A. Effects of metals on sperm quality,fertilization and hatching rates,and embryo and larval survival of pejerrey fish(Odontesthes bonariensis)[J].Ecotoxicology,2020,29(7):1072-1082.doi:10.1007/s10646-020-02245-w.
,Miranda L A. Effects of metals on sperm quality,fertilization and hatching rates,and embryo and larval survival of pejerrey fish(Odontesthes bonariensis)[J].Ecotoxicology,2020,29(7):1072-1082.doi:10.1007/s10646-020-02245-w.
[8] Dzyuba B,Legendre M,Baroiller J F,Cosson J. Sperm motility of the Nile tilapia(Oreochromis niloticus):Effects of temperature on the swimming characteristics[J].Animal Reproduction Science,2019,202:65-72.doi:10.1016/j.anireprosci.2019.01.010.
[9] 刘永新,方辉,来琦芳,梁利群. 我国盐碱水渔业现状与发展对策[J].中国工程科学,2016,18(3):74-78.
Liu Y X,Fang H,Lai Q F,Liang L Q. The current state and development strategy for China's saline-alkaline fisheries[J].Engineering Sciences,2016,18(3):74-78.
[10] 常玉梅,梁利群. 耐盐碱鱼类的生理和分子机制研究进展[J].水产学报,2021,45(5):798-812.doi:10.11964/jfc.20190311681.
Chang Y M,Liang L Q. Advances of research of physiological and molecular mechanisms related to alkali-saline adaptation for fish species inhabiting alkali-saline water[J].Journal of Fisheries of China,2021,45(5):798-812.
[11] 何强,常玉梅,苏宝锋,孙博,闫浩,梁利群. 高碱度和高氨对达里湖瓦氏雅罗鱼耗氧率和排氨率的影响[J].生物学杂志,2016,33(6):48-51,77.doi:10.3969/j.issn.2095-1736.2016.06.048.
He Q,Chang Y M,Su B F,Sun B,Yan H,Liang L Q. Effects of high carbonate alkalinity water and high ammonia water on oxygen consumption and ammonia excretion in Leuciscus waleckii Dybowski[J].Journal of Biology,2016,33(6):48-51,77.
[12] 常玉梅,何强,孙言春,梁利群,孙效文. 碳酸盐碱度胁迫下瓦式雅罗鱼血浆游离氨基酸水平的变化[J].中国水产科学,2016,23(1):117-124. doi:10.3724/SP.J.1118.2016.15080.
Chang Y M,He Q,Sun Y C,Liang L Q,Sun X W. Changes in plasma free amino acid levels in Leuciscus waleckii exposed to different environmental alkalinity levels[J].Journal of Fishery Sciences of China,2016,23(1):117-124.
[13] 高珊,常玉梅,赵雪飞,孙博,张立民,梁利群,董志国. 不同NaHCO3碱度对瓦氏雅罗鱼鳃组织结构的影响[J].水生生物学报,2020,44(4):736-743. doi:10.7541/2020.088.
Gao S,Chang Y M,Zhao X F,Sun B,Zhang L M,Liang L Q,Dong Z G. The effect of different bicarbonate alkalinity on the gill structure of Amuride(Leuciscus waleckii)[J].Acta Hydrobiologica Sinica,2020,44(4):736-743.
[14] 窦新杰,常玉梅,唐然,孙效文,陶然,王楠,梁利群,张丽霞. 瓦氏雅罗鱼群体基于 COⅠ序列的遗传多样性分析[J].华北农学报,2014,29(S1):29-34. doi:10.7668/hbnxb.2014.S1.007.
Dou X J,Chang Y M,Tang R,Sun X W,Tao R,Wang N,Liang L Q,Zhang L X. Genetic diversity of Leuciscus waleckii populations based on COⅠSequence[J].Acta Agriculturae Boreali-Sinica,2014,29(S1):29-34.
[15] 王瑞芳,安晓萍,齐景伟,刘玉辉,翁美其,孟和平,柳玉海,罗旭光. 达里湖瓦氏雅罗鱼生殖洄游过程中能量代谢和消化酶活性的变化[J].中国水产科学,2019,26(4):703-712.doi:10.3724/SP.J.1118.2019.18109.
Wang R F,An X P,Qi J W,Liu Y H,Weng M Q,Meng H P,Liu Y H,Luo X G. Energy metabolism and digestive enzyme activity regulation in Amuride(Leuciscus waleckii)during spawning migration from Dali Nor Lake to Gongger River[J].Journal of Fishery Sciences of China,2019,26(4):703-712.
[16] 谭中林,邓思红,陈修松,徐大勇,何学福. 氯化钠浓度对鲈鲤精子活力的影响[J].渔业研究,2021,43(2):207-211. doi:10.14012/j.cnki.fjsc.2021.02.012.
Tan Z L,Deng S H,Chen X S,Xu D Y,He X F. Effects of NaCl concentration on Percocypris pingi spermatozoa vitality[J].Journal of Fisheries Research,2021,43(2):207-211.
[17] 王信海,姜爱兰,蔺玉华,吴学军. 不同盐度和碱度对卡拉白鱼精子活力和受精率的影响[J].江西农业学报,2020,32(5):93-98. doi:10.19386/j.cnki.jxnyxb.2020.05.17.
Wang X H,Jiang A L,Lin Y H,Wu X J. Effects of different salinity and alkalinity on sperm motility and fertilization rate of Chalcalburnus chalcoides aralensis[J].Acta Agriculturae Jiangxi,2020,32(5):93-98.
[18] 周杨浩,吴艳红,张平梅,周卫国,荣义峰,肖新平,李新丹,祁洪芳,史建全,杜浩. 人工模拟产卵环境中青海湖裸鲤的繁殖行为[J].水生生物学报,2021,45(5):1120-1128.
Zhou Y H,Wu Y H,Zhang P M,Zhou W G,Rong Y F,Xiao X P,Li X D,Qi H F,Shi J Q,Du H. Reproductive behaviors of Gymnocypris przewalskii in artificial mimic spawning environments[J].Acta Hydrobiologica Sinica,2021,45(5):1120-1128.
[19] 米博瀚,赵雪飞,高珊,常玉梅,孙博,罗亮,张立民,梁利群. 碱胁迫对瓦氏雅罗鱼AKP基因表达及生理应答的影响[J].农业生物技术学报,2020,28(6):105-112. doi:10.3969/j.issn.1674-7968.2020.06.011.
Mi B H,Zhao X F,Gao S,Chang Y M,Sun B,Luo L,Zhang L M,Liang L Q. Effects of alkaline stress on AKP gene expression and physiology response in Leuciscus waleckii[J].Journal of Agricultural Biotechnology,2020,28(6):105-112.
[20] 常玉梅,程磊,孙博,苏宝锋,梁利群,王维坤. 中国绥芬河三块鱼不同群体的种属划分及起源[J].中国水产科学,2018,25(4):811-818.doi:10.3724/SP.J.1118.2018.18056.
Chang Y M,Cheng L,Sun B,Su B F,Liang L Q,Wang W K. Species classification and origin of Tribolodon in the Suifen river,China[J].Journal of Fishery Sciences of China,2018,25(4):811-818.
[21] 闫浩,苏宝锋,常玉梅,孙博,尚梅,张立民,梁利群. 不同养殖条件下滩头雅罗鱼性腺发育的组织学研究及生长比较[J].生物学杂志,2017,34(5):47-52. doi:10.3969/j.issn.2095-1736.2017.05.047.
Yan H,Su B F,Chang Y M,Sun B,Shang M,Zhang L M,Liang L Q. Histological studies on the gonadal development and growth comparison of Tribolodon brandti in different culture conditions[J].Journal of Biology,2017,34(5):47-52.
[22] Morisawa S,Morisawa M. Induction of potential for sperm motility by bicarbonate and pH in rainbow trout and chum salmon[J].The Journal of Experimental Biology,1988,136:13-22.doi:10.2307/1548397.
[23] Tanaka S,Utoh T,Yamada Y,Horie N,Okamura A,Akazawa A,Mikawa N,Oka H P,Kurokura H. Role of sodium bicarbonate on the initiation of sperm motility in the Japanese eel[J].Fisheries Science,2004,70(5):780-787. doi:10.1111/j.1444-2906.2004.00871.x.
[24] Ogˇuz A R. Environmental regulation of mitochondria-rich cells in Chalcalburnus tarichi(Pallas,1811)during reproductive migration[J].The Journal of Membrane Biology,2013,246(3):183-188.doi:10.1007/s00232-012-9518-3.
[25] Wright P A,Iwama G K,Wood C M. Ammonia and urea excretion IN lahontan cutthroat trout(ONCORHYNCHUS clarki henshawi)adapted TO the highly alkaline pyramid lake(pH 9.4)[J].Journal of Experimental Biology,1993,175(1):153-172. doi:10.1242/jeb.175.1.153.
[26] Iwama G K,McGeer J C,Wright P A,Wilkie M P,Wood C M. Divalent cations enhance ammonia excretion in Lahontan cutthroat trout in highly alkaline water[J].Journal of Fish Biology,1997,50(5):1061-1073. doi:10.1111/j.1095-8649.1997.tb01630.x.
[27] Tanaka S,Zhang H,Yamada Y,Okamura A,Horie N,Utoh T,Mikawa N,Oka H P,Kurokura H. Inhibitory effect of sodium bicarbonate on the motility of sperm of Japanese eel[J].Journal of Fish Biology,2002,60(5):1134-1141. doi:10.1111/j.1095-8649.2002.tb01710.x.
[28] 李飞,万全. 环境因子对胭脂鱼精子活力影响的研究[J].淡水渔业,2009,39(4):22-28.doi:10.3969/j.issn.1000-6907.2009.04.004.
Li F,Wan Q. Study on the effects of environmental factors on sperm motility of Myxocyprinus asiaticus(Bleeker)[J].Freshwater Fisheries,2009,39(4):22-28.
[29] 王雨,杨建,耿龙武,张宇婷,姜海峰,徐伟. 4种鲤科鱼类精子特性及不同pH对其活力的影响[J].淡水渔业,2020,50(5):94-98.doi:10.13721/j.cnki.dsyy.2020.05.013.
Wang Y,Yang J,Geng L W,Zhang Y T,Jiang H F,Xu W. Sperm characteristics of four cyprinid fishes and the effect of pH on their motility[J].Freshwater Fisheries,2020,50(5):94-98.
[30] 张涛,李胜忠,牛建功,时春明,焦飞. Na+、K+、葡萄糖及甘油对高体雅罗鱼精子活力的影响[J].南方农业学报,2017,48(4):734-738.doi:10.3969/j.issn.2095-1191.2017.04.028.
Zhang T,Li S Z,Niu J G,Shi C M,Jiao F. Effects of Na+,K+,glucose and glycerinon on sperm motility of Leuciscus idus[J].Journal of Southern Agriculture,2017,48(4):734-738.
[31] Billard R,Cosson M P. Some problems related to the assessment of sperm motility in freshwater fish[J].Journal of Experimental Zoology,1992,261(2):122-131.doi:10.1002/jez.1402610203.
[32] 赵会宏,刘晓春,林浩然,刘付永忠,王云新. 斜带石斑鱼精子超微结构及盐度、温度、pH对精子活力及寿命的影响[J].中国水产科学,2003,10(4):286-292. doi:10.3321/j.issn:1005-8737.2003.04.005.
Zhao H H,Liu X C,Lin H R,Liu F,Wang Y X. Ultrastructure of spermatozoa and effects of salinity,temperature and pH on spermatozoa motility in Epiniphelus coioides[J].Journal of Fishery Sciences of China,2003,10(4):286-292.
[33] 刘鉴毅,黄晓荣,章龙珍,庄平,赵峰,张涛,冯广朋. 盐度、温度和pH对2种篮子鱼精子活性的影响[J].海洋渔业,2014,36(6):523-528.doi:10.13233/j.cnki.mar.fish.2014.06.007.
Liu J Y,Huang X R,Zhang L Z,Zhuang P,Zhao F,Zhang T,Feng G P. Effects of salinity,temperature and pH on spermatozoa motility in two kinds of rabbitfish[J].Marine Fisheries,2014,36(6):523-528.
[34] Baynes S M,Scott A P,Dawson A P. Rainbow trout,Salmo gairdnerii Richardson,spermatozoa:Effects of cations and pH on motility[J].Journal of Fish Biology,1981,19(3):259-267.doi:10.1111/j.1095-8649.1981.tb05830.x.
[35] Marshall W S,Bryson S E,Idler D R. Gonadotropin action on brook trout sperm duct epithelium:Ion transport stimulation mediated by cAMP and Ca2+[J].General and Comparative Endocrinology,1993,90(2):232-242.doi:10.1006/gcen.1993.1078.
[36] 徐伟,耿龙武,李池陶,金国雄,刘晓勇. 大鳞鲃的人工繁殖、胚胎发育和耐盐碱测定[J].水产学报,2011,35(2):255-260.doi:10.3724/SP.J.1231.2011.17088.
Xu W,Geng L W,Li C T,Jin G X,Liu X Y. The artificial propagation,embryonic development and saline-alkali tolerant experiment of Barbus capito[J].Journal of Fisheries of China,2011,35(2):255-260.
