小麦是我国的主要粮食作物,河南省是我国小麦主产区,随着我国人口不断增加和人们生活水平的提高,对小麦产量和品质的要求也越来越高[1]。但高盐等非生物胁迫以及病害等生物胁迫对小麦产量产生了极大的影响[2]。同时,化学肥料过量使用等造成的土壤环境恶化也成为影响小麦产量的一大因素。在我国农业发展进程中,化肥的使用虽然能迅速提高作物的产量,但是多年来化肥的大量使用,出现了一些副作用,化肥在田间的利用率不高,一部分挥发到大气中造成了空气污染,一部分在土壤中出现了硝酸盐积累与淋洗的现象,同时一些重金属元素残留在土壤中造成土壤板结,另外,过量的化学肥料的使用加速了土壤酸化,使土壤养分失衡,进而影响了作物产量[3]。这些都直接影响我国农业的可持续发展。2021年中央一号文件明确指出,“推进农业绿色发展。持续推进化肥农药减量增效”。因此,具有提高植物抗性、改善土壤生态环境等功能的微生物肥料可以有效推进化肥农药减量增效,在当前及未来农业生产中具有重要的生态和社会意义。
木霉菌(Trichoderma spp.)作为重要的生防真菌,具有促进植物生长、提高植物抗逆性、改善土壤环境、增加作物产量和改良作物品质等功能,目前已被应用于微生物肥料和菌剂的开发中[4]。Huang等[5]分离到了具有抑制立枯丝核菌(Rhizoctonia solani)的哈茨木霉(Trichoderma harzianum)SQR-T37,该菌株制成的生物菌肥对黄瓜立枯病的防效达到了81.82%。Wang等[6]发现绿色木霉(Trichoderma viride)菌肥减少了土壤中铵(NH3)的挥发,提高了甜高粱对肥料中氮元素的利用率。Liu等[7]在辣椒(Capsicum annuum L.)生产上施用了含有贵州木霉(Trichoderma guizhouense)的生物菌肥,与化肥相比木霉菌肥的使用提高了土壤脲酶和过氧化物酶的活性,木霉菌肥促进了辣椒对养分的吸收进而提高了辣椒的产量。在我国农业生产中微生物肥料已经被越来越多的农业工作者认可并应用于农业生产中,绿色无污染的微生物肥料将成为我国农业可持续性发展的有效手段。
本研究通过施用木霉菌肥代替30%化肥与传统施用化肥相比较,分析盐胁迫条件下木霉菌肥对小麦的生长、抗病性以及产量和品质的影响,同时测定施用木霉菌肥后土壤酶活性的变化,从而明确木霉菌肥对小麦生长和土壤环境的影响,可为微生物菌肥应用于小麦安全生产奠定基础,并为木霉菌肥在农业生产上的应用提供理论依据。
1 材料和方法
1.1 试验田概况
试验于2016-2019年在河南省周口师范学院试验田(33°6′N,114°6′E)中进行,年平均降水量874.6 mm,年平均气温16.7 °C,该区为温带季风气候,试验田为黄土田块,试验始于2016年,土壤耕层(0~20 cm),基本理化性质为:pH值8.18,有机质0.18%,铵态氮6.14 mg/kg,速效磷23.36 mg/kg,速效钾202.51 mg/kg。
1.2 试验材料
供试小麦(Triticum aestivum)品种为西农979,购自周口市农资市场,供试哈茨木霉(Trichoderma harzianum T-aloe)为周口师范学院张福丽课题组分离保藏,GenBank号为KC753766。供试小麦赤霉病病原菌菌株为禾谷镰刀菌(Fusarium graminearum)PH-1由周口师范学院罗奇博士赠送。
1.3 试验设计
本试验共设置2个处理,每个处理3个重复,分别为1.125 kg木霉菌肥+262.5 g化肥(70%)处理(T);375 g化肥处理(C)。每个重复小区面积为1.0 m×5.0 m = 5.0 m2。采用沟施的方法将肥料施用在田中,先将小麦种子均匀地洒在田垄中(2016年10月17日播种),覆盖一层土,然后将肥料施在距离种子约10 cm的位置。试验田为小麦玉米轮作,玉米收获后,2017年10月15日播种小麦,施肥方式与上一年相同。2018年10月21日播种小麦,施肥方式与2016年相同。2018年11月25日用200 mmol/L的NaCl溶液浇灌小麦,NaCl处理后7 d测定叶片生理指标,2018年12月19日测定小麦生长指标。2019年4月15日在小麦扬花期时接种赤霉病菌,3 d后喷洒木霉孢子悬液,对照用PD培养基喷洒。在小麦生长1个月后统计小麦发病情况,在小麦收获后统计小麦千粒质量。2019年小麦灌浆期(2019年5月20日)收集不同施肥下小麦根际和非根际的土壤,测定土壤酶活性。
1.4 试验方法与指标测定
1.4.1 小麦种植 每小区播种小麦种子200 g,菌肥的制用参照Zhang等[8]的方法,化肥(N=15%,P2O5=12%,K2O=8%,湖北省黄麦岭磷化工有限责任公司)购于周口市农资市场。
1.4.2 木霉孢子悬液制备 -80 ℃保存的木霉菌1 mL接种到200 mL马铃薯葡萄糖液体培养基,180 r/min、28 ℃培养4 d,6层纱布过滤制备3×107个孢子/mL木霉孢子悬浮液。10 mL含有3×107个孢子/mL木霉孢子的悬浮液接种到500 mL马铃薯葡萄糖液体培养基,180 r/min、28 ℃培养7 d后用6层纱布过滤后备用。
1.4.3 生长指标和生理指标测定 通过测定小麦的株高、根长、根数、生物量(鲜质量和干质量)以及含水量分析盐胁迫下木霉菌肥对小麦生长的影响。
小麦叶片PAL活性的测定参照梁郸娜[9]等的方法进行测定;采用丙酮法对叶绿素含量进行测定[10];丙二醛(MDA)含量测定采用硫代巴比妥酸法[11];过氧化氢(H2O2)含量采用硫酸钛法进行测定[12]。
1.4.4 病原菌接种、防效分析与小麦产量评估 在小麦扬花期傍晚喷洒病原菌孢子液(2×106个孢子/mL)以接种病原菌,1个月后,采用五点取样法,每小区分5点统计,每点统计100个麦穗,按0~7级病情统计,计算病穗率、病情指数和防效[13]。小麦成熟收获后测量每小区小麦的千粒质量。
1.4.5 土壤酶活性测定 采用苯酚钠-次氯酸钠比色法测定土壤脲酶的活性[14];采用3,5-二硝基水杨酸比色法测定土壤蔗糖酶活性[15];采用TTC(氯化三苯基四氮唑)法测定土壤脱氢酶活性[16];采用高锰酸钾滴定法测定土壤过氧化氢酶活性[17];采用邻苯三酚比色法测定土壤过氧化物酶和多酚氧化酶活性[15]。
1.5 数据分析
采用Excel 2016 处理试验中的数据,采用IBM SPSS 25.0独立样本t检验方法进行显著性差异分析。
2 结果与分析
2.1 盐胁迫条件下木霉菌肥对小麦生长的影响
盐胁迫条件下木霉菌肥对小麦生长指标、生物量和含水量的影响如图1所示。施用木霉菌肥的小麦明显较为粗壮(图1-A),与施用化肥的小麦相比,株高提高了10.91%,根长增长了43.45%,根数增加了42.86%(图1-B)。施用木霉菌肥小麦植株的鲜质量、干质量(图1-C)和含水量(图1-D)分别为施用化肥小麦的2.92,1.95,1.17倍。以上结果说明,木霉菌肥的施用与化肥相比促进了小麦植株和根系的生长并提高了小麦的含水量。
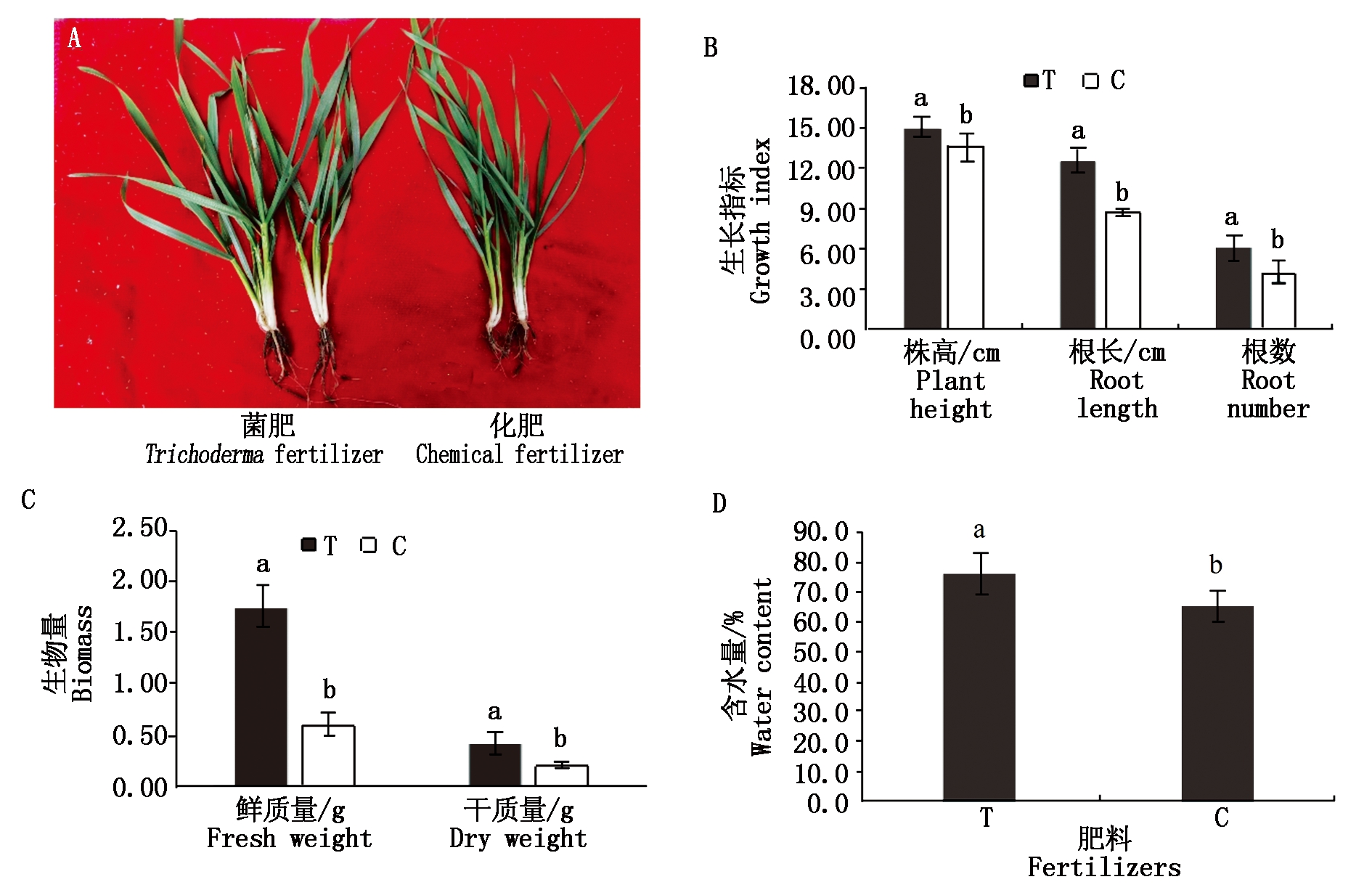
图中柱形图上的不同字母表示根据独立样本t检验与化肥(C)相比有显著性差异(P<0.05)。T.木霉菌肥;C.化学肥料。图2-5同。
Different letters on the column indicate significant difference(P<0.05) compared with chemical fertilizer (C)
according to the Independent-Samples t-test.T.Trichoderma fertilizer;C.Chemical fertilizer.The same as Fig.2-5.
图1 盐胁迫条件下木霉菌肥对小麦生长的影响
Fig.1 Effects of Trichoderma fertilizer on wheat growth under salt stress
2.2 盐胁迫条件下木霉菌肥对小麦生理指标的影响
小麦经NaCl处理后,体内的PAL活性、叶绿素含量、MDA含量和H2O2含量(以鲜质量计)在第0和7天的变化见图2。非盐胁迫条件下,施用木霉菌肥小麦的PAL活性比施用化肥的小麦高0.5%;盐胁迫条件下,施用2种肥料的小麦体内的PAL活性均明显下降,但7 d后木霉处理的比化肥处理的高15.8%(图2-A)。无论盐胁迫与否,木霉菌肥的施用都增加了小麦叶片的叶绿素含量,非盐胁迫条件下施用木霉菌肥小麦叶片叶绿素含量比施用化肥小麦高105.9%,盐胁迫条件下比化肥处理的高13.23%(图2-B)。非盐胁迫条件下,施用木霉菌肥小麦叶片MDA含量比施用化肥小麦低52.39%,盐胁迫条件下,施用2种肥料的小麦叶片内的MDA含量均有所升高,施用木霉菌肥的小麦比化肥处理低40.39%(图2-C)。盐胁迫前施用木霉菌肥小麦叶片H2O2含量比施用化肥小麦低21.83%,在盐胁迫后,施用2种肥料的小麦叶片内的H2O2含量均有所升高,施用木霉菌肥的小麦比化肥处理低12.22%(图2-D)。以上结果说明木霉菌肥通过提高抗氧化酶活性和叶绿素含量减轻了H2O2积累,从而减轻了盐胁迫造成的氧化伤害对小麦细胞的损伤。
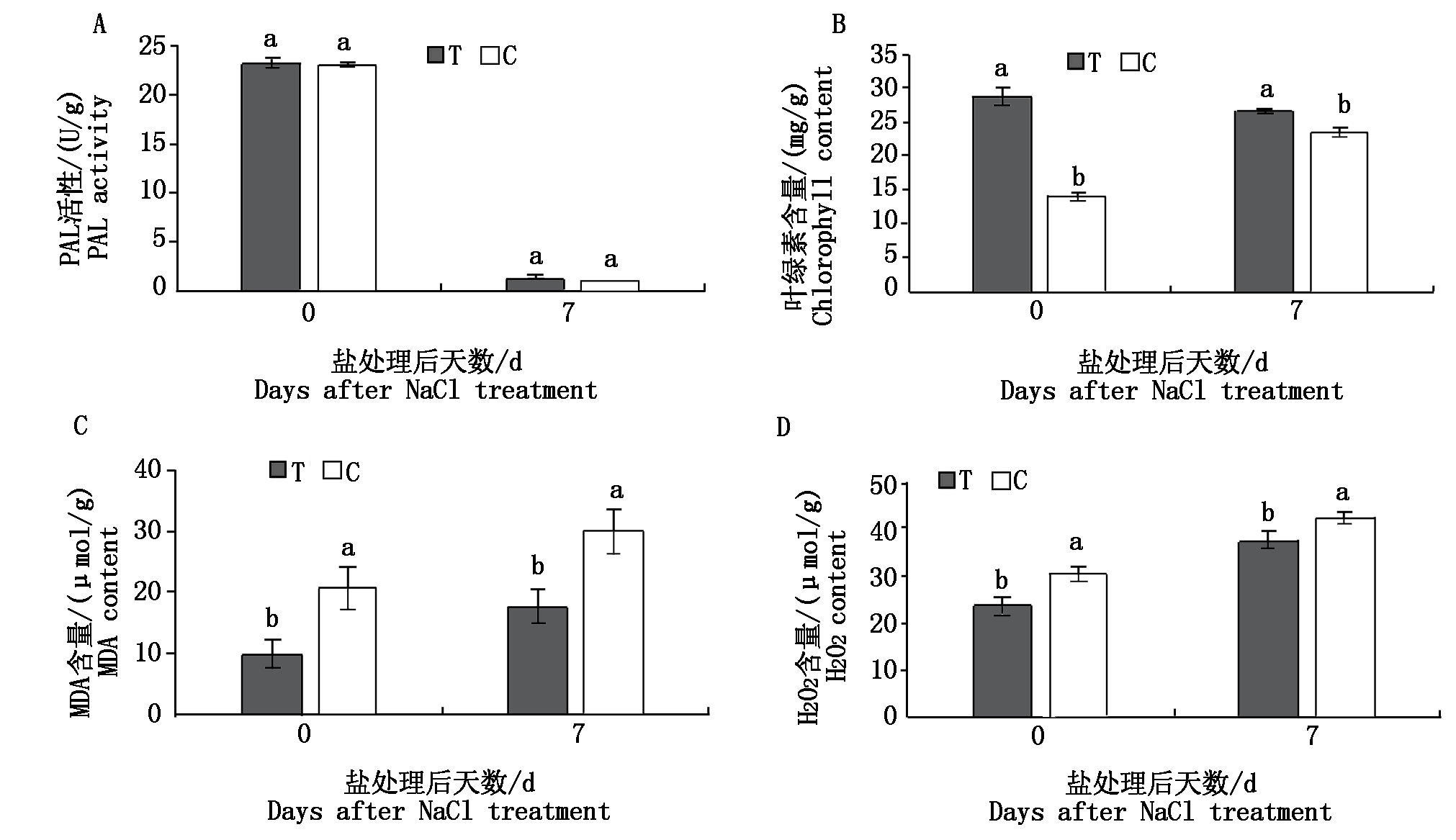
图2 盐胁迫条件下木霉菌肥对小麦生理特性的影响
Fig.2 Effects of Trichoderma fertilizer on wheat physiological characteristics under salt stress
2.3 盐胁迫条件下木霉菌肥对小麦赤霉病的防效分析
盐胁迫条件下,木霉菌肥明显减轻了小麦赤霉病的发生(图3-A-B),发病率和病情指数均有显著减少(图3-C-D)。施用木霉菌肥小麦的病穗率比施用化肥的减少80.54%,病情指数比施用化肥的低88.38%。由此得出,木霉菌肥对小麦赤霉病的防效为88.36%。以上结果说明木霉菌肥的施用能起到对小麦赤霉病的生防作用,降低小麦赤霉病的发病率。

A.施用木霉菌肥小麦发病情况;B.施用化肥小麦发病情况。图4-5同。
A.Disease incidence of wheat treated with Trichoderma fertilizer;B.Disease incidence of wheat treated with chemical fertilizer.The same as Fig.4-5.
图3 盐胁迫条件下木霉菌肥对小麦赤霉病的生防作用
Fig.3 Bio-control of Trichoderma fertilizer on Fusarium head blight under salt stress
2.4 盐胁迫条件下木霉菌肥对小麦籽粒大小的影响
盐胁迫条件下,施用木霉菌肥与化肥的小麦籽粒生长情况见图4。木霉菌肥增加了小麦籽粒宽度,但是籽粒长度无明显变化,并且施用木霉菌肥的小麦籽粒较饱满(图4-A)。施用木霉菌肥的小麦千粒质量为58.08 g,施用化肥的小麦千粒质量为53.06 g,增幅为9.5%(图4-B)。结果表明,盐胁迫条件下木霉菌肥的施用能够增加小麦产量和提升小麦品质。

图4 盐胁迫条件下木霉菌肥对小麦千粒质量的影响
Fig.4 Effect of Trichoderma fertilizer on wheat thousand seeds weight under salt stress
2.5 盐胁迫条件下木霉菌肥对土壤酶活性的影响
盐胁迫条件下,木霉菌肥对小麦非根际与根际土壤酶活性的影响如图5所示。施用木霉菌肥的小麦非根际土壤脲酶、蔗糖酶、脱氢酶、过氧化氢酶和过氧化物酶均显著高于施用化肥的土壤,分别比对照提高了833.3%,628.78%,189.47%,13.21%,12.9%,而多酚氧化酶在二者之间没有出现显著差异(P<0.05)。盐胁迫条件下,施用木霉菌肥小麦根际土壤的脲酶、蔗糖酶、脱氢酶、过氧化氢酶、过氧化物酶和多酚氧化酶活性与化肥相比分别提高了176.2%,139.07%,100.00%,22.06%,10.34%,18.52%。综上可知,木霉菌肥的施用可以提高土壤酶的活性,具有改善土壤生态环境的功能。

图5 盐胁迫条件下木霉菌肥对土壤酶活性的影响
Fig.5 Effect of Trichoderma fertilizer on soil enzyme activity under salt stress
3 结论与讨论
在本研究中,木霉菌肥的施用与化肥相比促进了小麦株高、根长和根数的增长,增加了小麦的生物量和含水量,表明木霉菌肥能够作为生长调节剂促进小麦的生长。木霉在发挥促生长作用的同时往往还发挥着提高植物抗逆性的功能[18]。因此,本试验用200 mmol/L NaCl溶液处理2种不同施肥的小麦,来分析木霉菌肥与化肥对小麦应对盐胁迫的影响。结果表明,在盐胁迫下,木霉菌肥的施用与化肥相比,小麦叶片内的PAL活性和叶绿素含量增加,MDA含量与H2O2含量降低。盐胁迫会导致植物失水或细胞渗透压增强,在应对盐胁迫时,植物通过调控体内生理生化变化、激素水平和基因响应等产生防御反应[19]。苯丙氨酸解氨酶(PAL)参与植物苯丙烷类代谢途径,是该途径的关键酶,苯丙烷类代谢途径的产物包括木质素、类黄酮色素和植物抗毒素等[20-21],在增强植物细胞壁的机械强度、消除氧自由基、水分运输中具有积极作用[22]。叶绿体是植物进行光合作用的细胞器,盐胁迫下,植物的气孔关闭以保存自身水分,气孔关闭后植物体光合作用减弱[23]。叶绿体同时也是产生活性氧(ROS)的主要细胞器,光合作用减弱会使ROS大量积累,植物的抗氧化能力下降,导致膜脂过氧化,最终对植物细胞造成损伤[24]。因此,植物叶片叶绿素含量能反映植物受胁迫的程度。H2O2是活性氧的一种,盐胁迫下,植物叶片内的过氧化氢含量与植物细胞受损伤程度呈正相关[25]。丙二醛是植物在逆境胁迫下膜脂过氧化的产物,抑制细胞膜蛋白质的合成、抑制植物的光合作用和呼吸作用,损伤植物细胞膜[26-27]。本研究结果说明,木霉菌肥的施用可以通过调节植物木质素的合成、增强光合作用、清除过氧化氢和降低植物细胞内的渗透胁迫物质来提高植物的抗盐性,进而减少盐胁迫对小麦造成的损伤。
小麦赤霉病是小麦的重要病害,盐胁迫条件下为验证木霉菌肥是否能够提高小麦的抗病性,本研究在小麦扬花期时接种禾谷镰刀菌,统计小麦病穗数、病情指数和防效,分析木霉菌肥对小麦抗病性的影响。结果表明,施用木霉菌肥后小麦赤霉病的病情指数显著低于化肥,表明木霉菌肥具有提高小麦抗病性的功能。进一步的研究结果表明,木霉菌肥的施用增大了小麦籽粒的宽度,小麦籽粒更加饱满,千粒质量增加了9.5%。表明木霉菌肥可以提高小麦产量和提升小麦品质。
土壤环境的健康对作物的生长具有重要的作用,土壤酶是表征土壤肥力的指标之一[28]。本研究测定了施用木霉菌肥后小麦非根际与根际土的脲酶、蔗糖酶、脱氢酶、过氧化氢酶、过氧化物酶和多酚氧化酶的活性。施用木霉菌肥后非根际(多酚氧化酶除外)与根际土壤酶活性均显著高于施用化肥的土壤酶活性。土壤脲酶水解尿素生成氨、二氧化碳和水,是土壤供氮能力的一个重要指标[29]。土壤蔗糖酶水解土壤中不可溶的蔗糖供植物吸收,为植物提供营养[30]。土壤脱氢酶是存在于土壤微生物体内的一种酶,通过将土壤有机质矿化为土壤微生物的呼吸途径传递能量,脱氢酶往往与土壤中微生物的丰度有关[31]。土壤过氧化氢酶将土壤中具有毒性的过氧化氢分解为水和氧气,减轻过氧化氢对植物的毒害作用[32]。土壤多酚氧化酶可将具有毒性的酚类物质转化为醌类,过氧化物酶可将过氧化氢转化为醌类[33]。因此,本研究结果表明,木霉菌肥的施用提高了土壤酶的活性,可以有效改善土壤生态环境。本研究结果表明,无论添加木霉菌肥还是单独施用化肥,非根际土的土壤酶活性均高于根际土土壤酶活性。本研究结果与高岩等[34]研究结果相同,高岩等大棚种植番茄的非根际土磷酸酶、脱氢酶、脲酶和蔗糖酶活性均高于根际土土壤酶活性。出现这种现象的原因可能与本研究施用肥料方式有关,本研究未直接将肥料施用于小麦根部,而是在距离小麦10 cm位置采用沟施的方式施肥,因此,导致非根际土壤酶活力高于根际土壤酶活力。另外,进行盐胁迫处理时本研究采用NaCl溶液直接浇灌小麦根部的方法,盐胁迫也可能影响了小麦根际土壤酶的活性。
综上所述,木霉菌肥在减少施用化肥30%的情况下,与单纯使用化肥相比,具有较好的促进小麦植株和根系生长、提高小麦抗盐性和抗病性、提高小麦产量和改善土壤生态环境等功能,将对我国农业绿色、可持续发展产生积极的促进作用。
[1] Qin X L,Zhang F X,Liu C,Yu H,Cao B G,Tian S Q,Liao Y C,Siddique K H M.Wheat yield improvements in China:Past trends and future directions[J].Field Crops Research,2015,177:117-124.doi:10.1016/j.fcr.2015.03.013.
[2] Zampieri M,Ceglar A,Dentener F,Toreti A.Wheat yield loss attributable to heat waves,drought and water excess at the global,national and subnational scales[J].Environmental Research Letters,2017,12(6):064008.doi:10.1088/1748-9326/aa723b.
[3] Yadav R,Ror P,Rathore P,Ramakrishna W.Bacteria from native soil in combination with arbuscular mycorrhizal fungi augment wheat yield and biofortification[J].Plant Physiology and Biochemistry,2020,150:222-233.doi:10.1016/j.plaphy.2020.02.039.
[4] Woo S L,Ruocco M,Vinale F,Nigro M,Marra R,Lombardi N,Pascale A,Lanzuise S,Manganiello G,Lorito M.Trichoderma-based products and their widespread use in agriculture[J].The Open Mycology Journal,2014,8 (1):71-126.doi:10.2174/1874437001408010071.
[5] Huang X Q,Chen L H,Ran W,Shen Q R,Yang X M.Trichoderma harzianum strain SQR-T37 and its bio-organic fertilizer could control Rhizoctonia solani damping-off disease in cucumber seedlings mainly by the mycoparasitism[J].Applied Microbiology and Biotechnology,2011,91 (3):741-755.doi:10.1007/s00253-011-3259-6.
[6] Wang X,Xu S J,Wu S H,Feng S G,Bai Z H,Zhuang G Q,Zhuang X L.Effect of Trichoderma viride biofertilizer on ammonia volatilization from an alkaline soil in Northern China[J].Journal of Environmental Sciences,2018,66:199-207.doi:10.1016/j.jes.2017.05.016.
[7] Liu Q M,Meng X H,Li T,Raza W,Liu D Y,Shen Q R.The growth promotion of peppers (Capsicum annuum L.) by Trichoderma guizhouense NJAU4742-based biological organic fertilizer:Possible role of increasing nutrient availabilities[J].Microorganisms,2020,8 (9):1296.doi:10.3390/microorganisms8091296.
[8] Zhang F L,Dou K,Liu C,Chen F J,Wu W W,Yang T W,Li L L,Liu T X,Yu L J.The application potential of Trichoderma T-soybean containing 1-aminocyclopropane-1-carboxylate for maize production[J].Physiological and Molecular Plant Pathology,2020,110:101475.doi:10.1016/j.pmpp.2020.101475.
[9] 梁郸娜,胡其靖,曹磊,宋琳琳,徐强,齐晓花,周福才,陈学好.蚜虫侵染对黄瓜叶片中丙二醛含量及保护酶活性的影响[J].江苏农业学报,2016,32(2):278-284.doi:10.3969/j.issn.1000-4440.2016.02.007.
Liang D N,Hu Q J,Cao L,Song L L,Xu Q,Qi X H,Zhou F C,Chen X H.Effects of aphid (Aphis gossypii Glover)infestation on MDA content and protective enzymes activities in cucumber[J]. Jiangsu Journal of Agricultural Sciences,2016,32 (2):278-284.
[10] 何启平,陈莹.校园常见植物叶绿素提取方法比较及其含量测定[J].黑龙江农业科学,2015 (10):117-120.doi:10.11942/j.issn1002-2767.2015.10.0117.
He Q P,Chen Y.Comparison on different extraction techniques about chlorophyll and determination of chlorophyll content of common plants in campus[J].Heilongjiang Agricultural Sciences,2015 (10):117-120.
[11] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:210-217.
Gao J F.Plant physiology experimental guidance[M].Beijing:Higher Education Press,2006:210-217.
[12] 刘萍,李明军.植物生理学实验[M].北京:科学出版社,2018:139-140.
Liu P,Li M J.Plant physiology experiment[M].Beijing:Science Press,2018:139-140.
[13] 中华人民共和国农业部.农药田间药效试验准则 第15部分:杀菌剂防治小麦赤霉病:NY/T 1464.15-2007[S].北京:农业出版社,2008.
Institute of Pesticide Control,Ministry of Agriculture,PRC.NY/T 1464.15-2007 Guidelines on efficacy evaluation of pesticides Part 15:Fungicides against fusarium head blight of wheat[S].Beijing:China Agriculture Press,2008.
[14] 丰骁,段建平,蒲小鹏,邹雨,李春荣.土壤脲酶活性两种测定方法的比较[J].草原与草坪,2008 (2):70-72.doi:10.3969/j.issn.1009-5500.2008.02.015.
Feng X,Duan J P,Pu X P,Zou Y,Li C R.Comparative analyses between two methods of measuring soil urease activity[J]. Grassland and Turf,2008 (2):70-72.
[15] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:41-60.
Guan S Y.Soil enzymes and their research methods[M].Beijing:Agriculture Press,1986:41-60.
[16] 戴濡伊,吴季荣,徐剑宏,俞明正,史建荣.小麦根际土壤脱氢酶活性测定方法的改进[J].江苏农业学报,2013,29 (4):772-776.doi:10.3969/j.issn.1000-4440.2013.04.014.
Dai R Y,Wu J R,Xu J H,Yu M Z,Shi J R.Improvement of determination dehydrogenase activity in wheat rhizospheric soil[J].Jiangsu Journal of Agricultural Sciences,2013,29 (4):772-776.
[17] 路鹏鹏,陈锐,孙晓宇,赵玲侠,瞿佳,沈卫荣.枝顶孢霉制剂防治根结线虫过程中土壤酶活性和微生物数量的变化[J].江苏农业科学,2017,45 (6):277-280.doi:10.15889/j.issn.1002-1302.2017.06.071.
Lu P P,Chen R,Sun X Y,Zhao L X,Qu J,Shen W R.Changes of soil enzyme activities and microbial numbers during the control of root-knot nematode by acremonium preparation[J].Jiangsu Journal of Agricultural Sciences,2017,45 (6):277-280.
[18] Hermosa R,Rubio M B,Cardoza R E,Nicol s C,Monte E,Gutiérrez S.The contribution of Trichoderma to balancing the costs of plant growth and defense[J].International Microbiolog,2013,16 (2):69-80.doi:10.2436/20.1501.01.181.
s C,Monte E,Gutiérrez S.The contribution of Trichoderma to balancing the costs of plant growth and defense[J].International Microbiolog,2013,16 (2):69-80.doi:10.2436/20.1501.01.181.
[19] Hirayama T,Shinozaki K.Research on plant abiotic stress responses in the post-genome era:Past,present and future[J].The Plant Journal,2010,61(6):1041-1052.doi:10.1111/j.1365-313X.2010.04124.x.
[20] Khan W,Prithiviraj B,Smith D L.Chitosan and chitin oligomers increase phenylalanine ammonia-lyase and tyrosine ammonia-lyase activities in soybean leaves[J]. Journal of Plant Physiology,2003,160 (8):859-863.doi:10.1078/0176-1617-00905.
[21] Liang X W,Dron M,Cramer C L,Dixon R A,Lamb C J.Differential regulation of phenylalanine ammonia-lyase genes during plant development and by environmental cues[J].Journal of Biological Chemistry,1989,264 (24):14486-14492.doi:10.1016/S0021-9258(18)71704-3.
[22] 王星,罗双霞,于萍,罗蕾,赵建军,王彦华,申书兴,陈雪平.茄科蔬菜苯丙烷类代谢及相关酶基因研究进展[J].园艺学报,2017,44(9):1738-1748.doi:10.16420/j.issn.0513-353x.2017-0499.
Wang X,Luo S X,Yu P,Luo L,Zhao J J,Wang Y H,Shen S X,Chen X P.Advances in phenylaprapanoid metabolism and its enzyme genes in Solanaceae vegetables[J].Acta Horticulturae Sinica,2017,44 (9):1738-1748.
[23] 郭倩倩,周文彬.植物响应联合胁迫机制的研究进展[J].植物学报,2019,54 (5):662-672.
Guo Q Q,Zhou W B.Advances in the mechanism underlying plant response to stress combination[J].Chinese Bulletin of Botany,2019,54 (5):662-672.
[24] Zhou Y,Diao M,Cui J X,Chen X J,Wen Z L,Zhang J W,Liu H Y.Exogenous GSH protects tomatoes against salt stress by modulating photosystem Ⅱ efficiency,absorbed light allocation and H2O2-scavenging system in chloroplasts[J].Journal of Integrative Agriculture,2018,17 (10):2257-2272.doi:10.1016/S2095-3119(18)62068-4.
[25] Formentin E,Sudiro C,Ronci M B,Locato V,Barizza E,Stevanato P,Ijaz B,Zottini M,De Gara L,Lo Schiavo F.H2O2 signature and innate antioxidative profile make the difference between sensitivity and tolerance to salt in rice cells[J].Frontiers in Plant Science,2018,9:1549.doi:10.3389/fpls.2018.01549.
[26] 杨婷.膜脂过氧化对植物细胞的伤害[J].科技与创新,2018 (8):61-62.doi:10.15913/j.cnki.kjycx.2018.08.061.
Yang T.Damage of membrane lipid peroxidation to plant cells[J].Science and Technology & Innovation,2018 (8):61-62.
[27] Rajabi-Khamseh S,Danesh-Shahraki A,Rafieiolhossaini M.Stress tolerance in flax plants inoculated with Bacillus and Azotobacter species under deficit irrigation[J].Physiologia Plantarum,2020,170(2):269-279.doi:10.1111/ppl.13154.
[28] 孙运杰,马海林,刘方春,孙蕾,王君,刘春生.生物肥对蓝莓根际土壤微生物学特性及土壤肥力的影响[J].水土保持学报,2015,29(3):167-171,177.doi:10.13870/j.cnki.stbcxb.2015.03.031.
Sun Y J,Ma H L,Liu F C,Sun L,Wang J,Liu C S.Effects of bio-fertilizer on microbial properties and soil fertility in blueberry rhizosphere soil[J].Journal of Soil and Water Conservation,2015,29 (3):167-171,177.
[29] Fisher K A,Yarwood S A,James B R.Soil urease activity and bacterial ureC gene copy numbers:Effect of pH[J].Geoderma,2017,285:1-8.doi:10.1016/j.geoderma.2016.09.012.
[30] 田晓燕,陆冠茹,高楠,杨锦媚,于君宝,韩广轩,管博.重度盐渍化湿地土壤酶活性对生物炭添加及浅翻处理的响应[J].土壤通报,2020,51 (5):1189-1195.doi:10.19336/j.cnki.trtb.2020.05.24.
Tian X Y,Lu G R,Gao N,Yang J M,Yu J B,Han G X,Guan B.Effect of biochar addition and ploughing on soil enzyme activities in heavily degraded saline wetland[J].Chinese Journal of Soil Science,2020,51 (5):1189-1195.
[31] Filipovic′ L,Romic′ M,Sikora S,Huic′ Babic′ K,Filipovic′ V,Gerke H H,Romic′ D.Response of soil dehydrogenase activity to salinity and cadmium species[J].Journal of Soil Science and Plant Nutrition,2020,20(2):530-536.doi:10.1007/s42729-019-00140-w.
[32] 卢越,张健琳,杨兰芳.不同作物生长和施肥对土壤酶活性的影响[J].环境生态学,2019,1 (6):81-85,90.
Lu Y,Zhang J L,Yang L F.Effects of growing crops and fertilization on soil enzyme activities[J].Environmental Ecology,2019,1 (6):81-85,90.
[33] 陶波,蒋凌雪,沈晓峰,栾凤侠,邱丽娟.抗草甘膦转基因大豆对根际和非根际土壤酶活性的影响[J].作物杂志,2011(1):45-49.doi:10.16035/j.issn.1001-7283.2011.01.016.
Tao B,Jiang L X,Shen X F,Luan F X,Qiu L J.Effects of genetic modified glyphosate resistant soybean on soil enzymes activities in rhizosphere and non-rhizosphere[J].Crops,2011(1):45-49.
[34] 高岩,曾路生,李俊良,陈清.优化施肥对设施番茄根际与非根际土壤养分及酶活性的影响[J].华北农学报,2013,28(S1):347-352.doi:10.7668/hbnxb.2013.S1.065.
Gao Y,Zeng L S,Li J L,Chen Q.Effect of optimized fertilization on soil nutrient and enzyme activity in tomato rhizosphere and non rhizosphere in greenhouse field[J].Acta Agriculturae Boreali-Sinica,2013,28(S1):347-352.
