来源于细菌的抗菌肽也被称为细菌素(Bacteriocin)。细菌素是由某些细菌在代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的多肽或前体多肽,通常细菌素都是一些阳离子肽,具有疏水性或两亲性 [1-2]。已有的研究表明,细菌素在食品和医药领域有开发和应用,除抗菌特性外还有抗病毒、抗肿瘤和抗生物膜(Antibiofilm)特性,甚至利用一些新材料可以增强其功能[3-4]。
具有抑菌活性的羊毛硫肽被称为羊毛硫细菌素(Lantibiotics),其抑菌谱较广,特别是对一些耐药性菌株,有较强的抑菌作用。因其不易产生抗药性,且可用于抗感染治疗和食品的防腐,所以对其开发利用具有较好的前景。最近几年,不断有新的羊毛硫细菌素被发现,如分离自一种类芽孢杆菌(Paenibacillus sp)的CMB001对革兰氏阳性菌和部分阴性菌有抑菌活性[5-6];有研究者经基因挖掘,从放线菌玫瑰孢链霉菌(Streptomyces roseosporus NRRL 11379)中推测出一个双组分羊毛硫细菌素(Roseocin)的基因簇,大肠杆菌中表达该基因簇相关基因,获得了有抗菌活性的roseocin[7]。此外,还可以通过现有的技术改造羊毛硫细菌素的结构来达到提高羊毛硫细菌素的抗菌活性和抗菌谱,如对Nisin和Mutacin 1140的分子改造[ 8-12 ]。
枯草芽孢杆菌(Bacillus subtilis)是一种革兰氏阳性菌,存在于土壤及动物胃肠道内。枯草芽孢杆菌的芽孢能够通过胃肠道屏障,短暂定植在胃肠道内。因其不具毒性及抗生素抗性,因此常作为较安全的益生菌用于肠道紊乱的防治。该菌能通过抑制多种致病菌的生长,维持人和动物胃肠道的微生态平衡[13]。此外,枯草芽孢杆菌的应用是多方面的,可以在家畜家禽养殖、土壤改良、有害物的降解中起作用[14-17]。
枯草芽孢杆菌能分泌多种低分子量的抗菌肽和细菌素类的抗菌活性物质,如抗菌肽SubtilosinA、Subtilin、表面活性素和伊枯草菌素等而抑制细菌的生长[18-19]。TasA是芽孢蛋白,大小为31 ku,是伴随着芽孢的形成而分泌的,与生物膜形成有关。TasA操纵子[19-20]包括基因yqxM-sipW-tasA,其中基因tasA编码TasA,基因yqxM 功能未知,sipW 与TasA的分泌、进入芽孢以及脱去N 末端的27个氨基酸有关。Subtilin是由32个氨基酸组成的含有5个环的羊毛硫细菌素,与Subtilin合成有关的基因由spa 操纵子调控[21-23]。Sublancin最早发现于B. subtilis 168中,因此被命名为Sublancin 168。从结构上看,Sublancin包含着一个β-甲基羊毛硫氨基酸桥和2个二硫键(由4个半胱氨酸形成)。在枯草芽孢杆菌168中,Sublancin操纵子包括sunA、sunT、bdbA、yolJ和bdbB基因[24]。在几种枯草芽孢杆菌菌株中,均发现了Subtilosin A,其三维结构已被测定。Subtilosin A 首先由35个氨基酸组成的大环,并通过3个硫醚键(存在于半胱氨酸上的硫原子分别与2个苯丙氨酸和一个苏氨酸上的A碳原子之间)将环分成4个小环。在枯草芽孢杆菌168中,与Subtilosin A 合成有关的是sbo-alb基因簇[25-26],包含8个基因:sbo、albA、albB、albC、albD、albE、albF和albG。其实枯草芽孢杆菌中可以产生多种抗菌肽,但分别来自不同的菌株。
羊毛硫细菌素Subtilomycin最初在枯草芽孢杆菌Strain MMA7上发现,该菌株分离自海绵 Haliclona simulans中[27],后在B subtilis BSn5菌株中也发现有Subtilomycin[28]。Subtilomycin具有较广的抗菌谱,理化特性比较稳定,耐热、耐酸碱性好;对某些蛋白酶也稳定[27]。已经确定了Subtilomycin的氨基酸序列为TWATIGKTIVQSVKKCRTFTCGCSLGSCSNCN,但经过了翻译后修饰[27],包括:T1、T4 和 T8位置的脱水成Dhb,N端进一步氧化成2-氧代丁酸;此外,在S11-C15、T17-C21、T20-C23、S24-C28和 S27-C31这些氨基酸残基对之间可形成硫醚或甲基硫醚,在Subtilomycin中存在4个小环[27]。甚至有研究表明,枯草芽孢杆菌BSn5通过产生Subtilomycin以结合自身产生的鞭毛蛋白而减少刺激植物的防御反应[29]。
前期的研究中,从江西省南昌市某猪场附近污泥中分离到一株枯草芽孢杆菌SX3411菌株(B. subtilis 3411)(菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,菌种保藏号CGMCC No.14396),初步确定枯草芽孢杆菌SX3411菌株中存在Subtilomycin[30]。通过原核融合表达Subtilomycin结构基因subA作为抗原,制备SubA的抗体来检测SubA在枯草芽孢杆菌SX3411的表达,以期更好地对枯草芽孢杆菌SX3411产Subtilomycin进行理论和生产研究。
1 材料和方法
1.1 试验材料
1.1.1 材料和试剂 枯草芽孢杆菌3411菌株,前期研究中从南昌市麻丘镇某猪场附近的土壤中分离得到,菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,菌种保藏号CGMCC No.14396。大肠杆菌(Escherichia coli)DH5α和BL21菌株由江西师范大学生命科学学院生物技术实验室保存。表达载体pET-41a(+)为美国novagen公司产品。
主要试剂包括无水葡萄糖、蛋白胨、酵母提取物(Yeast Extract)、NaCl、KCl、冰乙酸、NaOH、NaOAc·3H2O、Na2EDTA·2H2O、琼脂粉、甲醇、异丙醇、无水乙醇、Na2HPO4·12H2O、KH2PO4、Tris、Glycine、SDS、EDTA、Tween-20、PMSF、甘露醇、甘油、巯基乙醇和溴酚蓝等。所有试剂均购自国内外生物试剂生产厂家,无机试剂均为分析纯。SDS-PAGE凝胶快速制备试剂盒(上海生工生物工程有限公司),福氏完全佐剂和福氏不完全佐剂(美国 Sigma 公司),2×Taq PCR MasterMix(天根生化科技(北京)有限公司),HRP 标记羊抗兔 IgG[H&L](武汉博士德生物工程有限公司),DAB显色试剂盒(北京索莱宝科技有限公司),Protein A 亲和介质(美国 GE 公司)。
1.1.2 培养基 LB培养基为基础培养基:蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g,pH值 7.2,加水定容1 L,121 ℃灭菌20 min,固体培养基每1 L加15.0 g琼脂粉。
1.1.3 仪器与设备 D-37520 Osterode型台式高速离心机(美国Thermo公司);PTC-200型PCR仪(美国MJ-Research公司);ZHWY-103B型和ZHWY-2102型恒温培养振荡器(上海智城分析仪器制造有限公司);HT-1300-U超净工作台(苏净集团安泰公司);FE20型pH计(梅特勒-托利多仪器(上海)有限公司);ALO-210.2型电子天平(北京赛多利斯仪器系统有限公司);Biosafer 150-96型超声波细胞破碎仪(赛飞(中国)有限公司)。
1.2 试验方法
1.2.1 枯草芽孢杆菌3411的培养 取2%过夜培养的枯草芽孢杆菌3411菌种接种于100 mL新鲜LB液体培养基中,30 ℃180 r/min培养,于不同时间分别取样。
1.2.2 枯草芽孢杆菌3411菌体的处理 将培养获得的枯草芽孢杆菌3411发酵液10 mL经7 000 r/min离心5 min,取菌体沉淀,菌体沉淀用PBS缓冲液(0.1 mol/L浓度,pH值7)洗涤3遍,最后用1 mL的PBS缓冲液重悬菌体。加入PMSF至终浓度为1 mmol/L,经超声波破碎后12 000 r/min离心15 min,收集上清液备用。
1.2.3 subA基因的原核表达载体的构建 根据NCBI上给出的B subtilis Strain MMA7中Subtilomycin基因簇(GenBank序列号:JX912247.1)中的结构基因subA的序列,合成了SubA的3次重复的串联体3×subA 基因(南京金斯瑞生物科技公司合成),构建带有3×subA 基因的载体pUC57-3×subA。设计引物SL1(GGGGTACCTCCTTCTCATCAGACAGT,划线部分为KpnⅠ酶切位点)和SL2(CGGGATCCTCTGTCCTCTTCCTCATT,划线部分为BamH Ⅰ酶切位点),PCR扩增3×subA 基因序列,再同步双酶切3×subA序列和pET-41a(+)大肠杆菌表达载体,经过T4连接酶连接后转化大肠杆菌。
1.2.4 subA基因在大肠杆菌中的表达 含有串联的3×subA 基因序列的重组表达载体pET-41a(+)-3×subA大肠杆菌转化株BL21-pET41a(+)-3×subA工程菌接种于5 mL LB液体培养基中,于37 ℃和150 r/min过夜培养,即为种子培养基。取2%过夜培养的种子培养基接种于50 mL新鲜LB液体培养基中,37 ℃,180 r/min培养。当OD600值为0.6~0.8时,加入适量的IPTG溶液进行诱导表达。
1.2.5 Anti-3×SubA抗体的制备 首先进行SDS-PAGE电泳后切胶回收表达的SubA。将所有的大肠杆菌原核表达的3×SubA重组蛋白包涵体纯化样品进行12%胶浓度的SDS-PAGE电泳(具体配制见产品说明书)。电泳完毕后用预冷的0.25 mol/L KCl溶液于水平摇床上进行染色。5~10 min左右出现较为清晰的目的蛋白条带时,立即用干净的刀片切下目的蛋白所在的凝胶条带,将凝胶条放在蒸馏水里浸泡5~15 min,直至条带变为无色透明状。将脱色后的条带放入EP管中。
紧接着进行抗原注射免疫大白兔和抗体的纯化。将上一步得到的3×SubA重组蛋白样品胶条完全碾碎作为免疫抗原,先与福氏完全佐剂混合乳化均匀,对2只新西兰大白兔进行皮下和大腿肌肉多点注射,间隔时间7 d,免疫3次;而后抗原与福氏不完全佐剂混合,间隔时间7 d,免疫8次。兔子的耳静脉取血,静置后取血清,含有anti-3×SubA抗体的血清进行Protein A柱层析纯化(方法见产品说明书)。获得的纯化anti-3×SubA抗体采用ELISA 检测效价。
1.2.6 Western Blotting检测工程菌中SubA融合蛋白的原核表达 取培养好的重组大肠杆菌BL21-pET-41a(+)-3×subA菌液1.5 mL,7 000 r/min离心5 min。弃上清,保留菌体沉淀。菌体沉淀用PBS缓冲液(pH值7.4)洗3遍后,用菌液的1/10体积PBS缓冲液重悬菌体,根据菌体类型与体积选取适当的功率与工作时间,超声波破碎菌体,12 000 r/min离心15 min。取上清60 μL,加15 μL 5×变性蛋白上样缓冲液,在100 ℃水浴中煮沸10 min,10 000 r/min离心1 min后取10 μL上样。获得的沉淀先用终浓度为1% Triton重悬,4 ℃放置15 min,加入60 μL PBS缓冲液,再加上15 μL 5×变性蛋白上样缓冲液,在100 ℃水浴中煮沸10 min,10 000 r/min离心1 min后取10 μL上样。上清液和沉淀处理后同时进行SDS-PAGE电泳。电泳结束后,转PVDF膜,而后用5%的脱脂奶粉封闭、一抗结合(本研究制备的一抗为anti-3×SubA)、二抗结合(本研究用到的二抗为HRP 标记羊抗兔 IgG[H&L])以及显色(采用DAB显色试剂盒,使用方法参照说明书),获得杂交结果。
1.2.7 用anti-3×SubA抗体Western Blotting检测枯草芽孢杆菌3411中SubA的表达 将1.2.2步骤中30 ℃下不同时间获得的上清液取60 μL,加15 μL 5×变性蛋白上样缓冲液,在100 ℃水浴中煮沸10 min,10 000 r/min离心1 min后取40 μL上样,进行SDS-PAGE电泳。电泳结束后转PVDF膜,Western Blotting检测SubA在枯草葡萄芽孢杆菌3411中的表达。
2 结果与分析
2.1 对构建的表达载体pET41a(+)-3×subA检测
对合成的3×subA 基因序列以SL1和SL2为引物进行PCR扩增,而后双酶切,连接表达载体pET-41a(+),并获得有目的基因的大肠杆菌表达载体pET-41a(+)-3×subA,该载体转化大肠杆菌BL21菌株。而后以引物SL1和SL2进行PCR扩增检测表达载体的构建,结果可见有550 bp左右大小(实际567 bp)3×subA 基因的电泳带(图1-A),经进一步测序表明序列正确,由此确定构建的表达载体正确。同时抽提重组质粒pET-41a(+)-3×subA,用KpnⅠ和BamH Ⅰ进行酶切,也可见同样大小的DNA片段(图1-B)。这表明成功构建了subA 基因的表达载体,并转化进了大肠杆菌中。
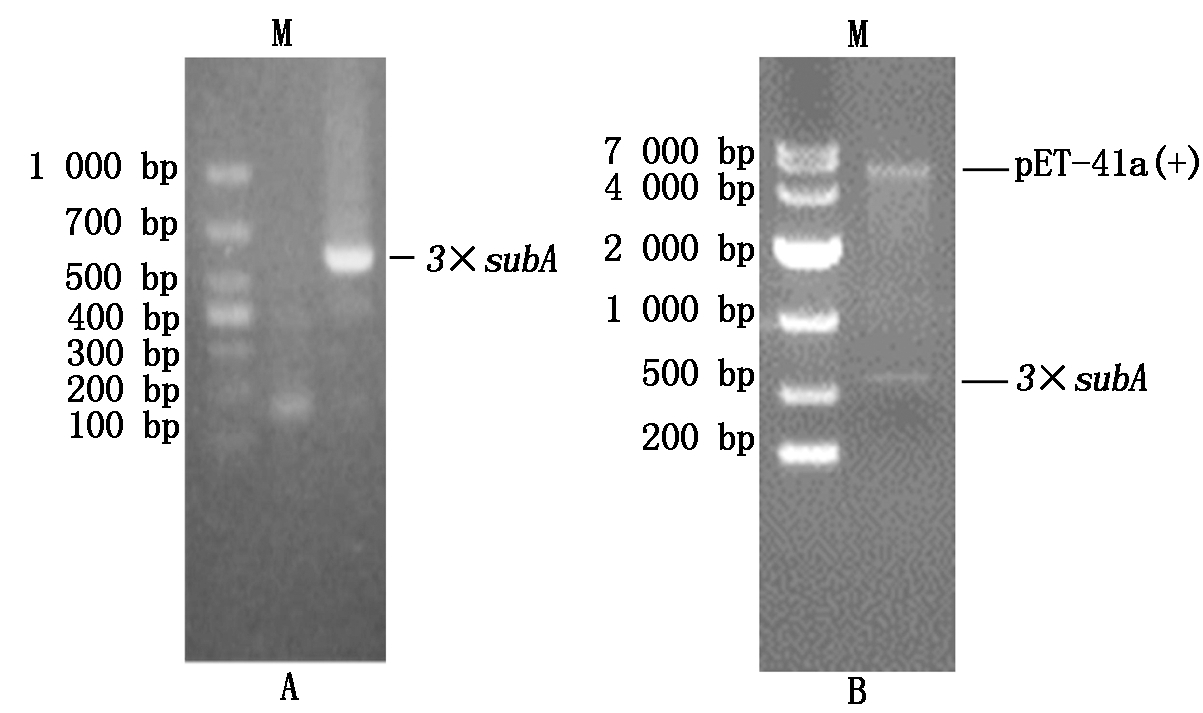
图1 重组质粒pET-41a(+)-3×subA的
PCR检测(A)和双酶切鉴定(B)
Fig.1 PCR analysis(A)and restriction enzyme digestion
(B)of the recombinant plasmid pET-41a-3×subA
2.2 重组3×subA基因在大肠杆菌中的表达
携带表达质粒的工程菌BL21-pET41a(+)-3×subA在条件为37 ℃,0.5 mmol/L IPTG诱导下融合蛋白的表达较好(图2)。根据电泳结果,经IPTG 6 h诱导后工程菌总蛋白中出现了明显的融合表达的3×SubA目标条带(大小约为54 ku)(图2-3,5),而大肠杆菌BL21菌株总蛋白和未经诱导的工程菌均未见有54 ku的3×SubA融合蛋白表达。此外,在经IPTG 6 h诱导后工程菌在超声波沉破碎后,表达蛋白只出现在沉淀中(图2-3),而未出现在上清液中(图2-4)。
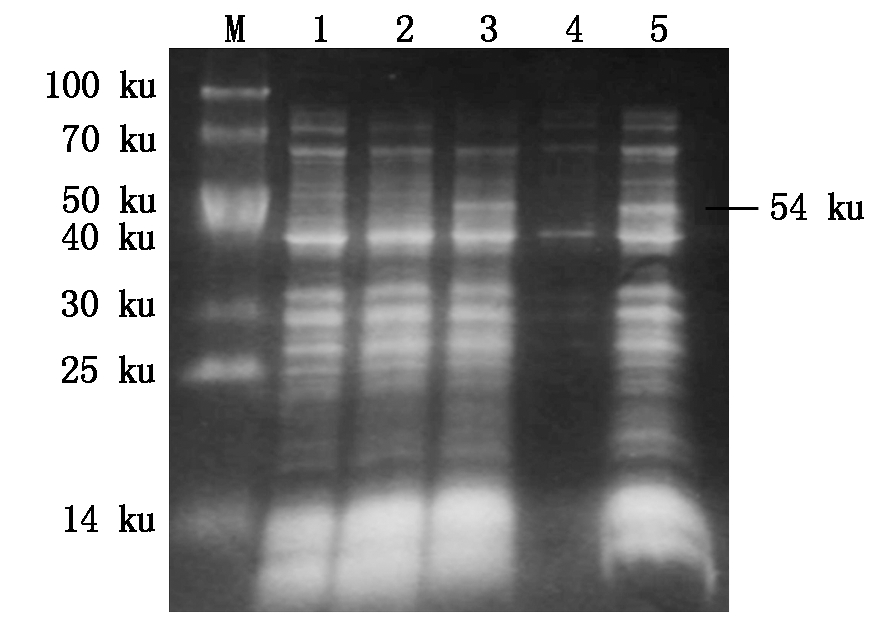
M.Blue Plus® Protein Marker(14~100 ku);1.大肠杆菌BL21菌体总蛋白;2.未经诱导的重组菌体总蛋白;3.37 ℃,0.5 mmol/L IPTG诱导6 h的重组菌体总蛋白;4.37 ℃,0.5 mmol/L IPTG诱导6 h的重组菌超声波破碎上清液;5.37 ℃,0.5 mmol/L IPTG诱导6 h的重组菌超声波破碎沉淀。
M.Blue Plus® Protein Marker(14-100 ku);1.Total protein of E. coli BL21;2.Total protein of engineering bacterium without induction;3.Total protein of engineering bacterium with induction of 0.5 mmol/L IPTG for 6 h at 37 ℃;4.Supernatant of engineering bacterium with induction of 0.5 mmol/L IPTG for 6 h at 37 ℃ after ultrasonic fragmentation;5.Precipitation of engineering bacterium with induction of 0.5 mmol/L IPTG for 6 h at 37 ℃ after ultrasonic fragmentation.
图2 重组蛋白3×SubA表达的SDS-PAGE检测
Fig.2 SDS-PAGE analysis of recombinant
protein 3×SubA expression
2.3 抗体的制备
将原核表达获得融合蛋白3×SubA进行SDS-PAGE电泳纯化,切取带有融合表达3×SubA的胶条免疫新西兰大白兔,可以得到抗体anti-3×SubA。获得的抗体经过亲和层析柱Protein A的纯化,经检测抗体的浓度为3.42 mg/mL。ELISA分析anti-3×SubA的滴度,结果表明,稀释50 000倍时,酶标仪检测ELISA的光吸收值为0.517,远超空白对照值0.074(免疫前的兔血清)(表1),说明获得的抗体anti-3×SubA有较高的效价。
表1 ELISA分析anti-3×SubA的效价
Tab.1 ELISA analysis of anti-3×SubA titre

抗体稀释度Antibody dilution50 00025 00012 5006 2503 125免疫前兔IgG(1∶3 000)Pre-immunization rabbit IgG (1∶3 000)OD450吸光值0.5171.0181.3111.5391.7110.074OD450 absorbance values
2.4 Western Blotting检测融合蛋白3×SubA在大肠杆菌中的表达
为进一步检测anti-3×SubA特异性,将构建好的重组大肠杆菌BL21-pET41a(+)-3×SubA经诱导后表达的重组蛋白3×SubA作为抗原,以anti-3×SubA为一抗,Western Blotting检测3×SubA蛋白的融合表达。在37 ℃下,0.5 mmol/L IPTG诱导6 h的重组菌BL21-pET-41a(+)-3×SubA菌体经超声波破碎后的沉淀和未经诱导的重组菌BL21-pET-41a(+)-3×SubA菌体超声波破碎沉淀,经处理后进行Western Blotting检测。可见诱导后的重组菌约在54 ku处出现了一条明显的特异性杂交带,而未诱导的重组菌没有出现54 ku大小的特异性杂交带(图3)。初步确定抗体anti-3×SubA可以检测出SubA。
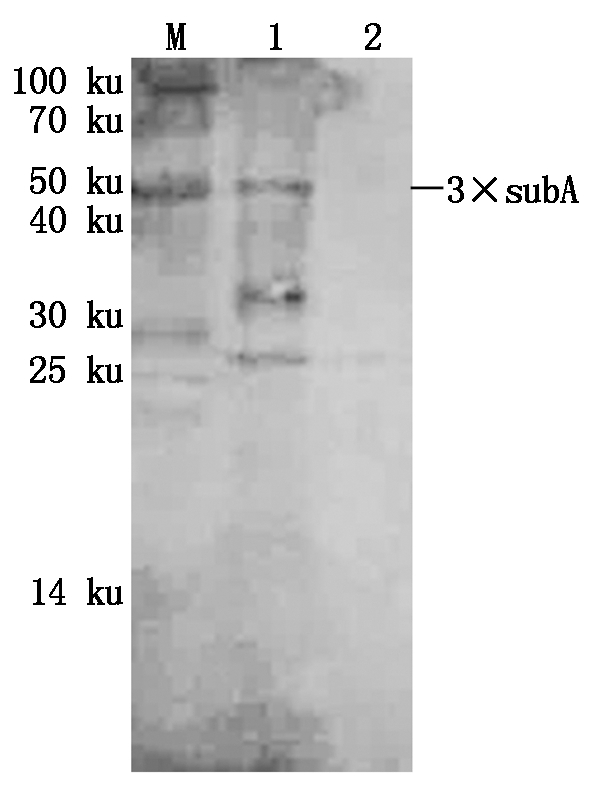
M.Blue Plus® Protein Marker(14~100 ku);1. 37 ℃下0.5 mmol/L IPTG诱导6 h的重组菌菌体超声波破碎后的总蛋白;2.未经诱导的重组菌菌体超声波破碎的总蛋白。
M. Blue Plus® Protein Marker(14-100 ku);1. Total protein of engineering bacterium with induction of 0.5 mmol/L IPTG for 6 h at 37 ℃;2.Total protein of engineering bacterium without induction.
图3 Western Blotting检测抗体anti-3×SubA的特异性
Fig.3 Western Blotting analysis of anti-3×SubA specificity
2.5 Western Blotting 检测枯草芽孢杆菌 3411中SubA蛋白的表达
为了检测枯草芽孢杆菌3411中Subtilomycin的前体多肽SubA在胞内的表达特性,在30 ℃的培养温度下对不同培养时间的枯草芽孢杆菌SX3411取样,菌体经超声波破碎处理后取上清液与anti-3×SubA抗体进行Western Blotting检测。由图4可知,在约6 ku位置处出现了特异性杂交带,与SubA的分子量(6.16 ku)基本一致。枯草芽孢杆菌SX3411在第10小时和第12小时胞内明显表达了SubA,而在第4小时未检测到SubA的表达,在第6,8小时SubA有微弱的表达,在第14小时未检测到SubA。由于制备的是多克隆抗体,在检测中也出现了非特异的蛋白质条带。
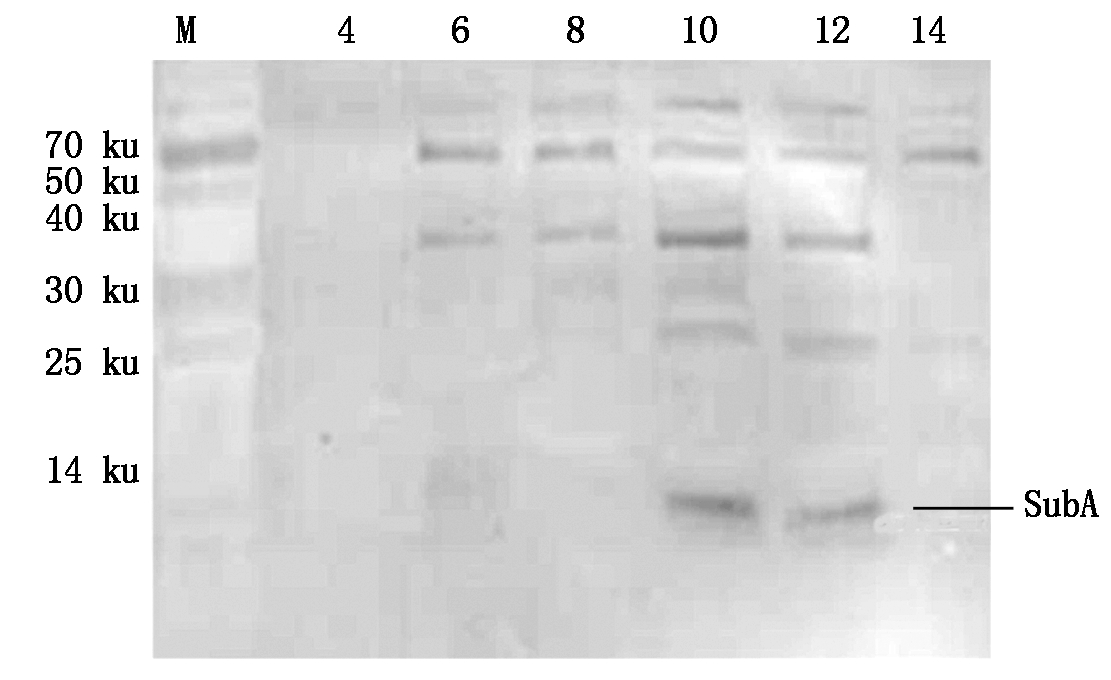
M.Blue Plus® Protein Marker(14~100 ku);培养时间分别为4,6,8,10,12,14 h ,温度均为30 ℃培养的枯草芽孢杆菌SX3411菌体超声波破碎的上清液。
M. Blue Plus® Protein Marker(14-100 ku);The supersonic crushing supernatant of Bacillus subtilis SX3411 cultured at 30 ℃ for 4,6,8,10,12,14 h,respectively.
图4 在枯草芽孢杆菌SX3411中SubA
表达的Western Blotting分析
Fig.4 Western Blotting analysis of SubA expression in
B subtilis SX3411
3 讨论
前期的研究发现,枯草芽孢杆菌3411可以天然的产生羊毛硫细菌素Subtilomycin[15]。已经了解到Subtilomycin除了具有良好的抑菌活性外,自身具有良好的理化特性,便于加工和利用[13,15]。由于Subtilomycin其前体也是一个小分子多肽,直接作为抗原免疫家兔,效果不明显。因此,设计了3次串联Subtilomycin前体的基因,在大肠杆菌中进行融合表达,以期获得更好的抗原性。通过这样的设计,在大肠杆菌中顺利表达了3次串联Subtilomycin前体基因3×subA,其表达蛋白3×SubA分子量为54 ku。
将大肠杆菌表达的3×SubA免疫家兔,获得了抗血清。对经过亲和柱纯化以后的抗体进行ELISA检测,所获得的抗体具有较高的抗体滴度。Western Blotting检测表明,枯草芽孢杆菌3411会天然表达Subtilomycin的前体肽SubA。枯草芽孢杆菌SX3411的前体蛋白SubA在30 ℃的培养温度下,于第6小时开始有少量的胞内表达,于第10,12小时有大量的表达,此时正是枯草芽孢杆菌3411的细胞处于代谢活跃期时。由此推测,当枯草芽孢杆菌3411进入对数生长期时,将会有前体蛋白SubA大量合成,也为羊毛硫细菌素Subtilomycin的生成做了前期准备。
[1] Drider D,Fimland G,Héchard Y,McMullen L M,Prévost H. The continuing story of class IIa bacteriocins[J].Microbiology and Molecular Biology Reviews,2006,70(2):564-582. doi:10.1128/mmbr.00016-05.
[2] Todorov S D. Bacteriocins from Lactobacillus plantarum-production,genetic organization and mode of action:Produção,organização genética e modo de ação[J].Brazilian Journal of Microbiology,2009,40(2):209-221. doi:10.1590/S1517-83822009000200001.
[3] Zgheib H,Drider D,Belguesmia Y. Broadening and enhancing bacteriocins activities by association with bioactive substances[J].International Journal of Environmental Research and Public Health,2020,17(21):7835. doi:10.3390/ijerph17217835.
[4] Naskar A,Kim K S. Potential novel food-related and biomedical applications of nanomaterials combined with bacteriocins[J].Pharmaceutics,2021,13(1):86. doi:10.3390/pharmaceutics13010086.
[5] Karczewski J,Krasucki S P,Asare-Okai P N,Diehl C,Friedman A,Brown C M,Maezato Y,Streatfield S J. Isolation,characterization and structure elucidation of a novel lantibiotic from Paenibacillus sp[J].Frontiers in Microbiology,2020,11:598789. doi:10.3389/fmicb.2020.598789.
[6] Karczewski J,Brown C M,Maezato Y,Krasucki S P,Streatfield S J. Efficacy of a novel lantibiotic,CMB001,against MRSA[J].Journal of Antimicrobial Chemotherapy,2021,76(6):1532-1538. doi:10.1093/jac/dkab040.
[7] Singh M,Chaudhary S,Sareen D. Roseocin,a novel two-component lantibiotic from an actinomycete[J].Molecular Microbiology,2020,113(2):326-337. doi:10.1111/mmi.14419.
[8] Vukomanovic′ M,Žunicˇ V,Kunej  ,Jancˇar B,Jeverica S,Podlipec R,Suvorov D. Nano-engineering the antimicrobial spectrum of lantibiotics:Activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7:4324. doi:10.1038/s41598-017-04670-0.
,Jancˇar B,Jeverica S,Podlipec R,Suvorov D. Nano-engineering the antimicrobial spectrum of lantibiotics:Activity of nisin against gram negative bacteria[J].Scientific Reports,2017,7:4324. doi:10.1038/s41598-017-04670-0.
[9] Li Q,Montalban-Lopez M,Kuipers O P. Increasing the antimicrobial activity of nisin-based lantibiotics against gram-negative pathogens[J].Applied and Environmental Microbiology,2018,84(12):e00052-18. doi:10.1128/aem.00052-18.
[10] Zaschke-Kriesche J,Reiners J,Lagedroste M,Smits S H J. Influence of nisin hinge-region variants on lantibiotic immunity and resistance proteins[J].Bioorganic & Medicinal Chemistry,2019,27(17):3947-3953. doi:10.1016/j.bmc.2019.07.014.
[11] Geng M X,Smith L. Modifying the lantibiotic mutacin 1140 for increased yield,activity,and stability[J].Applied and Environmental Microbiology,2018,84(15):e00830-18. doi:10.1128/aem.00830-18.
[12] Kers J A,Sharp R E,Defusco A W,Park J H,Xu J,Pulse M E,Weiss W J,Handfield M. Mutacin 1140 lantibiotic variants are efficacious against Clostridium difficile infection[J].Frontiers in Microbiology,2018,9:415. doi:10.3389/fmicb.2018.00415.
[13] Osipova I G,Sorokulova I B,Tereshkina N V,Grigor′eva L V. Safety of bacteria of the genus Bacillus,forming the base of some probiotics[J].Zhurnal Mikrobiologii,Epidemiologii Immunobiologii,1998(6):68-70.
[14] 李佳骏,王振华,胡正茂,唐慧琴,谷笑笑,廖成斌,潘康成. 重组枯草芽孢杆菌SE1对肉鸡生长性能、肠道消化酶活性和菌群的影响[J].动物营养学报,2018,30(4):1582-1591. doi:10.3969/j.issn.1006-267x.2018.04.044.
Li J J,Wang Z H,Hu Z M,Tang H Q,Gu X X,Liao C B,Pan K C. Effects of recombinant Bacillus subtilis SE1 on growth performance,intestinal digestive enzyme activities and microflora of broilers[J].Chinese Journal of Animal Nutrition,2018,30(4):1582-1591.
[15] 于洁,赵敏孟,龚道清. 枯草芽孢杆菌在畜禽生产中的研究进展[J].中国饲料,2020(19):6-11. doi:10.15906/j.cnki.cn11-2975/s.20201902.
Yu J,Zhao M M,Gong D Q. Research progress in application of Bacillus subtilis on animal production[J].China Feed,2020(19):6-11.
[16] 黄亚丽,郑立伟,黄媛媛,贾振华,宋水山,李再兴. 枯草芽孢杆菌菌剂不同施用方式对甜瓜土壤微生物多样性及生长的影响[J].生物工程学报,2020,36(12):2644-2656. doi:10.13345/j.cjb.200379.
Huang Y L,Zheng L W,Huang Y Y,Jia Z H,Song S S,Li Z X. Effects of different application methods of Bacillus subtilis agent on soil microbial diversity and growth of muskmelon[J].Chinese Journal of Biotechnology,2020,36(12):2644-2656.
[17] 周亮成,李运,李卓苗,林培炯,钟国华. 枯草芽孢杆菌BSF01菌剂制备及对高效氯氰菊酯的降解效果[J].华南农业大学学报,2018,39(3):54-59.
Zhou L C,Li Y,Li Z M,Lin P J,Zhong G H. Preparation of bacterial agent based on Bacillus subtilis BSF01 and its biodegradation effect on beta-cypermethrin[J].Journal of South China Agricultural University,2018,39(3):54-59.
[18] Leclère V,Béchet M,Adam A,Guez J S,Wathelet B,Ongena M,Thonart P,Gancel F,Chollet-Imbert M,Jacques P. Mycosubtilin overproduction by Bacillus subtilis BBG100 enhances the organism′s antagonistic and biocontrol activities[J].Applied and Environmental Microbiology,2005,71(8):4577-4584. doi:10.1128/AEM.71.8.4577-4584.2005.
[19] Stein T. Bacillus subtilis antibiotics:Structures,syntheses and specific functions[J].Molecular Microbiology,2005,56(4):845-857. doi:10.1111/j.1365-2958.2005.04587.x.
[20] Chu F,Kearns D B,McLoon A,Chai Y R,Kolter R,Losick R. A novel regulatory protein governing biofilm formation in Bacillus subtilis[J].Molecular Microbiology,2008,68(5):1117-1127. doi:10.1111/j.1365-2958.2008.06201.x.
[21] Heinzmann S,Entian K D,Stein T. Engineering Bacillus subtilis ATCC 6633 for improved production of the lantibiotic subtilin[J].Applied Microbiology and Biotechnology,2006,69(5):532-536. doi:10.1007/s00253-005-0023-9.
[22] Kleerebezem M,Bongers R,Rutten G,de Vos W M,Kuipers O P. Autoregulation of subtilin biosynthesis in Bacillus subtilis:The role of the spa-box in subtilin-responsive promoters[J].Peptides,2004,25(9):1415-1424. doi:10.1016/j.peptides.2003.11.025.
[23] Chatterjee C,Paul M,Xie L L,van der Donk W A. Biosynthesis and mode of action of lantibiotics[J].Chemical Reviews,2005,105(2):633-684. doi:10.1021/cr030105v.
[24] Luo Y,Helmann J D. Extracytoplasmic function σ factors with overlapping promoter specificity regulate sublancin production in Bacillus subtilis[J].Journal of Bacteriology,2009,191(15):4951-4958. doi:10.1128/jb.00549-09.
[25] Zheng G L,Yan L Z,Vederas J C,Zuber P. Genes of the sbo-alb locus of Bacillus subtilis are required for production of the antilisterial bacteriocin subtilosin[J].Journal of Bacteriology,1999,181(23):7346-7355. doi:10.1128/jb.181.23.7346-7355.1999.
[26] Stein T,Düsterhus S,Stroh A,Entian K D. Subtilosin production by two Bacillus subtilis subspecies and variance of the sbo-alb cluster[J].Applied and Environmental Microbiology,2004,70(4):2349-2353. doi:10.1128/aem.70.4.2349-2353.2004.
[27] Phelan R W,Barret M,Cotter P D,O'Connor P M,Chen R,Morrissey J P,Dobson A D W,O'Gara F,Barbosa T M. Subtilomycin:a new lantibiotic from Bacillus subtilis strain MMA7 isolated from the marine sponge Haliclona simulans[J].Marine Drugs,2013,11(6):1878-1898. doi:10.3390/md11061878.
[28] Deng Y,Li C Z,Zhu Y G,Wang P X,Qi Q D,Fu J J,Peng D H,Ruan L F,Sun M. ApnI,a transmembrane protein responsible for subtilomycin immunity,unveils a novel model for lantibiotic immunity[J].Applied and Environmental Microbiology,2014,80(20):6303-6315. doi:10.1128/AEM.02280-14.
[29] Deng Y,Chen H Q,Li C Z,Xu J Y,Qi Q D,Xu Y Y,Zhu Y G,Zheng J S,Peng D H,Ruan L F,Sun M. Endophyte Bacillus subtilis evade plant defense by producing lantibiotic subtilomycin to mask self-produced flagellin[J].Communications Biology,2019,2:368. doi:10.1038/s42003-019-0614-0.
[30] 李晓然,叶德晓,付鸣佳,钟雪晴,肖世平,杨志海. 枯草芽孢杆菌SX3411产羊毛硫细菌素subtilomycin的初步鉴定与理化特性分析[J].食品与发酵工业,2019,45(12):46-54. doi:10.13995/j.cnki.11-1802/ts.020116.
Li X R,Ye D X,Fu M J,Zhong X Q,Xiao S P,Yang Z H. Identification and physicochemical characterization of lantibiotic subtilomycin produced by Bacillus subtilis SX3411[J].Food and Fermentation Industries,2019,45(12):46-54.
