铬(Cr)和砷(As)、汞(Hg)、镉(Cd)、铅(Pb)等5种重金属因对人体的毒害作用大,被称为重金属“五毒”,铬污染是环境中最常见的重金属污染之一。铬存在有多种氧化价态,铬(Ⅲ)和铬(Ⅵ)是其最稳定、最常见的存在价态。铬(Ⅵ)因其易进入细胞内部,具有致癌和诱发基因突变的作用,普遍认为其具有严重的毒害作用,是铬污染治理研究的主要研究对象[1-2];而铬(Ⅲ)则在环境中较为稳定,是人体必需的微量元素之一,故对铬(Ⅲ)的研究则主要侧重于其生理活性的研究。
铬(Ⅲ)是葡萄糖耐量因子(GTF)的重要组成成分,在适当的浓度水平条件下可协同维持糖类、脂类、蛋白质、核酸等的正常代谢[3],因此,一般认为在适当浓度条件下铬(Ⅲ)是无毒的,常作为功能性食品的营养补充成分应用[4]。但铬(Ⅲ)在高浓度存在条件下,也能诱导产生自由基、引起DNA突变、引起动物精子畸形、产生细胞毒性等[5-6]。研究者们发现,L-02肝细胞经高浓度铬(Ⅲ)处理后细胞膜受到一定程度损害,其细胞膜透性增加、流动性降低[4]。高浓度铬(Ⅲ)除具有细胞生理生化毒性外,其对生态环境也有较大的危害性。Vignati等[7]研究发现,铬(Ⅲ)对羊角月牙藻(Pesudokirchneriella subcapitata)和凯氏小球藻(Chalorella kessleri )2种淡水绿藻的毒性远高于铬(Ⅵ)。在对土壤酶活性的研究发现,铬(Ⅲ)对土壤脲酶、土壤碱性磷酸酶、土壤脱氢酶、过氧化氢酶等活性具有显著的抑制作用[8-10]。
油菜(Brassica napus L.)属十字花科芸薹属植物,具有耐旱、耐寒、生物量大等特点,是我国的主要油料作物之一,在我国南北地区广泛种植。近年来,研究发现油菜具有修复铅、镉、镍、锌、铜等重金属污染的能力,使其已然成为重金属污染生物修复的研究热点。本研究对前期分离得到的耐铬(Ⅲ)油菜内生菌BNC-Q菌株进行菌种鉴定及铬(Ⅲ)处理反应性进行分析,以期为重金属铬污染的生物修复提供一定的基础。
BNC-Q菌株,保存于徐州工程学院生物芯片实验室。
TSB固体培养基(g/L):胰蛋白胨15.0,大豆蛋白胨5.0,NaCl 5.0,牛肉膏5.0,琼脂15.0,pH值7.2。LB液体培养基(g/L):酵母浸出粉5.0,胰蛋白胨10.0,NaCl 10.0,pH值自然。
挑取少量BNC-Q菌株于20 mL LB液体培养基中,37 ℃、180 r/min培养12 h,取2 μL菌液,用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)为引物,进行菌落PCR扩增。
PCR反应体系为50 μL(μL):模板 2,引物27F 2,引物1492R 2,10×PCR Buffer 5,dNTP Mix(2.5 mmol/each)4,ddH2O 34.5,Taq DNA polymerase(5 U/L)0.5。
PCR反应为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃后延伸10 min。
PCR产物于1%琼脂糖凝胶中进行琼脂糖凝胶电泳检测后,送上海生工生物有限公司进行测序。测序结果经NCBI网站进行Blast分析后,利用MEGA 7.0软件构建菌株系统发育树。
无菌条件下,挑取少量BNC-Q菌斑置于50 mL LB液体培养基中,37 ℃、180 r/min条件下培养12 h,得菌液种子液备用。
取1 mL上述菌液种子液,分别接入100 mL含铬(Ⅲ)的LB液体培养基中,铬(Ⅲ)的终浓度分别为0,1,2,5 mmol/L;接种后的菌液于37 ℃、150 r/min条件下培养,并分别在培养0,6,18,30,42,54 h后、于600 nm波长下测其菌液的OD值。
取1 mL BNC-Q菌液种子液分别接入100 mL含铬(Ⅲ)2 mmol/L的LB液体培养基中;37 ℃、200 r/min培养42 h后,取5 mL菌液,10 000 r/min、5 min,离心收集菌体,SDS-PAGE分析,以未经铬(Ⅲ)处理的BNC-Q菌为对照。
取含铬(Ⅲ)2 mmol/L的LB液体培养基培养的菌液和LB液体培养基培养的菌液各90 mL,8 000 r/min、10 min离心收集菌体,各取1.0 g湿菌体,加入30 mL磷酸盐缓冲液将菌体重新悬浮,冰上超声波破碎菌体(功率400 W,工作2 s,间隔3 s,30次),4 000 r/min、4 ℃离心10 min,收集上清液,备用。
1.6.1 DPPH清除率测定 取100 μL上述上清液,加入3.9 mL无水乙醇,混匀,作为样品溶液备用。
分别取1 mL DPPH·乙醇溶液(0.1 mmol/L)和样品溶液1 mL,混匀,暗处放置30 min,以无水乙醇为空白对照、517 nm条件下测其吸光度值A,并以下式计算DPPH清除率:
清除率![]()
式中:A0为DPPH·乙醇溶液1 mL+无水乙醇1 mL的吸光度值;A1为DPPH·乙醇溶液1 mL+样品溶液1 mL的吸光度值;A2为样品溶液1 mL+无水乙醇1 mL的吸光度值。
1.6.2 超氧阴离子自由基![]() 清除率测定 取两支试管,分别标记为A0和A1,A0试管中加入5 mL Tris-HCl缓冲溶液(pH值8.2,0.05 mmol/L)和2 mL蒸馏水,A1试管中加入5 mL Tris-HCl缓冲液(pH值8.2,0.05 mmol/L)、1.8 mL蒸馏水和0.2 mL上述待测上清液,25 ℃恒温水浴处理20 min,分别加入0.5 mL邻苯三酚溶液,立即混匀倒入比色皿中,于325 nm条件下测定吸光度值,分别记为A0、A1,每30 s记录1次,共记录5 min。以时间为横坐标、吸光值为纵坐标,作直线回归分别得到邻苯三酚自氧化速率V0和菌种清除超氧阴离子的速率V1,并以下式计算
清除率测定 取两支试管,分别标记为A0和A1,A0试管中加入5 mL Tris-HCl缓冲溶液(pH值8.2,0.05 mmol/L)和2 mL蒸馏水,A1试管中加入5 mL Tris-HCl缓冲液(pH值8.2,0.05 mmol/L)、1.8 mL蒸馏水和0.2 mL上述待测上清液,25 ℃恒温水浴处理20 min,分别加入0.5 mL邻苯三酚溶液,立即混匀倒入比色皿中,于325 nm条件下测定吸光度值,分别记为A0、A1,每30 s记录1次,共记录5 min。以时间为横坐标、吸光值为纵坐标,作直线回归分别得到邻苯三酚自氧化速率V0和菌种清除超氧阴离子的速率V1,并以下式计算![]() 清除率:
清除率:
清除率![]()
1.6.3 羟基自由基·OH清除率测定 取1 mL待测上清液,加入4 mL磷酸盐缓冲液,混匀,作为样品溶液备用。
①向25 mL 具塞试管中依次加入1.0 mL邻二氮菲(1.5 mmol/L)、2 mL磷酸盐缓冲液(0.2 mmol/L,pH值7.4)、1 mL 蒸馏水,充分摇匀后,加入1 mL FeSO4溶液(0.75 mmol/L),混匀,加1 mL H2O2(0.1%),具塞,于37 ℃水浴中反应60 min,反应结束后迅速于波长536 nm处测定其吸光度,其测定值为Ap。
②以1 mL 蒸馏水代替①中1 mL H2O2,测其吸光度值为Ab。
③用1 mL 样品溶液代替①中1 mL蒸馏水。测定其吸光度值为AS。
羟基自由基·OH清除率计算公式如下:
清除率![]()
以细菌16S rDNA通用引物27F和1492R为引物对BNC-Q菌株进行菌落PCR,电泳检测(图1)后,送生工生物工程(上海)股份有限公司进行测序,将测序序列在NCBI网站上进行Blast分析,发现BNC-Q菌株的16S rDNA与芽孢杆菌属同源性最高。用MEGA 7.0软件以Neighbor-Joining法构建系统发育树(图2),结果表明,BNC-Q菌株与阿氏芽孢杆菌(KC764988)进化亲缘关系最近。综上所述,确定BNC-Q为阿氏芽孢杆菌(Bacillus aryabhattai)。
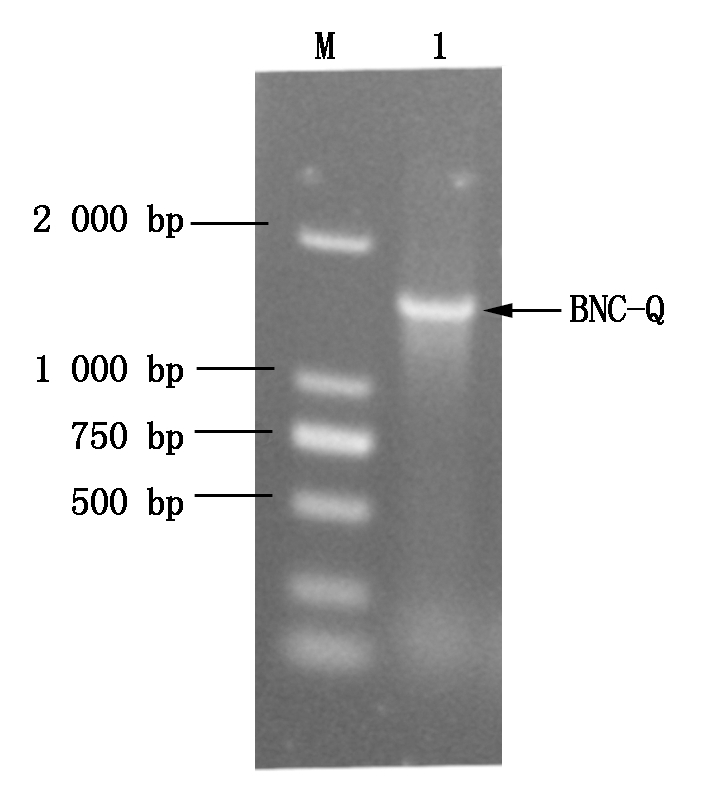
图1 16S rDNA PCR电泳
Fig.1 PCR amplication of 16S rDNA
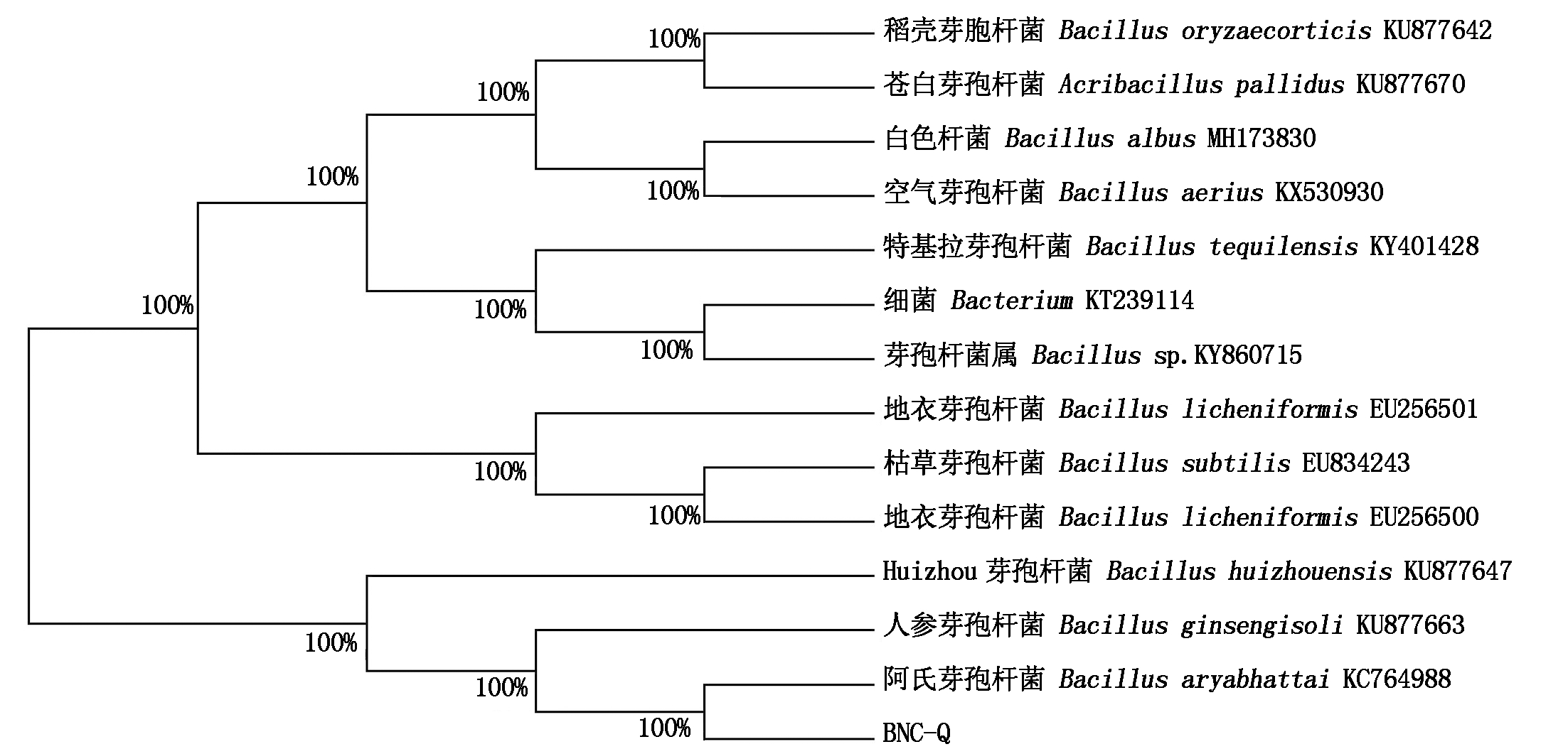
图2 BNC-Q菌株系统进化树
Fig.2 Phylogenetic tree of strain BNC-Q
%
以不含铬(Ⅲ)的LB液体培养基中培养的BNC-Q为对照,BNC-Q菌株在分别含有1,2,5 mmol/L铬(Ⅲ)的LB培养基中的生长曲线如图3所示。从图中可以看出,铬(Ⅲ)浓度为1,2 mmol/L时,BNC-Q菌株的生长趋势与对照组的生长曲线相似,接种培养至18 h,三者菌体光密度OD600值基本相同;接种培养18~54 h,1,2 mmol/L铬(Ⅲ)处理组的OD600值均高于对照组,其中2 mmol/L铬(Ⅲ)处理组的OD600值最高。铬(Ⅲ)浓度增加为5 mmol/L时,与对照组相比,BNC-Q菌株的生长趋势线有了明显的改变,不仅菌体OD600值明显变小,而且其生长周期出现了明显的滞后现象,接种培养30 h内菌体光密度OD600值没有明显的变化,接种培养30~54 h,OD600值才小幅度增加。综上所述,低浓度铬(Ⅲ)对BNC-Q菌株的生长具有促进作用,其中2 mmol/L铬(Ⅲ)对BNC-Q菌株的生长促进作用最强;高浓度铬(Ⅲ)对BNC-Q菌株的生长具有抑制作用,5 mmol/L铬(Ⅲ)可强烈抑制BNC-Q菌株的生长。
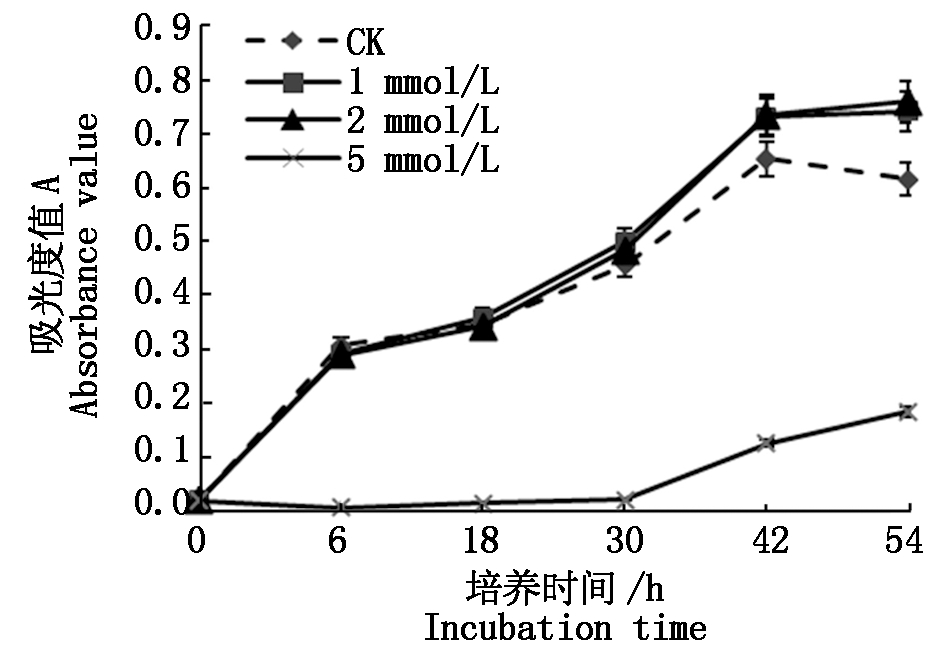
图3 铬(Ⅲ)对BNC-Q菌株生长的影响
Fig.3 Effect of Cr(Ⅲ)on BNC-Q growth
以无铬(Ⅲ)诱导培养的BNC-Q菌为对照,将2 mmol/L铬(Ⅲ)诱导培养的BNC-Q菌进行SDS-PAGE分析,结果如图4所示。从SDS-PAGE电泳图中可以看出,经2 mmol/L铬(Ⅲ)胁迫培养后BNC-Q菌体中多出一条约40 ku大小的蛋白质条带,推测此经诱导表达的40 ku大小的蛋白质与BNC-Q菌株的耐铬(Ⅲ)性密切相关。
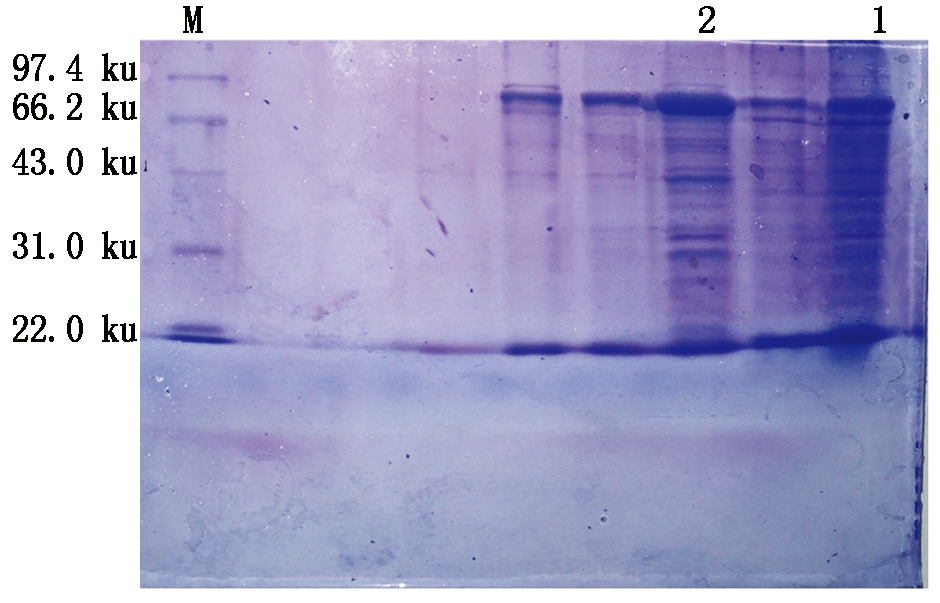
1.对照组;2.2 mmol/L铬(Ⅲ)胁迫培养组;M.Marker。
1.CK;2.2 mmol/L Cr(Ⅲ)treatment culture;M.Marker.
图4 BNC-Q菌株SDS-PAGE电泳
Fig.4 SDS-PAGE analysis of BNC-Q
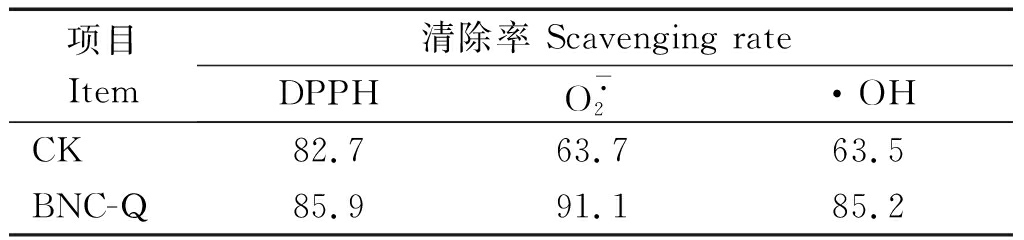
以无铬(Ⅲ)诱导培养的BNC-Q菌为对照,分别测定了BNC-Q菌经2 mmol/L铬(Ⅲ)诱导培养后清除DPPH自由基、超氧阴离子自由基![]() 和羟基自由基·OH的能力,结果见表1。从表中可以看出,与对照组相比,BNC-Q菌经2 mmol/L铬(Ⅲ)诱导培养后清除DPPH自由基的能力没有显著变化,而对超氧阴离子自由基
和羟基自由基·OH的能力,结果见表1。从表中可以看出,与对照组相比,BNC-Q菌经2 mmol/L铬(Ⅲ)诱导培养后清除DPPH自由基的能力没有显著变化,而对超氧阴离子自由基![]() 的清除率由对照组的63.7%上升到91.1%,对羟基自由基·OH的清除率由对照组的63.5%增加到85.2%。综上所述,2 mmol/L铬(Ⅲ)胁迫能显著增加BNC-Q菌株清除超氧阴离子自由基
的清除率由对照组的63.7%上升到91.1%,对羟基自由基·OH的清除率由对照组的63.5%增加到85.2%。综上所述,2 mmol/L铬(Ⅲ)胁迫能显著增加BNC-Q菌株清除超氧阴离子自由基![]() 和羟基自由基·OH的能力。
和羟基自由基·OH的能力。
表1 铬(Ⅲ)胁迫对BNC-Q菌株抗氧化能力的影响
Tab.1 Effects of chromium(Ⅲ)treatment on antioxidant
capacity of BNC-Q strain %
项目Item清除率 Scavenging rateDPPHO-·2·OHCK82.763.763.5BNC-Q85.991.185.2
阿氏芽孢杆菌是21世纪初才被发现的芽孢杆菌新种,分布范围广,研究者们已先后从动物肠道、深海、高原、植物根际土壤、植物根茎组织等多种环境场所分离出阿氏芽孢杆菌[11-15]。同时,关于阿氏芽孢杆菌应用方面的研究也逐渐成为热点,在大分子降解与合成、植物病害防治、合成激素促进植物生长等应用方面已有较多的相关报道[17-22];同时,研究者们也发现阿氏芽孢杆菌能够耐受多种重金属胁迫,可将高毒性有害重金属吸附于菌体中或转换为低毒无毒形式。Verma等[23]发现阿氏芽孢杆菌ITBHU02菌株在适宜条件下可对112 mg/L的铬(Ⅵ)吸附率达31.2 mg/g,铬(Ⅵ)移除率达93.6%;刘军生等[24]研究发现阿氏芽孢杆菌GR42菌株可耐受2 000 mg/L Pb2+、1 200 mg/L Zn2+,Cd2+浓度为800 mg/L时,镉去除率可达41.1%;杨丽等[25]研究发现,阿氏芽孢杆菌L24菌株在Cd2+浓度7 mg/L、Pb2+浓度14 mg/L的溶液中对Cd2+和Pb2+的移除率分别达到约36%,11%;Kushwaha等[26]研究发现,阿氏芽孢杆菌EPP4菌株对铬(Ⅵ)、Co和Ni的耐受浓度可达800,600,600 mg/L,EPP26菌株可耐受铬(Ⅵ)、Co和Ni的浓度分别为1 000,600,400 mg/L,EPP50菌株可耐受铬(Ⅵ)、Co和Ni的浓度分别为1 000,600,200 mg/L,同时EPP26和EPP50还可以耐受200 mg/L的铜;Paredes-Páliz等[27]发现阿氏芽孢杆菌RS025菌株具有较强的砷、铜等重金属耐受性,而对铅、镉等耐受性较差;Singh等[28]研究发现,阿氏芽孢杆菌NBRI014菌株能够耐受1 000 mg/L的砷酸盐;Ghosh等[29]发现阿氏芽孢杆菌MCC3374菌株具有强的砷耐受性;本研究中较低浓度铬(Ⅲ)能够促进BNC-Q菌株的生长,5 mmol/L铬(Ⅲ)则可较强程度抑制BNC-Q菌株的生长。
除重金属胁迫外,阿氏芽孢杆菌还能抵抗低温、缺氧、强紫外辐射多种环境胁迫的影响。Wen等[12]从我国南海1 810 m深海中分离得到了阿氏芽孢杆菌GZ03菌株;Yan等[15]从青藏高原土壤中筛选得到了能够耐受低温、缺氧和强紫外辐射的阿氏芽孢杆菌T61菌株。研究者们对T61菌株抗紫外辐射的机理进行了深入的研究,发现T61菌株细胞内形成了一系列的活性氧(Reactive oxygen species,ROS)防御系统[15]。T61缺乏OxyR调节系统,但相应的抗氧化物编码基因都存在,因此研究者们推测T61中存在着另外一些未知的类似OxyR调节系统的转录调控系统[15]。除抗氧化转录调控系统外,T61中还存在着一系列的酶活性的和非酶活性的抗氧化系统,如超氧化物歧化酶SOD、过氧化氢酶、过氧化物酶、硫氧还蛋白、谷胱甘肽、多胺等[15]。本研究中经2 mmol/L铬(Ⅲ)处理后BNC-Q体内物质清除超氧阴离子自由基和羟自由基的能力显著增加,推测是高浓度铬(Ⅲ)处理引发了其细胞内抗氧化系统的表达,产生了大量的SOD、过氧化氢酶等多种具有抗氧化活性的酶,这些酶能够高效清除超氧阴离子自由基和羟自由基;而DPPH是一种人工合成的自由基,其清除剂主要是类黄酮、维生素C、维生素E、β-胡萝卜素等等天然植物提取物或化合物[30],而BNC-Q经2 mmol/L铬(Ⅲ)诱导产生的可能主要是一些具有抗氧化活性的酶和少量的非酶性质的抗氧化物,故对DPPH自由基的清除率仅从对照组的82.7%增加到了处理组的85.9%。
[1] 考庆君,吴坤.铬的生物学作用及毒性研究进展[J].中国公共卫生,2004,20(11):1398-1400.doi:10.3321/j.issn:1001-0580.2004.11.069.
Kao Q J,Wu K.Research progress on biological function and toxicity of chromium[J].Chinese Journal of Public Health,2004,20(11):1398-1400.
[2] 钟旻依,张新全,杨昕颖,胡乙月,姜杏,聂刚.植物对重金属铬胁迫响应机制的研究进展[J].草业科学,2019,36(8):1962-1975. doi:10.11829/j.issn.1001-0629.2018-0699.
Zhong M Y,Zhang X Q,Yang X Y,Hu Y Y,Jiang X,Nie G. Recent advances in plant response to chromium stress[J].Pratacultural Science,2019,36(8):1962-1975.
[3] Sun Y,Ramirez J,Woski S A,Vincent J B. The binding of trivalent chromium to low-molecular-weight chromium-binding substance(LMWCr)and the transfer of chromium from transferrin and chromium picolinate to LMWCr[J].JBIC Journal of Biological Inorganic Chemistry,2000,5(1):129-136. doi:10.1007/s007750050016.
[4] 莫民帅. Cr(Ⅲ)和Cr(Ⅵ)对L-02肝细胞膜毒性的比较[D].长沙:中南大学,2005.doi:10.7666/d.y747432.
Mo M S. A comparision of trivalent and hexavalent chromium-induced toxicity in cell membrane of L-02 Hepatocytes[D].Changsha:Central South University,2005.
[5] Fébel H,Szegedi B,Husz r S. Absorption of inorganic,trivalent and hexavalent chromium following oral and intrajejunal doses in rats[J].Acta Veterinaria Hungarica,2001,49(2):203-209. doi:10.1556/004.49.2001.2.10.
r S. Absorption of inorganic,trivalent and hexavalent chromium following oral and intrajejunal doses in rats[J].Acta Veterinaria Hungarica,2001,49(2):203-209. doi:10.1556/004.49.2001.2.10.
[6] Catelas I,Petit A,Zukor D J,Huk O L. Cytotoxic and apoptotic effects of cobalt and chromium ions on J774 macrophages-Implication of caspase-3 in the apoptotic pathway[J].Journal of Materials Science(Materials in Medicine),2001,12(10/11/12):949-953. doi:10.1023/A:1012800813662.
[7] Vignati D A L,Dominik J,Beye M L,Pettine M,Ferrari B J D. Chromium(Ⅵ)is more toxic than chromium(Ⅲ)to freshwater algae:A paradigm to revise?[J].Ecotoxicology and Environmental Safety,2010,73(5):743-749. doi:10.1016/j.ecoenv.2010.01.011.
[8] 胡一,孔龙,和文祥,吕家珑. Cr3+的土壤酶效应研究[J].西北农林科技大学学报(自然科学版),2012,40(5):166-172. doi:10.13207/j.cnki.jnwafu.2012.05.013.
Hu Y,Kong L,He W X,Lü J L. Effects of Cr3+ on soil enzyme activity[J].Journal of Northwest A & F University (Natural Science Edition),2012,40(5):166-172.
[9] 梁艳茹,和文祥,邢少峰,吕家珑,唐明. 不同价态铬对土壤碱性磷酸酶活性的影响[J].西北农林科技大学学报(自然科学版),2010,38(5):156-160,166. doi:10.13207/j.cnki.jnwafu.2010.05.010.
Liang Y R,He W X,Xing S F,Lü J L,Tang M. Effects of different valence chromium on soil alkaline phosphatase activity[J].Journal of Northwest A & F University (Natural Science Edition),2010,38(5):156-160,166.
[10] 于修乐,马义兵,孙宗全,李合莲,李士伟,韩雪梅. 土壤中Cr(Ⅵ)和Cr(Ⅲ)生态毒性的差异性研究[J].农业环境科学学报,2018,37(11):2522-2531.
Yu X Y,Ma Y B,Sun Z Q,Li H L,Li S W,Han X M. Study on ecotoxicity differences of Cr(Ⅵ)and Cr(Ⅲ)in soils[J].Journal of Agro-Environment Science,2018,37(11):2522-2531.
[11] Shivaji S,Chaturvedi P,Begum Z,Pindi P K,Manorama R,Padmanaban D A,Shouche Y S,Pawar S,Vaishampayan P,Dutt C B S,Datta G N,Manchanda R K,Rao U R,Bhargava P M,Narlikar J V. Janibacter hoylei sp. nov.,Bacillus isronensis sp. nov. and Bacillus aryabhattai sp. nov.,isolated from cryotubes used for collecting air from the upper atmosphere[J].International Journal of Systematic and Evolutionary Microbiology,2009,59(12):2977-2986. doi:10.1099/ijs.0.002527-0.
[12] Wen J,Ren C,Huang N,Liu Y,Zeng R Y. Draft genome of bagasse-degrading bacteria Bacillus aryabhattai GZ03 from deep sea water[J].Marine Genomics,2015,19:13-14. doi:10.1016/j.margen.2014.11.004.
[13] Yadav K K,Bora A,Datta S,Chandel K,Gogoi H K,Prasad G B K S,Veer V. Molecular characterization of midgut microbiota of Aedes albopictus and Aedes aegypti from Arunachal Pradesh,India[J].Parasites & Vectors,2015,8(1):1-8. doi:10.1186/s13071-015-1252-0.
[14] Paredes-P liz K I,Caviedes M A,Doukkali B,Mateos-Naranjo E,Rodr guez-Llorente I D,Pajuelo E. Screening beneficial rhizobacteria from Spartina maritima for phytoremediation of metal polluted salt marshes:Comparison of gram-positive and gram-negative strains[J].Environmental Science and Pollution Research,2016,23(19):19825-19837. doi:10.1007/s11356-016-7184-1.
[15] Yan Y,Zhang L,Yu M Y,Wang J,Tang H,Yang Z W,Wan P. The genome of Bacillus aryabhattai T61 reveals its adaptation to Tibetan Plateau environment[J].Genes & Genomics,2016,38(3):293-301. doi:10.1007/s13258-015-0366-2.
[16] Mohapatra S,Maity S,Dash H R,Das S,Pattnaik S,Rath C C,Samantaray D. Bacillus and biopolymer:Prospects and challenges[J].Biochemistry and Biophysics Reports,2017,12:206-213. doi:10.1016/j.bbrep.2017.10.001.
[17] Paz A,Costa-Trigo I,Oliveira R P D S,Domínguez J M. Ligninolytic enzymes of endospore-forming Bacillus aryabhattai BA03[J].Current Microbiology,2020,77(5):702-709. doi:10.1007/s00284-019-01856-9.
[18] Chen Y F,Ye J R,Kong Q Q. Potassium-solubilizing activity of Bacillus aryabhattai SK1-7 and its growth-promoting effect on Populus alba L.[J].Forests,2020,11(12):1348.doi:10.3390/f11121348.
[19] Oksińska M P,Magnucka E G,Lejcus′ K,Pietr S J. Biodegradation of the cross-linked copolymer of acrylamide and potassium acrylate by soil bacteria[J].Environmental Science and Pollution Research,2016,23(6):5969-5977. doi:10.1007/s11356-016-6130-6.
[20] Pal Roy M,Datta S,Ghosh S. A novel extracellular low-temperature active phytase from Bacillus aryabhattai with potential application in plant growth[J].Biotechnology Progress,2017,33(3):633-641. doi:10.1002/btpr.2452.
[21] Bhattacharyya C,Bakshi U,Mallick I,Mukherji S,Bera B,Ghosh A. Genome-guided insights into the plant growth promotion capabilities of the physiologically versatile Bacillus aryabhattai strain AB211[J].Frontiers in Microbiology,2017,8:411. doi:10.3389/fmicb.2017.00411.
[22] Balakrishna Pillai A,Jaya Kumar A,Thulasi K,Kumarapillai H. Evaluation of short-chain-length polyhydroxyalkanoate accumulation in Bacillus aryabhattai[J].Brazilian Journal of Microbiology,2017,48(3):451-460. doi:10.1016/j.bjm.2017.01.005.
[23] Verma D K,Hasan S H,Singh D K,Singh S,Singh Y. Enhanced biosorptive remediation of hexavalent chromium using chemotailored biomass of a novel soil isolate Bacillus aryabhattai ITBHU02:Process variables optimization through artificial neural network linked genetic algorithm[J].Industrial & Engineering Chemistry Research,2014,53(9):3669-3681.doi:10.1021/ie404266k.
[24] 刘军生,解修超,罗阳兰,邓百万,柏秋月,燕孟琛,白星.抗镉内生细菌阿耶波多氏芽孢杆菌的分离鉴定及生物学特性[J].生物技术通报,2019,35(2):64-72. doi:10.13560/j.cnki.biotech.bull.1985.2018-0803.
Liu J S,Xie X C,Luo Y L,Deng B W,Bai Q Y,Yan M C,Bai X. Isolation,identification,and biological characteristics of a cadmium-resistant endophytic bacteria Bacillus aryabhattai[J].Biotechnology Bulletin,2019,35(2):64-72.
[25] 杨丽,燕传明,贺卓,盛下放,何琳燕. 重金属耐性芽孢杆菌的筛选及其对辣椒吸收镉铅的阻控效应[J].农业环境科学学报,2018,37(6):1086-1093. doi:10.11654/jaes.2017-1473.
Yang L,Yan C M,He Z,Sheng X F,He L Y. Effect of heavy metal-tolerant spore-forming bacteria on the cadmium and lead uptake of pepper[J].Journal of Agro-Environment Science,2018,37(6):1086-1093.
[26] Kushwaha P,Kashyap P L,Kuppusamy P,Srivastava A K,Tiwari R K. Functional characterization of endophytic bacilli from pearl millet(Pennisetum glaucum)and their possible role in multiple stress tolerance[J].Plant Biosystems-an International Journal Dealing With All Aspects of Plant Biology,2020,154(4):503-514. doi:10.1080/11263504.2019.1651773.
[27] Paredes-P liz K I,Pajuelo E,Doukkali B,Caviedes M,Rodr guez-Llorente I D,Mateos-Naranjo E. Bacterial inoculants for enhanced seed germination of Spartina densiflora:Implications for restoration of metal polluted areas[J].Marine Pollution Bulletin,2016,110(1):396-400. doi:10.1016/j.marpolbul.2016.06.036.
liz K I,Pajuelo E,Doukkali B,Caviedes M,Rodr guez-Llorente I D,Mateos-Naranjo E. Bacterial inoculants for enhanced seed germination of Spartina densiflora:Implications for restoration of metal polluted areas[J].Marine Pollution Bulletin,2016,110(1):396-400. doi:10.1016/j.marpolbul.2016.06.036.
[28] Singh N,Gupta S,Marwa N,Pandey V,Verma P C,Rathaur S,Singh N. Arsenic mediated modifications in Bacillus aryabhattai and their biotechnological applications for arsenic bioremediation[J].Chemosphere,2016,164:524-534.doi:10.1016/j.chemosphere.2016.08.119.
[29] Ghosh P K,Maiti T K,Pramanik K,Ghosh S K,Mitra S,De T K. The role of arsenic resistant Bacillus aryabhattai MCC3374 in promotion of rice seedlings growth and alleviation of arsenic phytotoxicity[J].Chemosphere,2018,211:407-419. doi:10.1016/j.chemosphere.2018.07.148.
[30] 韦献雅,殷丽琴,钟成,章明海,牛应泽. DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322. doi:10.7506/spkx1002-6630-201409062.
Wei X Y,Yin L Q,Zhong C,Zhang M H,Niu Y Z. Advances in the DPPH radical scavenging assay for antioxidant activity evaluation[J].Food Science,2014,35(9):317-322.
