茶(Camellia sinensis(L)O.Kuntze)是我国重要的经济作物之一,因其叶片优异的饮用品质而成为世界三大饮料之一。当前,茶园普遍采用单一的纯茶园栽培模式,造成了土壤退化和土壤微生态环境改变、病虫害加剧、生物多样性以及茶园生产力下降[1-2]。合理的作物多样性种植不仅可以提高养分资源利用、作物产量与品质[3-4],而且还能增加土壤微生物群落的多样性、促进土壤生态系统的营养循环[5-6]。研究已证实,茶园间作种植不同作物均具有明显的养分利用、产量与品质的优势[7-9]。Ma等[10]研究表明,在茶园里间作板栗可以显著提高土壤养分含量和酶活性,改善了土壤生态功能,进而提高茶叶产量与品质。刘腾飞等[11]研究发现,在茶园间作杨梅、枇杷可以提高土壤各养分含量,改良茶园的土壤性质,进而改善茶叶产量与营养品质。因此,在茶园中合理的多样性种植,对茶园土壤生态环境改善、茶叶高效优质生产的可持续发展具有重要意义。
土壤是茶树赖以生长以及养分吸收的重要来源,其中的营养成分的丰缺程度可以直接影响茶树的生长和茶叶品质[12]。微生物作为土壤生态系统中最活跃的组分,参与了土壤养分的周转以及肥力的形成过程,其数量、群落组成以及多样性可以反映土壤肥力的情况[13-14]。韦持章等[15]在茶与大豆间作体系中的研究结果发现,与茶树单作栽培相比,间作大豆后能够显著增加茶树根际微生物数量、增强土壤酶活性,改善了茶树根际微生物群落的组成。李艳春等[16]研究亦发现,在茶园中间作灵芝可以改善土壤的细菌群落结构,并提高了当中有益微生物菌群的相对丰度。然而,目前关于茶园间作系统土壤微生物的研究主要集中在数量、群落结构及酶活性等方面,但对茶园间作系统中土壤微生物群落代谢功能多样性的变化尚不清楚。因此,本研究通过田间试验,采用 Biolog 技术探讨茶树/大豆间作对土壤微生物群落代谢活性及功能多样性的影响,旨在为茶园间作复合生态系统的茶叶高产高效、优质与绿色生产提供更深入的微生物学依据。
1 材料和方法
1.1 供试地点
试验选择以广西南亚热带农业科学研究所的茶园(10 a茶龄)为研究对象,地处崇左市龙州县,地理坐标为22°21′N、106°46′E,海拔125 m,该地区属典型亚热带季风气候,年平均气温22 ℃,年平均降雨量1 273.6 mm以及年平均光照1 251 h。土壤是酸性红壤,其含有碱解氮118.44 mg/kg,速效磷12.68 mg/kg,速效钾144.75 mg/kg,机质11.17 g/kg,pH 值5.05。
供试品种:茶树品种为金萱(Camellia sinensis (L)O. Kuntze.Jinxuan);大豆品种为桂春-3(Glycine max (L.)Merr.Guichun-3)。
1.2 试验设计
试验采用随机区组排列,设单作茶树、单作大豆和茶树/大豆间作3个种植模式,设3个试验重复。茶园采用双行条栽的栽培模式,即大行距 1.20 m,小行距 0.40 m,行内株距 0.33 m。茶园间作处理,即在大行距间种植3行大豆,大豆行距0.40 m,株距0.30 m。茶园根据当地实际生产主要施用氮,磷,钾肥(施用量分别为 450,60,90 kg/m2)以及当地一些常规的有机肥料。在整个试验期间,所有茶园试验小区均采用一致的栽培管理模式。
1.3 土壤样品的采集
于2020年4月采样,采用5点采样法。在距离主根系5 cm处,先轻轻刮去表面土,用土钻采集0~20 cm深的耕层土壤,然后将 5点采集的土壤混合为 1 个样品,并将土样置于 4 ℃冰箱保鲜,用于土壤微生物代谢多样性分析。
1.4 测定项目与方法
采用 Biolog 微平板法对土壤微生物代谢功能多样性进行分析,并选取培养120 h的数据进行土壤微生物碳源利用和主成分分析。
平均颜色变化率(AWCD),用来反映土壤微生物的代谢活性,公式为AWCD=∑(Ci-Ri)/n;
土壤微生物群落多样性用 Shannon多样性指数(H)、Simpson 优势度指数(D)、均匀度指数(E)和群落丰富度指数(S)等来表示,公式如下:
H=-∑Pi(lnPi)
E=H/lnS
S=被利用碳源的总数
式中,Ci 为每一个微孔的光密度值,Ri 为对照孔的吸光值,n为 ECO 板上的31种碳源; Pi 为第 i孔的相对吸光值与整个平板相对吸光值总和的比率,即 Pi=(Ci-Ri)/∑(Ci-Ri);S 为微生物群落利用碳源种类的数目,即颜色变化孔数。
1.5 统计分析
采用Microsoft Excel 2010软件处理原始数据及绘图。土壤微生物群落代谢多样性的主成分分析利用Microsoft Excel 2010加载Multibase软件进行。
2 结果与分析
2.1 茶-大豆间作对土壤微生物活性的影响
平均颜色变化率(AWCD)可以表征土壤微生物群落的代谢活性,是评价土壤微生物群落碳源利用程度的重要指标之一[17]。由图1-A可以看出,在茶与大豆间作系统中,土壤微生物的平均颜色变化率值在 24 h 之前变化很小,且间作处理略低于单作处理。在24~192 h内,平均颜色变化率值开始快速增长且间作茶树和大豆的平均颜色变化率值均高于单作处理,随后缓慢增加直至趋于稳定,其中间作大豆的 AWCD 值较高,单作茶树最低。
在培养 120 h 时(如图1-B),间作茶树根系土壤微生物群落的平均颜色变化率值比单作茶树显著增加11.52%,间作大豆根系土壤微生物群落的平均颜色变化率值亦比单作大豆显著提高12.99%。此外,无论单作还是间作种植下,大豆根际微生物的平均颜色变化率值均高于茶树。综上结果说明,间作大豆能够提高了茶树根际土壤微生物群落对碳源利用的能力,进而提高土壤微生物群落的代谢活性。
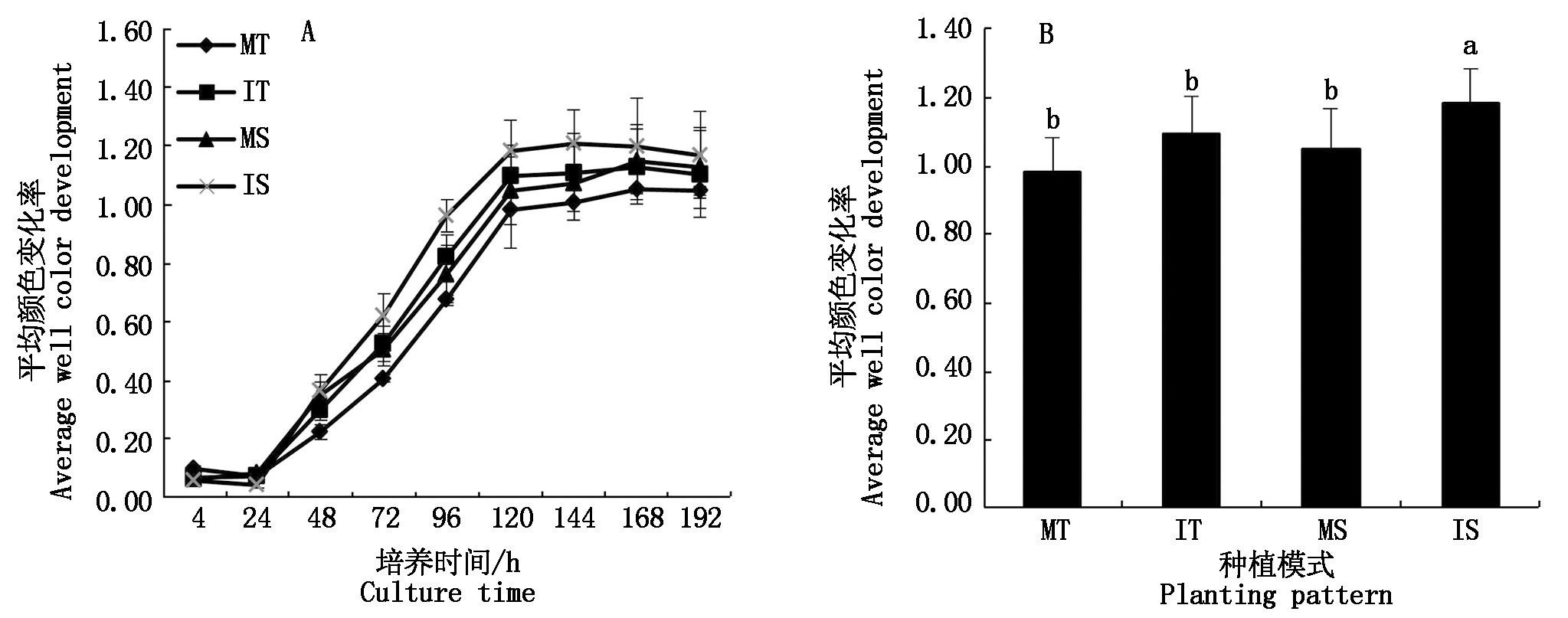
MT. 单作茶树;IT.间作茶树;MS.单作大豆;IS.间作大豆;不同小写字母表示单、间作处理平均颜色变化率的显著性差异(P<0.05)。图2-5同.
MT. Monocropped tea ;IT. Intercropped tea;MS.Monocropped soybean ;IS.Intercropped soybean. Different lowercase letters
indicated significant difference between AWCD of monocropped and intercropped treatments(P<0.05).The same as Fig.2-5.
图 1 间作对平均颜色变化率的影响
Fig.1 Effects of tea and soybean intercropping on average well color development
2.2 茶-大豆间作系统土壤微生物群落对6类碳源利用的差异
明确土壤中微生物对各种碳源的利用能力差异,能够更全面地了解土壤中微生物群落的代谢特征[18]。在茶与大豆间作复合模式中,茶树土壤微生物群落以利用糖类、氨基酸类、羧酸类及胺类等4类碳源为主,对聚合物类和酚酸类碳源的利用则相对弱一些,而大豆土壤微生物的碳源利用模式与茶树相一致。
茶与大豆间作影响着土壤微生物群落对6类碳源的利用能力(图2,3),其中茶树和大豆土壤微生物群落对 6 类碳源的利用模式有一些差异。与茶树单作栽培模式相比,间作大豆后提高了茶树土壤微生物群落对羧酸类、聚合物类、酚酸类及胺类等4类碳源的利用强度,其中聚合物类和酚酸类这两类碳源的利用强度分别显著提高了24.47%,141.67%。间作同样提高了大豆土壤微生物群落对糖类、聚合物类、羧酸类和酚酸类等4类碳源的利用,分别较单作大豆提高了1.02%,81.91%,53.19%,59.13%,其中羧酸类、聚合物类和酚酸类在单、间作间达到差异显著性水平。
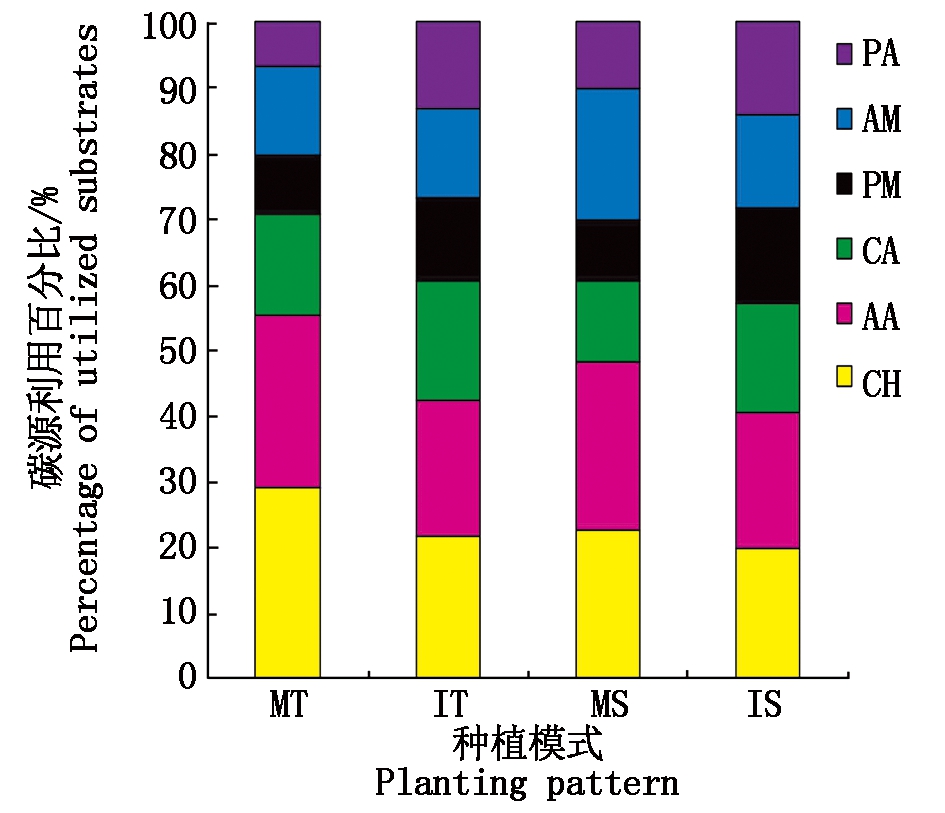
CH.糖类;AA.氨基酸类;CA.羧酸类;PM.聚合物类;
AM.胺类;PA.酚酸类。图3同。
CH.Carbohydrates;AA.Amino acids;CA.Carboxylic acids;
PM.Polymers;AM.Amines/amides;
PA.Phenolic acids.The same as Fig.3.
图 2 土壤微生物对碳源利用百分比
Fig.2 Percentage of utilized carbon
sources by soil microorganisms
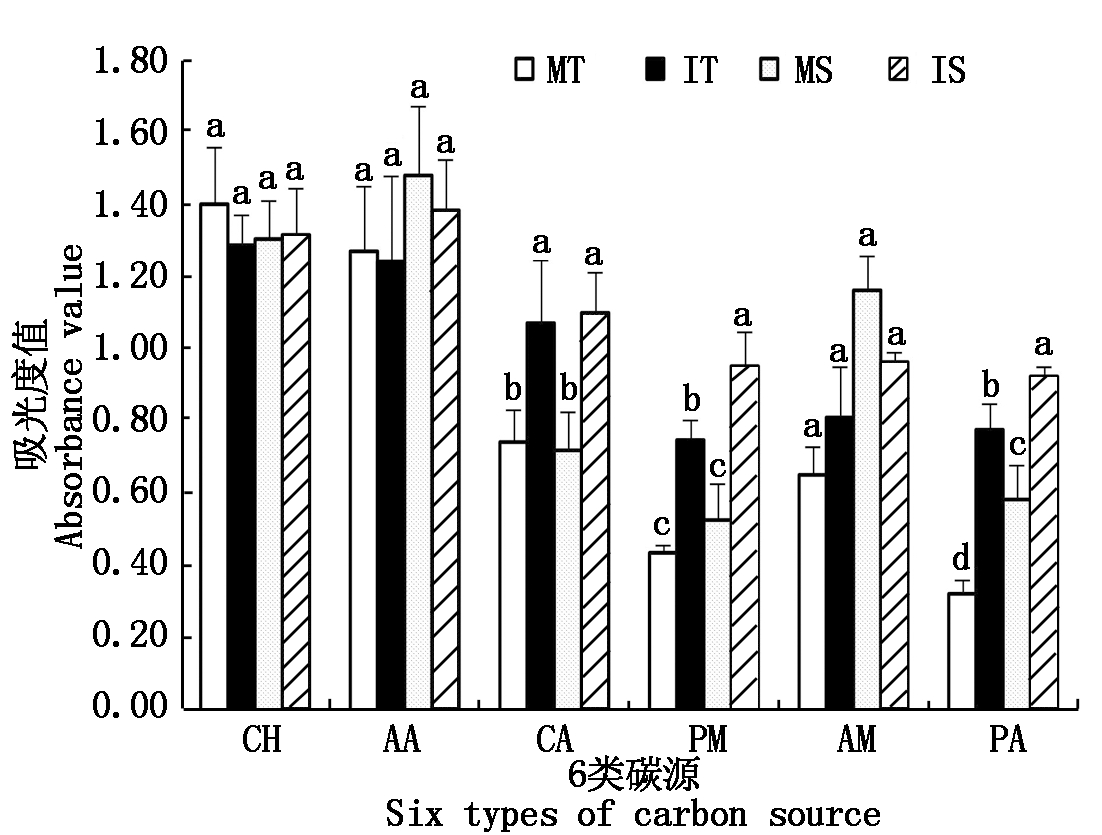
图3 土壤微生物对6类碳源的利用强度
Fig.3 Utilization intensity of soil microorganisms
to six types of carbon source
2.3 茶-大豆间作系统土壤微生物对单一碳源利用率的差异
土壤微生物对Biolog ECO平板上不同碳源利用能力的图被定义为Biolog 代谢指纹图谱。如图4 所示,与单作茶树相比,间作茶树土壤微生物对α-D-乳糖、β-甲基-D-葡萄糖苷、D-木糖、D-甘露醇、D,L-α-磷酸甘油等糖类碳源的利用强度增强,其中α-D-乳糖显著提高13.87%,D-木糖显著提高83.77%,D-甘露醇7.65%;间作茶树土壤微生物对D-半乳糖醛酸、D-葡糖氨酸、α-酮丁酸及D-苹果酸等羧酸类碳源的利用提高,其中D-半乳糖醛酸显著增加87.27%,D-葡糖氨酸显著增加369.35%,D-苹果酸显著增加70.61%;间作茶

图4 茶-大豆间作条件下土壤微生物对31 种碳源利用的特征
Fig.4 Utilized characteristics of 31 carbon sources by soil microorganisms in tea and soybean intercropping
树土壤微生物对L-精氨酸、L-苯丙氨酸的利用显著提高64.95%,180.97%;间作茶树土壤微生物对吐温40、环糊精的利用显著增加224.22%,322.74%;间作茶树土壤微生物对2-羟基苯甲酸、4-羟基苯甲酸的利用亦显著提高289.40%,129.64%。
与单作大豆相比,间作显著提高了大豆土壤微生物群落对D-木糖、i-赤藓糖醇与D-半乳糖酸-γ内酯等3类糖类的碳源利用强度335.00%,179.82%,140.21%,对β-甲基-D-葡萄糖苷的利用略有增加但不显著;间作提高了大豆土壤微生物对丙酮酸甲酯、D-葡糖氨酸、D-半乳糖醛酸、γ-羟丁酸、衣康酸及D-苹果酸等羧酸类碳源的利用,其中D-半乳糖醛酸显著增加30.14%,衣康酸显著增加326.61%,D-苹果酸显著增加79.41%;间作大豆土壤微生物对L-苯丙氨酸的利用显著提高72.70%,对L-丝氨酸的利用亦有增加但差异不显著;间作显著提高了大豆土壤微生物对吐温40、环糊精及肝糖等聚合物类碳源的利用,分别增加了182.35%,112.27%,95.84%;间作显著提高了大豆土壤微生物对4-羟基苯甲酸的利用强度59.13%,同样显著提高了对腐胺的利用强度。
2.4 茶-大豆间作系统土壤微生物碳源利用多样性的主成分分析
利用主成分分析探明茶与大豆间作系统土壤微生物群落的31种碳源的利用模式(图5-A)。主成分分析结果表明,在PC1上,茶树单、间作、大豆单、间作处理均有很好的分离,单作茶树分布在第一象限,间作茶树分布在第二象限,单作大豆分布在第四象限,间作大豆分布在第三象限;而在PC2上,单作与间作处理间的差异较小。同时,筛选出了茶树与大豆土壤微生物群落利用能力较强的10种碳源(图5-B),分别是i-赤藓糖醇、D,L-α-甘油磷酸,吐温40、α-酮丁酸、2-羟基苯甲酸、4-羟基苯甲酸、L-精氨酸、L-苏氨酸、苯乙胺和腐胺。
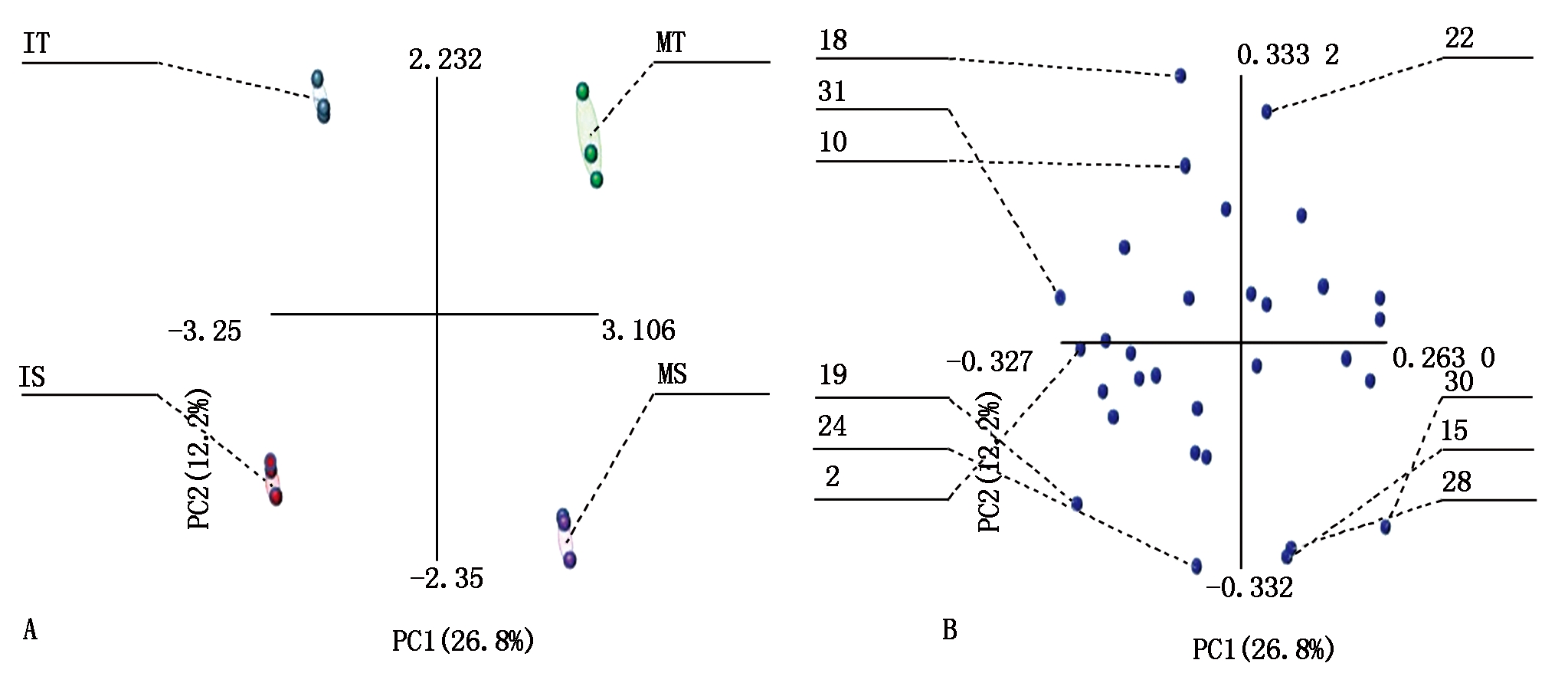
图5 茶-大豆间作条件下土壤微生物碳源利用特征的主成分分析
Fig.5 Principal component analysis of carbon sources utilization profiles by
soil microorganisms in tea and soybean intercropping
初始载荷因子的大小通常可以用来表征主成分与碳源利用之间的相关关系,即载荷因子数值越高,表示该碳源对主成分的影响就越明显。Choi等[19]研究认为,在PC1和PC2上,载荷系数高于0.18或小于-0.18的,可被认为具有较高的载荷量。由表1可以看出,在PC1上载荷较高的碳源有14种,主要包括4个糖类碳源、2个氨基酸类碳源、3个羧酸类碳源、2个聚合物类碳源、2个胺类碳源以及1个酚酸类碳源;在PC2上载荷系数较高的碳源则有9种,主要包括糖类碳源(3个)、氨基酸类碳源(2个)、羧酸类碳源(1个)、酚酸类碳源(2个)和胺类碳源(1个)。综上结果表明,糖类和羧酸类碳源可作为区分单、间作模式间差异的敏感碳源。
表1 ECO 微孔板中在 PC1 和 PC2 上载荷系数较高的主要碳源
Tab.1 The main carbon source with high loading coefficients on PC1 and PC2 in analysis of ECO micro-plate data
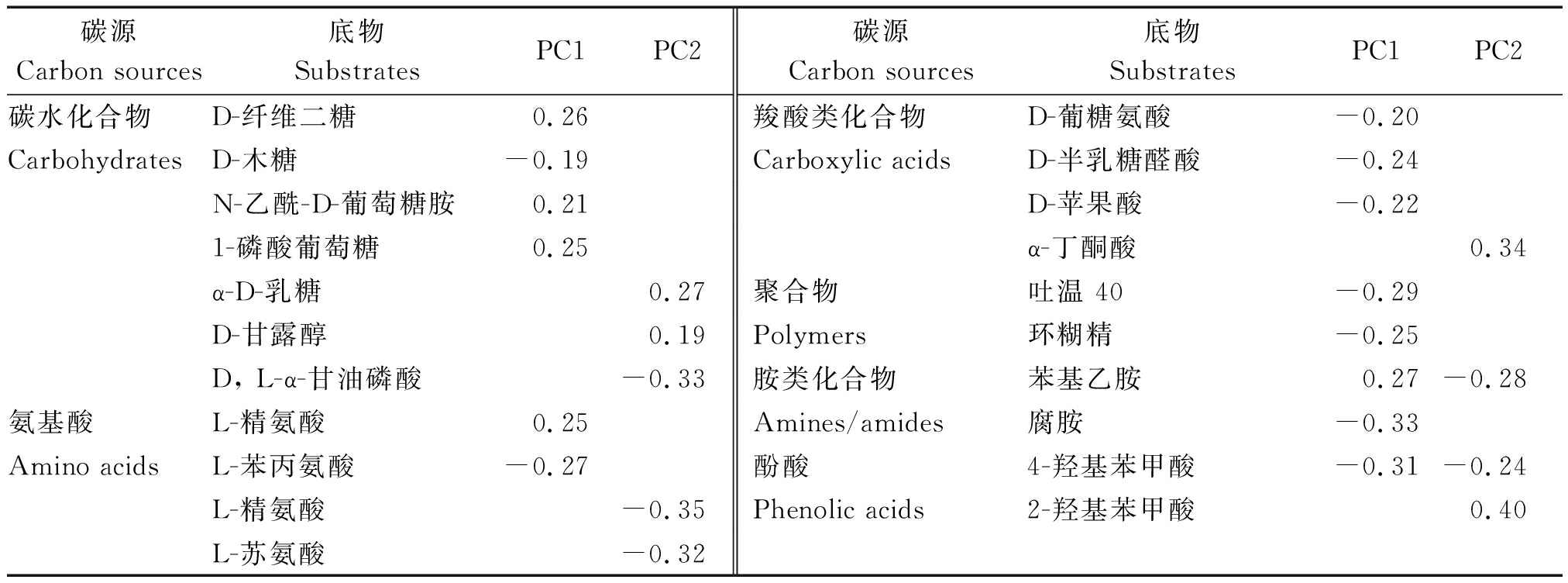
碳源Carbon sources底物SubstratesPC1PC2碳源Carbon sources底物SubstratesPC1PC2碳水化合物D-纤维二糖0.26羧酸类化合物D-葡糖氨酸-0.20CarbohydratesD-木糖-0.19Carboxylic acidsD-半乳糖醛酸-0.24N-乙酰-D-葡萄糖胺0.21D-苹果酸-0.221-磷酸葡萄糖0.25α-丁酮酸0.34α-D-乳糖0.27聚合物吐温 40-0.29D-甘露醇0.19Polymers环糊精-0.25D, L-α-甘油磷酸-0.33胺类化合物苯基乙胺0.27-0.28氨基酸L-精氨酸0.25Amines/amides腐胺-0.33Amino acidsL-苯丙氨酸-0.27酚酸4-羟基苯甲酸-0.31-0.24L-精氨酸-0.35Phenolic acids2-羟基苯甲酸0.40L-苏氨酸-0.32
注:载荷系数<0.18 或>-0.18。
Note:The loading coefficient was>0.18 or<-0.18.
2.5 茶-大豆间作对土壤微生物群落多样性指数的影响
土壤微生物多样性通常用Shannon 多样性指数(H)、Simpson 多样性指数(D)、均匀度指数(E)及丰富度指数(S)等主要参数来评价。由表2可知,在培养120 h,间作茶树土壤微生物群落多样性指数均高于单作茶树,但差异没有达到显著性水平;间作大豆土壤微生物群落多样性指数同样高于单作大豆,其中Shannon 指数(H)、均匀度指数(E)及丰富度指数(S)分别显著增加了12.41%,6.49%,13.51%。说明在茶树与大豆间作复合群体中,土壤微生物群落的丰富度增加、多样性改善,土壤微生物群落对碳源利用的模式更加多样化。
表2 间作对根系土壤微生物群落多样性指数的影响
Tab.2 Effect of tea and soybean intercropping on the diversity indices of soil microbial community
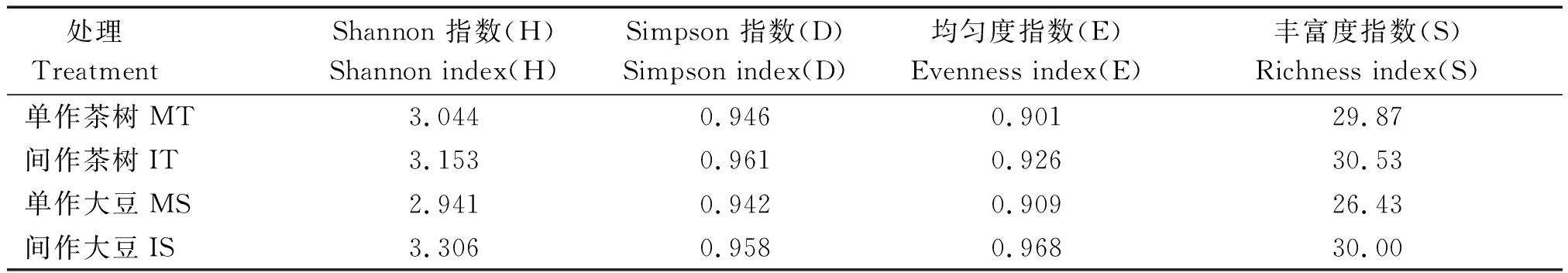
处理 Treatment Shannon 指数(H)Shannon index(H)Simpson 指数(D)Simpson index(D)均匀度指数(E)Evenness index(E)丰富度指数(S)Richness index(S)单作茶树MT3.0440.9460.90129.87间作茶树IT3.1530.9610.92630.53单作大豆MS2.9410.9420.90926.43间作大豆IS3.3060.9580.96830.00
3 讨论与结论
作物多样性种植不仅有利于维持土壤生态系统微生物的平衡,而且能显著提高土壤微生物的数量、代谢活性以及多样性[20-21]。土壤微生物群落的平均颜色变化率值可以用来表征土壤微生物活性的大小,即其值越高,代谢活性越高[18,22]。本试验中,相比于单作种植模式,茶树与大豆间作提高了土壤微生物群落的平均颜色变化率值,这结果与在茶树与白三叶草间作[23]、小麦与蚕豆间作[24]、甘蔗与花生间作[25]等系统中发现的间作提高土壤微生物群落的碳源平均利用率的结果相一致,说明在茶与大豆间作复合生态系统中,根系的交互作用显著提高了茶树和大豆土壤微生物群落的代谢活性。
多样性指数、均匀度指数、丰富度指数和优势度指数等4个常用指数通常被用来反映土壤微生物群落的多样性,可以揭示土壤微生物种群结构和功能的差异[26]。Qin等[27]研究结果发现,与单作种植模式相比,间作可以提高玉米与马铃薯根际土壤微生物群落的Shannon多样性指数及丰富度指数。Kihara 等[28]研究亦表明,在玉米-大豆间作系统中,土壤微生物群落的Shannon指数(H),Simpson指数(D)以及丰富度(S)均显著高于单作处理。相似地,在茶树/大豆间作系统中,本研究结果亦发现,与茶树单作栽培相比,间作大豆提高了茶树土壤微生物群落的Shannon指数(H)、Simpson指数(D)、均匀度指数(E)和丰富度指数(S);同时也提高了大豆土壤微生物群落的多样性指数,这与前人的研究结果一致。可见,茶与大豆间作种植能够改善土壤微生物群落的功能多样性,说明不同作物的合理间作,由于根系的相互作用会释放出更加丰富的根系分泌物,为土壤微生物的繁殖提供更多的能源物质,从而改变了土壤微生物群落结构的多样性。
此外,在茶与大豆间作复合生态系统中,土壤微生物主要对糖类、氨基酸类、羧酸类及胺类等4类碳源的利用较强。与单作种植相比,间作提高了茶树土壤微生物群落对羧酸类、聚合物类、酚酸类和胺类等4类碳源的利用强度,提高了大豆土壤微生物群落对糖类、聚合物类、羧酸类和酚酸类等4类碳源的利用强度。从土壤微生物群落对单一碳源的利用差异来看,间作条件下茶树土壤微生物群落对17种碳源的利用强度高于单作茶树;间作大豆土壤微生物群落同样亦有17种代谢碳源的利用高于单作大豆;其余的代谢碳源均低于单作模式,这些发现表明,茶树与大豆间作改变了土壤微生物的碳源代谢模式,但可能存在一定的负反馈调节作用,说明茶与大豆间作后产生的某些根系分泌物可能抑制了土壤微生物群落对某些碳源的利用,但其具体的作用机制还需进一步研究。
水稻与西瓜间作改变了根系分泌物中糖类、氨基酸和酚酸的组成与种类,更利于土壤微生物的生长繁殖,从而增加了根际土壤微生物群落的多样性[29]。桑树与大豆间作条件下,土壤微生物群落主要以利用糖类、聚合物类和羧酸类这3类碳源为主,并且土壤微生物对这3类碳源的利用模式差异作为区分单作与间作处理间差异主要依据[30]。本试验中,主成分分析结果亦解释了茶与大豆间作系统土壤微生物碳源利用模式的差异。单、间作茶树处理在主成分1(PC1)上出现明显的区分,单、间作大豆处理在PC1上也出现显著的分离;而在PC2上则均没有显著的差异,这些现象表明茶与大豆间作能够显著改变了土壤微生物群落的代谢多样性。茶与大豆间作条件下土壤微生物群落代谢多样性的改善主要是由于土壤微生物群落对PC1上载荷较高的碳源的利用模式差异引起的,其中糖类和羧酸类是 PC1上具有较高载荷的2类碳源,说明糖类和羧酸类是茶树-大豆间作促进土壤微生物多样性改善的敏感碳源,本研究结果与上述研究结果相似。
本试验条件下,与单作栽培模式相比,间作提高了茶树与大豆土壤微生物群落的碳源利用率、多样性指数。在茶与大豆间作系统中,土壤微生物群落对 6 类碳源的利用存在一定的差异,主要对糖类、氨基酸类、羧酸类及胺类等4类碳源的利用较强。主成分分析结果表明,茶树与大豆间作条件下,土壤微生物群落多样性的改善主要源自土壤微生物群落对糖类、羧酸类这2类碳源的利用模式改变。
[1] 尧渝,张厅,马伟伟,李兰英,李春华. 不同间作模式对茶树光合生理及茶叶品质的影响[J].山西农业科学,2016,44(4):470-473.doi:10.3969/j.issn.1002-2481.2016.04.12.
Yao Y,Zhang T,Ma W W,Li L Y,Li C H. Effects of different intercropping patterns on photosynthetic physiology characteristics of tea plants and tea quality[J].Journal of Shanxi Agricultural Sciences,2016,44(4):470-473.
[2] 王晟强,郑子成,李廷轩,李彦. 植茶年限对土壤团聚体中交换性盐基离子分布的影响[J].土壤学报,2013,50(5):1013-1020.doi:10.11766/trxb201210230431.
Wang S Q,Zheng Z C,Li T X,Li Y. Effects of age of tea plantations on distribution of exchangeable base cations in soil aggregates[J].Acta Pedologica Sinica,2013,50(5):1013-1020.
[3] Xiao J X,Yin X H,Ren J B,Zhang M Y,Tang L,Zheng Y. Complementation drives higher growth rate and yield of wheat and saves nitrogen fertilizer in wheat and faba bean intercropping[J].Field Crops Research,2018,221:119-129.doi:10.1016/j.fcr.2017.12.009.
[4] 王宇蕴,李兰,郑毅,汤利. 基于根系形态对磷吸收的贡献解析小麦||蚕豆间作促进磷吸收的作用[J].中国生态农业学报(中英文),2020,28(7):954-959.doi:10.13930/j.cnki.cjea.200163.
Wang Y Y,Li L,Zheng Y,Tang L. Contribution of root morphology to phosphorus absorption in wheat and faba bean intercropping system[J].Chinese Journal of Eco-Agriculture,2020,28(7):954-959.
[5] 覃潇敏,郑毅,汤利,龙光强. 玉米与马铃薯间作对根际微生物群落结构和多样性的影响[J].作物学报,2015,41(6):919-928.doi:10.3724/SP.J.1006.2015.00919.
Qin X M,Zheng Y,Tang L,Long G Q. Effects of maize and potato intercropping on rhizosphere microbial community structure and diversity[J].Acta Agronomica Sinica,2015,41(6):919-928.
[6] 董艳,董坤,汤利,郑毅,杨智仙,肖靖秀,赵平,胡国彬. 小麦蚕豆间作对蚕豆根际微生物群落功能多样性的影响及其与蚕豆枯萎病发生的关系[J].生态学报,2013,33(23):7445-7454.doi:10.5846/stxb201208281214.
Dong Y,Dong K,Tang L,Zheng Y,Yang Z X,Xiao J X,Zhao P,Hu G B. Relationship between rhizosphere microbial community functional diversity and faba bean fusarium wilt occurrence in wheat and faba bean intercropping system[J].Acta Ecologica Sinica,2013,33(23):7445-7454.
[7] Duan Y,Shen J Z,Zhang X L,Wen B,Ma Y C,Wang Y H,Fang W P,Zhu X J. Effects of soybean-tea intercropping on soil-available nutrients and tea quality[J].Acta Physiologiae Plantarum,2019,41(8):140-146.doi:10.1007/s11738-019-2932-8.
[8] 张永志,王淼,高健健,舒先飞,胡轩语,蒋慧光,沈周高,李叶云. 间作鼠茅对茶园杂草抑制效果和茶叶品质与产量指标的影响[J].安徽农业大学学报,2020,47(3):340-344.doi:10.13610/j.cnki.1672-352x.20200706.009.
Zhang Y Z,Wang M,Gao J J,Shu X F,Hu X Y,Jiang H G,Shen Z G,Li Y Y. Effects of intercropping Vulpia myuros on weed control and indexes of tea quality and production[J].Journal of Anhui Agricultural University,2020,47(3):340-344.
[9] 王慧敏,蔡洪月,何蓉蓉,赵飞. 间作芳香地被植物对茶园土壤理化性状及养分的影响[J].西南林业大学学报,2016,36(5):71-77.doi:10.11929/j.issn.2095-1914.2016.05.012.
Wang H M,Cai H Y,He R R,Zhao F. Effects of intercropping of aromatic plants with tea on physicochemical properties and soil nutrients in tea plantation[J].Journal of Southwest Forestry University,2016,36(5):71-77.
[10] Ma Y H,Fu S L,Zhang X P,Zhao K,Chen H Y H. Intercropping improves soil nutrient availability,soil enzyme activity and tea quantity and quality[J].Applied Soil Ecology,2017,119:171-178.doi:10.1016/j.apsoil.2017.06.028.
[11] 刘腾飞,董明辉,张丽,顾俊荣,张国芹,钱辉. 不同间作模式对茶园土壤和茶叶营养品质的影响[J].食品科学技术学报,2017,35(6):67-76.doi:10.3969/j.issn.2095-6002.2017.06.011.
Liu T F,Dong M H,Zhang L,Gu J R,Zhang G Q,Qian H. Effects of different intercropping patterns on tea-planted soil and tea nutritional quality[J].Journal of Food Science and Technology,2017,35(6):67-76.
[12] Yuan L,Wang S S,Wang Z H,Huang J G. Tea-grown soils and tea quality in Sichuan and Chongqing,China [J].Pedosphere,2000,10(1):45-52.
[13] 李培培,黄柯铭,申凤敏,仝昊天,田志强,韩燕来. 绿肥间作与氮肥减施对砂姜黑土微生物的影响[J].华北农学报,2020,35(4):145-152.doi:10.7668/hbnxb.20190912.
Li P P,Huang K M,Shen F M,Tong H T,Tian Z Q,Han Y L. Effects of intercropping green manure and nitrogen reduction on microbial community of lime concretion black soil[J].Acta Agriculturae Boreali-Sinica,2020,35(4):145-152.
[14] 李金婷,黄少欣,韦持章,农玉琴,陈远权,廖春文,覃潇敏. 不同氮素营养水平对茶树根际土壤微生物的影响及其在养分调控中的作用[J].华北农学报,2019,34(S1):281-288.doi:10.7668/hbnxb.20190114.
Li J T,Huang S X,Wei C Z,Nong Y Q,Chen Y Q,Liao C W,Qin X M. Effects of different nitrogen levels on tea rhizosphere microbial community and its role in adjusting soil nutrients[J].Acta Agriculturae Boreali-Sinica,2019,34(S1):281-288.
[15] 韦持章,农玉琴,陈远权,陈海生,韦锦坚,李金婷,陆金梅,覃潇敏. 茶树/大豆间作对根际土壤微生物群落及酶活性的影响[J].西北农业学报,2018,27(4):537-544.doi:10.7606/j.issn.1004-1389.2018.04.010.
Wei C Z,Nong Y Q,Chen Y Q,Chen H S,Wei J J,Li J T,Lu J M,Qin X M. Effects of tea and soybean intercropping on soil microbial community and enzyme activity[J].Acta Agriculturae Boreali-occidentalis Sinica,2018,27(4):537-544.
[16] 李艳春,林忠宁,陆烝,刘明香. 茶园间作灵芝对土壤细菌多样性和群落结构的影响[J].福建农业学报,2019,34(6):690-696.doi:10.19303/j.issn.1008-0384.2019.06.010.
Li Y C,Lin Z N,Lu Z,Liu M X. Microbial diversity and community structure in soil under tea bushes-Ganoderma lucidum intercropping[J].Fujian Journal of Agricultural Sciences,2019,34(6):690-696.
[17] Diosma G,Aulicino M,Chidichimo H,Balatti P A. Effect of tillage and N fertilization on microbial physiological profile of soils cultivated with wheat[J].Soil and Tillage Research,2006,91(1/2):236-243.doi:10.1016/j.still.2005.12.008.
[18] Weber K P,Grove J A,Gehder M,Anderson W A,Legge R L. Data transformations in the analysis of community-level substrate utilization data from microplates[J].Journal of Microbiological Methods,2007,69(3):461-469.doi:10.1016/j.mimet.2007.02.013.
[19] Choi K H,Dobbs F C. Comparison of two kinds of Biolog microplates(GN and ECO)in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods,1999,36(3):203-213.doi:10.1016/S0167-7012(99)00034-2.
[20] 刘亚军,马琨,李越,杜春凤,李倩,李贺,马玲,汪春明. 马铃薯间作栽培对土壤微生物群落结构与功能的影响[J].核农学报,2018,32(6):1186-1194.doi:10.11869/j.issn.100-8551.2018.06.1186.
Liu Y J,Ma K,Li Y,Du C F,Li Q,Li H,Ma L,Wang C M. Effect of different intercropping cultivation patterns of potato on the structure and function of soil microorganism community[J].Journal of Nuclear Agricultural Sciences,2018,32(6):1186-1194.
[21] 代真林,汪娅婷,姚秀英,张晋豪,王彦芳,姚博,魏兰芳,姬广海. 玉米大豆间作模式对玉米根际土壤微生物群落特征、玉米产量及病害的影响[J].云南农业大学学报(自然科学),2020,35(5):756-764.doi:10.12101/j.issn.1004-390X(n).201910045.
Dai Z L,Wang Y T,Yao X Y,Zhang J H,Wang Y F,Yao B,Wei L F,Ji G H. Effects of maize/soybean intercropping on the microbial community characteristics of maize rhizosphere soil,maize yield and diseases[J].Journal of Yunnan Agricultural University(Natural Science),2020,35(5):756-764.
[22] Anderson T H. Microbial eco-physiological indicators to asses soil quality[J].Agriculture,Ecosystems & Environment,2003,98(1/2/3):285-293.doi:10.1016/S0167-8809(03)00088-4.
[23] 徐华勤,肖润林,宋同清,罗文,任全,黄瑶. 稻草覆盖与间作三叶草对丘陵茶园土壤微生物群落功能的影响[J].生物多样性,2008,16(2):166-174.doi:10.3321/j.issn:1005-0094.2008.02.009.
Xu H Q,Xiao R L,Song T Q,Luo W,Ren Q,Huang Y. Effects of mulching and intercropping on the functional diversity of soil microbial communities in tea plantations[J].Biodiversity Science,2008,16(2):166-174.
[24] 杨智仙,汤利,郑毅,董坤,董艳. 不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J].植物营养与肥料学报,2014,20(3):570-579.doi:10.11674/zwyf.2014.0307.
Yang Z X,Tang L,Zheng Y,Dong K,Dong Y. Effects of different wheat cultivars intercropped with faba bean on faba bean Fusarium wilt,root exudates and rhizosphere microbial community functional diversity[J].Journal of Plant Nutrition and Fertilizers,2014,20(3):570-579.
[25] 郑亚强,杜广祖,李亦菲,陈斌,李正跃,肖关丽. 间作甘蔗对玉米根际微生物功能多样性的影响[J].生态学杂志,2018,37(7):2013-2019.doi:10.13292/j.1000-4890.201807.008.
Zheng Y Q,Du G Z,Li Y F,Chen B,Li Z Y,Xiao G L. Effects of intercropping sugarcane on functional diversity of maize rhizosphere microorganisms[J].Chinese Journal of Ecology,2018,37(7):2013-2019.
[26] 田春杰,陈家宽,钟扬. 微生物系统发育多样性及其保护生物学意义[J].应用生态学报,2003,14(4):609-612.
Tian C J,Chen J K,Zhong Y. Phylogenetic diversity of microbes and its perspectives in conservation biology [J].Chinese Journal of Applied Ecology,2003,14(4):609-612.
[27] Qin X M,Zheng Y,Tang L,Long G Q. Crop rhizospheric microbial community structure and functional diversity as affected by maize and potato intercropping[J].Journal of Plant Nutrition,2017,40(17):2402-2412.doi:10.1080/01904167.2017.1346674.
[28] Kihara J,Martius C,Bationo A,Thuita M,Lesueur D,Herrmann L,Amelung W,Vlek P L G. Soil aggregation and total diversity of bacteria and fungi in various tillage systems of sub-humid and semi-arid Kenya[J].Applied Soil Ecology,2012,58:12-20.doi:10.1016/j.apsoil.2012.03.004.
[29] Hao W Y,Ren L X,Ran W,Shen Q R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp.niveum[J].Plant and Soil,2010,336(1/2):485-497.doi:10.1007/s11104-010-0505-0.
[30] 李鑫,张会慧,岳冰冰,金微微,许楠,朱文旭,孙广玉. 桑树-大豆间作对盐碱土碳代谢微生物多样性的影响[J].应用生态学报,2012,23(7):1825-1831.doi:10.13287/j.1001-9332.2012.0209.
Li X,Zhang H H,Yue B B,Jin W W,Xu N,Zhu W X,Sun G Y. Effects of mulberry-soybean intercropping on carbon-metabolic microbial diversity in saline-alkaline soil[J].Chinese Journal of Applied Ecology,2012,23(7):1825-1831.
