高尿酸血症(Hyperuricemia,HUA)是一种嘌呤代谢紊乱引起的代谢性疾病,受遗传和环境两方面影响。在正常嘌呤饮食状态下,当不同日 2 次血尿酸水平女性高于0.6 mg/L(357 μmol/L),男性高于0.7 mg/L(420 μmol/L)时被定为高尿酸血症。高尿酸血症是痛风、糖尿病、高血压等多种慢性疾病的重要枢纽[1]。《中国高尿酸及痛风趋势白皮书》(2021)指出,我国高尿酸血症患病率总体呈逐年上升且呈现年轻化的趋势。高尿酸血症的患病人群约 1.77 亿,总体患病率为 13.3%,其中 18~25 岁患病率占 22%,26~35 岁患病率占 38%,35~45 岁患病率占 26%。这给社会公共健康带来巨大的挑战。因此,如何预防和治疗高尿酸血症成为当今全球关注的焦点。
高尿酸血症是一种与饮食密切相关的疾病,食疗对改善患者高尿酸血症及提高患者生活质量具有一定辅助作用。植物活性物质是指人们通过物理或化学的方法以植物(植物全部或某一部分)为原料提取或加工而来的一种或多种具有生物活性的物质。不同植物中含有多种不同的成分。研究表明,从植物中提取的黄酮类、皂苷类、多糖类、多酚类等活性物质能够通过抑制尿酸合成关键酶活性、调控OAT1、ABCG2、OAT3、 GLUT9、URAT1等尿酸转运蛋白表达,发挥调控尿酸代谢的作用,从而改善高尿酸血症及其并发症[2]。
近年来,尤其是屠呦呦研发青蒿素获诺贝尔奖后,越来越多的研究致力于从植物中挖掘具有降尿酸活性的天然物质,结合次生基因组学、代谢组学以及植物活性成分作用靶标的蛋白组学,探究植物活性物质对嘌呤代谢和尿酸合成的干预和影响。基于此,本研究对近年来国内外药食同源植物活性物质调节尿酸代谢的作用机制进行综述,旨在为调节体内嘌呤代谢的天然降尿酸产品的研究和开发提供理论基础。
1 食品摄入与尿酸代谢的关系
嘌呤是一种含氮的双化合物,在人体中主要以嘌呤核苷酸的形式存在。人体内嘌呤主要来源于膳食摄入、体内合成及核酸分解,其中外源膳食摄入是主要影响因子[3]。在代谢过程中,嘌呤核苷酸在单核苷酸酶的作用下生成相应的核苷,核苷在嘌呤核苷磷酸化酶的作用下生成相应的嘌呤,嘌呤在脱氨酶或氧化酶的作用下转化为黄嘌呤,最终黄嘌呤在黄嘌呤氧化酶分解氧化后转化成尿酸。正常情况下,人体每天尿酸生成与排泄能够保持恒定,其中 2/3 由肾脏随尿液排出;剩余部分从粪便排出或在肠道内被细菌分解[4]。尿酸作为体内嘌呤代谢的末端代谢产物,当体内嘌呤代谢异常或尿酸排泄受阻时,体内血尿酸浓度升高,从而导致高尿酸血症。其发病机制多样,一方面主要有尿酸产生过多:嘌呤代谢增加、外源嘌呤摄入过多和(或)内源嘌呤产生过多;另一方面由于尿酸代谢减少:肾小球滤过率降低、肾小管重吸收增加或肾小球再分泌减少。由于尿酸盐水溶性有限,当过量的尿酸在体内存留,直至尿酸盐达到饱和、结晶和沉积时就会引起体内血清尿酸浓度升高。因此,了解尿酸在人体中代谢过程是预防和治疗高尿酸血症的前提。
2 高尿酸血症化学合成药物治疗的概述
尿酸是嘌呤核苷酸代谢的最终产物,高尿酸血症的病理生理基础与嘌呤代谢异常有关。目前治疗高尿酸血症的药物大致可分为 4 类:①减少尿酸合成的药物,即黄嘌呤氧化酶(Xanthine oxidase,XO)抑制剂、新型黄嘌呤氧化酶抑制剂和 PNP 抑制剂,如别嘌醇、和非布司他;②促进尿酸排泄的药物,即尿酸转运体抑制剂,如雷西那德;③促进尿酸分解的药物,即催化尿酸转化为水溶性高、较易排泄的药物,如培戈洛酶;④消炎镇痛等辅助药物,包括秋水仙碱和阿那白滞素。不同类型治疗高尿酸血症的药物副作用严重,见表 1。
表1 常见降尿酸药物及其毒副作用
Tab.1 Common uric acid lowering drugs and their side effects
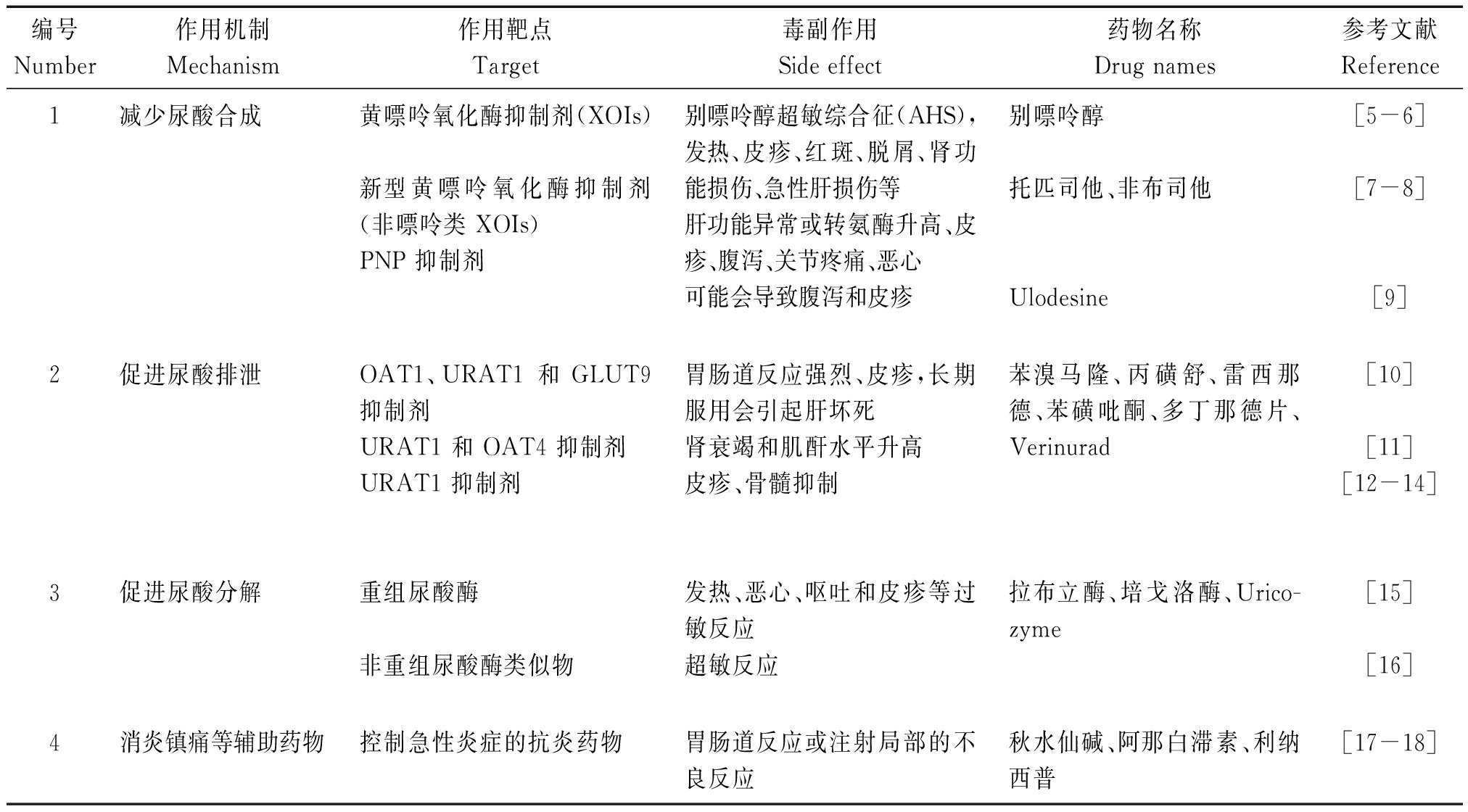
编号Number作用机制Mechanism作用靶点Target毒副作用Side effect药物名称Drug names参考文献Reference1减少尿酸合成黄嘌呤氧化酶抑制剂(XOIs)新型黄嘌呤氧化酶抑制剂(非嘌呤类 XOIs)PNP 抑制剂别嘌呤醇超敏综合征(AHS),发热、皮疹、红斑、脱屑、肾功能损伤、急性肝损伤等肝功能异常或转氨酶升高、皮疹、腹泻、关节疼痛、恶心可能会导致腹泻和皮疹别嘌呤醇托匹司他、非布司他Ulodesine[5-6][7-8][9]2促进尿酸排泄OAT1、URAT1 和GLUT9 抑制剂URAT1 和 OAT4 抑制剂URAT1 抑制剂胃肠道反应强烈、皮疹,长期服用会引起肝坏死肾衰竭和肌酐水平升高皮疹、骨髓抑制苯溴马隆、丙磺舒、雷西那德、苯磺吡酮、多丁那德片、Verinurad[10][11][12-14]3促进尿酸分解重组尿酸酶非重组尿酸酶类似物发热、恶心、呕吐和皮疹等过敏反应超敏反应拉布立酶、培戈洛酶、Urico-zyme[15][16]4消炎镇痛等辅助药物控制急性炎症的抗炎药物胃肠道反应或注射局部的不良反应秋水仙碱、阿那白滞素、利纳西普[17-18]
3 药食同源植物活性物质对尿酸代谢调控
3.1 植物活性物质提取与动物模型建造
植物活性物质提取主要来源于水果、蔬菜和药用植物的根、茎、叶、花和果实,且不同提取部位活性物质含量存在一定差异。它们是植物体内关键的次生代谢物,能够预防心血管疾病,抗衰老、抗氧化、消炎、抗突变作用等。植物活性物质有效提取是实现其药用价值的关键环节。传统的植物活性物质提取方法缺陷为溶剂(甲醇、乙醇、水等)提取法,成本低、易操作,但提取周期长、能耗大、提取率及纯度均较低等。近年来,植物活性物质提取方法主要有:超声辅助提取法、酶辅助提取法、连续逆流提取法、微波辅助提取法、超临界流体萃取法和加压液体提取法等,与传统溶剂提取相比,新方法在提取率、能耗、提取周期等方面均具有明显优势。总之,每种方法都有优缺点。由于植物活性物质种类繁多,结构复杂,在提取有效成分时应根据其特性,采取 2 种或 2 种以上方法相结合以实现高效提取率。
目前,大多数试验选用啮齿类动物(大鼠或小鼠),通过选择基因突变动物或化学诱导造模方式建立高尿酸血症模型。遗传突变动物模型优点在于其模拟人类高尿酸血症相关基因的多态性和遗传变异,但因死亡率高、成本高应用受限。化学诱导造模没有UOX或尿酸转运体缺失,更适用于药物筛选和应用。其主要是通过增加尿酸摄入、抑制尿酸排泄、增加尿酸前体物质及多种方法联合,诱导机体代谢混乱引发高尿酸血症[19-20]。相较于基因突变动物模型,其选择范围广、操作性强。因啮齿类动物能够分解尿酸氧化酶,故尿酸氧化酶抑制剂-氧嗪酸钾(PO)被广泛用于制备高尿酸血症模型。此外,多种方法联合造模也是较常用的方式,这种方式不仅可缓解某些高尿酸血症造模药物对肾脏等器官造成的损害,而且方法灵活多样,可根据疾病发展阶段选用不同造模药物或采用多种方法联合造模。
3.2 植物活性成分调节嘌呤代谢作用机理
植源性天然产物主要来自植物的根、茎、叶等组织器官,这些天然产物种类多样,主要包括多酚类、黄酮类及皂苷类等。根据“结构决定性质,性质决定功能”的理论,可知植物活性成分可同时具备多重功效[21],比单一靶标临床药物更有疗效,它是从机体整体性出发,利用多靶标预防疾病。随着人们对高尿酸血症病理、生理学理解层次的深入,发现该病并不是单一因素引起的。这种复杂慢性疾病治疗的目标是调节病理状态,控制疾病表现,从而延缓高尿酸血症的病情进展。网络药理学以系统生物学为基础结合高通量多组学、生物信息学和网络分析等技术,筛选药物分子作用靶点,评估植物活性成分对高尿酸血症的干预和影响,预测其调节高尿酸血症的信号通路和分子机制,揭示“疾病-基因-靶点-药物”之间的生物网络关系。
3.2.1 抑制尿酸合成 除外源摄入高嘌呤食物引起尿酸升高外,还能够通过调节嘌呤代谢过程中的关键酶,抑制尿酸的合成[22]。研究表明,许多果蔬提取物能够不同程度抑制XO活性,比如高良姜、紫苏叶及香椿叶等抑制效果较好。香椿叶 70% 乙醇提取物对XO抑制效果最强,其中化合物1,2,3,4,6-五-o-没食子酰-d-吡喃糖是一种可逆的非竞争性XO抑制剂[23]。费强等[24]通过体外对XO活性抑制及体内小鼠尿酸值探究高良姜降尿酸的有效部位,结果发现相较于其他极性部位,高良姜提取物萃取的乙酸乙酯部位降尿酸效果最好,并且其高剂量组(153±9.87)μmol/L降尿酸效果与模型组(156±7.2)μmol/L相当,对治疗高尿酸血症具有潜在开发价值。Wang 等[25]通过抑制动力学实验发现存在于水果和蔬菜中,山奈酚能够插入XO活性位点,占据酶的催化中心,避免底物的进入,引起XO构象的改变,从而以竞争性的方式可逆地抑制了XO活性。芥子酸是广泛存在于果蔬、谷物、油料作物及药用植物中的重要代谢产物[26]。Muhammad 等[27]探究了芥子酸对高尿酸血症的影响,试验表明,芥子酸不仅能够抑制血清和肝脏XO活性,并且呈剂量依赖性,在50,100 mg/kg 体重能够降低血清和尿液尿酸水平。这可能与其较高的黄酮含量相关。此外还有研究发现,从茶、藜蒿、山药及洋葱中提取物能够显著抑制尿酸合成关键酶的活性,从而实现降尿酸的作用。不同植物降尿酸的调控机制不同,具体作用机制见表 2。
表2 植物活性物质抑制黄嘌呤氧化酶的作用机制
Tab.2 Mechanism of inhibition of xanthine oxidase by bioactive substances

编号Number植物活性成分Plant activeingredients实验模型 Laboratorymodel调控机理Regulation mechanism参考文献Reference1绿茶多酚KM 小鼠绿茶多酚能够抑制 XO 活性,增加OAT1、OAT3及降低 URAT1 表达,从而实现降低血清和肝脏中尿酸的作用[28] 2藜蒿提取物KM 小鼠藜蒿醇提物具有显著降尿酸作用,并能抑制 XO 活性,这与其富含多种C2-C3 双键的黄酮类物质的有关[29]3山药提取物ICR 小鼠山药提取物能够显著降低尿酸水平,并且抑制肝脏XO活性[30]4槲皮素KM 小鼠从洋葱中分离提取的槲皮素有较强的抗氧化活性和XO抑制活性[31]
3.2.2 促进尿酸排泄 由于机体代谢产生的尿酸主要通过肾脏和肠道排出,所以尿酸排泄减少是增加患高尿酸血症风险的重要因素。植物活性成分具有降尿酸的作用[32]。目前,已发现多种转运蛋白参与肾脏近曲小管尿酸的转运过程,包括重吸收蛋白和分泌蛋白,比如 OAT、GLUT9、URAT1、ABCG2 等[33]。比如甜菊提取物能够通过与高尿酸血症小鼠肠道尿酸转运体 ABCG2 和 GLUT9相互作用增加肠道尿酸排泄[34]。还有研究发现,肉桂皮和野菊花的混合提取物 DKB114 具有抑制尿酸生成和促进尿酸排泄双重作用,这是由于它在抑制抑制XO活性,且下调URAT1、GLUT9的表达[35]。根据有关文献报道,近年来木瓜、紫薯、柠檬、薯蓣、菊苣等植物提取物能够通过调控尿酸转运体蛋白的表达来促进尿酸排泄,从而达到降尿酸的作用,其调控尿酸代谢的机理见表 3。
表3 植物活性物质促进尿酸排泄的作用机制
Tab.3 Mechanism of bioactive substances promoting uric acid excretion

3.2.3 肾保护作用 尿酸性肾病是一种免疫相关性疾病,这是由于高尿酸血症引起尿酸盐沉积于肾脏所引起的肾脏损伤。近年来这种并发症的发病率日益升高。大量研究表明,黄酮类化合物能够调节尿酸代谢保护肾损伤。落新妇苷能够通过抑制硫氧还蛋白互作蛋白(TXNIP)及其相关炎症信号通路的表达,防止肾脏损伤。这与 IL-1β 和IL-18 的上调有关,并通过抑制氧化应激表现出肾保护作用[44]。桑叶总黄酮能够干预腺嘌呤诱导模型大鼠尿酸水平和肾损伤的作用[45]。绿原酸能够通过减少高尿酸模型大鼠血清肌酐和尿素氮的含量,实现对肾脏的保护[46]。槲皮素是存在于植物中的一种天然黄酮类化合物,能够显著降低高尿酸血症合并肾损伤模型大鼠的血清尿酸水平,改善肾功能及减轻肾脏病变。山楂原花青素是原花青素中的多酚低聚体,能够有效降低胰岛素抵抗(IR)肾病模型大鼠的肾脏功能,降低 IR 大鼠尿液中肌酐、尿素氮及尿酸水平,从而对肾起到一定保护作用[47]。这些研究表明,黄酮类化合物在治疗高尿酸血症上具有一定的潜力,但相应的分子机制还有待进一步深入研究。还有研究发现芹菜素能够上调高尿酸血症小鼠肾脏 mOCT1、mOCT2、mOCTN1 和 mOCTN2 的表达,下调肾脏 mURAT1 水平,降低肾脏尿酸盐重吸收,从而改善模型小鼠血尿酸浓度[48]。白藜芦醇广泛存在与浆果、葡萄皮等水果中。作为一种非黄酮类多酚化合物的白藜芦醇影响尿酸在肾内转运,它能够通过下调 URAT1 mRNA 的表达,从而降低尿酸在肾细胞中的重吸收[49]。甜菜碱还可上调高尿酸血症小鼠肾脏有机阳离子转运体 OCT1/2蛋白和有机阳离子/肉毒碱转运体OCTN1/2蛋白的表达水平,改善高尿酸血症小鼠的肾功能[50]。
3.2.4 减轻炎症 高尿酸血症是一种常见慢性病,其特征是单钠尿酸(MSU)晶体沉积于关节或皮下组织,引起急性炎症发作或慢性关节炎。NLRP3炎性小体和 IL-1β 是痛风炎症通路的重要参与者。已有研究证明,植物化学物质对NLRP3炎症小体介导的痛风及其并发症具有积极作用[51]。Tai 等[52]从红茶中分离纯化了TF、TFDG和TF-3-g 3个茶黄素单体在防治高尿酸血症方面具有潜在的应用前景。研究发现,茶黄素主要单体降低高尿酸血症小鼠血清尿酸作用。他们抑制ADA和XOD的活性,下调GLUT9和URAT1的基因和蛋白表达,上调OAT1的基因和蛋白表达以及ABCG2、OCTN1、OCT1/2和OAT2的基因表达。降低高尿酸小鼠血清BUN和Cr值,改善高尿酸小鼠肾损害。其机制可能与减少炎症细胞数量和激活Nrf2/HO-1通路有关。萝卜硫素是广泛存在于十字花科(如花椰菜、卷心菜等)中的重要代谢产物,它能够阻断肝细胞中 NLRP 3 炎症小体的形成从而有效缓解痛风炎症发作[53]。白藜芦醇除了保护肾脏外,还能够改善痛风炎症。Yang 等[54]研究发现白藜芦醇能够改善痛风患者外周血细胞中 SIRT1 的mRNA 和蛋白水平,减少IL-1β的体外释放,从而缓解痛风性炎症。枸杞提取物能够抑制血管内皮细胞 TNF-α、IL-1 2种炎症因子的表达,改善尿酸对血管内皮细胞的损伤[55]。
综上所述,发现调节嘌呤代谢生理活性的天然产物结构类型多样,如黄酮类、皂苷类、生物碱类、多糖类等。这些植物活性物质能够通过上调OAT1、ABCG2、OAT3促进尿酸排泄和分解、下调 GLUT9、URAT1表达减少尿酸生成、抑制尿酸合成关键酶活性、抑制尿酸诱发的炎症和肾保护作用等方面对尿酸代谢进行调控。
4 结语
药食同源植物活性物质具有多环节、多层次、多靶点特点,可引发多效性。在预防和治疗慢性疾病领域展示出了良好的应用前景。近年来高尿酸血症呈高发趋势,其所引发的各种并发症已成为当今社会关注的焦点。截至目前,大量研究利用动物模型和细胞模型,证实了植物源食品及其提取物具有调节尿酸代谢的作用。这些植物活性物质结构独特,能够与多种尿酸代谢相关的生物分子结合,激活或抑制相关酶、转运蛋白等信号分子,从而参与了尿酸生成、排泄、重吸收等信号。相比合成药物单一作用于某一个特定信号分子,药食同源植物活性物质调控更安全、更多效。然而很多天然提取物及其活性成分尚未明确,植物活性成分调节尿酸代谢的功能及其他生理功能之间的关系尚未阐明。此外,植源性活性物质功能多样,相互之间的协同和拮抗作用还有待进一步研究。天然产物是新药设计与研发的重要源泉,因此阐明天然活性物质调节尿酸代谢机理,对开发更健康多效的活性成分产品或膳食配方,防治高尿酸血症新药创制研发提供更有价值的先导化合物。
[1] Yang W X,Ma Y,Hou Y L,Wang Y B,You C G.Prevalence of hyperuricemia and its correlation with serum lipids and blood glucose in physical examination population in 2015-2018:a retrospective study[J].Clinical Laboratory,2019,65(8):1501-1506.doi:10.7754/Clin.Lab.2019.190338.
[2] Luca S V,Macovei I,Bujor A,Miron A,Skalicka-Wozniak K,Aprotosoaie A C,Trifa A.Bioactivity of dietary polyphenols:The role of metabolites[J].Critical Reviews in Food Science and Nutrition,2020,60(4):626-659.doi:10.1080/10408398.2018.1546669.
[3] Frederic L.Gout furonculosis[J].Joint Bone Spine,2019,86(1):103.doi:10.1016/j.jbspin.2018.05.002.
[4] Mandal A K,Mount D B.The molecular physiology of uric acid homeostasis[J].Annual Review of Physiology,2015,77:323-345.doi:10.1146/annurev-physiol-021113-170343.
[5] Stamp L K,Chapman P T,Barclay M,Horne A,Frampton C,Tan P,Drake J,Dalbeth N.Allopurinol dose escalation to achieve serum urate below 6 mg /dL:an open-label extension study[J].Annals of the Rheumatic Diseases,2017,76(12):2065-2070.doi:10.1136/annrheumdis-2017-211873.
[6] Wallace M C,Roberts R L,Nanavati P,Miner J N,Dalbeth N,Topless R,Mirriman T R,Stamp L K.Association between ABCG2 rs2231142 and poor response to allopurinol:replication and meta-analysis[J].Rheumatology,2018,57(4):656-660.doi:10.1093/rheumatology/kex467.
[7] White W B,Saog K G,Becker M A,Borer J S,Gorelick P B,Whelton A,Hunt B,Castillo M,Gunawardhana L.Cardiovascular safety of febuxostat or allopurinol in patients with gout[J].The New England Journal of Medicine,2018,378(13):1200-1210.doi:10.1056/NEJMoa1710895.
[8] Mizukoshi T,Kato S,Ando M,Sobajima H,Ohashi N,Naruse T,Saka Y,Shimizu H,Nagata T,Maruyama S.Renoprotective effects of topiroxostat for hyperuricaemic patients with overt diabetic nephrop-athy study(ETUDE study):a prospective,randomized,multicentre clinical trial[J].Nephrology,2018,23(11):1023-1030.doi:10.1111/nep.13177.
[9] Yang X J,Huang X,Tian Z,Wang P,Li P H,Zhang J W.Establishment of a novel hyperuricemia animal model using mice and assessment of hyporuricemia action of PNP inhibitor Ulodesine[J].Chinese Pharmacological Bulletin,2017,33(6):883-886.doi:10.3969/j.issn.1001-1978.2017.06.027.
[10] Hanvivadhanakul P,Akkasilpa S,Deesomchok U.Efficacy of benzbromarone compared to allopurinol in lowering serum uric acid level in hyperuricemic patients[J].Journal of the Medical Association of Thailand,2002,85(S1):S40-S47.
[11] Shen Z C,Lee C A,Wallach K,Valdez S,Wilson D M,Kerr B,Gillen M.Lesinurad:evaluation of pharmacokinetic and pharmacodynamic interactions with warfarin in healthy volunteers[J].Clinical Pharmacology in Drug Development,2019,8(5):657-663.doi:10.1002/cpdd.662.
[12] Ishikawa T,Takahashi T,Taniguchi T,Hosoya T.Dotinurad:a novel selective urate reabsorption inhibitor for the treatment of hyperuricemia and gout[J].Expert Opinion on Pharmacotherapy,2021,22(11):1397-1406.doi:10.1080/14656566.2021.1918102.
[13] Stack AG,Dronamraju N,Parkinson J,Johansson S,Johnsson E,Erlandsson F,Terkeltaub R.Effect of intensive urate lowering with combined verinurad and febuxostat on albuminuria in patients with type 2 diabetes:a randomized trial[J].American Journal of Kidney Diseases,2021,77(4):481-489.doi:10.1053/j.ajkd.2020.09.009.
[14] Stack A G,Han D,Goldwater R,Johansson S,Dronamraju N,Oscarsson J,Johnsson E,Parkinson J,Erlandsson F.Dapagliflozin added to verinurad plus febuxostat further reduces serum uric acid in hyperuricemia:the QUARTZ study[J].Journal of Clinical Endocrinology & Metabolism,2021,106(5):E2347-E2356.doi:10.1210/clinem/dgaa748.
[15] Lipsky P E,Calabrese L H,Kavanaugh A,Sundy J S,Wright D,Wolfson,Becker M A.Pegloticase immunogenicity:the relationship between efficacy and anti-body development in patients treated for refractory chronic gout[J].Arthritis Research Therapy,2014,16(2):104-108.doi:10.1186/ar4497.
[16] Chiu Y C,Hsu T S,Huang C Y,Hsu C H.Molecular elucidation of a urate oxidase from deinococcus radiodurans for hyperuricemia and gout therapy[J].International Journal of Molecular Sciences,2021,22(11):5611.doi:10.3390/ijms22115611.
[17] Andreis A,Imazio M,Avondo S,Casula M,Paneva E,Piroli F,De Ferrari G M.Adverse events of colchicine for cardiovascular diseases:a comprehensive meta-analysis of 14188 patients from 21 randomized controlled trials[J].Journal of Cardiovascular Medicine,2021,22(8):637-644.doi:10.2459/JCM.0000000000001157.
[18] Sundy J S,Schumacher H R,Kivitz A,Weinstein S P,Wu R,King-Davis S,Evans R R.Rilonacept for gout flare prevention in patients receiving uric acid-lowering therapy:results of RESURGE,a phase Ⅲ,international safety study[J].Journal of Rheumatology,2014,41(8):1703-1711.doi:10.3899/jrheum.131226.
[19] Wang M,Zhao J,Zhang N,Chen J H.Astilbin improves potassium oxonate-induced hyperuricemia and kidney injury through regulating oxidative stress and inflammation response in mice[J].Biomedicine & Pharmacotherapy,2016,83:975-988.doi:10.1016/j.biopha.2016.07.025.
[20] Li L Z,Zhou G X,LI J,Li J,Jiang W,Liu B L,Zhou W.Compounds containing trace element copper or zinc exhibit as potent hyperuricemia inhibitors via xanthine oxidase inactivation[J].Journal of Trace Elements in Medicine and Biology,2018,49:72-78.doi:10.1016/j.jtemb.2018.04.019.
[21] Yousefian M,Shakour N,Hosseinzadeh H,Hayes A W,Hadizadeh F,Karimi G.The natural phenolic compounds as modulators of nadph oxidases in hypertension[J].Phytomedicine,2019,55:200-213.doi:10.1016/j.phymed.2018.08.002.
[22] 张瑛毓,付劢,范海茹,张丽静,王凤忠.具有降尿酸功效的食品研究进展[J].中国食物与营养,2020,26(1):50-53.doi:10.19870/j.cnki.11-3716/ts.2020.01.013.
Zhang Y Y,Fu M,Fan H R,Zhang L J,Wang F Z.Research progress on food with uric acid lowering effects[J].Food and Nutrition in China,2020,26(1):50-53.doi:10.19870/j.cnki.11-3716/ts.2020.01.013.
[23] Yuk H J,Lee Y S,Ryu H W,Kim S H,Kim D S.Effects of toona sinensis leaf extract and its chemical constituents on xanthine oxidase activity and serum uric acid levels in potassium oxonate-induced hyperuricemic rats[J].Molecules,2018,23(12):3254.doi:10.3390/molecules23123254.
[24] 费强,薛稳来,赵耀鑫,赵玲.超声酶解提取高良姜中高良姜素及降尿酸活性研究[J].食品研究与开发,2018,39(20):50-56.doi:10.3969/j.issn.1005-6521.2018.20.010.
Fei Q,Xue W L,Zhao Y X,Zhao L.Study on the extraction of galangin in alpinia officinarum hance by ultrasonic enzymatic and uric acid reduction activities[J].Food Research and Development,2018,39(20):50-56.
[25] Wang Y J,Zhang G W,Pan J H,Gong D M.Novel insights into the inhibitory mechanism of kaempferol on xanthine oxidase[J].Journal of Agricultural and Food Chemistry,2015,63(2):526-534.doi:10.1021/jf505584m.
[26] Thiel A,Muffler K,Tippkotter N,Suck K,Sohling U,Hruschka S M,Ulber R.A novel integrated downstream processing approach to recover sinapic acid,phytic acid and proteins from rapeseed meal[J].Journal of Chemical Technology and Biotechnology,2015,90(11):1999-2006.doi:10.1002/jctb.4664.
[27] Muhammad I,Arshad M,Ashfaq U R,Oumeddour D Z,Li J Y,Zhao L,Wang C T,Imam H,Muhammad N,Lian Y H.Antihyperuricemic effect of dietary polyphenol sinapic acid commonly present in various edible food plants[J].Journal of Food Biochemistry,2020,44(2):e13111.doi:10.1111/jfbc.13111.
[28] Chen G,Tan M L,Li K K,Leung P C.Green tea polyphenols decreases uric acid level through xanthine oxidase and renal urate transporters in hyperuricemic mice[J].Journal of Ethnopharmacology,2015,175:14-20.doi:10.1016/j.jep.2015.08.043.
[29] 李思慧,万茵,付桂明,张伦宁,黄婧嫣,陈雪洋,李会晓,朱美金.常见蔬菜醇提物对黄嘌呤氧化酶的抑制作用[J].南昌大学学报(理科版),2015,2(39):163-167.doi:10.13764/j.cnki.ncdl.2015.02.012.
Li S H,Wan Y,Fu G M,Zhang L N,Huang J Y,Chen X Y,Li H X,Zhu M J.Inhibitory effects of ethanol extracts of some common vegetables on xanthine oxidase[J].Journal of Nanchang University(Natural Science) ,2015,2(39):163-167.
[30] 祁鑫,王昌禄,李风娟,陈勉华,王玉荣,李专,李亚迪.常见蔬菜提取物对黄嘌呤氧化酶抑制作用的筛选研究[J].现代食品科技,2011,5(27):511-514.doi:10.13982/j.mfst.1673-9078.2011.05.002.
Qi X,Wang C L,Li F J,Chen M H,Wang Y R,Li Z,Li Y D.Inhititory effects of the extracts of some common vegetables on xanthine oxidase[J].Modern Food Science and Technology,2011,5(27):511-514.
[31] Nile S H,Nile A S,Keum Y S,Sharma K.Utilization of quercetin and quercetin glycosides from onion(Allium cepa L.)solid waste as an antioxidant,urease and xanthine oxidase inhibitors[J].Food Chemistry,2017,235:119-126.doi:10.1016/j.foodchem.2017.05.043.
[32] Bobulescu I A,Moe O W.Renal transport of uric acid:evolving concepts and uncertainties[J].Advances in Chronic Kidney Disease,2012,19(6):358-371.doi:10.1053/j.ackd.2012.07.009.
[33] Okada Y,Sim X,Go M J,Wu J Y.Meta-analysis identifies multiple loci associated with kidney function-related trains in east Asian populations[J].Nature Genetics,2012,44(8):904-909.doi:10.1038/ng.2352.
[34] Mehmood A,Zhao L,Wang C T,Hossen I,Raka R N,Zhang H M.Stevia residue extract increases intestinal uric acid excretion via interactions with intestinal urate transporters in hyperuricemic mice[J].Food & Function,2019,10(12):7900-7912.doi:10.1039/c9fo02032b.
[35] Sil L Y,Hyung K S,Joo Y H,Seon K D.DKB114,a mixture of chrysanthemum indicum linne flower and cinnamomum cassia(L.)J.presl bark extracts,improves hyperuricemia through Inhibition of xanthine oxidase activity and increasing urine excretion[J].Nutrients,2018,10(10):1381.doi:10.3390/nu10101381.
[36] Zhu C,Xu Y,Liu Z H,Wan X C,Li D X,Tai L L.The anti-hyperuricemic effect of epigallocatechin-3-gallate(EGCG)on hyperuricemic mice[J]. Biomedicine & Pharmacotherapy,2018,97:168-173.doi:10.1016/j.biopha.2017.10.013.
[37] Zhang R,Zhan S Y,Li S Y,Zhu Z Z,He J R,Lorenzo J M,Barba F J.Anti-hyperuricemic and nephroprotective effects of extracts from Chaenomeles sinensis(Thouin)Koehne in hyperuricemic mice[J]. Food & Function,2018(9):5778-5790.doi:10.1039/c8fo01480a.
[38] Zhang Z C,Su G H,Luo C L,Pang Y L,Wang L,Xing L,Wen J H,Zhang J L.Effects of anthocyanins from purple sweet potato(Ipomoea batatas L.cultivar Eshu No.8)on the serum uric acid level and xanthine oxidase activity in hyperuricemic mice[J].Food & Function,2015,6(9):3045-3055.doi:10.1039/c5fo00499c.
[39] Chen L,Li M,Wu J L,Li J X,Ma Z C.Effect of lemon water soluble extract on hyperuricemia in a mouse model[J].Food & Function,2019,10(9):6000-6008.doi:10.1039/c9fo00509a.
[40] Zhu L R,Dong Y F,Na S,Han R,Wei C Y,Chen G L.Saponins extracted from dioscorea collettii rhizomes regulate the expression of urate transporters in chronic hyperuricemia rats[J].Biomedicine & Pharmacotherapy,2017,93:88-94.doi:10.1016/j.biopha.2017.06.022.
[41] Wang Y,Lin Z J,Zhang B,Nie A Z,Bian M.Cichorium intybus L.promotes intestinal uric acid excretion by modulating ABCG2 in experimental hyperuricemia[J].Nutrition & Metabolism,2017,14:38.doi:10.1186/s12986-017-0190-6.
[42] Jiang Y,Lin Y,Hu Y J,Song X J,Pan H H,Zhang H J.Caffeoylquinic acid derivatives rich extract from Gnaphalium pensylvanicum willd.Ameliorates hyperuricemia and acute gouty arthritis in animal model[J].BMC Complementary and Alternative Medicine,2017,17(2):320.doi:10.1186/s12906-017-1834-9.
[43] Zuo J Y,He H M,Zuo Z Y,Bou C N,Löbenberg R.Erding formula in hyperuricemia treatment:unfolding traditional Chinese herbal compatibility using modern pharmaceutical approaches[J].Journal of Pharmacy and Pharmacology,2018,70(1):124-132.doi:10.1111/jphp.12840.
[44] Wang M,Zhao J,Zhang N,Chen J H.Astilbin improves potassium oxonate-induced hyperuricemia and kidney injury through regulating oxidative stress and inflammation response in mice[J].Biomedicine & Pharmacotherapy,2016,83:975-988.doi:10.1016/j.biopha.2016.07.025.
[45] 王珂,王瑞坡,李姣,赵頔,王洁琼,冉霞,瞿伟菁.桑叶黄酮对腺嘌呤诱导大鼠高尿酸血症肾损伤的防治作用[J].天然产物研究与开发,2012,24:172-175,202.
Wang K,Wang R P,Li J,Zhao D,Wang J Q,Ran X,Qu W J.The preventive and therapeutic effects of mulberry leaf flavonoids on adenine induced hyperuricemia and kidney injury in rats[J].Natural Product Research and Development,2012,24:172-175,202.
[46] 朱大帅.薏仁中多酚类化合物降尿酸活性及其作用机制研究[D].广州:华南理工大学,2015.
Zhu D S.In vitro and in vivo studies on phenolic compounds from adlay-derived seed:serum uric acid suppression and the mechanisms[D].Guangzhou:South China University of Technology,2015.
[47] 宓伟,王淇,李小真,张丽,孙璐璐,李朋朋,王芮.山楂原花青素及维生素 C 联合应用对胰岛素抵抗大鼠肾脏保护作用[J].中草药,2017,21(48):4479-4483.doi:10.7501/j.issn.0253-2670.2017.21.018.
Mi W,Wang Q,Li X Z,Zhang L,Sun L L,Li P P,Wang R.Effects of hawthorn proanthocyanidins and vitamin C on kidney protection in insulin-resistance rats[J].Chinese Traditional and Herbal Drugs,2017,21(48):4479-4483.
[48] 缪明星,王星,陆琰,王欣.芹菜素对氧嗪酸钾盐致高尿酸血症小鼠的降尿酸及肾保护作用机制研究[J].中国药房,2016,27(34):4794-4797.doi:10.6039/j.issn.1001-0408.2016.34.13.
Miao M X,Wang X,Lu Y,Wang X.Mechanism study on effect of apigenin on reducing uric acid ang renal protection in oteracil potassium-induced hyperuricemia mice[J].China Pharmacu,2016,27(34):4794-4797.
[49] T L C,Ching C L,Wen L C,Fung W P.Negative correlation between serum uric acid and kidney URAT1 mRNA expression caused by resveratrol in rats[J].Molecular Nutrition & Food Research,2017,61(10):1601030.doi:10.1002/mnfr.201601030.
[50] Wang M X,Liu Y L,Yang Y,Zhang D M,Kong L D.Nuciferine restores potassium oxonate-induced hyperuricemia and kidney inflammation in mice[J].European Journal of Pharmacology,2015,747:59-70.doi:10.1016/j.ejphar.2014.11.035.
[51] Jhang J J,Lin J H,Yen G C.Beneficial properties of phytochemicals on NLRP3 inflammasome-mediated gout and complication[J].Journal of Agricultural and Food Chemistry,2018,66:765-772.doi:10.1021/acs.jafc.7b05113.
[52] Tai L L,Liu Z H,Sun M H,Xie Q J,Cai X Q,Wang Y,Dong X,Xu Y.Anti-hyperuricemic effects of three theaflavins isolated from black tea in hyperuricemic mice[J].Journal of Functional Foods,2020,66:1-9.doi:10.1016/j.jff.2020.103803.
[53] Gabsik Y,Sang Hyeon Y,Hye Eun L,Han Chang K,Yong Yeon C,Hye Suk L,Joo Young.Suppression of NLRP3 inflammasome by oral treatment with sulforaphane alleviates acute gouty inflammation[J].Rheumatology,2018,57(4):727-736.doi:10.1093/rheumatology/kex499.
[54] Yang Q B,He Y L,Zhong X W,Xie W G,Zhou J G.Resveratrol ameliorates gouty inflammation via upregulation of sirtuin 1 to promote autophagy in gout patients[J].Inflammopharmacology,2019,27:47-56.doi:10.1007/s10787-018-00555-4.
[55] 孙铭,刘春雨,傅文绮,唐营德,刘晓琛,孙佳奇,赵剑.枸杞提取物对慢性高尿酸血症的治疗作用及机制研究[J].中国民族民间医药,2017,24(26):35-37.
Sun M,Liu C Y,Fu W Q,Tang Y D,Liu X S,Sun J Q,Zhao J.Effect and mechanism of Chinese wolfberry extract on serum metabolic substances in mice with chronic hyperuricemia[J].Chinese Journal of Ethnomedicine and Ethnopharma,2017,24(26):35-37.
