菜豆(Phaseolus vulgaris L.)又名豆角,芸豆,四季豆等,豆科(Fabaceae),蝶形花亚科(Faboideae),是一种小叶一年生草本矮生或蔓生植物,色泽翠绿,口感鲜美,是人们日常生活中的常见蔬菜。菜豆中含有丰富的糖、淀粉,蛋白质,膳食纤维,矿物质,纤维素,能够保护肠胃,促进消化,增进食欲,促进血液循环[1]。花色苷属于黄酮类物质,是以黄酮为基础的一类物质,在不同酸碱度或金属离子作用下会呈现出不同的颜色。花色苷主要的作用有清除身体内部自由基、增殖叶黄素、抑制肿瘤、预防癌症、消炎、抑制脂质过氧化和血小板凝集、防治糖尿病、减肥、保护眼睛视力等作用[2]。花色苷的合成和积累受到多种因素的影响,主要分为内因和外因:内因主要包括酶活性、糖代谢的影响,花色苷合成的结构基因、转运和积累相关的基因、调节基因、MicroRNA等;外因主要包括,氮肥,钾肥,pH,温度,光照,植物激素等[3-5]。
芸苔素内酯(Brassinolide,BR)又称油菜素内酯,是一种在自然界中存在的一种甾醇类化合物,被称之为植物的第六大激素,世界普遍认为芸苔素是一种活性最高的高效、广谱、无毒的植物生长激素,广泛的参与了植物生长发育的过程,能够提高植物光合、植物抗逆性等[6]。
芸苔素已在生产中得到广泛的应用,一般多用于促进植物光合作用,提高植物抗逆性等方面,对于芸苔素促进花色苷合成方面及其影响调控机制却鲜有报道[7]。本研究以紫架豆、紫玉架豆为材料,研究花色苷积累与不同浓度芸苔素之间的关系,探究芸苔素在菜豆花色苷合成通路上的影响,为提高菜豆品质,以及探究芸苔素作用机理提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为富含花色苷的紫皮菜豆品种紫架豆(A1)、紫玉架豆(A2),均由河北先凤种业有限公司提供。
1.2 试验设计
试验材料提前30 d,在人工气候培养箱内进行育苗,时间20 d,到菜豆苗生长至两叶一心时定植于山西农业大学园艺学院日光温室内,以盆栽方式进行试验,栽培盆内径为21 cm,高20 cm,每盆装混合基质3 kg。每个处理6盆,每盆1穴,每穴2株,重复3次。每个处理之间行间距50 cm,列间距50 cm。定植后进行常规田间管理。达到伸蔓期时及定植14 d后开始使用芸苔素处理,处理浓度B1:CK,B2:0.05 mg/L,B3:0.1 mg/L,B4:0.15 mg/L,B5:0.20 mg/L[8]。每14 d喷施1次,共喷施3次,分为对应菜豆苗期、伸蔓期、开花结荚期。
1.3 测定指标与方法
使用LI-6400XT便携式光合测定仪(美国LI-COR公司)测定菜豆叶片的光合参数:气孔导度(Stomatal conductanc,Gs)、胞 间CO2浓度(Intercellular carbon dioxide concentration,Ci)、净光合速率(Net photosynthetic rate,Pn)、蒸腾速率(Transpirationrate,Tr) [9] ;叶绿素采用80%丙酮直接浸提法,在光度值645,663,470 nm下比色测定;类黄酮使用硝酸铝法测定[10];多酚使用福林酚法测定[11];豆荚花青素含量使用盐酸甲醇法测定[12];原花青素含量使用盐酸-香草醛法测定[13];花色苷含量使用pH示差法测定[14]。
1.4 统计分析
使用Microsoft Excel 2010处理数据并进行作图,使用SPSS 22.0统计软件进行相关性分析和Duncan法多重比较分析。
2 结果与分析
2.1 不同浓度芸苔素对菜豆叶片光合特性的影响
2.1.1 不同浓度芸苔素处理对菜豆净光合速率(Pn)的影响 净光合速率(Pn)能够直接反映出菜豆植株的叶片光合速率及植株的生长状况。由表1可知,在菜豆苗期喷施芸苔素,各处理差异不显著,但各处理净光合速率(Pn)值均高于空白对照A1B1、A2B1;菜豆伸蔓期喷施芸苔素,处理A1B2、A1B3要显著性高于空白对照A1B1,A2其他处理均高于空白对照,但差异不显著;开花结荚期喷施处理A1B2、A1B5与处理A1B1差异显著,处理A2B2、A2B3、A2B4、A2B5均与处理A2B1差异显著。品种A1和A2间的净光合速率(Pn)并未出现显著差异。由此可以看出,芸苔素在不同时期均会对菜豆光合产生不同程度影响,伸蔓期处理A1B2、A1B3,在开花结荚期处理,A1B2、A1B5、A2B2、A2B5能够显著提高菜豆光合作用。
表1 不同浓度芸苔素处理对菜豆叶片净光合速率的影响
Tab.1 Effects of different concentrations of brassinolide on net photosynthetic rate of kidney bean μmol/(m2·s)
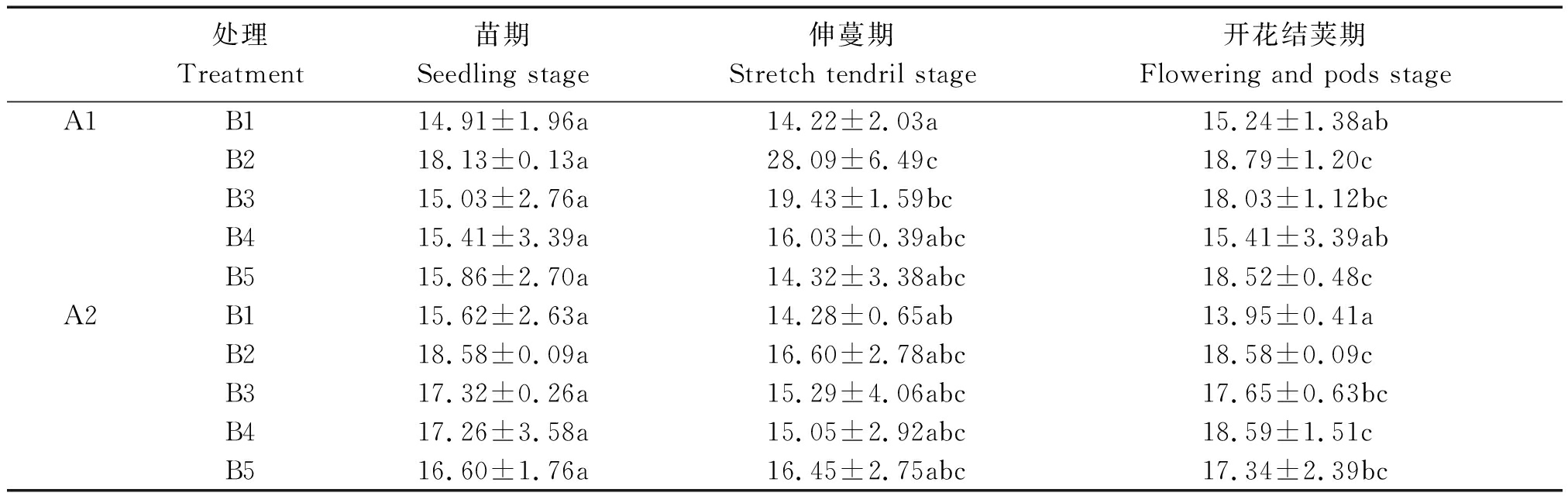
处理Treatment苗期Seedling stage伸蔓期Stretch tendril stage开花结荚期Flowering and pods stageA1B114.91±1.96a14.22±2.03a15.24±1.38abB218.13±0.13a28.09±6.49c18.79±1.20cB315.03±2.76a19.43±1.59bc18.03±1.12bcB415.41±3.39a16.03±0.39abc15.41±3.39abB515.86±2.70a14.32±3.38abc18.52±0.48cA2B115.62±2.63a14.28±0.65ab13.95±0.41aB218.58±0.09a16.60±2.78abc18.58±0.09cB317.32±0.26a15.29±4.06abc17.65±0.63bcB417.26±3.58a15.05±2.92abc18.59±1.51cB516.60±1.76a16.45±2.75abc17.34±2.39bc
注:不同小写字母表示同一时期不同处理在0.05水平差异显著。表2同。
Note:Different lowercase letters indicate significant differences between different treatments at 0.05 level during the same period.The same as Tab.2.
2.1.2 不同浓度芸苔素处理对菜豆叶片蒸腾速率(Tr)的影响 蒸腾作用的强弱能够直观反映出植物光合作用时叶片蒸腾失水的速度。由表2可知,在菜豆苗期喷施芸苔素,处理A1B3显著高于其他处理;在菜豆伸蔓期喷施芸苔素,处理A1B3>A1B4>A1B2>A1B5,均大于空白对照A1B1,并且差异显著,处理A2B5>A2B4>A2B3,均大于处理空白对照A2B1,且差异显著;在菜豆开花结荚期,处理A1B5>A1B3,与空白对照A1B1差异显著,品种A2并未产生显著差异。说明芸苔素在苗期,及开花结荚期对品种A1的影响要大于对品种A2的影响,且浓度B5对蒸腾速率(Tr)影响最大。
表2 不同浓度芸苔素处理对菜豆叶片蒸腾速率的影响
Tab.2 Effects of different concentrations of brassinolide on transpiration rate of bean μmol/(m2·s)
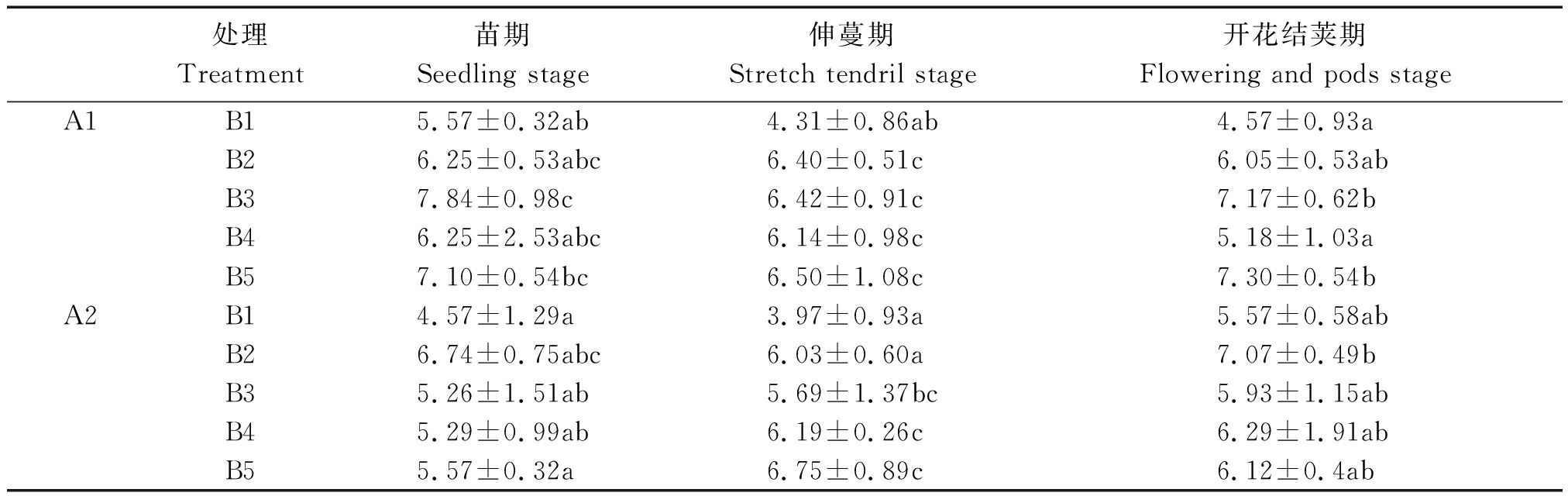
处理Treatment苗期Seedling stage伸蔓期Stretch tendril stage开花结荚期Flowering and pods stageA1B15.57±0.32ab4.31±0.86ab4.57±0.93aB26.25±0.53abc6.40±0.51c6.05±0.53abB37.84±0.98c6.42±0.91c7.17±0.62bB46.25±2.53abc6.14±0.98c5.18±1.03aB57.10±0.54bc6.50±1.08c7.30±0.54bA2B14.57±1.29a3.97±0.93a5.57±0.58abB26.74±0.75abc6.03±0.60a7.07±0.49bB35.26±1.51ab5.69±1.37bc5.93±1.15abB45.29±0.99ab6.19±0.26c6.29±1.91abB55.57±0.32a6.75±0.89c6.12±0.4ab
2.1.3 不同浓度芸苔素处理对菜豆叶片叶绿素含量的影响 叶绿素是植物光合作用的主要色素之一,能够直观反映出植株叶片的光合特性。由图1可知不同浓度芸苔素对菜豆叶片叶绿素含量产生不同程度的影响,品种A1叶绿素含量表现为A1B4>A1B2>A1B3>A1B5>A1B1,处理A1B4与空白处理A1B1差异显著,品种A2叶绿素含量表现为A2B2>A2B3>A2B4>A2B5>A2B1,处理 A2B2、A2B3、A2B5与空白处理A2B1差异显著。品种A1与品种A2相比较,品种A1的叶绿素含量要略高于A2,且处理A1B3的叶绿素含量为最高。
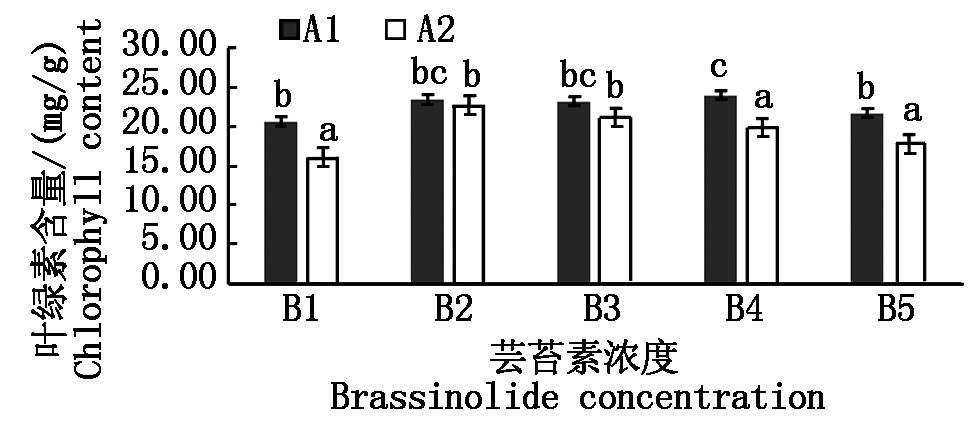
不同小写字母表示0.05水平差异显著。图2-5同。
Different lowercase letters indicate significant
differences treatments at 0.05 level.The same as Fig.2-5.
图1 不同浓度芸苔素处理对菜豆叶绿素含量的影响
Fig.1 Effects of different concentrations of brassinolide
on chlorophyll content of kidney bean
2.2 同浓度芸苔素处理对菜豆豆荚花青素含量的影响
花青素是花色苷合成的前体物质,花青素含量可以较为直观表现出芸苔素对色苷合成的影响。由图2可知品种A2的花青素含量要高于品种A1,且不同浓度的芸苔素对菜豆花色苷合成产生了不同程度的影响。品种A1的表现为A1B3>A1B4>A1B5>A1B2>A1B1,且处理A1B3与空白处理A1B1和处理A1B2差异显著;品种A2表现为A2B3>A2B4>A2B5>A2B2>A2B1,且处理A2B3与空白对照A2B1差异显著。品种A1与品种A2相比较,品种A2的花青素含量要高于品种A1;其中处理A2B3花青素含量为最高。
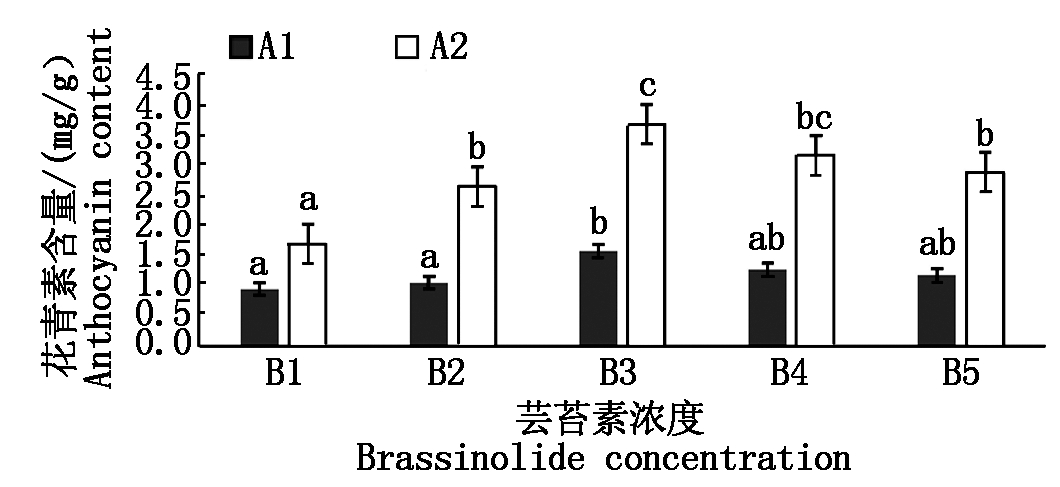
图2 不同浓度芸苔素处理对菜豆花青素含量的影响
Fig.2 Effects of brassinolide treatment at the same
concentration on anthocyanin content in kidney bean
2.3 不同浓度芸苔素处理对菜豆总黄酮含量的影响
花色苷属于黄酮类物质,总黄酮的含量能够较为直观地表现出花色苷合成通路中各物质含量的高低。由图3可知,不同浓度芸苔素对菜豆的总黄酮含量产生不同的影响,品种A2的类黄酮含量要普遍高于品种A1。品种A1 的表现为A1B3>A1B2>A1B1>A1B4>A1B5,处理A1B3与A1B2总黄酮含量高于空白对照A1B1,升高了0.74,0.55 mg/kg且差异显著;品种A2的表现为A2B5>A2B4>A2B3>A2B1>A2B2,处理A2B5、A2B4类黄酮含量分别高于空白对照A2B1 1.5,0.7 mg/kg,且差异显著;其中处理A2B5总黄酮含量最高,相对于对照含量提高了40.24%。
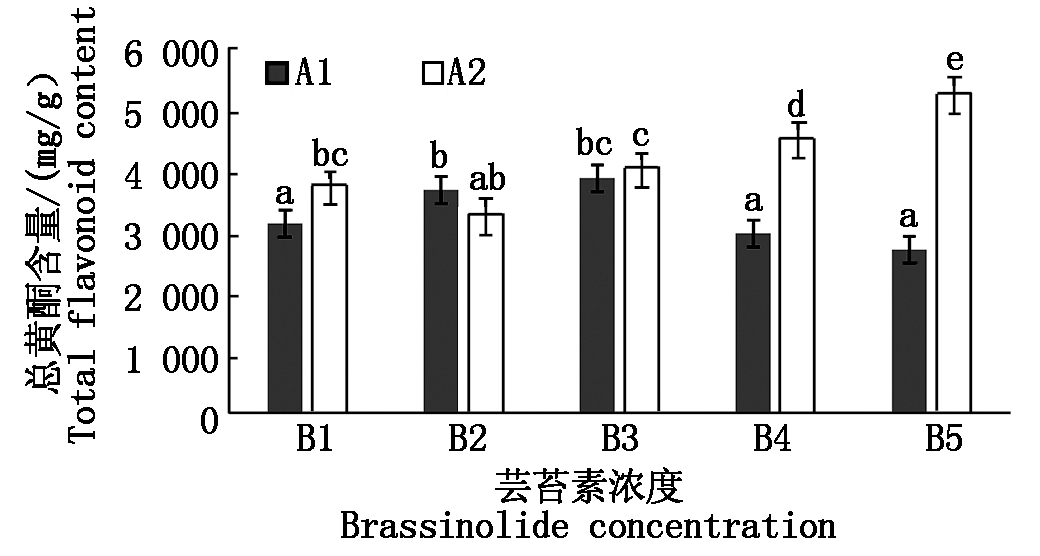
图3 不同浓度芸苔素处理对菜豆总黄酮含量的影响
Fig.3 Effects of different concentrations of Brassinolide
on total flavonoids content in kidney bean
2.4 不同浓度芸苔素处理对菜豆原花青素含量的影响
原花青素是花色苷合成的前体物质,通过花青素合成酶合成花青素,再通过类黄酮糖基转移酶合成花色苷。由图4可知不同浓度芸苔素对菜豆花色苷的合成产生不同的影响,品种A1的表现为 A1B3>A1B4>A1B2>A1B5>A1B1,处理A1B3和A1B4相比较空白对照升高了0.433 4,0.287 93 mg/kg,且差异产生显著。品种A2表现为A2B5>A2B3>A2B4>A2B2>A2B1,处理A2B5和A2B4较空白对照升高了0.27,0.19 mg/kg,产生显著差异,其中A1B3的原花青素含量最高,相较于对照含量提高了46.6%。
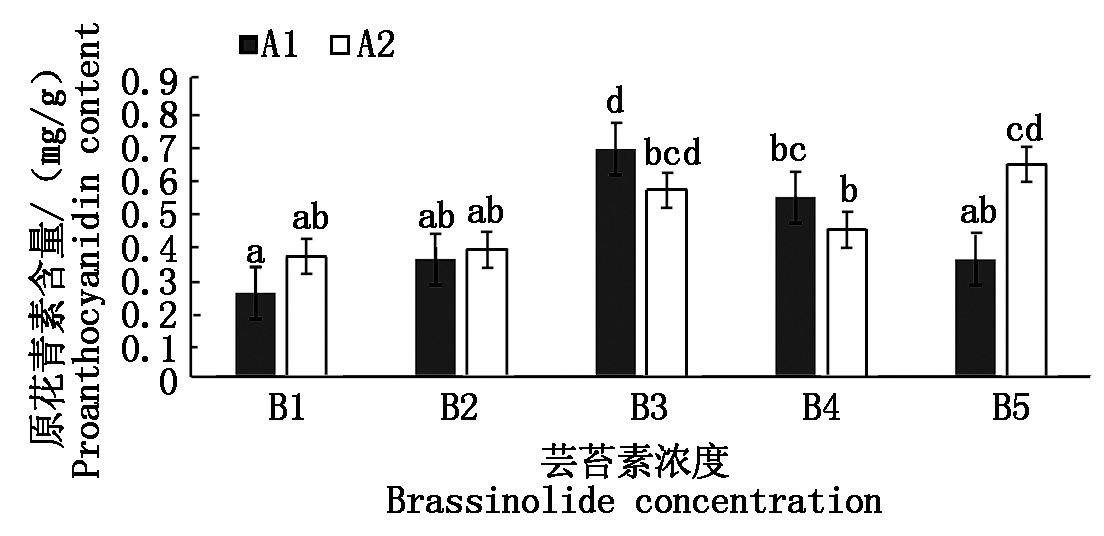
图4 不同浓度芸苔素处理对菜豆原花青素含量的影响
Fig.4 Effect of different concentrations of brassinolide
on the content of procyanidins in Phaseolus vulgaris L
2.5 不同浓度芸苔素处理对菜豆花色苷含量的影响
由图5可知,不同浓度芸苔素处理对菜豆花色苷合成产生不同程度的影响,对品种A2的影响更大,品种A1的表现为A1B3>A1B4>A1B2>A1B5>A1B1,处理A1B3、A1B4、A1B2较空白处理A1B1提高了0.95,1.15,1.22 mg/kg,且差异显著,品种A2表现为A2B4>A2B3>A2B5>A2B2>A2B1,处理A2B4、A2B3和A2B5较空白对照A2B1增大13.77,8.75,4.35 mg/kg,且差异显著,其中处理A1B3的花色苷含量为各处理最高,相较于对照含量提高了90.07%。
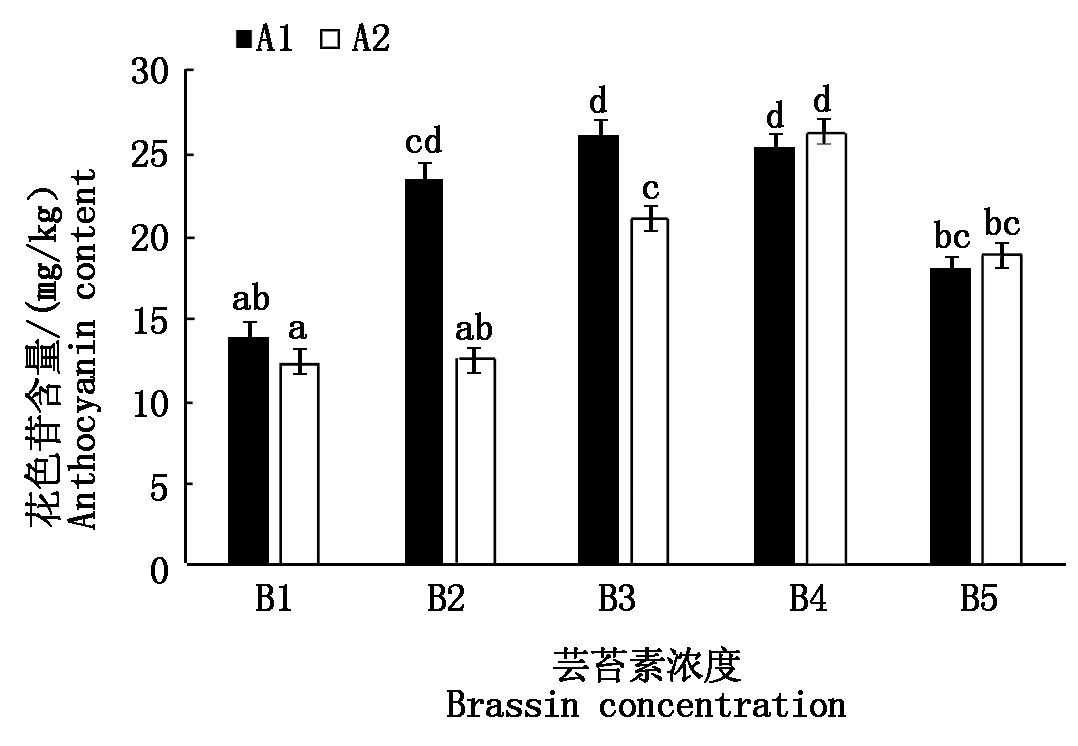
图5 不同浓度芸苔素处理对菜豆花色苷含量的影响
Fig.5 Effects of different concentrations of Brassinolide
on the content of anthocyanins in kidney bean
3 结论与讨论
3.1 不同浓度芸苔素对菜豆光合特性的影响
影响植物花青素合成的原因有光照,光照直接参与到诱导植物花青素的合成,影响植物花青素合成的因素有光的类别、强度、周期等因素,不同的光照条件能够通过影响色苷合成途径中相关酶合成基因的表达来影响植物花色苷的合成[15]。经前人研究发现,芸苔素在促进植物代谢以及光合作用、提高作物抗逆性有重要的作用。菜豆苗期及伸蔓期以营养生长为主,作物代谢旺盛,叶片活力高,不同芸苔素浓度处理产生的影响较小,作物通过光合所产生的养分大多用于作物自身营养生长,菜豆的开花结荚期主要进行生殖生长,光合作用产物除供应菜豆植株正常生长以外主要供应花和豆荚,在作物的开花伸蔓期,通过一段时间的吸收转化调节,外源喷施芸苔素在体内逐渐开始对菜豆光合作用产生影响,本研究表明,相较于不同时期,未喷施芸苔素的菜豆叶片光合作用并未产生显著差异,而喷施芸苔素的处理叶片在伸蔓期、开花结荚期光合作用差异显著增加,但从研究数据可看出,低浓度芸苔素促进光合作用的能力较强,而较高浓度的芸苔素对于作物光合能够起到促进作用,但增加量有限,伸蔓期处理A1B4、A1B5与处理A1B1 光合作用差异不显著,在菜豆开花结荚期处理A2B4、A2B4、A2B4与处理A1B1并未产生显著性差异,本研究结果表明,在菜豆的开花结荚期喷施芸苔素能够显著增加菜豆品种A1叶片的光合能力,但浓度B4、B5并不能显著地增加叶片的光合能力。在葡萄[16]、李、番茄[17]等作物中证实,低浓度芸苔素处理能够显著增加作物叶片的光和能力。
3.2 不同浓度芸苔素对菜豆叶绿素含量的影响
叶绿素存在于叶绿体中,能够将吸收的光能转化为化学能,对光能的传递和转化起到重要的作用,其含量能够评价植物的光合作用强弱程度。不同浓度的芸苔素对菜豆叶绿素浓度产生不同影响,喷施芸苔素能够显著增加菜豆叶片中叶绿素的含量,且较低浓度的芸苔素提高叶片叶绿素含量的效果更好,浓度B2、B3的促进效果为最佳。
3.3 不同浓度芸苔素对菜豆花色苷合成过程的影响
在花色苷合成通路,属于黄酮合成通路的一部分,总黄酮的含量能够大致表现出在花色苷合成过程中通路的物质积累量,可以从侧面反映出花色苷合成的影响。有研究表明,不同浓度的芸苔素处理对总黄酮的含量会产生不同程度的影响,在蓝莓着色期通过喷施0.4 mg/L的芸苔素内酯,能够显著增加果实中总黄酮的含量。在葡萄试验研究中,使用24-表芸苔素内酯喷施果实,会在转色的初期上调了Vv PAL和Vv UFGT的表达[18],并且果皮中单宁、黄酮醇和花色苷含量都有了一定的增加。相反,用芸苔素内酯抑制剂处理葡萄果实,延迟了葡萄果实的成熟和着色[18]。由此表明,芸苔素内脂在类黄酮物质积累以及葡萄成熟过程中发挥着重要的作用。本研究表明,不同品种,喷施不同浓度的芸苔素对菜豆总黄酮含量会产生不同的影响,对于品种A1较低浓度芸苔素处理能够显著增加菜豆中总黄酮的合成,而品种A2则在较高浓度芸苔素处理下显著增加菜豆中总黄酮的合成,说明不同品种的菜豆对芸苔素敏感度不同,但通过芸苔素处理能够较为显著的增加菜豆总黄酮的合成。
在花色苷合成通路上,二氢黄酮醇在类黄酮3′5′-羟化酶(F3′5′H)或者类黄酮3′-羟化酶(F3′H)催化作用下合成二氢杨黄酮或者二氢槲皮素,在二氢黄酮醇4-还原酶(DFR)催化作用下合成原花青素、原花青素在花色素合酶(ANS)催化合成花青素,花青素通过类黄酮糖基转移酶(UFGT)催化合成花色苷[18]。原花青素,花青素含量能够直观表现出花色苷合成过程中的各物质的变化量,以及芸苔素对花色苷合成通路的影响。在酿酒葡萄中研究表明,芸苔素显著影响苯丙氨酸解氨酶(PAL)活性,能够提高葡萄成熟过程中的花青素含量,催化花色素合成的花色素合酶(ANS),与催化原花色素合成的无色花色素还原酶(LAN)有着底物竞争关系[19-20]。本研究表明,不同浓度芸苔素处理对不同菜豆原花青素含量影响不同,综合考量,浓度B3对于各品种原花青素含量增加更加显著;不同浓度芸苔素对于菜豆花青素含量影响也不同,对于品种A1影响较小,但对品种A2的花青素含量影响较大,且浓度B3对菜豆中花青素含量增加最为显著。在最终产物花色苷的含量上,处理A1B3含量最高,并且显著高于对照,而花色苷是花青素经过糖基转移酶合成的,由此可以推断出对于品种A1芸苔素的作用下大量合成花色苷。综上所述,芸苔素对于增加菜豆中花色苷的合成起到了显著的作用。
通过对不同品种菜豆不同浓度芸苔素处理,发现不同浓度芸苔素在菜豆花色苷合成过程中起到了不同程度的影响,芸苔素浓度0.1 mg/L能够显著地提高菜豆的光合作用以及叶片中的叶绿素含量,并且显著提高了菜豆中花青素、原花青素、花色苷的含量,对于芸苔素关于菜豆中花色苷合成的蛋白代谢及分子转录需要进一步的研究[21]。
[1] 高华杰,李雨菲,刚永运,何洪巨. 紫皮豇豆(Vigna unguiculata L.)花色苷的研究[J].食品工业科技,2010,31(3):155-157,161.doi:10.13386/j.issn1002-0306.2010.03.058.
Gao H J,Li Y F,Gang Y Y,He H J. Study on anthocyanins in purple cowpea(Vigna unguiculata L.)[J].Science and Technology of Food Industry,2010,31(3):155-157,161.
[2] 李阳,毕勇毅. 花色苷研究进展[J].公共卫生与预防医学,2009,20(1):53-56.
Li Y,Bi Y Y. Progress on the study of anthocyanidin[J].Journal of Public Health and Preventive Medicine,2009,20(1):53-56.
[3] 丁悦,吴秋云,宋勇,刘明月,熊兴耀,范淑英,黄科. 植物体内花青素累积的外源调控机制研究进展[J].中国农学通报,2014,30(19):86-91.
Ding Y,Wu Q Y,Song Y,Liu M Y,Xiong X Y,Fan S Y,Huang K. The research on regulation mechanism of exogenous accumulation of anthocyanins in plants[J].Chinese Agricultural Science Bulletin,2014,30(19):86-91.
[4] 马丽,郭修武,乔军,张海娥. 果实花色苷合成激素调控的研究进展[J].北方园艺,2006(3):42-43.doi:10.3969/j.issn.1001-0009.2006.03.021.
Ma L,Guo X W,Qiao J,Zhang H E. Research progress on hormone regulation of anthocyanin synthesis in fruit [J].Northern Horticlture,2006(3):42-43.
[5] 林力浩,徐晨曦,王小丽,葛晨辉,戴绍军,王全华,蔡晓锋. 紫色蔬菜成色分子机制研究进展[J].上海师范大学学报(自然科学版),2015,44(6):663-671. doi:10.3969/J.ISSN.1000-5137.2015.06.014.
Lin L H,Xu C X,Wang X L,Ge C H,Dai S J,Wang Q H,Cai X F. Research advances on the molecular biological mechanism of purple vegetables colorization[J].Journal of Shanghai Normal University(Natural Sciences),2015,44(6):663-671.
[6] 陈秀,方朝阳. 植物生长调节剂芸苔素内酯在农业上的应用现状及前景[J].世界农药,2015,37(2):34-36,42. doi:10.16201/j.cnki.cn31-1827/tq.2015.02.08.
Chen X,Fang Z Y.Application status and development prospect of plant growth regulator brassinolide in agriculture[J].World Pesticides,2015,37(2):34-36,42.
[7] 刘静,容新民. 芸苔素内酯对促成栽培夏黑葡萄果实品质的影响[J].安徽农业科学,2015,43(33):58-59.doi:10.3969/j.issn.0517-6611.2015.33.020.
Liu J,Rong X M. Effects of brassinolide on fruit qality of summer cultivation black grape[J].Journal of Anhui Agricultural Sciences,2015,43(33):58-59.
[8] 马文婷,王振平. 脱落酸和乙烯利对蛇龙珠葡萄果实品质及花色苷的影响[J].西北农业学报,2015,24(5):81-88. doi:10.7606/j.issn.1004-1389.2015.05.014.
Ma W T,Wang Z P. Effects of ABA and ETH on grape quality and anthocyanin of cabernet gernischt[J].Acta Agriculturae Boreali-Occidentalis Sinica,2015,24(5):81-88.
[9] 苏培玺,杜明武,张立新,毕玉蓉,赵爱芬,刘新民. 日光温室草莓光合特性及对CO2浓度升高的响应[J].园艺学报,2002,29(5):423-426. doi:10.3321/j.issn:0513-353X.2002.05.005.
Su P X,Du M W,Zhang L X,Bi Y R,Zhao A F,Liu X M. Changes of photosynthetic characteristics and response to rising CO2 concentration in strawberry in solar greenhouse[J].Acta Horticulturae Sinica,2002,29(5):423-426.
[10] 薛晓芳,赵爱玲,任海燕,王永康,李登科,李毅.果树类黄酮的提取、分离纯化及检测方法[J].果树资源学报,2020,1(5):53-57. doi:10.16010/j.cnki.14-1127/s.2020.05.020
Xue X F,Zhao A L,Ren H Q,Wang Y K,Li D K,Li Y.Extraction,separation and detection methods of flavonoids on fruit trees[J].Journal of Fruit Resources,2020,1(5):53-57.
[11] 张强,尹丽,周旖璇,于琛琛,张纯刚,程岚. 丝瓜多酚组成、提取分离、含量测定及生物活性的研究进展[J].中国药房,2020,31(23):2928-2932. doi:10.6039/j.issn.1001-0408.2020.23.20.
Zhang Q,Yin L,Zhou Y X,Yu C C,Zhang C G,Cheng L. Research progress on composition,extraction,separation,content determination and biological activity of polyphenols in luffa[J].China Pharmacy,2020,31(23):2928-2932.
[12] 张彬,李萌,蒋茂双,王俊杰,侯思宇,韩渊怀,李红英.花青素积累与谷子低温胁迫响应的关系[J].核农学报,2020,34(11):2607-2613. doi:10.11869/j.issn.100-8551.2020.11.2607.
Zhang B,Li M,Jiang M S,Wang J J,Hou S Y,Han Y H,Li H Y.Relationship between anthocyanin accumulation and response to low temperature stress in foxtail millet[J].Journal of Nuclear Agricultural Sciences,2020,34(11):2607-2613.
[13] 李春阳,许时婴,王璋. 香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品科学,2004,25(2):157-161. doi:10.3321/j.issn:1002-6630.2004.02.036.
Li C Y,Xu S Y,Wang Z.Vanillin-HCl assay for the proanthocyanidins content of grape seed and stem[J].Food Science,2004,25(2):157-161.
[14] 周丹蓉,叶新福,方智振,姜翠翠,潘少霖,林炎娟. HPLC法测定李果实中花色苷含量及其与pH示差法的比较研究[J].东南园艺,2018,6(1):1-7.doi:10.3969/j.issn.2095-5774.2018.01.001.
Zhou D R,Ye X F,Fang Z Z,Jiang C C,Pan S L,Lin Y J. Determination of anthocyanin in plum fruit by HPLC and comparative study with pH differential method[J].Fujian Fruits,2018,6(1):1-7.
[15] 张社南,赵小龙. 细胞分裂素、赤霉素和芸薹素内酯对纽荷尔脐橙坐果和品质影响的试验初报[J].广西园艺,2004,15(6):23-25.doi:10.3969/j.issn.1674-5868.2004.06.013.
Zhang S N,Zhao X L. Preliminary study on the effects of cytokinin,gibberellin and brassinolide on fruit setting and quality of Newhall navel orange[J].Guangxi Yuanyi,2004,15(6):23-25.
[16] 马文婷. 脱落酸、乙烯利和芸苔素内酯对蛇龙珠葡萄果实品质及果皮花色苷的影响[D].银川:宁夏大学,2015.
Ma W T.Effects of ABA, ETH and BR on fruit quality and anthocyanin on grape peel of cabernet gernischt[D].Yinchuan:Ningxia University,2015.
[17] 张惟,刘亦学,杨秀荣,姜治国,张学文. 芸苔素内酯水剂对番茄产量及品质的影响[J].天津农业科学,2004,10(2):23-25.doi:10.3969/j.issn.1006-6500.2004.02.008.
Zhang W,Liu Y X,Yang X R,Jiang Z G,Zhang X W. Effect of brassinolides AS on yield and quality of tomato[J].Tianjin Agricultural Sciences,2004,10(2):23-25.
[18] 王西成,吴伟民,赵密珍,钱亚明,王壮伟. 激素调控葡萄果实发育与成熟的生理与分子机制研究进展[J].江西农业大学学报,2015,37(4):604-611. doi:10.13836/j.jjau.2015093.
Wang X C,Wu W M,Zhao M Z,Qian Y M,Wang Z W. Progress in the research of physiological and molecular mechanism in development and ripening of grape fruit regulated by hormones[J].Acta Agriculturae Universitatis Jiangxiensis,2015,37(4):604-611.
[19] 刘晓芬,李方,殷学仁,徐昌杰,陈昆松.花青苷生物合成转录调控研究进展[J].园艺学报,2013,40(11):2295-2306. doi:10.3969/j.issn.0513-353X.2013.11.023.doi:10.16420/j.issn.0513-353x.2013.11.001.
Liu X F,Li F,Yin X R,Xu C J,Chen K S.Recent advances in the transcriptional regulation of anthocyanin biosynthesis[J].Acta Horticulturae Sinica,2013,40(11):2295-2306.
[20] 赵杰堂. 激素调控植物花青素合成分子机制的研究进展[J].分子植物育种,2016,14(7):1884-1891. doi:10.13271/j.mpb.014.001884.
Zhao J T. Research progresses on molecular mechanism of hormone regulation of plant anthocyanin biosynthesis[J].Molecular Plant Breeding,2016,14(7):1884-1891.
[21] 张慧文,张玉,马超美. 原花青素的研究进展[J].食品科学,2015,36(5):296-304.doi:10.7506/spkx1002-6630-201505052.
Zhang H W,Zhang Y,Ma C M. Progress in procyanidins research[J].Food Science,2015,36(5):296-304.
