甘薯(Ipomoea batatas Lam.)又名地瓜、红薯等,属旋花科植物[1],是我国重要的粮食、饲料和工业原料作物,更是新型的生物能源作物[2]。目前,我国是世界上最大的甘薯生产国,年种植面积稳定在4×106 hm2左右;单产稳步提高,已达到世界平均水平的1.96倍[3]。近年来,随着甘薯经济价值的深度开发,甘薯产业发展对甘薯贮藏保鲜的要求越来越高。而甘薯在采后贮藏过程中极易腐烂、失水、发芽等,严重影响其经济价值[4]。探索产前调控对甘薯贮藏的影响,可为甘薯贮藏调控提高较好的理论参考依据,对甘薯贮藏具有重大意义。林婕等[5]研究表明甘薯最适贮藏温度为10~15 ℃。甘薯块根在贮藏过程中除了受温度[6-7]、湿度[8]、病菌[9]等影响,较高的甘薯钾素含量也能增强其耐贮藏性[10]。甘薯在采后贮藏过程中,其细胞壁在细胞壁酶作用下发生降解,进而发生腐烂[11]。钾以离子形式存在于甘薯植物体内,参与调节细胞渗透压,与甘薯细胞结构密切相关[12]。目前,针对甘薯贮藏产后调控措施已有较多研究,但甘薯贮藏产前调控措施的研究报道较少,施钾对甘薯贮藏的影响研究国内外罕见报道。本研究以商薯19、心香2个甘薯品种为材料,采用5个施钾梯度,利用相关测定方法来测定贮藏期内甘薯腐烂率、细胞壁成分及相关酶活性,通过分析施钾对甘薯块根在贮藏过程中细胞壁成分及酶活性的变化规律,分析细胞壁成分及酶活与腐烂率的关系,旨在探索施钾对甘薯采后贮藏的影响,为产前调控甘薯贮藏提供理论依据。
1 材料和方法
1.1 试验材料
试验品种为淀粉型品种商薯 19和鲜食型品种心香;供试肥料为硫酸钾(K2SO4含量 50%)、钙镁磷肥(P2O5含量 45%)和尿素(N含量 46%);供试土壤质地为红壤土,采用四分法测定土壤中氮磷钾的含量,测得0~20 cm 土层土壤全氮含量为 1.62 g/kg,全磷含量为1.08 g/kg,全钾含量为 25.2 mg/kg。
1.2 试验设计
本试验肥料梯度设置由表1可见,分为K0、K1、K2、K3、K4,种植前先施一次基肥,在种植30 d后追肥。小区面积24 m2(6 m×4 m),行距 100 cm,株距25 cm,起垄栽植,每小区4 垄,重复3 次,随机区组排列。生育期130 d,于2019 年10 月8 日统一收获,并挑选大小一致且无破损的甘薯块根存放于冷库中,温度控制在12 ℃左右,湿度控制在85%左右,保持贮藏条件不变,分别贮藏0,15,30,60,90 d取样,并测定其腐烂率、细胞壁成分及相关降解酶的活性。
表1 不同处理肥料施用量
Tab.1 Fertilizer application of different treatments kg/hm2

钾处理梯度Potassium treatmentgradient第1次施肥(基肥)First fertilization(basic fertilizer)第2次施肥(追肥)Second fertilization (top dressing)K2SO4尿素 Urea磷 PK2SO4尿素 Urea磷 PK00100121.501000K17575K2150150K3225225K4300300
1.3 试验方法
1.3.1 腐烂率测定 甘薯腐烂率的测定参照王雪姣等[13]的方法,具体计算方式如下:腐烂率=(腐烂甘薯个数/甘薯总个数)×100%。
1.3.2 果胶的测定 参照韩雅珊[14]的方法。
1.3.3 纤维素的测定 采用植物纤维素(Cellulose)酶联免疫分析法测定纤维素。采用ELISA试剂盒(江苏酶免实业有限公司)进行测定。
1.3.4 木质素的测定 参照熊素敏等[15]的方法。
1.3.5 多聚半乳糖醛酸酶(PG)活性测定 参照Ali等[16]的方法略有改动。在试管中分别加入1 mL 50 mmol/L pH值5.5乙酸-乙酸钠缓冲液、0.5 mL 10 g/L多聚半乳糖醛酸溶液和0.5 mL酶提取液,混匀后,于37 ℃加热1 h,取出立即加入1.5 mL DNS,沸水浴5 min,冷却至室温后,以蒸馏水稀释到25 mL,混匀测定。PG活性用μg/(h·g)表示。
1.3.6 纤维素酶(Cx)活性测定 参照Ali等[16]的方法略有改动。分别向试管中加入1.5 mL 10 g/L CMC溶液和0.5 mL酶提取液,剩下操作与PG酶相同。Cx活性用μg/(h·g)表示。
1.3.7 β-半乳糖苷酶(β-Gal)活性测定 参照Gil-Martín[17]的方法略有改动。取0.1 mL酶提取液,加入0.5 mL pH值 4.5的柠檬酸缓冲液和0.4 mL 0.2 mmol/L的邻硝基酚-β-半乳糖苷,37 ℃水浴30 min,最后加入2 mL 0.2 mol/L预冷的碳酸钠溶液终止反应,于405 nm波长下检测吸光值。
1.4 数据处理
试验数据使用SPSS 20.0软件进行统计分析,采用Tukey方法对数据进行多次检验。
2 结果与分析
2.1 不同施钾量的甘薯贮藏期间腐烂率变化
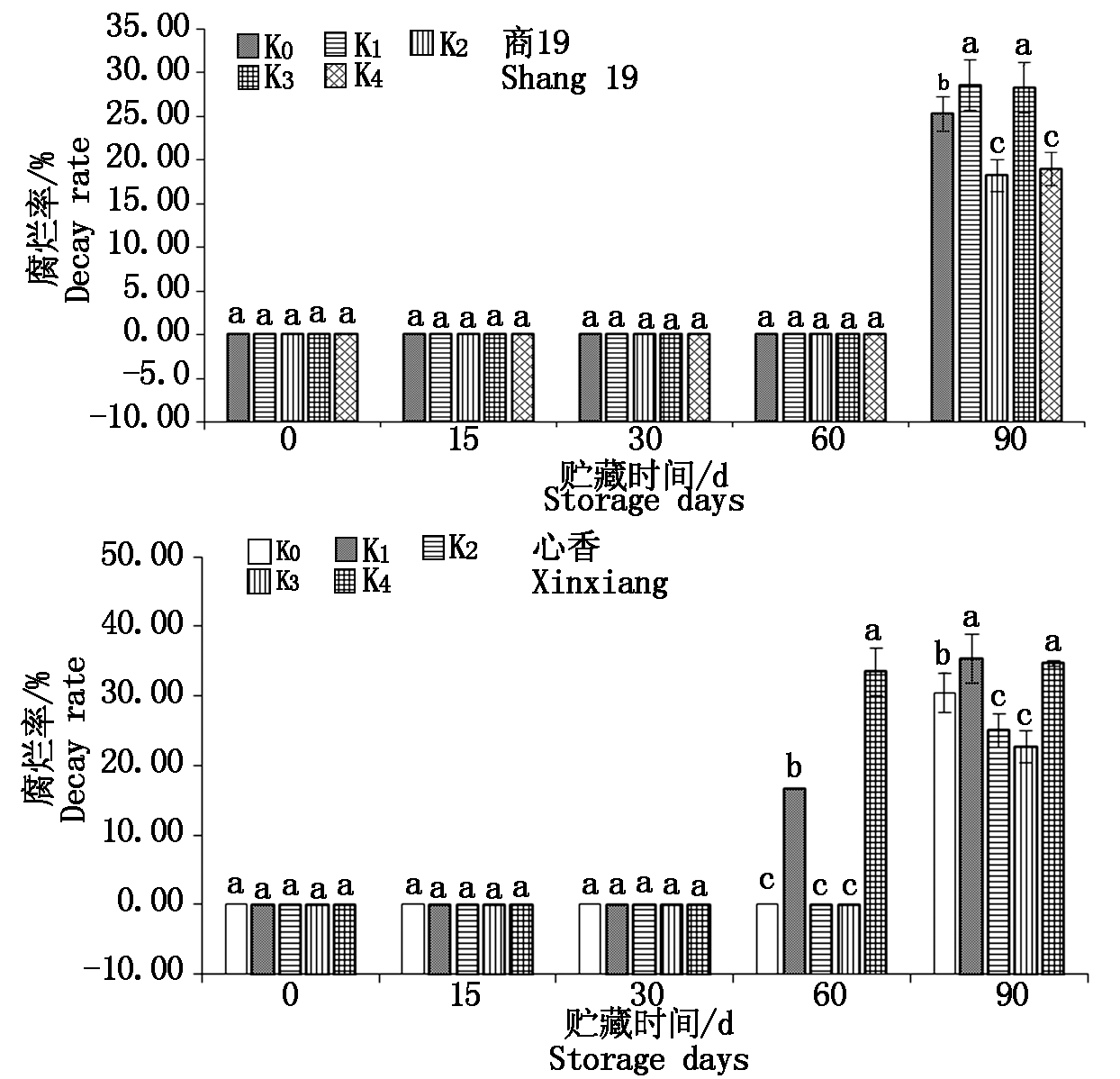
由图1可知,商薯19各处理组在贮藏期0~60 d内没有发生腐烂,在90 d开始腐烂。其中商薯19 K1、K3腐烂率显著较高,K1最高达28.57%;商薯19 K2、K4腐烂率显著较低,K2最低为18.25%。心香K1、K4在60 d就开始腐烂,在90 d腐烂率达到35.00%,显著高于其他4个处理组。心香K0、K2、K3在0~60 d贮藏期内没出现腐烂现象,在90 d出现不同程度的腐烂现象。其中心香K2、K3腐烂率显著较低,K3最低为23.00%。
柱形上用不同小写字母标识代表不同处理在同一
贮藏时间差异显著,P<0.05。图2-8同。
Different lowercase letters are used on the column to
indicate that different treatments are significant
difference in the same storage time,P<0.05. The same as Fig.2-8.
图1 贮藏期间甘薯腐烂率变化
Fig.1 Changes of rotting rate of sweetpotato during storage
2.2 不同施钾量的甘薯贮藏期间可溶性果胶含量变化
由图2可知,贮藏期间商薯19、心香的可溶性果胶含量上升。其中,商薯19 K0、K2、K4在贮藏15 d上升为最大值,分别为12.2,9.4,9.9 mg/g;商薯19 K1、K3在贮藏30 d达到最大值,分别为13.7,9.1 mg/g,其中商薯19 K1可溶性果胶含量在贮藏中后期显著下降,而商薯19 K3可溶性果胶含量在贮藏后期显著最低。心香K0、K1贮藏15 d上升为最大值,分别为9.3,10.1 mg/g;心香K2、K4在30 d达到最大值,分别为9.2,11.1 mg/g,心香K2在贮藏中后期波动平稳,而心香K4在贮藏中后期显著下降。心香K3则在90 d达到最大值,为10.6 mg/g。耐贮性好的心香K3在贮藏后期可溶性果胶含量显著高于其他处理,平均高1.14%。
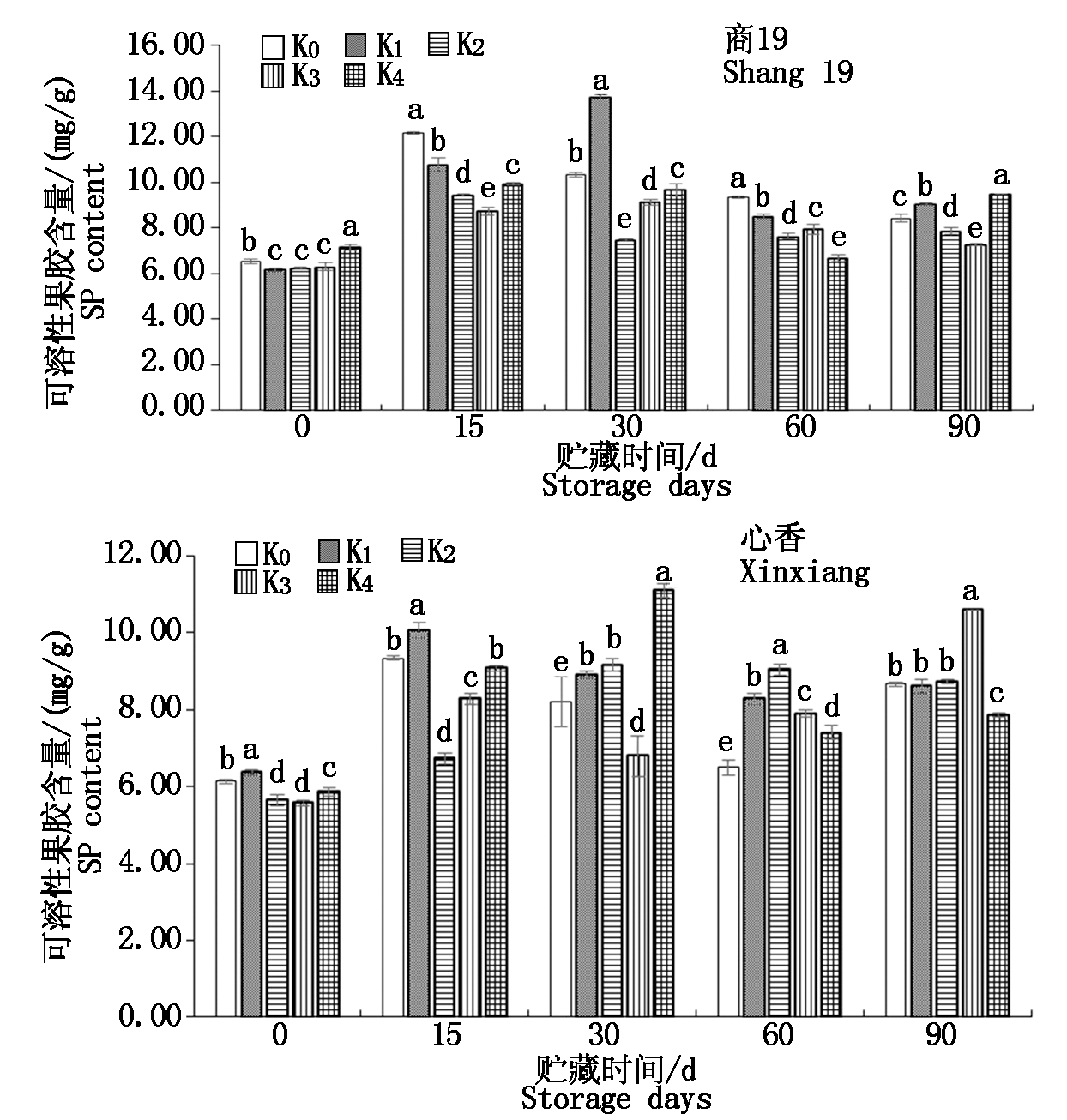
图2 贮藏期间甘薯可溶性果胶含量变化
Fig.2 Changes of soluble pectin content in
sweetpotato during storage
2.3 不同施钾量的甘薯贮藏期间原果胶含量变化
由图3可知,贮藏期间商薯19、心香的原果胶含量波动平稳,总体呈先上升后下降趋势。2个品种甘薯各处理组原果胶含量在贮藏期30 时均达到最高值。其中商薯19各处理组在贮藏90 d时其含量在115~118 mg/g,各处理组无显著差异,心香K3原果胶含量在贮藏后期显著高于其他处理组,为125.8 mg/g。

图3 贮藏期间甘薯原果胶含量变化
Fig.3 Changes of protopectin content in
sweetpotato during storage
2.4 不同施钾量的甘薯贮藏期间纤维素含量变化
由图4可知,贮藏期间商薯19、心香的纤维素含量变化波动平稳,在77~81 mg/g间波动。2个品种甘薯在贮藏60 d纤维素含量上升至最大值,之后纤维素可能在酶的作用下降解,90 d时的含量较60 d的含量显著下降。
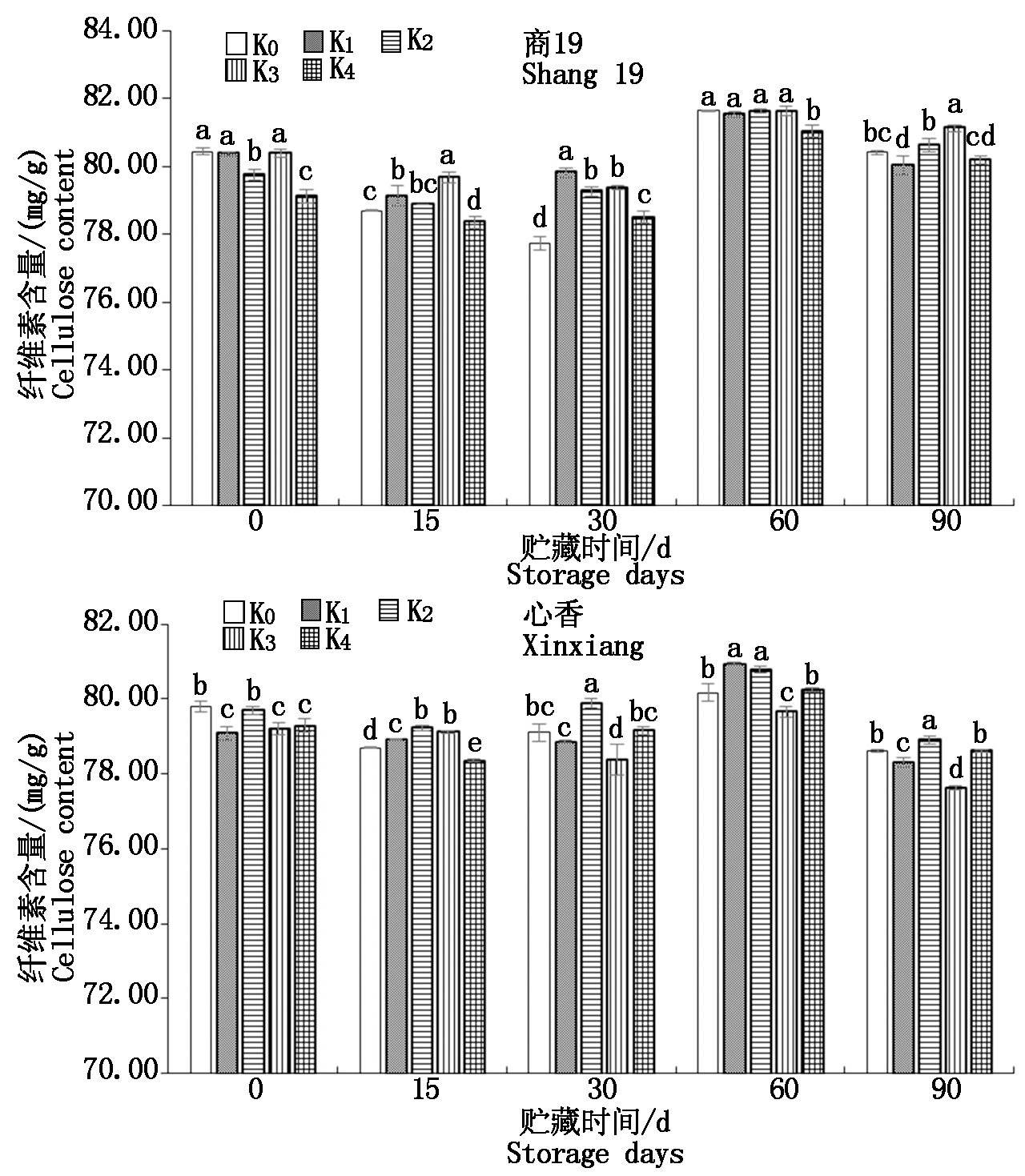
图4 贮藏期间甘薯纤维素含量变化
Fig.4 Changes of cellulose content in
sweetpotato during storage
2.5 不同施钾量的甘薯块根贮藏期间木质素含量变化
由图5可知,商薯19 K0、K1、K4木质素含量在贮藏期间呈上升趋势,在90 d达到最大值,分别为31.0,31.3,27.4 mg/g。商薯19 K2、K3呈先上升后下降趋势,分别在30,15 d达到最大值,分别29,28 mg/g。在贮藏90 d,商薯19 K0、K1显著高于其他3个处理。心香K0、K3、K4木质素含量在贮藏期间呈先上升后下降趋势,在30 d达到最大值,分别为27.6,24.3,29.7 mg/g。心香K1、K2在贮藏90 d达到最大值,分别为26.8,26.5 mg/g。在贮藏中后期,心香K1、K2显著高于其他3个处理。
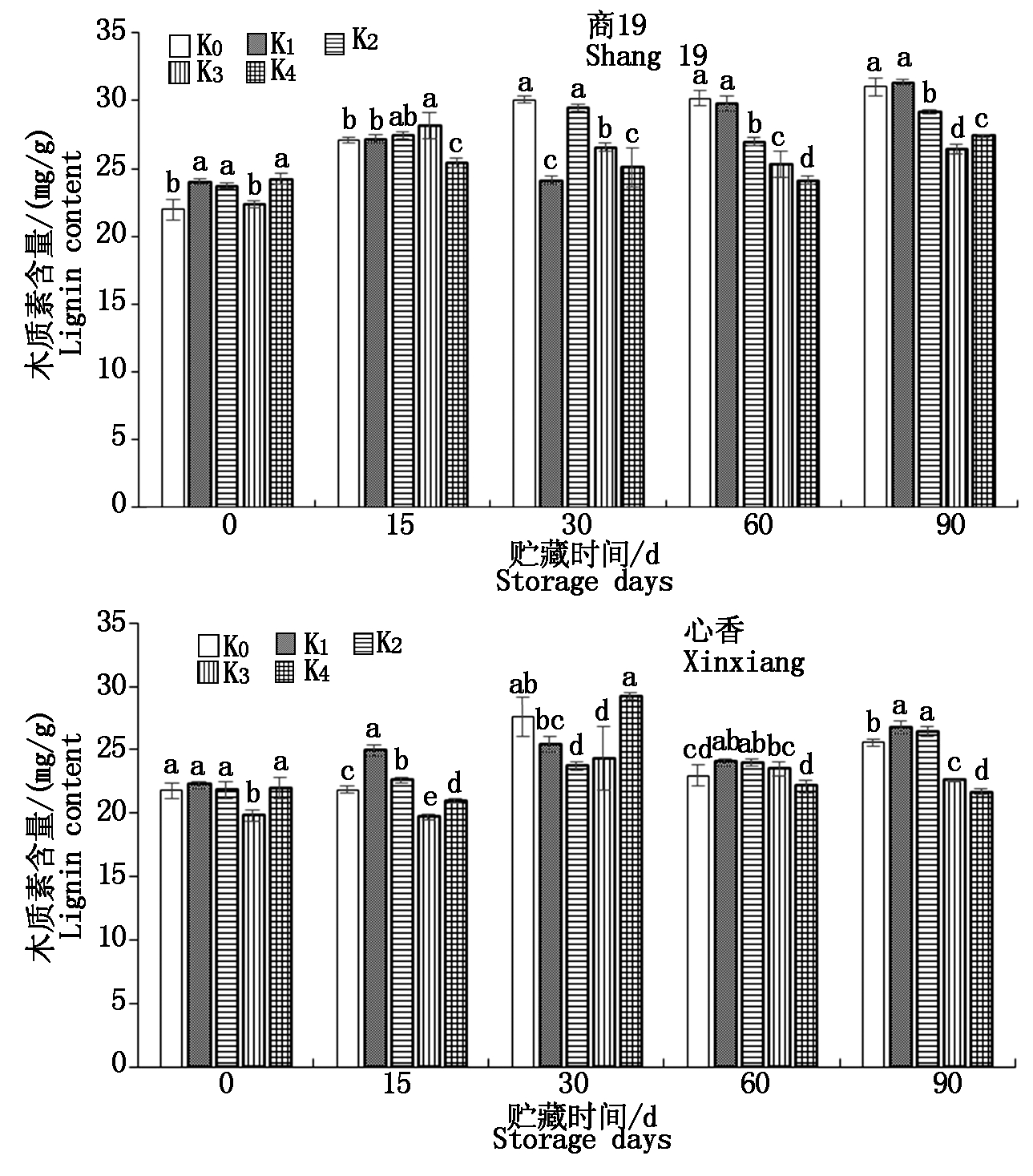
图5 贮藏期间甘薯块根干质量中木质素含量变化
Fig.5 Changes of lignin content of sweetpotato
storage roots during storage
2.6 不同施钾量的甘薯贮藏期间多聚半乳糖醛酸酶(PG)活性变化
由图6可知,商薯19在贮藏15 d时PG酶活性达到最大值,贮藏期间总体呈先上升后下降趋势,在60~90 d急剧下降。心香K0、K4贮藏期间呈下降趋势,心香K1、K2、K3呈先上升后下降趋势,其中心香K1、K3在30 d达到最大值,分别为6 704,6 592 μg/(h·g);心香K2在60 d达到最大值,为6 239 μg/(h·g)。心香各处理组PG酶活性在60~90 d急剧下降,与商19相同。
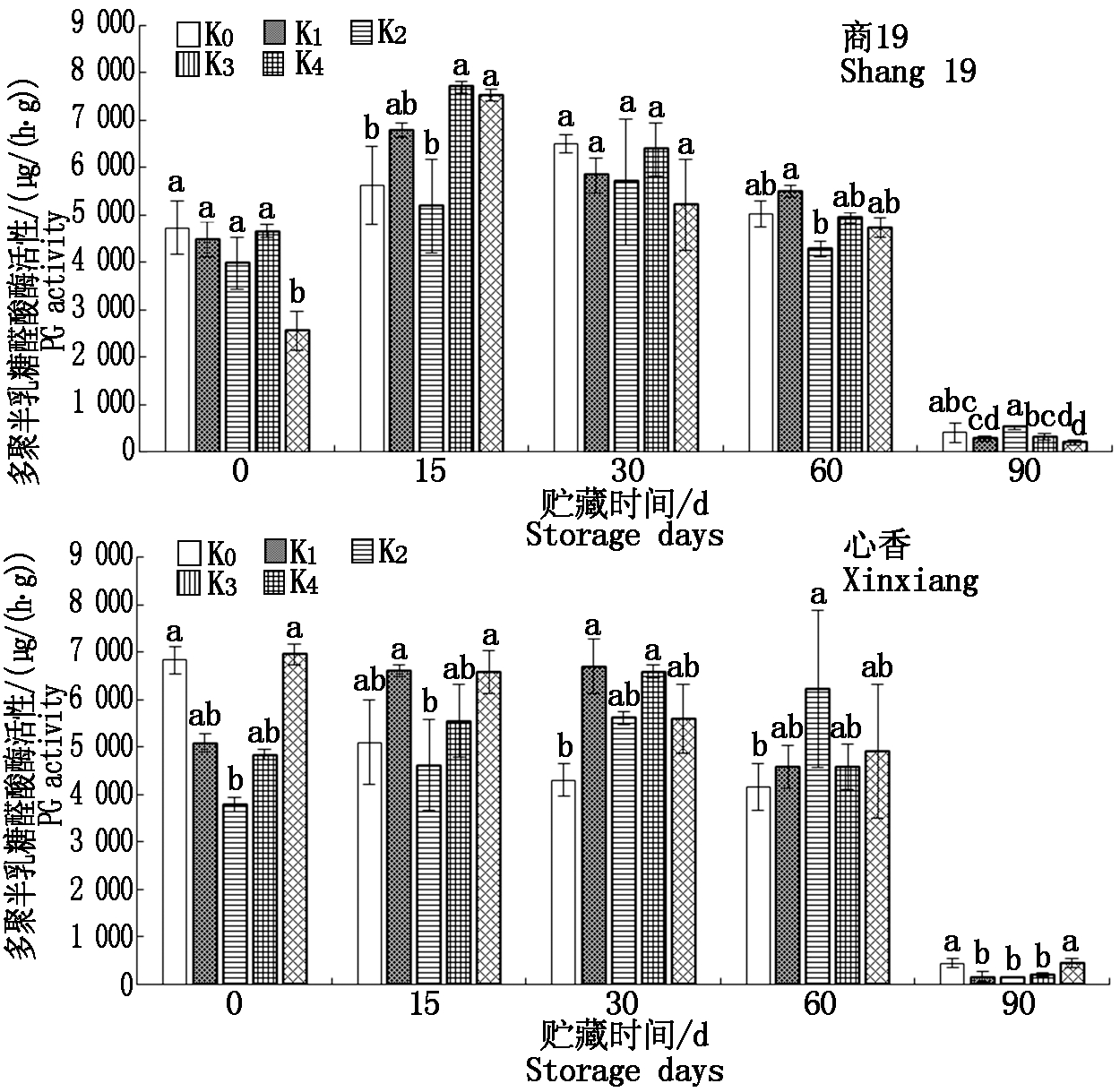
图6 贮藏期间甘薯多聚半乳糖醛酸酶(PG)活性变化
Fig.6 Changes of polygalacturonase(PG)activity
in sweetpotato during storage
2.7 不同施钾量的甘薯贮藏期间纤维素酶(Cx)活性变化
由图7可知,商薯19、心香各处理组Cx酶活性在贮藏期间先上升后下降,在60~90 d急剧下降。商薯19和心香Cx酶活性在60 d达到最大值,之后开始出现腐烂。
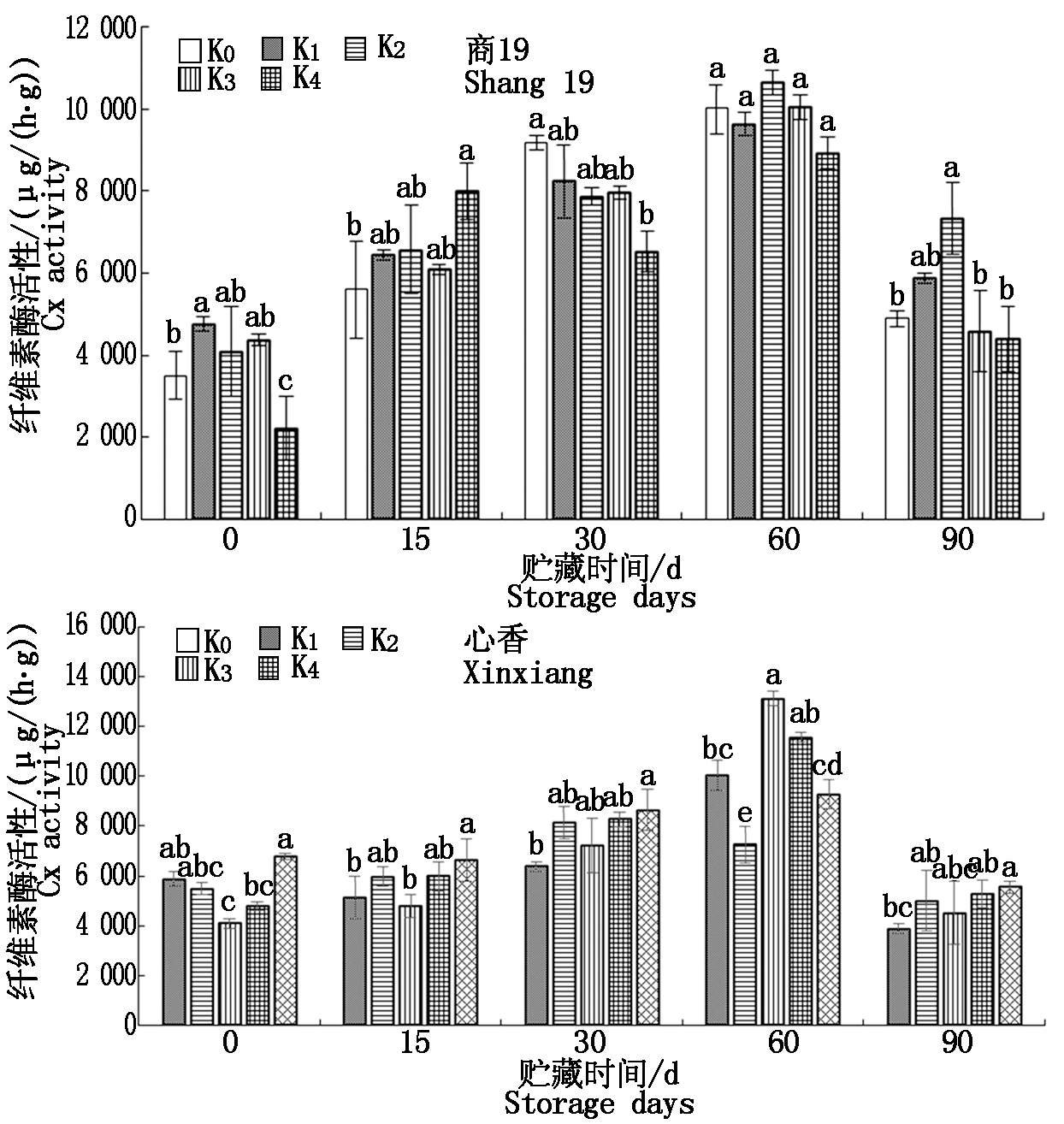
图7 贮藏期间甘薯纤维酶(Cx)活性变化
Fig.7 Changes in cellulase(Cx)activity
of sweetpotato during storage
2.8 不同施钾量的甘薯贮藏期间β-半乳糖苷酶(β-Gal)活性变化
由图8可知,商薯19 β-Gal酶活性在贮藏期间总体呈先下降后上升趋势,在60~90 d急剧上升。心香β-Gal酶活性总体呈上升趋势,在90 d达到最大值。其中耐贮性好的心香K3 β-Gal酶活性为0.06 U/g,低于其他4个处理组。
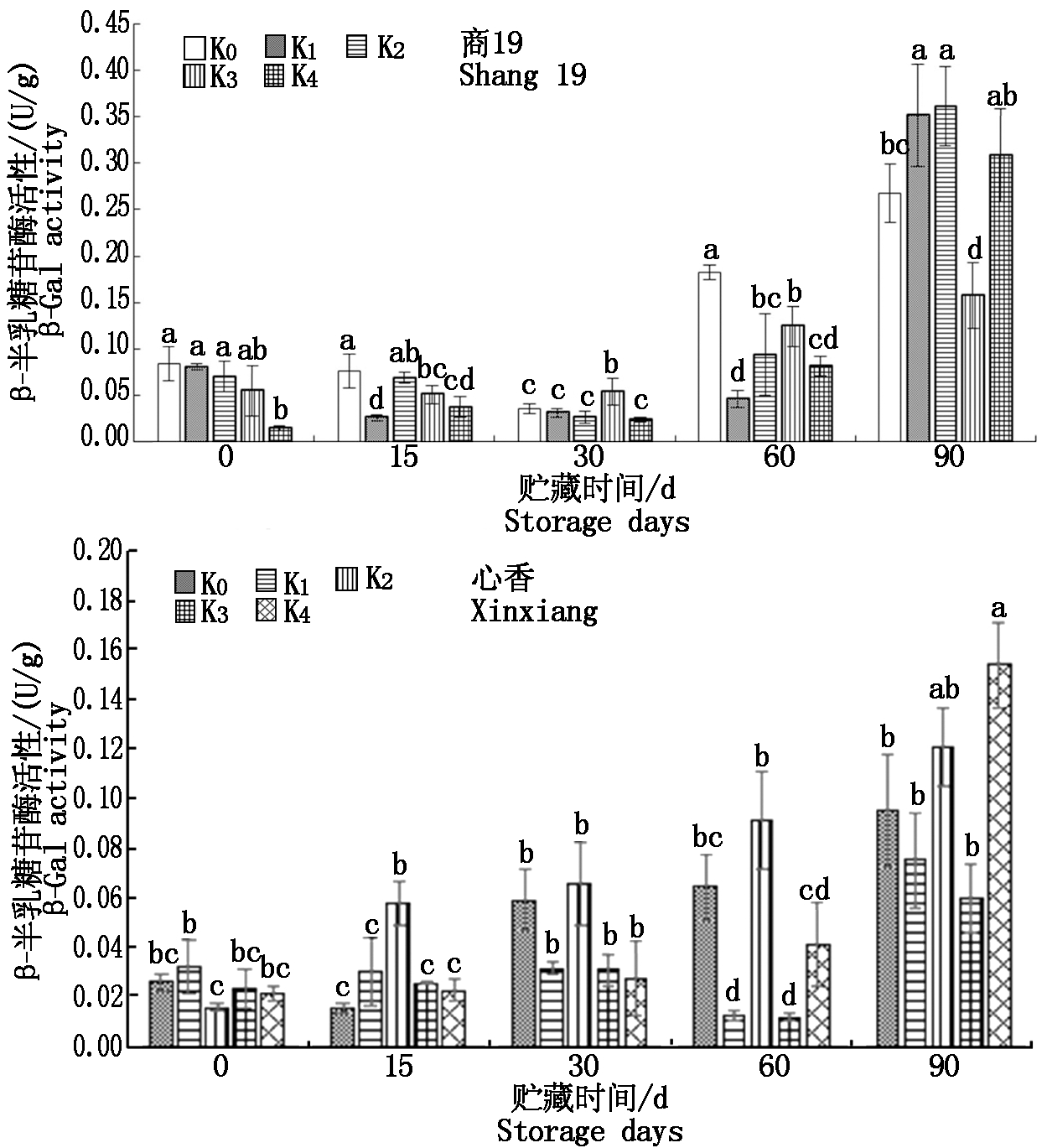
图8 贮藏期间甘薯β-半乳糖苷酶(β-Gal)活性变化
Fig.8 Changes of β-galactosidase(β-Gal)
activity in sweetpotato during storage
2.9 甘薯贮藏期间生理指标相关性分析
由表2可知,甘薯贮藏过程中腐烂率与β-Gal酶呈极显著正相关(P<0.01),与Cx酶呈显著负相关。
表2 甘薯贮藏期间生理指标相关性分析
Tab.2 Correlation analysis of physiological indexes of sweetpotato during storage
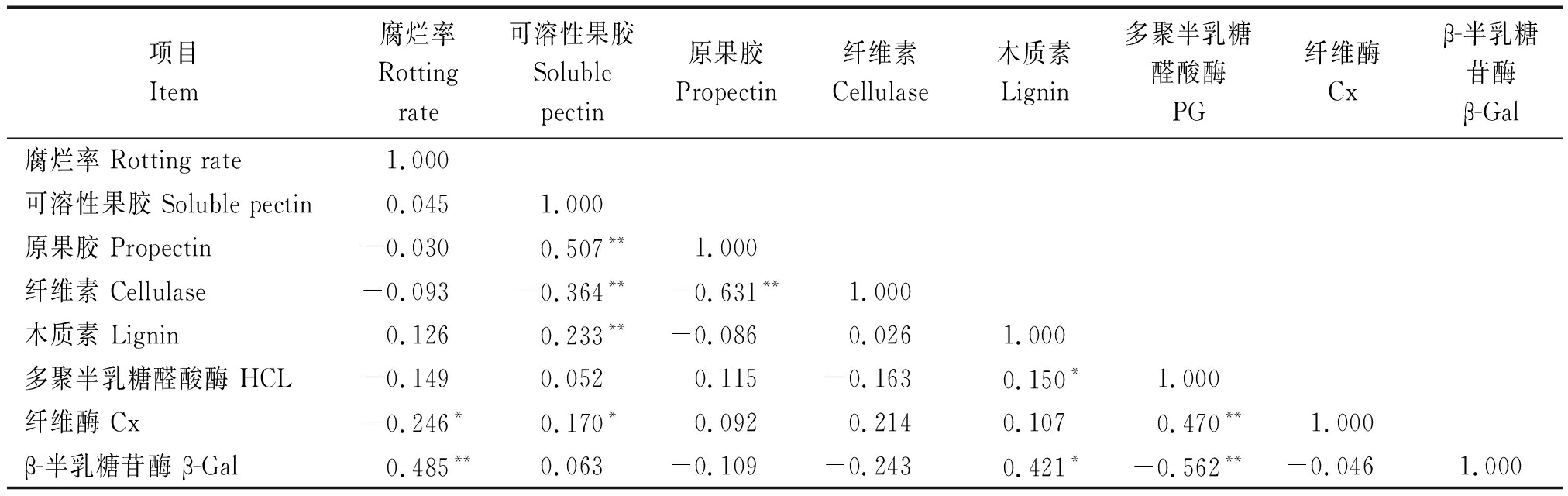
项目Item腐烂率Rotting rate可溶性果胶Soluble pectin原果胶Propectin纤维素Cellulase木质素Lignin多聚半乳糖醛酸酶PG纤维酶Cxβ-半乳糖苷酶β-Gal腐烂率 Rotting rate1.000可溶性果胶 Soluble pectin0.0451.000原果胶 Propectin-0.0300.507**1.000纤维素 Cellulase-0.093-0.364**-0.631**1.000木质素 Lignin0.1260.233**-0.0860.0261.000多聚半乳糖醛酸酶 HCL-0.1490.0520.115-0.1630.150*1.000纤维酶 Cx-0.246*0.170*0.0920.2140.1070.470**1.000β-半乳糖苷酶 β-Gal0.485**0.063-0.109-0.2430.421*-0.562**-0.0461.000
注:*.P<0.5;**.P<0.01。
3 讨论与结论
植物细胞壁结构和组成与贮藏特性密切相关,其主要组分为果胶、纤维素、半纤维素和木质素[18-19]。果胶可分为可溶性果胶和原果胶,是细胞壁基质和胞间层中最丰富的多糖,其含量和存在形式在调节细胞间黏附和细胞壁结构稳定方面起着重要的作用[20]。许多研究表明,原果胶被解聚或溶解,可溶性果胶增加,细胞间结合力减弱,细胞壁稳定结构被破坏[21]。本研究中,商薯19和心香各处理组贮藏期间原果胶含量下降,可溶性果胶含量上升,在90 d出现腐烂现象时,耐贮性表现较好的商薯19 K2可溶性果胶含量显著较低,心香K3原果胶含量显著高于其他处理。纤维素具有高度稳定的物理化学性质,是细胞壁中主要的承载基础,且在弱酸弱碱环境下仍能维持结构的稳定性,不易被细胞壁降解酶降解[22]。贮藏期间,商薯19和心香各处理组纤维素含量波动稳定,无显著差异。木质素主要基本结构单位是苯丙烷,其是一类细胞壁机械强度密切相关的特殊化合物[23],对植物细胞壁起到刚性支撑的物理作用和抵抗疾病的侵袭作用[24]。在贮藏后期,商薯19和心香K0、K1、K2的木质素含量都显著高于K3、K4。
多聚半乳糖醛酸酶(PG)能水解多聚半乳糖醛酸中的α-1,4-D-半乳糖苷键,降解果胶,引起细胞器发生变化[25]。纤维素酶(Cx)是降解羧甲基纤维素为寡糖和单糖的水解酶,在不同组织中所作用的多糖底物不同,固定作用于1,4-β-葡萄糖苷键,从而导致细胞壁“经纬结构”松散,有利于PG、β-Gal等酶分解果胶质,引起细胞壁降解。有研究表明,Cx酶能分解半纤维素基质多糖,破坏果胶-纤维素-半纤维素的网络结构,使果实细胞壁遭到破坏,果实质地软化,进而影响贮藏效果[26]。本研究中,在60,90 d时Cx酶活性都显著高于PG酶活性。PG酶和Cx酶均呈现先上升后下降趋势,且均在60~90 d急剧下降。其中,PG酶在15 d达到高峰值,Cx酶在60 d时达到高峰值,且甘薯开始出现腐烂现象。姜建中等[27]研究发现,细胞壁降解酶活性变化会引起细胞壁结构变化,自溶指数高的桑椹中的 PE、PG和β-Gal酶活性显著高于自溶指数低的桑椹。
本研究中,通过相关性分析发现β-Gal酶与腐烂率呈极显著正相关,与曹如霞等[11]研究结果相符。商薯19和心香各处理组在贮藏后期发生腐烂时,β-Gal酶活性显著上升。而耐贮性较好的心香K3 β-Gal酶活性较其他处理相比显著偏低。甘薯腐烂时,β-Gal酶活性高,与苹果贮藏一样[28]。β-Gal酶在细胞壁结构溶解或降解中起着重要作用,可通过降解β-半乳糖残基的成分而引起果胶、半纤维素等溶解,导致细胞间连接减少、细胞壁的组分变得不稳定[29],进而导致对病原菌等抗逆性降低,容易发生腐烂[30]。
通过研究施钾对甘薯贮藏过程中细胞壁成分及相关降解酶活性的变化,结果表明,商薯19K2、心香K3耐贮性表现最好,且具有较高的木质素、纤维素含量,且心香K3贮藏后期β-Gal酶活性低。在贮藏中后期,商薯19、心香出现腐烂高峰期前,Cx酶和β-Gal酶活性达到高峰值,加速降解细胞壁成分,导致细胞壁完整性下降,抗逆性减弱,容易发生腐烂。通过本研究发现,对于甘薯施用中钾处理能减缓细胞壁成分的降解,提高其细胞壁完整性的保持能力,降低腐烂率。高钾和低钾都会导致甘薯贮藏效果降低,这可能是由于不同的钾处理导致甘薯体内钾素含量不同,适宜的钾处理能使甘薯块根薄壁细胞膜结构完整、清晰,内含较多的线粒体和质体,胞质较丰富;提高超氧化物歧化酶(SOD)活性,降低了过氧化物酶(POD)的活性,减少过氧化物的产生和累积,降低丙二醛(MDA)的含量,减轻活性氧对细胞膜的伤害;稳定细胞结构,防止细胞间隙的扩大,来降低病原菌侵入的几率;而过低会导致甘薯生命活性降低,无法很好地维持细胞完整性,从而发生腐烂;过高则会对氧自由基代谢不利,导致甘薯生命活性太强,代谢活动过于旺盛,增强活性氧对细胞膜的伤害,从而容易发生腐烂。此外,不同甘薯基因型间存在钾素利用效率差异,本研究中心香的适宜钾浓度高于商薯19。
通过本研究发现,对于甘薯施用中钾处理能减缓其细胞壁成分的降解,提高细胞壁完整性的保持能力,降低腐烂率。心香的适宜钾浓度高于商薯19。
[1] 徐梦瑶,赵祥颖,张立鹤,贾洪玉,陈清春,刘建龙.甘薯的营养价值及保健作用[J].中国果菜,2017,37(5):17-21,47. doi:10.19590/j.cnki.1008-1038.2017.05.006
Xu M Y,Zhao X Y,Zhang L H,Jia H Y,Chen Q C,Liu J L.The nutritional value and health care function of sweet potato[J].China Fruit Vegetable,2017,37(5):17-21,47.
[2] 马剑凤,程金花,汪洁,戴红君,戴起伟.国内外甘薯产业发展概况[J].江苏农业科学,2012,40(12):1-5. doi:10.15889/j.issn.1002-1302.2012.12.044.
Ma J F,Cheng J H,Wang J,Dai H J,Dai Q W.Overview of the development of sweet potato industry at home and abroad[J].Jiangsu Agricultural Sciences,2012,40(12):1-5.
[3] 王欣,李强,曹清河,马代夫.中国甘薯产业和种业发展现状与未来展望[J].中国农业科学,2021,54(3):483-492. doi:10.3864/j.issn.0578-1752.2021.03.003.
Wang X,Li Q,Cao Q H,Ma D F.Current status and future prospective of sweetpotato production and seed industry in China[J].Scientia Agricultura Sinica,2021,54(3):483-492.
[4] 王晓军,赵琳,石江,骆乐谈,詹生华,马华升.甘薯采后贮藏保鲜及抑芽技术研究进展[J].浙江农业科学,2021,62(1):133-138. doi:10.16178/j.issn.0528-9017.20210144.
Wang X J,Zhao L,Shi J,Luo L T,Zhan S H,Ma H S.Research progress on postharvest storage and sprout inhibition of sweet potato[J].Journal of Zhejiang Agricultural Sciences,2021,62(1):133-138.
[5] 林婕, 邱万伟, 萧国庆, 练彬斌, 王则金.温度对甘薯贮藏品质的影响研究[J].食品工业,2016,37(3):64-67.
Lin J,Qiu W W,Xiao G Q,Lian B B,Wang Z J. Effects of temperature on the storage quality of sweet potatoes[J].The Food Industry,2016,37(3):64-67.
[6] 陈玲玲,曹如霞,徐舒,李玲,崔鹏,陆国权.甘薯块根在不同温度贮藏过程中游离糖及膳食纤维的变化[J].植物生理学报,2020,56(4):871-878.doi:10.13592/j.cnki.ppj.2019.0385.
Chen L L,Cao R X,Xu S,Li L,Cui P,Lu G Q.Changes of free sugar and dietary fiber in sweet potato roots during storage at different temperatures[J]. Plant Physiology Journal,2020,56(4):871-878.
[7] 闫海锋,李韦柳,熊军,韦民政,唐秀桦.不同贮藏温度对甘薯品质及失重率的影响[J].湖北农业科学,2020,59(2):137-140.doi:10.14088/j.cnki.issn0439-8114.2020.02.030.
Yan H F,Li W L,Xiong J,Wei M Z,Tang X H.Effect of different storage temperature on quality and weight loss rate of sweet potato[J].Hubei Agricultural Sciences,2020,59(2):137-140.
[8] 郭亮虎,王镇,李楠,逯腊虎,高炜,郭雅娴,武宗信.温度和湿度对紫甘薯贮藏品质的影响[J].中国农业科技导报,2020,22(2):107-114.doi:10.13304/j.nykjdb.2019.0145.
Guo L H,Wang Z,Li N,Lu L H,Gao W,Guo Y X,Wu Z X.Effects of temperature and humidity on the storage quality of purple sweet potato[J].Journal of China Agricultural Science and Technology Review,2020,22(2):107-114.
[9] 孙书军,周志林,张安,戴习彬,赵冬兰,唐君.影响甘薯种薯安全贮藏的主要因素及防控技术[J].农业开发与装备,2020(6):192-193.
Sun S J,Zhou Z L,Zhang A,Dai X B,Zhao D L,Tang J.The main factors affecting the safe storage of sweet potato seed potatoes and prevention and control techniques[J].Agricultural Development and Equipments,2020(6):192-193.
[10] 闫加启.钾肥在甘薯生长中的作用[J].北京农业,2003(6):26.doi:10.3969/j.issn.1000-6966.2003.06.036.
Yan J Q.The role of potassium fertilizer in the growth of sweet potato[J].Beijing Agriculture,2003(6):26.
[11] 曹如霞,徐舒,李玲,陈玲玲,陆国权. 甘薯块根贮藏期间细胞壁成分及降解酶活性变化[J].中国农业大学学报,2020,25(5):59-69. doi:10.11841/j.issn.1007-4333.2020.05.06.
Cao R X,Xu S,Li L,Chen L L,Lu G Q. Changes of cell wall components and degradation enzyme activity in sweetpotato storage roots during storage[J].Journal of China Agricultural University,2020,25(5):59-69.
[12] 史春余,王振林,赵秉强,郭风法,余松烈.钾营养对甘薯某些生理特性和产量形成的影响[J].植物营养与肥料学报,2002,8(1):81-85.doi:10.3321/j.issn:1008-505X.2002.01.015.
Shi C Y,Wang Z L,Zhao B Q,Guo F F,Yu S L. Effect of potassium nutrition on some physiological characteristics and yield formation of sweet potato[J].Journal of Plant Nutrition and Fertilizers,2002,8(1):81-85.
[13] 王雪姣, 衣红林, 王欣梅, 庄敏, 韩宇晨, 王庆国. 四个品种甘薯耐贮性及抗氧化特性的比较研究[J].食品与发酵科技,2016,52(3):20-25.doi:10.3969/j.issn.1674-506X.2016.03-005.
Wang X J,Yi H L,Wang X M,Zhuang M,Han Y C,Wang Q G. Comparison of storage capacity and antioxidant peculiarity of four genotypes of sweet potato[J]. Sichuan Food and Fermentation ,2016,52(3):20-25.
[14] 韩雅珊. 食品化学实验指导[M].北京:北京农业大学出版社,1992.
Han Y S. Guidance of food chemistry experiment[M].Beijing:Beijing Agricultural University Press,1992.
[15] 熊素敏,左秀凤,朱永义. 稻壳中纤维素、半纤维素和木质素的测定[J].粮食与饲料工业,2005(8):40-41.doi:10.3969/j.issn.1003-6202.2005.08.018.
Xiong S M,Zuo X F,Zhu Y Y. Determination of cellulose,hemi-cellulose and ligin in rice hull[J].Cereal & Feed Industry,2005(8):40-41.
[16] A li M B,Abu-Goukh A A. Changes in pectic substances and cell wall degrading enzymes during tomato fruit ripening[J].University of Khartoum Journal of Agricultural Sciences,2005,13(2):202-223.doi:10.1186/s12870-016-0887-0.
[17] Gil-Martín E, Rodríguez-Berrocal J, de la Cadena M P, Fernández-Briera A. Alterations of glycosidases in human colonic adenocarcinoma[J].Clinical Biochemistry,1997,30(1):17-25.doi:10.1016/S0009-9120(96)00123-3.
[18] Majda M,Robert S. The role of auxin in cell wall expansion[J]. International Journal of Molecular Sciences,2018,19(4):951.doi:10.3390/ijms19040951.
[19] Dheilly E,Gall S L,Guillou M C,Renou J P,Bonnin E,Orsel M,Lahaye M. Cell wall dynamics during apple development and storage involves hemicellulose modifications and related expressed genes[J]. BMC Plant Biology,2016,16(1):1-20.doi:10.1186/s12870-016-0887-0.
[20] Billy L,Mehinagic E,Royer G,Renard C M G C,Arvisenet G,Prost C,Jourjon F. Relationship between texture and pectin composition of two apple cultivars during storage[J].Postharvest Biology and Technology,2008,47(3):315-324.doi:10.1016/j.postharvbio.2007.07.011.
[21] Fischer R L,Bennett A B. Role of cell wall hydrolases in fruit ripening[J].Annual Review of Plant Physiology and Plant Molecular Biology,1991,42(1):675-703.doi:10.1146/annurev.pp.42.060191.003331.
[22] Bonnin E,Lahaye M. Contribution of cell wall modifying enzymes on the texture of fleshy fruits:The example of apple[J].Journal of the Serbian Chemical Society,2013,78(3):417-427.doi:10.2298/JSC121123004B.
[23] Lewis N G,Yamamoto E. Lignin:occurrence,biogenesis and biodegradation[J].Annual Review of Plant Physiology and Plant Molecular Biology,1990,41(1):455-496.doi:10.1146/annurev.pp.41.060190.002323.
[24] Lee R A,Berberi V,Labranche J,Lavoie J M. Lignin extraction reassessment of the severity factor with respect to hydroxide concentration[J].Bioresource Technology,2014,169(5):707-712.doi:10.1016/j.biortech.2014.07.038.
[25] Brummell D A,Dal Cin V,Crisosto C H,Labavitch J M. Cell wall metabolism during maturation,ripening and senescence of peach fruit[J].Journal of Experimental Botany. 2004,55(405):2029-2039.doi:10.1093/jxb/erh227.
[26] 王培,张丽芬,陈复生,杨宏顺,辛颖. 贮藏技术对采后水果细胞壁酶影响的研究进展[J].食品研究与开发,2017,38(19):199-204.doi:10.3969/j.issn.1005-6521.2017.19.044.
Wang P,Zhang L F,Chen F S,Yang H S,Xin Y. Research progress on the effects of storage technology on cell wall enzymes of post-harvest fruits[J]. Food Research and Development,2017,38(19):199-204.
[27] 姜建中, 蔡冲, 崔旭红, 翁连娟, 李若南. 桑椹采后自溶过程中的质地与细胞壁结构变化[J].蚕业科学,2018,44(4):580-587.doi:10.13441/j.cnki.cykx.2018.04.011.
Jiang J Z,Cai C,Cui X H,Weng L J,Li R N. Changes in texture and cell wall structure of postharvest mulberry fruits during aril breakdown[J].Science of Sericulture,2018,44(4):580-587.
[28] 易美君, 孔静, 许昕, 郁志芳.低温贮藏期间‘长富2’果实细胞壁酶及基因表达的变化[J].食品与发酵工业,2017,43(3):254-258.doi:10.13995/j.cnki.11-1802/ts.201703044.
Yi M J,Kong J,Xu X,Yu Z F. Changes in cell wall enzymes and gene expression of ′Changfu 2′fruit during low temperature storage[J].Food and Fermentation Industries,2017,43(3):254-258.
[29] Ranwala A P,Suematsu C,Masuda H. The role of beta-galactosidases in the modification of cell wall components during muskmelon fruit ripening[J].Plant Physiology,1992,100(3):1318-1325.doi:10.1104/pp.100.3.1318.
[30] Jovyn K T N, Schröder R, Brummell D A, Sutherland P W, Hallett I C, Smith B G, Melton L D, Johnston J W. Lower cell wall pectin solubilisation and galactose loss during early fruit development in apple(Malu×domestica)cultivar ‘Scifresh’ are associated with slower softening rate[J].Journal of Plant Physiology,2015,176(2):129-137.doi:10.1016/j.jplph.2014.12.012.
