干旱作为主要的胁迫因素之一严重阻碍小麦生长发育[1-3]。目前我国干旱和半干旱面积大约占国土面积的1/2左右[4-6]。因此,通过培育抗旱高产的小麦品种实现水分利用效率的提高,是保证小麦单产增加、实现小麦产业绿色可持续发展最基本的途径之一。
小麦植株对干旱做出反应,引起小麦各个器官和部位的丙二醛(MDA)、可溶性糖和可溶性蛋白等含量的变化,以及过氧化物酶(POD)和超氧化物歧化酶(SOD)活性的变化,它们的变化是研究作物抗旱性的重要指标。孙海丽等[7]、吴珍[8]研究认为,在一定范围内,小麦植株中可溶性糖含量随着干旱程度的增加而增加,可溶性糖是小麦适应干旱胁迫的调节物质之一;采用PEG模拟干旱发现,在轻度干旱条件下SOD酶活性增强,达到重度干旱时SOD酶活性反而会降低,在干旱胁迫条件下小麦叶片的CAT、POD活性均增加[9];张凯等[10]的研究表明,可溶性蛋白与调节植物细胞的渗透势有关,可溶性蛋白的含量高时植物细胞能维持较低的渗透势,从而缓解干旱胁迫带来的伤害。赵燕昊等[11]、谢燕等[12]研究表明,在干旱胁迫条件下,小麦MDA含量升高。
上述研究多为胁迫对作物生理特性的影响,而前人对干旱锻炼后小麦苗期抗氧化特性指标的变化鲜有报道,而苗期又是研究小麦抗逆能力的关键期,为此本试验以PEG6000模拟干旱胁迫,对经苗期锻炼的小麦在干旱胁迫下抗氧化特性指标进行了动态研究,以期为实现小麦抗旱能力的提高提供一定的理论依据[2-3,9]。
1 材料和方法
1.1 试验材料
本试验选用的小麦品种是青麦6号,由青岛农业大学小麦遗传与育种实验室提供。试验于2015年12月-2017年10月在青岛农业大学农学院的山东省旱作农业技术重点实验室进行。
1.2 试验设计
挑选籽粒饱满健康的小麦种子,首先用0.1%双氧水消毒5 min,蒸馏水反复冲洗数次后,再用蒸馏水浸泡24 h,置于25 ℃恒温光照培养箱中避光培养24 h露白后,挑选露白均匀一致的籽粒用1/2霍格兰氏(Hoagland)营养液通氧培养。出苗均匀后0~7 d用1/2的Hoagland营养液培养,生长7 d后换成Hoaland全营养液。小麦生长至一叶一心时,选取生长一致的幼苗将根系洗净,对照CK不做处理,锻炼T换为15% PEG6000的营养液进行培养。5 d后停止锻炼进行恢复,对照和处理均换成Hoaland全营养液进行培养。至小麦生长到三叶一心时,将对照CK分为CK1和CK2,处理T分为T1和T2,CK1和T1营养液中PEG浓度增加至25%、CK2和T2营养液中PEG浓度增加至35%(表1),继续进行培养。在0,2,4,6,8 d分别取植株叶片测定相关指标。
表1 不同试验处理方案
Tab.1 Treatments of different stress

处理Treatment锻炼培养液Priming nutrition恢复培养液Recovery nutrition胁迫培养液Stress nutritionCK1Hoaland营养液Hoaland营养液25%PEG6000 Hoaland营养液CK2Hoaland营养液Hoaland营养液35%PEG6000 Hoaland营养液T115%PEG6000 Hoaland营养液Hoaland营养液25%PEG6000 Hoaland营养液T215%PEG6000 Hoaland营养液Hoaland营养液35%PEG6000 Hoaland营养液
1.3 测定项目及方法
参照王爱国等[13]的方法测定超氧化物歧化酶(SOD)活性;采用愈创木酚法[14]测定过氧化物酶(POD)活性;丙二醛(MDA)含量的测定采用硫代巴比妥酸法[14];可溶性蛋白质含量测定采用考马斯亮蓝法[16],蒽酮比色法[17]测定小麦旗叶的可溶性糖含量,以上指标均用鲜样测定。
1.4 数据处理
数据、图表处理利用Excel 2010进行整理,利用 SAS 9.1进行统计分析和差异显著分析。
2 结果与分析
2.1 干旱胁迫对小麦叶片SOD活性的影响
由表2所示,各处理SOD(以鲜质量计)活性随干旱胁迫浓度和时间的增加而降低,在胁迫8 d出现最小值。各处理在开始胁迫时SOD活性差异不显著,随胁迫时间的增加,与对照相比,经锻炼的处理T1、T2的SOD活性降低程度较小,尤其是经锻炼的T1处理在2~8 d胁迫时间内都保持较高的活性,各处理SOD活性表现为T1>T2>CK1>CK2。与35% PEG6000 胁迫相较,25% PEG6000 胁迫下小麦叶片的SOD活性相对较高。第8天T1处理的活性为开始胁迫时(0 d)的67.32%,CK1处理为开始胁迫时的58.75%,T2处理为开始胁迫时的64.32%,CK2处理仅为开始胁迫时的56.48%。以第8天各处理酶活性比较发现T1处理酶活性是对照CK1的1.08倍,T2处理酶活性是CK2的1.16倍,T1酶活性是T2的1.05倍。
表2 干旱胁迫对小麦叶片SOD活性的影响
Tab.2 Effects of drought stress on SOD activity in wheat leaves U/g
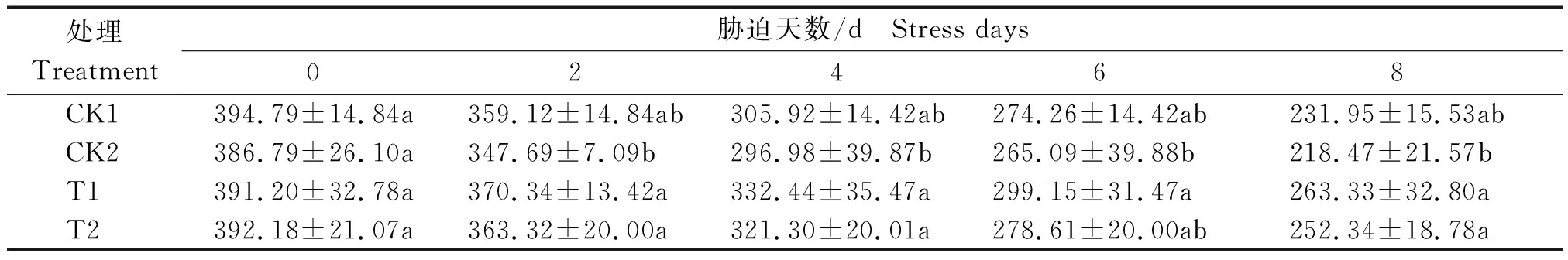
处理Treatment胁迫天数/d Stress days02468CK1394.79±14.84a359.12±14.84ab305.92±14.42ab274.26±14.42ab231.95±15.53abCK2386.79±26.10a347.69±7.09b296.98±39.87b265.09±39.88b218.47±21.57bT1391.20±32.78a370.34±13.42a332.44±35.47a299.15±31.47a263.33±32.80aT2392.18±21.07a363.32±20.00a321.30±20.01a278.61±20.00ab252.34±18.78a
注:不同小写字母表示同列不同处理间差异显著(P<0. 05)。表3-6同。
Note:Different lowercase letters indicate the same column significant difference between treatments(P<0 05).The same as Tab.3-6.
2.2 干旱胁迫对小麦叶片POD活性的影响
由表3可知,各处理POD(以鲜质量计)活性随干旱胁迫浓度和时间的增加而降低,在胁迫8 d出现最小值。各处理在开始胁迫时POD活性差异不显著,在干旱胁迫的第4天和第8天,经锻炼的处理T2的POD活性与对照相比差异显著且降低程度较小。经锻炼的T1处理在2~8 d胁迫时间内都保持较高的酶活性,且在干旱胁迫的第4天和第6天,T1的POD活性与对照相比差异显著且降低程度较小;各处理POD活性表现为T1>T2>CK1>CK2。与25% PEG6000胁迫相较,35% PEG6000胁迫下小麦叶片的POD活性相对较低。第8天T1处理的酶活性为开始胁迫时(0d时)的61.70%,CK1处理为开始胁迫时的54.25%,T2处理为开始胁迫时的58.67%,CK2处理仅为开始胁迫时的49.59%。以第8天各处理酶活性比较发现,T1处理酶活性是对照CK1的1.11倍,T2处理酶活性是CK2的1.18倍,T1酶活性是T2的1.05倍。
表3 干旱胁迫对小麦叶片POD活性的影响
Tab.3 Effects of drought stress on POD activity in wheat leaves U/(g·min)

处理Treatment胁迫天数/d Stress days02468CK1444.23±15.09a367.94±12.21b317.16±25.09b268.19±12.16b240.98±16.16abCK2438.30±10.11a364.15±7.21b291.83±21.13c252.94±18.58b217.36±18.58bT1434.92±11.04a400.34±14.10a353.63±24.57a298.83±17.10a268.33±25.93aT2436.76±10.01a383.04±5.77ab344.94±15.28a283.00±25.17ab256.25±15.28a
2.3 干旱胁迫对小麦叶片可溶性蛋白含量的影响
由表4所示,各处理可溶性蛋白含量随干旱胁迫浓度和时间的增加而降低,在胁迫8 d出现最小值。各处理在开始胁迫时可溶性蛋白含量差异不显著,随胁迫时间的增加,与对照相比,经锻炼的处理T1、T2的可溶性蛋白含量降低程度较小,尤其是经锻炼的T1处理在2,4,6,8 d胁迫时间内都保持较高的含量,各处理可溶性蛋白含量表现为T1>T2>CK1>CK2。与35% PEG6000 胁迫相较,25% PEG6000 胁迫下小麦叶片的可溶性蛋白含量相对较高。第8天T1处理的可溶性蛋白含量为开始胁迫时(0 d)的46.95%,CK1处理为开始胁迫时的38.48%,T2处理为开始胁迫时的64.32%,CK2处理仅为开始胁迫时的48.61%。以第8天各处理含量比较发现,T1处理含量是对照CK1的1.26倍,T2处理含量是CK2的1.50倍,T1含量是T2的1.04倍。
表4 干旱胁迫对小麦叶片可溶性蛋白含量的影响
Tab.4 Effects of drought stress on soluble protein content in wheat leaves mg/g
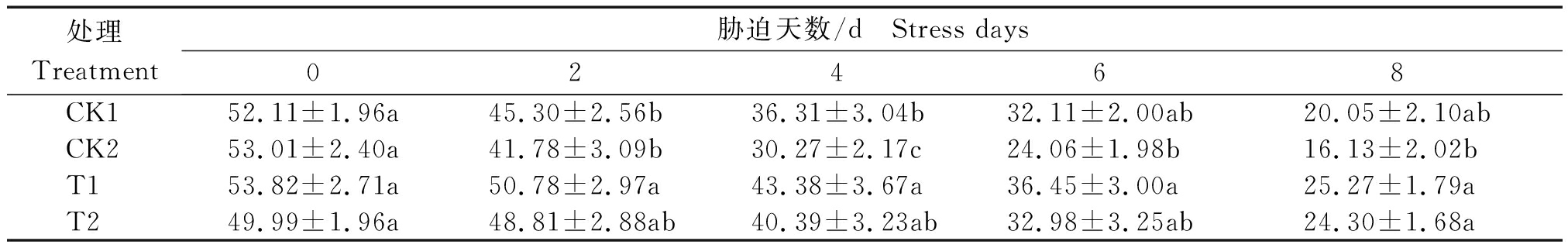
处理Treatment胁迫天数/d Stress days02468CK152.11±1.96a45.30±2.56b36.31±3.04b32.11±2.00ab20.05±2.10abCK253.01±2.40a41.78±3.09b30.27±2.17c24.06±1.98b16.13±2.02bT153.82±2.71a50.78±2.97a43.38±3.67a36.45±3.00a25.27±1.79aT249.99±1.96a48.81±2.88ab40.39±3.23ab32.98±3.25ab24.30±1.68a
2.4 干旱胁迫对小麦叶片可溶性糖含量的影响
由表5所示,可溶性糖含量(以鲜质量计)随干旱胁迫浓度和时间的增加而升高,干旱胁迫浓度增加可溶性糖含量降低,各处理在胁迫8 d出现最大值。各处理在开始胁迫时可溶性糖含量差异不显著,随胁迫时间的增加,与对照相比,经锻炼的处理T1、T2的可溶性糖含量升高程度较大,尤其是经锻炼的T1处理在2,4,6,8 d胁迫时间内都保持较高的含量,各处理可溶性糖含量表现为T1>T2>CK1>CK2。与35% PEG6000 胁迫相较,25% PEG6000 胁迫下小麦叶片的可溶性糖含量升高幅度相对较大。第8天T1处理的可溶性糖含量为开始胁迫时(0 d)的2.83倍,CK1处理为开始胁迫时的1.79倍,T2处理为开始胁迫时的1.95倍,CK2处理仅为开始胁迫时的1.52倍。以第8天各处理含量比较发现,T1处理含量是对照CK1的1.55倍,T2处理含量是CK2的1.30倍,T1含量是T2的1.50倍。
表5 干旱胁迫对小麦叶片可溶性糖含量的影响
Tab.5 Effects of drought stress on soluble sugar content in wheat leaves mg/(g·h)
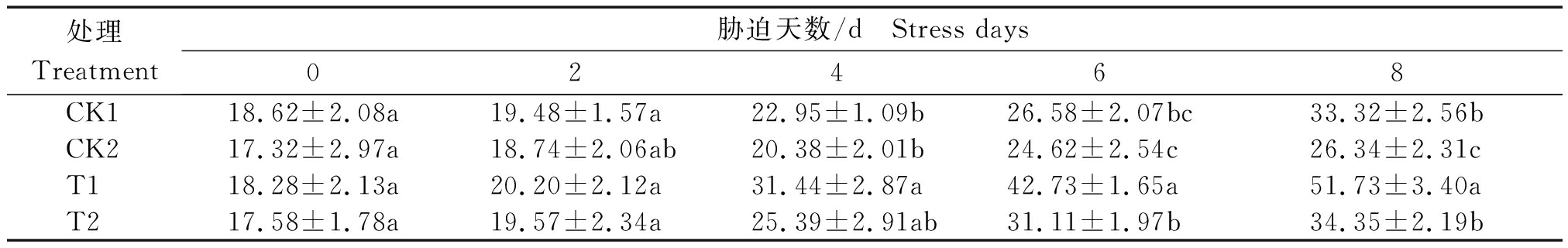
处理Treatment胁迫天数/d Stress days02468CK118.62±2.08a19.48±1.57a22.95±1.09b26.58±2.07bc33.32±2.56bCK217.32±2.97a18.74±2.06ab20.38±2.01b24.62±2.54c26.34±2.31cT118.28±2.13a20.20±2.12a31.44±2.87a42.73±1.65a51.73±3.40aT217.58±1.78a19.57±2.34a25.39±2.91ab31.11±1.97b34.35±2.19b
2.5 干旱胁迫对小麦叶片丙二醛含量的影响
由表6所示,各处理丙二醛含量(以鲜质量计)随干旱胁迫浓度和时间的增加而升高,各处理在胁迫8 d出现最大值。各处理在开始胁迫时丙二醛含量差异不显著,随胁迫时间的增加,经锻炼的处理T1、T2的丙二醛含量分别与对照相比,升高程度较小,叶片中积累的丙二醛含量较低,尤其是经锻炼的T1处理在2~8 d胁迫时间内都保持相对较低的含量,各处理丙二醛含量表现为T1 表6 干旱胁迫对小麦叶片丙二醛含量的影响 处理Treatment胁迫天数/d Stress days02468CK111.83±2.94a12.67±2.08ab15.60±2.18ab19.90±1.07ab25.17±1.86abCK211.97±0.78a15.00±0.91a17.10±0.95a24.60±2.27a29.86±1.64aT111.00±1.62a11.97±1.62b13.83±0.80b15.57±1.02b18.00±1.09cT212.07±0.59a12.97±1.13ab14.10±1.69b16.17±1.69b22.23±2.10b 干旱胁迫能够显著影响植物碳水化合物的代谢平衡,轻度的干旱条件即可使植株发生反应,改变生长和代谢过程[4-5]。干旱等逆境胁迫能够导致植株体内活性氧产生与清除系统的失衡,使得干旱胁迫下的植株体内积累大量的活性氧,导致代谢系统的紊乱。植株在干旱胁迫下保持较高的抗氧化系统酶SOD、POD的活性及渗透调节物质,有利于清除多余的活性氧减轻其伤害,以达到构建新的动态平衡的目的[10]。本试验发现,轻度干旱锻炼有利于SOD、POD活性的增强,干旱锻炼组小麦叶片中SOD、POD酶活性明显高于对照组,与35% PEG6000 胁迫相较,25% PEG6000 胁迫下小麦叶片的2种酶活性都相对较高,这与谢燕等[12]的研究结果一致,而其发现重度干旱可使POD含量降低,可能是因为小麦品种或培育环境等因素不同所致。 植株叶片中国的氮主要是以可溶性蛋白的形式存在,叶片衰老主要表现为可溶性蛋白含量降低。可溶性蛋白也是植株体内渗透调节物质之一。蛋白质含量在植物体内处于合成与降解的动态平衡之中[15]。本试验表明,在干旱锻炼后,锻炼组小麦叶片中可溶性蛋白含量明显高于对照组小麦叶片中可溶性蛋白含量,尤其是CK2与T2之间含量差距最为明显,与35% PEG6000 胁迫相较,25% PEG6000 胁迫下小麦叶片的可溶性蛋白含量相对较高。这与前人的观点一致[16,18],可溶性蛋白的含量高能够使植物细胞维持相对较低的渗透势,进而缓解干旱胁迫带来的伤害。 高等植物体内的主要光合产物以及碳水化合物代谢的主要形式是可溶性糖,同时可溶性糖也是植物体内重要的渗透物质[17]。在严重干旱状态下,植物细胞中蔗糖含量迅速增加,对细胞具有保护作用[17]。在本试验中,干旱锻炼组小麦叶片可溶性糖含量维持在一个相对较高水平,表明可溶性糖含量积累明显,可增强其渗透调节能力,在较低的叶水势下维持生长,这与许红[17]的研究结果一致。 MDA作为质膜过氧化过程的重要产物,其含量的高低在一定程度上可以直接反映质膜过氧化的程度,以及植物抵抗逆境条件的能力[19-20]。本试验中,所有处理的MDA含量均增加,但幅度有所不同,干旱锻炼组的小麦较对照组的MDA含量增加较缓慢且积累量较少,说明干旱锻炼可以降低膜系统受损程度,保持其正常生理代谢功能,延缓衰老。这与赵燕昊等[11]研究表明,在干旱胁迫条件下小麦的MDA含量升高的结论相吻合,但增加幅度不同,可能与试验环境等因素不同有关。 在本试验条件下小麦经过一定浓度PEG6000的干旱锻炼,可明显改变其体内抗氧化相关酶的活性和可溶性渗透调节物质的含量,增强对干旱环境的适应能力,有利于幼苗期的生长和发育,以T1处理效果最为明显,可见经低浓度干旱锻炼可以提高小麦在相对较低的干旱胁迫环境下的抗氧化能力,进而提升小麦的抗旱能力,为小麦的抗逆性研究提供了一定的理论支持。在一定浓度范围内,随锻炼的干旱浓度增加,其耐旱能力是否变化更明显,还有待于进一步的验证。 [1] 施成晓,陈婷,王昌江,秦晓梁,廖允成. 干旱胁迫对不同抗旱性小麦种子萌发及幼苗根芽生物量分配的影响[J].麦类作物学报,2016,36(4):483-490. doi:10.7606/j.issn.1009-1041.2016.04.14. Shi C X,Chen T,Wang C J,Qin X L,Liao Y C. Effect of drought stress on seed germination and biomass allocation of root and shoot of different drought resistant wheat cultivars[J].Journal of Triticeae Crops,2016,36(4):483-490. [2] Mohammadi R. Breeding for increased drought tolerance in wheat:A review[J].Crop and Pasture Science,2018,69(3):223. doi:10.1071/cp17387. [3] 陈军,高贵珍,方雪梅,吕晓娇. 干旱胁迫对小麦萌发期POD、CAT活性的影响[J].安徽农业科学,2014,42(17):5360-5361,5389. doi:10.13989/j.cnki.0517-6611.2014.17.065. Chen J,Gao G Z,Fang X M,Lü X J. Effects of drought stress on activity of POD and CAT in wheat during generation period[J].Journal of Anhui Agricultural Sciences,2014,42(17):5360-5361,5389. [4] Duan Y F,Zhang W S,Li B,Wang Y N,Li K X,Sodmergen,Han C Y,Zhang Y Z,Li X. An endoplasmic Reticulum response pathway mediates programmed cell death of root tip induced by water stress in Arabidopsis[J].The New Phytologist,2010,186(3):681-695. doi:10.1111/j.1469-8137.2010.03207.x. [5] Abid M,Tian Z W,Ata-Ul-karim S T,Liu Y,Cui Y K,Zahoor R,Jiang D,Dai T B. Improved tolerance to post-anthesis drought stress by pre-drought priming at vegetative stages in drought-tolerant and-sensitive wheat cultivars[J].Plant Physiology and Biochemistry,2016,106:218-227. doi:10.1016/j.plaphy.2016.05.003. [6] Gonzalez-Dugo V,Durand J L,Gastal F. Water deficit and nitrogen nutrition of crops.A review[J].Agronomy for Sustainable Development,2010,30(3):529-544.doi:10.1051/agro/2009059. [7] 孙海丽,王文佳,刘梦兰,丁位华,梁静. 小麦抗旱鉴定指标的研究现状与进展[J].河南科技学院学报(自然科学版),2020,48(4):1-7. Sun H L,Wang W J,Liu M L,Ding W H,Liang J. The research status and progress on identification indicators of wheat drought resistance[J].Journal of Henan Institute of Science and Technology (Natural Science Edition),2020,48(4):1-7. [8] 吴珍. PEG6000模拟干旱对兰黑粒小麦苗期生理特性的影响[J].陕西农业科学,2016,62(11):9-12. doi:10.3969/j.issn.0488-5368.2016.11.004. Wu Z. Effects of PEG6000 simulated drought on physiological characteristics of blue and black wheat seedlings[J].Shaanxi Journal of Agricultural Sciences,2016,62(11):9-12. [9] 常慧萍,付瑞敏,杨雪,邢文会,韩鸿鹏,夏铁骑,张红. 干旱胁迫下假单胞菌HN1202对小麦种子萌发及幼苗生长的影响[J].河南教育学院学报(自然科学版),2019,28(2):46-53. doi:10.3969/j.issn.1007-0834.2019.02.010. Chang H P,Fu R M,Yang X,Xing W H,Han H P,Xia T Q,Zhang H. Effect of Pseudomonas sp. HN1202 on seed germination and seedling growth of wheat under drought stress[J].Journal of Henan Institute of Education (Natural Science Edition),2019,28(2):46-53. [10] 张凯,马兰英,马丽媛. 不同温度条件下模拟干旱胁迫对小麦种子萌发的影响[J].江苏农业科学,2020,48(20):79-82. doi:10.15889/j.issn.1002-1302.2020.20.013. Zhang K,Ma L Y,Ma L Y. Effect of simulated drought stress on wheat seed germination under different temperature conditions[J].Jiangsu Agricultural Sciences,2020,48(20):79-82. [11] 赵燕昊,曹跃芬,孙威怡,戎均康. 小麦抗旱研究进展[J].植物生理学报,2016,52(12):1795-1803. doi:10.13592/j.cnki.ppj.2016.0299. Zhao Y H,Cao Y F,Sun W Y,Rong J K. The research advances in drought resistance in wheat[J].Plant Physiology Journal,2016,52(12):1795-1803. [12] 谢燕,张庆龙,胡玲,王法宏,李豪圣,孔令安. PEG胁迫对不同小麦品种幼苗抗旱生理指标的影响[J].麦类作物学报,2017,37(7):947-954. doi:10.7606/j.issn.1009-1041.2017.07.12 Xie Y,Zhang Q L,Hu L,Wang F H,Li H S,Kong L A. Physiological responses of different wheat cultivars to PEG stress[J].Journal of Triticeae Crops,2017,37(7):947-954. [13] 王爱国,罗广华,邵从本,吴淑君,郭俊彦. 大豆种子超氧物歧化酶的研究[J].植物生理学报,1983,9(1):77-84. Wang A G,Luo G H,Shao C B,Wu S J,Guo J Y. A study on the superoxide dismutase of soybean seeds[J].Physiology and Molecular Biology of Plants,1983,9(1):77-84. [14] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000:164-169. Li H S. Experimental principles and techniques of plant physiology and biochemistry[M].Beijing: Higher Education Press,2000:164-169. [15] El-Samad H M,Shaddad M A K. Salt tolerance of soybean cultivars[J].Biologia Plantarum,1997,39(2):263-269. doi:10.1023/a:1000309407275. [16] 孟祥浩,刘义国,张玉梅,张洪生,穆平,林琪. 不同小麦品种苗期抗氧化特性及根系活力对盐胁迫的响应[J].麦类作物学报,2015,35(8):1168-1175. doi:10.7606/j.issn.1009-1041.2015.08.20. Meng X H,Liu Y G,Zhang Y M,Zhang H S,Mu P,Lin Q. Responses of antioxidant properties and root activity of different wheat varieties to salt stress at seedling stage[J].Journal of Triticeae Crops,2015,35(8):1168-1175. [17] 许红. 干旱胁迫下多胺对小麦种子萌发的影响及其机理研究[D].杨凌:西北农林科技大学,2016. Xu H. Effect of polyamine on seed germination of wheat under drought and mechanism research[D].Yangling:Northwest A & F University,2016. [18] 李同花,王笑,蔡剑,周琴,戴廷波,姜东. 不同小麦品种对干旱锻炼响应的综合评价[J].麦类作物学报,2018,38(1):65-73. Li T H,Wang X,Cai J,Zhou Q,Dai T B,Jiang D. Comprehensive evaluation of drought priming on plant tolerance in different wheat cultivars[J].Journal of Triticeae Crops,2018,38(1):65-73. [19] 滕开琼,司冰,贾文华. PEG胁迫条件下水旱稻种子萌发的生理效应及脂质过氧化作用的影响[J].河南农业,2017(1):48-49. doi:10.15904/j.cnki.hnny.2017.01.082. Teng K Q,Si B,Jia W H. Physiological effects of PEG stress on germination and lipid peroxidation of upland rice seeds [J].Henan Nongye,2017(1):48-49. [20] 张军,吴秀宁,王新军. 盐胁迫对小麦幼苗根系生长的影响[J].商洛学院学报,2016,30(4):52-55. doi:10.13440/j.slxy.1674-0033.2016.04.014. Zhang J,Wu X N,Wang X J. Effects of salt stress on root growth of wheat at its seedling stage[J].Journal of Shangluo University,2016,30(4):52-55.
Tab.6 Effects of drought stress on malonaldehyde content in wheat leaves nmol/g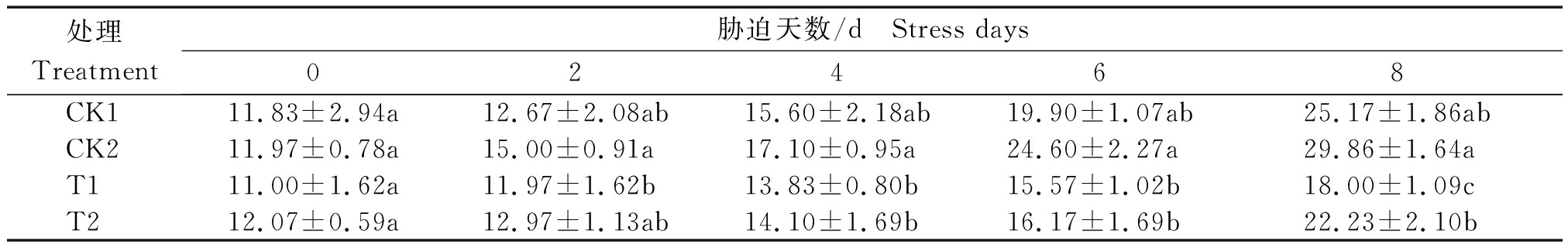
3 讨论与结论
