高温是全球普遍存在的自然灾害,尤其进入21 世纪以来,全球气候变暖引起的高温天气频发以及极端高温,严重限制植物生长发育,是影响作物产量的主要非生物胁迫因素之一[1]。因此,研究作物对高温的响应机制对认知和提升作物抗高温能力具有十分重要的理论和现实意义。
近年来,中外学者对植物适应高温胁迫的机制研究越来越广泛,从植物形态、生理特性和细胞结构以及分子机制做出了较为详细的阐述。研究表明,高温胁迫会破坏植物细胞稳态,导致植物结构发生严重变化、代谢功能和生理过程紊乱,从而影响植物的生长和产量形成,甚至造成植株死亡[2-3]。在正常环境下,植物体内活性氧(ROS)含量较少,对维持细胞内信号系统稳定起着重要作用,高温胁迫下,植物细胞氧化还原平衡发生改变,导致ROS含量急剧增加,如超氧阴离子![]() 过氧化氢(H2O2)、羟自由基(·OH)等,ROS 过量积累能够引起蛋白质变性、DNA的断裂和降解以及膜脂过氧化程度加深,对细胞结构和功能造成破坏,导致植物遭受氧化损伤[4-5]。为了有效避免体内ROS的过量积累,植物自身演化出一系列氧化防御系统,主要包括抗氧化酶和抗氧化物质,常见的抗氧化酶有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等[6],短期高温胁迫能够诱导抗氧化酶活性增加,有助于清除ROS,缓解应激相关细胞损伤[7-9],而在极端高温或长期高温胁迫下,由于抗氧化酶蛋白质结构破坏和活性的耗竭,抗氧化酶活性显著下降,导致植物细胞氧化还原系统严重失衡,造成植物死亡[10-11]。ROS的产生部位主要为叶绿体、线粒体和过氧化物酶体[12],其中叶绿体是植物光合作用的主要细胞器,对高温胁迫高度敏感,据报道,高温胁迫显著降低了光合作用,主要是由于气孔的关闭、叶绿素的降解以及光系统Ⅱ(PSⅡ)结构完整性遭到破坏,从而抑制羧化中心对CO2的同化能力和光能的吸收转化能力,以及导致电子传递链的中断,造成植物能量供应不足和氧化损伤加重,引起植株萎蔫和枯死等现象[13-16]。
过氧化氢(H2O2)、羟自由基(·OH)等,ROS 过量积累能够引起蛋白质变性、DNA的断裂和降解以及膜脂过氧化程度加深,对细胞结构和功能造成破坏,导致植物遭受氧化损伤[4-5]。为了有效避免体内ROS的过量积累,植物自身演化出一系列氧化防御系统,主要包括抗氧化酶和抗氧化物质,常见的抗氧化酶有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等[6],短期高温胁迫能够诱导抗氧化酶活性增加,有助于清除ROS,缓解应激相关细胞损伤[7-9],而在极端高温或长期高温胁迫下,由于抗氧化酶蛋白质结构破坏和活性的耗竭,抗氧化酶活性显著下降,导致植物细胞氧化还原系统严重失衡,造成植物死亡[10-11]。ROS的产生部位主要为叶绿体、线粒体和过氧化物酶体[12],其中叶绿体是植物光合作用的主要细胞器,对高温胁迫高度敏感,据报道,高温胁迫显著降低了光合作用,主要是由于气孔的关闭、叶绿素的降解以及光系统Ⅱ(PSⅡ)结构完整性遭到破坏,从而抑制羧化中心对CO2的同化能力和光能的吸收转化能力,以及导致电子传递链的中断,造成植物能量供应不足和氧化损伤加重,引起植株萎蔫和枯死等现象[13-16]。
芝麻(Sesamum indicum L.)是我国特色油料作物之一,目前,高温灾害是制约我国芝麻生产的重要非生物胁迫因子,关于芝麻对高温胁迫响应研究报道较少,因此,探究芝麻对高温的响应机制十分必要。本研究选用耐热性和热敏感的2个芝麻品种为材料,在苗期进行不同时间的高温胁迫,测定叶片中膜脂过氧化相关指标(相对电导率、丙二醛、ROS)、抗氧化酶(SOD、POD和CAT)活性、光合气体交换参数、叶绿素荧光参数,并进行气孔扫描电镜观察、叶绿体透射电镜观察,分析耐热性差异显著的2个品种响应高温胁迫时生理变化差异,为深入探究芝麻耐热机理和品种改良提供理论依据。
1 材料和方法
1.1 供试材料
选用的郑太芝3号(耐热性品种)和SP19(热敏性品种)芝麻品种由河南省农业科学院芝麻研究中心提供。选取籽粒饱满、大小均一的种子播种在塑料盆(直径16 cm,高度14 cm)中,每个处理3 盆。培养基质为营养土和珍珠岩配制比例3∶1,培养温度为30 ℃,相对湿度为70%。待植株长至2对真叶时,选取长势一致的植株进行处理。
1.2 试验方法
将郑太芝3号和SP19植株分别置于30 ℃(对照,CK)和45 ℃(高温,HT)恒温培养箱中连续处理10 d,培养条件:昼夜14 h/10 h,相对湿度70%,光照350 μmol/(m2·s)。待处理4,6,8,10 d后进行形态指标、相对含水量和光合特性指标测定,收集叶片,在液氮中速冻后保存于-80 ℃超低温冰箱中,用于生理生化指标测定。
1.3 测定项目与方法
分别对每个处理植株用标尺测定株高、叶长和叶宽;采集叶片后立即称量鲜质量(FW),然后将叶片浸入去离子水中4~5 h,用吸水纸擦干称质量即为饱和鲜质量(TW),之后将叶片放入烘箱中105 ℃杀青15 min,再在80 ℃烘至恒质量即为干质量(DW),计算相对含水量(%)=(FW-DW)/(TW-DW)×100%;相对电导率(REC)采用电解质渗漏法进行测定;叶绿素含量测定利用便携式SPAD-502 叶绿素仪测定SPAD值;SOD、POD、CAT活性,丙二醛(MDA)含量以及![]() 产生速率和H2O2含量均采用试剂盒(格锐思生物,苏州),按照说明进行操作测定,每个处理3次重复。选取从基部起第3对真叶,采用GFS-3000 光合作用测定仪(WALZ,德国)测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)等气体交换参数,测定时间在9:00-10:30,有效辐射强度为1 500 mol/(m2·s)。利用双通道调制叶绿素荧光仪Dual-PAM-100(WALZ,德国)测定芝麻叶片叶绿素荧光参数:用叶片夹夹住叶片,暗适应30 min后,分别测定初始荧光(Fo)、最大荧光(Fm),以及最小荧光(Fo′)、稳态荧光(Fs)等荧光参数,计算实际量子产量(φPS Ⅱ)、电子传递速率(ETR)和PS Ⅱ最大光化学效率(Fv/Fm)。采集从基部起第3对真叶,用刀片将叶片主叶脉两侧部位切取小方块,放入2 mL 离心管中,置入戊二醛进行固定。一部分用PBS清洗,经过乙醇梯度脱水后,进行乙酸异戊酯置换处理,然后干燥,喷金,在扫描电子显微镜下观察叶绿体结构变化和拍照;另一部分按照PBS清洗-锇酸固定-清洗-乙醇梯度脱水-渗透-包埋步骤处理后,进行切片,用醋酸双氧铀和柠檬酸铅染色,在透射电子显微镜下进行观察和拍照。
产生速率和H2O2含量均采用试剂盒(格锐思生物,苏州),按照说明进行操作测定,每个处理3次重复。选取从基部起第3对真叶,采用GFS-3000 光合作用测定仪(WALZ,德国)测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)等气体交换参数,测定时间在9:00-10:30,有效辐射强度为1 500 mol/(m2·s)。利用双通道调制叶绿素荧光仪Dual-PAM-100(WALZ,德国)测定芝麻叶片叶绿素荧光参数:用叶片夹夹住叶片,暗适应30 min后,分别测定初始荧光(Fo)、最大荧光(Fm),以及最小荧光(Fo′)、稳态荧光(Fs)等荧光参数,计算实际量子产量(φPS Ⅱ)、电子传递速率(ETR)和PS Ⅱ最大光化学效率(Fv/Fm)。采集从基部起第3对真叶,用刀片将叶片主叶脉两侧部位切取小方块,放入2 mL 离心管中,置入戊二醛进行固定。一部分用PBS清洗,经过乙醇梯度脱水后,进行乙酸异戊酯置换处理,然后干燥,喷金,在扫描电子显微镜下观察叶绿体结构变化和拍照;另一部分按照PBS清洗-锇酸固定-清洗-乙醇梯度脱水-渗透-包埋步骤处理后,进行切片,用醋酸双氧铀和柠檬酸铅染色,在透射电子显微镜下进行观察和拍照。
1.4 数据处理与统计分析
试验数据利用Microsoft Excel 2010软件进行统计和整理,利用SPSS 16.0进行数据差异显著性分析。
2 结果与分析
2.1 高温胁迫对芝麻幼苗生长发育和相对含水量的影响
由表1可知,随高温胁迫时间的延长,2种芝麻的株高、叶长、叶宽和相对含水量相比对照均呈下降趋势。高温处理4 d,郑太芝3号和SP19幼苗的株高和叶宽下降不显著(P>0.05),仅SP19幼苗的叶长开始显著下降(P<0.05),较对照减少了15.82%。胁迫6 d,SP19幼苗的株高、叶长和相对含水量均显著下降(P<0.05),分别较对照减少了9.28%,17.32%和8.13百分点。当胁迫8,10 d时,郑太芝3号幼苗的叶长较对照下降了14.42%和14.61%,相对含水量较对照下降了11.07,14.87百分点,差异均达显著水平,其他指标下降不显著;而SP19幼苗的株高下降了8.21%和14.03%,叶长下降了25.79%和31.30%,叶宽下降了10.48%和14.17%,相对含水量下降了18.68,22.07百分点,差异均达显著水平。品种间比较来看,在高温胁迫下,郑太芝3号的株高、叶长、叶宽和相对含水量受抑制程度均低于SP19。
表1 高温胁迫对芝麻幼苗生长特性和相对含水量的影响
Tab.1 Effects of heat treatment on growth characteristics and relative water content of sesame seedlings
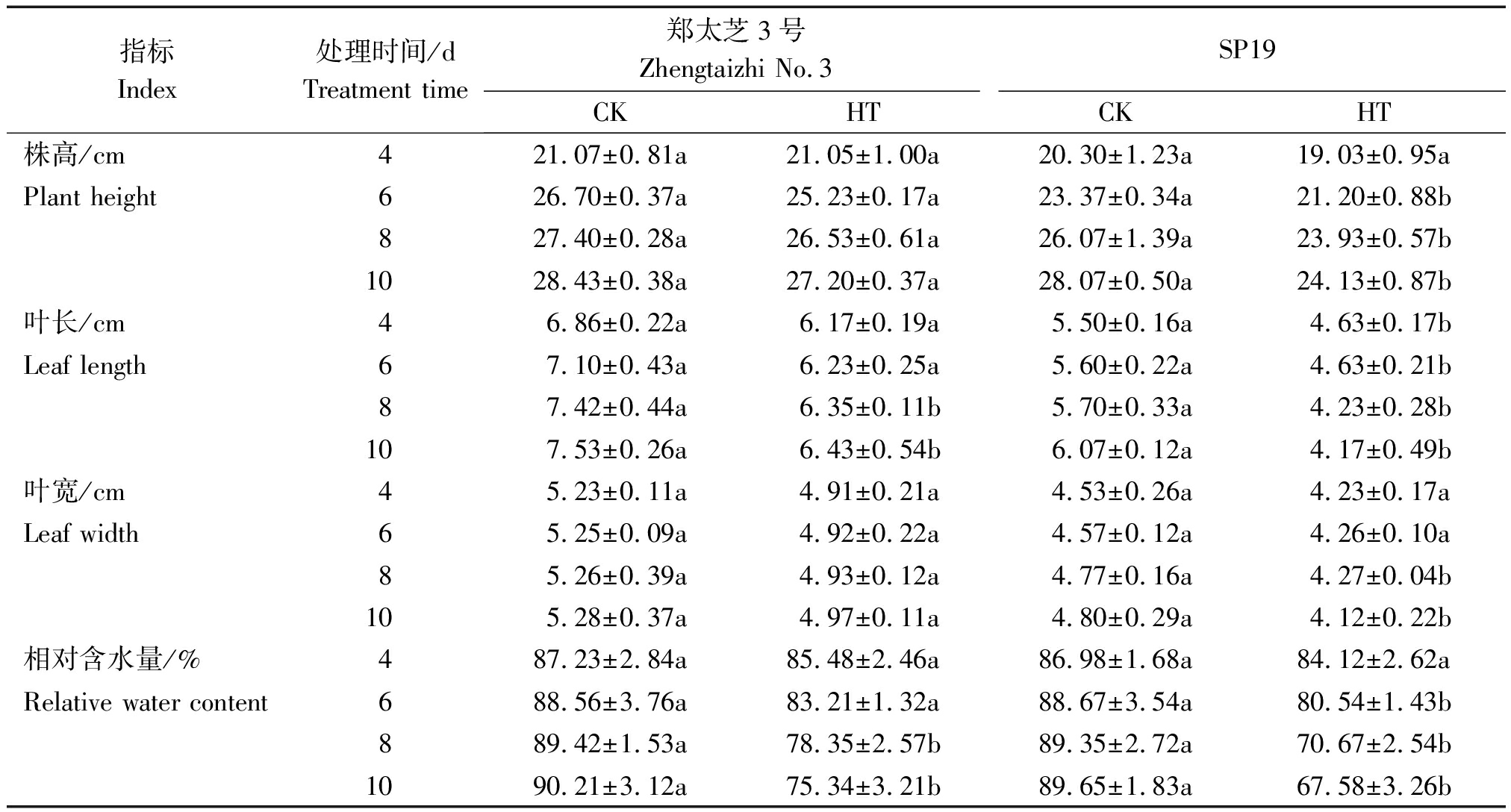
指标Index处理时间/dTreatment time郑太芝3号Zhengtaizhi No.3SP19CKHTCKHT株高/cm421.07±0.81a21.05±1.00a20.30±1.23a19.03±0.95aPlant height626.70±0.37a25.23±0.17a23.37±0.34a21.20±0.88b827.40±0.28a26.53±0.61a26.07±1.39a23.93±0.57b1028.43±0.38a27.20±0.37a28.07±0.50a24.13±0.87b叶长/cm46.86±0.22a6.17±0.19a5.50±0.16a4.63±0.17bLeaf length67.10±0.43a6.23±0.25a5.60±0.22a4.63±0.21b87.42±0.44a6.35±0.11b5.70±0.33a4.23±0.28b107.53±0.26a6.43±0.54b6.07±0.12a4.17±0.49b叶宽/cm45.23±0.11a4.91±0.21a4.53±0.26a4.23±0.17aLeaf width65.25±0.09a4.92±0.22a4.57±0.12a4.26±0.10a85.26±0.39a4.93±0.12a4.77±0.16a4.27±0.04b105.28±0.37a4.97±0.11a4.80±0.29a4.12±0.22b相对含水量/%487.23±2.84a85.48±2.46a86.98±1.68a84.12±2.62aRelative water content688.56±3.76a83.21±1.32a88.67±3.54a80.54±1.43b889.42±1.53a78.35±2.57b89.35±2.72a70.67±2.54b1090.21±3.12a75.34±3.21b89.65±1.83a67.58±3.26b
注:不同小写字母表示同一品种在同一时间不同温度处理下差异显著(P<0.05)。
Note:Different lowercase letters show significant difference(P<0.05)of the same variety at the same time and different temperature.
2.2 高温胁迫对芝麻幼苗相对电导率、丙二醛含量和活性氧水平的影响
由图1可知,高温胁迫不同程度地提高了芝麻幼苗的相对电导率、丙二醛、活性氧含量。郑太芝3号和SP19幼苗的多数相关指标均在高温胁迫6 d开始显著(P<0.05)增加。高温胁迫6 d,郑太芝3号幼苗叶片的相对电导率较对照显著增加了3.03百分点,8,10 d极显著增加了4.50,5.83百分点,丙二醛含量分别增加了22.31%,42.68%和82.47%,过氧化氢含量分别增加了20.11%,32.44%和60.87%,超氧阴离子产生速率分别增加了38.80%,62.42%和77.25%,而SP19相对电导率分别增加了4.33,8.40,13.43百分点,丙二醛含量分别增加了44.85%,70.62%和97.21%,过氧化氢含量分别增加了20.11%,32.44%和60.87%,超氧阴离子产生速率分别增加了48.31%,94.62%和134.35%。品种间比较来看,在高温胁迫下,SP19幼苗的质膜相对透性和氧化损伤程度明显高于郑太芝3号。
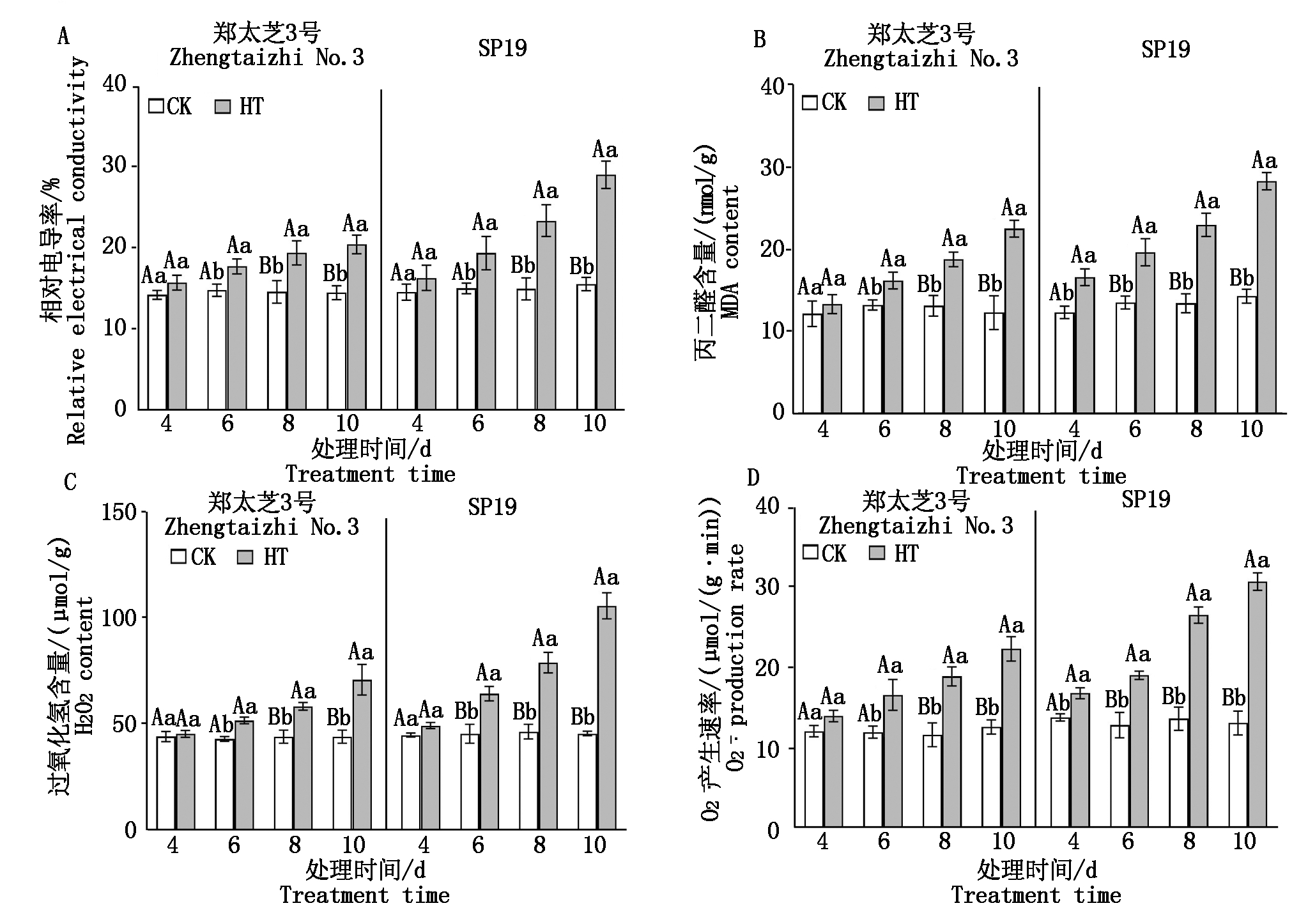
不同小写字母表示同一时期不同处理存在显著差异(P<0.05);不同大写字母表示存在极显著差异(P<0.01)。图2-5同。
Different lowercase letters indicate that there are significant differences (P<0.05) between different treatments in the same period;
Different big letters indicate a very significant difference(P<0.01). The same as Fig.2-5.
图1 高温胁迫对芝麻幼苗相对电导率、丙二醛含量和活性氧水平的影响
Fig.1 Effects of heat treatment on REC,MDA content and ROS level in the seedling leaves of sesame
2.3 高温胁迫对芝麻幼苗抗氧化酶活性的影响
由图2可知,随高温胁迫时间的延长,郑太芝3号和SP19幼苗的SOD和CAT活性均呈先增加后降低的变化趋势,而POD活性均逐渐升高。在胁迫8 d时,郑太芝3号和SP19幼苗的SOD活性均增至最高值,较对照分别增加了2.93,2.63倍,差异均达极显著水平。郑太芝3号和SP19幼苗的CAT活性分别在高温胁迫8,6 d增至最高值,分别增加了1.10,0.99倍,差异均达极显著水平。在胁迫10 d时,郑太芝3号和SP19幼苗的POD活性较对照分别增加了1.86,1.52倍,差异达极显著水平。品种间比较来看,郑太芝3号SOD、POD和CAT活性均高于SP19。
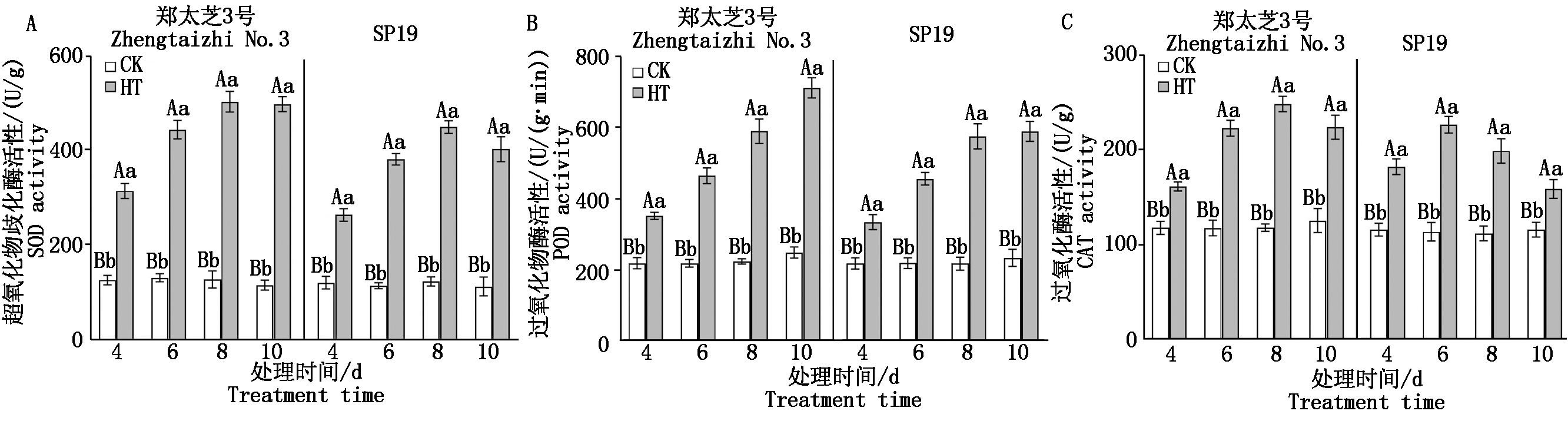
图2 高温胁迫对芝麻幼苗抗氧化酶活性的影响
Fig.2 Effects of heat treatment on antioxidant enzyme activities in the seedling leaves of sesame
2.4 高温胁迫对芝麻幼苗叶绿素含量的影响
由图3可知,随高温胁迫时间的延长,郑太芝3号和SP19幼苗的叶绿素含量(SPAD值)呈不断下降趋势,从高温胁迫 6 d郑太芝3号和SP19幼苗的叶绿素含量均开始显著下降。胁迫至 10 d,郑太芝3号和SP19幼苗的叶绿素含量分别极显著降低了14.37%和27.55%。

图3 高温胁迫对芝麻幼苗叶绿素含量的影响
Fig.3 Effects of heat treatment on chlorophyll content
in the seedling leaves of sesame
2.5 高温胁迫对芝麻幼苗气体交换参数的影响
由图4可知,随着胁迫时间的延长,郑太芝3号幼苗的Pn、Tr、Ci和Gs 均呈现逐渐下降趋势。胁迫4 d 时,郑太芝3号幼苗的Pn较对照略有升高,但差异不显著,Tr、Ci和 Gs较对照增加了30.97%,10.40%和8.9%,差异均达显著水平,胁迫6 d,郑太芝3号幼苗的Pn显著下降了11.26%,而Tr、Ci和Gs下降不显著,胁迫 8 d,郑太芝3号幼苗的Pn较对照显著下降了11.58%,10 d极显著下降了18.41%,而Tr较对照分别下降了21.31%和28.49%,Ci分别下降了18.78%和30.45%,Gs分别下降了16.10%和23.31%,差异均达极显著水平。

图4 高温胁迫对芝麻幼苗气体交换参数的影响
Fig.4 Effects of heat treatment on gas exchange parameter in the seedling leaves of sesame
SP19幼苗的Pn、Tr、Gs随着胁迫时间的增加也均呈现逐渐下降趋势,而 Ci 在处理 6 d时降至最低值后呈现上升趋势。胁迫 4 d 时,SP19幼苗的Ci和Gs较对照略有升高,但差异不显著,Pn略有下降,Tr较对照增加了30.36%,差异达极显著水平,胁迫6 d 时,SP19幼苗的Pn下降了21.87%,Tr下降了11.85%,Ci下降了10.74%,Gs下降了9.37%,差异均达显著水平,在胁迫8 ,10 d 时,SP19幼苗的Pn较对照分别下降了37.90%和56.98%,Tr较对照分别下降了28.94%和40.60%,Ci较对照分别提高了5.62%和17.49%,Gs分别下降了26.75%和38.02%,除8 d Ci外差异均达显著水平。
2.6 高温胁迫对芝麻幼苗叶绿素荧光参数的影响
如图5所示,2种供试芝麻品种幼苗叶片的Fv/Fm、φPSⅡ和ETR(Ⅱ)均随着高温胁迫时间的延长而呈现不断下降趋势,郑太芝3号幼苗的Fv/Fm、φPSⅡ和ETR(Ⅱ)均在胁迫8 d开始显著下降,而SP19幼苗的相关指标在胁迫6 d开始呈现显著下降。胁迫6 d SP19幼苗的Fv/Fm、φPSⅡ和ETR(Ⅱ)较对照分别下降了12.30%,11.04%和9.52%。高温胁迫8 d,10 d郑太芝3号幼苗的Fv/Fm较对照分别下降了14.29%和20.92%,φPSⅡ较对照分别下降了17.61%和31.62%,ETR(Ⅱ)分别下降了11.10%和22.72%;而SP19幼苗的Fv/Fm较对照分别下降了24.02%和37.15%,φPSⅡ较对照分别下降了32.68%和54.90%,ETR(Ⅱ)分别下降了22.55%和34.94%。
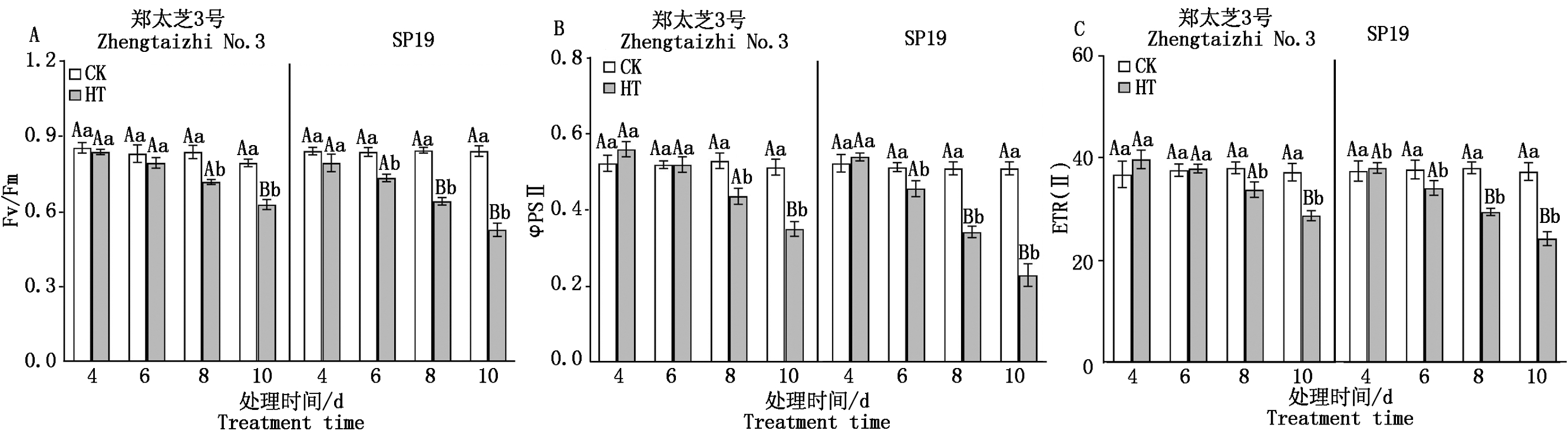
图5 高温胁迫对芝麻幼苗叶绿素荧光参数的影响
Fig.5 Effects of heat treatment on chlorophyll fluorescence
parameters in the seedling leaves of sesame
2.7 高温胁迫对芝麻幼苗叶片气孔形态的影响
通过利用扫描电镜对2种芝麻叶片的气孔形态进行观察,如图6所示,在正常环境下,2种芝麻品种的气孔开放程度较高,气孔周围下表皮细胞表面较为平滑,且蜡质纹饰不明显,而在45 ℃高温处理10 d后,郑太芝3号和SP19的叶片气孔发生明显改变,气孔周围的表皮细胞呈现凹凸不平,大部分气孔处于关闭或半关闭状态并且保卫细胞皱缩变形,陷于周围的表皮内。品种间比较来看,高温胁迫下,郑太芝3号叶片气孔不完全闭合,气孔周围的表皮细胞趋于平整光滑,保卫细胞皱缩变形不明显,而SP19叶片气孔处于完全闭合状态,保卫细胞皱缩变形严重,且周围的表皮细胞凹凸不平严重。
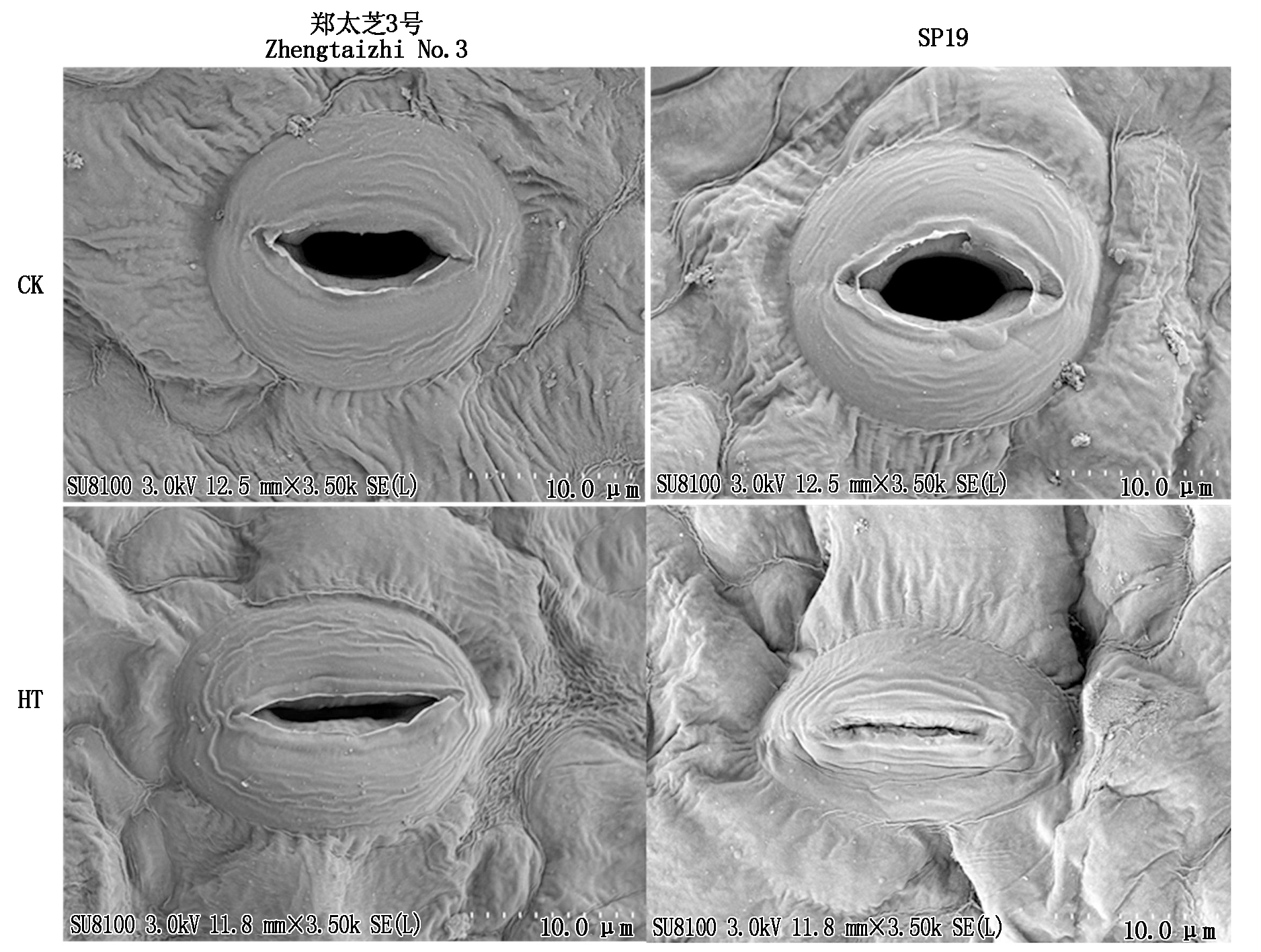
图6 高温胁迫10 d对芝麻幼苗气孔形态的影响
Fig.6 Effects of heat treatment for 10 d on stomatal morphology in the seedling leaves of sesame
2.8 高温胁迫对芝麻幼苗叶片叶绿体结构的影响
如图7所示,常温下,芝麻叶绿体呈月牙状,紧贴细胞膜,膜结构完整,基粒片层规则排列且清晰,均匀分布在叶绿体中,叶绿体中存在着淀粉粒和少量嗜锇颗粒。高温处理10 d后,芝麻叶绿体体积变大,形状趋于圆型,叶绿体膜有解体现象,基粒片层堆叠增厚,淀粉粒消失,叶绿体移动至细胞内部。同时,在SP19叶绿体上观察到大量嗜锇颗粒,基粒片层部分已经断裂甚至解体,尽管郑太芝3号叶绿体上观察到嗜锇颗粒有所增加但明显少于SP19,基粒片层断裂较少。这些结果表明,高温下郑太芝3号叶绿体结构的稳定性高于SP19。
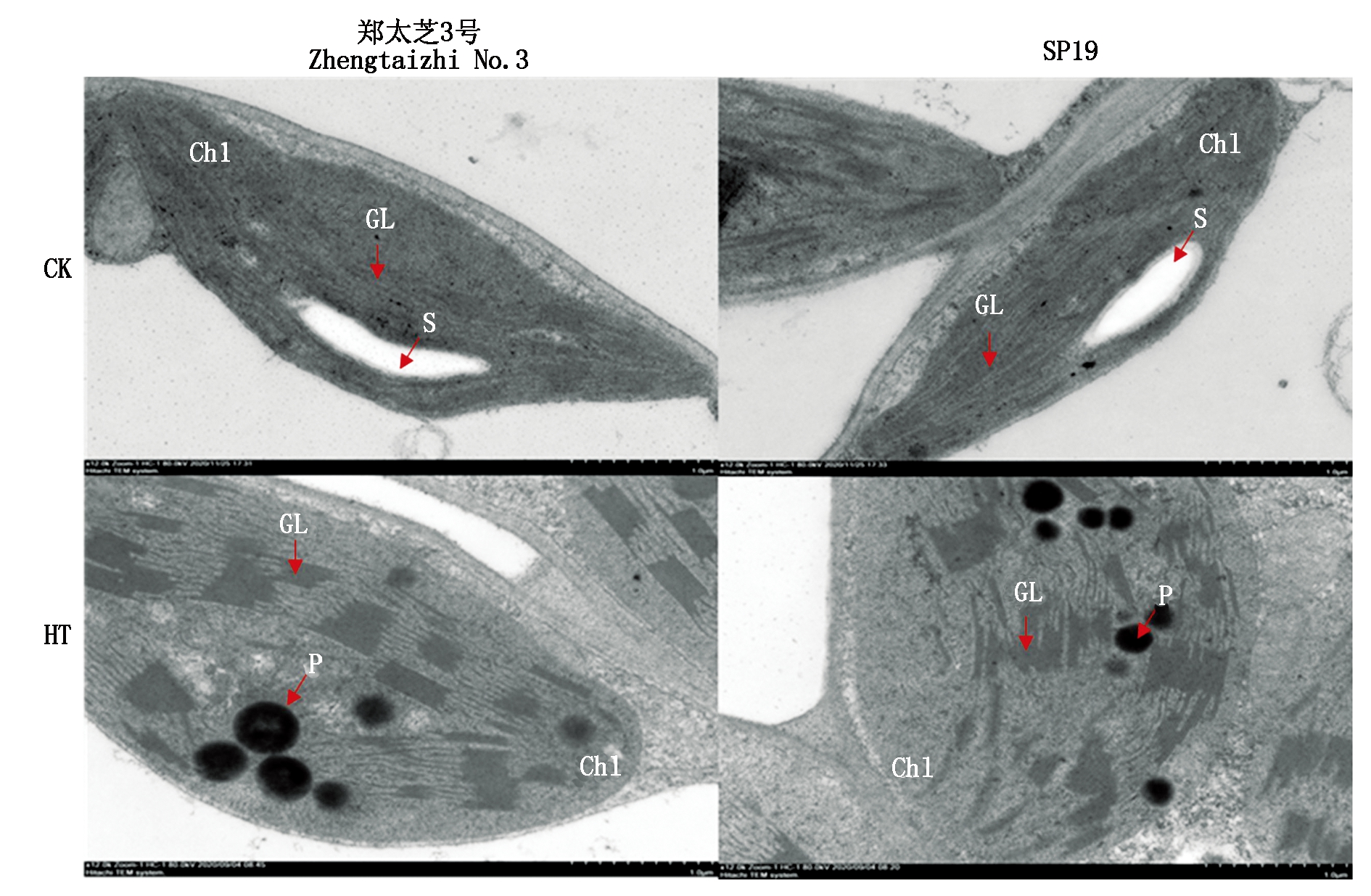
Chl.叶绿体;S.淀粉粒;P.嗜锇颗粒;GL.基粒片层。
Chl.Chloroplast;S.Starch grain;P.Plastoglobule;GL.Grana lamellae.
图7 高温胁迫10 d对芝麻幼苗叶绿体超微结构的影响
Fig.7 Effects of heat treatment for 10 d on chloroplast ultrastructure in the seedling leaves of sesame
3 讨论与结论
植物对高温胁迫响应是较为复杂又相互协调的生物学调控过程,其中主要包括分子、细胞、生理生化的响应,导致植物形态发生改变[17]。研究表明,高温胁迫能够引起植物光合作用和氧化应激发生明显改变,造成植物生长发育受到抑制[18]。目前,关于植物对高温胁迫的生理生化响应在较多作物中已作了大量研究,但关于芝麻对高温的生理响应机制尚无报道,本研究对芝麻幼苗在不同胁迫时间下的形态、生理以及显微结构变化进行全面的分析,并比较不同耐热性芝麻品种响应高温胁迫的生理特性差异,旨在明确芝麻幼苗对高温胁迫响应和适应机制。
3.1 不同耐热性芝麻品种生长参数对高温胁迫的响应变化
高温胁迫下,植物生理代谢过程出现紊乱,造成其生长发育受到抑制[19]。本研究表明,随高温胁迫时间延长,不同耐热性芝麻幼苗叶长、叶宽以及相对含水量不同程度下降,热敏感芝麻品种的株高受到显著抑制,而耐热性芝麻品种株高略受抑制,这一结果在其他作物研究中也得到证实[20-21],说明高温胁迫对芝麻的生长发育产生了一系列负面影响。此外,不同耐热性芝麻品种响应高温胁迫时存在着差异,本研究中,胁迫4~10 d时,耐热性品种郑太芝3号的株高和叶宽略有下降但不显著,叶长和相对含水量显著下降的胁迫时间为8 d;而热敏感品种SP19株高和相对含水量均在胁迫时间6 d时开始显著下降,叶宽开始显著下降时间为8 d,叶长为4 d,说明高温胁迫下芝麻幼苗的生长发育抑制程度与不同品种耐热性密切相关,且相比热敏感品种SP19,高温胁迫对耐热性品种郑太芝3号生长的影响程度较小。
3.2 不同耐热性芝麻品种光合特性对高温胁迫的响应变化
光合作用在植物的生长发育中扮演着重要角色,较多研究表明,光合作用对高温胁迫较为敏感,高温胁迫导致植物的光抑制,使光系统破坏,促进叶绿素的降解和光合同化的降低[22-23]。在本研究中,随着高温胁迫的加剧,光合指标 Pn、Gs、Tr、Ci和相对叶绿素含量均降低,表明高温胁迫对芝麻幼苗的光合作用具有显著的抑制作用。此外,研究发现,在胁迫4 d时,2种芝麻品种幼苗的叶绿素含量略微减少,而Pn、Gs、Tr、Ci较对照均有不同程度的提高,这可能是由于在较短时间的高温胁迫下,芝麻通过提高自身的蒸腾作用,启动降温的自身保护机制,诱导气孔的开放,增加了外界二氧化碳的摄入量,从而提高了自身的净光合速率。植物光合作用的抑制主要受气孔和非气孔限制,随着胁迫时间的延长,植物为了减少自身水分大量蒸发,保持体内细胞膨胀压力,诱导气孔关闭,但减少了与外界环境的气体交换,同时叶绿素合成受到抑制,从而造成Pn的下降[24-25],本研究结果也证实这一结论,在高温胁迫6 d时,2种芝麻品种Pn、Gs、Tr和Ci 都呈降低趋势,而郑太芝3号的Fv/Fm、φPS Ⅱ 和ETR 在处理 6 d 时变化较小,仅SP19的Fv/Fm、φPS Ⅱ 和ETR有所下降,表明短期的高温胁迫下芝麻幼苗光合能力受抑制的主要因素为气孔限制。然而在高温胁迫8~10 d,2种芝麻品种的光合指标 Pn、Gs和Tr均不同程度地下降,有趣的是,敏感品种SP19的Ci与郑太芝3号结果相反呈上升趋势。前人研究表明,Ci 和Gs变化趋势是判断Pn下降的气孔或非气孔因素的主要依据,Ci 值随胁迫程度上升,而Gs 却表现为下降趋势时,非气孔限制是Pn下降的主要因素[26- 27]。进一步对高温胁迫10 d 2种芝麻品种幼苗叶片的气孔开放程度进行观察,发现耐热性品种郑太芝3号气孔处于半关闭状态而热敏感品种SP19气孔为完全关闭状态。这些结果表明,在重度高温胁迫时,非气孔限制是芝麻叶片Pn 下降的主要因素。相比较于热敏感品种SP19,耐热性品种郑太芝3号表现为气孔和非气孔限制较低,说明芝麻品种的耐热性与气孔限制密切相关。
非气孔限制主要由于植物叶片叶绿素含量减少,光系统的稳定性和完整性遭到破坏,叶绿体机构遭到破坏,致使光系统活性降低,从而造成Pn 下降[25]。研究表明,在非生物胁迫下,PSⅡ是光系统最敏感的部位,易受到胁迫损伤,而光系统Ⅰ较为稳定[28]。PSⅡ作为光系统反应中心,是调节光能吸收、转化以及电子传递速率的主要部位[29]。本研究发现,2 个芝麻品种随着高温胁迫时间延长,Fv/Fm、φPSⅡ和ETR(Ⅱ)均呈下降趋势,表明高温胁迫下,芝麻幼苗叶片PSⅡ受到损害,活性降低。相比较于热敏感品种SP19,高温胁迫下耐热性品种郑太芝3号Fv/Fm、φPSⅡ和ETR(Ⅱ)下降程度较低,这与前人研究结论相一致[10],表明PSⅡ活性在芝麻耐热性中扮演着重要角色。对高温胁迫10 d 2种品种叶片叶绿体结构观察表明,高温胁迫后2种品种叶绿体结构受到不同程度的破坏,整体表现为叶绿体趋于圆形,向膜内移动,基粒堆积加厚和片层断裂,嗜锇颗粒变大和增多,与前人结果较为相似[30-31],表明高温导致芝麻叶绿体超微结构发生变化从而造成光合机构的破坏。相比较于热敏感品种SP19,耐热性品种郑太芝3号的叶绿体结构较为稳定,表明叶绿体结构的稳定性对提高芝麻的耐热能力起着关键性作用。此外,这些结果进一步证实了重度高温胁迫下,非气孔限制是导致芝麻幼苗Pn 下降的主要原因。
3.3 不同耐热性芝麻品种活性氧和抗氧化酶活性对高温胁迫的响应变化
较多研究表明,高温胁迫打破 ROS产生和清除之间的平衡,诱导其过量积累[32]。高温胁迫导致叶绿体结构的破坏,抑制了 PS Ⅱ 活性,叶绿体作为ROS的主要产生部位,PS Ⅱ 活性降低导致激发能量从天线传递到反应中心受阻,引起能量过剩从而产生过量的ROS,造成氧化损伤加剧膜脂过氧化作用,MDA含量增加,破坏植物细胞内部环境[33]。本研究表明,随着高温胁迫时间的延长,ROS和MDA含量均呈现不同程度的上升趋势,说明高温胁迫下,芝麻幼苗生长受到抑制与ROS的过量积累密切相关,加剧了光合机构和功能的破坏,造成植物受到氧化损伤。相比较于热敏感品种SP19,同一胁迫时间下耐热性品种郑太芝3号ROS和MDA含量增加程度较低,表明维持ROS的平衡和降低膜脂过氧化程度是芝麻具有较高耐热性的关键因素。
为了有效保持ROS在植物体内的平衡,植物自身演化出一系列的抗氧化防御系统。在非生物胁迫下,抗氧化酶系统积极发挥作用,SOD、POD和CAT为植物重要的抗氧化酶,植物通过提高其活性来维持ROS 代谢平衡[6,34]。本研究结果表明,高温胁迫下芝麻幼苗叶片中SOD、POD和CAT活性均高于对照,且3 种酶活性增幅相比,SOD 活性提高幅度较大,POD其次,SOD作为抗氧化应激的第一道防线,较高SOD活性能有效去除![]() 说明在芝麻幼苗中SOD对高温胁迫较为敏感,在芝麻耐热性中起着关键性作用,这一结果与刘敏等[18]结论一致。随高温胁迫时间的延长,2种不同的芝麻品种SOD和 CAT增长趋势发生改变,热敏感品种SP19中SOD和 CAT活性呈现先升高后降低趋势,酶活性最高值分别在处理后8,6 d,尽管耐热性品种郑太芝3号变化趋势相同,但其酶活性最高值均在8 d,这一结果与Zou等[35]报道相似,轻度高温处理能够激活酶活性,而重度高温胁迫下酶活性下降,然而Djanaguiraman等[36]研究发现,SOD、POD和CAT活性均随胁迫时间的延长呈下降趋势,这可能与不同物种对高温胁迫程度和时间响应不同有关。此外,本研究发现,这3种酶活性在同一胁迫时间下郑太芝3号均高于SP19,说明维持较高抗氧化能力是芝麻提高耐热能力的关键因素。
说明在芝麻幼苗中SOD对高温胁迫较为敏感,在芝麻耐热性中起着关键性作用,这一结果与刘敏等[18]结论一致。随高温胁迫时间的延长,2种不同的芝麻品种SOD和 CAT增长趋势发生改变,热敏感品种SP19中SOD和 CAT活性呈现先升高后降低趋势,酶活性最高值分别在处理后8,6 d,尽管耐热性品种郑太芝3号变化趋势相同,但其酶活性最高值均在8 d,这一结果与Zou等[35]报道相似,轻度高温处理能够激活酶活性,而重度高温胁迫下酶活性下降,然而Djanaguiraman等[36]研究发现,SOD、POD和CAT活性均随胁迫时间的延长呈下降趋势,这可能与不同物种对高温胁迫程度和时间响应不同有关。此外,本研究发现,这3种酶活性在同一胁迫时间下郑太芝3号均高于SP19,说明维持较高抗氧化能力是芝麻提高耐热能力的关键因素。
综上,本试验通过对2种不同耐热性芝麻品种的生长特性和生理变化分析,发现高温胁迫能够破坏光合系统结构和功能,造成ROS过量积累,显著降低叶绿素含量和净光合速率,明显抑制芝麻幼苗的生长,尤其热敏感品种SP19 中光系统活性中心对高温胁迫较为敏感,不可逆损伤明显高于郑太芝3号,且净光合速率降低在轻度高温胁迫下主要由于气孔限制因素,随胁迫时间延长非气孔限制因素占主导地位。另外,明确了郑太芝3号在高温胁迫下,植株体内抗氧化酶活性较高、膜脂过氧化程度较低、叶绿体结构稳定和叶绿素降解少是其具有高耐热性的关键。这些结果为芝麻耐热性品种选育和改良提供了理论依据。
[1] Deryng D,Conway D,Ramankutty N,Price J,Warren R.Global crop yield response to extreme heat stress under multiple climate change futures[J].Environmental Research Letters,2014,9(3):034011.doi:10.1088/1748-9326/9/3/034011.
[2] 王涛,田雪瑶,谢寅峰,张往祥.植物耐热性研究进展[J].云南农业大学学报,2013,28(5):719-726.doi:10.3969/j.issn.1004-390X(n).2013.05.019.
Wang T,Tian X Y,Xie Y F,Zhang W X.Research advance on heat-stress tolerance in plants[J].Journal of Yunnan Agricultural University,2013,28(5):719-726.
[3] Bokszczanin K L,Solanaceae Pollen Thermotolerance Initial Training Network(SPOT-ITN)Consortium,Fragkostefanakis S.Perspectives on deciphering mechanisms underlying plant heat stress response and thermotolerance[J].Front Plant Sci,2013,4: 315.doi:10.3389/fpls.2013.00315.
[4] Djanaguiraman M,Prasad P V V,Seppanen M.Selenium protects sorghum leaves from oxidative damage under high temperature stress by enhancing antioxidant defense system[J].Plant Physiology and Biochemistry,2010,48(12):999-1007.doi: 10.1016/j.plaphy.2010.09.009.
[5] Ruelland E,Zachowski A.How plants sense temperature[J].Environmental and Experimental Botany,2010,69(3):225-232.doi:10.1016/j.envexpbot.2010.05.011.
[6] Bueno P,Piqueras A.Effect of transition metals on stress,lipid peroxidation and antioxidant enzyme activities in tobacco cell cultures[J].Plant Growth Regulation,2002,36(2):161-167.doi:10.1023/A:1015044705137.
[7] Kumar R R.Protection against heat stress in wheat involves change in cell membrane stability,antioxidant enzymes,osmolyte,H2O2 and transcript of heat shock protein[J].International Journal of Plant Physiology and Biochemistry,2012,4(4):83-91.
[8] 田佳,李佳,孟清波,李中勇,徐继忠.不同苹果品种叶片耐热阈值及高温下生理生化响应[J].河南农业科学,2021,50(1):121-128.doi:10.15933/j.cnki.1004-3268.2021.01.015.
Tian J,Li J,Meng Q B,Li Z Y,Xu J Z.Heat tolerance threshold and physiological and biochemical responses of leaves of different apple varieties[J].Journal of Henan Agricultural Sciences,2021,50(1):121-128.
[9] Ding H D,He J,Wu Y,Wu X X,Ge C L,Wang Y J,Zhong S L,Peiter E,Liang J S,Xu W F.The tomato mitogen-activated protein kinase SlMPK1 is as a negative regulator of the high-temperature stress response[J].Plant Physiology,2018,177(2):633-651.doi:10.1104/pp.18.00067.
[10] 王宏辉,顾俊杰,房伟民,陈发棣,张栋梁.高温胁迫对4个红掌盆栽品种生理特性的影响[J].华北农学报,2016,31(2):139-145.doi:10.7668/hbnxb.2016.02.023.
Wang H H,Gu J J,Fang W M,Chen F D,Zhang D L.Effect of high-temperature stress on physiological property of four potted cultivars of Anthurium andraeanum[J].Acta Agriculturae Boreali-Sinica,2016,31(2):139-145.
[11] 张俊环,黄卫东.葡萄幼苗在温度逆境交叉适应过程中活性氧及抗氧化酶的变化[J].园艺学报,2007,34(5):1073-1080.doi:10.3321/j.issn:0513-353x.2007.05.001.
Zhang J H,Huang W D.Changes of active oxygen and antioxidant enzymes in leaves of young grape plants during cross adaptation to temperature stress[J].Acta Horticulturae Sinica,2007,34(5):1073-1080.
[12] Foyer C H,Descourvières P,Kunert K J.Protection against oxygen radicals:an important defence mechanism studied in transgenic plants[J]. Plant Cell and Environment,1994,17(5):507-523.doi:10.1111/j.1365-3040.1994.tb00146.x.
[13] Gao Y,Guo Y K,Dai A H,Sun W J,Bai J G.Paraquat pretreatment alters antioxidant enzyme activity and protects chloroplast ultrastructure in heat-stressed cucumber leaves[J].Biologia Plantarum,2011,55(4):788-792.doi:10.1007/s10535-011-0189-1.
[14] Qi X L,Hu L,Dong H B,Zhang L,Wang G S,Gao C,Gang X W.Characteristics of photosynthesis in different wheat cultivars under high light intensity and high temperature stresses[J].Acta Agronomica Sinica,2008,34(12):2196-2201.doi: 10.3724/SP.J.1006.2008.02196.
[15] Li Y T,Xu W W,Ren B Z,Zhao B,Zhang J W,Liu P,Zhang Z S.High temperature reduces photosynthesis in maize leaves by damaging chloroplast ultrastructure and photosystem Ⅱ[J]. Journal of Agronomy and Crop Science,2020,206(5):548-564.doi:10.1111/jac.12401.
[16] Chen W R,Zheng J S,Li Y Q,Guo W D.Effects of high temperature on photosynthesis,chlorophyll fluorescence,chloroplast ultrastructure,and antioxidant activities in fingered citron[J].Russian Journal of Plant Physiology,2012,59(6):732-740.doi:10.1134/S1021443712060040.
[17] Wahid A,Gelani S,Ashraf M,Foolad A M R.Heat tolerance in plants:An overview[J].Environmental and Experimental Botany,2007,61(3):199-223.doi:10.1016/j.envexpbot.2007.05.011.
[18] 刘敏,房玉林.高温胁迫对葡萄幼树生理指标和超显微结构的影响[J].中国农业科学,2020,53(7):1444-1458.doi:10.3864/j.issn.0578-1752.2020.07.013.
Liu M,Fang Y L.Effects of heat stress on physiological indexes and ultrastructure of grapevines[J].Scientia Agricultura Sinica,2020,53(7):1444-1458.
[19] 徐海,宋波,顾宗福,毕研飞,魏斌.植物耐热机理研究进展[J].江苏农业学报,2020,36(1):243-250.doi:10.3969/j.issn.1000-4440.2020.01.034.
Xu H,Song B,Gu Z F,Bi Y F,Wei B.Advances in heat tolerance mechanisms of plants[J]. Jiangsu Journal of Agricultural Sciences,2020,36(1):243-250.
[20] 贾志银,巩振辉,许红娟,逯明辉.高温胁迫对辣椒幼苗生长及生理性状的影响[J].北方园艺,2010(12):5-8.
Jia Z Y,Gong Z H,Xu H J,Lu M H.Effect of high temperature stress on morphology and physiological characteristics of pepper seedlings[J].Northern Horticulture,2010(12):5-8.
[21] 陈绮翎,黄璇,周越,李强,周冀衡,程昌新.温度胁迫对不同烤烟品种幼苗生长及生理指标的影响[J].云南农业大学学报(自然科学),2016,31(3):462-468.doi:10.16211/j.issn.1004-390X(n).2016.03.013.
Chen Q L,Huang X,Zhou Y,Li Q,Zhou J H,Cheng C X.Effect of temperature stress on growth and physiological indexes of different varieties of flue-cured tobacco seedlings[J].Journal of Yunnan Agricultural University(Natural Science),2016,31(3):462-468.
[22] Carmo-Silva A E,Salvucci M E.The temperature response of CO2 assimilation,photochemical activities and Rubisco activation in Camelina sativa,a potential bioenergy crop with limited capacity for acclimation to heat stress[J].Planta,2012,236(5):1433-1445.doi:10.1007/s00425-012-1691-1.
[23] Mathur S,Jajoo A.Photosynthesis:Limitations in response to high temperature stress[J].Journal of Photochemistry and Photobiology B(Biology),2014,137:116-126.doi:1016/j.jphtobiol.2014.010.10.
[24] Song Y P,Chen Q Q,Ci D,Shao X N,Zhang D Q.Effects of high temperature on photosynthesis and related gene expression in poplar[J].BMC Plant Biology,2014,14:111.doi:10.1186/1471-2229-14-111.
[25] Dias A S,Semedo J,Ramalho J C,Lidon F C.Bread and durum wheat under heat stress:a comparative study on the photosynthetic performance[J].Journal of Agronomy and Crop Science,2011,197(1):50-56.doi: 10.1111/j.1439-037X.2010.00442.x.
[26] Gebhardt W.Photosynthetic efficiency[J].Radiation and Environmental Biophysics,1986,25(4):275-288.doi:10.1007/BF01214641.
[27] 张仁和,郑友军,马国胜,张兴华,路海东,史俊通,薛吉全.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
Zhang R H,Zheng Y J,Ma G S,Zhang X H,Lu H D,Shi J T,Xue J Q.Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding[J].Acta Ecologica Sinica,2011,31(5):1303-1311.
[28] Tikkanen M,Mekala N R,Aro E M.Photosystem Ⅱ photoinhibition-repair cycle protects Photosystem I from irreversible damage[J].Biochimica et Biophysica Acta,2014,1837(1):210-215.doi:10.1016/j.bbabio.2013.10.001.
[29] Rahoutei J,García-Luque I,Barón M.Inhibition of photosynthesis by viral infection:Effect on PSⅡ structure and function[J].Physiologia Plantarum,2000,110(2):286-292.doi: 10.1034/j.1399-3054.2000.110220.x.
[30] Vani B,Saradhi P P,Mohanty P.Alteration in chloroplast structure and thylakoid membrane composition due to in vivo heat treatment of rice seedlings:correlation with the functional changes[J].Journal of Plant Physiology,2001,158(5):583-592.doi:10.1078/0176-1617-00260.
[31] Zhang R,Wise R R,Struck K R,Sharkey T D.Moderate heat stress of Arabidopsis thaliana leaves causes chloroplast swelling and plastoglobule formation[J].Photosynthesis Research,2010,105(2):123-134.doi:10.1007/s11120-010-9572-6.
[32] Zang X S,Geng X L,Wang F,Liu Z S,Zhang L Y,Zhao Y,Tian X J,Ni Z F,Yao Y Y,Xin M M,Hu Z R,Sun Q X,Peng H R.Overexpression of wheat ferritin gene TaFER-5B enhances tolerance to heat stress and other abiotic stresses associated with the ROS scavenging[J].BMC Plant Biology,2017,17(1):14.doi:10.1186/s12870-016-0958-2.
[33] Asada K.Production and scavenging of reactive oxygen species in chloroplasts and their functions[J].Plant Physiology,2006,141(2):391-396.doi:10.1104/pp.106.082040.
[34] Almeselmani M,Qeshmukh P S,Sairam R K,Kushvaha S R,Singh T P.Protective role of antioxidant enzymes under high temperature stress[J].Plant Science,2006,171(3):382-388.doi:10.1016/j.plantsci.2006.04.009.
[35] Zou M Q,Yuan L Y,Zhu S D,Liu S,Ge J T,Wang C G.Effects of heat stress on photosynthetic characteristics and chloroplast ultrastructure of a heat-sensitive and heat-tolerant cultivar of wucai(Brassica campestris L.)[J].Acta Physiologiae Plantarum,2017,39(1):30-40.doi: 10.1007/s11738-016-2319-z.
[36] Djanaguiraman M,Boyle D L,Welti R,Jagadish S V K,Prasad P V V.Decreased photosynthetic rate under high temperature in wheat is due to lipid desaturation,oxidation,acylation,and damage of organelles[J].BMC Plant Biology,2018,18(1):55-72.doi: 10.1186/s12870-018-1263-z.