WRKY转录因子家族在植物中广泛存在,在拟南芥(Arabidopsis thaliana)[1]、水稻(Oryza sativa L.)[2]、大豆(Glycine max L.)[3]、玉米(Zea mays L.)[4]、小麦(Triticum aestivum L.)[5]、棉花(Gossypium hirsutum L.)[6]等植物中均已发现多个WRKY转录因子。WRKY转录因子家族参与了多种生物学过程,例如种子萌发[7-8]、植物生长和发育[9]、植物衰老[10]等。同时还发现WRKY转录因子家族参与了植物体内多种转录调控和信号转导过程[7,11-14],例如生物胁迫和非生物胁迫反应,植物免疫应答和病原体防御[15-16]。WRKY基因的结构域是由60个氨基酸残基所组成的,由于所有的WRKY转录因子都有一段高度保守的WRKYGQK结构域,所以被统称为WRKY转录因子[17]。研究表明,高度保守的WRKY结构域是WRKY转录因子最主要的特征,使其能特异识别靶基因启动子区的W-box(C/TTGACC/T)作用元件,直接或间接结合参与植物信号转导过程基因的顺式作用元件,从而诱导靶基因表达,调控植物各种发育与生理过程。研究证明,WRKY转录因子在调控干旱、低温、盐碱等胁迫响应途径中发挥重要作用[18-19]。例如,在拟南芥中过表达AtWRKY25、AtWRKY33基因可提高植株的耐盐性[20];拟南芥中过表达大豆GsWRKY20基因可以增强转基因植物的耐旱性[21];在拟南芥中过表达小麦TaWRKY79,当植株受到NaCl和ABA的诱导时,转基因植株表现出更强的耐受性[22];将大豆GmWRKY21在拟南芥中异源表达,与野生型植株相比,GmWRKY21转基因植株的耐冷性增强[23]。综上所述,WRKY蛋白是植物抗非生物胁迫的关键因子,但WRKY家族成员众多,参与的调控网络也十分复杂,人们对该家族基因的蛋白表达方面了解甚少。
紫花苜蓿(Medicago sativa L.)是一种重要的豆科牧草,在世界各地广泛种植,因其良好的饲用价值,成为畜牧业的首选青饲料之一[24]。但紫花苜蓿产量严重受盐碱、干旱、温度等环境条件的制约[25]。紫花苜蓿对非生物逆境的响应是一个非常复杂的过程,目前多从生理生化及分子生物学等角度对其进行解析[26-27]。蛋白质是植物各种生理变化的执行者,随着蛋白质组学的不断发展,越来越多的学者更注重蛋白质在植物体中的作用研究。相对于拟南芥、大豆等作物中的WRKY基因的研究,对紫花苜蓿WRKY转录因子在蛋白水平的研究鲜有报道。在前期的转录组高表达差异基因研究中发现,MsWRKY33基因在多种非生物逆境中均出现高丰度差异表达,推测其可能参与到非生物逆境的响应途径中,但是具体功能还有待进一步研究。为在蛋白水平上探索紫花苜蓿MsWRKY33基因的生物学功能,本研究以中苜1号紫花苜蓿为材料,对MsWRKY33蛋白结构特性进行了生物信息学分析,并基于抗原-抗体的特异性免疫识别,通过免疫印迹技术分析了多种逆境和ABA处理条件下MsWRKY33蛋白的表达特征。该研究丰富了对MsWRKY33基因功能的认识,并初步分析了MsWRKY33蛋白在紫花苜蓿响应多种非生物逆境中的作用。
1 材料和方法
1.1 试验材料
中苜1号紫花苜蓿为中国农业科学院北京畜牧兽医研究所育成品种。
1.2 试验方法
1.2.1 生物信息学分析 使用ExPASy(https://web.expasy.org/)对MsWRKY33蛋白理化性质进行预测;SMART(http://smart.embl-heidelberg.de/)用于预测MsWRKY33保守功能结构域;使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白跨膜序列;PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测信号肽等二级结构;用BEPITOPE软件对MsWRKY33蛋白进行免疫原性预测。确定该蛋白的免疫原性、可溶性、信号肽及跨膜区域等影响蛋白表达的区域。
1.2.2 MsWRKY33抗原序列的克隆 使用普洛麦格公司的RNA提取试剂盒提取中苜1号紫花苜蓿总RNA;利用Trans Script Green One-Step qRT-PCR反转录体系合成cDNA。以cDNA为模板,引物MsWRKY33-F:5′-TCAGGGATCCGGTAGTCATAATCATCCT-3′;MsWRKY33-R:5′-CGTAGTCGACTTAAACATTGTTGTTGTTG-3′,高保真酶Taq Polymerase(TaKaRa)扩增MsWRKY33抗原序列。PCR反应程序为94 ℃ 4 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 45 s,28个循环;72 ℃延伸10 min,1%琼脂糖凝胶电泳分离扩增的目的条带,用琼脂糖凝胶回收试剂盒回收目的片段。用SaIⅠ/BamHⅠ双酶切该目的片段和连接载体pET-SUMO,T4连接酶连接后转化大肠杆菌Trans5α,挑取单克隆进行PCR检测,阳性克隆送上海生工生物工程有限公司测序。
1.2.3 蛋白制备与纯化 将测序鉴定正确的重组质粒pET-MsWRKY33转化大肠杆菌BL21(DE3),挑取含重组质粒的单菌落至1 mL LB(Kan,50 μg/mL)中,37 ℃过夜培养,取10 μL菌液加入相同的250 mL LB培养基中,37 ℃振荡培养至OD600=0.6,取50 μL液体作为未诱导的对照组,余下的加入IPTG诱导剂至终浓度0.5 mmol/L作为试验组,两组继续在37 ℃振荡培养3 h。取菌体1 mL,10 360 r/min离心30 s收获沉淀,用100 μL 1%SDS重悬,混匀,100 ℃ 10 min。10 360 r/min离心10 min,取上清进行SDS-PAGE检测分析。
大量表达蛋白则取2 mL过夜培养菌液加入2 L LB(Kan,50 μg/mL)培养基中,37 ℃振荡培养至OD600约0.6,降低温度到30 ℃。加入IPTG诱导剂至终浓度0.5 mmol/L作为试验组,30 ℃继续振荡培养3 h。收集发酵液,10 360 r/min离心10 min收集菌体,由于重组蛋白端C具有His标签,可以进行镍柱亲和纯化。因此诱导表达后的菌体可悬浮于50 mL预冷的亲和层析NTA-0缓冲液中,冰浴超声波破碎细菌,控制功率为300 W,超声4 s,暂停4 s,超声90次。10 360 r/min 4 ℃离心30 min,收集上清以及沉淀。取少量样品进行聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测,剩余上清及沉淀置于4 ℃备用。
将Ni-NTA树脂装入合适的层析柱,用10倍柱床体积的NTA-0 Buffer冲洗。将剩余样品加到层析柱中,流速控制在0.5 mL/min左右,收集穿透部分。层析用10倍柱床体积的NTA-0 Buffer冲洗,流速控制在1 mL/min左右。分别用10倍柱床体积的NTA-20,NTA-60,NTA-200,NTA-500 Buffer洗脱,流速控制在1 mL/min左右,收集各洗脱峰。SDS-PAGE检测各组分。纯度达到要求的组分,置于透析带中,4 ℃以1×PBS透析(换液2次)。4 ℃超滤浓缩透析产物。
1.2.4 多克隆抗体的制备与纯化 将重组pET-MsWRKY33蛋白作为抗原(2 μg/mL),乳化后进行兔子免疫,总共经过6次免疫,每次免疫中间隔14 d,最后一次免疫3~5 d后心脏取血,4 ℃析出血清,获得含抗体的血清后用PBS洗涤纯化,使用Millipore蛋白浓缩管浓缩到所需体积,经过SDS-PAGE检测纯度,-20 ℃保存,避免反复冻融。同时,重组蛋白作为抗原(2 μg/mL),100 μL/孔加入聚苯乙烯96孔反应板中,4 ℃放置过夜。次日倾去孔内的液体,PBS洗涤3次。加100 μL/孔TBST,室温放置30 min,PBS洗涤3次。加入含待测抗体的抗血清(取血4 ℃过夜后5 980 r/min离心10 min得上清),将血清按1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000……进行倍比稀释(以空白血清做阴性对照),每孔100 μL,再加入HRP标记羊抗兔IgG(1∶10 000),100 μL/孔,37 ℃孵育30 min。酶标仪测定450 nm处各孔的吸光度值,阳性反应的最大稀释度为待测样品的效价。
1.2.5 样品处理 选取健康饱满的中苜1号紫花苜蓿种子,用砂纸轻轻擦出划痕以除硬实,置于预先铺好湿润滤纸的培养皿中萌发,待种子露白后,转移至1/2 MS液体培养基中,在人工智能温室中培养。培养条件为:光照16 h,温度25 ℃,光强400 μmol/(m2·s);黑暗8 h,温度23 ℃。
①干旱处理:将紫花苜蓿苗置于含15% PEG 6000的1/2 MS营养液中,于处理的0,6,12,24,48 h 5个时间点取样,液氮速冻后,-80 ℃保存备用。
②盐处理:将紫花苜蓿苗置于含150 mmol/L NaCl的1/2 MS营养液中,于处理的0,6,12,24,48 h 5个时间点取样,液氮速冻后,-80 ℃保存备用。
③低温处理:将紫花苜蓿苗置于4 ℃环境中,于处理的0,6,12,24,48 h 5个时间点取样,液氮速冻后,-80 ℃保存备用。
④脱落酸(Abscisic acid,ABA)处理:将紫花苜蓿苗置于含0.1 mmol/L ABA的1/2 MS营养液中,于处理的0,6,12,24,48 h 5个时间点取样,液氮速冻后,-80 ℃保存备用。
1.2.6 蛋白提取 将上述冻存的苜蓿样品在液氮中充分研磨,每100 mg样品加入1 mL蛋白质提取液(62.5 mmol/L Tris-HCl,pH=7.4)、10%甘油、0.1% SDS、2 mmol/L EDTA、1 mmol/L PMSF和5%β-巯基乙醇),立即混匀置于冰上30 min,每隔10 min涡旋振荡1次,10 360 r/min 4 ℃离心20 min,取上清即为总蛋白质,-20 ℃保存备用。
1.2.7 免疫印迹分析(Western Blotting,WB) 将各个处理的蛋白样品从-20 ℃冰箱中取出,沸煮5 min,10 360 r/min离心30 s。用DYCZ-24K型电泳仪(北京六一生物科技有限公司,北京)进行SDS-PAGE电泳,分离蛋白质,电泳完成后,将胶取下来,依据胶的大小剪取聚氧亚乙烯膜(PVDF)。PVDF膜用100%甲醇处理5 min。用DYCZ-24K型电转仪(北京六一生物科技有限公司,北京)进行膜转移:膜心黑色面(负极)在下,按照海绵、3层滤纸、胶、膜、3层滤纸、海绵的结构放置,过程中用玻璃棒赶净气泡,放入下槽,在下槽侧面放置冰盒,加含SDS的转移Buffer至刻度线位置,电压100 V,1 h冰上转膜。将转好的PVDF膜取出,置于TBST缓冲液,室温封闭12 h。在封闭好的膜中加入一抗(MsWRKY33多抗)(1∶1 000)20 μL,室温孵育5 h,然后用TBST溶液洗3次,每次10 min,再加入二抗(羊抗兔IgG(H+L)-HRP)(1∶10 000),室温振荡孵育2 h,用TBS溶液洗膜3次,每次10 min,再用TBS洗10 min,用吸水纸吸干膜上的TBS缓冲溶液,用ECL化学发光剂孵育膜2 min,使用Tanon 5200全自动化学发光图像分析系统发光成像,检测蛋白表达结果,并利用图像处理软件Image J读取WB条带灰度值。
2 结果与分析
2.1 MsWRKY33蛋白生物信息学分析
利用生物信息学预测网站ExPASy对MsWRKY33蛋白理化性质进行预测,该蛋白全长511 aa,蛋白分子式为C1129H1788N320O371S10,理论分子量为57.16 ku,理论等电点为7.02,不稳定指数为50.6,预测是一个不稳定蛋白。此外,该蛋白含有21个酸性氨基酸残基和21个碱性氨基酸残基,平均疏水性为-0.314,由此说明MsWRKY33蛋白可能是一个亲水性蛋白。使用SMART预测MsWRKY33蛋白在200~450 aa的位置有2个WRKY结构域(图1-A)。二级结构预测显示MsWRKY33蛋白主要由无规则卷曲和延伸链结构组成,不具有信号肽(图1-B)和跨膜结构域(图1-C),不属于分泌型蛋白。
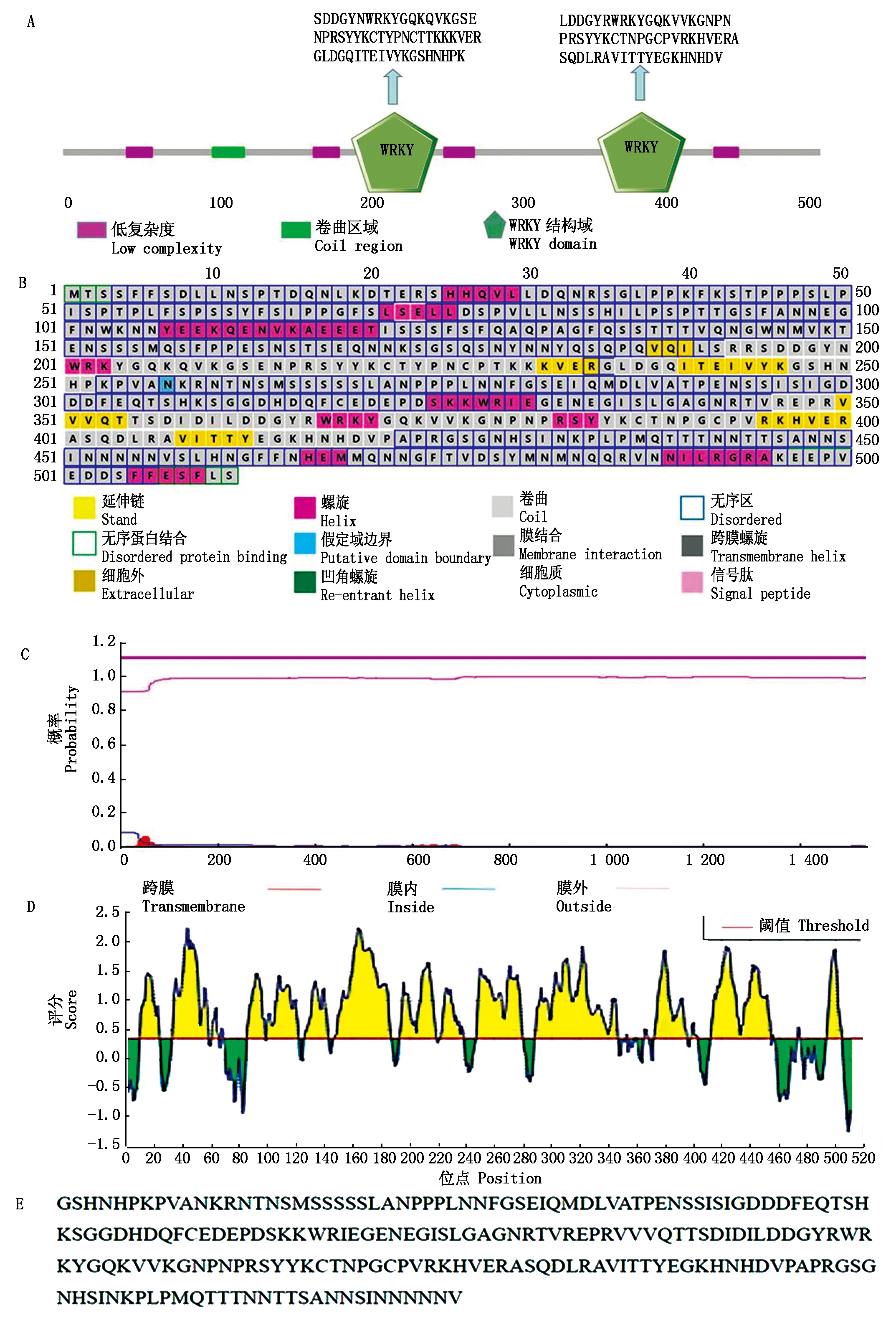
A.MsWRKY33蛋白中的WRKY保守结构域预测;B.MsWRKY33蛋白二级结构预测;
C.MsWRKY33蛋白的跨膜结构域预测;D.MsWRKY33蛋白免疫原性预测;E.MsWRKY33蛋白表达序列。
A.Prediction of WRKY conserved domain of MsWRKY33 protein;B.Secondary structure prediction of MsWRKY33 protein;C.Transmembrane
domain prediction of MsWRKY33 protein;D.Immunogenicity prediction of MsWRKY33 protein;E.MsWRKY33 protein expression sequence.
图1 MsWRKY33蛋白生物信息学分析
Fig.1 Bioinformatics analysis of MsWRKY33 protein
免疫原性预测显示,该蛋白免疫原性较强(图1-D)。该蛋白全长序列较长,一般情况下,蛋白的分子量越大,蛋白的表达难度越大。结合序列的特异性以及B细胞表位覆盖度,将序列截断,选用247~457 aa区域重组蛋白制备多抗,确定的表达序列如图1-E所示。
2.2 MsWRKY33抗原序列的克隆
以中苜1号紫花苜蓿总RNA反转录成的cDNA为模板,MsWRKY33-F/R为引物,用PCR的方法扩增出长度为654 bp(247~457 aa)的抗原序列(图2-A)。将该片段克隆到pET-SUMO表达载体中,转化后挑取单克隆,利用引物MsWRKY33-F/R进行PCR验证(图2-B)。将阳性克隆送北京华大基因生物公司进行测序,克隆的MsWRKY33抗原序列与图1-E中的蛋白序列相符,没有突变发生,表明载体已经构建成功。
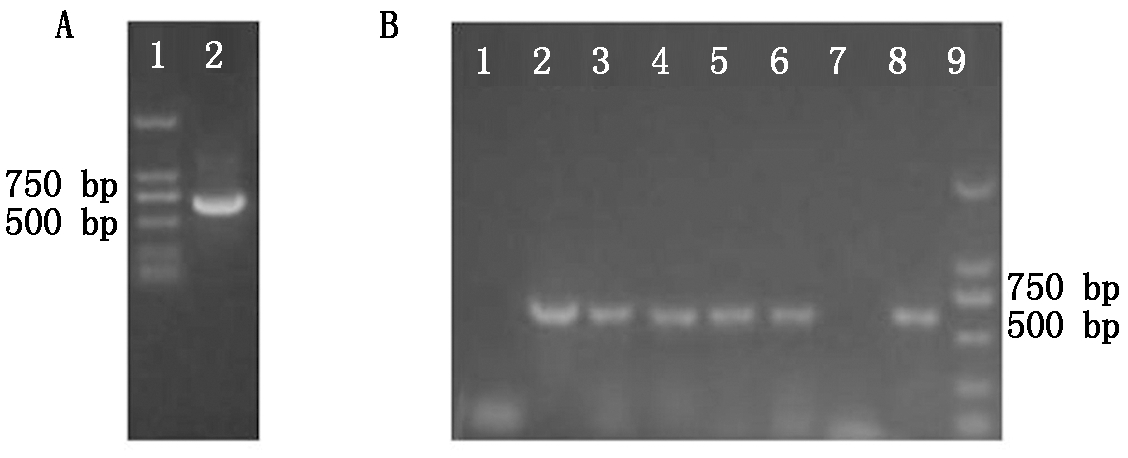
A.MsWRKY33抗原序列克隆:1.Marker;2.MsWRKY33抗原序列;B.重组质粒pET-MsWRKY33的PCR检测:1.阴性对照;2.阳性对照;3-8.单克隆;9.Marker。
A.Clone of MsWRKY33 antigen sequence:1.Marker;2.MsWRKY33 antigen sequence;B.PCR detection of recombinant plasmid pET-MsWRKY33:1.Negative control;2.Positive control;3-8.Monoclonal;9.Marker.
图2 重组载体的构建
Fig.2 Construction of recombinant vector
2.3 蛋白制备与纯化
将重组质粒pET-MsWRKY33转化到大肠杆菌BL21后,未诱导的作为对照组,经IPTG诱导的作为试验组,收获沉淀后取上清进行SDS-PAGE,结果如图3-A,得到小量表达的MsWRKY33蛋白。原核表达的蛋白分为可溶性蛋白和包涵体2种,可溶性蛋白存在于菌体破碎后的上清部分,包涵体为沉淀中的不可溶性蛋白。为获得较多的可溶性MsWRKY33蛋白,进行了大量表达。使用超声破碎离心,分离得到上清和沉淀,分别将其纯化后再进行SDS-PAGE,结果如图3-B所示,未经诱导的对照样品中没有信号,而在上清、沉淀和纯化蛋白质样品中均出现分子量符合预期的特异信号,表明插入的外源基因片段已经成功在大肠杆菌中表达。再经Ni-NTA树脂层析柱纯化后获得纯化重组蛋白,如图3-C所示,只检测出单一的且分子量符合的目标信号,表明已成功获得了纯化重组蛋白。
2.4 多克隆抗体的制备与纯化及抗体WB检测
以纯化的MsWRKY33蛋白为免疫原,免疫兔子,得到抗血清,经纯化后获得多克隆抗体。以MsWRKY33纯化蛋白包被96孔板,以未免疫的正常兔血清为对照,酶标仪测定抗体效价,结果如图4所示,当OD450值为2.5时,抗体的稀释倍数约为16 000左右,即利用这一浓度可以有效地检测到抗原,表明制备的抗体具有很高的检测灵敏度。纯化后的多克隆抗体经过SDS-PAGE检测其纯度,结果如图5-A所示。为验证多克隆抗体的特异性,采用WB进行检测,结果如图5-B所示:样品中没有可见的背景信号,以天然蛋白(天然蛋白质的分子量为56 ku)作为对照,重组蛋白有分子量为48 ku(23 ku MsWRKY33目的蛋白+25 ku标签)的特异条带。上述结果说明,所获得的MsWRKY33抗体具有较强的特异性。
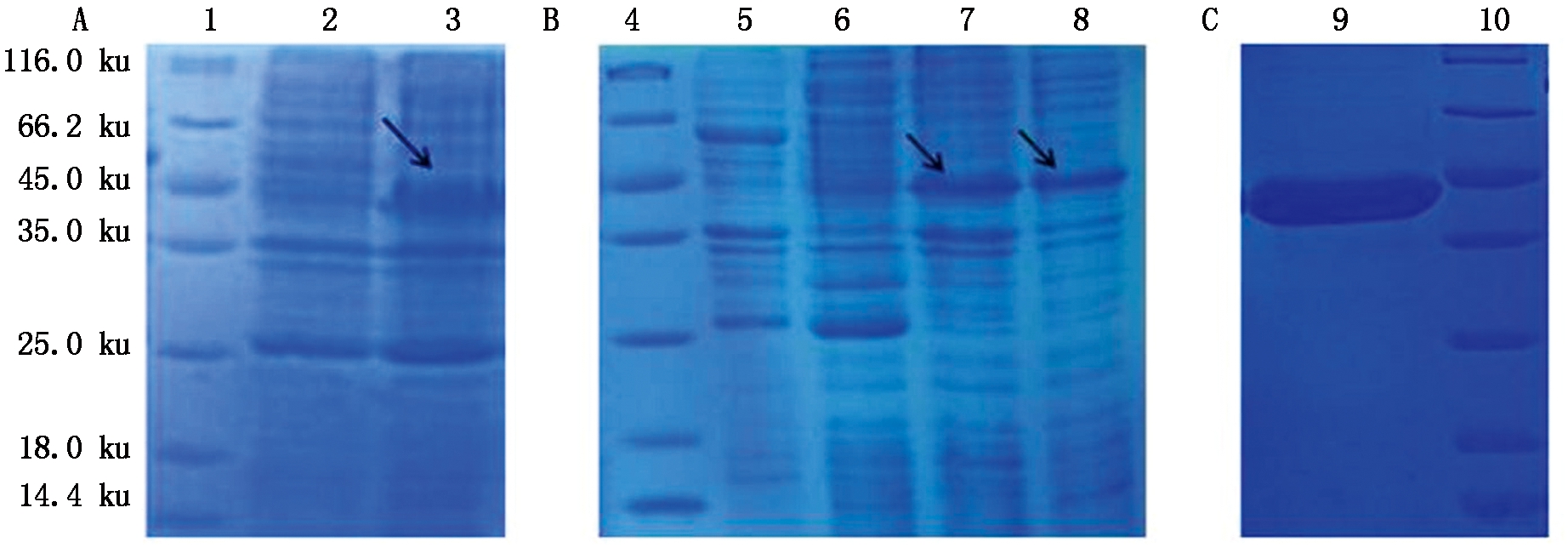
A.小量表达重组蛋白的SDS-PAGE检测:1.Marker;2.转化pET-MsWRKY33未经IPTG诱导的蛋白;3.转化pET-MsWRKY33经IPTG诱导的蛋白。B.大量表达重组蛋白SDS-PAGE检测:4.Marker;5.转化pET-SUMO空载体的总蛋白;6.转化pET-MsWRKY33未经IPTG诱导的蛋白;7.转化pET-MsWRKY33经IPTG诱导的蛋白沉淀;8.转化pET-MsWRKY33经IPTG诱导的蛋白上清。C.纯化重组蛋白:9.纯化后pET-MsWRKY33蛋白;10.Marker;黑色箭头表示重组蛋白所在位置。
A.SDS-PAGE detection of small amount of expressed recombinant protein:1.Marker;2.Transformed pET-MsWRKY33 protein without IPTG-induced;3.Transformed pET-MsWRKY33 protein with IPTG induced.B.SDS-PAGE detection of a large amount of recombinant protein expression:4.Marker;5.The total protein of pET-SUMO empty vector;6.pET-MsWRKY33 protein without IPTG induction;7.pET-MsWRKY33 protein precipitation induced by IPTG;8.pET-MsWRKY33 protein supernatant induced by IPTG.C.Purified recombinant protein:9.Purified pET-MsWRKY33 protein;10.Marker;The black arrow indicates the location of the recombinant protein.
图3 MsWRKY33蛋白的表达
Fig.3 Expression of MsWRKY33 protein
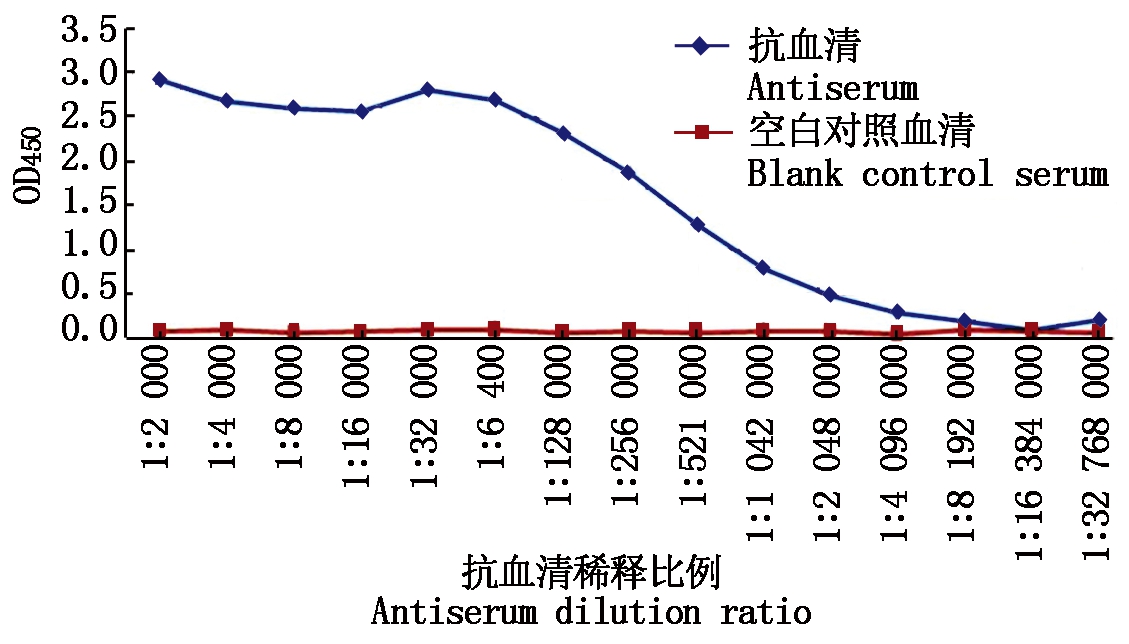
图4 抗体效价检测
Fig.4 Antibody titer determination
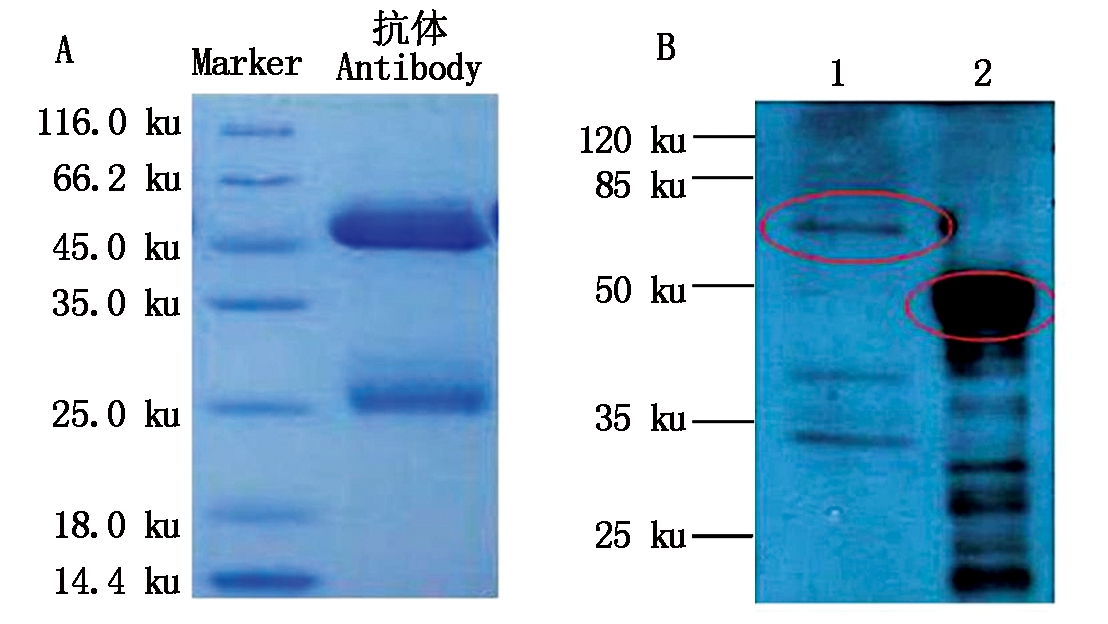
A.MsWRKY33多克隆抗体;B.WB检测结果:1.天然蛋白;2.重组蛋白;红色圆圈表示目标蛋白所在位置。
A.MsWRKY33 polyclonal antibody;B.Western Blotting results:1.Natural protein;2.Recombinant protein;The red circle indicates the location of the target protein.
图5 多克隆抗体的制备与WB检测
Fig.5 Preparation of polyclonal antibody
and Western Blotting
2.5 MsWRKY33蛋白在逆境胁迫下的表达特征
为了解MsWRKY33在盐、低温、干旱3种逆境条件和ABA处理下蛋白水平的表达情况,本试验对中苜1号紫花苜蓿进行了这4种处理,在处理后的0,6,12,24,48 h分别采集了样品。提取蛋白后用制备的MsWRKY33多克隆抗体进行WB试验。如图6所示,用NaCl胁迫处理后,在6,12 h样品泳道中对应48 ku位置几乎没有可见条带,在24 h样品泳道目标区域有明显的条带,说明处理24 h后蛋白表达量显著增加,处理48 h蛋白表达丰度又大幅降低(图6-A),说明盐胁迫可以诱导MsWRKY33蛋白在紫花苜蓿中的表达。4 ℃、PEG和ABA处理后,MsWRKY33蛋白的表达也均在24 h显著增加,说明这3种处理也可以诱导MsWRKY33蛋白在紫花苜蓿中的表达。同时利用Image J软件分析了4个处理下WB条带的灰度值,从图6-E可以发现,NaCl处理下MsWRKY33蛋白在24 h的表达丰度明显强于其他3个处理,高出其他3个处理2~5倍,表明NaCl处理下的蛋白表达高于其他3个处理。在48 h时,只有NaCl处理下MsWRKY33蛋白还有较高的表达,其余3个处理MsWRKY33蛋白的表达均已同0 h一致,说明MsWRKY33蛋白对盐处理更加敏感且持续。
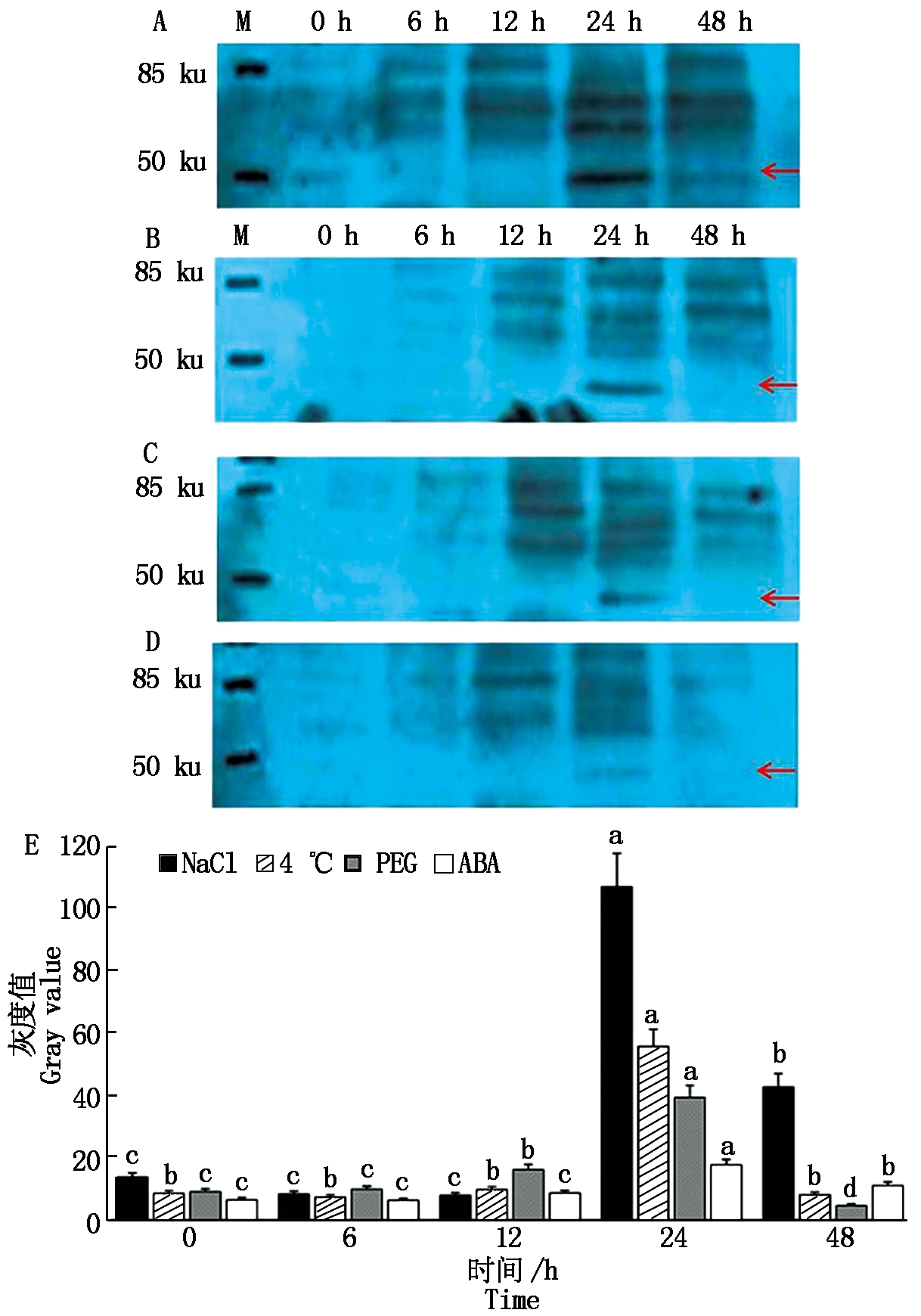
A.NaCl处理;B.4 ℃处理;C.PEG处理;D.ABA处理;E.WB的灰度值分析;红色箭头表示MsWRKY33蛋白被胁迫诱导表达时出现的位置;不同小写字母表示在P<0.05 水平差异显著。
A.NaCl treatment;B.4 ℃ treatment;C.PEG treatment;D.ABA treatment;E.WB gray value analysis;The red arrow indicates the position where MsWRKY33 protein is induced by stress; Different small letters indicate statistical difference(P<0.05).
图6 MsWRKY33蛋白在逆境胁迫下的表达特征
Fig.6 Expression profiling of MsWRKY33
protein under abiotic stress treatments
3 讨论与结论
在过去几十年中,研究者运用原核表达的重组蛋白免疫鼠、兔等动物来制备抗体已经表达了数百种重组蛋白[28]。通过原核表达获得大量的抗原蛋白,既可用于蛋白质性质与功能研究,也可用于蛋白质的相互作用等生化功能研究[29]。本研究中,将MsWRKY33抗原序列克隆到原核表达载体上,经IPTG诱导实现了MsWRKY33融合蛋白的高效表达。融合蛋白经Ni-NTA亲和柱亲和层析洗脱后,得到了满足抗体制备需要的高纯度抗原,经免疫小鼠,纯化抗血清后得到了效价较高且特异性好的多克隆抗体,该抗体不仅可以识别在大肠杆菌原核表达的MsWRKY33融合蛋白,而且还可以特异识别紫花苜蓿总蛋白中的MsWRKY33蛋白。多克隆抗体的成功制备为进一步研究紫花苜蓿MsWRKY33蛋白功能奠定了基础。
WB技术由Burnette[30-31]在1981年提出,其原理主要是提出组织总蛋白经SDS-PAGE电泳,分离出大小不同的蛋白质,通过抗原抗体特异结合转移至PVDF膜上,最后用ECL发光信号检测蛋白质表达情况。本研究利用制备的MsWRKY33多克隆抗体进行WB试验,成功检测到分子量接近于50 ku的重组蛋白。并且研究了盐、低温、干旱和ABA这4种胁迫下紫花苜蓿组织中MsWRKY33蛋白的表达情况,初步研究发现MsWRKY33蛋白表达受4种逆境诱导,但在高盐条件下紫花苜蓿中的MsWRKY33蛋白表达丰度明显高于其他处理,表明MsWRKY33蛋白在植物响应盐胁迫过程中可能具有较为重要的作用。冯光燕等[32]在转录水平上检测了盐胁迫下中苜1号紫花苜蓿中MsWRKY33的表达情况,发现MsWRKY33的表达量在处理前8 h均较低,在处理12 h达到最高水平,后又缓慢降低,在本试验中,MsWRKY33蛋白水平表达在24 h达到最高水平,可以看出,蛋白表达峰值的到来要晚于转录水平。这主要是因为真核基因表达的转录和翻译发生的时间和位点存在时空间隔,其次在转录后,又会有转录后加工,转录产物的降解、翻译,甚至翻译后加工及修饰等。所以导致转录水平和翻译水平不完全一致,可能在MsWRKY33蛋白达到峰值的时候mRNA已经开始降解,或者在mRNA达到峰值的时候MsWRKY33蛋白量还在增加中。
通常植物的耐逆途径是由多个基因控制,一个转录因子不仅可以参与多个抗逆途径,某个耐逆途径也可以由多个转录因子调控[33]。近几年,越来越多的研究表明,WRKY转录因子在传导逆境信号、调控逆境相关基因中扮演关键角色[15]。本研究发现紫花苜蓿MsWRKY33转录因子蛋白参与多种非生物逆境胁迫,对盐胁迫尤其敏感,而盐胁迫调控网络主要通过至少2种途径:ABA依赖和非ABA依赖信号传导途径[34]。冯光燕等[32]在转录水平上检测了ABA处理后中苜1号紫花苜蓿中MsWRKY33的表达情况,发现MsWRKY33的表达量在处理12 h达到峰值,且表达丰度较低,在本研究中,经ABA处理后MsWRKY33蛋白的表达丰度也较低,仅在24 h有微弱表达。说明MsWRKY33参与的盐胁迫调控网络可能不依赖于ABA信号途径或ABA信号途径不是主要途径。
本研究发现MsWRKY33蛋白不具有信号肽,有较强的蛋白免疫原性,并根据其蛋白特性克隆了MsWRKY33抗原序列,制备了MsWRKY33多克隆抗体。通过WB实验发现MsWRKY33蛋白对盐胁迫响应较为敏感,且可能通过非ABA依赖信号传导途径参与盐胁迫调控。
[1] Eulgem T,Somssich I E.Networks of WRKY transcription factors in defense signaling[J].Current Opinion in Plant Biology,2007,10(4):366-371.doi:10.1016/j.pbi.2007.04.020.
[2] Ross C A,Liu Y,Shen Q J.The WRKY gene family in rice(Oryza sativa)[J].Journal of Integrative Plant Biology,2007,49(6):827-842.doi:10.1111/j.1744-7909.2007.00504.x.
[3] Bencke-Malato M,Cabreira C,Wiebke-Strohm B,Bücker-Neto L,Mancini E,Osorio M B,Homrich M S,Turchetto-Zolet A C,De Carvalho M C C G,Stolf R,Weber R L M,Westergaard G,Castagnaro A P,Abdelnoor R V,![]() F C,Margis-Pinheiro M,Bodanese-Zanettini M H.Genome-wide annotation of the soybean WRKY family and functional characterization of genes involved in response to Phakopsora pachyrhizi infection[J].BMC Plant Biology,2014,14:236.doi:10.1186/s12870-014-0236-0.
F C,Margis-Pinheiro M,Bodanese-Zanettini M H.Genome-wide annotation of the soybean WRKY family and functional characterization of genes involved in response to Phakopsora pachyrhizi infection[J].BMC Plant Biology,2014,14:236.doi:10.1186/s12870-014-0236-0.
[4] Wei K F,Chen J,Chen Y F,Wu L J,Xie D X.Molecular phylogenetic and expression analysis of the complete WRKY transcription factor family in maize[J].DNA Research,2012,19(2):153-164.doi:10.1093/dnares/dsr048.
[5] Ning P,Liu C C,Kang J Q,Lü J Y.Genome-wide analysis of WRKY transcription factors in wheat(Triticum aestivum L.)and differential expression under water deficit condition[J].Peer J,2017,5:e3232.doi:10.7717/peerj.3232.
[6] Chen N,Su M W,Chi X Y,Zhang Z M,Pan L J,Chen M N,Wang T,Wang M,Yang Z,Yu S L.Transcriptome analysis reveals salt-stress-regulated biological processes and key pathways in roots of peanut (Arachis hypogaea L.)[J].Genes & Genomics,2016,38(6):493-507.doi:10.1007/s13258-016-0395-5.
[7] Lagacé M,Matton D P.Characterization of a WRKY transcription factor expressed in late Torpedo-stage embryos of Solanum chacoense[J].Planta,2004,219(1):185-189.doi:10.1007/s00425-004-1253-2.
[8] Zentella R,Zhang Z L,Park M,Thomas S G,Endo A,Murase K,Fleet C M,Jikumaru Y,Nambara E,Kamiya Y,Sun T P.Global analysis of DELLA direct targets in early gibberellin signaling in Arabidopsis[J].The Plant Cell,2007,19(10):3037-3057.doi:10.1105/tpc.107.054999.
[9] Johnson C S,Kolevski B,Smyth D R.TRANSPARENT TESTA GLABRA2,a trichome and seed coat development gene of Arabidopsis,encodes a WRKY transcription factor[J].The Plant Cell,2002,14(6):1359-1375.doi:10.1105/tpc.001404.
[10] Robatzek S,Somssich I E.Targets of AtWRKY6 regulation during plant senescence and pathogen defense[J].Genes & Development,2002,16(9):1139-1149.doi:10.1101/gad.222702.
[11] Lai Z B,Li Y,Wang F,Cheng Y,Fan B F,Yu J Q,Chen Z X.Arabidopsis Sigma factor binding proteins are activators of the WRKY33 transcription factor in plant defense[J].The Plant Cell,2011,23(10):3824-3841.doi:10.1105/tpc.111.090571.
[12] Rushton D L,Tripathi P,Rabara R C,Lin J,Ringler P,Boken A K,Langum T J,Smidt L,Boomsma D D,Emme N J,Chen X F,Finer J J,Shen Q J,Rushton P J.WRKY transcription factors:Key components in abscisic acid signalling[J].Plant Biotechnology Journal,2012,10(1):2-11.doi:10.1111/j.1467-7652.2011.00634.x.
[13] Rinerson C I,Rabara R C,Tripathi P,Shen Q J,Rushton P J.The evolution of WRKY transcription factors[J].BMC Plant Biology,2015,15:66.doi:10.1186/s12870-015-0456-y.
[14] Kloth K J,Wiegers G L,Busscher-Lange J,van Haarst J C,Kruijer W,Bouwmeester H J,Dicke M,Jongsma M A.AtWRKY22 promotes susceptibility to aphids and modulates salicylic acid and jasmonic acid signalling[J].Journal of Experimental Botany,2016,67(11):3383-3396.doi:10.1093/jxb/erw159.
[15] Pandey S P,Somssich I E.The role of WRKY transcription factors in plant immunity[J].Plant Physiology,2009,150(4):1648-1655.doi:10.1104/pp.109.138990.
[16] Birkenbihl R P,Diezel C,Somssich I E.Arabidopsis WRKY33 is a key transcriptional regulator of hormonal and metabolic responses toward Botrytis cinerea infection[J].Plant Physiology,2012,159(1):266-285.doi:10.1104/pp.111.192641.
[17] Rushton P J,Torres J T,Parniske M,Wernert P,Hahlbrock K,Somssich I E.Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J].EMBO J,1996,15(20):5690-5700.doi:10.1002/j.1460-2075.1996.tb00953.x.
[18] Chen L G,Song Y,Li S J,Zhang L P,Zou C S,Yu D Q.The role of WRKY transcription factors in plant abiotic stresses[J].Biochimica et Biophysica Acta,2012,1819(2):120-128.doi:10.1016/j.bbagrm.2011.09.002.
[19] 刘晓林,杨学勇,余宏军,蒋卫杰,赵文超,王燕,张晓孟.适用于黄瓜叶片、根系和果实总蛋白的双向电泳体系的建立[J].基因组学与应用生物学,2016,35(3):721-727.doi:10.13417/j.gab.035.000721.
Liu X L,Yang X Y,Yu H J,Jiang W J,Zhao W C,Wang Y,Zhang X M.Establishment of two-dimensional electrophoresis system suitable for cucumber leave,root and fruit proteins[J].Genomics and Applied Biology,2016,35(3):721-727.
[20] Jiang Y Q,Deyholos M K.Functional characterization of Arabidopsis NaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses[J].Plant Molecular Biology,2009,69(1/2):91-105.doi:10.1007/s11103-008-9408-3.
[21] Luo X,Bai X,Sun X L,Zhu D,Liu B H,Ji W,Cai H,Cao L,Wu J,Hu M R,Liu X,Tang L L,Zhu Y M.Expression of wild soybean WRKY20 in Arabidopsis enhances drought tolerance and regulates ABA signalling[J].Journal of Experimental Botany,2013,64(8):2155-2169.doi:10.1093/jxb/ert073.
[22] Qin Y X,Tian Y C,Han L,Yang X C.Constitutive expression of a salinity-induced wheat WRKY transcription factor enhances salinity and ionic stress tolerance in transgenic Arabidopsis thaliana[J].Biochemical and Biophysical Research Communications,2013,441(2):476-481.
[23] Zhou Q Y,Tian A G,Zou H F,Xie Z M,Lei G,Huang J,Wang C M,Wang H W,Zhang J S,Chen S Y.Soybean WRKY-type transcription factor genes,GmWRKY13,GmWRKY21,and GmWRKY54,confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants[J].Plant Biotechnology Journal,2008,6(5):486-503.doi:10.1111/j.1467-7652.2008.00336.x.
[24] Bolton J L.Alfalfa botany,cultivation and utilization[M].London:Leonard Hill,1962.
[25] 于浩然,贾玉山,贾鹏飞,连直,卢强,李俊峰,王志军,任志花.不同盐碱度对紫花苜蓿产量及品质的影响[J].中国草地学报,2019,41(4):143-149.doi:10.16742/j.zgcdxb.20180240.
Yu H R,Jia Y S,Jia P F,Lian Z,Lu Q,Li J F,Wang Z J,Ren Z H.Comprehensive evaluation of growth,yield and quality of alfalfa in different saline-alkali soil[J].Chinese Journal of Grassland,2019,41(4):143-149.
[26] Wang X S,Ren H L,Wei Z W,Wang Y W,Ren W B.Effects of neutral salt and alkali on ion distributions in the roots,shoots,and leaves of two alfalfa cultivars with differing degrees of salt tolerance[J].Journal of Integrative Agriculture,2017,16(8):1800-1807.doi:10.1016/S2095-3119(16)61522-8.
[27] 董蔚,邬培祥,杨宁,刘锡江,宋玉光.紫花苜蓿盐胁迫响应WRKY转录因子的克隆及表达特征分析[J].植物生理学报,2018,54(9):1481-1489.doi:10.13592/j.cnki.ppj.2018.0306.
Dong W,Wu P X,Yang N,Liu X J,Song Y G.Cloning and expression analysis of WRKY transcription factor involved in salinity stress in alfalfa[J].Plant Physiology Journal,2018,54(9):1481-1489.
[28] 程彦伟,李亮,沈嵘,齐耀程,刘晓宇,王宁,张炜.水稻LRR型类受体蛋白激酶胞外区的原核表达及多克隆抗体制备[J].生物化学与生物物理进展,2008,35(9):1077-1083.doi:10.3321/j.issn:1000-3282.2008.09.016.
Cheng Y W,Li L,Shen R,Qi Y C,Liu X Y,Wang N,Zhang W.Prokaryotic expression and polyclonal antibody preparation of the extracellular domain about rice LRR receptor-like protein kinase[J].Progress in Biochemistry and Biophysics,2008,35(9):1077-1083.
[29] 王增,代茹,张江巍,陈尚武,张文,马会勤.拟南芥WUS蛋白的原核表达、亲和纯化和多克隆抗体制备[J].生物工程学报,2009,25(9):1409-1416.doi:10.3321/j.issn:1000-3061.2009.09.019.
Wang Z,Dai R,Zhang J W,Chen S W,Zhang W,Ma H Q.Induced expression of Arabidopsis thaliana WUSCHEL in Escherichia coli,affinity protein purification and polyclonal antibody preparation[J].Chinese Journal of Biotechnology,2009,25(9):1409-1416.
[30] Burnette W N.Western Blotting:Electrophoretic transfer of proteins from sodium dodecyl sulfate-polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A[J].Analytical Biochemistry,1981,112(2):195-203.doi:10.1016/0003-2697(81)90281-5.
[31] Bronstein I,Voyta J C,Murphy O J,Bresnick L,Kricka L J.Improved chemiluminescent western blotting procedure[J].Biotechniques,1992,12(5):748-753.
[32] 冯光燕,王学敏,付媛媛,方志红,高洪文,张新全.紫花苜蓿 MsWRKY33转录因子的分离及遗传转化研究[J].草业学报,2015,24(11):48-57.doi:10.11686/cyxb2015131.
Feng G Y,Wang X M,Fu Y Y,Fang Z H,Gao H W,Zhang X Q.Isolation of MsWRKY33 transcription factor and its genetic transformation in Medicago sativa[J].Acta Prataculturae Sinica,2015,24(11):48-57.
[33] Chen F,Hu Y,Vannozzi A,Wu K C,Cai H Y,Qin Y,Mullis A,Lin Z G,Zhang L S.The WRKY transcription factor family in model plants and crops[J].Critical Reviews in Plant Sciences,2017,36(5/6):311-335.doi:10.1080/07352689.2018.1441103.
[34] Zhu J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247-273.doi:10.1146/annurev.arplant.53.091401.143329.