叶片是植物重要的光合作用器官,为植物体的生长发育提供所需的能量物质与光合同化产物,在植物生长发育中起着重要作用。水稻作为人类赖以生存的主要粮食作物之一,也是重要的单子叶模式植物,研究表明,水稻籽粒灌浆结实所需营养物质的60%~80%直接来源于叶片的光合作用[1]。衰老是植物体生长发育过程的最后阶段,是受自身遗传因子和外界环境因素综合调控的植物细胞程序性死亡过程,会导致植物细胞、组织、器官甚至整个植物体的生理活动和生物学功能逐渐衰退,是植物生长发育的重要生命历程,在发育生物学方面具有显著的意义[2-3]。在植物自然衰老过程中,营养物质会从叶片等源器官逐渐转移至生殖器官,这是植物体生长发育过程的必经阶段,也是植物在漫长进化过程中适应自然环境的一种自我保护机制,但早衰或非正常的衰老会对植物造成严重的损害[2,4-5]。叶片早衰是植物体生理代谢机能提前衰退的一种生理现象,具体表现为叶片光合作用速率下降、叶色逐渐变黄或出现斑点、核酸和蛋白质及脂质等水解、丙二醛与活性氧等物质含量增加、抗氧化保护酶类活性下降、衰老相关基因显著差异表达、叶片细胞结构损伤解体[6-7]。对水稻而言,叶早衰会导致植株光合作用减弱、叶片功能期缩短,供给植株生长发育的可利用营养物质和能量缺乏,从而引起籽粒灌浆不足、结实率下降、千粒质量降低等,严重影响水稻产量和品质,给农业生产带来不可挽回的损失[8]。因此,探究水稻叶早衰的分子机理与作用机制一直备受农业科学工作者的高度重视,挖掘、研究、利用叶早衰相关基因,对高产、优质的水稻新品种培育及栽培措施优化改良具有重要意义。
叶片衰老是一个较为精细复杂的生命过程,其启动与发展进程受到众多内部因素与外部因素的共同调控,具体来说,内部因素主要包括内源激素、基因和遗传调控,外部因素主要包括温度、光照、水分、营养元素和病虫害等,各个影响因子之间相互联系与制约,构建成复杂的衰老调控网络[9-10]。目前,关于水稻叶片早衰原因与分子机制研究已经取得了较大的进展,相关研究表明,已经在水稻中鉴定出150多个叶片衰老相关基因(Senescence-associated genes,SAGs),其中50多个基因经遗传转化与互补验证被证实与叶片早衰有关,并在分子和遗传水平上初步阐明了其作用机理与衰老调控机制[11]。根据所涉及的代谢途径与信号通路,这些SAGs的功能主要与叶绿素发育与降解、激素合成与信号转导、能量代谢、过氧化反应、逆境胁迫、蛋白质合成与降解、细胞程序化死亡及其他代谢等途径有关[12-20]。随着基因组学与分子生物技术的快速发展,水稻叶早衰突变体的筛选与应用一直受到农业科学家的青睐,前人通过诱变技术、转座子插入、T-DNA插入等技术手段处理水稻种子以及对水稻自然突变体进行筛选,获得了大量水稻叶早衰相关突变体,并以这些突变体为材料对很多SAGs进行定位与克隆,且进行了相关的功能研究[21-22]。研究结果表明,通过对水稻叶早衰突变体的研究,已经有20多种SAGs完成了基因定位与部分功能解析,这些基因在水稻的12条染色体上都有分布[10]。根据水稻叶衰老突变体的表型特征,可将其分为叶片黄化与叶片有斑点两大类型,它们的野生型品种、早衰特征、衰老黄化或衰老斑点出现时期、斑点颜色与形状及目标基因所在位置都存在差异,其中,叶片黄化早衰突变体主要有psl1、psl2、psl3、Ospsel1、mps1、esl2、esl3、esl4、esl5、esl6、esl9、esl11、sel4、es5、Ossac3等,叶片有斑点早衰突变体主要有lts1、psls1、wss1、lmes1、lmes2、zs、Osled、osles、pse(t)、es-t、W330、Ospls1、Ospls3等[10]。综合前人的研究,水稻叶片黄化与叶片有斑点早衰突变体的农艺性状与其野生型都有明显的差异,这些突变体表现出生育期缩短、植株变矮、有效穗数及穗粒数显著降低等,且大多数突变体在苗期或分蘖期等营养生长阶段就开始出现较为明显的叶早衰表型[23]。近年来,虽然通过遗传学等方法克隆了部分水稻叶早衰相关基因,也从生理生化的角度在一定程度上初步阐明了叶早衰的分子机理,但是,叶片衰老过程往往不是由单个基因决定的,而是由多个基因共同构成的调控网络所控制。因此,今后还需进一步挖掘更多的叶早衰相关调控基因,并结合现代分子生物学与遗传学技术手段开展叶衰老机理研究。
本研究对水稻叶早衰突变体osles3进行农艺性状调查与相关生理特性分析,并利用分子标记进行遗传分析与基因定位,旨在为进一步探究水稻叶早衰调控机理、水稻抗衰老品种选育及调优栽培奠定理论基础。
1 材料和方法
1.1 试验材料
水稻叶早衰突变体是来自粳稻中花11(ZH11)的一个自然变异引起的叶片有斑点型早衰突变体,命名为osles3(Oryza sativa leaf early senescence 3),试验材料种植于华南农业大学教学试验农场,常规水肥管理。珍汕97(ZS97)为正常的籼稻品种,作为母本用于突变体osles3的遗传分析与基因定位。
1.2 农艺性状调查
大田正常栽培条件下,2019,2020年在水稻成熟期,随机选取野生型ZH11及其突变体osles3植株各20株,对株高、分蘖数、结实率、穗粒数及千粒质量等主要农艺性状进行调查与分析。
1.3 遗传分析与基因定位
以osles3为父本,分别与中ZH11和ZS97杂交,获得F1,F1自交获得F2分离群体,观察F1和F2植株表型,统计F2群体中正常表型植株与叶早衰表型植株的分离比情况,确定控制突变体叶早衰表型的显隐性,并用SAS软件进行连续性矫正下的卡方检验。选择ZS97/osles3的F2群体中具有明显叶早衰突变体表型的单株进行基因定位,分单株剪取叶片进行取样,采用简易TPS法提取水稻基因组总DNA[24],选取华南农业大学植物分子育种实验室已有的均匀分布于水稻12条染色体上的SSR及InDel分子标记,筛选在ZH11和ZS97 2个亲本间具有多态性的引物。利用20株F2突变体单株,用筛选到的标记进行共分离分析,将目标基因初定位于某一染色体上。然后利用在该染色体相应区段具有多态性的标记,以F2分离群体为材料,通过图位克隆方法进行基因精细定位。PCR扩增使用2×Taq MasterMix(购自北京康为世纪生物科技有限公司,商品货号:CW0682),PCR扩增产物用6%聚丙烯酰胺凝胶电泳分离,银染显色后拍照,观察记录扩增条带。
1.4 生物信息学分析
利用在线软件ProtParam(http://cn.expasy.org/tools/protparam.html)预测蛋白质分子量、理论等电点、氨基酸含量及结构稳定性等。通过NCBI(http://blast.ncbi.nlm.nih.gov)的BlastN和BlastP对核苷酸序列及其编码的氨基酸序列进行相似性和同源性分析,蛋白质的保守结构域在NCBI网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行预测。蛋白序列基序分析通过MEME(http://meme-suite.org/tools/meme)在线工具分析完成。TMpred在线网站(http://www.ch.embnet.org/software/TMPRED)用于分析蛋白序列的跨膜结构域。ProtScale在线网站(https://web.expasy.org /protscale /)用于分析蛋白的亲疏水性。序列整理和多重比对由DNAman和ClustalX 2.1软件完成,比对结果图片由在线软件ESpript(http://espript.ibcp.fr/ESPript /cgi-bin/ESPript.cgi)生成。氨基酸序列系统进化树构建由MEGA 5.0软件完成,采用邻接法(Neighbour-joining)构建,并套用JTT(Jones-Taylor-Thornton model)模型分析,结果经过Bootstrap校正。采用NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_server.html)中的MLRC分析方法对蛋白的二级结构进行预测。在线分析工具Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)用于分析蛋白质三级结构,利用PyMOL软件预测蛋白3D结构模型。
2 结果与分析
2.1 突变体osles3的表型及主要农艺性状
本研究在水稻粳稻品种ZH11中筛选到一个由自然变异引起的叶片有斑点型早衰突变体osles3,对野生型ZH11和突变体osles3进行全生育期表型观察发现,从苗期-分蘖初期,ZH11和osles3没有明显差异;从分蘖后期开始,osles3叶片逐渐表现出浅褐色水浸状斑点,出现早衰表型;而后,至抽穗期,osles3叶片水浸状衰老斑点逐渐扩大,颜色变为深褐色,早衰表型明显;在成熟期后,osles3植株整体衰老,所有叶片均表现出严重衰老症状,甚至枯死;野生型ZH11在相同时期的叶片均未表现出早衰症状(图1)。
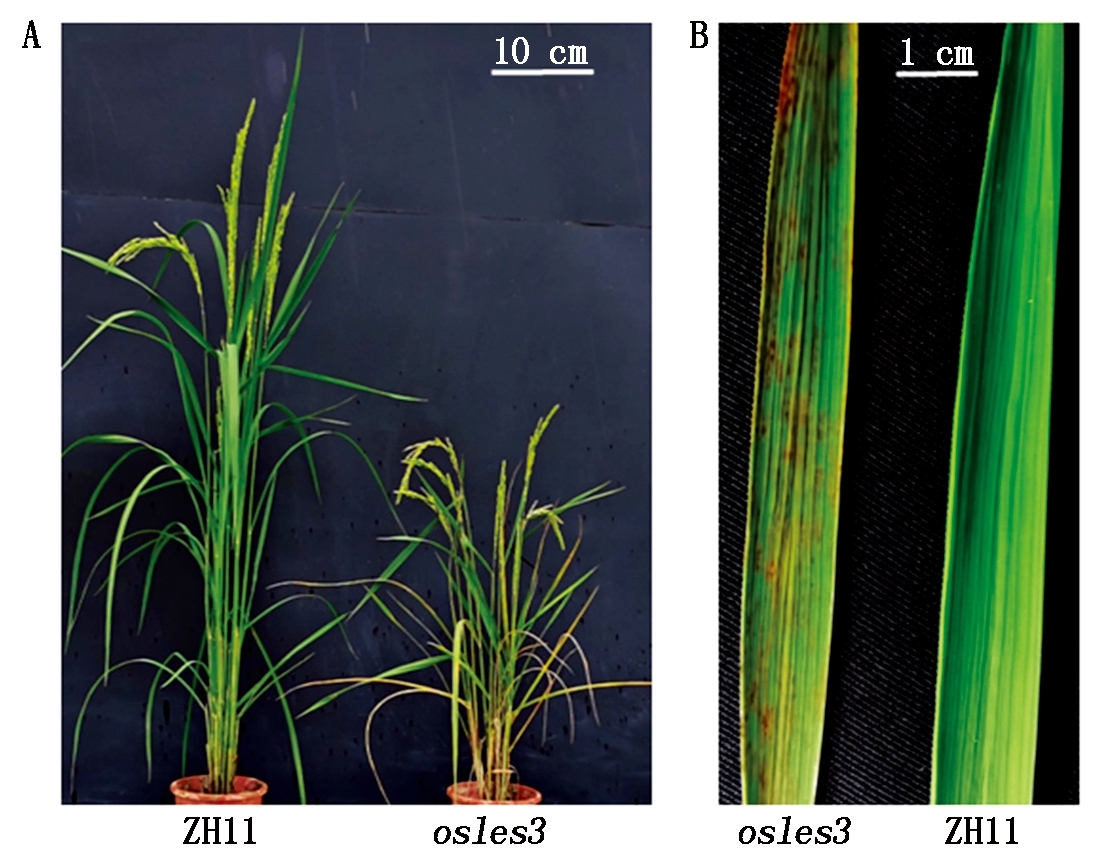
图1 叶早衰突变体osles3及其野生型ZH11表型
Fig.1 Phenotype of leaf early senescence mutant
osles3 and its wild-type ZH11
由于突变体植株叶片过早衰老,导致光合作用效率降低,从而影响到整个植株的生长发育。在成熟期对osles3与ZH11的主要农艺性状进行考察,分析结果表明,与野生型相比较,突变体osles3表型发生了极显著变化,其中,株高、分蘖数、穗粒数与千粒质量等分别下降了43.6%,43.9%,76.3%,30.4%,而结实率则减少了27.69百分点(表1)。以上结果表明,osles3叶片早衰会显著影响水稻植株生长,并导产量严重下降。
表1 突变体osles3与其野生型ZH11的主要农艺性状
Tab.1 The main agronomic traits of the mutant osles3 and its wild-type ZH11
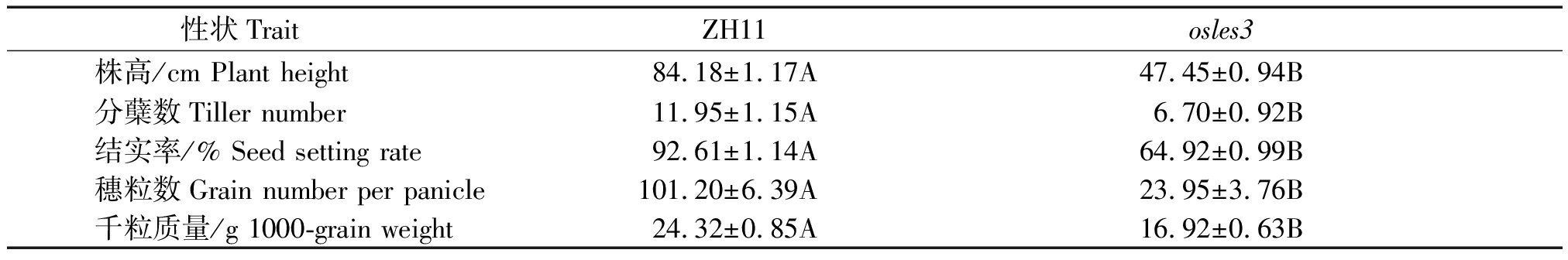
性状Trait ZH11osles3株高/cm Plant height84.18±1.17A47.45±0.94B分蘖数Tiller number11.95±1.15A6.70±0.92B结实率/% Seed setting rate92.61±1.14A64.92±0.99B穗粒数Grain number per panicle101.20±6.39A23.95±3.76B千粒质量/g 1000-grain weight24.32±0.85A16.92±0.63B
注:表中数值为平均值±标准误差;不同大写字母表示差异极显著(P<0.01)。
Note:The data in the table are mean±s;different capieal letters indicate significant differences(P<0.01).
2.2 突变体osles3的遗传分析
分别将粳稻ZH11和籼稻ZS97与osles3杂交获得F1,F1自交获得F2分离群体。植株表型统计结果显示:ZH11/osles3和ZS97/osles3的F1单株表型均为野生型(叶色正常);2个不同杂交组合的F2群体分别共有426,464株,其中野生型植株分别为317,352株,突变型(叶片早衰)植株分别为109,112株,其野生型与突变型单株比例均符合3∶1的分离比(表2),符合孟德尔单基因隐性遗传的分离比例,说明突变体osles3的叶早衰性状由一对单位点隐性基因控制。
表2 突变体osles3的遗传分析
Tab.2 Genetic analysis of osles3 mutant

组合Combination野生型Wild-type突变型Mutant总数Total numberχ2 (3∶1)χ2 (0.05)ZH11/osles33171094260.593.84ZS97/osles33521124640.733.84
2.3 突变体osles3的基因定位
将ZS97/osles3的F2群体中510个有明显叶早衰突变表型的单株作为基因定位群体。对均匀分布于12条染色体的SSR标记与InDel标记进行有多态性筛选后,然后利用20株突变体表型单株,选用106个有多态性的分子标记进行全基因组连锁分析。分析结果发现,突变表型与位于第3染色体长臂上的PSM127有明显相关性,进而利用有多态性标记RM16、PSM439及PSM127对510个F2突变体表型单株进行全面检测,初步地将叶早衰基因OsLES3定位于分子标记PSM127与PSM439之间,OsLES3与PSM127和PSM439的遗传距离分别为3.0,3.7 cM(图2)。为进一步精细定位OsLES3基因,在完成基因初定位的基础上,再利用分布于PSM127与PSM439间的多对有多态性标记对510个突变体表型单株进行检测分析,最终发现OsLES3位于RM15524与RM15551之间,距离2个标记的遗传距离分别为0.9,0.5 cM(图2)。
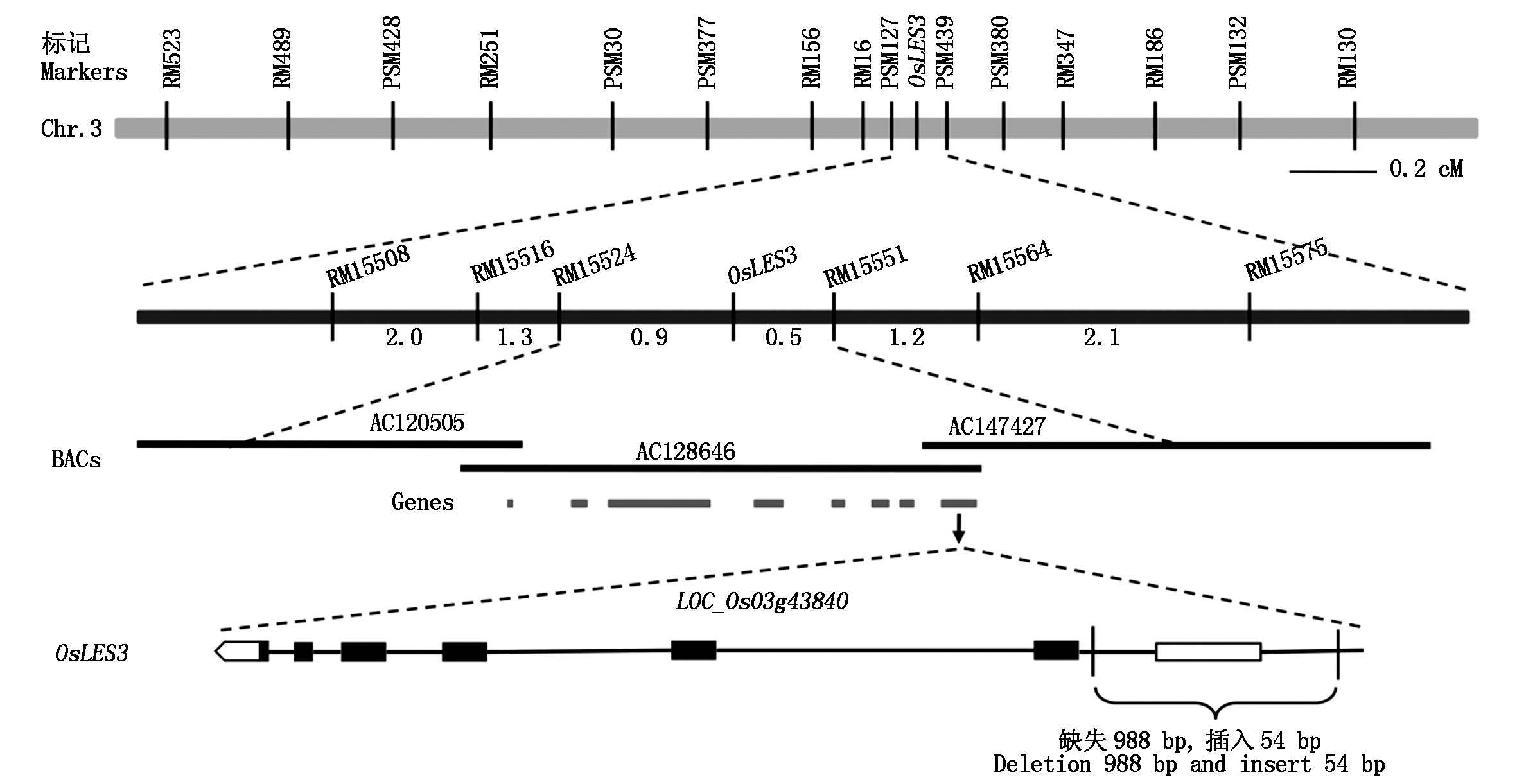
图2 OsLES3的精细定位
Fig.2 Fine mapping of OsLES3
参考水稻基因组数据库(http://rice.plantbiology.msu.edu/index.shtml)发现,RM15524与RM15551物理距离为354.7 kb,区间内共有多个候选基因,其中一个位于BAC克隆AC128646上的基因LOC_Os03g43840是已报道的水稻叶片早衰相关基因OsLED[25]。为进一步鉴定并确认突变体候选基因,对所有候选基因进行测序分析,结果发现,与野生型ZH11相比,osles3突变体的LOC_Os03g43840基因起始密码子(ATG)5′上游-17~-1 004 bp区段内存在长度为988 bp的核苷酸片段缺失,且插入了长度为54 bp的核苷酸片段(图2),而其他基因序列与野生型均无差异。因此,确定LOC_Os03g43840为该叶早衰突变体的候选基因OsLES3,OsLES3与OsLED是等位基因。
2.4 水稻OsLES3基因的生物信息学分析
2.4.1 OsLES3基因编码氨基酸序列分析 从水稻基因组数据库获得OsLES3基因编码的氨基酸序列,通过ProtParam在线分析OsLES3蛋白的理化性质,分析结果见表3,OsLES3编码186个氨基酸,蛋白质分子式为C828H1344N238O258S22,分子量为19.466 54 ku,理论等电点为8.79,稳定系数、亲水性指数与脂肪族氨基酸指数分别为53.51,0.051,70.65,是一个疏水性弱、脂溶性强的不稳定蛋白;在氨基酸组成上,含量最高的是缬氨酸(Val),其次是脯氨酸(Pro),不含苯丙氨酸(Phe)、色氨酸(Trp)及吡咯赖氨酸(Pyl)与硒半胱氨酸(Sec)。TMPred数据库的跨膜结构域分析表明,OsLES3具有一个跨膜结构域,无信号肽,亚细胞定位可能在细胞核。
表3 OsLES3蛋白氨基酸组成
Tab.3 The amino acids composition of OsLES3 protein
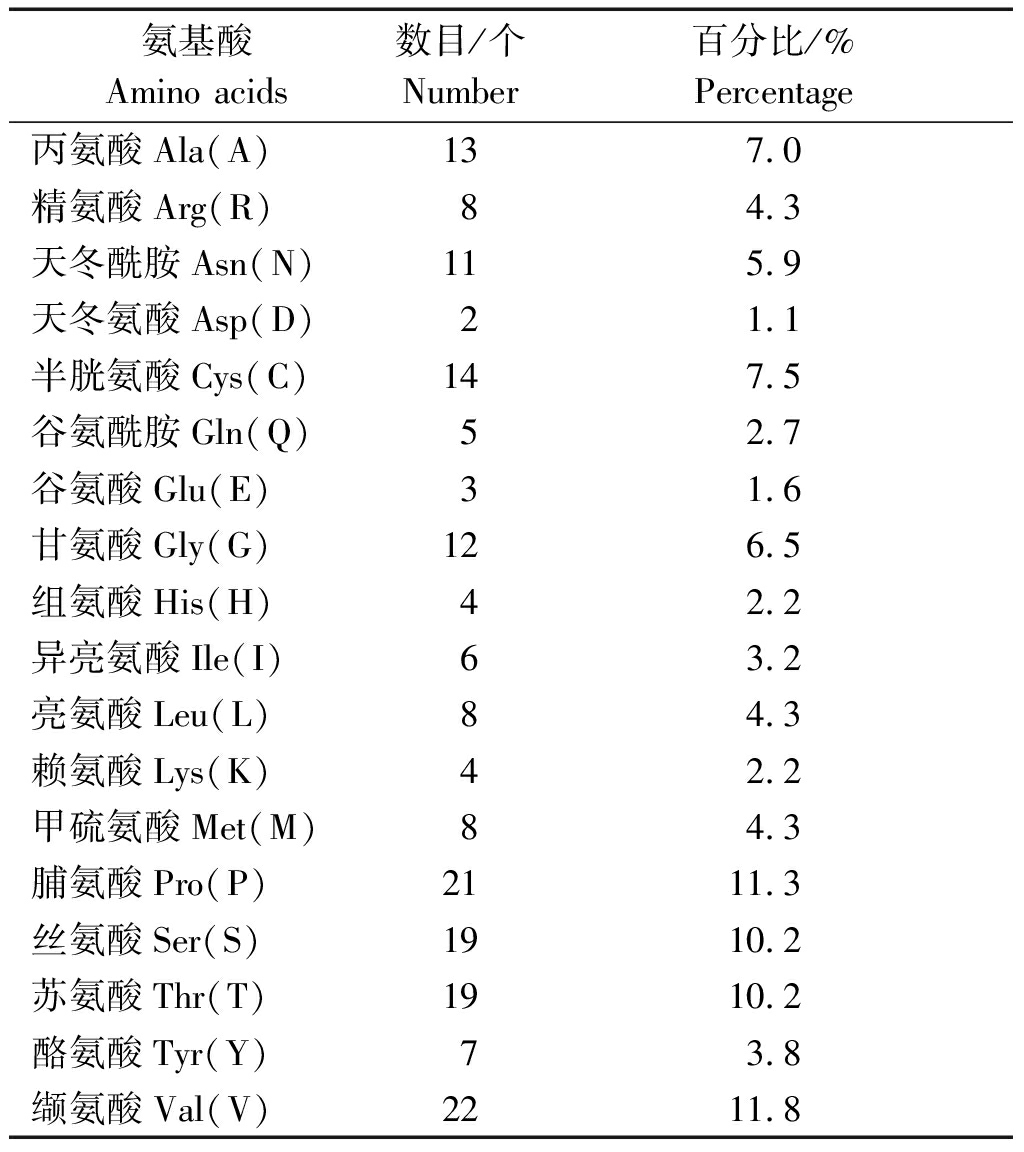
氨基酸Amino acids数目/个Number百分比/%Percentage丙氨酸Ala(A)137.0精氨酸Arg(R)84.3天冬酰胺Asn(N)115.9天冬氨酸Asp(D)21.1半胱氨酸Cys(C)147.5谷氨酰胺Gln(Q)52.7谷氨酸Glu(E)31.6甘氨酸Gly(G)126.5组氨酸His(H)42.2异亮氨酸Ile(I)63.2亮氨酸Leu(L)84.3赖氨酸Lys(K)42.2甲硫氨酸Met(M)84.3脯氨酸Pro(P)2111.3丝氨酸Ser(S)1910.2苏氨酸Thr(T)1910.2酪氨酸Tyr(Y)73.8缬氨酸Val(V)2211.8
2.4.2 同源性、结构域及进化树分析 通过NCBI数据库的Blast分析,发现OsLES3氨基酸序列与高粱(Sorghum bicolor)LOL3蛋白、大麦(Hordeum vulgare)LSD1-like蛋白和山羊草(Aegilops tauschii)LOL3蛋白亚型X2等相似性较高,相似度分别达到79.57%,79.03%,78.49%。通过ClustalW和ENDscript/ESPript网站将与OsLES3同源性较高的多个单子叶及双子叶植物蛋白进行多序列比对,结果显示,这些蛋白与OsLES3结构相似,NCBI保守结构域分析结果表明,该蛋白含有3个保守的zf-LSD1结构域(图3),表明OsLES3属于典型的锌指(Zinc finger)蛋白LSD1型基因家族的一员。同时,利用MEME工具对蛋白基序(Motif)进行分析,发现它们都含有3个相同的保守基序(图4)。此外,系统进化树分析结果显示,OsLES3与二穗短柄草(Brachypodium distachyon)、山羊草及大麦等禾本科植物的锌指蛋白亲缘关系较近(图5)。

黑色虚线区域为zf-LSD1结构域。
The zf-LSD1 domain in the black dotted line region.
图3 OsLES3蛋白序列及其他序列的多重比对
Fig.3 Multiple alignment of OsLES3 amino acid sequence and other sequences

图4 OsLES3蛋白序列及其他序列的基序分析
Fig.4 Motif analysis of OsLES3 amino acid sequence and other sequences

图5 OsLES3蛋白与其他植物锌指蛋白的进化树分析
Fig.5 Molecular phylogenetic tree of OsLES3 and zinc finger proteins of other plants
2.4.3 二级与三级结构预测 利用SOPMA对OsLES3蛋白进行二级结构预测,结果显示,OsLES3蛋白由α-螺旋(11.29%)、延伸链(23.66%)及无规则卷曲(65.05%)组成(图6)。进一步利用Phyre2在线工具和PyMOL软件预测了OsLES3蛋白的部分三级结构,预测结果显示,OsLES3富含无规则卷曲、延伸链与α-螺旋,与二级结构预测结果相似,其中有93个氨基酸残基与一个锌带RNA结合蛋白(PDB号:c6tmfW)的三级结构高度相似(图7)。
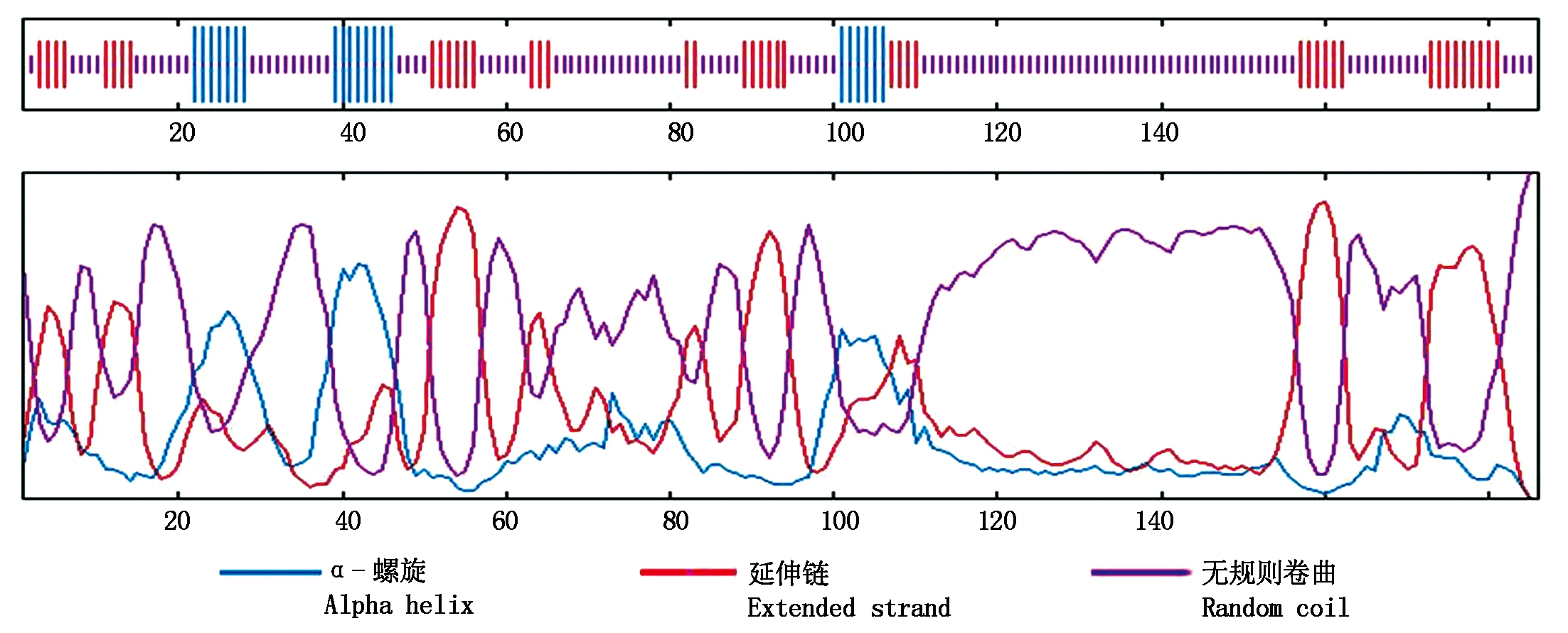
图6 OsLES3蛋白二级结构预测
Fig.6 Secondary structure prediction of OsLES3 protein

图7 OsLES3蛋白三级结构预测
Fig.7 Tertiary structure prediction of OsLES3 protein
3 讨论与结论
衰老是植物生长发育过程中不可避免的重要阶段,然而,早衰是一个非正常的过程,会造成光合效率减弱而导致作物减产及品质降低。引发植物衰老的原因不仅与其自身发育时期有关,还受一系列内部信号及外部因素的影响,如激素、黑暗、高盐、病原体攻击和养分胁迫等[26-27]。植物衰老是一个高度程序化的过程,其遗传和生理机制非常复杂,受复杂网络的调控,尽管很多衰老相关基因已被克隆且进行了相关的功能研究,但衰老的具体调控机理仍然不是很明晰,还需挖掘鉴定更多的未知基因。
在水稻生产中,有时会发生叶片早衰,致使结实率和千粒质量等农艺性状表现值偏低,造成一定的经济损失,因此,探究水稻衰老机制具有重要的现实意义。随着水稻基因组测序完成及遗传学与基因工程技术的发展,结合水稻突变体的发掘与利用,多个水稻叶片衰老相关基因被鉴定出来[10]。在本研究中,水稻叶早衰突变体osles3表型与野生型ZH11在分蘖后期就表现出显著差异,叶片出现水浸状衰老黄化斑点,成熟期叶片几乎全部枯萎。通过图位克隆,将OsLES3定位于第3染色体长臂上的RM15524与RM15551之间。研究表明,水稻叶衰老基因OsLED(LOC_Os03g43840)也位于该区间内[25],分析结果显示,本研究所定位的OsLES3与OsLED为等位基因,进一步证实了osles3的叶早衰表型与OsLES3基因突变有关。OsLES3编码一个LOL3蛋白,含有3个zf-LSD1结构域,生物信息学比较分析发现其与高粱及山羊草LOL3、大麦LSD1-like等锌指蛋白具有较高同源性,属于典型的锌指蛋白家族成员。
大量研究表明,锌指蛋白是植物体内重要的转录因子之一,广泛参与植物的生长发育过程,在叶片衰老调控中起重要作用[28-29]。含有LSD1-like锌指结构域的拟南芥LSD1相关蛋白已经被证明参与抗病反应和细胞程序性死亡,Xu等[30]研究发现,在水稻基因组中也存在AtLSD1的直系同源基因OsLOL2,其编码一个定位于细胞核的含有2个LSD1-like锌指结构域的蛋白。Wang等[31]研究发现,水稻中C2C2型锌指蛋白OsLSD1与细胞程序化死亡和愈伤组织分化的调控有关,OsLSD1对水稻细胞程序化死亡过程具有负效应,其反义转基因植株表现出类病变衰老表型。OsTZF1是一个串联锌指蛋白,利用RNAi技术降低OsTZF1基因表达会引起水稻叶片提前衰老[32]。还有研究表明,一个新的定位于细胞核的CCCH型锌指蛋白OsDOS,是叶片衰老的负调节因子,OsDOSRNAi转基因水稻植株在孕穗期逐渐开始表现出叶早衰表型[33]。
本研究利用水稻叶早衰自然变异突变体osles3完成了对OsLES3基因的精细定位,该基因翻译起始点(ATG)5′上游区(-17~-1 004 bp)存在988 bp的核苷酸片段缺失与54 bp的核苷酸片段插入可能导致了突变体表型的产生。OsLES3是一个LSD1型锌指蛋白基因,在水稻叶片衰老调控中起着重要的作用,但其具体调控机制还不是很清楚。由于植物衰老的机制及其遗传学调控网络十分复杂,因此,OsLES3基因对水稻叶片衰老的影响可能不是单一基因的作用结果,还有待对其互作基因及上、下游基因进行深入研究,构建这些基因的遗传网络进一步探索植物衰老调控的内在机制。本研究获得的结果为深入了解植物叶片衰老机理提供了一定的理论基础,也为培育叶片延缓衰老的优质高产水稻品种提供了基因靶点和资源。
[1] Wang Y W,Xu C,Lü C F,Wu M,Cai X J,Liu Z T,Song X M,Chen G X,Lü C G.Chlorophyll a fluorescence analysis of high-yield rice(Oryza sativa L.)LYPJ during leaf senescence[J].Photosynthetica,2016,54(3):422-429.doi:10.1007/s11099-016-0185-y.
[2] Yoshida S.Molecular regulation of leaf senescence[J].Current Opinion in Plant Biology,2003,6(1):79-84.doi:10.1016/S1369526602000092.
[3] 张玉霞,朱爱民,郭园,杜晓艳,栾瑞涛.追施氮肥对灌浆期沙地饲用燕麦叶片衰老特性的影响[J].华北农学报,2019,34(1):124-130.doi:10.7668/hbnxb.201750623.
Zhang Y X,Zhu A M,Guo Y,Du X Y,Luan R T.Effects of applying nitrogen fertilizer on leaf senescence characteristics of oat in sandy land during grain filling stage[J].Acta Agriculturae Boreali-Sinica,2019,34(1):124-130.
[4] 王鹏杰,吴殿星,舒小丽.水稻衰老相关突变体的研究进展[J].核农学报,2018,32(3):497-505.doi:10.11869/j.issn.100-8551.2018.03.0497.
Wang P J,Wu D X,Shu X L.Advances of research on rice senescence mutants[J].Journal of Nuclear Agricultural Sciences,2018,32(3):497-505.
[5] 丁世琪,吴洪恺.植物早衰的分子机理研究进展[J].杂交水稻,2011,26(5):1-5.doi:10.3969/j.issn.1005-3956.2011.05.001.
Ding S Q,Wu H K.Progress in molecular mechanism underlying plant premature senescence[J].Hybrid Rice,2011,26(5):1-5.
[6] 王复标,戎玲玲,安婷,余世洲,孙惠敏.功能叶早衰突变体水稻后期自然衰老的生理特性研究[J].核农学报,2021,35(3):518-525.doi:10.11869/j.issn.100-8551.2021.03.0518.
Wang F B,Rong L L,An T,Yu S Z,Sun H M.Physiological characteristics of top three functional leaves for a senilism rice mutant[J].Journal of Nuclear Agricultural Sciences,2021,35(3):518-525.
[7] 刘洪展,郑风荣,赵世杰.不同衰老类型小麦品种在衰老过程中光合特性的变化[J].华北农学报,2006,21(3):13-15.doi:10.3321/j.issn:1000-7091.2006.03.004.
Liu H Z,Zheng F R,Zhao S J.The change of photosynthetic characteristics in wheat varieties with different senescence-type during natural senescence[J].Acta Agriculturae Boreali-Sinica,2006,21(3):13-15.
[8] Navabpour S, Morris K, Allen R, Harrison E, A-H-Mackerness S, Buchanan-Wollaston V.Expression of senescence-enhanced genes in response to oxidative stress[J].Journal of Experimental Botany,2003,54(391):2285-2292.doi:10.1093/jxb/erg267.
[9] 徐娜,徐江民,蒋玲欢,饶玉春.水稻叶片早衰成因及分子机理研究进展[J].植物学报,2017,52(1):102-112.doi:10.11983/CBB16222.
Xu N,Xu J M,Jiang L H,Rao Y C.Advances in understanding leaf premature senescence and its molecular mechanism in rice[J].Bulletin of Botany,2017,52(1):102-112.
[10] 李可,禹晴,徐云姬,杨建昌.水稻叶片早衰突变体的农艺与生理性状研究进展[J].中国水稻科学,2020,34(2):104-114.doi:10.16819/j.1001-7216.2020.9078.
Li K,Yu Q,Xu Y J,Yang J C.Research progress in agronomic and physiological traits of early leaf senescence mutants in rice[J].Chinese Journal of Rice Science,2020,34(2):104-114.
[11] 朱永生,徐靖,蒋家焕,郑燕梅,陈丽萍,蔡秋华,王爱荣,张建福.水稻早衰突变体w14的鉴定和病程相关基因表达分析[J].福建农业学报,2020,35(6):626-632.doi:10.19303/j.issn.1008-0384.2020.06.008.
Zhu Y S,Xu J,Jiang J H,Zheng Y M,Chen L P,Cai Q H,Wang A R,Zhang J F.Resistance to early senescence and rice blast/blight:a mutant variety and expressions of responsible genes[J].Fujian Journal of Agricultural Sciences,2020,35(6):626-632.
[12] Liang C Z,Wang Y Q,Zhu Y N,Tang J Y,Hu B,Liu L C,Ou S J,Wu H K,Sun X H,Chu J F,Chu C C.OsNAP connects abscisic acid and leaf senescence by fine-tuning abscisic acid biosynthesis and directly targeting senescence-associated genes in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(27):10013-10018.doi:10.1073/pnas.1321568111.
[13] Sakuraba Y,Rahman M L,Cho S H,Kim Y S,Koh H J,Yoo S C,Paek N C.The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J].The Plant Journal,2013,74(1):122-133.doi:10.1111/tpj.12110.
[14] Leng Y J,Yang Y L,Ren D Y,Huang L C,Dai L P,Wang Y Q,Chen L,Tu Z J,Gao Y H,Li X Y,Zhu L,Hu J,Zhang G H,Gao Z Y,Guo L B,Kong Z S,Lin Y J,Qian Q,Zeng D L.A Rice PECTATE LYASE-LIKE gene is required for plant growth and leaf senescence[J].Plant Physiology,2017,174(2):1151-1166.doi:10.1104/pp.16.01625.
[15] Yamatani H,Sato Y,Masuda Y,Kato Y,Morita R,Fukunaga K,Nagamura Y,Nishimura M,Sakamoto W,Tanaka A,Kusaba M.NYC4,the rice ortholog of Arabidopsis THF1,is involved in the degradation of chlorophyll-protein complexes during leaf senescence[J].The Plant Journal,2013,74(4):652-662.doi:10.1111/tpj.12154.
[16] Zhou Y,Liu L,Huang W F,Yuan M,Zhou F,Li X H,Lin Y J.Overexpression of OsSWEET5 in rice causes growth retardation and precocious senescence[J].PLoS One,2014,9(4):e94210.doi:10.1371/journal.pone.0094210.
[17] Chen Y,Xu Y Y,Luo W,Li W X,Chen N,Zhang D J,Chong K.The F-box protein OsFBK12 targets OsSAMS1 for degradation and affects pleiotropic phenotypes,including leaf senescence,in rice[J].Plant Physiology,2013,163(4):1673-1685.doi:10.1104/pp.113.224527.
[18] Wang S,Lei C L,Wang J L,Ma J,Tang S,Wang C L,Zhao K J,Tian P,Zhang H,Qi C Y,Cheng Z J,Zhang X,Guo X P,Liu L L,Wu C Y,Wan J M.SPL33,encoding an eEF1A-like protein,negatively regulates cell death and defense responses in rice[J].Journal of Experimental Botany,2017,68(5):899-913.doi:10.1093/jxb/erx001.
[19] Sun L T,Wang Y H,Liu L L,Wang C M,Gan T,Zhang Z Y,Wang Y L,Wang D,Niu M,Long W H,Li X H,Zheng M,Jiang L,Wan J M.Isolation and characterization of a spotted leaf 32 mutant with early leaf senescence and enhanced defense response in rice[J].Scientific Reports,2017,7:41846.doi:10.1038/srep41846.
[20] Ke S W,Liu S C,Luan X,Xie X M,Hsieh T F,Zhang X Q.Mutation in a putative glycosyltransferase-like gene causes programmed cell death and early leaf senescence in rice[J].Rice,2019,12(1):7.doi:10.1186/s12284-019-0266-1.
[21] Schippers J H M,Schmidt R,Wagstaff C,Jing H C.Living to die and dying to live:the survival strategy behind leaf senescence[J].Plant Physiology,2015,169(2):914-930.doi:10.1104/pp.15.00498.
[22] 周纯,焦然,胡萍,林晗,胡娟,徐娜,吴先美,饶玉春,王跃星.水稻早衰突变体LS-es1的基因定位及候选基因分析[J].植物学报,2019,54(5):606-619.doi:10.11983/CBB19053.
Zhou C,Jiao R,Hu P,Lin H,Hu J,Xu N,Wu X M,Rao Y C,Wang Y X.Gene mapping and candidate gene analysis of rice early senescence mutant LS-es1[J].Chinese Bulletin of Botany,2019,54(5):606-619.
[23] Wang M,Zhang T,Peng H,Luo S,Tan J J,Jiang K F,Heng Y Q,Zhang X,Guo X P,Zheng J K,Cheng Z J.Rice premature leaf senescence 2,encoding a glycosyltransferase(GT),is involved in leaf senescence[J].Frontiers in Plant Science,2018,9:560.doi:10.3389/fpls.2018.00560.
[24] 张向前,邹金松,朱海涛,李晓燕,曾瑞珍.水稻早熟多子房突变体fon5的遗传分析和基因定位[J].遗传,2008,30(10):1349-1355.doi:10.3321/j.issn:0253-9772.2008.10.017.
Zhang X Q,Zou J S,Zhu H T,Li X Y,Zeng R Z.Genetic analysis and gene mapping of an early flowering and multi-ovary mutant in rice(Oryza sativa L.)[J].Hereditas,2008,30(10):1349-1355.
[25] 赵晨晨,黄福灯,龚盼,杨茜,程方民,潘刚.水稻叶片早衰突变体osled的生理特征与基因定位[J].作物学报,2014,40(11):1946-1955.doi:10.3724/SP.J.1006.2014.01946.
Zhao C C,Huang F D,Gong P,Yang X,Cheng F M,Pan G.Physiological characteristics and gene mapping of a leaf early-senescence mutant osled in rice[J].Acta Agronomica Sinica,2014,40(11):1946-1955.
[26] Zhao X S,Zhang T B,Feng H J,Qiu T C,Li Z C,Yang J,Peng Y L,Zhao W S.OsNBL1,a multi-organelle localized protein,plays essential roles in rice senescence,disease resistance,and salt tolerance[J].Rice,2021,14(1):1-17.doi:10.1186/s12284-020-00450-z.
[27] 谢金水,邵彩虹,唐秀英,刘光,石庆华.养分胁迫对威优916生育后期叶鞘衰老影响的蛋白质组分析[J].华北农学报,2011,26(3):106-112.doi:10.7668/hbnxb.2011.03.022.
Xie J S,Shao C H,Tang X Y,Liu G,Shi Q H.Proteomics analysis of rice sheath senescence under nutrient stress condition during late development stage[J].Acta Agriculturae Boreali-Sinica,2011,26(3):106-112.
[28] Luoni S B,Astigueta F H,Nicosia S,Moschen S,Fernandez P,Heinz R.Transcription factors associated with leaf senescence in crops[J]. Plants,2019,8(10):411.doi:10.3390/plants8100411.
[29] 任美艳,王志林,郭慧琴,薛敏,殷玉梅,王茅雁.沙冬青C2H2型锌指蛋白基因AmZFP1的克隆与表达分析[J].华北农学报,2017,32(2):8-13.doi:10.7668/hbnxb.2017.02.002.
Ren M Y,Wang Z L,Guo H Q,Xue M,Yin Y M,Wang M Y.Cloning and expression analysis of AmZFP1,a C2H2-type ZFP gene from Ammopiptanthus mongolicus[J].Acta Agriculturae Boreali-Sinica,2017,32(2):8-13.
[30] Xu C X,He C Z.The rice OsLOL2 gene encodes a zinc finger protein involved in rice growth and disease resistance[J].Molecular Genetics and Genomics,2007,278(1):85-94.doi:10.1007/s00438-007-0232-2.
[31] Wang L J,Pei Z Y,Tian Y C,He C Z.OsLSD1,a rice zinc finger protein,regulates programmed cell death and callus differentiation[J].Molecular Plant-Microbe Interactions,2005,18(5):375-384.doi:10.1094/MPMI-18-0375.
[32] Jan A, Maruyama K, Todaka D, Kidokoro S, Abo M, Yoshimura E, Shinozaki K, Nakashima K, Yamaguchi-Shinozaki K.OsTZF1,a CCCH-tandem zinc finger protein,confers delayed senescence and stress tolerance in rice by regulating stress-related genes[J].Plant Physiology,2013,161(3):1202-1216.doi:10.1104/pp.112.205385.
[33] Kong Z S,Li M N,Yang W Q,Xu W Y,Xue Y B.A novel nuclear-localized CCCH-type zinc finger protein,OsDOS,is involved in delaying leaf senescence in rice[J].Plant Physiology,2006,141(4):1376-1388.doi:10.1104/pp.106.082941.