小麦作为世界范围内广泛种植的粮食作物,养活了全球将近40%的人口[1]。从2014-2019年,小麦的播种面积百分比由14.73%降低到14.30%,但总产量由12 823.5万t增加到13 359.6万t,增加了4%[2-3],高产小麦品种的推广和种植是播种面积减少情况下总产量仍在稳步增长的主要原因之一。小麦作为主要的粮食作物,其生长调控及产量提高一直是育种工作中备受关注的环节。提高小麦产量的关键是培育抗逆高产品种,而培育高产品种的一种有效的技术手段是挖掘调控生长及产量的关键基因。
植物的生长发育是一个复杂的过程,但通过植物激素的作用,可以很好地协调和调控。茉莉酸(Jasmonic acid,JA)在植物的生长发育和防御反应中都有重要的调控作用。茉莉酸类物质(JAs)是指以茉莉酸、茉莉酸甲酯(MeJA)等物质为代表的环戊烷酮衍生物,它们广泛存在于所有植物中,作为一种重要的信号分子[4],调控植物的种子萌发、生长发育、果实成熟、光合作用等生理生化过程[5-9],还参与植物在生物胁迫、非生物胁迫下的防御反应[10-15]。
茉莉酸类物质含量的增加能诱导特异基因的表达,从而大量合成茉莉酸诱导蛋白(Jasmonate-induced proteins,JIPs)[16],已经被报道的如营养贮藏蛋白[17]、大麦JIP23[18]、硫堇蛋白[19]、渗透蛋白[20]及蛋白酶抑制剂[21]、热胁迫蛋白JIP[22]等,这些JIPs参与了植物的氮素储存、糖运输、病原体防御、渗透胁迫及昆虫或机械损伤、热胁迫的抵御等生物过程。小麦中茉莉酸诱导蛋白基因Ta-JA2 (GenBank:EU035635)最早由牛吉山等[23]用基因芯片技术结合分池法从小麦兰考90(6)中克隆得到,该基因具有Dirigen和Jacalin_like 2个典型的保守域,与小麦抗白粉病有关,是一个JA诱导表达相关基因。
目前,对于小麦JIP蛋白的研究大多集中在胁迫处理的生理生化等方面,有关小麦JIP参与调控生长的研究鲜有报道。本研究通过同源克隆的方法从小麦中克隆得到茉莉酸诱导蛋白基因并命名为TaJIP2,构建其RNA干扰(RNAi)载体并对小麦进行遗传转化,通过分析TaJIP2基因的组织差异表达模式,以及沉默TaJIP2对JA生物合成关键酶丙二烯氧化物环化酶(Allene oxide cyclase,AOC)、12-氧-植物二烯酸还原酶(12-oxo-phytodienoic acid reductase,OPR)活性,内源JA含量,光合作用及小麦生长和产量的影响,研究TaJIP2基因在小麦生长、成熟和产量方面的调控功能,为调控小麦生长和创制小麦早熟、高产新种质提供理论基础和基因保障。
1 材料和方法
1.1 试验材料
1.1.1 植物材料与培养 供试材料为小麦品种百农207,由河南科技学院生命科技学院河南省粮食作物基因组编辑工程技术研究中心保存。小麦植株种于以蛭石、营养土体积比1∶3为基质的苗盆中,待长至三叶一心期后置于春化培养箱春化28 d,转移至人工气候室培养,培养光周期为16 h光照/8 h黑暗,温度为25 ℃(光照)/16 ℃(黑暗),光照强度约为5 000 lx,相对湿度为65%左右。
1.1.2 质粒及菌种 大肠杆菌(Escherichia coli)DH5α、农杆菌(Agrobacterium tumefaciens)GV3101、表达载体质粒pTCK303由河南省粮食作物基因组编辑工程技术研究中心提供,pMDTM19-T Vector Cloning Kit购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 TaJIP2基因的序列分析 使用小麦基因组数据库在线网站(https://wheat-urgi.versailles.inra.fr/Seq-Repository)比对TaJIP2基因在A,B,D上的同源序列,用DNAMAN软件进行序列比对,分析它们的同源关系,通过NCBI(https://blast.ncbi.nlm.nih.gov)在线翻译TaJIP2蛋白序列。
1.2.2 TaJIP2基因RNAi载体的构建 根据小麦TaJIP2基因序列同源比对结果,用Primer Primer 6软件设计TaJIP2基因RNAi引物TaJIP2-RNA1-pTCK303、TaJIP2-RNA2-pTCK303(表1),以小麦cDNA为模板,通过PCR扩增后将其作为反向重复序列插入到RNAi表达载体pTCK303中,其中正向酶切位点采用BamHⅠ、KpnⅠ,反向酶切位点采用SacⅠ、SpeⅠ,构建完成后得到重组载体质粒TaJIP2-RNAi-pTCK303。
1.2.3 农杆菌介导的小麦遗传转化 参照Supartana等[24]的报道,将构好的RNAi载体与pTCK303对百农207小麦进行遗传转化,得到11株TaJIP2-RNAi-pTCK303遗传转化植株和4株pTCK303空载体对照植株用于TaJIP2基因功能分析,同时设置野生型(WT)对照。
1.2.4 小麦总RNA的提取及TaJIP2基因的组织差异表达模式和表达量分析 称取0.1 g的小麦幼苗组织,置于研钵中,迅速加入液氮,研磨成粉末,TRIzol法提取样品总RNA[25],TRIzol购自美国Invitrogen公司。经1%琼脂糖凝胶电泳检测RNA无降解后,用核酸蛋白分析仪测定A260、A280,检测RNA的浓度和纯度。根据购自宝生物工程(大连)有限公司的PrimeScriptTM RT regent Kit with gDNA Eraser(Perfect Real Time)试剂盒反转录合成cDNA第一条链。
依据TaJIP2基因的编码序列设计特异性引物TaJIP2-qPCR-F1/R1(表1),内参基因选择TaActin-WAC[23],采用宝生物工程(大连)有限公司的TB Green® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)试剂盒对TaJIP2基因在WT小麦幼根、叶鞘、幼叶、旗叶、茎节、茎秆、雌蕊、雄蕊、穗轴、颖壳中的表达水平以及在小麦T0阳性单株幼苗期叶片和根系中的相对表达量进行实时荧光定量PCR(Real-time fluorescent quantitative RCR,qPCR)分析。
表1 试验所需引物序列
Tab.1 Primer sequences used in the experiment
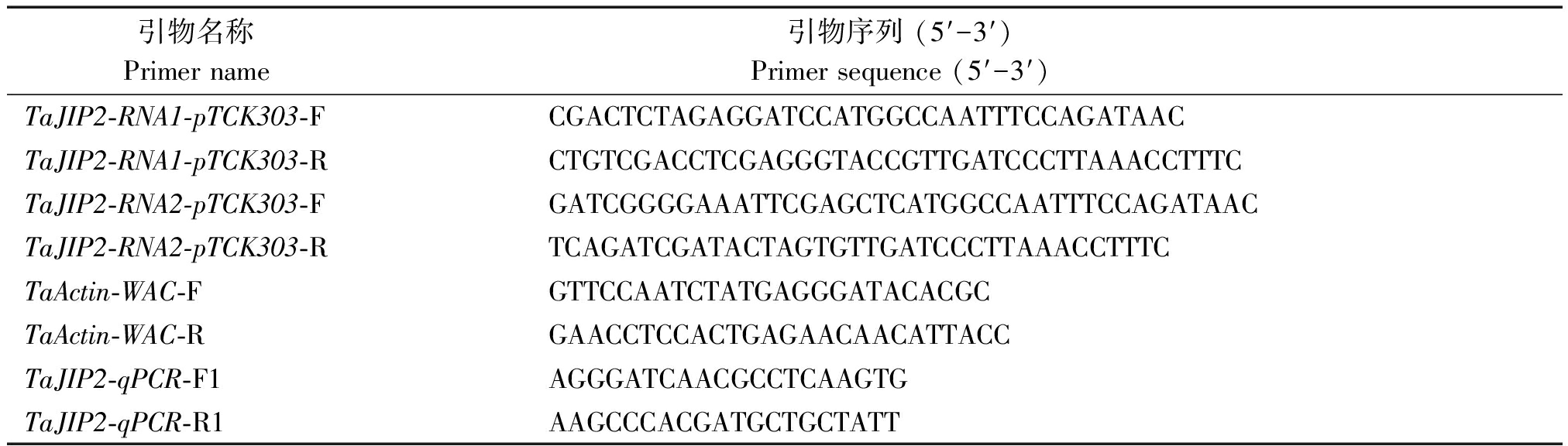
引物名称 Primer name 引物序列 (5′-3′) Primer sequence (5′-3′) TaJIP2-RNA1-pTCK303-FCGACTCTAGAGGATCCATGGCCAATTTCCAGATAACTaJIP2-RNA1-pTCK303-RCTGTCGACCTCGAGGGTACCGTTGATCCCTTAAACCTTTCTaJIP2-RNA2-pTCK303-FGATCGGGGAAATTCGAGCTCATGGCCAATTTCCAGATAACTaJIP2-RNA2-pTCK303-RTCAGATCGATACTAGTGTTGATCCCTTAAACCTTTCTaActin-WAC-FGTTCCAATCTATGAGGGATACACGCTaActin-WAC-RGAACCTCCACTGAGAACAACATTACCTaJIP2-qPCR-F1AGGGATCAACGCCTCAAGTGTaJIP2-qPCR-R1AAGCCCACGATGCTGCTATT
1.2.5 小麦JA生物合成通路关键酶活性、JA含量测定及根尖超微结构的观察 将分蘖期新鲜小麦组织在液氮中研磨后,加入样品体积9倍的提取液(0.1 mmol/L pH值7.4的PBS),4 ℃浸提2 h,离心10 min后收集上清液,采用上海优选生物科技有限公司的ELISA试剂盒测定小麦JA生物合成通路关键酶AOC、OPR活性以及JA含量。
观察同一生育时期小麦根尖细胞超微结构,使用薄刀片取不同处理小麦植株以及WT的根尖组织(每样本1 mm×3 mm),立即用2.5%的戊二醛固定细胞,常规操作步骤对样本进行包埋处理,用Lecia EMUC7超薄切片机切成约50 nm厚的切片。采用Hitachi HT7700透射电子显微镜在80 kV电压下观察小麦各个处理根尖细胞的超微结构。
1.2.6 小麦叶片光合参数测定 选取拔节期完全展开且没有遮挡的小麦健康叶片,采用LI-6400便携式光合测定仪(LI6400XT,UK)测定其净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)等指标,分析沉默TaJIP2基因对小麦叶片光合作用的影响。
1.2.7 小麦产量和产量构成因素测定 小麦成熟后,对小麦进行单株收获,测定沉默TaJIP2基因对小麦单株穗数、穗粒数、千粒质量及单株产量的影响。
1.2.8 数据分析 采用Excel 2010软件进行数据分析和作图,采用SPSS软件进行方差分析。
2 结果与分析
2.1 TaJIP2基因序列同源性比对
将TaJIP2的核苷酸序列与A、B、D基因组上的同源基因的核苷酸序列进行比对分析,发现TaJIP2位于2B染色体上,其核苷酸序列与3个基因组上的核苷酸序列高度同源(图1),同源性为97.57%。通过NCBI分析,发现该基因包含915 bp的ORF,编码了一个由303个氨基酸组成的蛋白质。

图1 TaJIP2基因核苷酸多序列比对
Fig.1 Multiple sequence alignment of TaJIP2 gene
2.2 小麦TaJIP2基因的组织差异表达模式分析
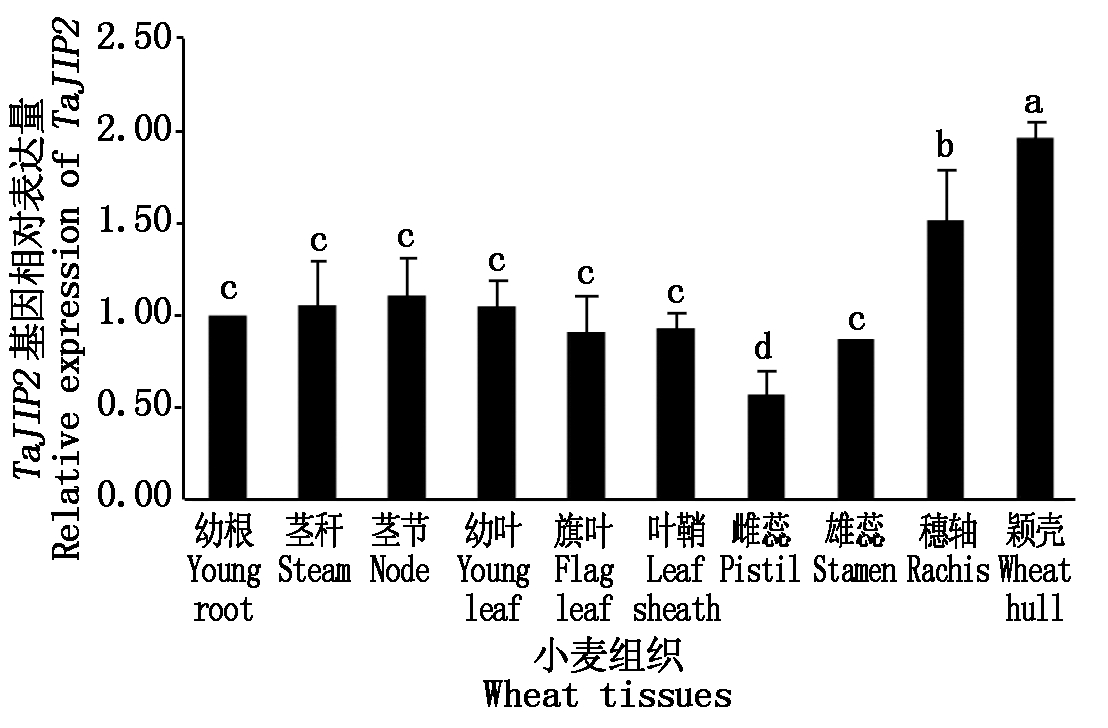
分别提取WT小麦幼根、叶鞘、幼叶、旗叶、茎节、茎秆、雌蕊、雄蕊、穗轴、颖壳的总RNA,反转录成cDNA后,以小麦TaActin-WAC为内参,对小麦各组织部位进行TaJIP2基因的qRT-PCR分析。以幼根的表达量为参照,使用2-ΔΔCT法计算TaJIP2基因在其他组织中的相对表达量,结果表明,TaJIP2基因在小麦各部位均有表达,其中在颖壳中表达量最高,显著高于其他组织(P<0.05);其次是穗轴,显著高于幼根等部位的表达量(P<0.05);在茎秆、茎节、幼叶、旗叶、叶鞘、雄蕊中的表达量与在幼根中的表达量差异不显著;在雌蕊中的表达量最低,显著低于其他组织(P<0.05)(图2)。
2.3 TaJIP2基因表达量分析
提取小麦T0阳性单株幼苗期叶片和根系总RNA,并反转录成cDNA进行qRT-PCR分析。结果表明,TaJIP2基因在WT和pTCK303对照植株的根和叶中表达量差异不显著,TaJIP2-RNAi-pTCK303阳性单株中的TaJIP2基因在叶片和根系中的相对表达量分别为0.19和0.39,显著低于WT和pTCK303对照植株(P<0.05)(图3),表明RNAi诱导了TaJIP2基因在小麦叶片和根系中发生沉默。
数据为3个独立试验的平均值;不同字母表示差异显著(P<0.05)。
图3-4,6,8,10同。
The values are the averages of three independent experiments;Different letters
indicate significant differences(P<0.05).The same as Fig.3-4,6,8,10.
图2 TaJIP2基因在小麦不同组织部位的表达分析
Fig.2 Expression analysis of TaJIP2 gene in
different tissues of wheat
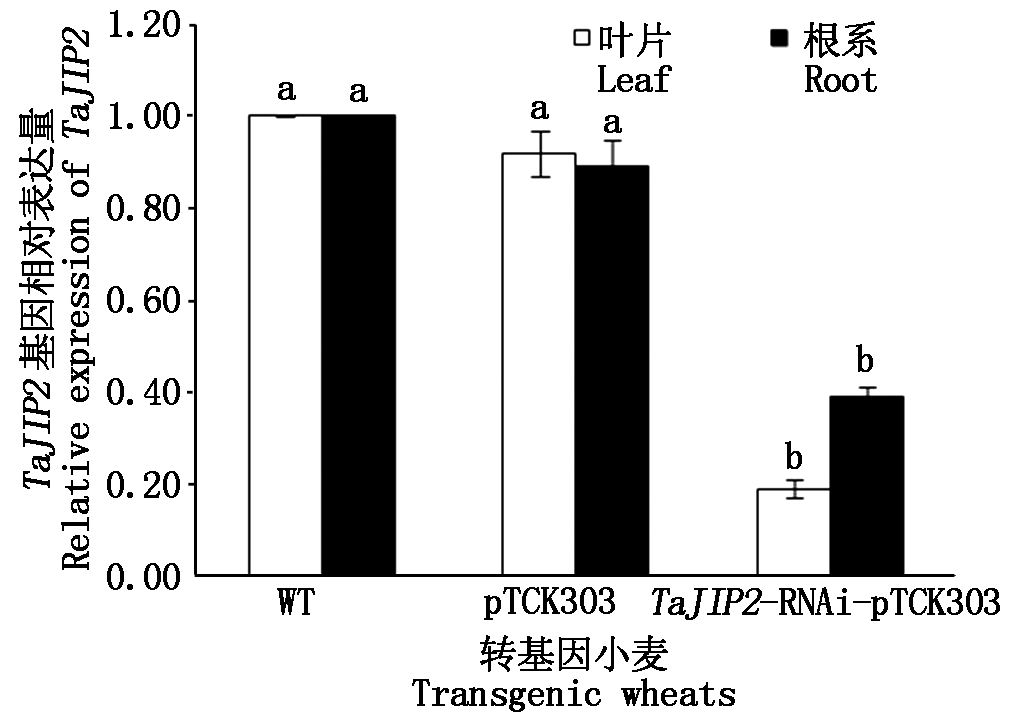
图3 TaJIP2基因在RNAi和
对照小麦叶片和根系中的表达量分析
Fig.3 Expression analysis of TaJIP2 gene in leaves and
roots of RNA inference and control wheat plants
2.4 TaJIP2基因对小麦生长的负调控作用
2.4.1 沉默TaJIP2基因对JA生物合成关键酶活性及内源JA含量的影响 沉默TaJIP2基因小麦植株分蘖期叶片和根系中JA合成关键酶AOC的活性分别是pTCK303空载体对照植株的1.13,1.12倍,OPR活性分别是pTCK303空载体对照植株的1.10,1.25倍,显著高于pTCK303对照植株(P<0.05)(图4-A、B)。同一时期TaJIP2基因沉默的小麦植株叶片的JA含量分别是pTCK303空载体和WT对照植株的1.16,1.08倍,根系的JA含量分别是pTCK303空载体和WT对照植株的1.64,1.39倍,即沉默TaJIP2基因小麦叶片和根系的JA含量显著高于WT和pTCK303对照植株(P<0.05)(图4-C),其中JA含量在根系中的差异更明显。TaJIP2基因沉默植株叶片和根系中的JA含量与JA合成途径关键酶AOC和OPR的活性显著高于pTCK303空载体对照,表明沉默TaJIP2基因显著促进了小麦叶片和根系JA合成。
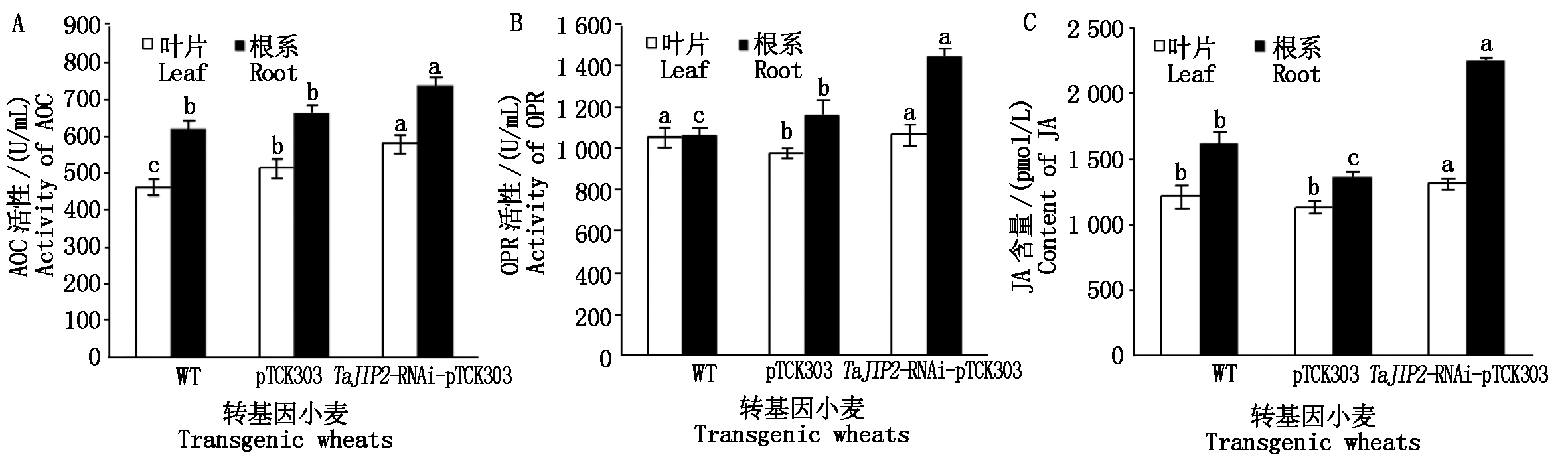
图4 RNAi和对照小麦中JA生物合成关键酶活性及JA含量分析
Fig.4 Activity of key enzymes for JA biosynthesis and JA content in RNA inference and control wheat plants
2.4.2 TaJIP2基因调控小麦生长表型分析 通过对小麦分蘖期表型观察和测定,结果表明,沉默TaJIP2基因小麦株高是pTCK303对照植株的1.24倍,显著增加(P<0.05),与WT对照差异不显著(图5,图6-A);而沉默TaJIP2基因小麦根长分别是pTCK303载体和WT对照植株的1.75,1.10倍,显著高于pTCK303载体和WT对照植株(P<0.05)(图5,图6-B)。以上结果表明,沉默TaJIP2基因显著促进了小麦地上部分和根系的生长,其中对根系生长的促进作用更显著,该结果与JA在TaJIP2基因沉默小麦根系中的合成和积累表现一致(图4-C),说明TaJIP2基因沉默显著促进了小麦根系中JA的合成和根系的生长,TaJIP2基因是一个小麦苗期生长的负调控基因。

图5 沉默TaJIP2基因对小麦叶片和根系生长的影响
Fig.5 Effects of silencing TaJIP2 gene on
leaf and root growth in wheat
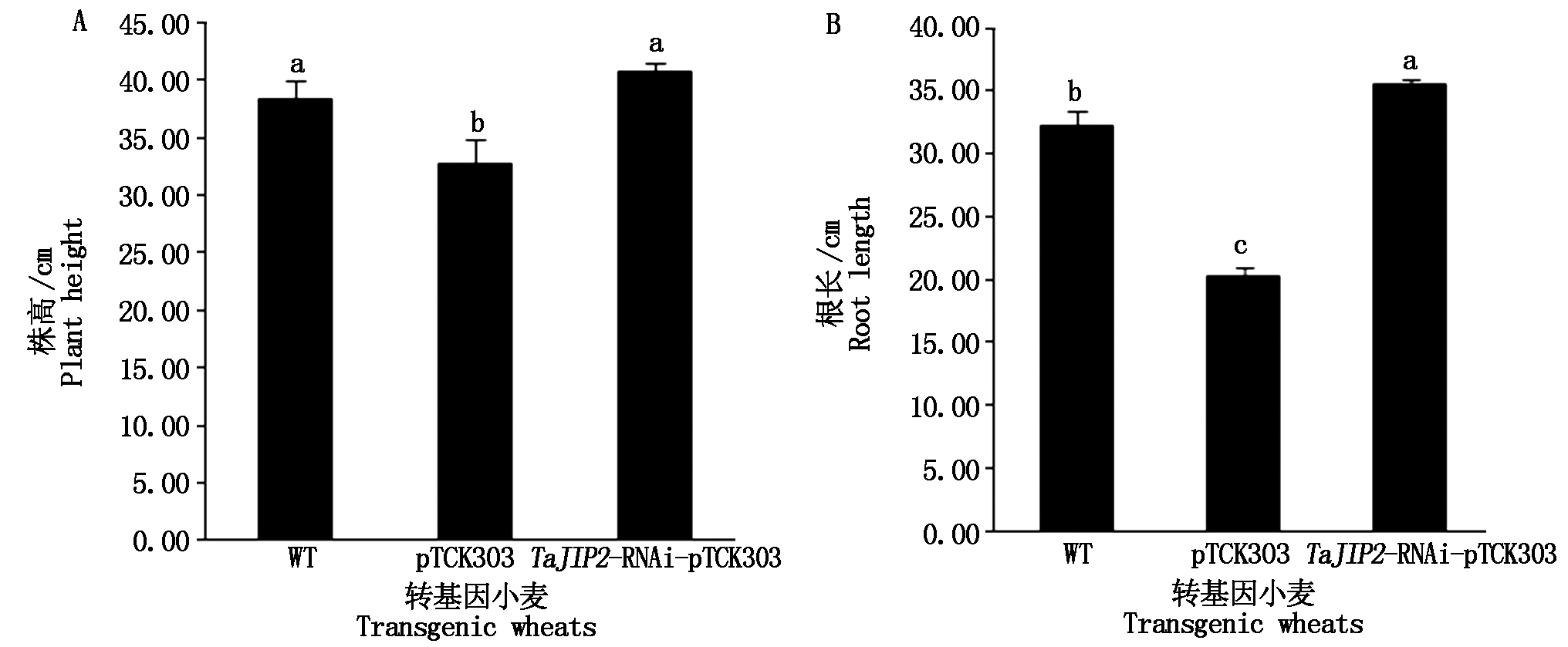
图6 沉默TaJIP2基因对小麦根长和株高的影响
Fig.6 Effects of silencing TaJIP2 gene on root length and plant height in wheat
2.4.3 沉默TaJIP2基因对小麦根尖细胞超微结构的影响 由于沉默TaJIP2基因显著提高了JA含量,并显著促进了根系生长,利用透射电镜观察了同一时期根尖细胞超微结构,结果表明,WT植株根尖细胞结构完整且细胞壁光滑平整(图7-A1-A4);pTCK303载体对照植株根尖细胞的细胞壁变薄,细胞器明显减少(图7-B1-B4);沉默TaJIP2基因的小麦植株根尖细胞线粒体、内质网等细胞器数量增加,胞间充斥着结构完整的细胞器(图7-C1-C4),表明根尖细胞活力更强。综上所述,沉默TaJIP2基因增加了JA的生物合成和根尖细胞活力,从而促进小麦植株生长。
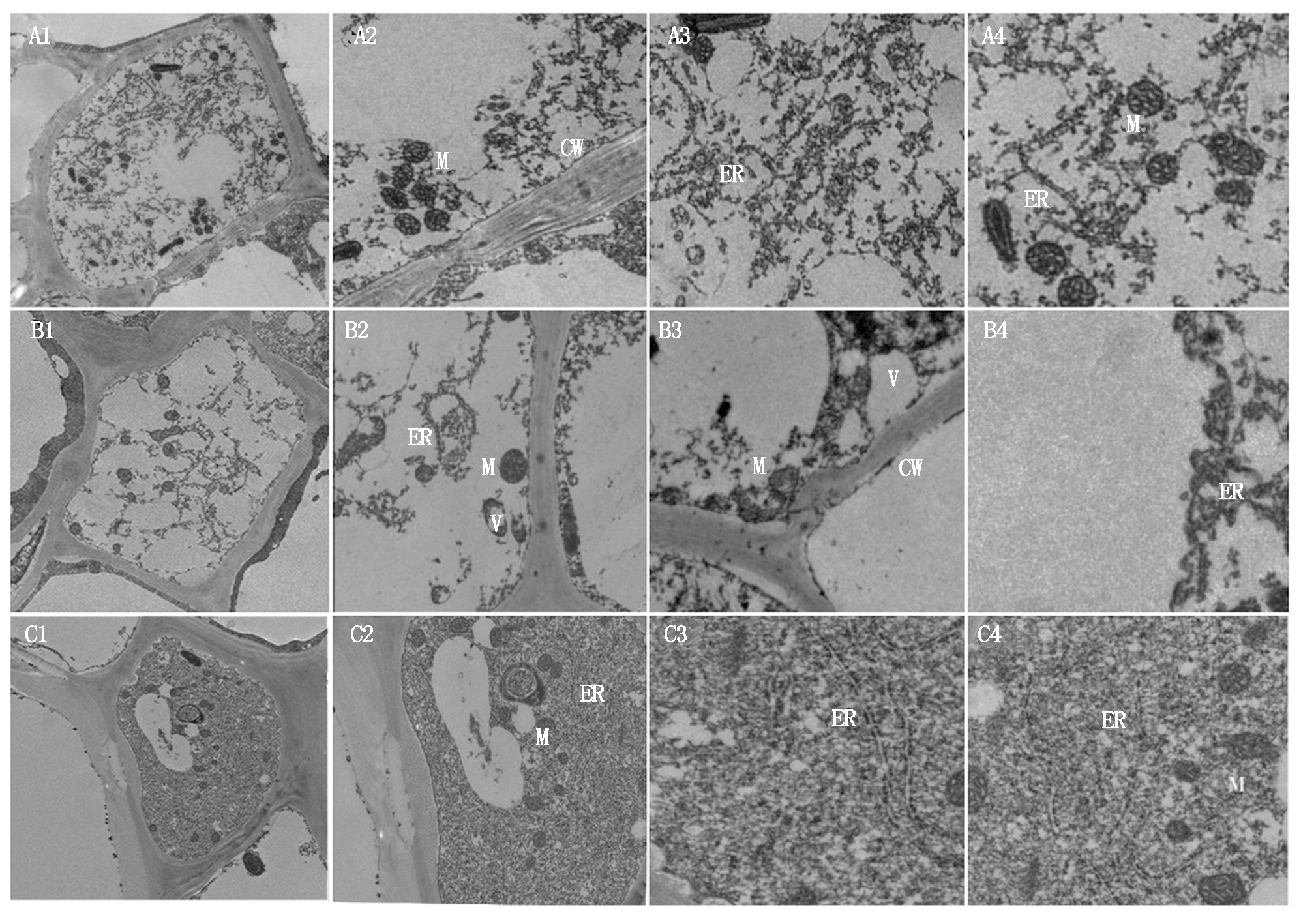
A1~A4.WT植株;B1~B4.pTCK303空载体对照植株;C1~C4.TaJIP2-RNAi-pTCK303转基因植株。A1、B1、C1的比例尺为5.0 μm;
A2、B2、C2、A3、B3、C3、A4、B4、C4的比例尺为2.0 μm。M.线粒体;CW.细胞壁;ER.内质网;V.液泡。
A1-A4.WT plant;B1-B4.pTCK303 transgenic plant;C1-C4.TaJIP2-RNAi-pTCK303 transgenic plant.Scale bars indicate 5.0 μm in A1,B1,C1;
Scale bars indicate 2.0 μm in A2,B2,C2,A3,B3,C3,A4,B4,C4.M.Mitochondria;CW.Cell wall;ER.Endoplasmic reticulum;V.Vacuole.
图7 沉默TaJIP2基因对小麦根尖细胞超微结构的影响
Fig.7 Effects of silencing TaJIP2 gene on the ultrastructure of root tip cells in wheat
2.5 TaJIP2基因对小麦成熟的负调控作用
2.5.1 沉默TaJIP2基因对小麦叶片光合作用效率的促进作用 TaJIP2基因沉默小麦叶片的净光合速率是pTCK303对照植株的4.16倍,气孔导度是pTCK303对照植株的2.14倍,均显著高于pTCK303对照植株(P<0.05)(图8-A-B);而TaJIP2基因沉默小麦叶片的胞间CO2浓度是pTCK303对照植株的81%,显著低于pTCK303对照植株(P<0.05)(图8-C),可能是由于TaJIP2基因沉默植株叶片的光合效率高,胞间CO2浓度消耗多导致的;两者的蒸腾速率差异不显著(图8-D)。以上结果表明,沉默TaJIP2基因显著增加了小麦叶片的光合效率,TaJIP2基因是一个小麦叶片光合负调控基因。
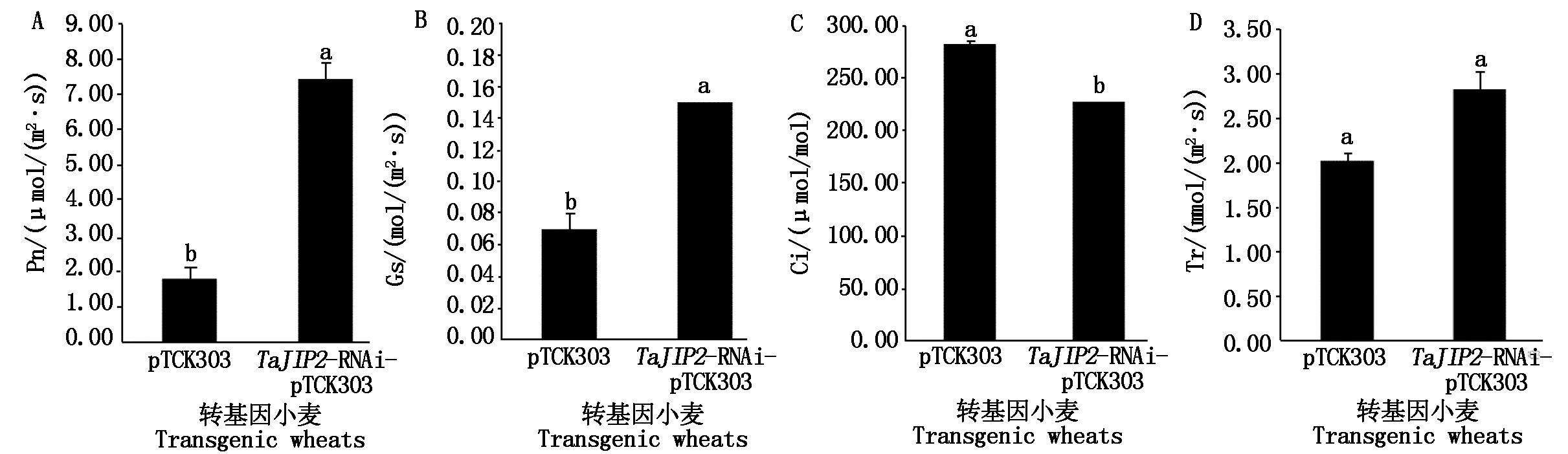
图8 沉默TaJIP2基因对小麦叶片光合参数的影响
Fig.8 Effects of silencing TaJIP2 gene on photosynthetic parameters of leaves in wheat
2.5.2 沉默TaJIP2基因对小麦早熟的促进作用 在小麦植株生殖生长过程中,与WT和pTCK303对照植株相比,沉默TaJIP2基因后小麦抽穗时间提前,TaJIP2基因沉默小麦已经大部分完成抽穗,pTCK303对照植株少数抽穗,尚在开花期,WT则完全未抽穗(图9-A)。开花期随机抽取TaJIP2基因沉默植株、pTCK303对照植株各5个小穗剥开观察,发现TaJIP2基因沉默植株穗部已经孕育籽粒且籽粒饱满,而pTCK303对照植株仍处于扬花期(图9-B-C)。以上结果表明,沉默TaJIP2基因促进了小麦植株抽穗和籽粒灌浆,使小麦成熟时间提前,说明TaJIP2基因是一个小麦成熟的负调控基因。

A.小麦穗部表型;B.小穗表型;C.小穗分析。
A.Phenotype of wheat panicle;B.Phenotype of wheat spikelet;C.Analysis of wheat spikelet.
图9 沉默TaJIP2基因对小麦植株穗部及籽粒表型的影响
Fig.9 Effects of silencing TaJIP2 gene on phenotype of panicle and grain in wheat
2.6 TaJIP2基因对小麦产量的负调控作用
通过观察成熟期麦穗发现,沉默TaJIP2基因麦穗比pTCK303空载体对照植株大(图10-A),籽粒多且饱满(图10-B)。沉默TaJIP2基因小麦籽粒粒长显著高于pTCK303对照植株,与WT差异不显著;而沉默TaJIP2基因小麦籽粒粒宽显著高于pTCK303空载体和WT对照植株,分别是pTCK303空载体和WT对照植株的1.39,1.10倍(图10-C)。此外,pTCK303对照植株的籽粒小且干瘪(图10-B),其粒长和粒宽都显著小于TaJIP2基因沉默植株和WT(P<0.05)(图10-C)。
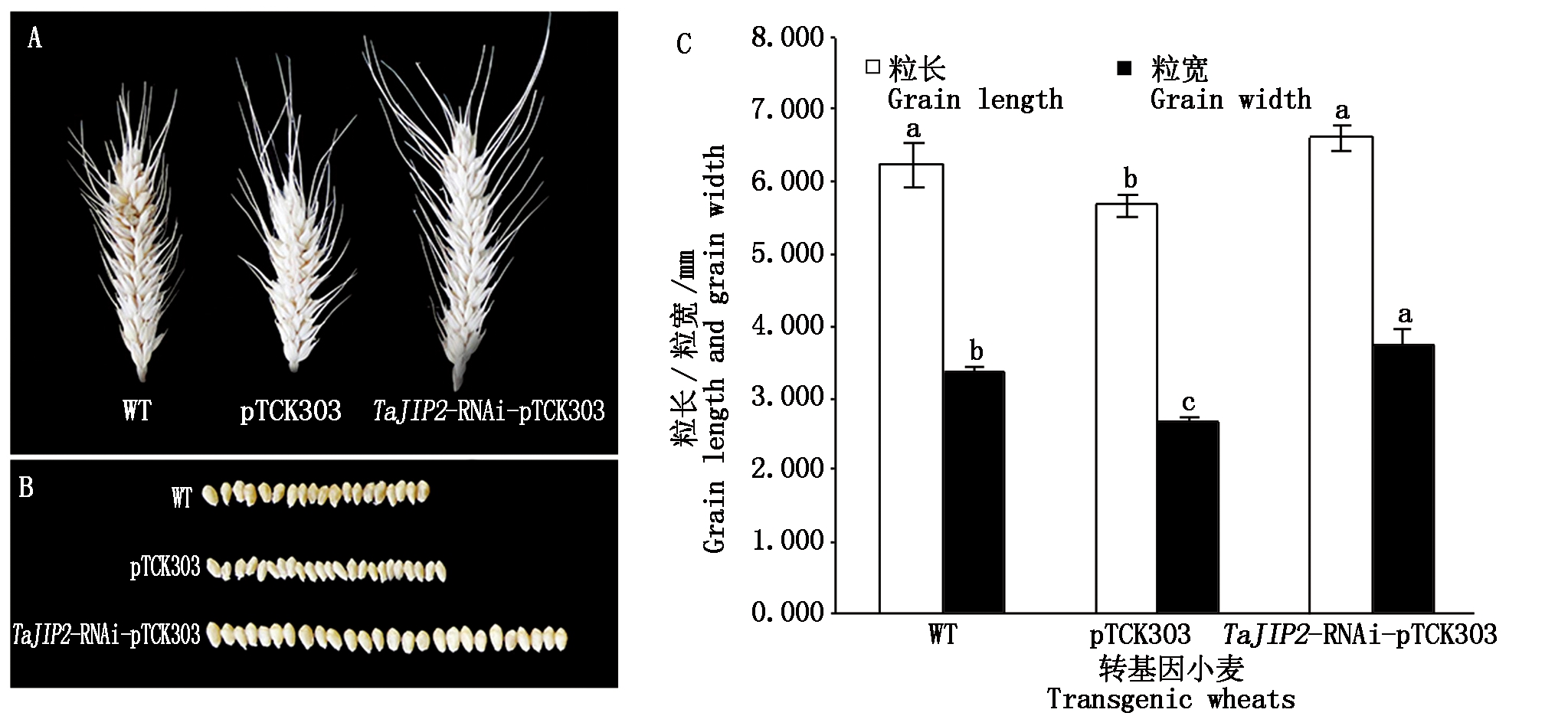
图10 沉默TaJIP2基因对小麦穗部及籽粒性状的影响
Fig.10 Effects of silencing TaJIP2 gene on panicle and grain properties in wheat
沉默TaJIP2基因小麦穗数、穗粒数、千粒质量和单株产量都显著高于pTCK303空载体和WT对照植株(表2),表明沉默TaJIP2基因促进了小麦抽穗与结实灌浆,显著提高了小麦产量,即TaJIP2基因是一个小麦产量的负调控基因。
表2 沉默TaJIP2基因对小麦产量及其构成的影响
Tab.2 Effects of silencing TaJIP2 gene on yield and its composition in wheat
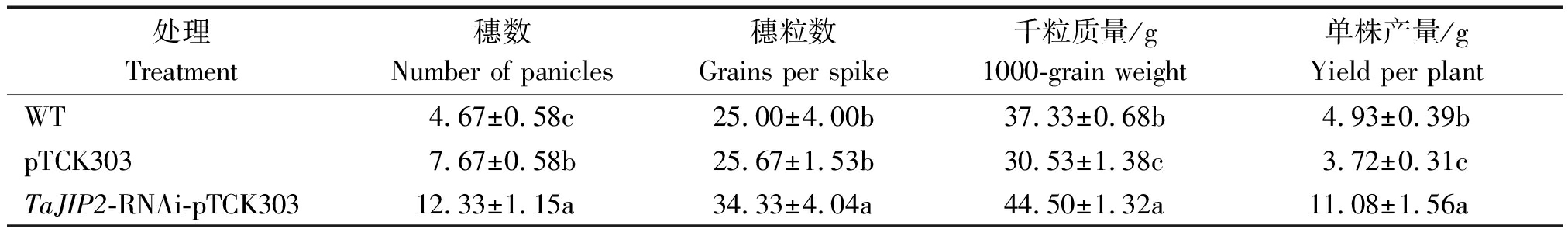
处理Treatment穗数Number of panicles穗粒数Grains per spike千粒质量/g1000-grain weight单株产量/gYield per plantWT4.67±0.58c25.00±4.00b37.33±0.68b4.93±0.39bpTCK3037.67±0.58b25.67±1.53b30.53±1.38c3.72±0.31cTaJIP2-RNAi-pTCK30312.33±1.15a34.33±4.04a44.50±1.32a11.08±1.56a
注:每组数据的数值(平均值±s)为3个独立试验的平均值,不同字母表示差异显著(P<0.05)。
Note:The values(means±s)are the averages of three independent experiments, and different letters indicate significant difference(P<0.05).
3 讨论与结论
茉莉酸类物质在植物生长发育、抗性诱导、开花代谢、各种生物与非生物胁迫的防御等各个方面都起到重要调控作用。Jacalin类凝集素(Jacalin related lectin,JRL)作为植物凝集素超家族的一个大家族,可根据结构特点分为3种,一种是只包含一个Jacalin结构域,一种是在多肽链前端包含其他结构域的嵌合凝集素,以及只包含多个Jacalin结构域的全凝集素[26],能有效响应生物或非生物胁迫刺激及参与植物生长发育。对于单子叶植物JRL,在小麦中被发现的大多都是参与植物的防御反应[27-28]。牛吉山等[23]利用基因芯片技术结合分池法在小麦品系兰考90(6)克隆到茉莉酮酸酯诱导蛋白基因Ta-JA2(GenBank 登录号:EU035635),其编码的蛋白质有一个Dirigent结构域和一个Jacalin-like结构域,对小麦白粉病具有高抗性,其表达受白粉菌的诱导而增强,同样证明了JRL在小麦病原菌防御中起作用。目前,小麦中已知功能并包含Jacalin-like结构域的Jacalin类凝集素基因还包括:春化相关基因TaVER2[29]、与白粉菌和赤霉菌抗病反应相关基因TaJRL2[30]、小麦病害响应基因TaWC1-1[31]、对黑森麦秆虫幼虫有抑制作用的基因TaHFR-1[32]及小麦赤霉病抗病相关基因TaJRL53[33]等。本研究从小麦百农207中扩增到了一个茉莉酸诱导蛋白基因TaJIP2,与牛吉山等[23]报道的Ta-JA2为同一个基因,但目前TaJIP2基因在小麦中促进生长的调控机制鲜有报道。
牛吉山等[23]研究认为,Ta-JA2基因主要在兰考90(6)叶片和茎中表达,茎和幼穗中几乎不表达,在叶片中按幼叶、壮叶、旗叶依次增强,推测该基因在兰考90(6)幼叶中的稳定和相对高水平表达可能与其高抗病性有关。而本研究对TaJIP2基因在百农207幼根、幼叶、旗叶、茎秆、茎节、雌蕊、雄蕊、穗轴、颖壳等不同组织中的表达模式进行分析后发现,其在颖壳中的表达量最高,穗轴中次之,雌蕊中最少,在幼根、茎秆、茎节、幼叶、旗叶、叶鞘和雄蕊组织之间差异不显著,推测TaJIP2基因在颖壳和穗轴中的相对高表达与TaJIP2基因沉默小麦提早抽穗、灌浆有关。该结果与牛吉山等[23]研究结果不同,可能是由于小麦品种不同,造成了TaJIP2基因组织表达部位的不同。
本研究对TaJIP2在小麦基因组数据库中A、B、D 3个基因组的同源序列进行比对,发现TaJIP2基因存在于2B染色体上,且其核苷酸序列与3个染色体上的核苷酸序列高度同源。为了进一步研究小麦TaJIP2基因的功能,本试验扩增了小麦TaJIP2基因并构建了TaJIP2基因的RNAi载体,发现沉默TaJIP2基因促进JA生物合成通路关键酶AOC和OPR活性增强以及JA含量增加,这与TaJIP2基因沉默植株中该基因的表达量相反,表明TaJIP2是小麦JA生物合成通路关键酶AOC和OPR活性及JA含量的负调控基因,其中JA含量的差异主要体现在根系上。同时TaJIP2基因沉默的小麦株高和根长分别是pTCK303对照植株的1.24,1.75倍,表明沉默TaJIP2基因显著促进了小麦根系和地上部分生长,其中根系生长状况差异更显著。因此,进一步观察了TaJIP2基因沉默和对照小麦的根尖细胞超微结构,发现TaJIP2基因沉默植株根尖细胞结构完整,细胞内各细胞器种类和数量丰富,细胞活性强,从而促进了根系生长。以上结果表明,TaJIP2基因对小麦JA合成以及小麦植株生长具有显著负调控作用。
沉默TaJIP2基因后小麦叶片的净光合速率是pTCK303对照植株的4.16倍,气孔导度是pTCK303对照植株的2.14倍。沉默TaJIP2基因通过增加小麦叶片净光合速率、气孔导度,显著提高了小麦叶片的光合作用效率,表明TaJIP2基因是一个小麦叶片光合负调控基因。同时,沉默TaJIP2基因后促进了小麦的成熟,表明TaJIP2是一个小麦成熟的负调控基因。此外,沉默TaJIP2基因增加了成熟期麦穗的大小以及单穗籽粒的数量和饱满程度,小麦籽粒粒长和粒宽显著高于pTCK303对照,其中粒宽分别是pTCK303空载体和WT对照植株的1.39,1.10倍。沉默TaJIP2基因小麦穗数、穗粒数、千粒质量和单株产量都显著高于pTCK303空载体和WT对照植株。表明沉默TaJIP2基因促进了小麦抽穗与结实灌浆,显著提高了小麦产量,即TaJIP2基因是一个小麦产量的负调控基因。
综上所述,从小麦中克隆的茉莉酸诱导蛋白基因TaJIP2在小麦各个部位均有表达,在颖壳的表达量最高;沉默TaJIP2基因通过提高JA生物合成关键酶AOC和OPR的活性和JA含量,维持根尖细胞结构完整、提高胞内细胞器的种类和数目,增加叶片光合作用效率,提高小麦单株穗数、穗粒数、籽粒长宽和千粒质量,从而促进小麦植株生长、提前成熟和高产,表明TaJIP2是一个小麦生长、成熟和产量的关键负调控基因。以上研究结果为创制小麦早熟、高产新种质提供了理论基础和基因资源。
[1] 傅向东,刘倩,李振声,张爱民,凌宏清,童依平,刘志勇.小麦基因组研究现状与展望[J].中国科学院院刊,2018,33(9):909-914.doi:10.16418/j.issn.1000-3045.2018.09.003.
Fu X D,Liu Q,Li Z S,Zhang A M,Ling H Q,Tong Y P,Liu Z Y.Research achievement and prospect development on wheat genome[J].Bulletin of the Chinese Academy of Sciences,2018,33(9):909-914.
[2] 中华人民共和国国家统计局.国际统计年鉴[M].北京:中国统计出版社,2019:239-244.
National Bureau of Statistics of China.International statistical yearbook[M].Beijing:China Statistics Press,2019:239-244.
[3] 中华人民共和国国家统计局.中国统计年鉴[M].北京:中国统计出版社,2020:377-387.
National Bureau of Statistics of China.China statistical yearbook [M].Beijing:China Statistics Press,2020:377-387.
[4] Turner J G,Ellis C,Devoto A.The jasmonate signal pathway[J].The Plant Cell,2002,14(S1):153-164.doi:10.1105/tpc.000679.
[5] Staswick P E,Su W,Howell S H.Methyl jasmonate inhibition of root growth and induction of a leaf protein are decreased in an Arabidopsis thaliana mutant[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(15):6837-6840.doi:10.1073/pnas.89.15.6837.
[6] Fang H X,Luo F,Li P X,Zhou Q,Zhou X,Wei B D,Cheng S C,Zhou H S,Ji S J.Potential of jasmonic acid(JA)in accelerating postharvest yellowing of broccoli by promoting its chlorophyll degradation[J].Food Chemistry,2020,309:125737.doi:10.1016/j.foodchem.2019.125737.
[7] Zeng X C,Zhou X,Zhang W,Murofushi N,Kitahara T,Kamuro Y.Opening of rice floret in rapid response to methyl jasmonate[J].Journal of Plant Growth Regulation,1999,18(4):153-158.doi:10.1007/PL00007063.
[8] Liu Y,Wang H Y.JA modulates phytochrome a signaling via repressing FHY3 activity by JAZ proteins[J].Plant Signaling & Behavior,2020,15(3):1726636.doi:10.1080/15592324.2020.1726636.
[9] 王俊斌,李欣,王海风,任健,张少英.茉莉酸对植物花器官发育和叶片衰老的分子调控研究进展[J].天津农学院学报,2009,16(3):40-43.doi:10.3969/j.issn.1008-5394.2009.03.012.
Wang J B,Li X,Wang H F,Ren J,Zhang S Y.Molecular regulation progresses of jasmonic acid on plant flower organs development and leaves senescence[J].Journal of Tianjin Agricultural College,2009,16(3):40-43.
[10] ![]() és H,Barrios P,Dorta F,Polanco V,S
és H,Barrios P,Dorta F,Polanco V,S nchez C,S
nchez C,S nchez E,Ramírez I.Involvement of jasmonic acid and derivatives in plant response to pathogen and insects and in fruit ripening[J].Journal of Plant Growth Regulation,2004,23(3):246-260.doi:10.1007/s00344-004-0035-1.
nchez E,Ramírez I.Involvement of jasmonic acid and derivatives in plant response to pathogen and insects and in fruit ripening[J].Journal of Plant Growth Regulation,2004,23(3):246-260.doi:10.1007/s00344-004-0035-1.
[11] Chehab E W,Kaspi R,Savchenko T,Rowe H,Negre-Zakharov F,Kliebenstein D,Dehesh K.Distinct roles of jasmonates and aldehydes in plant-defense responses[J].PLoS One,2008,3(4):e1904.doi:10.1371/journal.pone.0001904.
[12] Li L,Zhao Y F,McCaig B C,Wingerd B A,Wang J H,Whalon M E,Pichersky E,Howe G A.The tomato homolog of CORONATINE-INSENSITIVE1 is required for the maternal control of seed maturation,jasmonate-signaled defense responses,and glandular trichome development[J].The Plant Cell,2004,16(1):126-143.doi:10.1105/tpc.017954.
[13] Wasternack C,Stenzel I,Hause B,Hause G,Kutter C,Maucher H,Neumerkel J,Feussner I,Miersch O.The wound response in tomato-role of jasmonic acid[J].Journal of Plant Physiology,2006,163(3):297-306.doi:10.1016/j.jplph.2005.10.014.
[14] 刘庆霞,李梦莎,国静.茉莉酸生物合成的调控及其信号通路[J].植物生理学报,2012,48(9):837-844.doi:10.13592/j.cnki.ppj.2012.09.013.
Liu Q X,Li M S,Guo J.Regulation of jasmonic acid biosynthesis and jasmonic acid signaling pathway[J].Plant Physiology Communications,2012,48(9):837-844.
[15] 董桃杏,蔡昆争,曾任森.干旱胁迫下茉莉酸甲酯对水稻叶片质膜透性及无机离子含量的影响[J].华北农学报,2010,25(1):136-140.doi:10.7668/hbnxb.2010.01.027.
Dong T X,Cai K Z,Zeng R S.Effects of methyl jasmonate on membrane permeability and inorganic ions content in rice leaves under drought stress[J].Acta Agriculturae Boreali-Sinica,2010,25(1):136-140.
[16] Sembdner G,Parthier B.The biochemistry and the physiological and molecular actions of jasmonates[J].Annual Review of Plant Physiology and Plant Molecular Biology,1993,44(1):569-589.doi:10.1146/annurev.pp.44.060193.003033.
[17] Staswick P E,Huang J F,Rhee Y.Nitrogen and methyl jasmonate induction of soybean vegetative storage protein genes[J].Plant Physiology,1991,96(1):130-136.doi:10.1104/pp.96.1.130.
[18] Hause B,Demus U,Teichmann C,Parthier B,Wasternack C.Developmental and tissue-specific expression of JIP-23,a jasmonate-inducible protein of barley[J].Plant and Cell Physiology,1996,37(5):641-649.doi:10.1093/oxfordjournals.pcp.a028993.
[19] Andresen I,Becker W,Schlüter K,Burges J,Parthier B,Apel K.The identification of leaf thionin as one of the main jasmonate-induced proteins of barley(Hordeum vulgare)[J].Plant Molecular Biology,1992,19(2):193-204.doi:10.1007/BF00027341.
[20] Xu Y,Chang P F L,Liu D,Narasimhan M L,Raghothama K G,Hasegawa P M,Bressan R A.Plant defense genes are synergistically induced by ethylene and methyl jasmonate[J].The Plant Cell,1994,6(8):1077-1085.doi:10.1105/tpc.6.8.1077.
[21] Ryan C A.The search for the proteinase inhibitor-inducing factor,PIIF[J].Plant Molecular Biology,1992,19(1):123-133.doi:10.1007/BF00015610.
[22] 王飞,田雪军,赵月,臧新山,耿晓丽,倪中福,姚颖垠,胡兆荣,辛明明.小麦茉莉酸诱导蛋白基因TaJIP的克隆和功能鉴定[J].中国农业大学学报,2015,20(2):50-57.doi:10.11841/j.issn.1007-4333.2015.02.07.
Wang F,Tian X J,Zhao Y,Zang X S,Geng X L,Ni Z F,Yao Y Y,Hu Z R,Xin M M.Isolation and characterization of jasmonate induced protein TaJIP in wheat(Triticum aestivum)[J].Journal of China Agricultural University,2015,20(2):50-57.
[23] 牛吉山,常阳,王保勤.一个小麦茉莉酮酸酯诱导蛋白基因的克隆和鉴定[J].植物病理学报,2008,38(2):171-177.doi:10.3321/j.issn:0412-0914.2008.02.009.
Niu J S,Chang Y,Wang B Q.Cloning and characterization of a jasmonate-induced protein gene in wheat[J].Acta Phytopathologica Sinica,2008,38(2):171-177.
[24] Supartana P,Shimizu T,Shioiri H,Nogawa M,Nozue M,Kojima M.Development of simple and efficient in planta transformation method for rice (Oryza sativa L.)using Agrobacterium tumefaciens[J].Journal of Bioscience and Bioengineering,2005,100(4):391-397.doi:10.1263/jbb.100.391.
[25] Hummon A B,Lim S R,Difilippantonio M J,Ried T.Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage[J].BioTechniques,2007,42(4):467-470,472.doi:10.2144/000112401.
[26] 向阳,杜才富,马正强.Jacalin类凝集素研究进展[J].植物生理学报,2013,49(10):1023-1029.doi:10.13592/j.cnki.ppj.2013.10.017.
Xiang Y,Du C F,Ma Z Q.Progress in research on jacalin-related lectins[J].Plant Physiology Journal,2013,49(10):1023-1029.
[27] Xiang Y,Song M,Wei Z Y,Tong J H,Zhang L X,Xiao L T,Ma Z Q,Wang Y.A jacalin-related lectin-like gene in wheat is a component of the plant defence system[J].Journal of Experimental Botany,2011,62(15):5471-5483.doi:10.1093/jxb/err226.
[28] Ma Q H,Zhen W B,Liu Y C.Jacalin domain in wheat jasmonate-regulated protein Ta-JA1 confers agglutinating activity and pathogen resistance[J].Biochimie,2013,95(2):359-365.doi:10.1016/j.biochi.2012.10.014.
[29] Yong W D,Xu Y Y,Xu W Z,Wang X,Li N,Wu J S,Liang T B,Chong K,Xu Z H,Tan K H,Zhu Z Q.Vernalization-induced flowering in wheat is mediated by a lectin-like gene VER2[J].Planta,2003,217(2):261-270.doi:10.1007/s00425-003-0994-7.
[30] 程燕.小麦凝激素类基因TaJRL2的克隆与分析[D].南京:南京农业大学,2010:38-45.doi:10.7666/d.Y2527512.
Cheng Y.Cloning and analysis of wheat lectin-like gene TaJRL2[D].Nanjing:Nanjing Agricultural University,2010:38-45.
[31] Görlach J,Volrath S,Knauf-Beiter G,Hengy G,Beckhove U,Kogel K H,Oostendorp M,Staub T,Ward E,Kessmann H,Ryals J.Benzothiadiazole,a novel class of inducers of systemic acquired resistance,activates gene expression and disease resistance in wheat[J].The Plant Cell,1996,8(4):629-643.doi:10.1105/tpc.8.4.629.
[32] Subramanyam S,Sardesai N,Puthoff D P,Meyer J M,Nemacheck J A,Gonzalo M,Williams C E.Expression of two wheat defense-response genes, Hfr-1 and Wci-1,under biotic and abiotic stresses[J].Plant Science,2006,170(1):90-103.doi:10.1016/j.plantsci.2005.08.006.
[33] 陈同睿,罗艳君,赵潘婷,贾海燕,马正强.过表达TaJRL53基因提高了小麦赤霉病抗性[J].作物学报,2021,47(1):19-29.doi:10.3724/SP.J.1006.2021.01050.
Chen T R,Luo Y J,Zhao P T,Jia H Y,Ma Z Q.Overexpression of TaJRL53 enhances the Fusarium head blight resistance in wheat[J].Acta Agronomica Sinica,2021,47(1):19-29.