牦牛生活在高寒低氧地区、具有重要文化和生产意义,被称为高原上的生命之舟。牦牛肉营养价值丰富,是符合现代市场需求的绿色食品[1-2]。脂肪组织的生长发育是影响牦牛肉品质的关键因素之一。脂肪组织的沉积能力与脂肪细胞分化的过程密切相关,该过程是一个系统且复杂的过程,受多个转录因子相互协同作用[3]。
增强子结合蛋白α(CCAAT/Enhancer binding protein alpha,CEBPα)是碱性亮氨酸拉链蛋白家族的一个亚家族(增强子结合蛋白家族:CCAAT Enhancer binding protein,C/EBPs)中最早被发现的成员[4]。早期研究显示,CEBPα基因在骨髓组织细胞分化和机体免疫等过程中发挥重要作用[5-7]。随后有研究报道了CEBPα在脂肪细胞分化过程中的作用[8-9],CEBPα受CEBPβ、KLFs家族等转录调控因子调控,同时它还可以调控PPARγ、胆固醇调节元件结合蛋白(Sterol-regulatory element binding proteins, SREBPs)等来调控脂肪细胞的分化[3, 10]。牟彦双等[11]通过添加油酸来探究鸡前体脂肪细胞分化过程中CEBPα基因的表达,发现在脂肪细胞分化过程中表达较晚。张萌萌等[12]研究发现,CEBPα基因在牛肌内前体脂肪细胞分化早期开始表达,分化后期表达量明显增加,说明CEBPα基因在不同物种脂肪细胞的表达模式存在差异。上述研究结果表明,CEBPα基因对于调控畜禽脂肪沉积有重要作用,但目前尚未有研究报道CEBPα基因在牦牛脂肪组织中的作用。
因此,本试验以牦牛为研究对象,克隆了牦牛CEBPα基因的整个CDS区并预测了蛋白结构和功能。通过qRT-PCR检测了CEBPα基因在牦牛各组织中的表达及牦牛脂肪细胞中的表达模式,为深入研究CEBPα基因在牦牛脂肪组织中的功能研究提供基础数据。
1 材料和方法
1.1 样本采集
试验所用动物为4岁左右的金川公牦牛和麦洼公牦牛各4头,均由四川阿坝羌族藏族自治州金川县庆林乡牦牛养殖场提供。采集牦牛的心、肝、脾、肾、胃、小肠、皮下脂肪、内脏脂肪和肌肉组织。采集的组织样品用高温灭菌的PBS清洗后,放入2 mL冻存管置于液氮罐带回实验室。采集的皮下脂肪组织用PBS清洗后,放入含有5×双抗(PS)的DMEM培养基中,迅速带回实验室分离牦牛原代皮下脂肪细胞。
1.2 主要试剂
TRIzol购自成都擎科梓熙生物技术有限公司,PrimeScriptRT Master Mix购自TaKaRa,SYBR Real-time PCR mixture试剂购自BioTeke,Gel Extraction Kit(100)胶回收试剂盒购自上海索莱宝生物科技有限公司。细胞培养所用试剂耗材均购自成都鹏世达有限公司。氯仿、无水乙醇均为国产分析纯,购自成都鹏世达有限公司。
1.3 细胞培养
采用经典的胶原酶消化法分离牦牛原代皮下脂肪细胞。即将脂肪组织剪碎,加入适量1 mg/mL Ⅰ型胶原酶,37 ℃水浴锅消化1 h,之后加入细胞培养液(含10%的FBS和1% PS的DMEM培养基)终止消化,1 700 r/min离心5 min,后将沉淀重悬,接种在10 cm培养皿中,放入37 ℃、5% CO2的细胞培养箱中培养。第2天用PBS清洗2~3次,每2 d更换1次培养液,待细胞融合至80%时诱导分化,收集0,3,6,9 d的细胞样品用于提取RNA。
1.4 RNA提取及cDNA合成
使用TRIzol法提取组织和细胞样品总RNA,RNA的质量和浓度通过核酸浓度测定仪进行评估,OD260/280在1.8~2.0被用于合成cDNA。按PrimeScriptRT Master Mix试剂盒的说明书合成cDNA。
1.5 引物设计
根据NCBI公布的牦牛预测序列(XM_005893918.2)设计基因序列,利用Primer premier 5.0软件设计引物,引物由成都擎科梓熙生物技术有限公司合成。引物信息见表1。
表1 PCR引物序列
Tab.1 PCR primer sequences

基因Gene引物序列Primer sequence产物大小/bpProduct size用途ApplicationCEBPαF:GGAGGACTTTAGCTCCCCCA657克隆R:TTGAGATCCGGAGACCCGAACEBPαF:TGCGCAAGAGCCGGGACAAG166qRT-PCRR:ACCAGGGAGCTCTCGGGCAGPPIAF:AGCACTGGGGAGAAAGGATT248qRT-PCRR:AGCCACTCAGTCTTGGCAGT
注:F.正向引物;R.反向引物。
Note:F.Forward primer;R.Reverse primer.
1.6 PCR扩增及克隆
以牦牛皮下脂肪的cDNA为模板,利用聚合酶链式反应进行目的基因的扩增。PCR反应体系如下:上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA模板(1 000 ng/μL)1 μL,ddH2O 5.5 μL,PCR Mix 7.5 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,61 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。对PCR产物进行凝胶电泳。电泳完成后,将凝胶在紫外下照胶,将目的片段进行切割置于1.5 mL离心管中。参照胶回收试剂盒对目的片段进行胶回收。回收产物与pGM-T载体进行过夜连接,其中使用抗生素为氨苄(浓度100 mg/mL)。将连接产物转化入大肠杆菌DH5α感受态细胞,在37 ℃恒温培养箱中培养12~16 h,挑选3个阳性菌落做菌液PCR。将阳性菌液送至成都擎科梓熙生物技术有限公司进行双向测序。
1.7 实时荧光定量PCR
将反转录后的各组织和细胞样品cDNA为模板,以PPIA为内参基因,检测CEBPα的表达量。qRT-PCR反应体系15 μL:模板cDNA (100 ng/μL)3 μL,上、下游引物(10 μmol/L)各0.5 μL,SYBR®Premix Ex TaqTMⅡ 7.5 μL,ddH2O 3.5 μL。反应条件:94 ℃ 2 min;94 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,共45个循环。每个样本重复3次。
1.8 Bodipy染色
收集诱导分化9 d的细胞样品,用PBS洗3次,4%多聚甲醛固定30 min;PBS洗3次,用终浓度2 μmol/L的Bodipy染色液染色30 min;PBS洗3次,加入DAPI染色10 min,荧光显微镜下拍照。
1.9 生物信息学分析
根据获得的牦牛CEBPα的CDS序列分别做以下几个方面的生物信息学分析:①通过NCBI在线网站的 ORF Finder ( https:/ /www.ncbi.nlm.nih.gov /orffinder/) 寻找开放阅读框,获得氨基酸序列。②用DNAMAN软件进行同源性比对,然后利用MEGA 5软件构建系统发育树。③ProtParam 软件分析牦牛CEBPα蛋白的理化性质。④用ProtScale 软件在线分析牦牛CEBPα蛋白的亲疏水性。⑤用Tmpred、NetPhos 2.0 Server在线软件分析CEBPΑ蛋白的跨膜结构和磷酸化位点。⑥用HNN和Phyre2在线软件分析CEBPα蛋白的二级、三级结构。
1.10 数据分析
数据表示为平均值±标准误。使用GraphPad Prism 8.0 软件进行显著性分析,其中每组数据3个重复(n=3),P<0.05表示差异显著。
2 结果与分析
2.1 牦牛CEBPα基因克隆及同源性分析
以牦牛皮下脂肪组织的cDNA为模板,利用PCR扩增获得牦牛CEBPα基因全长为657 bp,与预测序列一致(图1)。NCBI ORF Finder在线网站进行开放阅读框分析,发现开放阅读框大小为645 bp,编码214个氨基酸。
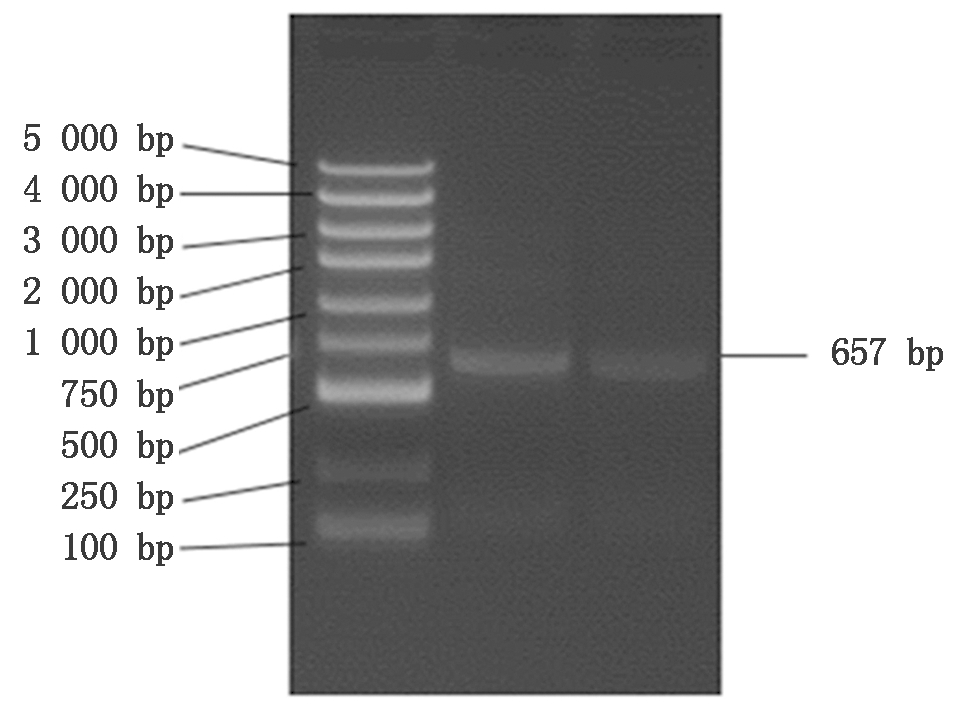
图1 牦牛CEBPα基因PCR扩增产物
Fig.1 PCR amplification products of CEBPα gene in yak
牦牛与大西洋鲑、普通牛、大鼠、鸡、绵羊、小鼠、猕猴、人的CEBPα基因核苷酸和氨基酸序列进行同源比对(表2)。可知牦牛与普通牛的核苷酸同源性最高,为99.73%,与大西洋鲑的核苷酸同源性最低,为73.86%;牦牛与小鼠和大鼠的氨基酸同源性相对较高,为100%,与普通牛的氨基酸同源性为99.19%,与大西洋鲑的氨基酸同源性低,为75.58%。以核苷酸序列构建系统进化树,聚类结果表明(图2),牦牛与普通牛和绵羊亲缘关系较近,与大西洋鲑的亲缘关系最远。
表2 牦牛CEBPα基因与其他已知物种的核苷酸、氨基酸序列对比结果
Tab.2 Comparison results of nucleotide and amino acid sequences of CEBPα gene of yaks and other known species
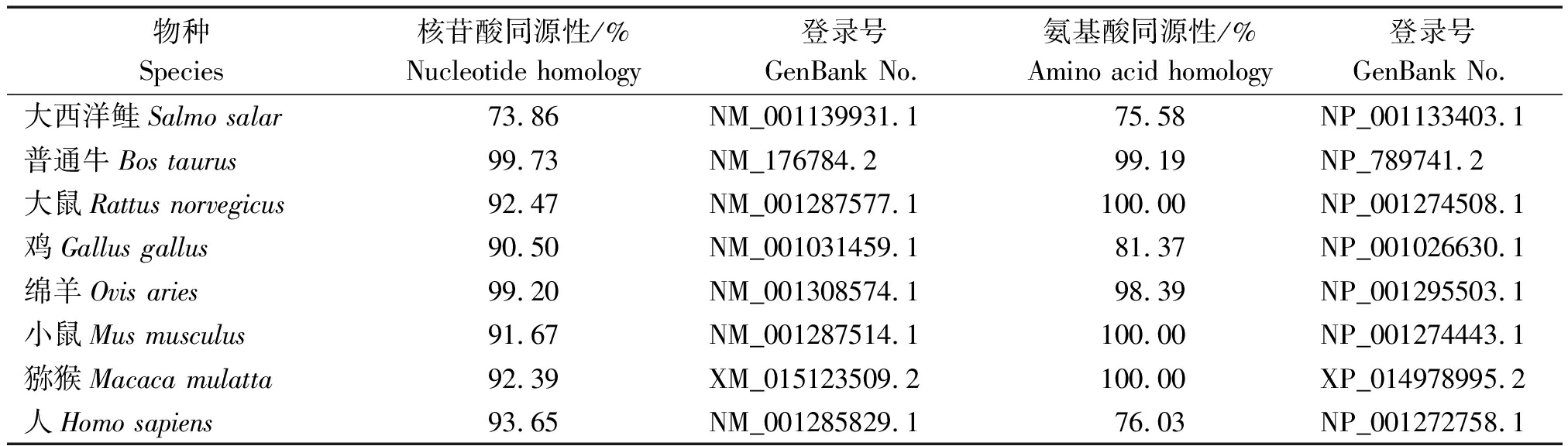
物种Species核苷酸同源性/%Nucleotide homology登录号GenBank No.氨基酸同源性/%Amino acid homology登录号GenBank No.大西洋鲑Salmo salar73.86NM_001139931.175.58NP_001133403.1普通牛Bos taurus99.73NM_176784.299.19NP_789741.2大鼠Rattus norvegicus92.47NM_001287577.1100.00NP_001274508.1鸡Gallus gallus90.50NM_001031459.181.37NP_001026630.1绵羊Ovis aries99.20NM_001308574.198.39NP_001295503.1小鼠Mus musculus91.67NM_001287514.1100.00NP_001274443.1猕猴Macaca mulatta92.39XM_015123509.2100.00XP_014978995.2人Homo sapiens93.65NM_001285829.176.03NP_001272758.1
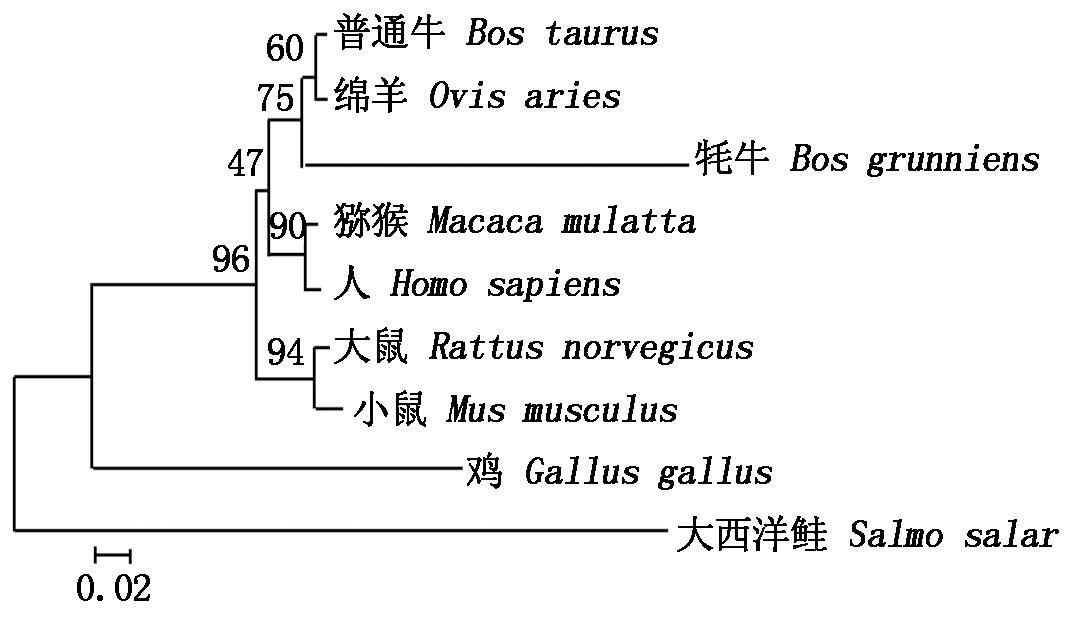
图2 牦牛与其他物种的CEBPα基因系统进化树
Fig.2 Genetic phylogenetic tree of CEBPα
in yaks and other species
2.2 牦牛CEBPα蛋白结构及功能预测
牦牛CEBPα蛋白分子质量为23.267 73 ku,分子式为C1004H1574N302O325S6,氨基酸数为213,含19种氨基酸,其中Ala和Pro含量较高,所占比例分别为11.2%,9.8%,Cys含量较低,所占比例为0.9%(表3)。CEBPα蛋白理论等电点(pI)为5.59,带正电荷的残基总数(Arg+Lys)为27,带负电荷的残基总数(Asp+Glu)为32。其在哺乳动物的尚未成熟的红细胞中半衰期为30 h,不稳性定指数(Ⅱ)为57.23,属于不稳定蛋白,脂溶指数为57.57,亲水性的平均值(GRAVY)为-0.844,为亲水蛋白。
表3 牦牛CEBPα基因氨基酸组成
Tab.3 Amino acid composition of CEBPα gene in yak
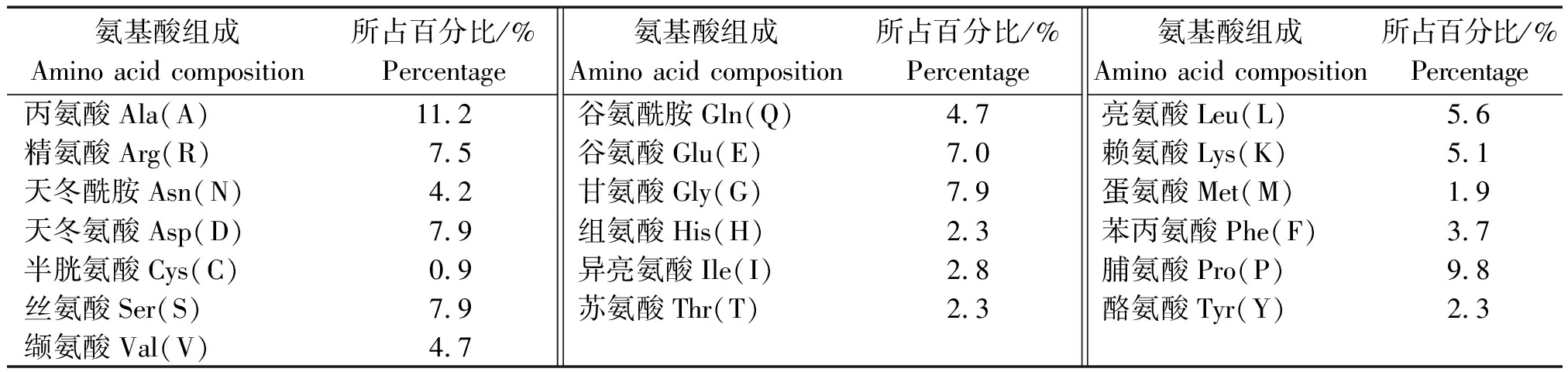
氨基酸组成Amino acid composition所占百分比/%Percentage氨基酸组成Amino acid composition所占百分比/%Percentage氨基酸组成Amino acid composition所占百分比/%Percentage丙氨酸Ala(A)11.2谷氨酰胺Gln(Q)4.7亮氨酸Leu(L)5.6精氨酸Arg(R)7.5谷氨酸Glu(E)7.0赖氨酸Lys(K)5.1天冬酰胺Asn(N)4.2甘氨酸Gly(G)7.9蛋氨酸Met(M)1.9天冬氨酸Asp(D)7.9组氨酸His(H)2.3苯丙氨酸Phe(F)3.7半胱氨酸Cys(C)0.9异亮氨酸Ile(I)2.8脯氨酸Pro(P)9.8丝氨酸Ser(S)7.9苏氨酸Thr(T)2.3酪氨酸Tyr(Y)2.3缬氨酸Val(V)4.7
CEBPα蛋白 19个磷酸化位点,包括Ser(3、17、21、27、40、61、65、125、130、147、180、197),Thr(158、166、185),Tyr(7、67、106、208),其中红色、绿色、蓝色分别代表丝氨酸、苏氨酸、酪氨酸的磷酸化位点(图3)。
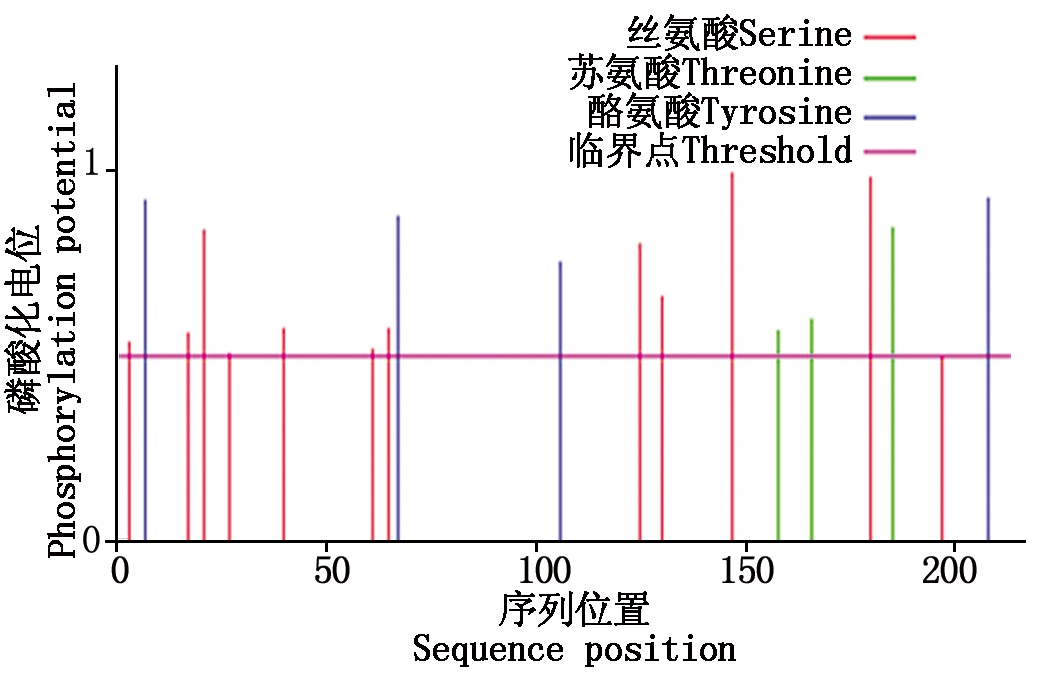
图3 牦牛CEBPα蛋白磷酸化位点分析
Fig.3 The phosphorylation site analysis
of yak CEBPα protein
CEBPα蛋白的二级结构主要为α螺旋(蓝色)和无规则卷曲(紫色),分别占27.10%,67.29%,β转角和延伸链(红色)占比为0和5.61%(图4)。三级结构预测结果与二级结构一致(图5)。
图4 牦牛CEBPα蛋白二级结构预测
Fig.4 Secondary structure prediction of CEBPα protein in yaks
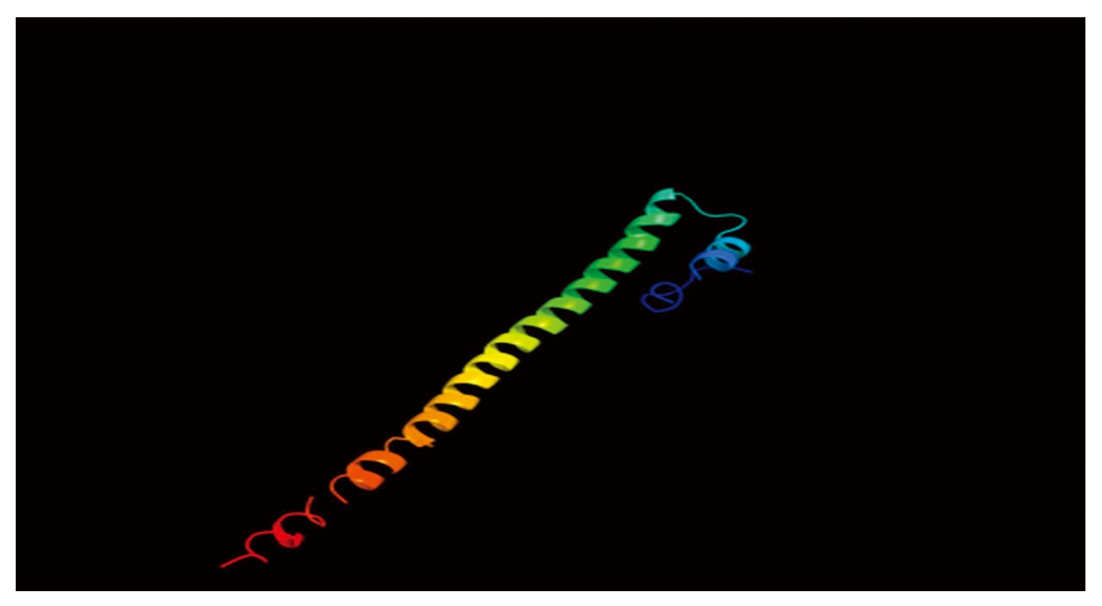
图5 牦牛CEBPα蛋白三级结构预测
Fig.5 Prediction of tertiary structure of
CEBPα protein in yaks
2.3 牦牛CEBPα基因组织表达谱
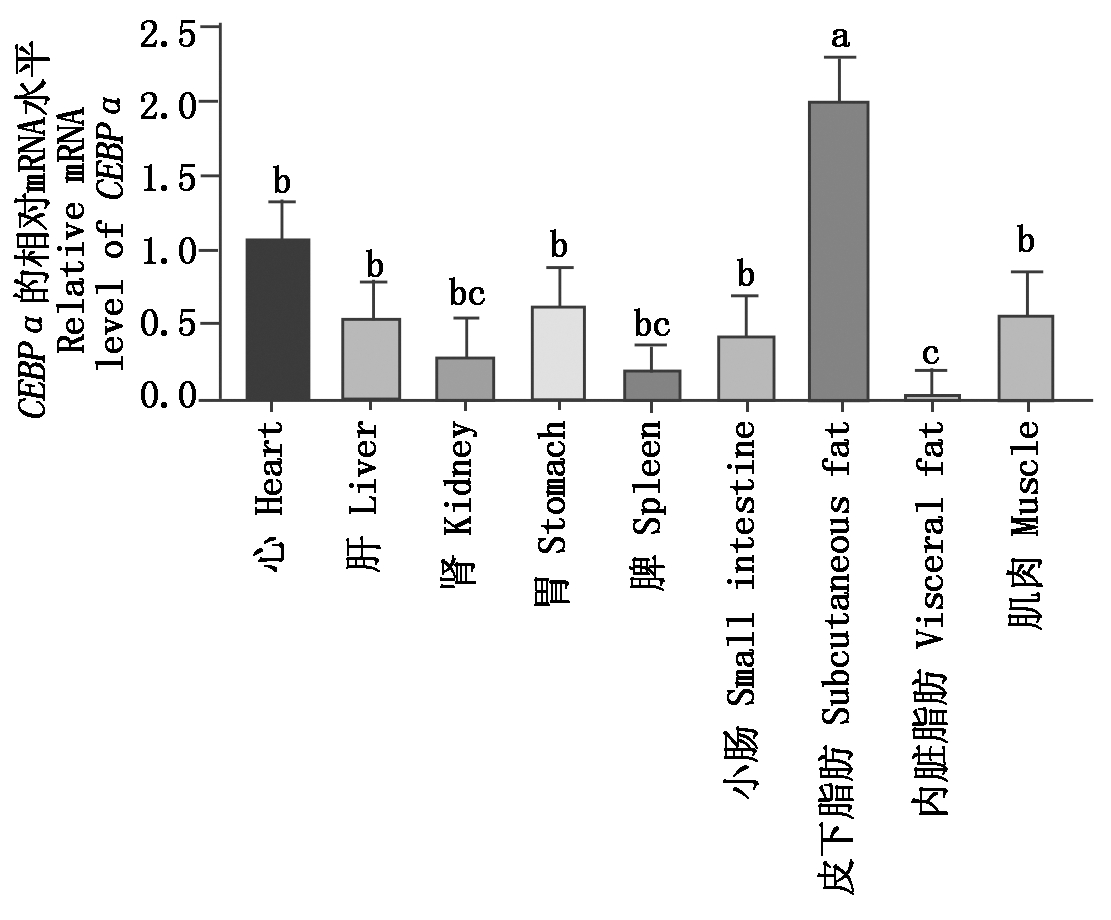
以心为参照,通过qRT-PCR检测牦牛组织中CEBPα mRNA的表达,结果表明,CEBPα在牦牛各组织中广泛表达(图6),在皮下脂肪组织的表达显著高于其他组织(P<0.05),在肾、脾和内脏脂肪组织中表达量相对较低。
2.4 CEBPα在牦牛皮下脂肪细胞诱导分化过程中的表达
从牦牛皮下脂肪组织中分离得到的原代脂肪细胞进行诱导分化,观察细胞形态的变化。分离得到的牦牛前体脂肪细胞类似于成纤维细胞,细胞形态呈梭形或三角形(图7-A)。当细胞密度达到100%融合时进行诱导分化(图7-B)。诱导分化9 d,细胞形态发生变化,由梭形变为不规则形态或圆形,细胞内充满大量脂滴(图7-C)。Bodipy染色结果表明(图8),分化9 d,有明显的脂滴积累。
不同小写字母表示差异显著(P<0.05)。
The different lowercase letters indicate significant difference(P<0.05) .
图6 CEBPα mRNA在牦牛不同组织中的表达
Fig.6 The mRNA expression of CEBPα
in different tissues of yak

A.牦牛前体脂肪细胞(Preadipocyte,Pre)的形态;B.诱导分化第0天的细胞形态图;C.诱导分化第9天的细胞形态图。
A.The morphology of yak preadipocytes (Preadipocyte, Pre);B.The morphology of cells at day 0 of induced differentiation;
C.The morphology of cells on the 9th day of induced differentiation.
图7 牦牛皮下脂肪细胞成脂分化的细胞形态图(100×)
Fig.7 Cell morphology of adipogenic differentiation of subcutaneous adipocytes in yaks(100×)
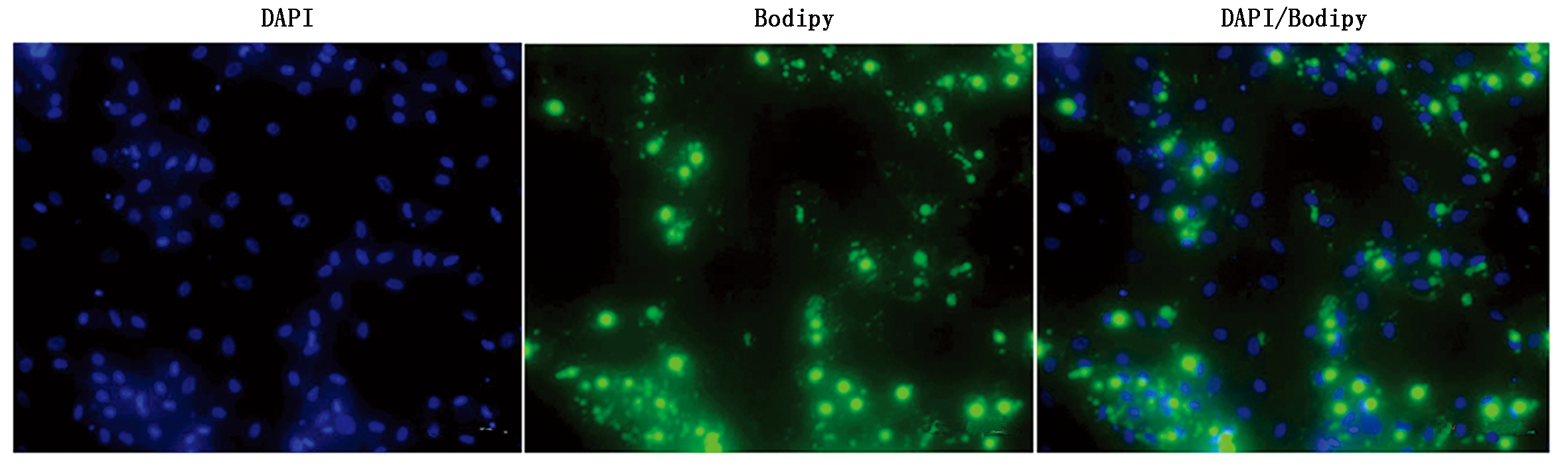
图8 Bodipy染色(100×)
Fig.8 Bodipy stain (100×)
在诱导分化第0,3,6,9天收集牦牛脂肪细胞样品,采用qPCR技术对CEBPα mRNA的表达量进行相对定量分析(图9)。研究结果表明,CEBPα在分化的第3,6,9天与第 0 天相比,均极显著上升(P<0.01),在分化过程中呈现上升的趋势。
3 讨论与结论
研究表明,在构建体外培养的牛成肌细胞体系中,CEBPα能诱导成肌细胞向脂肪细胞转化[13]。在牛肌肉的干细胞(MSCs)中过表达CEBPα能诱导LPL、PPARγ、C/EBPβ和C/EBPδ基因的表达,表明CEBPα基因在脂肪细胞分化过程可能具有重要作用[14]。此外Wang等[15]研究指出,牛CEBPα基因可以调控ABHD5 基因(alpha/beta hydrolase 5,ABHD5),间接调控细胞脂质代谢。因此,本研究采用金川牦牛和麦洼牦牛为研究对象,获得牦牛CEBPα的基因序列及其在牦牛脂肪组织中的表达特性,为后续研究CEBPα基因对牦牛脂肪沉积的具体作用机制提供了依据和参考。
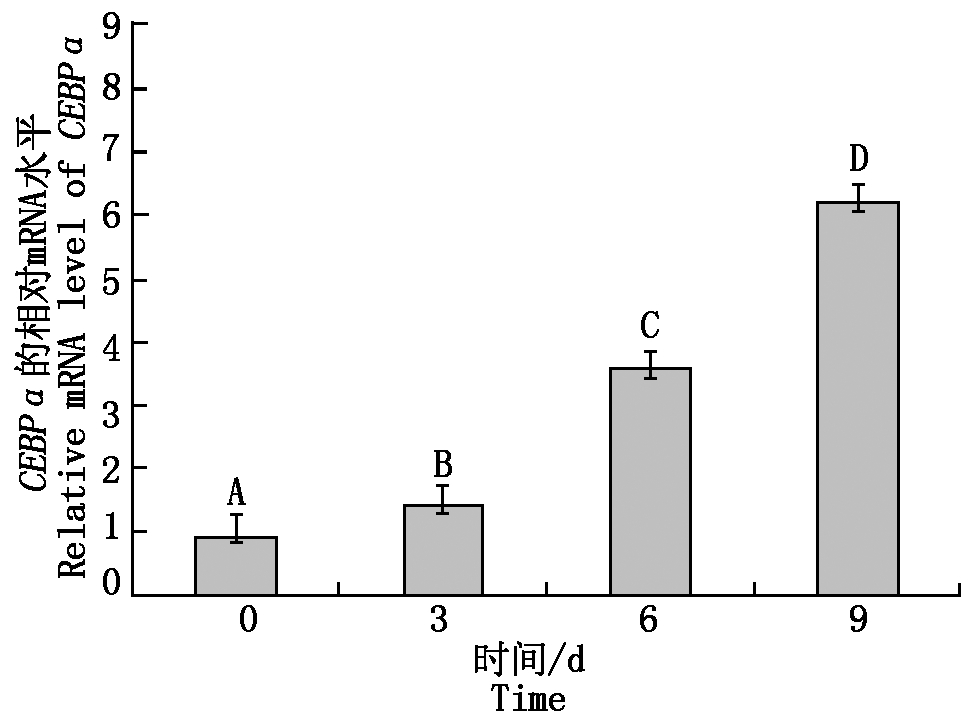
不同大写字母表示差异极显著(P<0.01)。
The different capital letters indicate extremely
significant difference(P<0.01) .
图9 牦牛CEBPα mRNA在牦牛皮下
脂肪细胞诱导分化过程中的表达
Fig.9 Expression of yak CEBPα mRNA in the process
of induced differentiation of subcutaneous adipocytes
通过PCR成功获得牦牛CEBPα基因,其CDS区全长645 bp,编码214个氨基酸,该蛋白为不稳定亲水性蛋白。同源性分析结果表明,牦牛CEBPα基因与普通牛的同源性相对较高,核酸同源性为99.73%,氨基酸同源性为99.19%,构建系统进化树的结果显示,牦牛与普通牛和绵羊的相似性较高。系统发育树与同源性比对结果一致,说明CEBPα基因的编码区在进化过程中相对保守。
组织表达结果发现,CEBPα在牦牛不同组织中均有表达,其中皮下脂肪表达水平最高,内脏脂肪表达量最低。说明CEBPα可能在调控牦牛皮下脂肪的发育中具有重要作用。有研究报道,CEBPα在小鼠脂肪组织、肺、胎盘和肝脏中高表达[15-16]。池永东等[17]研究发现,CEBPα在皮下脂肪组织中表达量最高,这与本研究的结果相一致,推测该基因可能在反刍动物中相对保守,在其他物种中存在物种特异性。
分离到的牦牛皮下脂肪细胞呈梭形或三角形,在经过诱导成脂,细胞形态变为不规则形态或圆形,并伴随着脂滴的产生和积聚。刘敏等[18]分离得到猪皮下前体脂肪细胞,细胞形态呈不规则梭形。这与本试验分离的得到的前体脂肪细胞形态相一致。表明成功分离了牦牛前提脂肪细胞。CEBPα在牦牛脂肪细胞分化过程中随着分化的进行,其表达量逐渐上升。笔者推测CEBPα可能在牦牛脂肪细胞分化早期发挥作用。有研究报道,在3T3-L1脂肪细胞中,CEBPα的表达量随着分化的进行,表达量逐渐升高,在第6天达到顶峰[19]。这与笔者的研究结果相一致。王家麒等[20]研究表明,在绵羊前体脂肪细胞中。随着诱导分化的进行CEBPα表达量呈现先上升后下降。这与笔者的研究结果存在差异,推测其可能的原因,是由于物种之间的差异造成的。
本研究克隆了牦牛的CEBPα基因,其CDS区全长645 bp,编码214个氨基酸,该蛋白的不稳定系数为57.23,表明该蛋白具有不稳定性,亲水性占比大于疏水性,为亲水性蛋白。CEBPα在皮下脂肪组织中高表达,在内脏脂肪组织中低表达。在牦牛前体脂肪细胞诱导分化过程中,其表达量逐渐升高。以上结果为牦牛CEBPα基因在牦牛脂肪组织中的功能研究提供基础数据。
[1] Qiu Q, Zhang G J, Ma T, Qian W B, Wang J Y, Ye Z Q, et al.The yak genome and adaptation to life at high altitude[J].Nature Genetics, 2012, 44(8):946-949. doi:10.1038/ng.2343.
[2] Hu Q J, Ma T, Wang K, Xu T, Liu J Q, Qiu Q. The Yak genome database:An integrative database for studying yak biology and high-altitude adaption[J].BMC Genomics, 2012, 13(1):600. doi:10.1186/1471-2164-13-600.
[3] Sarjeant K, Stephens J M.Adipogenesis [J].Cold Spring Harb Perspect Biol, 2012, 4(9):a008417. doi:10.1101/cshperspect.a008417.
[4] Oikarinen J, Hatamochi A, de Crombrugghe B. Separate binding sites for nuclear factor 1 and a CCAAT DNA binding factor in the mouse α2(I) collagen promoter[J].The Journal of Biological Chemistry, 1987, 262(23):11064-11070.
[5] Di Stefano B, Sardina J L, van Oevelen C, Collombet S, Kallin E M, Vicent G P, Lu J, Thieffry D, Beato M, Graf T.C/EBPα poises B cells for rapid reprogramming into induced pluripotent stem cells[J].Nature, 2014, 506(7487):235-239. doi:10.1038/nature12885.
[6] Darlington G J, Ross S E, MacDougald O A.The role of C/EBP genes in adipocyte differentiation [J].J Biol Chem, 1998, 273(46):30057-30060. doi:10.1074/jbc.273.46.30057.
[7] Braun T P, Coblentz C, Smith B M, Coleman D J, Schonrock Z, Carratt S A, Callahan R L, Maniaci B, Druker B J, Maxson J E. Combined inhibition of JAK/STAT pathway and lysine-specific demethylase 1 as a therapeutic strategy in CSF3R/CEBPA mutant acute myeloid leukemia[J].Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(24):13670-13679. doi:10.1073/pnas.1918307117.
[8] Olofsson L E, Orho-Melander M, William-Olsson L, Sjöholm K,Sjöström L,Groop L, Carlsson B, Carlsson L M S, Olsson B.CCAAT/enhancer binding protein α(C/EBPα) in adipose tissue regulates genes in lipid and glucose metabolism and a genetic variation in C/EBPα is associated with serum levels of triglycerides [J].J Clin Endocrinol Metab, 2008, 93(12):4880-4886. doi:10.1210/jc.2008-0574.
[9] Fatima L A, Campello R S, Barreto-Andrade J N, Passarelli M, Santos R S, Clegg D J, Machado U F. Estradiol stimulates adipogenesis and Slc2a4/GLUT4 expression via ESR1-mediated activation of CEBPA[J].Molecular and Cellular Endocrinology, 2019, 498:110447. doi:10.1016/j.mce.2019.05.006.
[10] He Y F, Liu F Y, Zhang W X. Tangeritin inhibits adipogenesis by down-regulating C/EBPα, C/EBPβ, and PPARγ expression in 3T3-L1 fat cells[J].Genetics and Molecular Research, 2015, 14(4):13642-13648. doi:10.4238/2015.October.28.26.
[11] 牟彦双, 王宇祥, 李辉.油酸对鸡前脂肪细胞分化过程中基因表达的影响[J].东北农业大学学报, 2013, 44(12):46-51.doi:10.3969/j.issn.1005-9369.2013.12.009.
Mu Y S, Wang Y X, Li H. Effects of deate on gene expression during differentiation of chicken preadipocyte[J]. Journal of Northeast Agricultural University, 2013, 44(12):46-51.
[12] 张萌萌, 魏胜娟, 王艺如, 王深圳, 郑月英, 郑豪, 颜培实. 牛肌内前体脂肪细胞的分离培养及分化相关基因的表达规律研究[J].畜牧与兽医, 2018, 50(5):1-6.
Zhang M M, Wei S J, Wang Y R, Wang S Z, Zheng Y Y, Zheng H, Yan P S. Primary culture and expression of differentiation-related genes in bovine intramuscular preadipocytes[J].Animal Husbandry & Veterinary Medicine, 2018, 50(5):1-6.
[13] 皇甫一凡. C/EBPα基因诱导牛成肌细胞转分化的研究[D].杨凌:西北农林科技大学, 2013.
Huangpu Y F. C/EBPα gene induce the trans-differentiation of bovine myoblasts[D].Yangling:Northwest A & F University, 2013.
[14] Adoligbe C, Huangfu Y F, Zan L S, Wang H. C/EBPα gene as a genetic marker for beef quality improvement[J].Genetics and Molecular Research, 2015, 14(3):9370-9383. doi:10.4238/2015.August.14.1.
[15] Wang X Y, Khan R, Raza S H A, Li A N, Zhang Y, Liang C C, Yang W C, Wu S, Zan L S. Molecular characterization of ABHD5 gene promoter in intramuscular preadipocytes of Qinchuan cattle:Roles of Evi1 and C/EBPα[J].Gene, 2019, 690:38-47. doi:10.1016/j.gene.2018.12.030.
[16] Moseti D, Regassa A, Kim W K. Molecular regulation of adipogenesis and potential anti-adipogenic bioactive molecules[J].Int J Mol Sci, 2016, 17(1):124. doi:10.3390/ijms17010124.
[17] 池永东, 王永, 赵越, 朱江江, 林亚秋. 山羊C/EBPα、C/EBPβ和C/EBPδ基因克隆及表达模式研究[J].华北农学报, 2020, 35(5):231-238. doi:10.7668/hbnxb.20 190869.
Chi Y D, Wang Y, Zhao Y, Zhu J J, Lin Y Q. Study on cloning and expression patterns of goat C/EBPα, C/EBPβ and C/EBPδ genes[J].Acta Agriculturae Boreali-Sinica, 2020, 35(5):231-238.
[18] 刘敏, 张雪莲, 张万锋, 何志强, 黑伟, 蔡春波, 高鹏飞, 曹果清, 李步高, 郭晓红. 马身猪皮下前体脂肪细胞的分离培养及成脂诱导分化研究[J].新疆农业大学学报, 2019, 42(3):175-181. doi:10.3969/j.issn.1007-8614.2019.03.004.
Liu M, Zhang X L, Zhang W F, He Z Q, Hei W, Cai C B, Gao P F, Cao G Q, Li B G, Guo X H. Isolation, culture and differentiation of Mashen pig subcutaneous preadipocyte[J].Journal of Xinjiang Agricultural University, 2019, 42(3):175-181.
[19] Cao Z, Umek R M, McKnight S L. Regulated expression of three C/EBP isoforms during adipose conversion of 3T3-L1 cells[J].Genes & Development, 1991, 5(9):1538-1552. doi:10.1101/gad.5.9.1538.
[20] 王家麒, 韩福慧, 赵乐, 贺建宁, 周李生, 李兰兰, 柳楠. miR-18b-3p靶向SCD调控绵羊前体脂肪细胞分化的研究[J].中国畜牧杂志, 2021, 57(5):117-123.doi:10.19556/j.0258-7033.20210306-05.
Wang J L, Han F H, Zhao L, He J N, Zhou L S, Li L L, Liu N. Study on miR-18b-3p targeting SCD to regulate the differentiation of sheep precursor adipocytes[J].Chinese Journal of Animal Science, 2021, 57(5):117-123.