铝在岩石圈和土壤矿物中大量存在,是存在于土壤中最多的金属元素[1]。一般情况下,土壤中的铝以黏土硅酸盐矿物、铝氧化物、氢氧化物的形式存在,对植物无毒害[2]。而在土壤中pH值<5.5时,土壤中就会有活性铝析出,在土壤pH值达到4.3时,会导致大量的活性铝离子释放[3],Al3+具有很高的植物毒性,是植物生长和发育的主要限制因素,一般认为铝毒会直接抑制初生根的生长,干扰顶端分生组织区细胞分裂和细胞伸长,此外茎与叶的伸长生长受到抑制,阻碍了养分的吸收,干扰了植物的内部代谢过程,并打破活性氧自由基与抗氧化系统之间平衡,最终导致作物减产。
西瓜(Citrullus lanatus (Thunb.)Matsum. et Nakai)是葫芦科西瓜属一年生蔓性草本植物,含丰富的矿物盐和多种维生素,在全世界广泛种植。我国是世界西瓜生产与消费的第一大国,西瓜的种植面积占全国蔬菜种植面积的10%左右[4]。但由于我国长江以南地区红壤土含量丰富,加上酸雨现象严重,化学肥料使用不合理,导致了土壤富铝子化[5],带来了许多环境问题,这严重制约了西瓜的生长发育,导致西瓜品质降低,产量下降。
植物中氮氧化物的研究始于20世纪90年代末,现已经引起了植物生物学界的普遍关注[6]。目前,关于外源NO缓解铝毒损伤的研究中大致有2种观点:一种认为NO可以增加植物抗氧化性[7],从而减少铝对植物根系的氧化。另一种说法是NO会影响植物体内的生物代谢,从而提高植物对铝的抵抗力,减少铝造成的伤害[8]。因此,NO在打破种子休眠、抑制下胚轴伸长、延缓叶片衰老、缓解非生物胁迫等方面发挥着重要的作用[9]。在植物中,NO具有双重作用:低浓度时,它具有保护功能;但高浓度的NO会对细胞造成严重的损伤[10]。有研究表明,NO在铝胁迫过程中起着信号分子的作用,NO可以调节H2S生物合成和降解的关键酶来诱导H2S的产生,进而促进铝诱导的柠檬酸盐分泌,并通过上调H+-ATPase偶联的柠檬酸盐转运蛋白共转运系统提高大豆对铝毒性的抗性,这些作用均会被NO内源抑制剂作用逆转[11]。除此以外,NO在植物铝胁迫取得了一定进展,越来越多的文章报道了外源NO对铝胁迫的缓解作用,NO可以显著促进铝胁迫下大豆、水稻、拟南芥等根系伸长生长并减少铝离子在根尖的积累,进一步减轻铝毒性[12-14]。目前,铝胁迫下NO对西瓜根系的缓解作用尚不清楚,本研究以外源SNP处理西瓜幼苗,并添加NO抑制剂(L-NAME)处理消除内源NO对试验的干扰,探讨了外源NO对铝胁迫下西瓜根系生理和营养元素吸收的影响,为进一步探索降低西瓜铝毒性损伤提供了可行的方案,为西瓜生产实践提供了理论依据。
1 材料和方法
1.1 试验材料
西瓜品种为早佳84-24;试剂为十八水合硫酸铝(Al2(SO4)3·18H2O,分析纯,科龙),硝普钠(SNP,C5H4FeN6Na2O3,分析纯,科龙),亚硝基左旋精氨酸甲酯(L-NAME,C7H15N5O4·HCl,分析纯,麦克林)。
1.2 试验设计
选用大小均匀、健康饱满的西瓜种子(包衣),室温浸泡6 h后,恒温培养箱中30 ℃发芽,种子露白1~2 mm后播种于基质为珍珠岩∶蛭石∶有机肥=4∶3∶1的穴盘中,每处理72株,共设7个处理(表1)。西瓜幼苗一叶一心后,每3 d浇灌一次1/3 Hoagland营养液。当幼苗长到两叶一心时移栽到10 cm×10 cm的营养钵中。当幼苗为三叶一心时,向根系中施入不同浓度的处理溶液(以Hoagland营养液为溶剂,分别添加浓度为1 200 μmol/L的Al2(SO4)3和不同浓度SNP以及L-NAME,调节pH值为4.5。培养15 d后对西瓜根系进行的生理生化指标和营养元素含量测定。
表1 试验中处理组成及pH值
Tab.1 Treatment composition and pH in the test
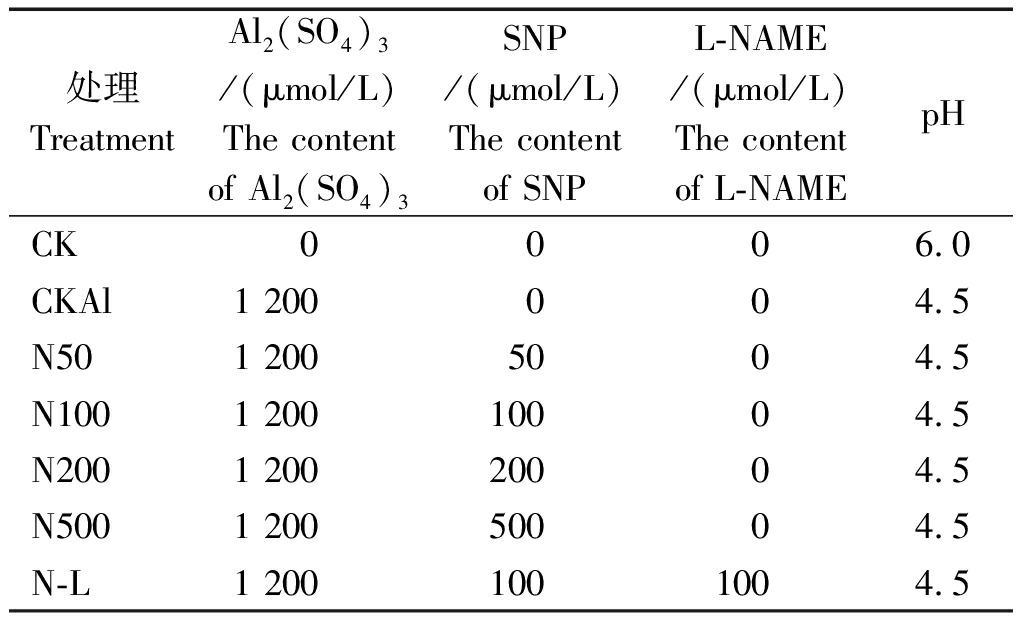
处理TreatmentAl2(SO4)3/(μmol/L)The content of Al2(SO4)3SNP/(μmol/L)The content of SNPL-NAME/(μmol/L)The content of L-NAMEpHCK0006.0CKAl1 200004.5N501 200 5004.5N1001 20010004.5N2001 20020004.5N5001 20050004.5N-L1 2001001004.5
1.3 测定方法
1.3.1 生理指标 每个处理随机选取15株,将根系用蒸馏水洗净并用滤纸擦干水分,进行指标测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法;过氧化物酶(POD)采用分光光度法;过氧化氢酶(CAT)活性采用紫外分光光度法;丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法;脯氨酸(Pro)含量采用酸性茚三酮比色法;可溶性糖含量采用蒽酮比色法;硝酸还原酶含量采用离体法;根系活力采用TTC法;根系电解质渗透率采用电导仪测定法[15-16]。
1.3.2 矿物质含量测定 将西瓜根系烘干粉碎,进行K、Ca、Mg、Fe、Zn、Cu、Al元素含量测定:称取0.5 g样品置于锥形瓶中,分别加入硝酸(16 mL)和高氯酸(4 mL),保鲜膜封口浸泡10 h,在电热板上加热消煮,定容后过滤到离心管中,用原子吸收分光光度计进行测定。N与P元素测定:消煮液换为H2SO4和H2O2,其他步骤不变,N元素使用全自动凯氏定氮仪测定,P元素测定采用钒钼黄比色法测定[17]。
1.4 数据处理
采用Excel 2019软件进行数据整理,SPSS 20.0进行方差分析,使用Orign 2019b进行绘图,图表中数据均为平均值±标准差。
2 结果与分析
2.1 外源NO对铝胁迫下西瓜根系生长状况的影响
由表2可知,CKAl处理下西瓜根系生长较CK处理显著受到抑制,其主根长及根系活力均显著降低,根鲜质量及根干质量有所下降但无显著差异。在施加外源NO后,与CKAl相比,西瓜根系生长受到促进,其根鲜质量、根干质量、主根长及根系活力(以鲜质量计)均升高,并随着NO浓度的上升,促进作用减弱。在N50处理时,西瓜根系长势最好,根鲜质量、根干质量、主根长、根系活力分别比CKAl高51.68%,105.71%,161.80%,44.11%。而在N500处理时,NO促进根系作用减弱消失,甚至表现出抑制。与N100相比,N-L处理中西瓜的根鲜质量、根干质量、主根长、根系活力均降低,但无显著差异。说明外施NO可以促进铝胁迫下西瓜根系生长,减少铝毒对根的抑制。
表2 外源NO对铝胁迫下西瓜生长状况的影响
Tab.2 Effect of NO on growth condition of watermelon under aluminum stress
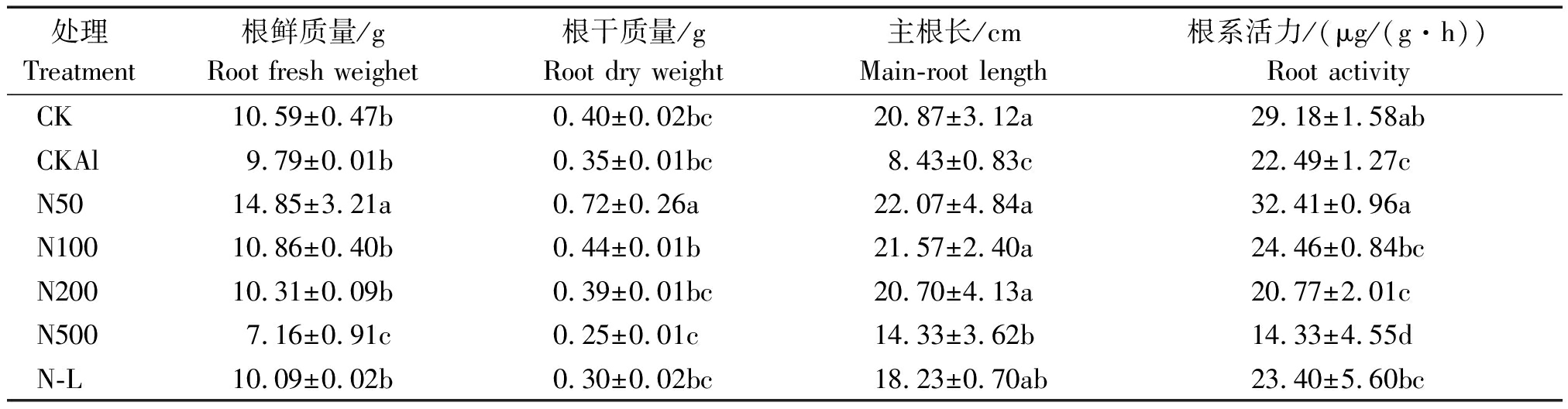
处理Treatment根鲜质量/gRoot fresh weighet根干质量/gRoot dry weight主根长/cmMain-root length根系活力/(μg/(g·h))Root activityCK10.59±0.47b0.40±0.02bc20.87±3.12a29.18±1.58abCKAl9.79±0.01b0.35±0.01bc8.43±0.83c22.49±1.27cN5014.85±3.21a0.72±0.26a22.07±4.84a32.41±0.96aN10010.86±0.40b0.44±0.01b21.57±2.40a24.46±0.84bcN20010.31±0.09b0.39±0.01bc20.70±4.13a20.77±2.01cN5007.16±0.91c0.25±0.01c14.33±3.62b14.33±4.55dN-L10.09±0.02b0.30±0.02bc18.23±0.70ab23.40±5.60bc
注:同一品种不同处理间小写字母不同表示两者差异达显著水平(P<0.05)。表3同。
Note:Data with different small letters within the same variety are significantly different treatments(P<0. 05). The same as Tab.3.
2.2 外源NO对铝胁迫下西瓜根系抗氧化酶的影响
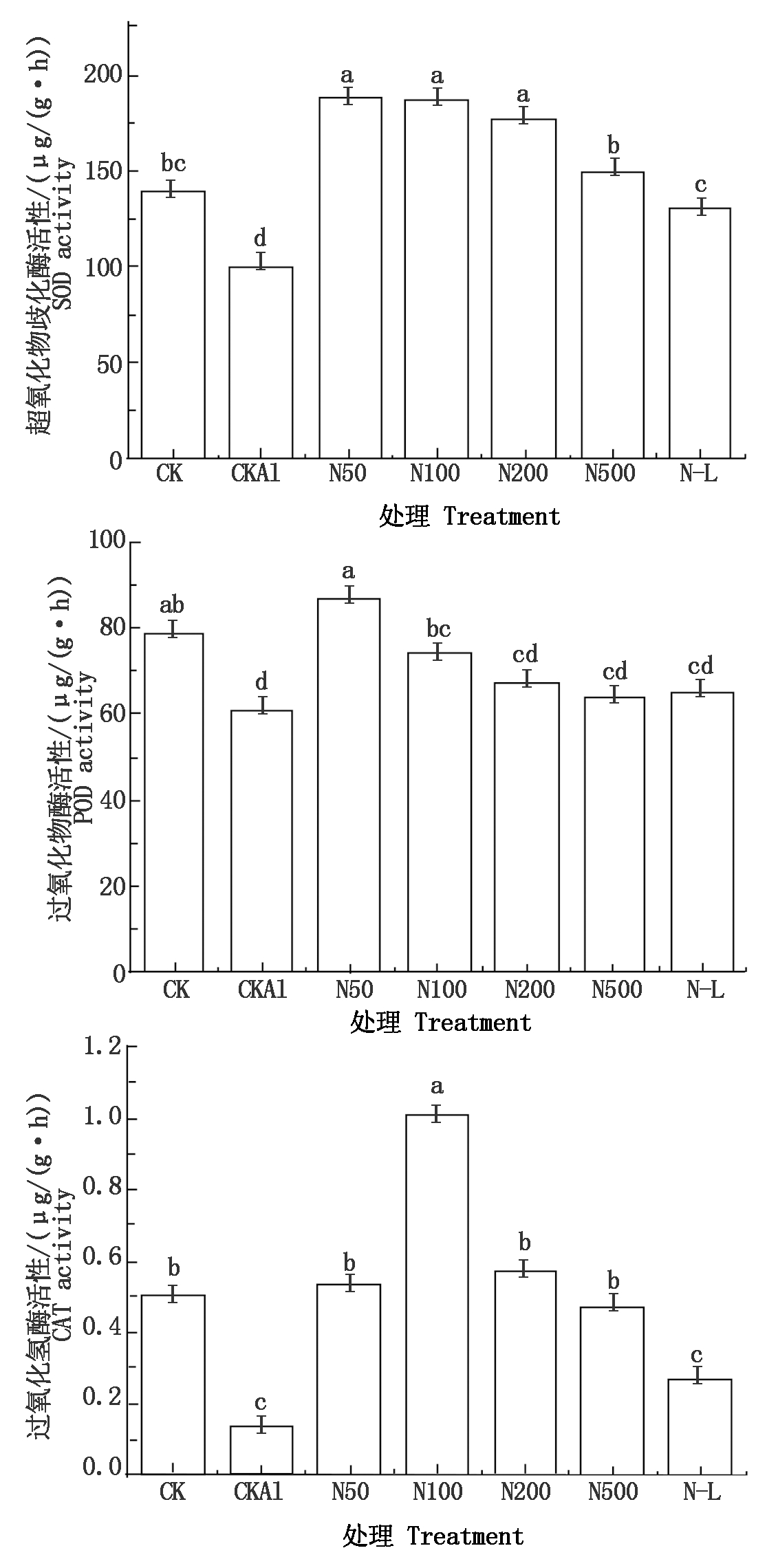
由图1可见,CKAl处理下西瓜根系SOD、POD和CAT活性均显著低于CK。在施加外源NO后,根系SOD、POD、CAT的活性均显著提高,随着NO浓度的升高表现出低浓度促进高浓度抑制的趋势。N50处理下SOD、POD活性最高,分别比CKAl高88.54%,41.92%。在N100处理中,其过氧化氢酶活性最高,比CKAl高669.23%。N500处理时则表现为抑制抗氧化酶的合成。与N100相比,N-L处理中SOD、CAT活性显著降低,而POD活性无显著差异。说明外施NO可以促进铝胁迫下西瓜抗氧化酶的合成,有助于提高西瓜根系耐铝能力。
2.3 外源NO对铝胁迫下西瓜根系渗透调节物质的影响
由图2可以看出,铝胁迫(CKAl)下西瓜根系中可溶性糖和脯氨酸含量较CK显著增加,但可溶性蛋白质含量无显著差异。在添加外源NO后,与CKAl相比,可溶性糖含量在N50、N100、N200时显著降低。可溶性蛋白含量在N50、N100时无显著差异,N500时则显著上升。脯氨酸含量随着NO浓度升高呈现出先升高后下降。在N500处理中,可溶性糖与可溶性蛋白含量达到最高,分别比CKAl高1.59%,40.89%。在N100处理中,脯氨酸含量最高,比CKAl高13.58%。与N100相比,N-L处理中可溶性蛋白与可溶性糖的含量显著升高,脯氨酸的含量显著降低。说明低浓度NO(50,100 μmol/L)可以通过增加脯氨酸含量来缓解西瓜铝胁迫对根系的损伤,而高浓度NO(500 μmol/L)对西瓜根系生长起抑制作用,此时可溶性糖与可溶性蛋白含量升高。
2.4 外源NO对铝胁迫下西瓜根系丙二醛及电解质渗透率的影响
丙二醛作为质膜过氧化的产物,其含量的高低可以表示质膜过氧化的强弱,质膜过氧化会导致质膜透性发生改变,从而使电解质大量外渗,因此,电解质渗透率强度又可以表示质膜受伤害或变性程度[18]。由图3可知,西瓜在受到铝胁迫后,与CK相比,其丙二醛含量与电解质渗透率显著上升。添加外源NO后,随着NO浓度上升,丙二醛含量呈现出先减小后增加,而电解质渗透率呈现出不断增加的趋势。在N100处理中丙二醛含量最低,比CKAl低5.55%,在N50时电解质渗透率最低,比CKAl低26.51%。在NO浓度为500 μmol/L时丙二醛含量与电解质渗透率均达到最大,分别比CKAl高22.07%,49.17%。与N100相比,N-L处理下丙二醛含量及电解质渗透率均升高,说明低浓度NO(50 μmol/L)可以通过减少质膜过氧化程度来降低丙二醛含量从而缓解铝胁迫下西瓜根系损伤,高浓度(500 μmol/L)则表现为抑制作用。
同一品种不同处理间小写字母不同
表示两者差异达显著水平(P<0.05) 。图2-4同。
Data with different small letters within the same variety are
significantly different treatments (P<0. 05). The same as Fig.2-4.
图1 外源NO对铝胁迫下西瓜根系
SOD、POD、CAT活性的影响
Fig.1 Effects of exogenous NO on activities of SOD,
POD and CAT in watermelon roots under aluminum stress
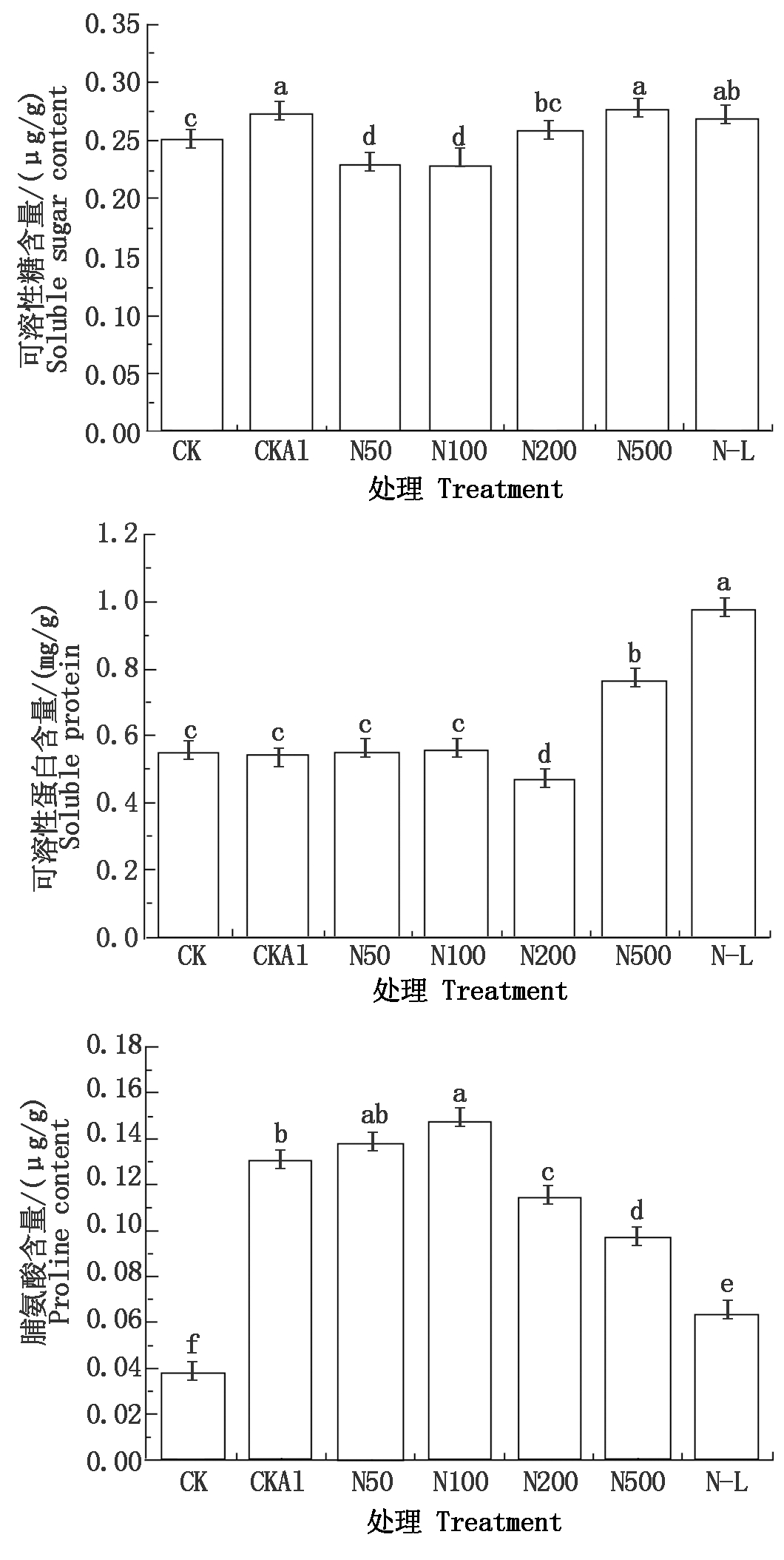
图2 外源NO对铝胁迫下西瓜
根系渗透调节物质的影响
Fig.2 Effects of exogenous NO on osmotic
regulatory substances in watermelon
roots under aluminum stress
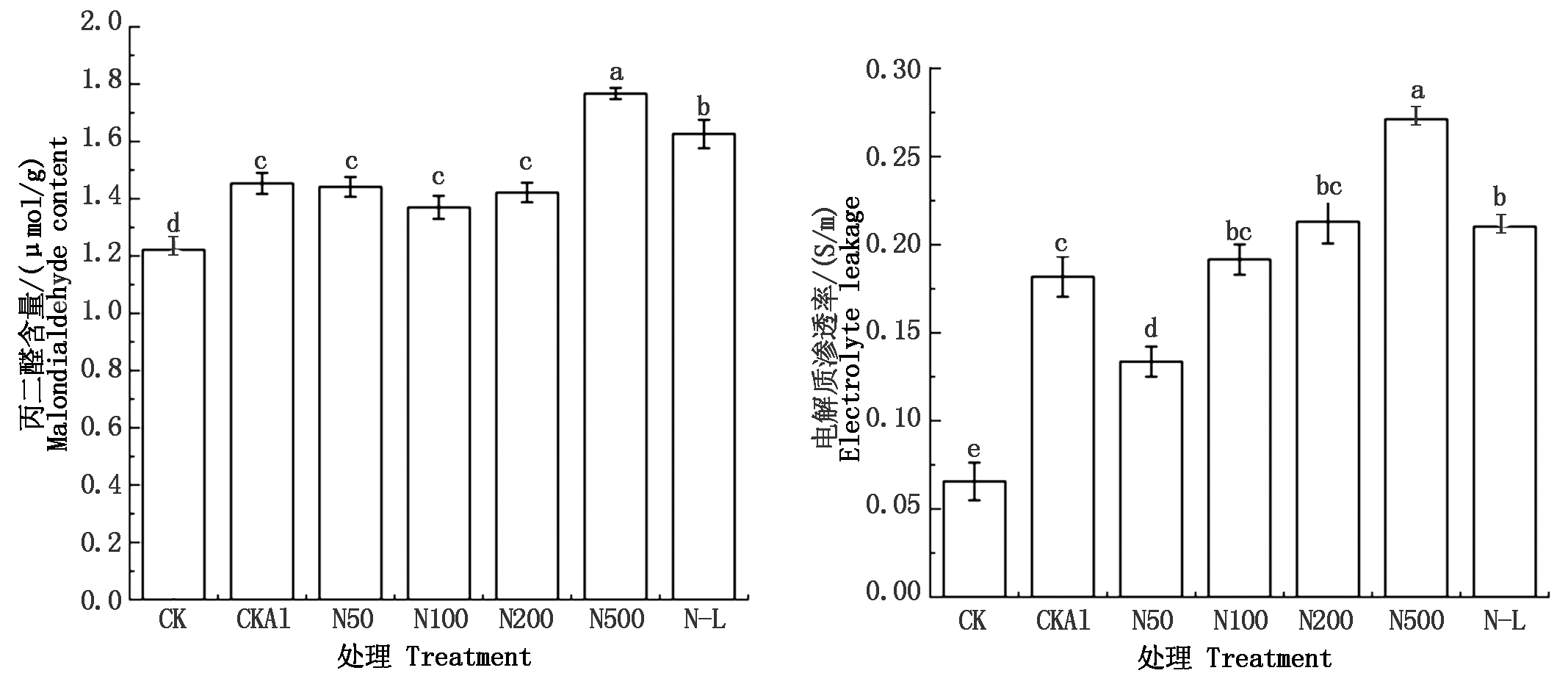
图3 外源NO对铝胁迫下西瓜根系丙二醛及电解质渗透率的影响
Fig.3 Effects of exogenous NO on malondialdehyde and electrolyte leakage in watermelon roots under aluminum stress
2.5 NO对铝胁迫下西瓜根系硝酸还原酶及氮元素吸收的影响
由图4可知,与CK相比,CKAl的硝酸还原酶及氮元素含量显著降低。添加了NO后,可以促进根系中的硝酸还原酶及氮元素含量的上升,在NO浓度为50 μmol/L时,硝酸还原酶及氮元素含量达到最大,分别比CKAl高39.70%,4.50%。而当NO浓度≥200 μmol/L时,则表现为抑制硝酸还原酶的合成及氮元素的积累,说明NO促进作用具有双重性。在添加NOS抑制剂L-NAME后,N-L中硝酸还原酶及氮元素含量较N100显著下降,说明NO可以通过调节硝酸还原酶的含量促进氮元素吸收。
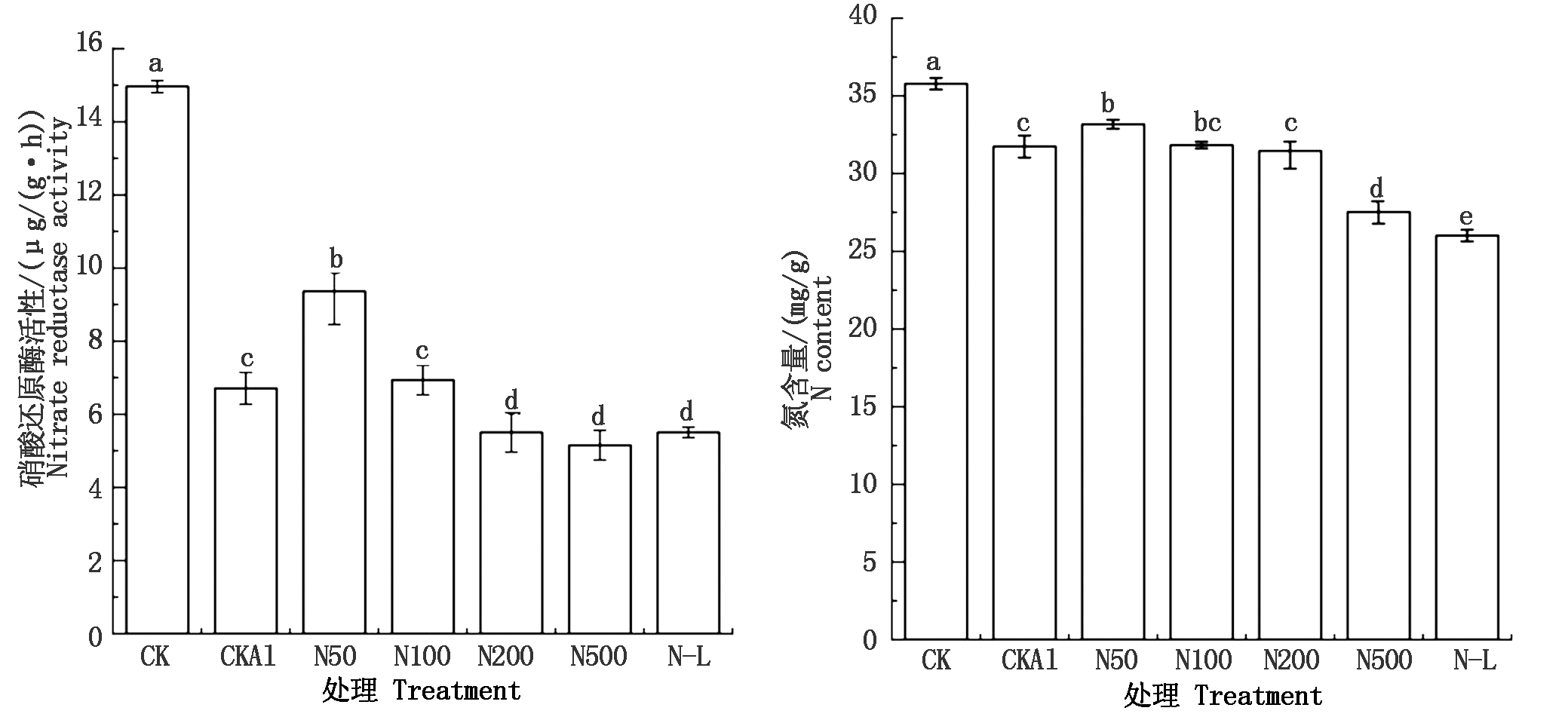
图4 NO对铝胁迫下西瓜根系硝酸还原酶及氮元素吸收的影响
Fig.4 Effects of NO on nitrate reductase and nitrogen uptake in watermelon roots under aluminum stress
2.6 NO对铝胁迫下西瓜根系矿质营养元素吸收的影响
由表3可知,西瓜在受到铝胁迫后,抑制了根系对钙、镁、铁、磷元素的吸收,促进了钾、锌、铝元素的吸收,而铜元素含量无显著差异。外源NO处理后,西瓜根系营养元素积累量随NO浓度的变化而变化,不同的营养元素变化规律不同。外施NO促进了西瓜根系对钙、镁、铁、铜、磷元素的吸收,抑制了根系对锌、铝、钾元素的吸收。在N50处理中钙、镁、磷元素含量达到最高,比 CKAl高了8.88%,7.08%,39.04%,同时显著抑制了铝元素的吸收。在N200处理下锌元素含量达到最高,比CKAl高了25.61%。与N100相比,N-L处理下抑制了西瓜根系对钾、钙、磷、镁元素的吸收,促进了铁、锌、铝元素含量的吸收,铜元素无显著变化。说明外源NO可促进铝胁迫下西瓜根系养分的积累,抑制铝离子在根尖的富集。从而缓解铝胁迫对西瓜根系的损伤,影响西瓜的生长及其生理。
表3 NO对铝胁迫下西瓜根系营养元素吸收的影响
Tab.3 Effects of NO on nutrient uptake in watermelon roots under aluminum stress mg/g
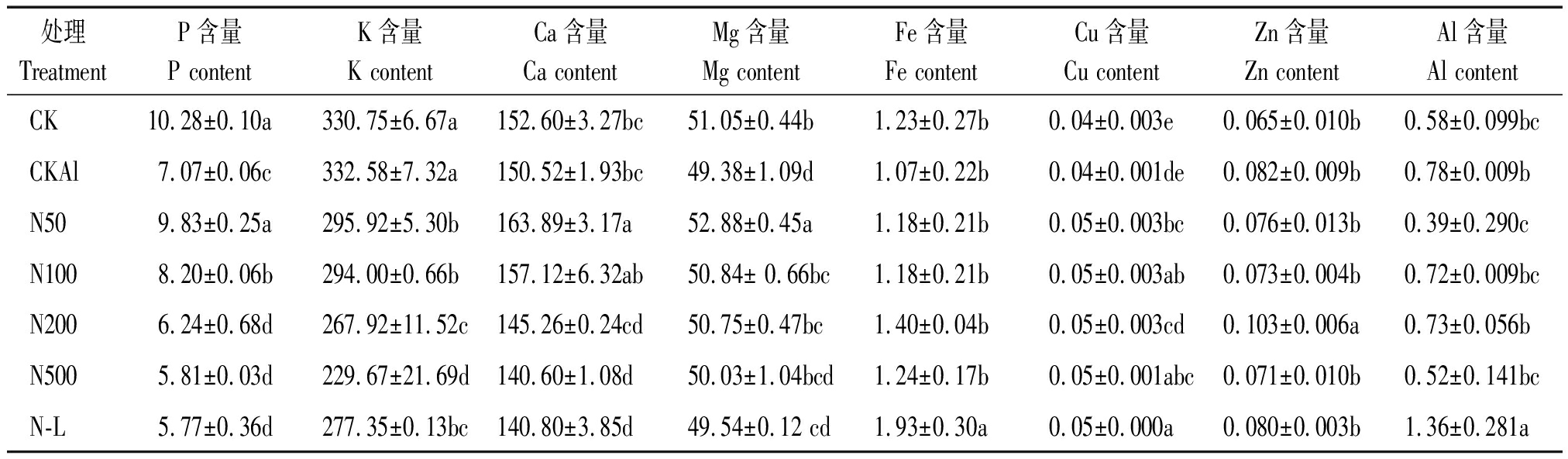
处理TreatmentP含量P contentK含量K contentCa含量Ca contentMg含量Mg contentFe含量Fe contentCu含量Cu contentZn含量Zn contentAl含量Al content CK10.28±0.10a330.75±6.67a152.60±3.27bc51.05±0.44b1.23±0.27b0.04±0.003e0.065±0.010b0.58±0.099bcCKAl7.07±0.06c332.58±7.32a150.52±1.93bc49.38±1.09d1.07±0.22b0.04±0.001de0.082±0.009b0.78±0.009bN509.83±0.25a295.92±5.30b163.89±3.17a52.88±0.45a1.18±0.21b0.05±0.003bc0.076±0.013b0.39±0.290cN1008.20±0.06b294.00±0.66b157.12±6.32ab50.84± 0.66bc1.18±0.21b0.05±0.003ab0.073±0.004b0.72±0.009bcN2006.24±0.68d267.92±11.52c145.26±0.24cd50.75±0.47bc1.40±0.04b0.05±0.003cd0.103±0.006a0.73±0.056bN5005.81±0.03d229.67±21.69d140.60±1.08d50.03±1.04bcd1.24±0.17b0.05±0.001abc0.071±0.010b0.52±0.141bcN-L5.77±0.36d277.35±0.13bc140.80±3.85d49.54±0.12 cd1.93±0.30a0.05±0.000a0.080±0.003b1.36±0.281a
3 讨论与结论
在南方地区酸性土壤中,由于土壤成土母质性质以及母质含铝量高的原因,导致大量的活性铝离子释放[19],对植物直接产生毒害作用,抑制植物的生长发育,影响作物品质及产量。高铝胁迫下表现为最明显的特征为直接抑制接触到铝的植物根的伸长,即铝直接抑制了植物根尖细胞的分裂伸长,使根系变得短粗而扭曲,并抑制根毛和须根生长,导致根尖膨大[20]。在前期试验中,通过苏木精染色法发现铝胁迫下西瓜根尖铝离子大量富集在分生区及伸长区,推断出铝离子抑制了西瓜根系伸长和分裂,破坏了根的结构使其功能损伤,这与前人的结论一致。本试验中,铝胁迫下显著抑制了西瓜根系的伸长生长,在添加适当浓度外源NO后铝抑制作用减弱,西瓜根系活力显著增加,说明NO可以缓解铝毒对西瓜根系生长的抑制。
高铝胁迫还会引起植物体内产生大量的活性氧自由基,破坏活性氧自由基与抗氧化酶之间的代谢平衡[21],如果活性氧不能及时被清除,则会损伤细胞膜系统,造成质膜过氧化产生丙二醛,且细胞内的电解质外渗还会导致电导率增大。有研究表明,八仙花受到铝胁迫后其抗氧化酶活性与H2O2含量均先升高后下降到最初水平,说明抗氧化酶系统在铝胁迫时发挥了重要的作用[22]。铝胁迫下,油菜品种幼苗根系质膜透性均有所增加[23],大豆根系的生物氧化强度降低,根细胞质膜透性增大,电解质渗透率增加,外渗K+浓度不断上升 [24]。本研究在前期试验中,通过对西瓜根尖进行schiff染色发现铝胁迫下MDA主要分布在西瓜根尖分生区及伸长区,添加适宜浓度NO则可以减少丙二醛在根尖的积累。本试验中,铝胁迫下西瓜根系SOD、POD、CAT活性均显著降低,丙二醛含量及电解质渗透率上升。添加外源NO可以促进西瓜根系抗氧化酶的合成,从而减少活性氧损伤,缓解铝胁迫下生理损伤,推测可能由于低浓度 NO可以通过各种方式与 ROS作用,发挥抗氧化功能,从而降低质膜过氧化程度来缓解铝胁迫下西瓜根系损伤。
脯氨酸是细胞内最重要的渗透调节物质,以游离的形式在植物中积累,在逆境中会大量积累,通过降低细胞渗透势来减少胞液外渗[25]。可溶性蛋白与可溶性糖含量也可作为一种渗透调节物质,参与植物的生长发育。白爱兴等[26]研究表明,盐胁迫显著提高了酸枣幼叶的可溶性蛋白质、可溶性糖和脯氨酸含量,提高了酸枣的渗透调节能力。本试验中,铝胁迫下西瓜根系可溶性糖与脯氨酸含量显著上升,可溶性蛋白的含量无显著差异。在添加外源NO后,西瓜根系中脯氨酸含量显著积累,在渗透平衡调节中起决定性作用,可以维持细胞渗透平衡,减少细胞液外流。
硝酸还原酶(NR)是植物体内的一种重要的氧化还原酶,参与植物体内的氮代谢并直接参与NO的合成。NR催化NO3-转化生成NO2-的过程,是植物吸收利用NO3-过程中的第一个酶,NR可以直接调节NO3-的还原,从而调节氮代谢。因此,常用硝酸还原酶的活性表示氮代谢的强弱[27]。植物中NO的来源主要包括依赖于亚硝酸盐的还原途径和依赖于精氨酸的氧化途径。植物中硝酸还原酶可以NADPH/NADH作为电子供体,将硝酸盐(NO3-)转化为亚硝酸盐(NO2-),随后NO2-可以被NR还原或者通过线粒体中的电子传递链还原为NO[28],如Yamasaki等[29]发现NR化亚硝酸盐产生NO,在含NO2-和NADH的缓冲液(pH值7.0)中加入NR,就会有NO产生。其次植物可以通过多种非酶途径形成NO,如由NO的供体硝普钠(SNP)、S-亚硝基-N-乙酰清霉胺(SNAP)形成NO。本试验中,铝胁迫下西瓜根系NR活性显著降低,氮元素积累也显著降低。添加外源SNP后西瓜根系硝酸还原酶与氮元素含量均显著升高。推断SNP使西瓜根系通过非酶促反应形成NO并参与西瓜体内耐铝调节,可以通过促进硝酸还原酶的合成进而参与根系氮代谢过程。添加NOS抑制剂后SNP的缓解作用消失,可能由于抑制了内源NO产生,降低了硝酸还原酶的活性并直接影响西瓜根系氮元素的积累,然而,目前有关NO促进硝酸还原酶的合成机理尚不清楚,有待进一步研究。
铝胁迫下植物根系的生长受到抑制,直接影响植物对土壤中营养元素的吸收积累。植物根尖的根毛区和伸长区是从根系土壤吸收水分和养分最主要的部位。铝胁迫下,许多蔬菜作物根尖富集了大量铝离子,它们与阳离子竞争结合位点,导致离子通道阻塞,抑制矿物质元素的吸收,最终使植物缺素,影响其正常生长发育。植物发生铝毒害的原因之一是铝干扰了矿质元素的吸收及转运,尤其是 P、K、Ca和Mg的吸收和运输。黄春琼等[30]研究狗牙根发现铝胁迫下增加了狗牙根植株体内铝的含量,抑制了狗牙根对 N、P、K、Ca 的吸收。在本试验中,高铝胁迫导致根系中铝大量富集,抑制了根系对钙、镁、铁、磷的吸收。推测其原因一方面大量的活性Al3+进入根尖细胞壁后,与质膜表面的阴离子相互作用,改变膜电位和质膜结构,从而改变离子转运体的活性;另一方面铝离子与金属阳离子竞争阳离子结合位点以及阻塞了阳离子通道,共同导致多价阳离子吸收受到抑制。经不同浓度的NO处理后,西瓜根系营养元素的含量会发生改变,适宜浓度NO会促进西瓜根系对营养元素的吸收,NO浓度缓解效果因浓度的不同而存在明显差异,其中以50 μmol/L浓度NO缓解效果最好,这与刘强等[31]的研究结果一致,适宜浓度外源NO也可以促进烟草根系对钙、镁、铁和铜营养元素的吸收。具体原因可能为NO一方面降低了铝对细胞壁的结构损伤,提高了细胞壁对铝的结合能力;另一方面NO作为信号分子提高H+-ATP的活性,从而促进离子运输。
综上所述,铝胁迫下西瓜根系丙二醛含量升高,活性氧与抗氧化酶的代谢平衡受到破坏,营养元素吸收受到影响。通过外施一定浓度的NO可以使西瓜根系的电解质渗透率及丙二醛含量下降,质膜过氧化程度降低,促进SOD、POD、CAT活性的提高,且NO能影响西瓜根系对营养元素的吸收,减少根系中铝元素的含量。因此,适宜浓度的NO可以缓解铝胁迫下的西瓜损伤,提升对铝的耐性,为西瓜的栽培提供试验依据。
[1] 陈微微,陈传奇,刘鹏,徐根娣,何芳,范铭,池慧. 荞麦和金荞麦根际土壤铝形态变化及对其生长的影响[J].水土保持学报,2007,21(1):176-179,192. doi:10.13870/j.cnki.stbcxb.2007.01.043.
Chen W W,Chen C Q,Liu P,Xu G D,He F,Fan M,Chi H. Forms of aluminum in rhizosphere soil and its effect on growth of Fagopyrum esculentum and Fagopyrum cymosum[J].Journal of Soil and Water Conservation,2007,21(1):176-179,192.
[2] 陈小丽. 铝在土壤固/液相中化学行为的研究进展[J].广西农学报,2006,21(4):38-43. doi:10.3969/j.issn.1003-4374.2006.04.014.
Chen X L. Study progress on chemical behavior of aluminum at interface between soil solid and solution[J].Journal of Guangxi Agriculture,2006,21(4):38-43.
[3] 吴家龙,郭彦彪,张池,邓婷,王皓宇,杨淇钧,刘青,周波,任宗玲,戴军. 华南矿区与非矿区土壤酸化特征及铝形态分析[J].华南农业大学学报,2019,40(2):21-30. doi:10.7671/j.issn.1001-411X.201806011.
Wu J L,Guo Y B,Zhang C,Deng T,Wang H Y,Yang Q J,Liu Q,Zhou B,Ren Z L,Dai J. Acidification characteristics and aluminum speciation in soil from mining and non-mining areas of Southern China[J].Journal of South China Agricultural University,2019,40(2):21-30.
[4] 李干琼,王志丹. 我国西瓜产业发展现状及趋势分析[J].中国瓜菜,2019,32(12):79-83. doi:10.16861/j.cnki.zggc.2019.0340.
Li G Q,Wang Z D. Analysis of current situation and trend of development of watermelon industry in China[J].China Cucurbits and Vegetables,2019,32(12):79-83.
[5] 吕焕哲,王凯荣,谢小立,王开锋. 施用水稻秸秆对酸性红壤铝形态的动态影响[J].水土保持学报,2006,20(4):110-112,119. doi:10.13870/j.cnki.stbcxb.2006.04.026.
Lü H Z,Wang K R,Xie X L,Wang K F. Dynamic effects of varying amount of rice straw on different aluminum form[J].Journal of Soil and Water Conservation,2006,20(4):110-112,119.
[6] 秦毓茜,李延红. 一氧化氮在植物中的生理作用[J].安徽农业科学,2006,34(9):1802-1804. doi:10.3969/j.issn.0517-6611.2006.09.024.
Qin Y Q,Li Y H. Role of nitric oxide in plant[J].Journal of Anhui Agricultural Sciences,2006,34(9):1802-1804.
[7] 王华华,张杨阳,刘文文. 铝胁迫下一氧化氮对大豆根生长抑制的缓解作用[J].江苏农业科学,2019,47(18):122-125.doi:10.15889/j.issn.1002-1302.2019.18.025.
Wang H H,Zhang Y Y,Liu W W. Mitigating effect of nitrogen oxide on growth inhibition of soybean roots under aluminum stress[J].Jiangsu Agricultural Sciences,2019,47(18):122-125.
[8] Liu S L,Yang R J,Pan Y Z,Ren B,Chen Q B,Li X,Xiong X,Tao J J,Cheng Q S,Ma M D. Beneficial behavior of nitric oxide in copper-treated medicinal plants[J]. Journal of Hazardous Materials,2016,314:140-154. doi:10.1016/j.jhazmat.2016.04.042.
[9] Wang H H,Ji F,Zhang Y Y,Hou J J,Liu W W,Huang J J,Liang W H. Interactions between hydrogen sulphide and nitric oxide regulate two soybean citrate transporters during the alleviation of aluminium toxicity[J].Plant Cell and Environment,2019,42(8):2340-2356. doi:10.1111/pce.13555.
[10] Ozfidan-Konakci C,Yildiztugay E,Elbasan F,Kucukoduk M,Turkan I. Hydrogen sulfide(H2S)and nitric oxide(NO)alleviate cobalt toxicity in wheat(Triticum aestivum L.)by modulating photosynthesis,chloroplastic redox and antioxidant capacity[J].Journal of Hazardous Materials,2020,388:122061. doi:10.1016/j.jhazmat.2020.122061.
[11] Wang H H,Huang J J,Bi Y R. Nitrate reductase-dependent nitric oxide production is involved in aluminum tolerance in red kidney bean roots[J]. Plant Science,2010,179(3):281-288. doi:10.1016/j.plantsci.2010.05.014.
[12] Wang H H,Li Y,Hou J J,Huang J J,Liang W H. Nitrate reductase-mediated nitric oxide production alleviates Al-induced inhibition of root elongation by regulating the ascorbate-glutathione cycle in soybean roots[J].Plant and Soil,2017,410(1/2):453-465. doi:10.1007/s11104-016-3045-4.
[13] Lan Y L,Chai Y Q,Xing C H,Wu K,Wang L P,Cai M Z. Nitric oxide reduces the aluminum-binding capacity in rice root tips by regulating the cell wall composition and enhancing antioxidant enzymes[J].Ecotoxicology and Environmental Safety,2021,208:111499. doi:10.1016/J.ECOENV.2020.111499.
[14] Li D X,Ma W N,Wei J,Mao Y W,Peng Z P,Zhang J R,Kong X Y,Han Q Q,Fan W,Yang Y,Chen J H,Wu L Q,Rengel Z,Cui X M,Chen Q. Magnesium promotes root growth and increases aluminum tolerance via modulation of nitric oxide production in Arabidopsis[J].Plant and Soil,2020,457(1/2):83-95. doi:10.1007/s11104-019-04274-9.
[15] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
Li H S. Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2000.
[16] 高俊凤. 植物生理学实验指导[M].北京:高等教育出版社,2006.
Gao J F. Plant physiology experiment instruction[M].Beijing:Higher Education Press,2006.
[17] 鲍士旦. 土壤农化分析[M].3版. 北京:中国农业出版社,2000.
Bao S D. Soil agrochemical analysis[M].3rd Edition.Beijing:China Agriculture Press,2000.
[18] 黄开腾,陈勇杏,黄琳,曾小飚,陆全杰,张肃杰. 铝锰复合胁迫对向日葵幼苗叶片渗透调节物质的影响[J].安徽农学通报,2020,26(17):16-18. doi:10.16377/j.cnki.issn1007-7731.2020.17.007.
Huang K T,Chen Y X,Huang L,Zeng X B,Lu Q J,Zhang S J. Effects of aluminum and manganese stress on osmotic regulatory substances in leaves of sunflower seedlings[J].Anhui Agricultural Science Bulletin,2020,26(17):16-18.
[19] 吴道铭,傅友强,于智卫,沈宏. 我国南方红壤酸化和铝毒现状及防治[J].土壤,2013,45(4):577-584.doi:10.13758/j.cnki.tr.2013.04.001.
Wu D M,Fu Y Q,Yu Z W,Shen H. Status of red soil acidification and aluminum toxicity in South China and prevention[J].Soils,2013,45(4):577-584.
[20] Riyazuddin,Nageswara Rao T,Hussain I,Koo B H. Effect of aluminum tri-hydroxide/zinc borate and aluminium tri-hydroxide/melamine flame retardant systems synergies on epoxy resin[J].Materials Today:Proceedings,2020,27:2269-2272. doi:10.1016/j.matpr.2019.09.110.
[21] 李文静,毛纪隆,吴玉环,唐可,潘芳芳,方芳,蔡妙珍,刘鹏. 吲哚乙酸对铝胁迫下栝楼生理响应及DNA损伤的缓解作用[J].应用生态学报,2020,31(12):4235-4242. doi:10.13287/j.1001-9332.202012.009.
Li W J,Mao J L,Wu Y H,Tang K,Pan F F,Fang F,Cai M Z,Liu P. Effects of IAA on physiological response to aluminum stress and DNA damage of Trichosanthes kirilowii[J].Chinese Journal of Applied Ecology,2020,31(12):4235-4242.
[22] 彭尽晖,陈海霞,龚雯,傅微. 铝胁迫对八仙花离体植株质膜透性与抗氧化系统的影响[J].湖南农业大学学报(自然科学版),2013,39(S1):42-44. doi:10.13331/j.cnki.jhau.2013.s1.027.
Peng J H,Chen H X,Gong W,Fu W. Effects of aluminum stress on plasma membrane permeability and antioxidant system of in vitro plants of Hypophylla chinensis[J].Journal of Hunan Agricultural University(Natural Sciences),2013,39(S1):42-44.
[23] 韩德鹏,刘星月,王馨悦,罗莎,付东辉,周庆红. 铝胁迫对油菜根系形态和生理指标的影响[J].核农学报,2019,33(9):1824-1832. doi:10.11869/j.issn.100-8551.2019.09.1824.
Han D P,Liu X Y,Wang X Y,Luo S,Fu D H,Zhou Q H. Effects of aluminum stress on morphology parameters of roots and physiological indexes in Brassica napus L.[J].Journal of Nuclear Agricultural Sciences,2019,33(9):1824-1832.
[24] 吴彩玉,陈珠,李育军,陈敏忠,唐加,植石灿,倪乔丹. 不同浓度铝胁迫下水分胁迫对大豆幼苗生理代谢的影响[J].长江蔬菜,2018(14):39-44. doi:10.3865/j.issn.1001-3547.2018.14.015.
Wu C Y,Chen Z,Li Y J,Chen M Z,Tang J,Zhi S C,Ni Q D. Effects of water stress under different aluminum concentrations on physiological metabolism of soybean seedlings[J].Journal of Changjiang Vegetables, 2018(14):39-44.
[25] 王新英,史军辉,刘茂秀,白丽丽,艾吉尔·阿不拉. 洪水漫溢对塔里木河中游天然胡杨林叶渗透调节物质及抗氧化酶活性的影响[J].干旱区研究,2020,37(6):1544-1551. doi:10.13866/j.azr.2020.06.20.
Wang X Y,Shi J H,Liu M X,Bai L L,Aijier Abula. Effects of flood overtopping on leaf osmotic adjustment substances and antioxidant enzyme activities of natural Populus euphratica forest in the middle reaches of the Tarim River[J].Arid Zone Research,2020,37(6):1544-1551.
[26] 白爱兴,鲁晓燕. 钙和钙效应剂对NaCl胁迫下酸枣幼苗抗氧化系统及渗透调节物质含量的影响[J].植物生理学报,2020,56(9):1910-1920. doi:10.13592/j.cnki.ppj.2020.0070.
Bai A X,Lu X Y. Effects of calcium and calcium effectors on antioxidant system and osmotic adjustment substances content of sour jujube(Ziziphus jujuba var. spinosa)seedlings under NaCl stress[J].Plant Physiology Journal,2020,56(9):1910-1920.
[27] 胡书明,吴春燕,冉胜祥,王洪伟. 一氧化氮对园艺植物的生理作用及其应用前景[J].现代园艺,2021,44(10):126-127. doi:10.14051/j.cnki.xdyy.2021.10.055.
Hu S M,Wu C Y, Ran S X,Wang H W. Physiological effects of nitric oxide on horticultural plants and its application prospect[J].Contemporary Horticulture,2021,44(10):126-127.
[28] Rockel P,Strube F,Rockel A,Wildt J,Kaiser W M. Regulation of nitric oxide(NO)production by plant nitrate reductase in vivo and in vitro[J]. Journal of Experimental Botany,2002,53(366):103-110. doi:10.1093/jexbot/53.366.103.
[29] Yamasaki H,Sakihama Y. Simultaneous production of nitric oxide and peroxynitrite by plant nitrate reductase: in vitro evidence for the NR-dependent formation of active nitrogen species[J].FEBS Letters,2000,468(1):89-92. doi:10.1016/S0014-5793(00)01203-5.
[30] 黄春琼,陈振,崔蓉菁,刘国道,王文强. 铝胁迫对狗牙根种质资源营养元素吸收的影响[J].热带作物学报,2020,41(6):1092-1099. doi:10.3969/j.issn.1000-2561.2020.06.004.
Huang C Q,Chen Z,Cui R J,Liu G D,Wang W Q. The effect of aluminum stress on nutrient absorption in cynodon dactylon accessions[J].Chinese Journal of Tropical Crops,2020,41(6):1092-1099.
[31] 刘强,柳正葳,刘召亮,乔清华,张玉. 一氧化氮对铝胁迫下烟草根系营养元素吸收和呼吸电子传递及内源激素含量的影响[J].江苏农业学报,2020,36(2):292-298. doi:10.3969/j.issn.1000-4440.2020.02.006.
Liu Q,Liu Z W,Liu Z L,Qiao Q H,Zhang Y. Effects of nitric oxide on nutrient uptake,respiratory electron transfer and endogenous phytohormones contents in roots of tobacco seedlings under aluminum stress[J].Jiangsu Journal of Agricultural Sciences,2020,36(2):292-298.