盐胁迫是影响作物产量的主要环境问题之一,目前全世界范围内19.6%的耕地及超过2%的非耕地已经出现盐碱化。在灌溉及半干旱地区,由于不合理施肥造成的盐碱化土地面积正在逐年增加,预计到2050年将增加1倍[1]。中国是盐碱地大国,在6 700万hm2耕地中,有10%的耕地为盐碱化土壤[2]。土壤盐碱化引起植物叶片黄化、脱水和植株死亡,也影响农作物的产量和品质。
萝卜(Raphanus sativus L.)是我国重要的蔬菜作物,年播种面积107万 hm2,占总体蔬菜播种面积的5%。萝卜还是重要的出口创汇蔬菜,随着农业产业结构调整的深入,出口加工萝卜已成为许多地方种植业结构调整的主要经济作物之一。关于萝卜耐盐性的报道较少,Grattan等[3]将萝卜定义为中等盐敏感植物,而Sonneveld等[4]认为萝卜是盐敏感类蔬菜作物。研究表明,盐胁迫影响萝卜种子萌发、幼苗鲜质量、叶面积及水分和养分利用率,最终影响产量和品质[5-7]。培育耐盐品种是解决这一问题的根本途径之一。
植物耐盐机理是一种复杂的生理生化过程,是由多个基因参与的调控网络[8]。Sun等[9]利用转录组学分析研究了萝卜盐胁迫响应的分子机制,在mRNA水平上鉴定出8 709个差异表达基因。这些基因可能参与盐胁迫信号感知和转导、渗透调节、离子平衡和活性氧清除等响应过程。盐胁迫减少植物组织中的气体交换,使得CO2向叶片供应受阻,影响光合电子传递链,从而产生对植物体有害的活性氧(ROS)[10]。过氧化氢酶(Catalase,CAT)和超氧化物歧化酶(Superoxide dismutase,SOD)是清除活性氧的重要物质。CAT和SOD基因响应盐胁迫在许多植物中得到验证,例如在棉花(Gossypium L.)中过表达GhCAT1和GhSOD1可提高耐盐性[11]。本研究针对盐胁迫对萝卜发芽率、幼苗植株生长发育的影响,以及RsCAT和RsSOD基因在不同浓度盐胁迫下耐、感盐品种中的表达模式,以期为了解萝卜响应盐胁迫的分子机制,培育耐盐品种提供参考。
1 材料和方法
1.1 种子盐处理方法
试验材料包括11个不同类型萝卜品种,其中Tamgocho Hama Daikon和Yura Hama Daikon属于东亚野萝卜,没有膨大的肉质根(表1)。每个处理取100粒种子,置于铺有3层滤纸的培养皿中,滤纸分别用100,200 mmol/L的NaCl溶液充分浸湿,25 ℃下暗培养,以清水为对照,3次重复。3 d后调查种子发芽数,计算发芽率(Germination percent,GP)和发芽指数(Germination index,GI)。GP=(发芽数/种子总数)×100%;GI=盐处理发芽率/对照发芽率。分别选出发芽率最高和最低的品种(Yura Hama Daikon和五斤红)为耐盐和感盐品种进行后续的试验。
表1 供试材料来源及主要性状
Tab.1 Materials and main traits
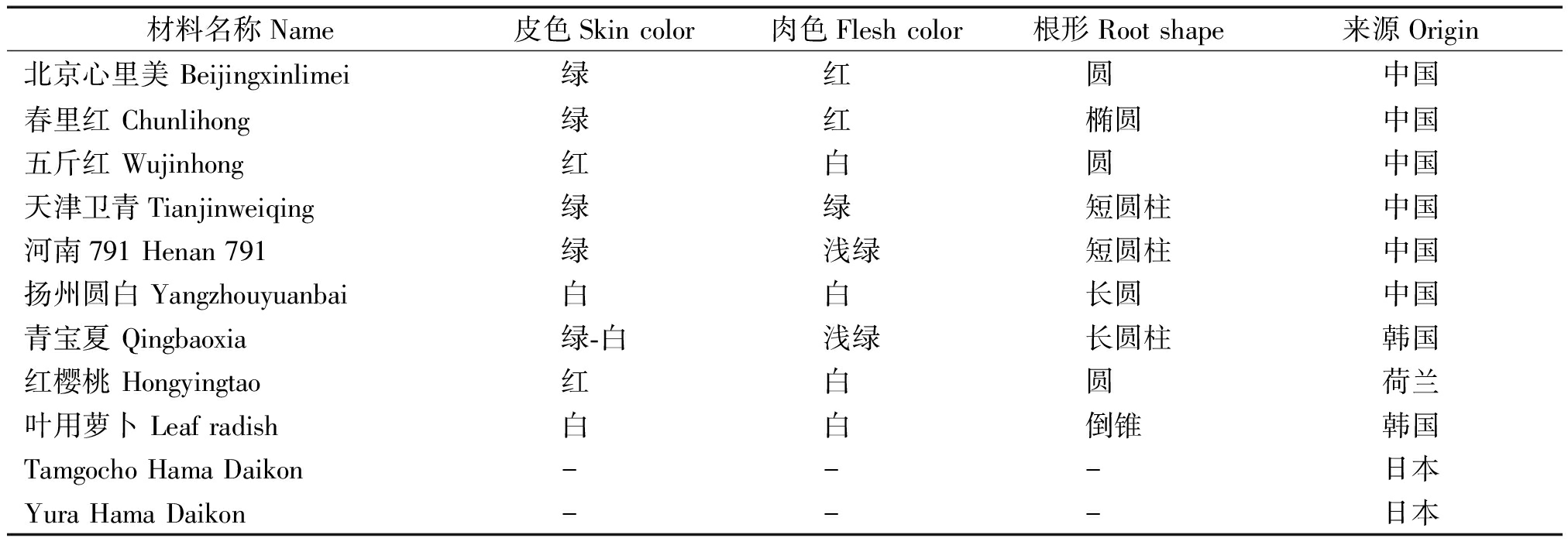
材料名称Name皮色Skin color肉色Flesh color根形Root shape来源Origin北京心里美 Beijingxinlimei绿红圆中国春里红 Chunlihong绿红椭圆中国五斤红 Wujinhong红白圆中国天津卫青Tianjinweiqing绿绿短圆柱中国河南791 Henan 791绿浅绿短圆柱中国扬州圆白 Yangzhouyuanbai白白长圆中国青宝夏 Qingbaoxia绿-白浅绿长圆柱韩国红樱桃 Hongyingtao红白圆荷兰叶用萝卜 Leaf radish白白倒锥韩国Tamgocho Hama Daikon---日本Yura Hama Daikon---日本
1.2 幼苗盐处理方法
试验在温室中进行,种子用3%次氯酸钠进行表面消毒15 min,播种于装有珍珠岩的育苗盘中。两叶一心期移栽到泡沫漂浮板中,用海绵球固定,置于1/2霍格兰氏营养液(pH值7.0)中,白天和夜间平均温度分别为28,20 ℃,14 h光照。缓苗3 d后进行盐胁迫处理。设置2个NaCl浓度梯度:100,200 mmol/L,以不加盐的营养液为对照。为保证盐浓度不变,每2 d更换1次营养液。每个处理50株,3次重复。
1.3 盐胁迫对萝卜幼苗生长的影响
盐胁迫处理21 d后调查株高和叶焦指数。根据功能叶干枯的数量和叶片黄化程度对叶片进行综合评级(图1)。0级:没有黄化叶;1级:1片叶部分黄化,边缘有少量干枯;3级:1~2片完全黄化,叶边缘有干枯;5级:1~2片叶完全干枯,其余叶片边缘或中间干枯;7级:3片叶完全干枯;9级:植株完全干枯。叶焦指数(Leaf scorch index)按以下公式计算:叶焦指数![]()

图1 萝卜幼苗盐处理后叶片焦化程度的分级
Fig.1 Grading of leaf scorch after salt treatment
1.4 RNA提取和qPCR分析
分别取未处理(0 h)、盐胁迫后24 h,48 h,7 d,14 d表现胁迫损伤的叶片,每个处理3个生物学重复,液氮速冻后放入-80 ℃冰箱保存。利用植物RNA提取试剂盒(华越洋公司)提取总RNA,1%琼脂糖电泳检测RNA浓度、纯度及完整性。
根据萝卜“Aokubi DH”参考基因组注释结果[12],注释基因RSG17403和RSG21616分别编码过氧化氢酶基因(RsCAT)和超氧化物歧化酶(RsSOD)基因,选择RsRPⅡ为内参基因,根据基因CDS序列设计引物进行qPCR分析,所用引物信息见表2。
表2 qRT-PCR所用引物信息
Tab.2 Primers information for qRT-PCR
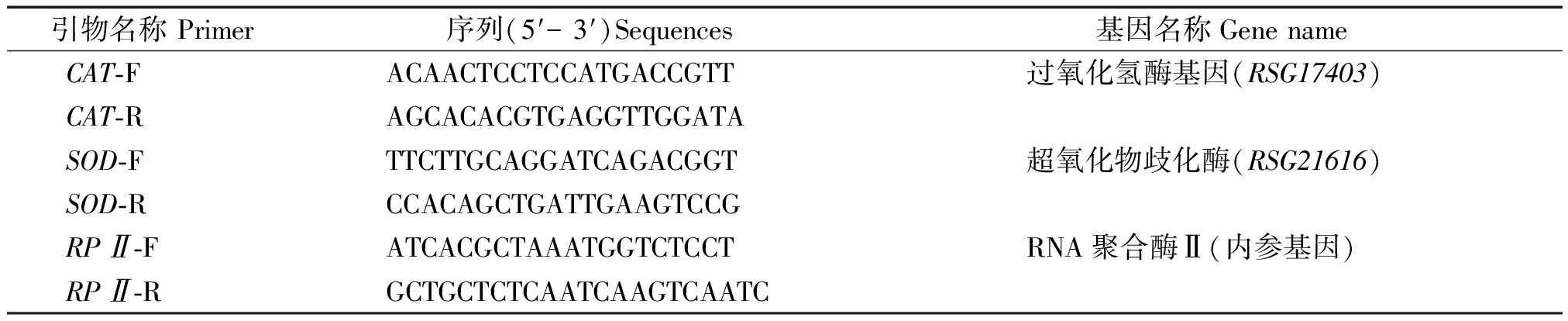
引物名称 Primer序列(5′- 3′)Sequences基因名称Gene nameCAT-FACAACTCCTCCATGACCGTT过氧化氢酶基因(RSG17403)CAT-RAGCACACGTGAGGTTGGATASOD-FTTCTTGCAGGATCAGACGGT超氧化物歧化酶(RSG21616)SOD-RCCACAGCTGATTGAAGTCCGRPⅡ-FATCACGCTAAATGGTCTCCTRNA聚合酶Ⅱ(内参基因)RPⅡ-RGCTGCTCTCAATCAAGTCAATC
取1 μg总RNA,DNase Ⅰ消化后用反转录试剂盒(TaKaRa)将其反转录成cDNA。qRT-PCR反应体系为20 μL,包含100 ng cDNA,10 μL 2×TB Green Premix Ex Taq Ⅱ (Tli RNaseH Plus,TaKaRa),各0.4 μmol/L上下游引物。反应程序如下:95 ℃,30 s;40 循环(95 ℃,5 s;60 ℃,20 s);95 ℃,5 s;60 ℃,1 min;50 ℃,30 s。扩增数据使用LIGHTCYCLER 480(version 1.5,Roche)软件分析,相对表达量采用2-ΔΔCt方法计算。
2 结果与分析
2.1 盐胁迫对不同萝卜品种发芽率的影响
种子萌发阶段是萝卜对盐胁迫最敏感的时期之一,盐胁迫可降低种子发芽率,且不同品种下降程度不同。不同浓度盐胁迫(100,200 mmol/L)对11个萝卜品种发芽率的影响结果表明(表3):盐胁迫下所有品种的发芽率均受影响,随着盐浓度的增大发芽率下降明显,且在品种之间存在明显差异。在200 mmol/L盐胁迫下,五斤红和红樱桃发芽率下降最为明显,分别为3.33%,9.00%;二者的发芽指数均小于0.1(0.04,0.09),属于盐敏感品种;Yura Hama Daikon和叶用萝卜的发芽率下降幅度最小,分别为94.33%,86.00%,发芽指数分别为0.94,0.86,属于耐盐品种。
表3 盐胁迫对11个萝卜品种发芽率的影响
Tab.3 Effect of salt stress on the germination percentage and germination index of radish seeds
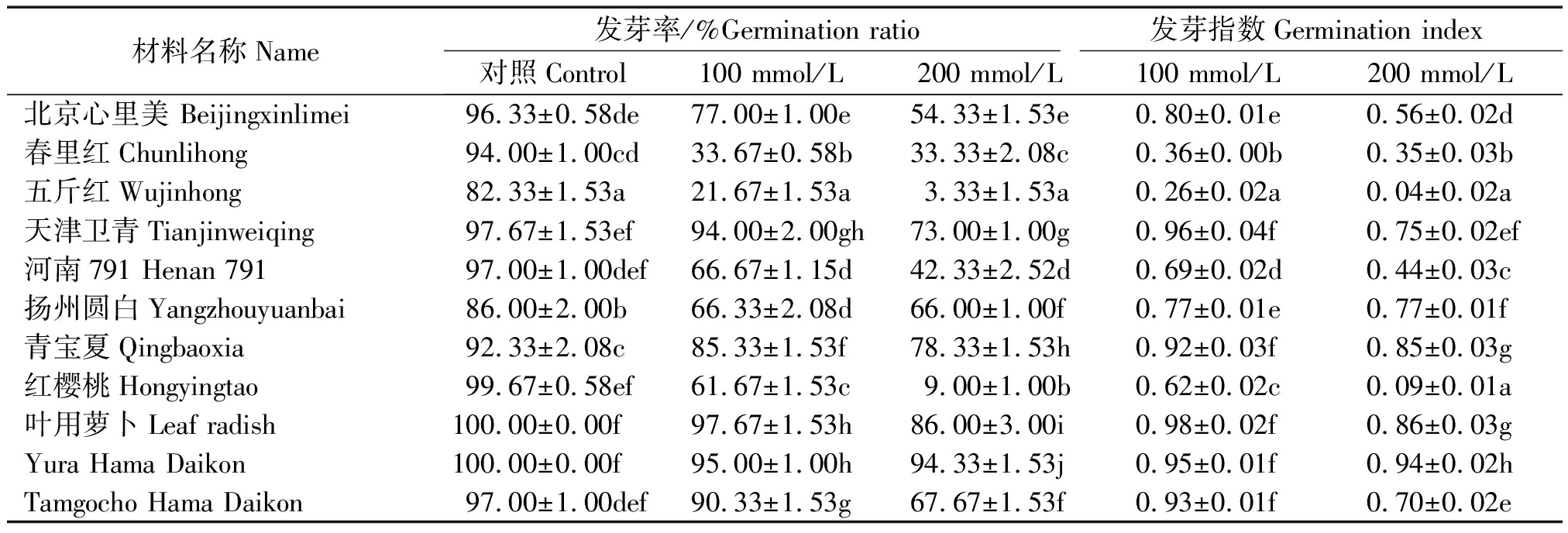
材料名称Name发芽率/%Germination ratio发芽指数Germination index对照Control100 mmol/L200 mmol/L100 mmol/L200 mmol/L北京心里美 Beijingxinlimei96.33±0.58de77.00±1.00e54.33±1.53e0.80±0.01e0.56±0.02d春里红Chunlihong94.00±1.00cd33.67±0.58b33.33±2.08c0.36±0.00b0.35±0.03b五斤红Wujinhong82.33±1.53a21.67±1.53a3.33±1.53a0.26±0.02a0.04±0.02a天津卫青Tianjinweiqing97.67±1.53ef94.00±2.00gh73.00±1.00g0.96±0.04f0.75±0.02ef河南791 Henan 79197.00±1.00def66.67±1.15d42.33±2.52d0.69±0.02d0.44±0.03c扬州圆白Yangzhouyuanbai86.00±2.00b66.33±2.08d66.00±1.00f0.77±0.01e0.77±0.01f青宝夏Qingbaoxia92.33±2.08c85.33±1.53f78.33±1.53h0.92±0.03f0.85±0.03g红樱桃Hongyingtao99.67±0.58ef61.67±1.53c9.00±1.00b0.62±0.02c0.09±0.01a叶用萝卜Leaf radish100.00±0.00f97.67±1.53h86.00±3.00i0.98±0.02f0.86±0.03gYura Hama Daikon100.00±0.00f95.00±1.00h94.33±1.53j0.95±0.01f0.94±0.02hTamgocho Hama Daikon97.00±1.00def90.33±1.53g67.67±1.53f0.93±0.01f0.70±0.02e
注:不同小写字母表示在P<0.05水平上具有显著差异。表4同。
Note:Values followed by the different small letters are significantly different at P<0.05. The same as Tab.4 .
2.2 盐胁迫对萝卜幼苗生长的影响
选取耐盐品种Yura Hama Daikon和盐敏感品种五斤红进行幼苗盐胁迫试验,不同浓度盐处理21 d后,与对照相比,无论是耐盐品种还是感盐品种,其株高均明显降低。随着盐处理浓度的增加,这种抑制生长的作用愈加明显(表4,图2-A、B)。耐盐品种Yura Hama Daikon在100,200 mmol/L盐浓度处理后,株高分别降低26.05%,46.18%,盐敏感品种五斤红株高则分别下降35.64%,75.25%。可见耐盐品种株高下降幅度明显低于盐敏感品种。
表4 不同盐浓度处理对耐、感盐萝卜幼苗株高、叶焦指数的影响
Tab.4 Effect of salt stress on the plant height and leaf scorch index in to salt-tolerant and salt-sensitive radish
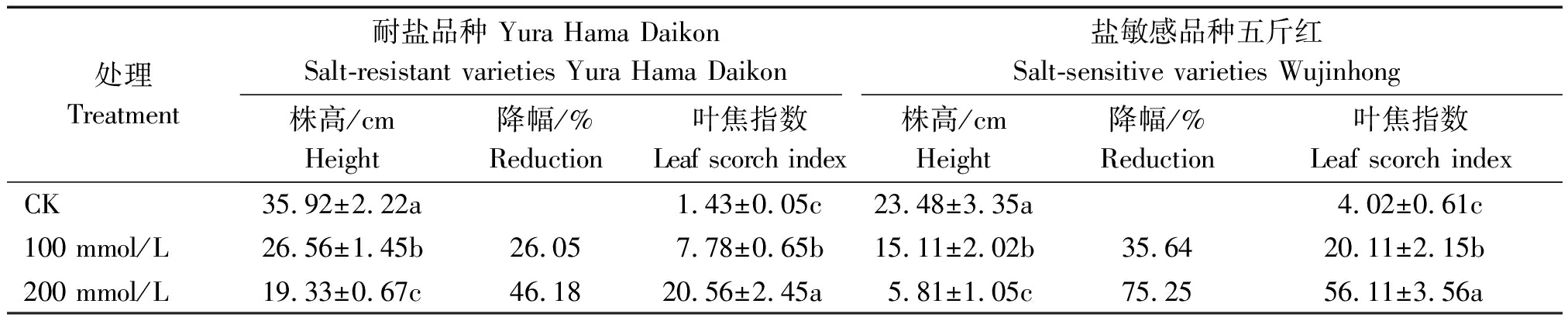
处理Treatment耐盐品种 Yura Hama DaikonSalt-resistant varieties Yura Hama Daikon盐敏感品种五斤红Salt-sensitive varieties Wujinhong株高/cmHeight降幅/%Reduction叶焦指数Leaf scorch index株高/cmHeight降幅/%Reduction叶焦指数Leaf scorch indexCK35.92±2.22a1.43±0.05c23.48±3.35a4.02±0.61c100 mmol/L26.56±1.45b26.057.78±0.65b15.11±2.02b35.6420.11±2.15b200 mmol/L19.33±0.67c46.1820.56±2.45a5.81±1.05c75.2556.11±3.56a

图片左侧为对照;右侧为200 mmol/L盐水处理植株。
Left.Control;Right.200 mmol/L NaCl treatment.
图2 盐胁迫对萝卜品种Yura Hama Daikon(A)和五斤红(B)幼苗株高的影响
Fig.2 Effect of salt stress on the plant height of Yura Hama Daikon (A) and Wujinhong(B)
盐胁迫影响植株生长,主要是由于毒害植株根系和叶片,造成根系减少,叶片黄化焦枯,影响植株的光合作用。本研究通过调查盐胁迫后的植株叶焦指数,研究不同浓度盐处理对植株叶片发育的影响。盐处理21 d后,耐盐品种(Yura Hama Daikon)和感盐品种(五斤红)的叶焦指数均显著升高,且随着盐处理浓度的增加,叶焦指数也显著增加(表4)。在100,200 mmol/L浓度的盐处理后,Yura Hama Daikon的叶焦指数分别为7.78和20.56,明显低于五斤红的叶焦指数(20.11和56.11)。结果表明Yura Hama Daikon的耐盐性显著强于五斤红(图3)。

图3 200 mmol/L盐浓度胁迫对萝卜品种Yura Hama Daikon(A)和五斤红(B)幼苗叶片的影响
Fig.3 Effect of salt stress(200 mmol/L)on leaf growth in Yura Hama Daikon (A) and Wujinhong (B)
2.3 耐、感盐萝卜品种中RsCAT和RsSOD基因的表达模式
盐胁迫会导致植物细胞内活性氧的产生,严重破坏正常新陈代谢,植物可以通过合成抗氧化酶抵御细胞氧化的伤害,其中过氧化氢酶(CAT)和超氧化物歧化酶(SOD)能够清除活性氧,保护细胞减轻伤害。本试验研究了这2个基因在不同盐浓度过程中的表达模式,结果表明:耐、感品种中RsCAT基因的表达量在中等盐浓度(100 mmol/L)及高浓度盐(200 mmol/L)处理后表现出相同的趋势,即随着处理时间的延长呈现先升后降的趋势(图4-A)。但不同盐浓度处理时基因表达量最高值出现的时间不同,100 mmol/L处理时该基因的表达量在7 d达到最高值,耐、感品种间没有显著差异;而200 mmol/L处理时,耐盐品种中该基因表达量持续升高,7 d后达到峰值,而盐敏感品种中该基因的表达量在48 h最高,之后逐渐降低(图4-A)。这表明:较高浓度的盐胁迫能够促使抗过氧化氢酶基因RsCAT在耐盐品种中表达量逐渐升高,且维持的时间较长,通过持续合成抗氧化酶,来减少植株的伤害;而感盐品种中RsCAT基因迅速表达但抗氧化持续能力较弱。
RsSOD基因表达模式与RsCAT不同,100 mmol/L盐处理后,该基因的表达量在14 d时最高,且在耐盐品种中的表达量显著高于盐敏感品种。高盐浓度(200 mmol/L)处理后,耐盐品种的应激响应更迅速,24 h表达量最高,之后维持较高的水平,而盐敏感品种RsSOD的表达量在24 h和7 d均显著低于耐盐品种,其表达量最大值出现在14 d后(图4-B)。
对比RsCAT与RsSOD基因的表达模式,发现虽然二者均为抗氧化基因,但在响应盐胁迫时,RsSOD应激响应更迅速,而RsCAT基因抗氧化作用维持的时间更长,来减轻植株的伤害。
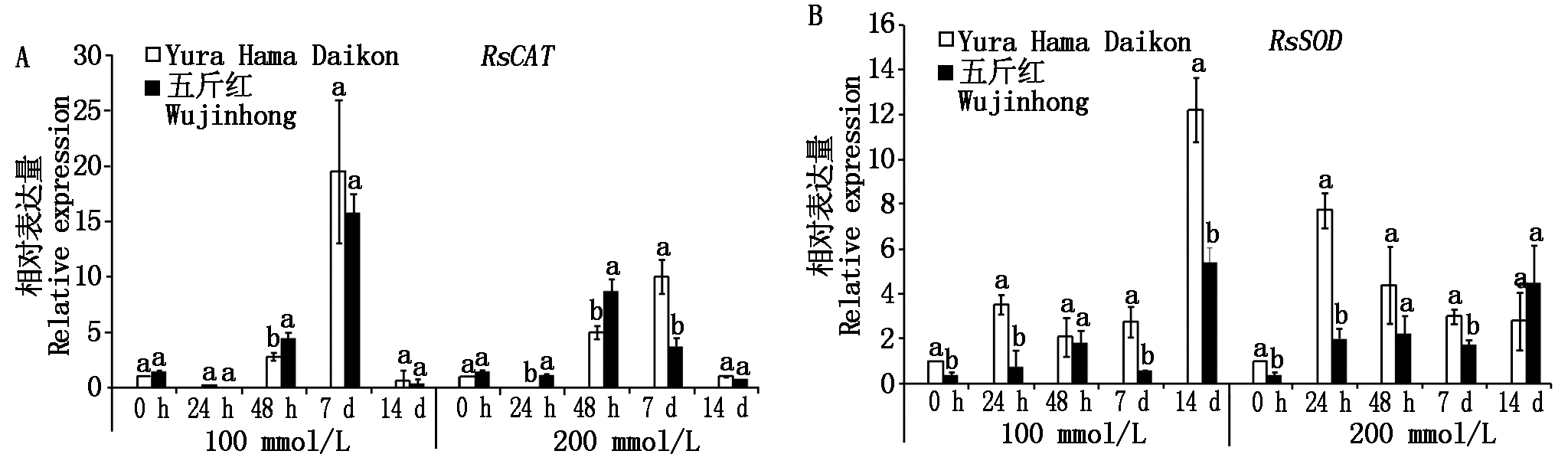
不同小写字母表示同一时间基因表达量在耐、感盐品种间差异显著(P<0.05)。
Different small letters indicate significant difference in gene expression between salt-tolerant and salt-susceptible
varieties at the same time(P<0.05).
图4 盐胁迫响应基因RsCAT (A)和RsSOD (B)在耐、感盐品种中的表达模式
Fig.4 Expression pattern of salt responsive genes RsCAT (A)and RsSOD (B)in Yura Hama
Daikon and Wujinghong
3 讨论与结论
种子萌发期和幼苗期是萝卜对盐胁迫响应最敏感的时期,发芽率、发芽势、根长、苗高可以作为初步筛选植物抗性的依据,这主要是由于种子萌发需要大量水分,高浓度的盐会降低培养皿中的水势,抑制种子吸收水分,进而降低发芽率[13]。基于此,本研究以高浓度盐处理后的发芽率作为指标,筛选出盐敏感品种和耐盐品种。这一结果也在进一步的盐胁迫试验中获得证实,因为根据幼苗株高及叶焦指数等植株生长指标,耐盐品种依然比盐敏感品种表现出较强的耐盐能力;因此,以发芽率作为初步筛选耐盐材料的方法是可靠的。
植物在盐胁迫下会产生大量使细胞发生氧化的活性氧,此时会产生一些毒性物质,如丙二醛。植物具有清除活性氧的酶系,可抵御活性氧对细胞的破坏,包括超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等[14]。CAT和SOD参与盐胁迫的响应以及与植物耐盐性的关系已经在多种作物中报道。Sun等[9]对萝卜品种NAU-YH盐胁迫48 h后的转录组分析表明,盐胁迫能够提高RsSOD的表达量。盐胁迫下CAT基因的表达显著增加,该基因的表达水平也与耐盐性存在相关性[15]。过表达Cu/Zn-SOD或CAT基因的转基因大白菜(Brassica campestris L.)[16]、番茄(Solanum lycopersicum L.)[17]、水稻(Oryza sativa L.)[18]能够显著减少盐胁迫引起的氧化损伤,显著提高盐胁迫的抗性。本研究结果也表明:在盐胁迫下,耐盐品种中RsCAT和RsSOD基因的表达模式不同于盐敏感品种,二者在萝卜响应盐胁迫过程中发挥重要作用。但在同一品种中2个基因的表达模式不同,例如耐盐品种在高浓度盐胁迫条件下,RsSOD在24 h迅速达到最高值,而RsCAT在7 d后达到最高值。这是因为SOD和CAT在清除自由氧时所起的作用不同。盐胁迫引起活性氧大量积累,在清除过程中,首先由SOD将O2-转变成H2O2,再由CAT将H2O2转变成H2O和O2[19]。RsSOD基因先于RsCAT基因发挥作用,所以在响应盐胁迫时,RsSOD应激响应更迅速,而RsCAT基因抗氧化作用维持的时间更长,来减轻植株的伤害。
本研究通过盐胁迫发芽试验发现,大多数材料表现为中等盐敏感耐盐品种,所用的大红袍和樱桃萝卜2个栽培类型表现为盐敏感,这是否意味着这2个萝卜栽培类型普遍具有较弱的耐盐能力,还需要更多的材料数据支持。Nishio等[20]认为Yura Hama Daikon是生长在日本海滨的野生萝卜,很少出现在陆地或河边,具有良好的盐胁迫适应性。本研究结果也证实了该品种具有很好的耐盐性,其耐盐性明显高于栽培萝卜,这为进一步研究萝卜响应盐胁迫的分子机制和选育耐盐品种提供了良好的材料。在后续的研究中,将利用耐、感盐构建遗传群体,筛选耐盐性状关键基因,为创制耐盐新种质提供支撑。
[1] Singh A. Soil salinity: A global threat to sustainable development[J].Soil Use and Management,2021.doi:10.1111/sum.12772.
[2] 李建国,濮励杰,朱明,张润森.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9):1233-1245.doi:10.11821/xb201209008.
Li J G,Pu L J,Zhu M,Zhang R S.The present situation and hot issues in the salt-affected soil research[J].Acta Geographica Sinica,2012,67(9):1233-1245.
[3] Grattan S,Hanson B,Salinity S.Crop salt tolerance[M].USA Davis:Agricultural salinity and drainage University of California Irrigation Program,2006.
[4] Sonneveld C,van den Bos A L.Effects of nutrient levels on growth and quality of radish(Raphanus sativus L.)grown on different substrates[J].Journal of Plant Nutrition,1995,18(3):501-513.doi:10.1080/01904169509364918.
[5] Marcelis L F M,Van Hooijdonk J.Effect of salinity on growth,water use and nutrient use in radish(Raphanus sativus L.)[J].Plant and Soil,1999,215(1):57-64.doi:10.1023/A:1004742713538.
[6] 李会芬.盐胁迫对不同品种萝卜光合作用的影响[J].现代农村科技,2018(12):59-60.doi:10.3969/j.issn.1674-5329.2018.12.043.
Li H F.Effects of salt stress on photosynthesis of different varieties of radish [J].Xiandai Nongcun Keji,2018(12):59-60.
[7] Yuan G F,Wang X P,Guo R F,Wang Q M.Effect of salt stress on phenolic compounds,glucosinolates,myrosinase and antioxidant activity in radish sprouts[J].Food Chemistry,2010,121(4):1014-1019.doi:10.1016/j.foodchem.2010.01.040.
[8] Kumar A, Singh S, Gaurav A K, Srivastava S, Verma J P. Plant growth-promoting bacteria: Biological tools for the mitigation of salinity stress in plants[J].Frontiers in Microbiology,2020,11:1216.doi:10.3389/fmicb.2020.01216.
[9] Sun X C,Xu L,Wang Y,Luo X B,Zhu X W,Kinuthia K B,Nie S S,Feng H Y,Li C,Liu L W.Transcriptome-based gene expression profiling identifies differentially expressed genes critical for salt stress response in radish(Raphanus sativus L.)[J].Plant Cell Reports,2016,35(2):329-346.doi:10.1007/s00299-015-1887-5.
[10] Asada K.THE WATER-WATER CYCLE IN CHLOROPLASTS:Scavenging of active oxygens and dissipation of excess photons[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:601-639.doi:10.1146/annurev.arplant.50.1.601.
[11] Luo X L,Wu J H,Li Y B,Nan Z R,Guo X,Wang Y X,Zhang A H,Wang Z A,Xia G X,Tian Y C.Synergistic effects of GhSOD1 and GhCAT1 overexpression in cotton chloroplasts on enhancing tolerance to methyl viologen and salt stresses[J].PLoS One,2013,8(1):e54002.doi:10.1371/journal.pone.0054002.
[12] Mitsui Y,Shimomura M,Komatsu K,Namiki N,Shibata-Hatta M,Imai M,Katayose Y,Mukai Y,Kanamori H,Kurita K,Kagami T,Wakatsuki A,Ohyanagi H,Ikawa H,Minaka N,Nakagawa K,Shiwa Y,Sasaki T.The radish genome and comprehensive gene expression profile of tuberous root formation and development[J].Sci Rep,2015,5:10835.doi:10.1038/srep10835.
[13] Samarah N H, Bany Hani M M I, Makhadmeh I M. Effect of magnetic treatment of water or seeds on germination and productivity of tomato plants under salinity stress[J].Horticulturae,2021,7(8):220.doi:10.3390/horticulturae7080220.
[14] 刘晓蕊,尚丽霞,蔡勤安,于志晶,马瑞.耐盐转基因植物研究进展[J].东北农业科学,2021,46(4):27-33.doi:10.16423/j.cnki.1003-8701.2021.04.007.
Liu X R,Shang L X,Cai Q A,Yu Z J,Ma R.Research progress of salt tolerant transgenic plants[J].Journal of Northeast Agricultural Sciences,2021,46(4):27-33.
[15] Sharif I, Aleem S, Farooq J, Rizwan M, Younas A, Sarwar G, Chohan S M. Salinity stress in cotton: Effects, mechanism of tolerance and its management strategies[J].Physiology and Molecular Biology of Plants,2019, 25(4): 807-820. doi:10.1007/s12298-019-00676-2.
[16] Tseng M J,Liu C W,Yiu J C.Enhanced tolerance to sulfur dioxide and salt stress of transgenic Chinese cabbage plants expressing both superoxide dismutase and catalase in chloroplasts[J].Plant Physiology and Biochemistry,2007,45(10/11):822-833.doi:10.1016/j.plaphy.2007.07.011.
[17] Wang Y,Wisniewski M,Meilan R Uratsu S L,Cui M G,Dandeker A,Fuchigami L.Ectopic expression of Mn-SOD in Lycopersicon esculentum leads to enhanced tolerance to salt and oxidative stress[J]. Journal of Applied Horticulture,2007,9(1):3-8.doi:10.37855/jah.2007.v09i01.01.
[18] Guan Q J,Liao X,He M L,Li X F,Wang Z Y,Ma H Y,Yu S,Liu S K.Tolerance analysis of chloroplast OsCu/Zn-SOD overexpressing rice under NaCl and NaHCO3 stress[J].PLoS One,2017,12(10):e0186052.doi:10.1371/journal.pone.0186052.
[19] Wang J, Huang R. Modulation of ethylene and ascorbic acid on reactive oxygen species scavenging in plant salt response[J].Frontiers in Plant Science,2019,10:319.doi:10.3389/fpls.2019.00319.
[20] Nishio T,Kitashiba H.The radish genome[M].Berlin:Springer International Publishing,2017:2-3.doi:10.1007/978-3-319-59253-4.