镉(Cd)是植物体内的非必需元素,在土壤中的镉极易被植物吸收,并快速从根部转移至地上部[1],而植物自身缺乏有效的镉代谢途径,因此,镉元素会在植物体内大量富集,会导致植物生长迟滞、光合作用受阻,甚至出现细胞死亡等严重的生理胁迫[2]。随着我国工业化的持续推进,工业废水、废渣携带有大量的镉离子渗透入土壤中。同时纯度不高的农药和化肥中都有镉离子的残留,无节制的施用均导致了农田土壤中镉含量急剧增加[3]。据统计,我国土壤的镉污染情况极其严重,污染超标率高达7.0%[4]。蔬菜产地一般位于集中处理工业废水、废渣的城市近郊,所以蔬菜镉含量极易超标,蔬菜的正常生长发育面临严重威胁[5]。
油菜素内酯(BR)是植物体内重要的固醇类激素,可调控植物种子萌发、光合作用、生殖生长和逆境响应等途径的基因表达和生理代谢[6]。表油菜素内酯(EBR)是一种人工合成的高活性油菜素内酯类似物,生产中常被用作外源油菜素内酯。目前研究发现,EBR对多种植物逆境胁迫具有缓解效应。Singh等[7]在番茄上的研究表明,EBR可以激活番茄中热休克蛋白MT-sHSP合成路径,从而提高番茄抵御高温胁迫的能力;Thussagunpanit等[8]在水稻上的研究表明,表油菜素内酯可以有效提高高温胁迫下水稻种子的发芽率,增加植物体内光合色素的含量,增强植物的光合作用,减轻高温造成的失绿症状;Li等[9]研究表明,在低温胁迫下,EBR可以通过提高辣椒抗氧化酶的活性来减弱逆境下的生理损害;俞明宏等[10]在番茄以及孙维悦等[11]在龙葵上的研究表明,EBR可显著提高镉胁迫下植物的生物量、光能的捕获与转换能力、抗氧化酶活性,并降低镉的转运系数,有效缓解Cd胁迫对植株幼苗生长的抑制作用。近年来,随着我国镉污染的情况不断恶化,农业科学工作者进行了大量关于缓解植物镉胁迫的研究[12-14]。然而,关于表油菜素内酯对镉胁迫下辣椒生理影响和基因表达的研究尚未见报道。
本研究针对辣椒生产中出现的镉污染问题,探究了重度镉胁迫下不同浓度EBR对辣椒幼苗各项生理指标和抗逆相关基因的影响,旨在探讨EBR对辣椒逆境响应的调节机制,丰富辣椒抗逆机制的理论认识,以期为辣椒耐重金属栽培提供一定的理论依据。
供试辣椒品种为晋椒503(Capsicum annuum L. cv. Jinjiao 503),由山西农业大学园艺学院辣椒育种团队提供。镉离子供体CdCl2和表油菜素内酯(EBR)均购自山西半天生物科技有限公司。
1.2.1 种子萌发试验 选取均匀无病害的晋椒503辣椒种子,用灭菌水在室温下浸泡4~5 h;然后用75%乙醇冲洗20 s,15%的NaClO冲洗15 min,灭菌水洗涤3次,放入真空干燥箱40 ℃烘干30 min,播种于72孔的穴盘中,于25 ℃(光/暗,12 h/12 h)光照培养箱中培养;培养12 d后,取长势一致的幼苗,分别移栽至对照组(CK处理液为灭菌水)和5个处理组(表1)的营养箱中。在处理12 d后分别取样测定各指标含量,每处理3次重复。
表1 试验处理
Tab.1 Experimental treatment

处理Treatment土壤营养液Soil nutrient solution叶面营养液Leaf nutrient solutionCK1/2 Hoglang营养液蒸馏水Cd1/2 Hoglang营养液+100 μmol/L Cd2+蒸馏水Cd+EBR501/2 Hoglang营养液+100 μmol/L Cd2+50 μmol/L EBRCd+EBR1001/2 Hoglang营养液+100 μmol/L Cd2+100 μmol/L EBRCd+EBR2001/2 Hoglang营养液+100 μmol/L Cd2+200 μmol/L EBRCd+EBR3001/2 Hoglang营养液+100 μmol/L Cd2+300 μmol/L EBR
1.2.2 幼苗生理指标的测定 叶绿素a、b和类胡萝卜素含量的测定采用丙酮提取法提取晋椒503辣椒幼苗叶片中的光合色素,然后分别在470,649,665 nm波长下记录吸光度;AsA、DHA、GSH、GSSG含量![]() 产生速率和H2O2含量测定采用Murshed等[15]的方法进行。过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)酶活性采用吴雪霞等[16]的方法进行测定。
产生速率和H2O2含量测定采用Murshed等[15]的方法进行。过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)酶活性采用吴雪霞等[16]的方法进行测定。
1.2.3 RNA的提取及荧光定量PCR分析 分别提取CK、Cd和Cd+EBR100 这3个处理辣椒幼苗叶片总RNA(Omega RNA提取试剂盒,USA),采用反转录试剂盒(PrimeScript II cDNA Synthesis Kit,TaKaRa,Japan)进行反转录。
采用SYBR Premix EX Taq TM试剂盒,在ABI 7500 实时荧光定量PCR仪上进行荧光定量PCR分析。反应体系为20 μL,反应条件为95 ℃ 2 min;95 ℃ 15 s,62 ℃ 30 s,40次循环。引物序列见表2。每个样品重复3次,以beta-tubulin 为内参基因,选择24 h的CK处理为参数,采用2-ΔΔCt法计算基因相对表达量。
表2 引物序列
Tab.2 Primers sequence
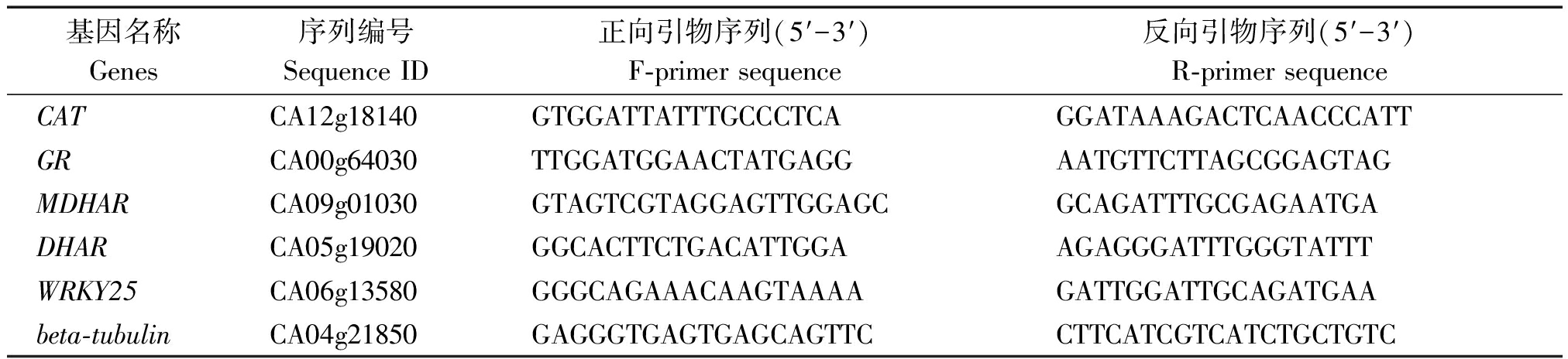
基因名称Genes序列编号Sequence ID正向引物序列(5′-3′)F-primer sequence反向引物序列(5′-3′)R-primer sequenceCATCA12g18140GTGGATTATTTGCCCTCAGGATAAAGACTCAACCCATTGRCA00g64030TTGGATGGAACTATGAGGAATGTTCTTAGCGGAGTAGMDHARCA09g01030GTAGTCGTAGGAGTTGGAGCGCAGATTTGCGAGAATGADHARCA05g19020GGCACTTCTGACATTGGAAGAGGGATTTGGGTATTTWRKY25CA06g13580GGGCAGAAACAAGTAAAAGATTGGATTGCAGATGAAbeta-tubulinCA04g21850GAGGGTGAGTGAGCAGTTCCTTCATCGTCATCTGCTGTC
采用Microsoft Office Excel 2016整理数据和作图;采用SAS 1.2分析数据,采用Duncan法进行多重比较。
由表3可知,与未添加镉的CK相比,添加Cd处理的根长、株高、地上部鲜质量和地下部鲜质量均有显著下降(P<0.05),降幅分别为19.49%,52.57%,32.76%和31.10%;在镉胁迫下,喷施100 μmol/L表油菜素内酯的处理Cd+EBR100比Cd处理的根长显著升高了21.99%(P<0.05),株高显著增长了11.53%(P<0.05),地上部鲜质量显著增长了41.20%(P< 0.05),地下部鲜质量显著增长了33.33%(P<0.05)。说明喷施表油菜素内酯可有效缓解镉胁迫对辣椒幼苗的毒害、促进辣椒幼苗生物量的增加,其中,Cd+EBR100处理的效果最好。
表3 EBR 对镉胁迫下辣椒幼苗生物量的影响
Tab.3 Effect of EBR on biomass of pepper seedlings under cadmium stress
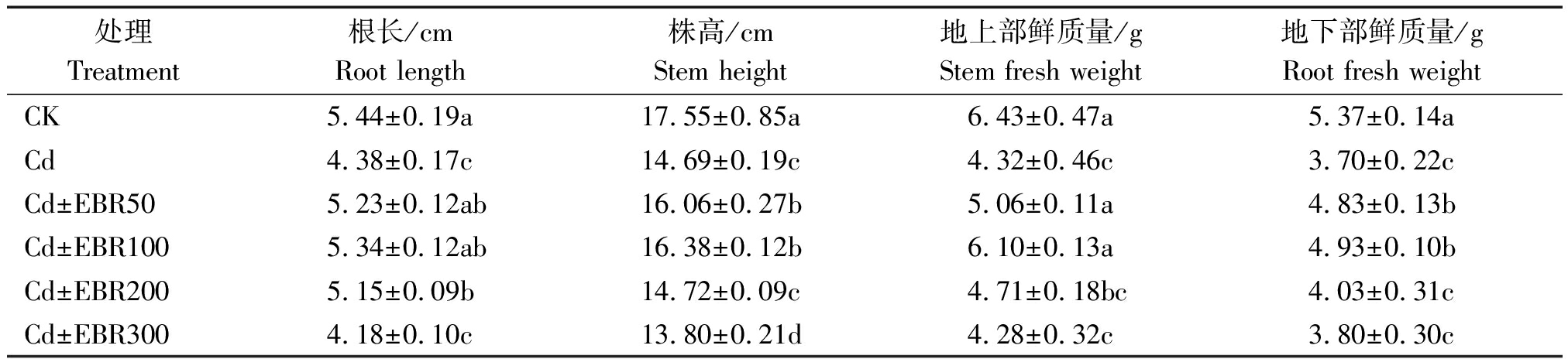
处理Treatment根长/cmRoot length株高/cm Stem height地上部鲜质量/gStem fresh weight地下部鲜质量/gRoot fresh weightCK5.44±0.19a17.55±0.85a6.43±0.47a5.37±0.14aCd4.38±0.17c14.69±0.19c4.32±0.46c3.70±0.22cCd±EBR505.23±0.12ab16.06±0.27b5.06±0.11a4.83±0.13bCd±EBR1005.34±0.12ab16.38±0.12b6.10±0.13a4.93±0.10bCd±EBR2005.15±0.09b14.72±0.09c4.71±0.18bc4.03±0.31cCd±EBR3004.18±0.10c13.80±0.21d4.28±0.32c3.80±0.30c
注:同列不同字母表示在0.05水平差异显著。表 4同。
Note:Different letters represent significant difference at 0.05 level. The same as Tab.4.
由表4可知,与CK相比,镉胁迫下处理的叶绿素a、叶绿素b、类胡萝卜素含量和叶绿素a/叶绿素b均显著降低(P<0.05),降幅分别为47.13%,30.84%,49.99%和23.56%。说明重度镉胁迫对辣椒叶片的光合色素具有明显的抑制作用。在镉离子胁迫下,施加EBR浓度为50 μmol/L的处理(Cd+EBR50)与Cd处理相比,辣椒幼苗叶片的叶绿素a含量显著提高了28.01%(P<0.05),叶绿素b显著提高了32.38%(P<0.05),类胡萝卜素含量显著提高了50.97%(P<0.05);施加EBR浓度为100 μmol/L的处理(Cd+EBR100)与Cd处理相比,辣椒幼苗叶片的绿素a、叶绿素b、类胡萝卜素含量均有显著提高(P<0.05),增幅分别为50.64%,28.31%和63.60%。说明表油菜素内酯可有效提升辣椒光合色素的含量,从而提升幼苗对镉胁迫的耐受性,其中,Cd+EBR50和Cd+EBR100这2个处理的效果较为明显。
表4 EBR 对镉胁迫下辣椒幼苗光合色素的影响
Tab.4 Effect of EBR on photosynthetic pigment of pepper seedlings under cadmium stress
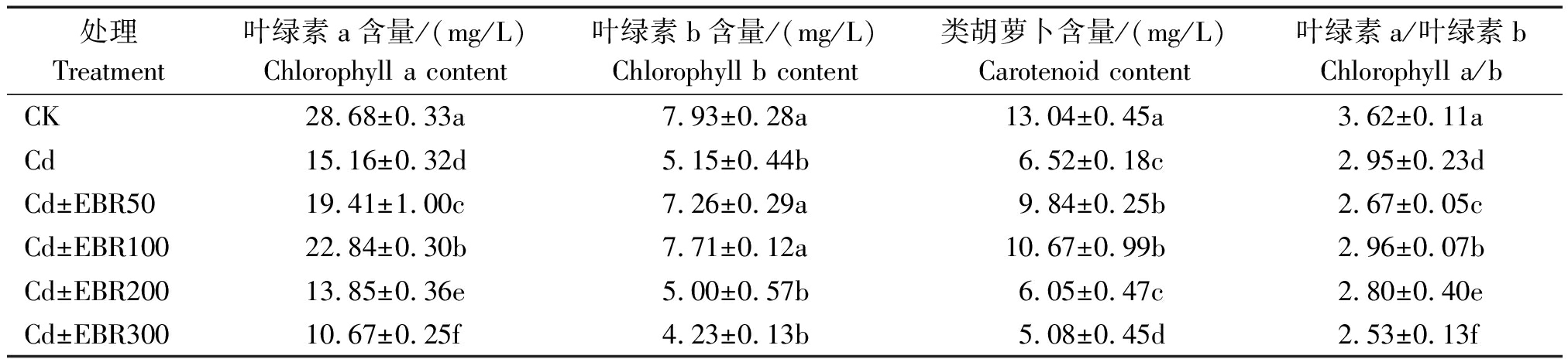
处理Treatment叶绿素a含量/(mg/L)Chlorophyll a content叶绿素b含量/(mg/L)Chlorophyll b content类胡萝卜含量/(mg/L)Carotenoid content叶绿素a/叶绿素bChlorophyll a/bCK28.68±0.33a7.93±0.28a13.04±0.45a3.62±0.11aCd15.16±0.32d5.15±0.44b6.52±0.18c2.95±0.23dCd±EBR5019.41±1.00c7.26±0.29a9.84±0.25b2.67±0.05cCd±EBR10022.84±0.30b7.71±0.12a10.67±0.99b2.96±0.07bCd±EBR20013.85±0.36e5.00±0.57b6.05±0.47c2.80±0.40eCd±EBR30010.67±0.25f4.23±0.13b5.08±0.45d2.53±0.13f
由图1可知,与CK相比,镉胁迫下处理Cd的CAT活性、APX活性、POD活性、SOD活性均显著下降(P<0.05),分别降低了45.94%,34.82%,33.35%和37.88%,说明镉离子对辣椒体内的抗氧化酶活性均有显著的抑制作用;在镉胁迫下,不同浓度的EBR对辣椒叶片中的抗氧化酶活性有明显影响,其中,Cd+EBR100处理的效果最为突出,与Cd处理相比,CAT活性、APX活性、POD活性、SOD活性均显著上升(P<0.05),分别升高了38.44%,103.68%,38.44%和50.04%。值得注意的是,Cd+EBR100处理的APX活性不仅高于Cd处理,还显著高于CK(P<0.05),说明100 μmol/L EBR不仅可以抵消镉离子对辣椒叶片中APX活性的影响,还可以大幅提升APX活性。
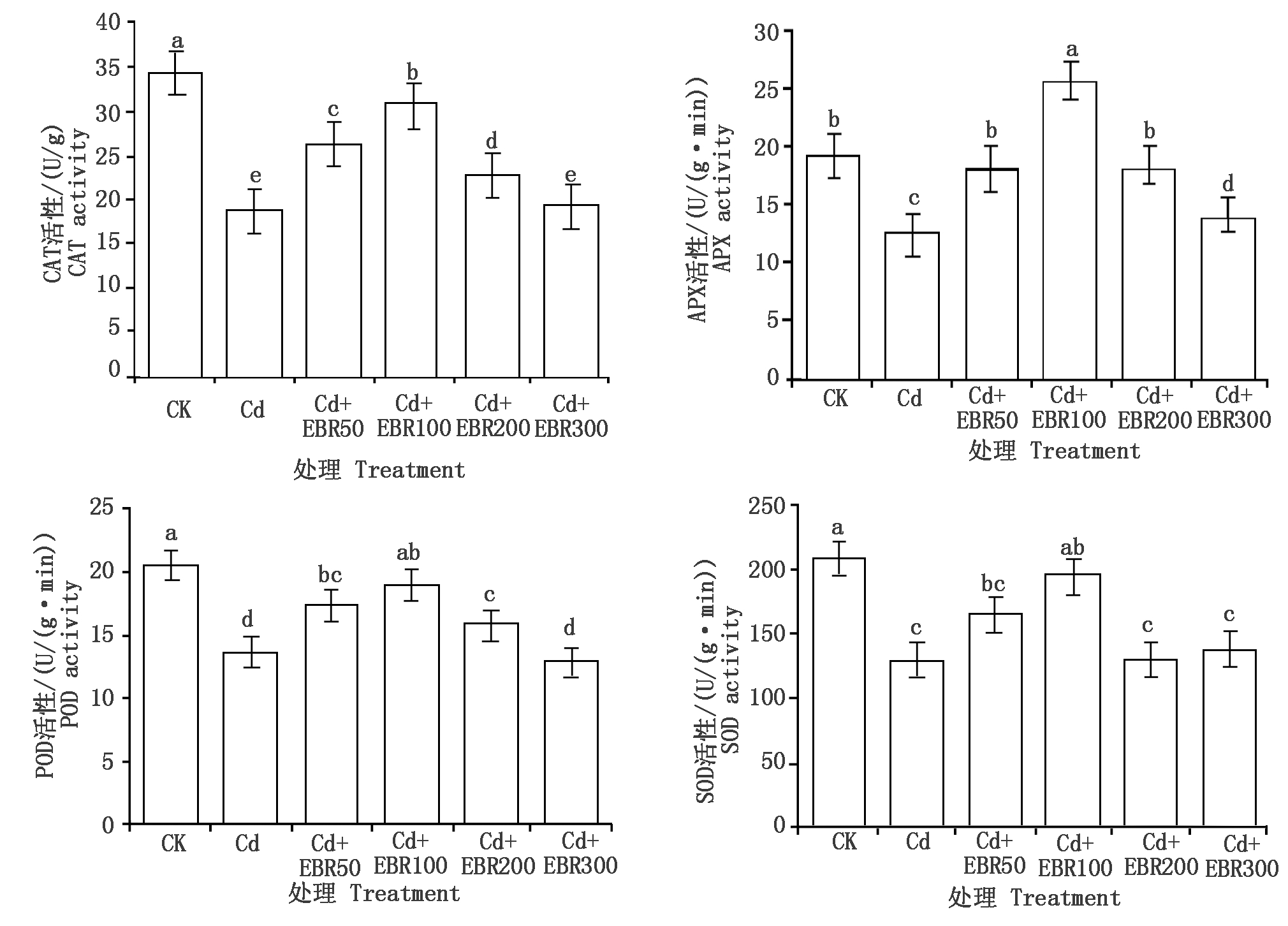
不同字母表示在0.05水平差异显著。图 2-5同。
Different letters represent significant difference at 0.05 level. The same as Fig.2-5.
图1 表油菜素内酯对镉胁迫下辣椒叶片抗氧化物酶活性的影响
Fig.1 Effect of EBR on antioxidant enzyme activity of pepper leaf under cadmium stress
由图2可知,与CK相比,Cd处理的GR活性、DHAR活性(以鲜质量计)有显著降低(P<0.05),降幅分别为27.84%,48.93%;MDHAR活性(以鲜质量计)也有所下降,但差异不显著。在镉胁迫下,EBR50、EBR 100、EBR处理显著降低辣椒叶片GR活性、DHAR活性和MDHAR活性(P<0.05),其中,Cd+EBR100处理的效果最为突出,比Cd处理GR活性上升了38.04%、DHAR活性上升了70.59%、MDHAR活性上升了35.83%。值得注意的是,经过低浓度的EBR(50,100,200 μmol/L)处理的辣椒叶片,MDHAR活性不仅高于Cd处理,同时也高于CK,其中Cd+EBR100处理差异显著(P<0.05)。
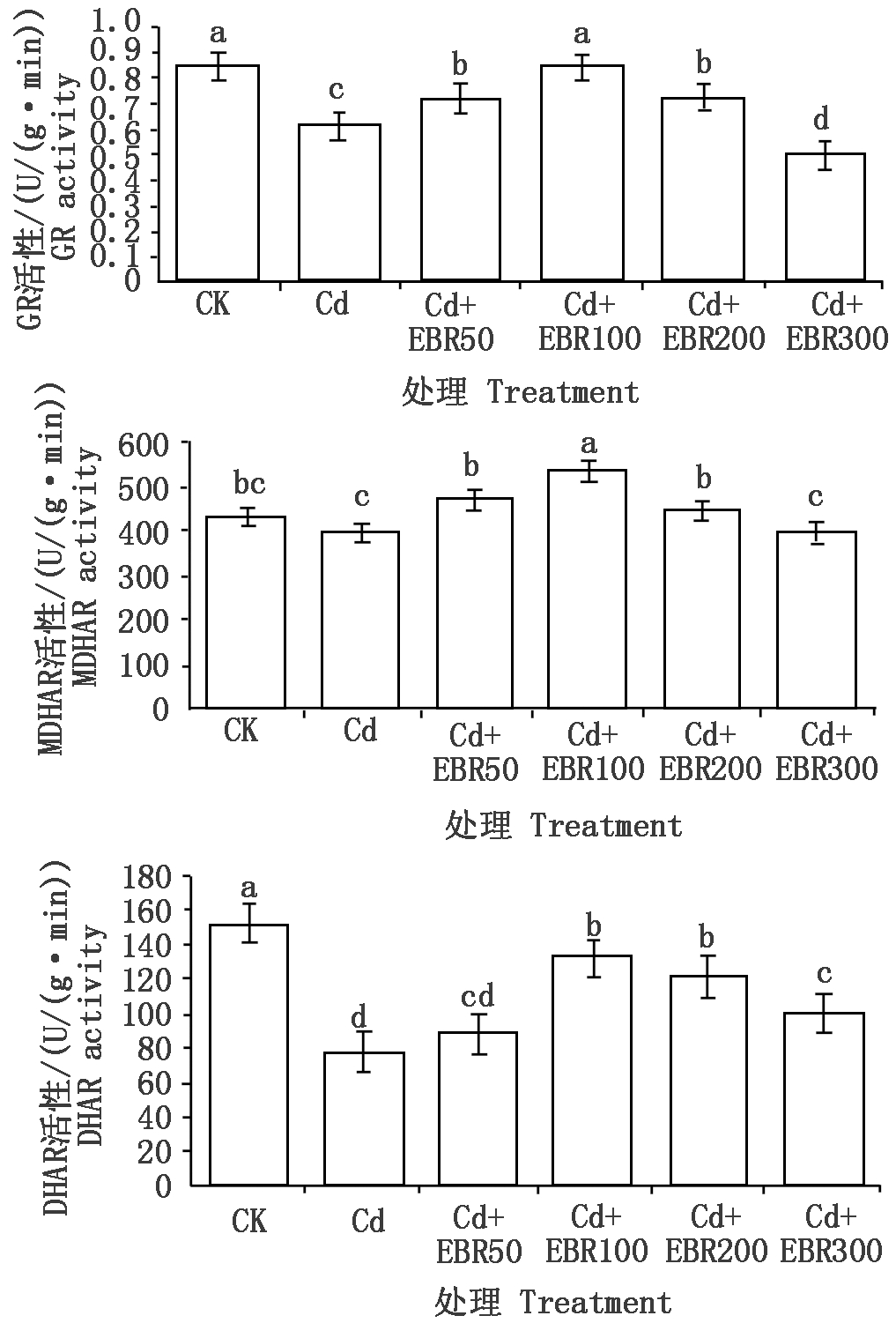
图2 表油菜素内酯对镉胁迫下辣椒叶片
AsA-GSH循环关键酶活性的影响
Fig.2 Effect of EBR on enzymes activity in AsA-GSH
circulation of pepper leaf under cadmium stress
由图3可知,镉胁迫处理(Cd)比CK在GSH、DHA、GSSG含量(以鲜质量计)上有显著升高(P<0.05),增幅分别为21.79%,59.49%,72.47%;而Cd处理的AsA含量(以鲜质量计)、AsA/DHA和GSH/GSSG比CK显著降低(P<0.05),降幅分别为15.96%,47.33%,29.39%。低浓度的EBR(50,100,200 μmol/L)可显著提升镉胁迫下的辣椒叶片AsA含量、GSH含量、AsA/DHA和GSH/GSSG(P<0.05),并显著降低DHA、GSSG含量(P<0.05),其中,Cd+EBR100处理的效果最为突出,与Cd处理相比,AsA含量显著上升了13.44%,GSH含量显著上升了28.79%,AsA/DHA和GSH/GSSG分别显著上升了54.12%,83.66%,DHA、GSSG含量分别显著下降了26.41%,29.90%。
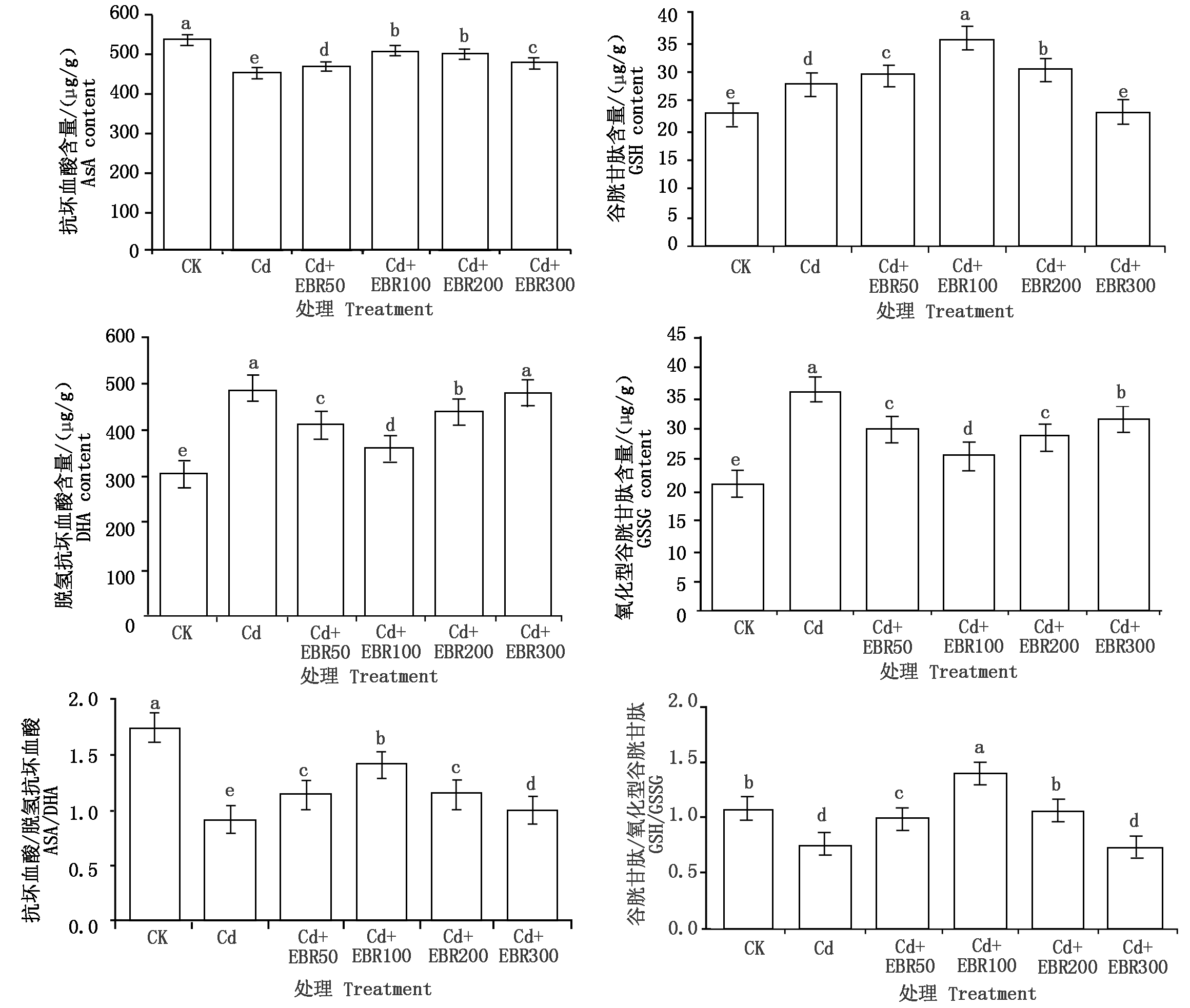
图3 表油菜素内酯对镉胁迫下辣椒叶片AsA-GSH循环的影响
Fig.3 Effect of EBR on AsA-GSH circulation of pepper leaf under cadmium stress
由图4可知,Cd处理比CK在![]() 产生速率和H2O2含量上有显著升高(P<0.05),增幅分别为71.09%,62.80%。说明镉胁迫可显著升高辣椒幼苗叶片中ROS的含量。低浓度的EBR(50,100,200 μmol/L)可显著降低镉胁迫下的辣椒叶片中
产生速率和H2O2含量上有显著升高(P<0.05),增幅分别为71.09%,62.80%。说明镉胁迫可显著升高辣椒幼苗叶片中ROS的含量。低浓度的EBR(50,100,200 μmol/L)可显著降低镉胁迫下的辣椒叶片中![]() 产生速率和H2O2含量(P<0.05),其中,Cd+EBR100处理的效果最为明显,降幅分别为71.09%,62.80%。说明外源表油菜素内酯可有效提升辣椒幼苗清除体内ROS的能力,降低镉胁迫对辣椒的生理损害。
产生速率和H2O2含量(P<0.05),其中,Cd+EBR100处理的效果最为明显,降幅分别为71.09%,62.80%。说明外源表油菜素内酯可有效提升辣椒幼苗清除体内ROS的能力,降低镉胁迫对辣椒的生理损害。
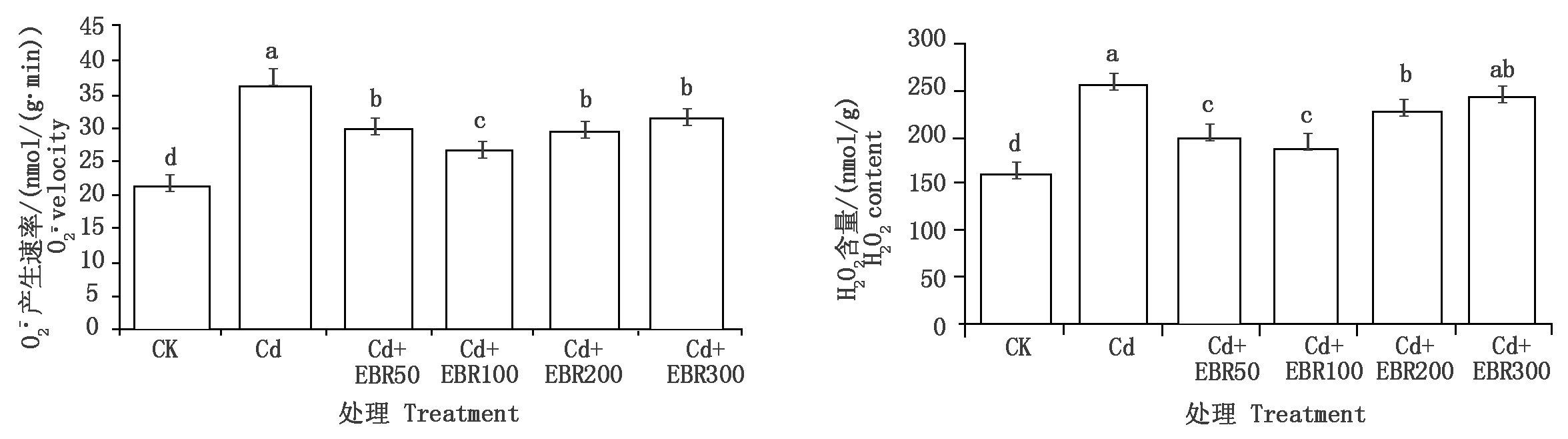
图4 表油菜素内酯对镉胁迫下辣椒叶片![]() 产生速率和H2O2含量的影响
产生速率和H2O2含量的影响
Fig.4 Effect of EBR on ![]() and H2O2 content of pepper leaf under cadmium stress
and H2O2 content of pepper leaf under cadmium stress
由图5可知,与CK相比,Cd处理的辣椒叶片中的DHAR、GR、MDHAR、CAT和WRKY25基因表达量均显著提升(P<0.05),增幅分别为30.67%,21.00%,94.33%,24.67%,433.00%。在镉胁迫下喷施100 μmol/L的表油菜素内酯可显著提高辣椒幼苗叶片中DHAR、MDHAR和WRKY25基因表达量(P<0.05),增幅分别为17.60%,18.01%,36.84%;喷施100 μmol/L的表油菜素内酯不能显著提升GR和CAT基因的表达量。
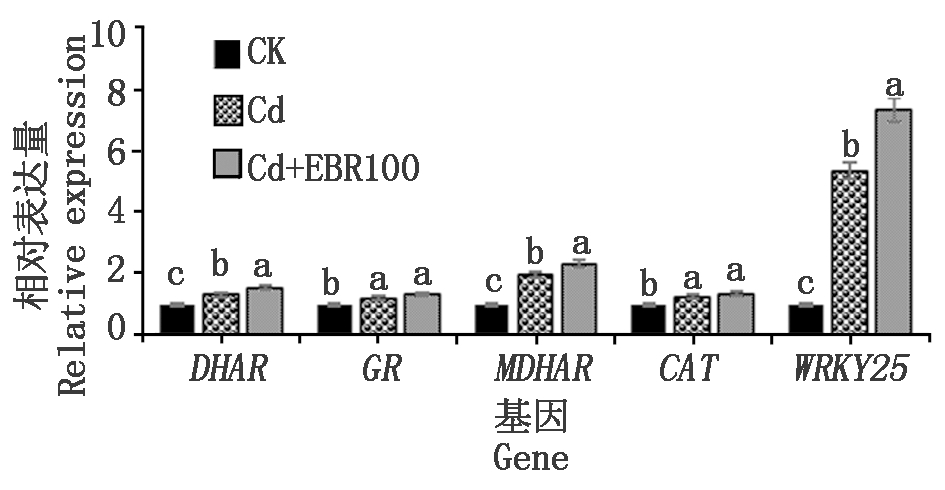
图5 表油菜素内酯对镉胁迫下辣椒叶片
基因相对表达量的影响
Fig.5 Effect of EBR on genes relative expression
of pepper leaf under cadmium stress
镉对植物的影响主要表现在两方面,一方面,低浓度的镉离子可激活植物体内H2O2等信号途径,从而加速体内各项生理生化活动[17];另一方面,高浓度的镉离子会对植物体的正常生长发育和光合作用起到抑制作用,从而降低植物的产量和品质[18]。为了模拟重度镉污染农田对辣椒的生理胁迫,本研究选用了含有高浓度(100 μmol/L)镉离子的营养液培养辣椒幼苗,结果表明,在重度镉胁迫下辣椒幼苗的根长、株高、地上部鲜质量、地下部鲜质量、叶绿素a、叶绿素b和类胡萝卜素含量均有显著下降(P<0.05),而在叶面喷施适量的EBR则可有效提升镉胁迫下辣椒生物量和光合色素含量。说明 EBR可以缓解镉胁迫辣椒幼苗生长发育的抑制和对光合色素的降解,有效保护辣椒光合系统,从而提升幼苗对镉胁迫的耐受性。这与Hayat等[19]和俞明宏等[10]在番茄上的研究结果一致。
植物体内清除ROS机制可分为抗氧化酶和非抗氧化酶2个清除系统,其中,抗氧化酶系统的关键酶为过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX);非抗氧化酶系统又称为抗坏血酸(AsA)-谷胱甘肽(GSH)循环系统,二者协同作用来清除ROS,从而提高植物抗逆性[20],SOD首先将![]() 歧化为H2O2和氧气,产生的H2O2分别由POD催化还原型辅酶代谢、APX 催化AsA 代谢,或者是CAT直接清除,因而抗氧化酶在抵御重金属胁迫中通常具有积极作用。覃勇荣等[21]研究结果表明,低浓度 Cd胁迫可以提高抗氧化酶的活性,然而在高浓度的Cd胁迫下,SOD、POD和 CAT活性则逐渐降低。本研究结果表明,在重度镉胁迫下,辣椒幼苗的抗氧化物酶活性均显著降低(P<0.05),这可能是由于Cd离子替换了这些抗氧化酶活性中心的Mg、Fe和Mn等离子,使这些酶失去原有功能。在对镉胁迫下的辣椒幼苗喷施适当浓度的EBR后,抗氧化物酶活性均显著提高(P<0.05),其中,AXP活性甚至高于未经镉离子处理的CK。
歧化为H2O2和氧气,产生的H2O2分别由POD催化还原型辅酶代谢、APX 催化AsA 代谢,或者是CAT直接清除,因而抗氧化酶在抵御重金属胁迫中通常具有积极作用。覃勇荣等[21]研究结果表明,低浓度 Cd胁迫可以提高抗氧化酶的活性,然而在高浓度的Cd胁迫下,SOD、POD和 CAT活性则逐渐降低。本研究结果表明,在重度镉胁迫下,辣椒幼苗的抗氧化物酶活性均显著降低(P<0.05),这可能是由于Cd离子替换了这些抗氧化酶活性中心的Mg、Fe和Mn等离子,使这些酶失去原有功能。在对镉胁迫下的辣椒幼苗喷施适当浓度的EBR后,抗氧化物酶活性均显著提高(P<0.05),其中,AXP活性甚至高于未经镉离子处理的CK。
AsA-GSH循环系统是植物体内清除ROS的重要途径,AsA和GSH均可直接还原ROS,分别形成氧化态的DHA和GSSG,从而完成对ROS的清除。GSH的硫醇基团对镉离子有很高的亲和性,可迅速结合大量的镉离子生成螯合肽,从而降低植物体内镉离子浓度,缓解镉胁迫效应。Aravind等[22]研究表明,AsA 含量少的植物对逆境胁迫更加敏感,长时间的镉胁迫会造成AsA含量显著降低。GR、DHAR和MDHAR是AsA-GSH循环系统的关键酶,其中,GR可将氧化态的GSSG还原为GSH[23],MDHAR和DHAR可分别将单脱氢抗坏血酸(MDHA)和DHA还原为AsA,从而实现GSH和AsA的循环再生[24]。本研究结果表明,在重度镉胁迫下,辣椒叶片的GR活性、DHAR活性有显著降低(P<0.05),MDHAR活性略有降低,但差异不显著;GSH、DHA、GSSG含量上有显著升高(P<0.05),AsA含量、AsA/DHA和GSH/GSSG比CK有显著降低(P<0.05)。说明辣椒在镉胁迫下可通过调高体内GSH含量来螯合镉离子,从而降低镉胁迫对细胞的生理胁迫;但是由于镉离子使得GR和DHAR失活、使得GSSG和DHA无法快速转变为GSH和AsA,造成AsA含量、AsA/DHA和GSH/GSSG的显著降低,ROS的非抗氧化酶系统受到抑制,造成体内ROS的大量积累。同时,本研究结果还表明,添加适量的EBR可显著提升辣椒叶片GR活性、DHAR活性和MDHAR活性(P<0.05),从而提升AsA含量、GSH含量、AsA/DHA和GSH/GSSG,并显著降低DHA、GSSG含量(P<0.05)。说明EBR可通过激活AsA-GSH循环系统关键酶活性来提升AsA-GSH的循环速率,通过提高AsA-GSH循环系统还原态与氧化态的比例来应对镉离子引起的细胞氧化胁迫。
在非胁迫状态下,植物细胞内的![]() 和H2O2等ROS的产生和清除处于动态平衡状态,而过多的镉离子会打破该平衡状态,使ROS在细胞内大量积累,引起细胞膜脂过氧化,造成细胞氧化胁迫,影响植物的生长发育、光合作用、逆境响应[25]。本研究结果表明,在镉胁迫下,辣椒幼苗
和H2O2等ROS的产生和清除处于动态平衡状态,而过多的镉离子会打破该平衡状态,使ROS在细胞内大量积累,引起细胞膜脂过氧化,造成细胞氧化胁迫,影响植物的生长发育、光合作用、逆境响应[25]。本研究结果表明,在镉胁迫下,辣椒幼苗![]() 产生速率和H2O2含量有显著升高,添加适量的EBR可有效清除辣椒体内ROS。重度镉胁迫下辣椒体内的抗氧化酶和非抗氧化酶2个清除系统受到明显抑制,造成体内的ROS大量积累,而添加外源表油菜素内酯则可显著提高这2个清除系统的相关酶活性,从而提高抗氧化酶系统和AsA-GSH循环系统清除ROS的效率,有效缓解镉离子对植株的胁迫效应。
产生速率和H2O2含量有显著升高,添加适量的EBR可有效清除辣椒体内ROS。重度镉胁迫下辣椒体内的抗氧化酶和非抗氧化酶2个清除系统受到明显抑制,造成体内的ROS大量积累,而添加外源表油菜素内酯则可显著提高这2个清除系统的相关酶活性,从而提高抗氧化酶系统和AsA-GSH循环系统清除ROS的效率,有效缓解镉离子对植株的胁迫效应。
基因的转录调控是植物应对逆境的重要机制,当植物受到干旱、高温和重金属离子等逆境胁迫时会激发相应信号途径调控下游抗逆基因的表达,增强植物的抗逆能力[26-27]。WRKY家族参与调控植物体内多条激素信号转导途径,与植物逆境响应密切相关,对植物对逆境的抵抗能力具有一定的调控能力[28-30]。Cai等[31]在大豆上筛选出了29个响应镉胁迫的WRKY家族基因,在大豆和拟南芥中超表达GmWRKY142基因后,植株均获得了更强的耐镉性,同时该基因还可调控多个植物激素信号基因的表达。本研究结果表明,重度镉胁迫可显著提高辣椒叶片中的DHAR、GR、MDHAR、CAT和WRKY25基因表达量(P<0.05),说明高浓度的镉离子可直接或间接激活辣椒体内抗逆基因的表达,来响应过度积累的ROS带来的生理损害,然而高浓度的镉离子占据或替换GR、CAT和DHAR的活性中心,显著降低酶活性,使其无法行使正常功能,从而进一步加剧了胁迫损害。同时,本研究还表明,喷施100 μmol/L的表油菜素内酯可显著提高辣椒幼苗叶片中DHAR、MDHAR和WRKY25基因表达量(P<0.05),却不能显著提升GR和CAT基因的表达量。说明EBR可有效调控DHAR、MDHAR和WRKY25基因表达,进而提升DHAR、MDHAR的活性,并激活WRKY家族主导的信号通路,提升辣椒对ROS的清除能力和对镉离子的耐受性;而EBR对GR和CAT活性的增强则更有可能作用于翻译后修饰水平,具体调控机制还有待进一步研究。
[1] Smeets K,Opdenakker K,Remans T,Forzani C,Hirt H,Vangronsveld J,Cuypers A. The role of the kinase OXI1 in cadmium-and copper-induced molecular responses in Arabidopsis thaliana[J].Plant, Cell & Environment,2013,36(6):1228-1238.doi:10.1111/pce.12056.
[2] 鲜靖苹,王勇,马晖玲.一氧化氮信号途径参与草地早熟禾耐镉机制的研究[J].草地学报,2019,27(6):1577-1586.
Xian J P,Wang Y,Ma H L. Study on cadmium-resistant mechanism of Poa pratensis mediated by no signaling pathway[J].Acta Agrestia Sinica,2019,27(6):1577-1586.
[3] 杨颂娟,王秋月,华丽君,黄真池. 镉胁迫对桉树(Eucalyptus)保护酶活性及相关基因表达的影响[J].分子植物育种,2020,18(6):2006-2012.doi:10.13271/j.mpb.018.002006.
Yang S J,Wang Q Y,Hua L J,Huang Z C. Effects of cadmium stress on protective enzymes activity and related genes expression in Eucalyptus[J].Molecular Plant Breeding,2020,18(6):2006-2012.
[4] 陈能场,郑煜基,何晓峰,李小飞,张晓霞. 《全国土壤污染状况调查公报》探析[J].农业环境科学学报,2017,36(9):1689-1692. doi:10.11654/jaes.2017-1220.
Chen N C,Zheng Y J,He X F,Li X F,Zhang X X. Analysis of the report on the national general survey of soil contamination[J].Journal of Agro-Environment Science,2017,36(9):1689-1692.
[5] 胡文海,詹秀花,闫小红,王旭明,黄黎锋. 24-表油菜素内酯对干旱胁迫下辣椒幼苗叶片抗氧化酶系统及耐旱相关基因表达的影响[J].植物研究,2015,35(6):908-914. doi:10.7525/j.issn.1673-5102.2015.06.019.
Hu W H,Zhan X H,Yan X H,Wang X M,Huang L F. Effects of 24-epibrassinolide on antioxidant system and expression of drought-tolerance relative genes in pepper seedlings under drought stress[J].Bulletin of Botanical Research,2015,35(6):908-914.
[6] Demirci T,Çelikkol Akçay U,Göktürk Baydar N. Effects of 24-epibrassinolide and l-phenylalanine on growth and caffeic acid derivative production in hairy root culture of Echinacea purpurea L. Moench[J].Acta Physiologiae Plantarum,2020,42(4):1-11. doi:10.1007/s11738-020-03055-7.
[7] Singh I,Shono M. Physiological and molecular effects of 24-epibrassinolide,a brassinosteroid on thermotolerance of tomato[J].Plant Growth Regulation,2005,47(2/3):111-119. doi:10.1007/s10725-005-3252-0.
[8] Thussagunpanit J,Jutamanee K,Kaveeta L,Chai-Arree W,Pankean P,Homvisasevongsa S,Suksamrarn A. Comparative effects of brassinosteroid and brassinosteroid mimic on improving photosynthesis,lipid peroxidation,and rice seed set under heat stress[J].Journal of Plant Growth Regulation,2015,34(2):320-331. doi:10.1007/s00344-014-9467-4.
[9] Li J,Yang P,Gan Y T,Yu J H,Xie J M. Brassinosteroid alleviates chilling-induced oxidative stress in pepper by enhancing antioxidation systems and maintenance of photosystem Ⅱ[J].Acta Physiologiae Plantarum,2015,37(11):1-11. doi:10.1007/s11738-015-1966-9.
[10] 俞明宏,王力明,刘继,李焕秀,林立金,唐懿. 表油菜素内酯对镉胁迫下番茄幼苗生长及镉累积的影响[J].中国土壤与肥料,2020(3):151-156. doi:10.11838/sfsc.1673-6257.19467.
Yu M H,Wang L M,Liu J,Li H X,Lin L J,Tang Y. Effects of epibrassinolide on the growth and cadmium accumulation of tomato seedlings under cadmium stress [J].Soil and Fertilizer Sciences in China,2020(3):151-156.
[11] 孙维悦,于丽杰,金晓霞,董延龙. 2,4-EBL对不同浓度镉胁迫下龙葵(Solanum nigrum L.)幼苗的缓解作用[J].分子植物育种,2019,17(11):3735-3745. doi:10.13271/j.mpb.017.003735.
Sun W Y,Yu L J,Jin X X,Dong Y L. Alleviation effects of 2,4-EBL on seedlings of Solanum nigrum L. under different concentration of cadmium stress[J].Molecular Plant Breeding,2019,17(11):3735-3745.
[12] Sanjari S,Keramat B,Nadernejad N,Mozafari H. Ameliorative effects of 24-epibrassinolide and thiamine on excess cadmium-induced oxidative stress in Canola(Brassica napus L.)plants[J].Journal of Plant Interactions,2019,14(1):359-368. doi:10.1080/17429145.2019.1637952.
[13] Chen L,Long C,Wang D,Yang J Y. Phytoremediation of cadmium(Cd)and uranium(U)contaminated soils by Brassica juncea L. enhanced with exogenous application of plant growth regulators[J].Chemosphere,2020,242:125112. doi:10.1016/j.chemosphere.2019.125112.
[14] Jan S,Alyemeni M N,Wijaya L,Alam P,Siddique K H,Ahmad P. Interactive effect of 24-epibrassinolide and silicon alleviates cadmium stress via the modulation of antioxidant defense and glyoxalase systems and macronutrient content in Pisum sativum L. seedlings[J].BMC Plant Biology,2018,18(1):146. doi:10.1186/s12870-018-1359-5.
[15] Murshed R,Lopez-Lauri F,Sallanon H. Effect of water stress on antioxidant systems and oxidative parameters in fruits of tomato(Solanum lycopersicon L,cv. Micro-tom)[J].Physiology and Molecular Biology of Plants,2013,19(3):363-378. doi:10.1007/s12298-013-0173-7.
[16] 吴雪霞,张圣美,杨左芬,朱宗文,张爱冬,尚静,田守波,查丁石. 短期温度胁迫对西葫芦叶片抗坏血酸代谢系统的影响[J].上海农业学报,2020,36(1):53-58. doi:10.15955/j.issn1000-3924.2020.01.09.
Wu X X,Zhang S M,Yang Z F,Zhu Z W,Zhang A D,Shang J,Tian S B,Zha D S. Effects of short-low and high temperature stress on ascorbic acid metabolism system in squash seedlings leaves[J].Acta Agriculturae Shanghai,2020,36(1):53-58.
[17] 王小红,郭军康,贾红磊,李艳萍,吕欣,任倩. 外源水杨酸缓解镉对番茄毒害作用的研究[J].农业环境科学学报,2019,38(12):2705-2714. doi:10.11654/jaes.2019-0754.
Wang X H,Guo J K,Jia H L,Li Y P,Lü X,Ren Q. The effect of exogenous salicylic acid on alleviating cadmium toxicity in tomato plants[J].Journal of Agro-Environment Science,2019,38(12):2705-2714.
[18] 方志刚,胡朝阳,蔡庆生. 两个多花黑麦草品种对镉胁迫的生理响应及其镉耐性差异[J].植物生理学报,2020,56(5):1033-1042. doi:10.13592/j.cnki.ppj.2019.0532.
Fang Z G,Hu Z Y,Cai Q S. Physiological response to cadmium stress and differences in cadmium tolerance of two Lolium multiflorum cultivars[J].Plant Physiology Journal,2020,56(5):1033-1042.
[19] Hayat S,Alyemeni M N,Hasan S A. Foliar spray of brassinosteroid enhances yield and quality of Solanum lycopersicum under cadmium stress[J].Saudi Journal of Biological Sciences,2012,19(3):325-335. doi:10.1016/j.sjbs.2012.03.005.
[20] Kaya C. Nitrate reductase is required for salicylic acid-induced water stress tolerance of pepper by upraising the AsA-GSH pathway and glyoxalase system[J].Physiologia Plantarum,2020,15(6):13153-13160. doi:10.1111/ppl.13153.
[21] 覃勇荣,汤丰瑜,严海杰,白新高,刘旭辉. 重金属胁迫对任豆种子萌发及幼苗抗氧化酶活性的影响[J].种子,2017,36(10):31-36. doi:10.16590/j.cnki.1001-4705.2017.10.031.
Qin Y R,Tang F Y,Yan H J,Bai X G,Liu X H. Effects of heavy metal stress on seed germination and seedlings antioxidant enzyme activity of Zenia insigni[J].Seed,2017,36(10):31-36.
[22] Aravind P,Prasad M N V. Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zinc involves ascorbate-glutathione cycle and glutathione metabolism[J].Plant Physiology and Biochemistry,2005,43(2):107-116. doi:10.1016/j.plaphy.2005.01.002.
[23] Feng J,Chen L C,Zuo J R. Protein S-Nitrosylation in plants:Current progresses and challenges[J].Journal of Integrative Plant Biology,2019,61(12):1206-1223. doi:10.1111/jipb.12780.
[24] Shan C J,Wang B S,Sun H L,Gao S,Li H. H2S induces NO in the regulation of AsA-GSH cycle in wheat seedlings by water stress[J].Protoplasma,2020,257(5):1487-1493. doi:10.1007/s00709-020-01510-3.
[25] Liang Y L,Zheng P,Li S,Li K Z,Xu H N. nitrate reductase-dependent NO production is involved in H2S-induced nitrate stress tolerance in tomato via activation of antioxidant enzymes[J].Scientia Horticulturae,2018,229(2):207-214. doi:10.1016/j.scienta.2017.10.044.
[26] Xu Z G,Ge Y,Zhang W,Zhao Y L,Yang G Y. The walnut JrVHAG1 gene is involved in cadmium stress response through ABA-signal pathway and MYB transcription regulation[J].BMC Plant Biology,2018,18(1):19. doi:10.1186/s12870-018-1231-7.
[27] Yang Q L,Yao C L,Wang Z Y. Acute temperature and cadmium stress response characterization of small heat shock protein 27 in large yellow croaker,Larimichthys crocea[J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2012,155(2):190-197. doi:10.1016/j.cbpc.2011.08.003.
[28] Wang P J,Yue C,Chen D,Zheng Y C,Zhang Q,Yang J F,Ye N X. Genome-wide identification of WRKY family genes and their response to abiotic stresses in tea plant(Camellia sinensis)[J].Genes & Genomics,2019,41(1):17-33. doi:10.1007/s13258-018-0734-9.
[29] Zhao L,Zhang W,Song Q,Xuan Y,Li K,Cheng L,Qiao H,Wang G,Zhou C. A WRKY transcription factor,TaWRKY40-D,promotes leaf senescence associated with jasmonic acid and abscisic acid pathways in wheat[J].Plant Biology ,2020,22(6):1072-1085. doi:10.1111/plb.13155.
[30] Zhu D,Hou L X,Xiao P L,Guo Y,Deyholos M K,Liu X. VvWRKY30,a grape WRKY transcription factor,plays a positive regulatory role under salinity stress[J].Plant Science,2019,280:132-142. doi:10.1016/j.plantsci.2018.03.018.
[31] Cai Z D,Xian P Q,Wang H,Lin R B,Lian T X,Cheng Y B,Ma Q B,Nian H. Transcription factor GmWRKY142 confers cadmium resistance by up-regulating the cadmium tolerance 1-like genes[J].Frontiers in Plant Science,2020,11:724. doi:10.3389/fpls.2020.00724.