羊草(Leymus chinensis)别称碱草,广泛分布于36°~62° N、92°~132° E,是一种生态幅度宽广的旱中型植物[1],具有抗逆性强、粗蛋白含量高、产量高等优良特性,在改善我国北方草原生态环境、发展草原畜牧业方面发挥着重要作用[2]。通常情况下,生长在天然草原的羊草经常面临极端气温、土壤养分贫瘠和盐碱胁迫的挑战。目前,已有学者从生理学层面对羊草如何响应逆境胁迫进行了研究。通常情况下,逆境胁迫时羊草的发芽率下降,株高、叶面积、地上生物量等生长指标受到显著抑制[3];叶片气孔阻力增大,光合效率与蒸腾速率减弱[4];无机离子含量发生明显变化[5],多种酶活性受到抑制[6]。通过提高空气中CO2浓度[7],施用适当浓度的油菜素内酯、5-氨基乙酰丙酸等植物生长调节剂或氮、磷、钾等叶面营养[8-10]有助于羊草体内脯氨酸(Proline,Pro)、丙二醛(Malondialdehyde,MDA)、有机酸的合成[11-12]以及超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)活性的增强[13-14],能够有效缓解逆境胁迫对羊草生长带来的危害。另一方面,随着测序技术的快速发展,羊草的基因组学研究也逐渐开展,学者们开始深入到分子生物学层面探讨羊草的抗逆性机制,尤其是在优良抗逆性基因的挖掘方面已取得重要成果。目前已在羊草体内鉴定到的抗逆基因很多,如抗盐胁迫基因LcLHP[15],抗盐碱的铁蛋白基因FER[16]、Na+/H+逆向转运蛋白基因NHX1[17],抗低温的叶绿体基因FIN2[18]以及抗旱基因WRKY5[19]等。
钙是植物生长发育必需的矿质元素,一方面Ca2+参与维持细胞壁、细胞膜结构的稳定[20];另一方面Ca2+作为细胞内的第二信使,参与多种生理生化过程及酶活性的调节[21-22]。近年来,钙对植物抗逆性的影响研究备受关注。加入外源钙能在一定程度上缓解胁迫对植物的伤害[23],这一方法已广泛应用于小麦[24]、燕麦[25]、苜蓿[26]等植物的抗逆性研究中,但是关于钙是否能帮助提高羊草抗逆性的生理研究还较为匮乏,因此,基于无菌培养皿体系,通过模拟盐、碱、渗透、低温胁迫并向培养基中加入不同浓度的CaCl2溶液,对CaCl2在羊草应对4种非生物胁迫时的调节作用进行了分析,可为提高羊草耐受性提供参考依据。
1 材料和方法
1.1 试验材料
羊草种子于2018年9月采自内蒙古呼和浩特市和林格尔县,地理坐标为40°31′32.47″N,111°50′33.22″E。现保存于牧草与特色作物生物学教育部重点实验室。
1.2 试验方法
1.2.1 培养基的配制 全营养培养基(CK)的配制:以1 L为例,0.5 mol/L MES 10 mL,100×MS Fe盐5 mL,1 mol/L H3PO4 1 mL,1 mol/L CaCl2 1 mL,1 mol/L MgSO4 1 mL,100×MS MnSO4 5 mL,200×MS微量元素2.5 mL,1 mol/L KNO3 5 mL,BTP调节溶液pH值至5.7,加入1%蔗糖与1.1%琼脂。121 ℃高温高压灭菌20 min,倒入10 cm×10 cm的方形塑料培养皿中,凝固后备用。
1.2.2 试验处理 在CK的基础上,通过改变培养基中的NaCl浓度模拟盐胁迫,改变pH值模拟碱胁迫,改变Mannitol浓度模拟渗透胁迫,改变羊草幼苗的生长温度模拟低温胁迫。每种试验处理设置5个生物学重复。具体试验处理如下:含不同浓度CaCl2(0,1,20 mmol/L)并含不同浓度NaCl(0,150 mmol/L);含不同浓度CaCl2(0,1,20 mmol/L)并含不同pH值(5.7,8.5);含不同浓度CaCl2(0,1,20 mmol/L)并含不同浓度Mannitol(0,300 mmol/L);含不同浓度CaCl2(0,1,20 mmol/L)并含不同生长温度(23,4 ℃)。
1.2.3 钙对盐、碱、渗透胁迫下羊草幼苗生长特性的影响 将羊草种子浸泡于去离子水中,置于4 ℃冰箱内,5 d后挑取已沉底种子,用含有5% NaClO+0.1% Triton X-100的溶液消毒30 min,之后用去离子水清洗6次,备用。消毒后的羊草种子播种在不同试验处理的培养基中,置于生长室内黑暗春化2 d后进行竖直培养。光照11 d后,观察表型并拍照,测量根长、叶长、鲜质量数据。生长室的培养条件为:(22±2)℃,光周期为12 h光照/12 h黑暗,光照强度150 μmol/(m2·s)。
1.2.4 钙对低温胁迫下羊草幼苗生长与生理特性的影响 利用RDN-400D-3型人工气候箱对供试羊草进行培养,通过改变气候箱中的昼/夜温度模拟低温胁迫。将消毒后的羊草种子分别播种在3种不同浓度CaCl2的培养基上,置于人工气候箱内(对照组:昼/夜为23 ℃/23 ℃)黑暗春化2 d后,分别放入23 ℃/23 ℃、23 ℃/4 ℃环境中进行竖直培养。光照11 d后,观察表型,采集根长、叶长、鲜质量数据,并拍照。同时利用苏州科铭生物技术有限公司生产的试剂盒(http://www.cominbio.com/)对羊草叶中的丙二醛(Malondialdehyde,MDA)、还原型谷胱甘肽(Reduced glutathione,GSH)、还原型抗坏血酸(Ascorbic acid,AsA)含量及超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、谷胱甘肽还原酶(Glutathione reductase,GR)酶活性进行测定。
1.3 统计分析
应用Excel 2010软件进行数据整理,SPSS 16.0软件进行统计分析,用Dunnett法比较不同处理间的差异。
2 结果与分析
2.1 钙对盐胁迫下羊草种子发芽率和幼苗生长特性的影响
2.1.1 钙对盐胁迫下羊草种子发芽率的影响 由图1可知,与0 mmol/L NaCl相比,相同CaCl2浓度下150 mmol/L NaCl胁迫会显著抑制羊草种子萌发(P<0.05)。0 mmol/L NaCl条件下,3种不同浓度CaCl2的培养基上,羊草种子的发芽率为96.23%~99.04%,不同处理间的差异不显著(P>0.05)。150 mmol/L NaCl胁迫时,当补加CaCl2浓度由0 mmol/L增加至1~20 mmol/L时,羊草种子的发芽率由28.57%提高至85.00%,当补加1 mmol/L CaCl2后羊草种子发芽率显著提高。
2.1.2 钙对盐胁迫下羊草幼苗生长特性的影响 由图2可知,与0 mmol/L NaCl相比,相同CaCl2浓度下150 mmol/L NaCl胁迫时羊草幼苗的根长、叶长和鲜质量都显著降低(P<0.05),其中根长降低18.87%~25.49%,叶长降低47.18%~51.18%,鲜质量降低50.32%~74.47%。由此可见,150 mmol/L NaCl胁迫时羊草幼苗的生长受到抑制。0 mmol/L NaCl条件下,3种不同浓度CaCl2的培养基上,羊草幼苗的根长、叶长和鲜质量均无显著差异(P>0.05)。150 mmol/L NaCl胁迫时,当外源CaCl2浓度为0 mmol/L时,羊草幼苗的生长受到显著抑制,羊草幼苗的根长、叶长数据无法准确采集,只采集到其鲜质量数据;当外源CaCl2浓度增加至1 mmol/L时,羊草幼苗的根长、叶长和鲜质量显著增加(P<0.05),其中鲜质量增加了90.36%。当外源CaCl2浓度由1 mmol/L增加至20 mmol/L时,羊草幼苗的根长、叶长和鲜质量均无显著性差异(P>0.05)。综上所述,补加1 mmol/L外源CaCl2能有效缓解150 mmol/L NaCl胁迫对羊草幼苗生长的抑制作用。
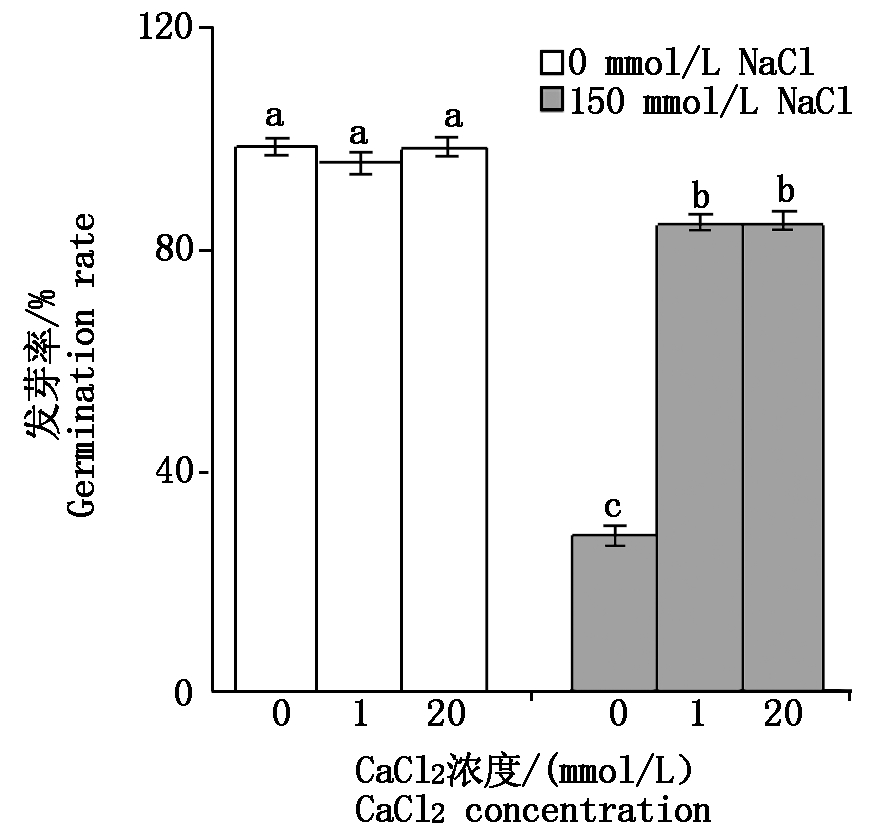
不同小写字母表示处理间差异显著(P<0.05)。图2-6同。
Different lowercase letters indicate significant differences
between treatments at P<0.05. The same as Fig.2-6.
图1 钙对盐胁迫下羊草种子发芽率的影响
Fig.1 Effect of calcium on germination rate of Leymus
chinensis seedlings under salt stress
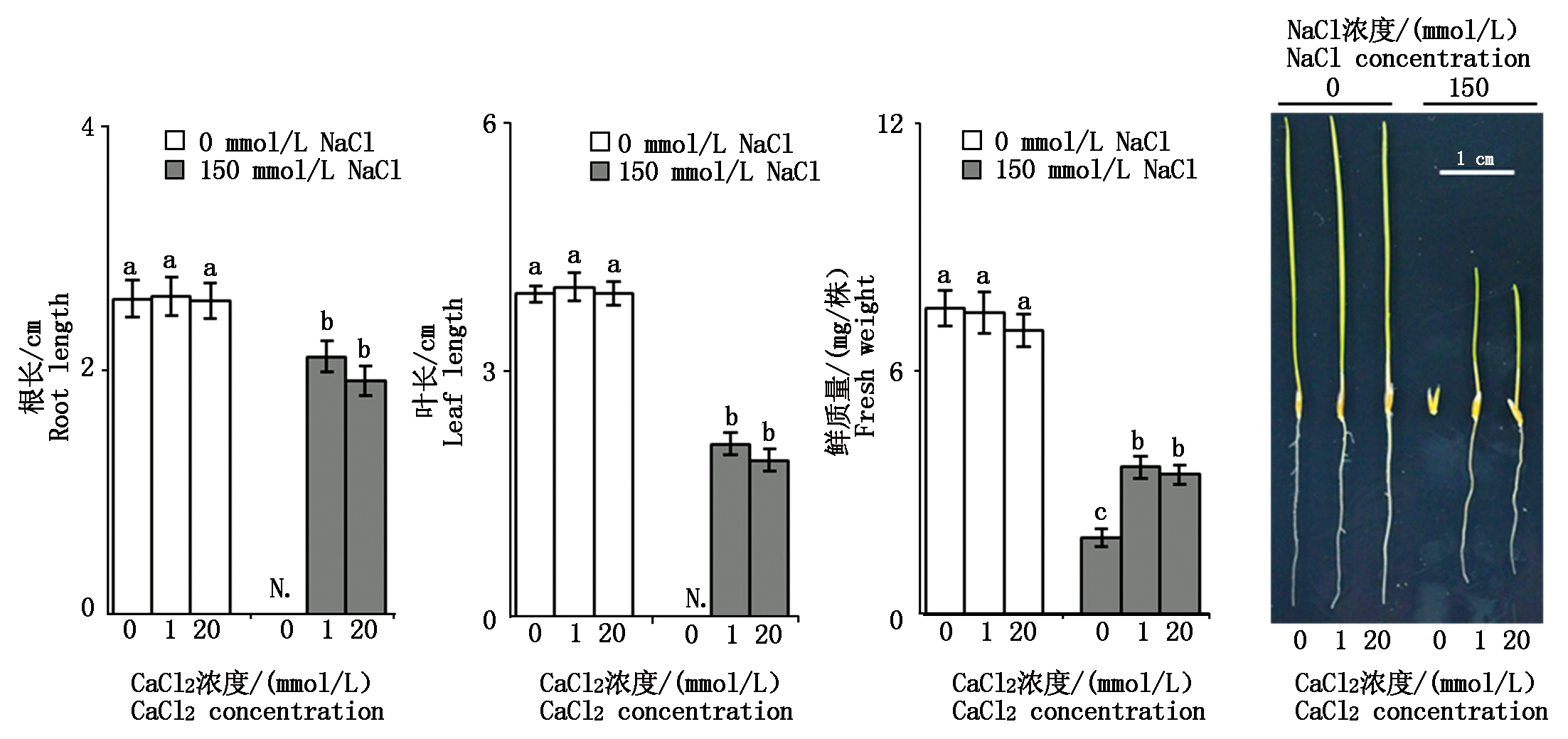
图2 钙对盐胁迫下羊草幼苗生长特性的影响
Fig.2 Effect of calcium on growth characteristics of Leymus chinensis seedlings under salt stress
2.2 钙对碱胁迫下羊草幼苗生长特性的影响
由图3可知,与pH值5.7相比,相同CaCl2浓度下pH值8.5胁迫时羊草幼苗的根长、叶长、鲜质量基本都降低,其中根长降低10.71%~20.35%,叶长降低40.84%~47.84%,鲜质量降低43.15%~47.69%。结果表明,pH值8.5胁迫时羊草幼苗的生长受到抑制。pH值5.7条件下,3种不同浓度CaCl2的培养基上,羊草幼苗的根长、叶长和鲜质量均无显著性差异(P>0.05)。pH值8.5胁迫时,3种不同浓度CaCl2的培养基上,羊草幼苗的叶长和鲜质量均无显著性差异(P>0.05)。当培养基中CaCl2浓度由0 mmol/L增加至1 mmol/L时,羊草幼苗的根长增加14.94%;当CaCl2浓度由1 mmol/L增加至20 mmol/L时,羊草幼苗的根长下降10.00%。总的来说,补加外源CaCl2并未有效缓解pH值8.5胁迫对羊草幼苗生长的抑制作用。
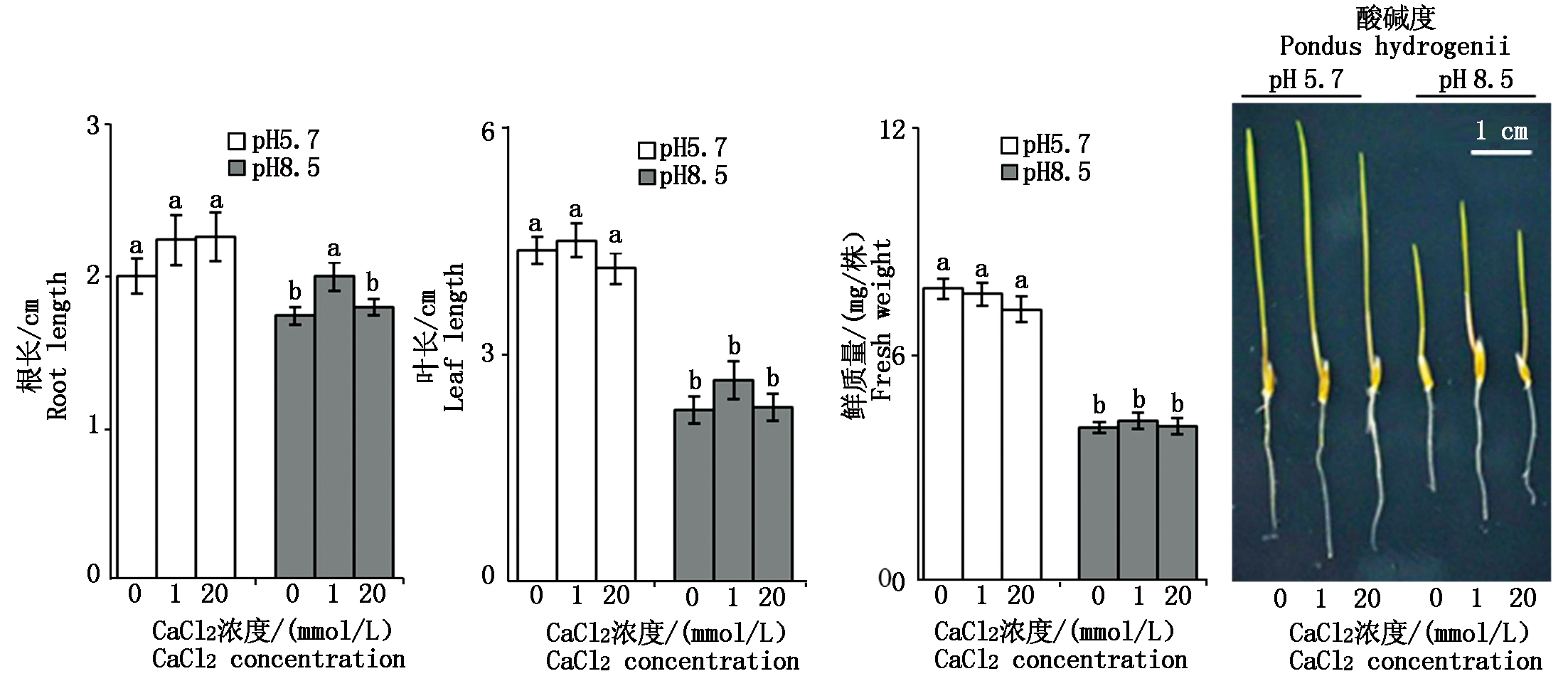
图3 钙对碱胁迫下羊草幼苗生长特性的影响
Fig.3 Effect of calcium on growth characteristics of Leymus chinensis seedlings under alkali stress
2.3 钙对渗透胁迫下羊草幼苗生长特性的影响
由图4可知,与0 mmol/L Mannitol相比,相同CaCl2浓度下300 mmol/L Mannitol胁迫时羊草幼苗的根长、叶长和鲜质量均显著降低(P<0.05),其中根长降低27.70%~35.20%,叶长降低47.14%~50.00%,鲜质量降低38.35%~41.74%。结果表明,300 mmol/L Mannitol胁迫时羊草幼苗的生长受到抑制。0 mmol/L Mannitol条件下,3种不同浓度CaCl2的培养基上,羊草幼苗的根长、叶长和鲜质量均无显著性差异(P>0.05)。300 mmol/L Mannitol胁迫时,3种不同浓度CaCl2的培养基上,羊草幼苗的根长、叶长和鲜质量均无显著性差异(P>0.05)。结果表明,补加外源CaCl2并未有效缓解300 mmol/L Mannitol胁迫对羊草幼苗生长的抑制作用。

图4 钙对渗透胁迫下羊草幼苗生长特性的影响
Fig.4 Effect of calcium on growth characteristics of Leymus chinensis seedlings under osmotic stress
2.4 钙对低温胁迫下羊草幼苗生长和生理特性的影响
2.4.1 钙对低温胁迫下羊草幼苗生长特性的影响 由图5可知,与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草幼苗的叶长、鲜质量显著降低(P<0.05),其中叶长降低23.72%~49.12%,鲜质量降低26.91%~43.35%。当CaCl2浓度为0 mmol/L,4 ℃胁迫时羊草的根长会显著降低20.19%;当CaCl2浓度为1 mmol/L时,对照和低温胁迫下羊草的根长差异不显著(P>0.05);当CaCl2浓度为20 mmol/L,4 ℃胁迫时羊草的根长会显著降低20.85%。总的来说,4 ℃低温胁迫时羊草幼苗的生长受到抑制。23 ℃生长条件下,3种不同浓度CaCl2的培养基上,羊草幼苗的根长、叶长和鲜质量均无显著性差异(P>0.05)。4 ℃胁迫时,当外源CaCl2浓度由0 mmol/L增加至1 mmol/L时,羊草幼苗的根长、叶长与鲜质量均显著增加(P<0.05),其中根长增加19.88%,叶长增加18.10%,鲜质量增加23.25%。当CaCl2浓度由1 mmol/L增加至20 mmol/L时,羊草幼苗的根长会下降16.08%,而叶长与鲜质量分别增加了19.71%,11.90%。综上所述,补加20 mmol/L外源CaCl2能有效缓解4 ℃低温胁迫对羊草幼苗生长的抑制作用。
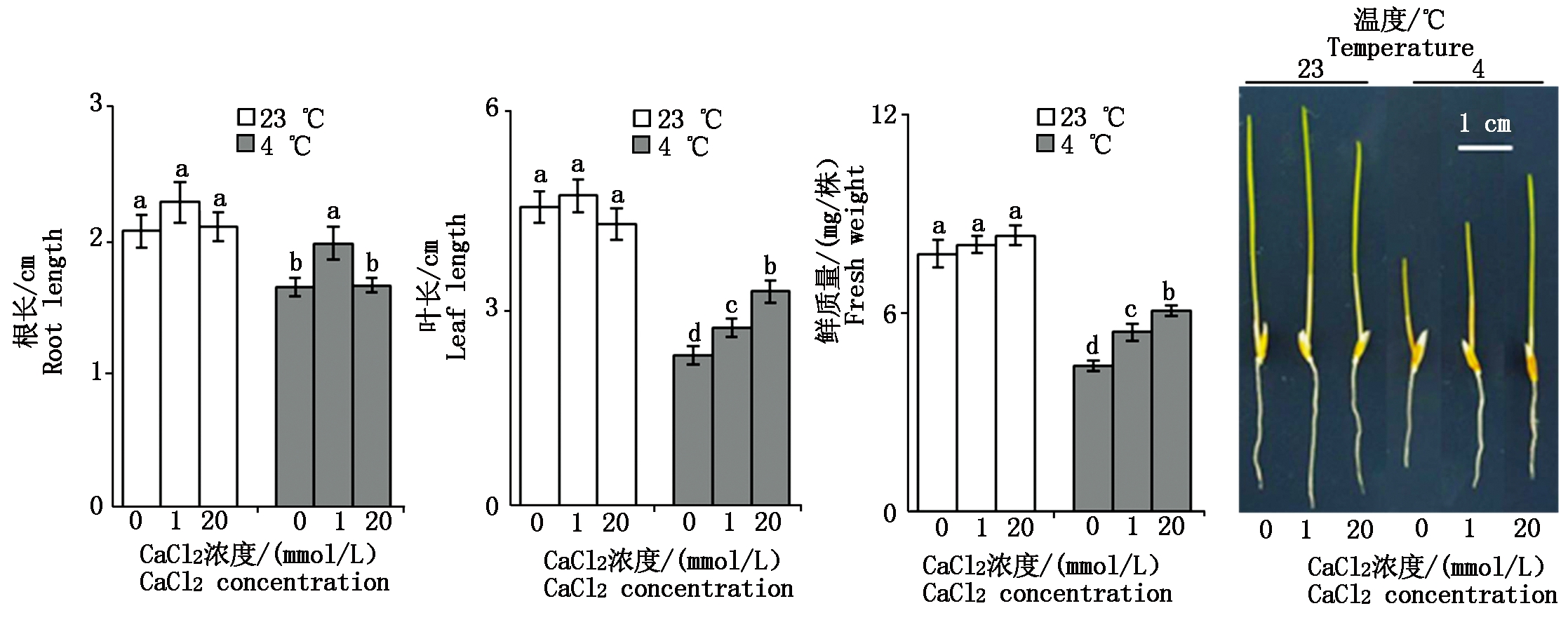
图5 钙对低温胁迫下羊草幼苗生长特性的影响
Fig.5 Effect of calcium on growth characteristics of Leymus chinensis seedlings under cold stress
2.4.2 钙对低温胁迫下羊草的膜脂过氧化物和保护酶活性的影响 MDA是植物在遭遇逆境胁迫时膜脂过氧化物作用的产物,其含量大小间接反映了细胞膜受损程度。由图6可知,与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中MDA含量(以鲜质量计)显著升高(P<0.05)。4 ℃胁迫时,补加外源CaCl2后羊草叶中MDA含量会显著下降(P<0.05)。当补加CaCl2浓度分别为1,20 mmol/L时,MDA含量分别降低了27.41%,36.78%,这表明补加外源CaCl2能降低羊草叶中MDA的积累量,有效缓解低温胁迫对膜的损害。
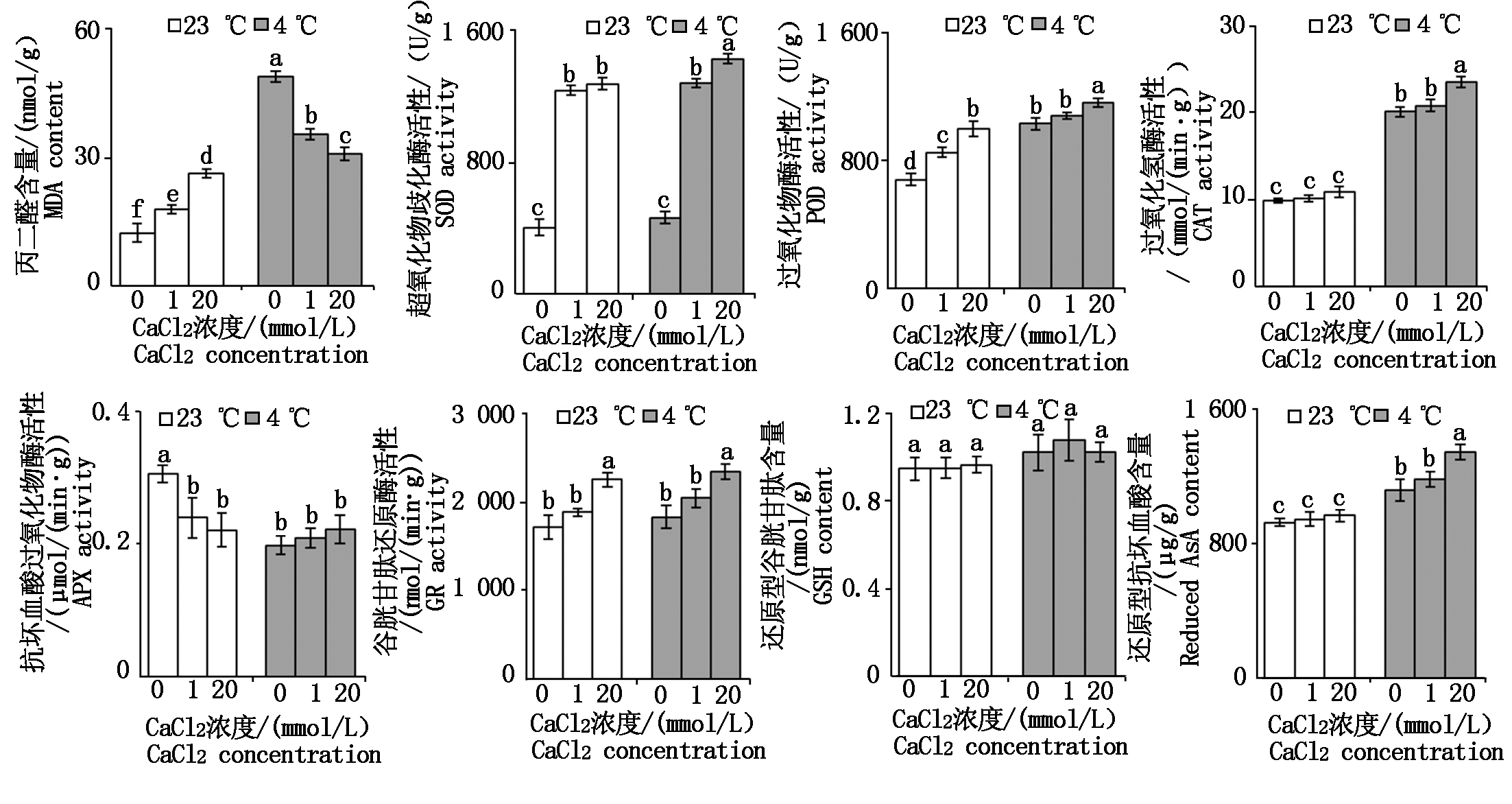
图6 钙对低温胁迫下羊草叶中膜脂过氧化和保护酶活性的影响
Fig.6 Effects of calcium on membrane lipid peroxidation and activity
of protective enzymes in shoots of Leymus chinensis seedlings under cold stress
与对照(23 ℃)相比,当CaCl2浓度在0~1 mmol/L时,4 ℃胁迫对羊草叶中SOD活性(以鲜质量计)影响不显著(P>0.05);当CaCl2浓度为20 mmol/L时,SOD活性显著增加11.68%。4 ℃胁迫时,当外源CaCl2浓度由0 mmol/L增加至1~20 mmol/L时,羊草叶中SOD活性提高至原来的1.73~2.03倍。当CaCl2浓度为20 mmol/L时,羊草叶中SOD活性最高。
与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中POD活性(以鲜质量计)显著增强了15.89%~50.58%。4 ℃胁迫时,补加1 mmol/L CaCl2时对羊草叶中POD活性无显著影响,补加20 mmol/L CaCl2时POD活性显著增加7.41%~12.60%。
与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中CAT活性(以鲜质量计)显著提高至原来的1.02~1.14倍。4 ℃胁迫时,补加1 mmol/L CaCl2时对羊草叶中CAT活性无显著影响,补加20 mmol/L CaCl2时CAT活性显著增加12.87%~17.01%。
与对照(23 ℃)相比,当CaCl2浓度为0 mmol/L时4 ℃胁迫时羊草叶中APX活性(以鲜质量计)显著降低了35.16%,当CaCl2浓度在1~20 mmol/L时4 ℃胁迫对APX活性影响不显著(P>0.05)。4 ℃胁迫时,补加外源CaCl2对羊草叶中APX活性无显著影响(P>0.05)。
与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中GR活性未发生显著变化(P>0.05)。4 ℃胁迫时,补加1 mmol/L CaCl2对羊草叶中GR活性无显著影响,补加20 mmol/L CaCl2时GR活性显著增加14.52%~27.95%。
与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中GSH含量(以鲜质量计)未发生显著变化(P>0.05)。4 ℃胁迫时,3种不同浓度CaCl2的培养基上,羊草叶中GSH含量均无显著性差异(P>0.05)。
与对照(23 ℃)相比,相同CaCl2浓度下4 ℃胁迫时羊草叶中还原型AsA含量(以鲜质量计)显著增加了20.50%~38.94%。4 ℃胁迫时,补加1 mmol/L CaCl2对羊草叶中还原型AsA含量无显著影响,补加20 mmol/L CaCl2时还原型AsA含量显著增加13.90%~20.31%。
总的来说,低温胁迫下,补加20 mmol/L CaCl2时羊草叶中MDA含量降低,SOD、POD、CAT、GR活性增强,还原型AsA含量增加,羊草的抗寒能力明显提高。
3 讨论与结论
3.1 钙调节羊草非生物胁迫耐受性的作用
本研究发现,150 mmol/L NaCl胁迫时羊草种子发芽率、根长、叶长和鲜质量均显著下降,羊草生长受到抑制。这是因为高浓度的NaCl能置换细胞膜上的Ca2+,使得膜结合的Na+/Ca2+增加,导致膜结构受到损伤,通透性增加,引起细胞内溶质外渗[27];此外,NaCl胁迫下植物的净光合速率和蒸腾速率呈下降趋势[28],将会影响光合作用、矿质元素吸收等生理活动过程,致使植物生长受阻,生物量减少[29-30]。当补加外源CaCl2后羊草种子的发芽率提高,根长、叶长、鲜质量增加,表明CaCl2能有效缓解盐胁迫对羊草幼苗生长的抑制作用,这与Genc等[31]、杨利艳等[32]在研究Ca2+对小麦萌发及抗盐性效应时得出的结果一致,即一定浓度的CaCl2能促进种子萌发、缓解盐害对幼苗生长的抑制作用。引起该结果的原因可能是由于补加外源Ca2+后细胞膜脂组分中的磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PG)、磷脂酰甘油(PA)含量增加,高水平的磷脂可结合更多的Ca,增大质膜磷脂单层的稳定性,改变蛋白质结构,使得Na+、氯化物不易进入细胞[33],在一定程度上降低质膜的透性及膜脂过氧化程度;另外,外源Ca2+的加入能弥补植物自身因Ca2+不足引起的营养胁迫,维持植物体内矿质元素(K、Ca)的正常代谢吸收[34]。然而当补加CaCl2浓度在1~20 mmol/L时,羊草种子发芽率、根长、叶长、鲜质量没有发生显著变化,说明并非外源Ca2+浓度越高羊草幼苗的抗盐性越强,这与韩志平等[35]、李春燕等[36]的研究得出的结论相似。盐胁迫条件下补加外源CaCl2时,Ca2+本身会产生盐胁迫[36],而Cl-大量累积也会加重盐胁迫,此时植物细胞内的脂质含量下降,对细胞膜结构完整性造成损伤[37],最终导致植物的生长受抑制。
pH值8.5胁迫或300 mmol/L Mannitol胁迫时,羊草幼苗的根长、叶长和鲜质量等生长指标均受到显著影响,但是补加1~20 mmol/L CaCl2后并未有效缓解碱胁迫或渗透胁迫对羊草幼苗生长的抑制作用,这与Chen等[38]、宋新妍等[39]、姜义宝等[40]的类似研究结果存在差异。Chen等[38]在研究盐碱胁迫与外源Ca2+交互作用对多花黑麦草生长和渗透调节的影响时发现,当外源Ca2+浓度为6 mmol/L时,黑麦草叶片中脯氨酸含量最低,叶绿素含量、根系活力和Mg2+含量最高,植株生长受抑状况得到显著改善。宋新妍等[39]在研究钙处理对小麦抗旱性的影响时发现,100 mmol/L CaCl2喷施处理小麦苗期叶片能使Pro、可溶性糖含量增加,MDA含量降低,SOD活性升高。姜义宝等[40]在研究钙处理对苜蓿幼苗抗旱性的影响时发现,20 mmol/L CaCl2处理能有效提高苜蓿的抗旱性。本研究与以往类似研究结论不一致的原因可能与外源CaCl2浓度、植物种类、胁迫程度等多个因素密切相关。
4 ℃低温胁迫时,羊草幼苗的生长受到了抑制,根长、叶长和鲜质量显著下降,这与张燕[41]在研究不同温度对羊草形态特征的影响时得出的结论一致,即低温处理会显著降低羊草的株高、干鲜质量、根系活力。补加CaCl2后羊草幼苗在低温胁迫下的受抑制作用得到显著缓解,为了深入分析钙的调节作用,对加入CaCl2前后羊草幼苗体内的生理指标进行了测定。结果发现,低温胁迫时羊草叶中MDA含量、POD、CAT活性显著增加,这表明低温胁迫时羊草体内的活性氧过多积累导致膜脂过氧化,此时抗氧化系统开始发挥作用。当补加外源CaCl2后羊草叶中MDA含量降低,SOD、POD、CAT、GR活性及还原型AsA含量增加,这与胡丽涛[24]、张丽等[42]、Shi等[43]在研究外源CaCl2在小麦、裸燕麦、百慕达草应对冷胁迫时所起的调节作用结果一致。Ca2+是植物体内的一种信号分子,当低温胁迫发生时,位于质膜及内质网膜上的Ca2+通道打开,此时细胞质Ca2+浓度将发生变化,产生钙信号。Ca2+与受体蛋白CaM结合形成多功能的调节蛋白Ca2+-CaM,调控Ca2+-ATPase等下游靶蛋白酶的活性,继而引发相应的生理响应以抵御逆境胁迫[24]。
3.2 研究不足之处
生长在自然条件下的羊草常受到极端气温、土壤养分贫瘠和盐碱胁迫的影响,不仅严重损害了它的产量与品质,甚至会阻碍畜牧业的持续发展。因此,本研究在模拟盐、碱、渗透和低温4种非生物胁迫的基础上,重点探讨了添加外源CaCl2是否有助于提高羊草幼苗的耐受性。然而研究中仍存在些许不足之处:非生物胁迫下,羊草幼苗的生长受到了抑制,但是仅选取了低温这一因素深入分析了加入CaCl2前后羊草幼苗体内多种防御酶的变化。这是因为①150 mmol/L NaCl胁迫下,当外源CaCl2为0 mmol/L时羊草种子的发芽率极低,幼苗的生长发育受到显著抑制,收集到的羊草幼苗无法满足生理试验测定,因此并未对不同组合处理间羊草体内的防御酶进行测定。陈全战等[44]在研究钙对盐胁迫下向日葵幼苗光合生理特性的影响时发现,150 mmol/L NaCl胁迫条件下,经过钙处理后的植物幼苗其体内的SOD、POD和CAT活性明显提高,MDA含量降低,这为本研究“150 mmol/L NaCl胁迫时加入CaCl2前后羊草幼苗体内防御酶的变化”提供了可参考的数据。②pH值 8.5或300 mmol/L Mannitol胁迫下,补加外源CaCl2没有显著提高羊草幼苗的抗碱性或抗旱性,因此未再进一步分析碱、干旱胁迫时羊草幼苗羊草体内防御酶等的变化。今后可在已有的基础上,通过增设CaCl2浓度梯度,改变盐、碱和渗透胁迫程度更细致探讨钙在羊草应对胁迫时的调节作用,为提高羊草适应性及其栽培生产和开发利用提供理论依据。
3.3 结论
补加外源 CaCl2可以提高羊草的抗盐能力和抗低温能力,但是对羊草的抗碱和抗渗透胁迫能力没有改善,这表明钙在羊草应对非生物胁迫时的调节作用受到CaCl2浓度、胁迫类型与程度的共同影响。
[1] 祝延成. 羊草生物生态学[M].长春:吉林科学技术出版社,2004.
Zhu Y C. Bioecology of Leymus chinensis[M].Changchun:Jilin Science and Technology Press,2004.
[2] 刘公社,李晓霞,齐冬梅,陈双燕,程丽琴. 羊草种质资源的评价与利用[J].科学通报,2016,61(2):271-281. doi:10.1360/N972015-00719.
Liu G S,Li X X,Qi D M,Chen S Y,Cheng L Q. Evaluation and utilization of Leymus chinensis germplasm resources[J].Chinese Science Bulletin,2016,61(2):271-281.
[3] 梁潇,侯向阳,王艳荣,任卫波,赵青山,王照兰,李怡,武自念. 羊草种质资源耐盐碱性综合评价[J].中国草地学报,2019,41(3):1-9. doi:10.16742/j.zgcdxb.20180198.
Liang X,Hou X Y,Wang Y R,Ren W B,Zhao Q S,Wang Z L,Li Y,Wu Z N. Comprehensive evaluation on saline-alkali tolerance of Leymus chinensis germplasm resources[J].Chinese Journal of Grassland,2019,41(3):1-9.
[4] 肖列. CO2浓度升高、干旱胁迫和施氮对白羊草生长和根际微生物的影响[D].杨凌:西北农林科技大学,2015.
Xiao L. Combines effects of elevated CO2,drought stress and nitrogen application on the growth of Biothriochloa ischaemum and its soil microbial properties[D].Yangling:Northwest A&F University,2015.
[5] 黄立华,梁正伟. 直播羊草在不同pH土壤环境下的离子吸收特性[J].中国草地学报,2008,30(1):35-39,55.
Huang L H,Liang Z W. Ionic absorption characteristics of Leymus chinensis seeded in various pH soils[J].Chinese Journal of Grassland,2008,30(1):35-39,55.
[6] 张永志,赵首萍,徐明飞,王钢军,郑纪慈. Pb胁迫对番茄幼苗抗氧化酶系统的影响[J].浙江农业科学,2009,1(3):452-456. doi:10.3969/j.issn.0528-9017.2009.03.005.
Zhang Y Z,Zhao S P,Xu M F,Wang G J,Zheng J C. Effects of Pb stress on activity of antioxidant enzyme system in tomato seedlings[J].Journal of Zhejiang Agricultural Sciences,2009,1(3):452-456.
[7] 张昌胜,刘国彬,薛萐,冀智清,张超.干旱胁迫和CO2浓度升高条件下白羊草的光合特征[J].应用生态学报,2012,23(11):3009-3015.doi:10.13287/j.1001-9332.2012.0480.
Zhang C S,Liu G B,Xue S,Ji Z Q,Zhang C. Photosynthetic characteristics of Bothriochloa ischaemum under drought stress and elevated CO2 concentration[J].Chinese Journal of Applied Ecology,2012,23(11):3009-3015.
[8] 宋吉轩,李金还,刘美茹,牛建行,王冉,吕俊,宗学凤,王三根. 油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究[J].草业学报,2015,24(8):93-102. doi:10.11686/cyxb2015001.
Song J X,Li J H,Liu M R,Niu J X,Wang R,Lü J,Zong X F,Wang S G. Effects of brassinosteroid application on osmotic adjustment and antioxidant enzymes in Leymus chinensis under drought stress[J].Acta Prataculturae Sinica,2015,24(8):93-102.
[9] 宋吉轩. 干旱胁迫下植物生长调节剂对羊草生长及生理特性的影响与转录组分析[D].重庆:西南大学,2017.
Song J X. Effects of plant growth regulators on growth and physiological characteristics of Leymus chinensis under drought stress and transcriptome analysis[D].Chongqing:Southwest University,2017.
[10] 宋吉轩,吕俊,宗学凤,何秀娟,徐宇,吴潇,王三根. 干旱胁迫下BR与N、P、K配合对羊草生长及抗旱性的影响[J].草业学报,2018,27(11):171-178. doi:10.11686/cyxb2017512.
Song J X,Lü J,Zong X F,He X J,Xu Y,Wu X,Wang S G. Effects of brassinolide and N,P,K fertiliser on growth of Leymus chinensis under drought stress[J].Acta Prataculturae Sinica,2018,27(11):171-178.
[11] 钟华,董洁,郭晋梅,董宽虎. 不同白羊草居群对干旱胁迫的生理响应及抗旱性评价[J].草地学报,2018,26(1):195-202. doi:10.11733/j.issn.1007-0435.2018.01.024.
Zhong H,Dong J,Guo J M,Dong K H. Physiological response to drought stresses and drought resistances evaluation of different old world bluestem populations[J].Acta Agrestia Sinica,2018,26(1):195-202.
[12] 李久道,金华,朴世领,邹吉祥,郭鹏,李琳琳,王智. 羊草根、叶在干旱和盐胁迫下的生理反应[J].草业科学,2017,34(8):1705-1710. doi:10.11829/j.issn.1001-0629.2016-0528.
Li J D,Jin H,Piao S L,Zou J X,Guo P,Li L L,Wang Z. Physiological response of leaves and roots of Leymus chinensis under drought and salt stress[J].Pratacultural Science,2017,34(8):1705-1710.
[13] Foyer C H,Descourvières P,Kunert K J. Protection against oxygen radicals:an important defence mechanism studied in transgenic plant[J].Plant,Cell and Environment,1994,17(5):507-523.doi:10.1111/j.1365-3040.1994.tb00146.x.
[14] 褚妍,任菲,赵贵林,胡国霞,陈强,李雪梅.渗透胁迫对植物抗氧化酶影响的研究进展[J].安徽农业科学,2011,39(3):1300-1302. doi:10.3969/j.issn.0517-6611.2011.03.018.
Chu Y,Ren F,Zhao G L,Hu G X,Chen Q,Li X M. The research of antioxidant enzymes on plants osmotic stress[J].Journal of Anhui Agricultural Sciences,2011,39(3):1300-1302.
[15] 张旸,孙天旭,郭勃予,汤明威,李玉花,解莉楠. 羊草脂氧合酶同源蛋白基因 LcLHP 的克隆与表达分析[J].华北农学报,2015,30(4):35-42. doi:10.7668/hbnxb.2015.04.007.
Zhang Y,Sun T X,Guo B Y,Tang M W,Li Y H,Xie L N. Cloning and expression of lipoxygenase homology protein from Leymus chinensis[J].Acta Agriculturae Boreali-Sinica,2015,30(4):35-42.
[16] 刘鸣,王江,李玉花,解莉楠. 羊草铁蛋白基因(LcFER)全长cDNA的克隆及原核表达[J].河北农业大学学报,2013,36(6):16-21.doi:10.13320/j.cnki.jauh.2013.06.004.
Liu M,Wang J,Li Y H,Xie L N. Cloning of full-length cDNA of FER gene in Leymus chinensis and its expression in E.coli[J].Journal of Agricultural University of Hebei,2013,36(6):16-21.
[17] 李晓薇,郭嘉,王鑫,王法微,李海燕. 羊草液泡膜Na+/H+逆向转运蛋白基因LcNHX1的克隆及功能分析[J].中国草地学报,2017,39(5):1-9. doi:10.16742/j.zgcdxb.2017-05-01.
Li X W,Guo J,Wang X,Wang F W,Li H Y. Cloning and functional analysis of a vacuolar Na+/H+ antiporter gene LcNHX1 from Leymus chinensis[J].Chinese Journal of Grassland,2017,39(5):1-9.
[18] Li L Y,Yang H M,Liu P,Ren W B,Wu X H,Huang F. Combined impact of heat stress and phosphate deficiency on growth and photochemical activity of sheepgrass(Leymus chinensis)[J].Journal of Plant Physiology,2018,231:271-276. doi:10.1016/j.jplph.2018.10.008.
[19] Ma T,Li M L,Zhao A G,Xu X,Liu G S,Cheng L Q. LcWRKY5:an unknown function gene from sheepgrass improves drought tolerance in transgenic Arabidopsis[J].Plant Cell Reports,2014,33(9):1507-1518. doi:10.1007/s00299-014-1634-3.
[20] Hepler P K. Calcium:a central regulator of plant growth and development[J].The Plant Cell,2005,17(8):2142-2155. doi:10.1105/tpc.105.032508.
[21] Clapham D E. Calcium signaling[J].Cell,2007,131(6):1047-1058.doi:10.1016/j.cell.2007.11.028.
[22] Lecourieux D,Ranjeva R,Pugin A. Calcium in plant defence-signalling pathways[J].New Phytologist,2006,171(2):249-269. doi:10.1111/j.1469-8137.2006.01777.x.
[23] Farzadfar S,Zarinkamar F,Modarres-Sanavy S A M,Hojati M. Exogenously applied calcium alleviates cadmium toxicity in Matricaria chamomilla L. plants[J].Environmental Science and Pollution Research,2013,20(3):1413-1422. doi:10.1007/s11356-012-1181-9.
[24] 胡丽涛. 钙和钙效应剂对低温胁迫下小麦生理生化特性的影响[D].重庆:西南大学,2010.
Hu L T. Effect of calcium and Ca2+ messenger on physiological and biochemical characteristics of winter wheat seedlings under low temperature stress[D].Chongqing:Southwest University,2010.
[25] 张宇君,赵丽丽,王普昶,陈超. 盐旱交互对燕麦种子萌发及幼苗生理特性的影响[J].草业学报,2018,54(5):141-152. doi:10.11686/cyxb2017433.
Zhang Y J,Zhao L L,Wang P C,Chen C. Effects of interaction between Ca2+ salt and drought stress on seed germination and seedlings physiology of oats [J].Acta Prataculturae Sinica,2018,27(5):141-152.
[26] 郭郁频,任永霞,刘贵河,曹春梅,闫利军. 外源钙和赤霉素对干旱胁迫下苜蓿幼苗生理特性的影响[J].草业学报,2015,24(7):89-96. doi:10.11686/cyxb2014502.
Guo Y P,Ren Y X,Liu G H,Cao C M,Yan L J. Effects of calcium(CaCl2),GA3 and complex liquid on the physiological characteris-tics of alfalfa seedlings under drought stress[J].Acta Prataculturae Sinica,2015,24(7):89-96.
[27] 赵险飞. 盐胁迫和干旱胁迫下杨树细胞内Ca2+和Ca2+-ATPase变化[D].北京:北京林业大学,2005.
Zhao X F. Changes of the Ca2+ and the Ca2+-ATPase in cells of poplar under salt stress and drought stress[D].Beijing:Beijing Forestry University,2005.
[28] 任艳芳,何俊瑜. NaCl胁迫对莴苣幼苗生长和光合性能的影响[J].华北农学报,2008,23(4):149-153.doi:10.7668/hbnxb.2008.04.034.
Ren Y F,He J Y. Effects of NaCl stress on growth and photosynthetic characteristics of lettuce(Lactuca sativa L.)seedlings[J].Acta Agriculturae Boreali-Sinica,2008,23(4):149-153.
[29] 颜宏,赵伟,尹尚军,石德成,周道玮.羊草对不同盐碱胁迫的生理响应[J].草业学报,2006,15(6):49-55.doi:10.3321/j.issn:1004-5759.2006.06.008.
Yan H,Zhao W,Yin S J,Shi D C,Zhou D W. Different physiological responses of Aneurolepidium chinense to NaCl and Na2CO3[J].Acta Prataculturae Sinica,2006,15(6):49-55.
[30] 鲁少尉,齐飞,李天来. NaCl及等渗PEG胁迫对番茄叶片光合特性及蔗糖代谢的影响[J].华北农学报,2012,27(3):136-141. doi:10.3969/j.issn.1000-7091.2012.03.027.
Lu S W,Qi F,Li T L. Effect of NaCl and PEG iso-osmotic stresses on photosynthetic characteristics and sucrose metabolizing in tomato leaf[J].Acta Agriculturae Boreali-Sinica,2012,27(3):136-141.
[31] Genc Y,Tester M,McDonald G K. Calcium requirement of wheat in saline and non-saline conditions[J].Plant and Soil,2010,327(1/2):331-345. doi:10.1007/s11104-009-0057-3.
[32] 杨利艳,韩榕. Ca2+对小麦萌发及幼苗抗盐性的效应[J].植物学报,2011,46(2):155-161. doi:10.3724/SP.J.1259.2011.00155.
Yang L Y,Han R. Effects of Ca2+ on wheat germination and seedling development under saline stress[J].Chinese Bulletin of Botany,2011,46(2):155-161.
[33] 赵可夫,卢元芳,张宝泽,衣建龙. Ca对小麦幼苗降低盐害效应的研究[J].植物学报,1993,35(1):51-56.
Zhao K F,Lu Y F,Zhang B Z,Yi J L. Influence of calcium on alleviating NaCl-induced injury effects in wheat seedlings[J].Acta Bontanica Sinica,1993,35(1):51-56.
[34] Tuna A L,Kaya C,Ashraf M,Altunlu H,Yokas I,Yagmur B. The effects of calcium sulphate on growth,membrane stability and nutrient uptake of tomato plants grown under salt stress[J].Environmental and Experimental Botany,2007,59(2):173-178. doi:10.1016/j.envexpbot.2005.12.007.
[35] 韩志平,张海霞,李侠. 外源钙对NaCl胁迫下西瓜幼苗生长的缓解效应研究[J].农业科学与技术(英文版),2017,18(4):627-631.doi:10.16175/j.cnki.1009-4229.2017.04.015.
Han Z P,Zhang H X,Li X. Effects of exogenous calcium(Ca)on the growth of watermelon seedlings under NaCl stress[J].Agricultural Science and Technology,2017,18(4):627-631.
[36] 李春燕,张光勇,王维行,袁寒,张虹. Ca2+对NaCl胁迫下番茄种子萌发和幼苗的影响[J].农业研究与应用,2015(2):6-9. doi:10.3969/j.issn.2095-0764.2015.02.002.
Li C Y,Zhang G Y,Wang W H,Yuan H,Zhang H. Efects of Ca2+ on seed germination and seedling growth of tomoto under NaCl stress[J].Agricultural Research and Application,2015(2):6-9.
[37] Guimarães F V A,Lacerda C F,Marques E C,Miranda M R A,Abreu C E B,Prisco J T,Gomes-Filho E. Calcium can moderate changes on membrane structure and lipid composition in cowpea plants under salt stress[J].Plant Growth Regulation,2011,65(1):55-63. doi:10.1007/s10725-011-9574-1.
[38] Chen Y Y,Lu P Z,Sun P,Wei L,Chen G L,Wu D. Interactive salt-alkali stress and exogenous Ca2+ effects on growth and osmotic adjustment of Lolium multiflorum in a coastal estuary[J]. Flora-Morphology Distribution Functional Ecology of Plants,2017,229:92-99. doi:10.1016/j.flora.2017.02.018.
[39] 宋新妍,张崔灿,韩晓弟. CaCl2对冬小麦抗旱性影响的研究[J].安徽农业科学,2009,37(30):14637-14638.doi:10.13989/j.cnki.0517-6611.2009.30.069.
Song X Y,Zhang C C,Han X D. Study on drought resistance of calcium chloride in growth of winter wheat seedling[J].Journal of Anhui Agricultural Sciences,2009,37(30):14637-14638.
[40] 姜义宝,李建华,方丽云,王成章. 钙处理对苜蓿幼苗抗旱性的影响[J].中国草地学报,2008,30(1):117-120.
Jiang Y B,Li J H,Fang L Y,Wang C Z. Effect of calcium on drought resisting of alfalfa seedlings[J].Chinese Journal of Grassland,2008,30(1):117-120.
[41] 张燕. 不同环境因子对羊草生长适应性的影响研究[D].重庆:西南大学,2018.
Zhang Y. Effects of different environment factors on Leymus chinensis (Trin.)growth adaptability[D].Chongqing:Southwest University,2018.
[42] 张丽,贾志国. 低温对不同萌发状态裸燕麦种子生长生理特性的影响[J].江苏农业科学,2016,44(6):161-164.doi:10.15889/j.issn.1002-1302.2016.06.042.
Zhang L,Jia Z G. Effects of low temperature on growth and physiological characteristics of Avena nuda L. seeds in different germination states[J].Jiangsu Agricultural Sciences,2016,44(6):161-164.
[43] Shi H T,Ye T T,Zhong B,Liu X,Chan Z L. Comparative proteomic and metabolomic analyses reveal mechanisms of improved cold stress tolerance in bermudagrass(Cynodon dactylon (L.)Pers.)by exogenous calcium[J].Journal of Integrative Plant Biology,2014,56(11):1064-1079. doi:10.1111/jipb.12167.
[44] 陈全战,张边江,周峰,周泉澄,华春. 钙对盐胁迫下油用向日葵幼苗光合生理特性的影响[J].华北农学报,2009,24(2):149-152.doi:10.7668/hbnxb.2009.02.031.
Chen Q Z,Zhang B J,Zhou F,Zhou Q C,Hua C. Effects of supplemental calcium on photosynthetic characteristics of oil sunflower seedlings[J].Acta Agriculturae Boreali-Sinica,2009,24(2):149-152.