TCP4是植物特有的转录因子TCP(Teosinte branched1,cycloidea,proliferating cell factors)家族成员之一,影响多种植物激素的合成,调控植物的生长发育[1],例如主根、侧根、叶片形态、花蕊形成、表皮毛分化、子叶舒展、下胚轴延伸、避荫反应、植物油脂合成等过程[2]。转录因子TCP4在植物生长发育各个过程中与植物激素信号转导途径中的多种蛋白(如MYB、SAP11)相互作用[3-5],可能在植物抵抗生物和非生物胁迫等方面发挥着重要作用[5]。在植物发育过程中TCP4还具有时空限制的表达模式,这些表达模式提高了TCP4在局部触发或拮抗激素信号传导的可能性[6]。TCP4具有非典型的螺旋-环-螺旋(bHLH)结构域,因此,转录因子TCP4能够与功能基因的顺式作用元件结合调控其表达[7],与其他转录因子相互作用表现为转录抑制和转录激活。近10多年来的研究揭示了部分TCP4的功能和分子机制,但这些研究仍处于初级阶段[8]。
本研究克隆了拟南芥AtTCP4基因,并在大肠杆菌中进行原核表达以获得有蛋白活性的AtTCP4,旨在为进一步揭示TCP4在植物生长发育过程的调控作用和调控靶基因的鉴定奠定基础。
1 材料和方法
1.1 试验材料
野生型拟南芥(Arabidopsis thaliana)种子由中国科学院昆明植物研究所提供,大肠杆菌Rosetta(DE3)感受态细胞购自上海碧云天生物技术有限公司,载体pET-28a购于北京索莱宝科技有限公司。
1.2 AtTCP4的克隆以及原核表达载体的构建
采用Promega有限公司的Eastep® Super 总RNA提取试剂盒,从拟南芥叶片中提取总RNA,利用EvaGreen 2×qPCR MasterMix-ROX试剂盒反转录获得cDNA。根据拟南芥基因组数据库TCP4序列(基因登录号AT3G15030),利用引物设计软件Primer Premier 5.0设计特异性引物,EZ-TCP4-EcoR Ⅰ-F:CGCGGATCCGAATTCATGTCTGACGACCAA,EZ-Hind Ⅲ-R:TGCGGCCGCAAGCTTTCAATGGCGAGAAAT,利用南京诺唯赞生物科技股份有限公司Phanta® Max Super-Fidelity DNA Polymerase试剂盒对TCP4进行扩增。RT-PCR反应程序为:95 ℃ 3 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min,12 ℃ ∞。RT-PCR扩增产物通过1%琼脂糖凝胶电泳并胶回收纯化(Omega Bio-Tek公司 E. Z. N. A® Gel Extraction Kit试剂盒)。采用南京诺唯赞生物科技股份有限公司同源重组试剂盒,并加入TCP4胶回收片段以及pET-28a载体双酶切产物进行连接,将重组表达载体转化至E.coli DH5α 感受态细胞中,进行菌落PCR和质粒酶切验证,然后将阳性克隆菌株送至生工生物工程(上海)股份有限公司测序。
1.3 重组菌株pET-28a-AtTCP4的诱导和表达
将测序正确的重组质粒 pET-28a-AtTCP4转化到大肠杆菌Rosetta(DE3)中,取1 μL重组菌株菌液接种到3 mL LB液体培养基中,37 ℃、180 r/min过夜活化。将活化后菌液吸取100 μL再接种到10 mL LB液体培养基中,37 ℃、200 r/min培养至OD600=0.8。加入1 mmol/L IPTG,28 ℃诱导4 h或18 ℃过夜诱导表达。各取2 mL菌液,离心收集菌体。加入60 μL的蛋白Loading Buffer吹打混匀,沸水浴5~10 min,冰上冷却1 min,离心进行电泳分析。
1.4 蛋白纯化
采用Promega公司Magne HisTM Protein Purification System试剂盒纯化蛋白。将细胞沉淀重悬于100 μL Fast BreakTM细胞裂解液中,室温涡旋孵育2 h。加入30 μL Magne HisTM Ni颗粒,4 ℃涡旋孵育 2 h,确保Magne HisTM Ni颗粒混合均匀。试管放置磁力架中约30 s,以捕获Magne HisTM Ni颗粒,弃上清液。加入150 μL Magne HisTM洗涤缓冲液,颠倒混匀,弃上清液。重复洗涤3次。加入洗脱缓冲液100 μL,室温静止1~2 min,放置在磁力架中约30 s,吸取含有纯化蛋白的上清液。进行SDS-PAGE电泳检测,考马斯亮蓝染液验证是否纯化成功。
1.5 Western Blot检验目的蛋白
样品加入等体积蛋白Loading Buffer,煮沸5 min,冰上冷却1 min,12 000 r/min、离心1 min[9],用10%SDS-聚丙烯酰胺凝胶分离蛋白后,转PVDF膜,使用His抗体通过免疫印迹法检测蛋白[10]。
1.6 EMSA分析
从NCBI数据库中查询LOX2基因启动子序列,通过PLANT CARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析其启动子序列是否有bHLH结构域结合位点,确认LOX2基因启动子序列含有转录因子TCP4顺式作用元件。由上海捷瑞生物工程有限公司设计探针和竞争性探针,采用化学发光法EMSA试剂盒(上海碧云天生物技术有限公司)验证TCP4蛋白与探针的结合。
2 结果与分析
2.1 转录因子AtTCP4生物信息学分析
通过拟南芥基因组数据库TAIR(https://www.arabidopsis.org/)查询转录因子AtTCP4基因序列以及蛋白序列,对转录因子TCP家族进行蛋白序列比较以及构建系统发育进化树,其结果见图1-A、B。拟南芥TCP家族基因编码区由Basic、Helix Ⅰ、Loop和Helix Ⅱ结构域构成,因此,转录因子TCP4能够与功能基因的顺式作用元件结合调控其表达。根据结合位点碱基序列不同,将TCP家族分为两大类:Ⅰ类(GGNCCCAC)和Ⅱ类(GTGGNCC)。Ⅱ类又分为CYC/TBI、CIN两大类,CIN包括TCP10、TCP3、TCP4、TCP2、TCP24、TCP13、TCP5、TCP17。对TCP4蛋白进行三级结构预测,其结果见图1-C。转录因子TCP4可以形成同源二聚体,与水稻转录因子PCF6三级结构相似度高达70.04%。
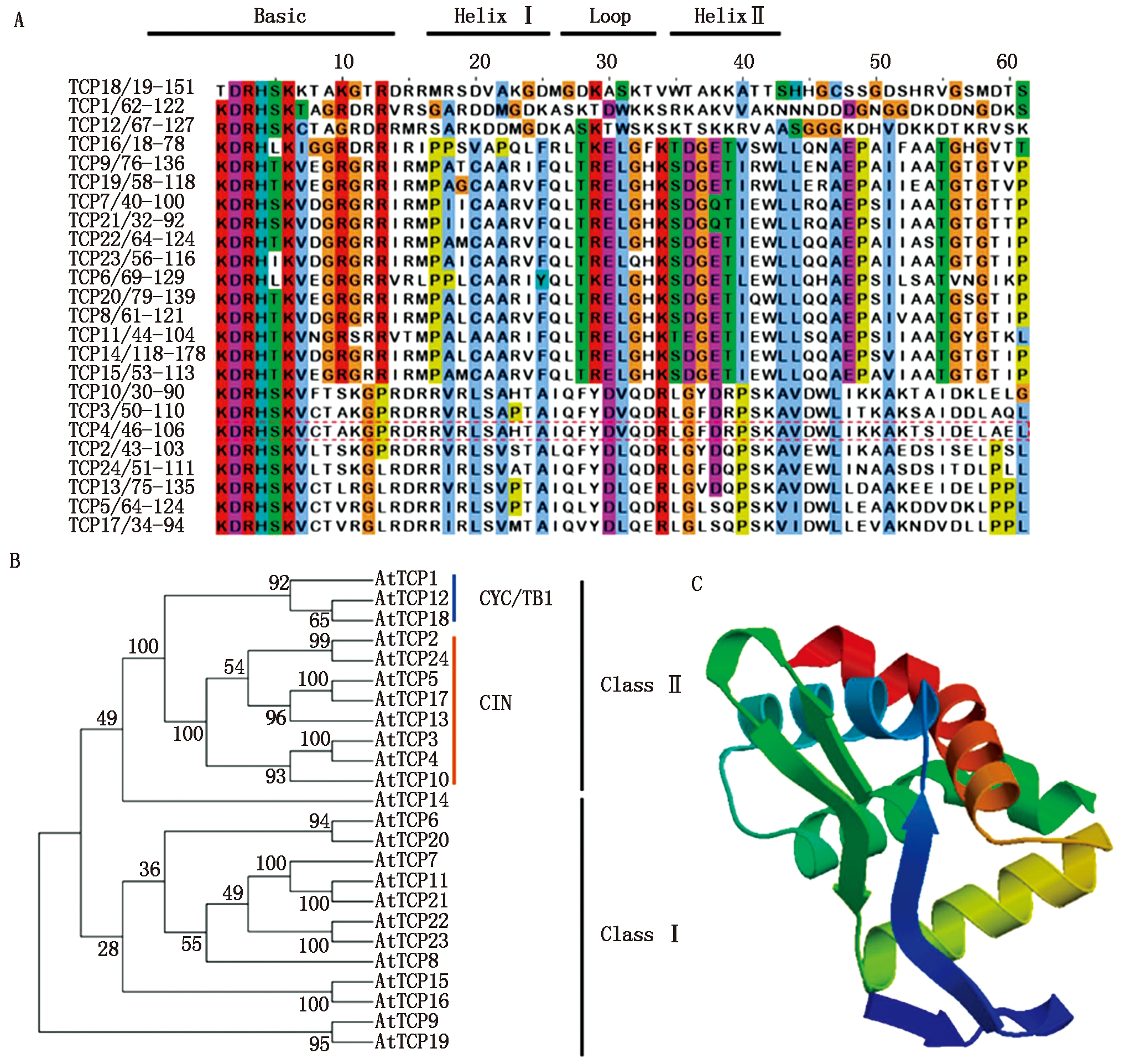
A.转录因子TCP家族功能结构域氨基酸序列分析;B.转录因子TCP家族发育进化树;C.转录因子AtTCP4蛋白三级结构预测。
A.Transcription factor TCP family functional domain amino acid sequence analysis;B.Transcription factor
TCP family developmental tree;C.Transcription factor AtTCP4 protein tertiary structure prediction.
图1 转录因子AtTCP4生物信息学分析
Fig.1 Transcription factor AtTCP4 bioinformatics analysis
2.2 AtTCP4基因克隆以及原核载体构建
从野生型拟南芥中提取总RNA,反转录获得cDNA,设计特异性引物对AtTCP4进行扩增,通过1%琼脂糖凝胶电泳,获得1 200 bp 左右的特异性条带(图2-A),与AtTCP4开放阅读框长度相同。对其进行胶回收、纯化,连接到pET-28a载体,转入大肠杆菌DH5α筛选培养后进行菌落PCR验证(图2-B),获得阳性重组子。对阳性质粒测序进一步证实目的基因已连接到pET-28a质粒,表明成功构建原核表达载体pET-28a-AtTCP4。
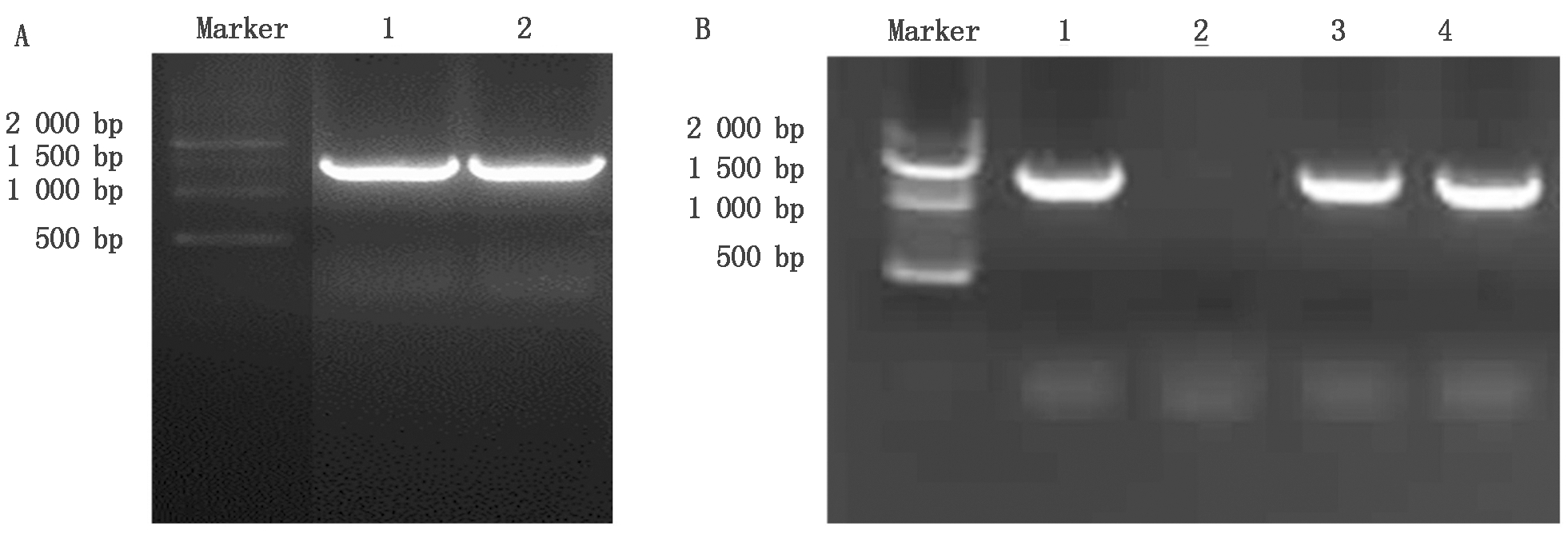
A.RT-PCR扩增AtTCP4:1-2. RT-PCR产物;B.pET28a-AtTCP4转化菌落PCR扩增:
1,3,4.AtTCP4重组菌落PCR扩增产物;2.AtTCP4假阳性重组菌落PCR产物。
A.RT-PCR amplification of AtTCP4:1-2.RT-PCR product;B.Colony PCR amplification of pET-28a-AtTCP4:
1,3,4.AtTCP4 recombinant colony PCR amplification product;2.AtTCP4 false positive recombinant colony PCR products.
图2 AtTCP4基因扩增以及pET-28a-AtTCP4载体构建
Fig.2 AtTCP4 gene amplification and pET-28a-AtTCP4 vector construction
2.3 重组菌株pET-28a-AtTCP4的诱导和表达
将测序正确的重组质粒 pET-28a-AtTCP4转化到Rosetta(DE3)大肠杆菌感受态细胞,挑取单菌落进行PCR,鉴定阳性菌株。将含重组质粒 pET-28a-AtTCP4的菌株在37 ℃摇床摇至OD600=0.8,加入1 mmol/L IPTG、28 ℃诱导4 h或18 ℃过夜诱导表达。
将IPTG诱导表达的菌液进行4 ℃、10 000 r/min离心,弃上清液,收集沉淀。加入60 μL的蛋白Loading Buffer吹打混匀沸水浴5~10 min,置于冰上冷却1 min,离心提取总蛋白,进行电泳分析。SDS-PAGE 电泳检测,在约75 ku 位置出现一条明显的蛋白条带(图3-A)。采用Promega公司Magne HisTM Protein Purification System试剂盒纯化AtTCP4蛋白,SDS-PAGE 电泳检测,在约75 ku 位置出现单一的蛋白条带(图3-B)。
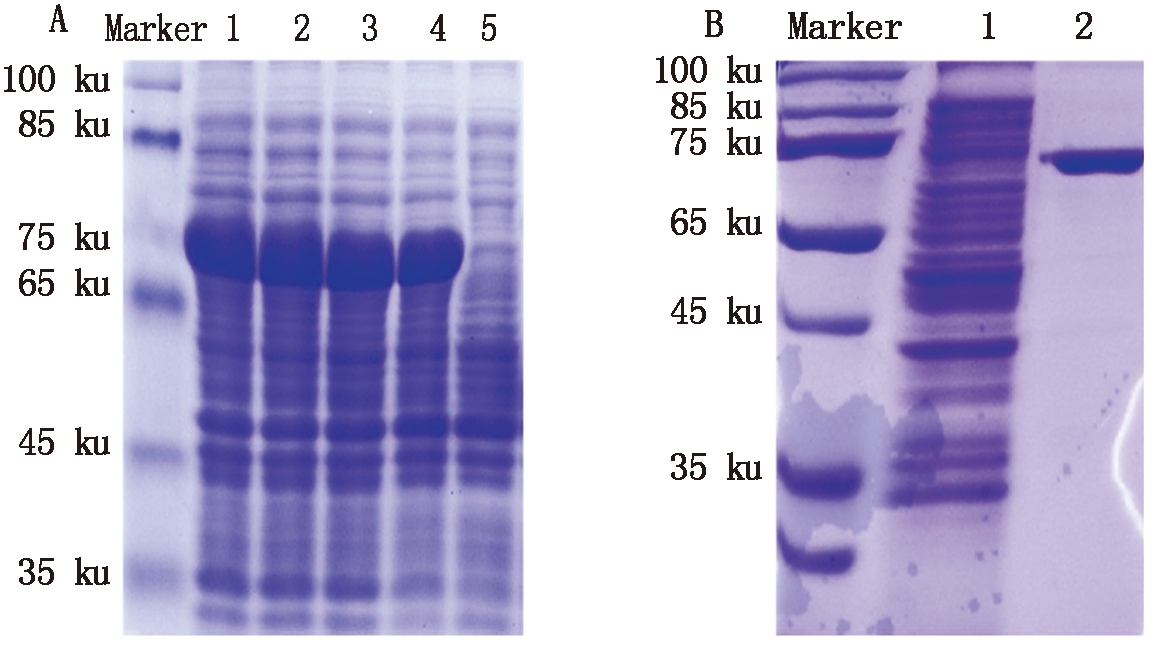
A.SDS-PAGE分析AtTCP4蛋白表达:1-2.28 ℃、4 h诱导pET28a-AtTCP4表达;3-4.18 ℃、过夜诱导pET-28a-AtTCP4表达;5.未诱导pET-28a-AtTCP4表达;B.AtTCP4蛋白的纯化分析:1.菌株破碎离心后上清液;2.AtTCP4蛋白纯化后。
A.SDS-PAGE analysis of AtTCP4 protein expression:1-2.28 ℃,4 h to induce pET-28a-AtTCP4 expression;3-4.18 ℃,overnight to induce pET-28a-AtTCP4 expression;5.The expression of pET-28a-AtTCP4 was not induced;B.The purification analysis of AtTCP4 protein:1.Supernatant after strain breakage and centrifugation;2. AtTCP4 protein was purified.
图3 重组菌株pET-28a-AtTCP4的诱导和表达
Fig.3 Induction and expression of
recombinant strain pET-28a-AtTCP4
2.4 Western Blot检测AtTCP4蛋白
将诱导表达后的蛋白经过Magen HisTM Protein Purification System试剂盒纯化,SDS-PAGE电泳后转移到 PVDF 膜上进行Western Blot 检测,在75 ku位置处出现了目的蛋白,与预期一致(图4)。将纯化的AtTCP4蛋白冻存于-80 ℃。
2.5 转录因子AtTCP4与LOX2基因启动子区域结合
根据顺式作用元件设计探针和竞争性探针,凝胶电泳迁移试验(EMSA)验证AtTCP4蛋白与探针结合情况,结果如图5所示,AtTCP4蛋白与探针结合,当加入竞争性探针后,条带变暗。证实转录因子AtTCP4与LOX2基因启动子区域结合。
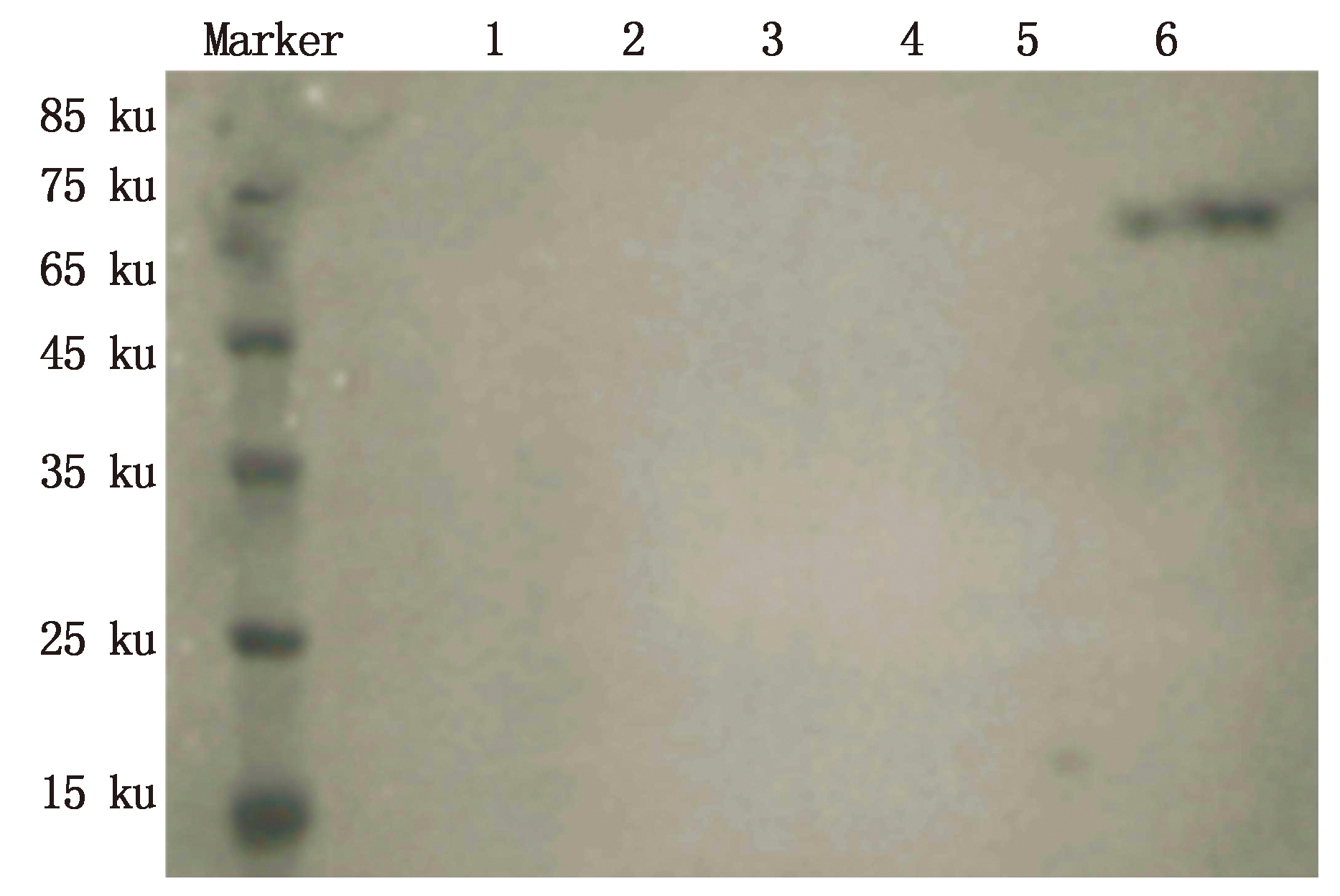
1.孵育后流出液;2.镍磁珠洗液1;3.镍磁珠洗液2;4.镍磁珠洗液3;5.洗脱后的镍磁珠;6.洗脱液。
1.Effluent after incubation;2.Nickel beads washing solution 1;3.Nickel beads washing solution 2;4.Nickel beads washing solution 3;5.Washing Nickel beads after removal;6.Elution solution.
图4 Western Blot检测AtTCP4蛋白
Fig.4 AtTCP4 protein was detected by Western Blot

图5 EMSA验证转录因子AtTCP4与
LOX2基因启动子区域结合
Fig.5 EMSA verifies the transcription factor AtTCP4
binds to the promoter region of LOX2 gene
3 讨论
TCP家族是保守的转录因子家族,对拟南芥TCP家族进行多序列比对,TCP家族基因编码区是由55~59个氨基酸组成的非典型的螺旋-环-螺旋(bHLH)结构域。水稻转录因子OsTCP家族在140~240位置包含一个bHLH结构域[11]。Liu等[12]通过系统发育分析表明,TCP家族基因在陆生植物之间具有保守性。番茄基因组中有30个SlTCP基因,蛋白多序列比对和系统发育树将转录因子SlTCP家族分为Ⅰ类和Ⅱ类。Ⅰ类的TCP结构域相比Ⅱ类缺少4个氨基酸[13]。Ⅱ类TCP家族含有一个富含精氨酸的残基基序(R结构域)[14]和一个谷氨酸-半胱氨酸-谷氨酸伸展结构域[15],其功能是未知的。根据结合位点碱基不同,可将拟南芥TCP蛋白分为Ⅰ类和Ⅱ类。正是因为结合位点碱基不同,转录因子TCP与顺式作用元件结合具有多样性,能够调控更多功能基因的表达,参与植物生理生化过程,响应外界刺激调控植物生长发育[16]。TCP蛋白可以形成同源二聚体和异源二聚体,但异源二聚体比同源二聚体更有效结合到DNA启动子区域。因此,同源或异源二聚体识别顺式调控元件时具有不同的亲和力,所以功能基因的表达量也有所不同[17]。这会使调控网络具有复杂性和特异性。
研究表明,拟南芥AtTCP4主要在子叶和幼叶中表达并调节这些组织器官的形态[18],还可与一些功能基因的顺式作用元件结合,调控多种植物激素的合成,从而参与植物生长发育过程。在JA信号途径中,Lipoxygenase2(LOX2)基因受TCP转录因子的调控,该基因编码参与由α-亚麻酸合成 JA途径的叶绿体酶,LOX2的诱导使JA积累最终促进叶片衰老[19]。本研究通过构建原核载体,诱导纯化获得AtTCP4蛋白。利用EMSA试验验证了转录因子TCP4能够结合到LOX2基因的启动子区域,调控LOX2基因的表达,从而参与植物激素的合成。AtTCP4蛋白的获得为进一步了解其蛋白结构提供试验材料,同时为蛋白质伴侣的鉴定和其他下游功能基因的确定奠定了基础[20]。
[1] Vadde B V L,Challa K R,Nath U. The TCP4 transcription factor regulates trichome cell differentiation by directly activating GLABROUS INFLORESCENCE STEMS in Arabidopsis thaliana[J].The Plant Journal,2018,93(2):259-269. doi:10.1111/tpj.13772.
[2] Liu J,Cheng X L,Liu P,Li D Y,Chen T,Gu X F,Sun J Q. MicroRNA319-regulated TCPs interact with FBHs and PFT1 to activate CO transcription and control flowering time in Arabidopsis[J].PLoS Genetics,2017,13(5):e1006833. doi:10.1371/journal.pgen.1006833.
[3] Kubota A,Ito S,Shim J S,Johnson R S,Song Y H,Breton G,Goralogia G S,Kwon M S,Laboy Cintr n D,Koyama T,Ohme-Takagi M,Pruneda-Paz J L,Kay S A,MacCoss M J,Imaizumi T. TCP4-dependent induction of CONSTANS transcription requires GIGANTEA in photoperiodic flowering in Arabidopsis[J].PLoS Genetics,2017,13(6):e1006856. doi:10.1371/journal.pgen.1006856.
n D,Koyama T,Ohme-Takagi M,Pruneda-Paz J L,Kay S A,MacCoss M J,Imaizumi T. TCP4-dependent induction of CONSTANS transcription requires GIGANTEA in photoperiodic flowering in Arabidopsis[J].PLoS Genetics,2017,13(6):e1006856. doi:10.1371/journal.pgen.1006856.
[4] Guan P Z,Ripoll J J,Wang R H,Vuong L,Bailey-Steinitz L J,Ye D N,Crawford N M. Interacting TCP and NLP transcription factors control plant responses to nitrate availability[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(9):2419-2424. doi:10.1073/pnas.1615676114.
[5] Wang H Y,Wang H L,Shao H B,Tang X L. Recent advances in utilizing transcription factors to improve plant abiotic stress tolerance by transgenic technology[J].Frontiers in Plant Science,2016,7:67. doi:10.3389/fpls.2016.00067.
[6] Challa K R,Aggarwal P,Nath U. Activation of YUCCA5 by the transcription factor TCP4 integrates developmental and environmental signals to promote hypocotyl elongation in Arabidopsis[J].The Plant Cell,2016,28(9):2117-2130. doi:10.1105/tpc.16.00360.
[7] Gahlaut V,Jaiswal V,Kumar A,Gupta P K. Transcription factors involved in drought tolerance and their possible role in developing drought tolerant cultivars with emphasis on wheat(Triticum aestivum L.)[J].Theoretical and Applied Genetics,2016,129(11):2019-2042. doi:10.1007/s00122-016-2794-z.
[8] Mao Y F,Wu F J,Yu X,Bai J J,Zhong W L,He Y K. microRNA319a-targeted Brassica rapa ssp. pekinensis TCP genes modulate head shape in Chinese cabbage by differential cell division arrest in leaf regions[J]. Plant Physiology,2014,164(2):710-720.doi:10.1104/pp.113.228007.
[9] Wang W,Ye R Q,Xin Y,Fang X F,Li C L,Shi H Q,Zhou X P,Qi Y J. An importin β protein negatively regulates MicroRNA activity in Arabidopsis[J].The Plant Cell,2011,23(10):3565-3576. doi:10.1105/tpc.111.091058.
[10] Liu L J,Zhang Y Y,Tang S Y,Zhao Q Z,Zhang Z H,Zhang H W,Dong L,Guo H S,Xie Q. An efficient system to detect protein ubiquitination by agroinfiltration in Nicotiana benthamiana[J].The Plant Journal,2010,61(5):893-903. doi:10.1111/j.1365-313X.2009.04109.x.
[11] Li W P,Chen G L,Xiao G S,Zhu S S,Zhou N,Zhu P P,Zhang Q,Hu T Z. Overexpression of TCP transcription factor OsPCF7 improves agronomic trait in rice[J].Molecular Breeding,2020,40(5):1-13. doi:10.1007/s11032-020-01129-5.
[12] Liu M M,Wang M M,Yang J,Wen J,Guo P C,Wu Y W,Ke Y Z,Li P F,Li J N,Du H. Evolutionary and comparative expression analyses of TCP transcription factor gene family in land plants[J].International Journal of Molecular Sciences,2019,20(14):3591.doi:10.3390/ijms20143591.
[13] Martín-Trillo M,Cubas P. TCP genes:A family snapshot ten years later[J].Trends in Plant Science,2010,15(1):31-39. doi:10.1016/j.tplants.2009.11.003.
[14] Cubas P,Lauter N,Doebley J,Coen E. The TCP domain:a motif found in proteins regulating plant growth and development[J].The Plant Journal,1999,18(2):215-222.doi:10.1046/j.1365-313X.1999.00444.x.
[15] Howarth D G,Donoghue M J. Phylogenetic analysis of the "ECE" (CYC/TB1)clade reveals duplications predating the core eudicots[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(24):9101-9106. doi:10.1073/pnas.0602827103.
[16] Nicolas M,Cubas P. TCP factors:New kids on the signaling block[J].Current Opinion in Plant Biology,2016,33:33-41. doi:10.1016/j.pbi.2016.05.006.
[17] Kosugi S,Ohashi Y. DNA binding and dimerization specificity and potential targets for the TCP protein family[J].The Plant Journal,2002,30(3):337-348. doi:10.1046/j.1365-313x.2002.01294.x.
[18] Koyama T,Mitsuda N,Seki M,Shinozaki K,Ohme-Takagi M. TCP transcription factors regulate the activities of ASYMMETRIC LEAVES1 and miR164,as well as the auxin response,during differentiation of leaves in Arabidopsis[J].The Plant Cell,2010,22(11):3574-3588. doi:10.1105/tpc.110.075598.
[19] Noh M,Shin J S,Hong J C,Kim S Y,Shin J S. Arabidopsis TCX8 functions as a senescence modulator by regulating LOX2 expression[J].Plant Cell Reports,2021,40(4):677-689. doi:10.1007/s00299-021-02663-y.
[20] Bresso E G,Chorostecki U,Rodriguez R E,Palatnik J F,Schommer C. Spatial control of gene expression by miR319-regulated TCP transcription factors in leaf development[J].Plant Physiology,2018,176(2):1694-1708. doi:10.1104/pp.17.00823.