内质网是真核细胞中至关重要的细胞器,是蛋白质合成加工及运输的主要场所[1]。在氧化应激、贫血、Ca2+稳态紊乱等不利因素的影响下,错误折叠和未折叠蛋白质在内质网中累积,诱发内质网应激(Endoplasmic reticulum stress,ERS),产生未折叠蛋白反应(Unfolded protein response,UPR) [2],从而保护细胞免受应激危害,帮助细胞恢复稳态[3]。研究表明,DNA损伤诱导转录本3(DNA damage inducible transcript 3,DDIT3)和免疫球蛋白重链结合蛋白(Immunoglobulin heavy chain binding protein,Bip)是ERS的代表性基因,其表达量的变化直接反映ERS程度[4]。DDIT3(又名C/EBPζ、CHOP和GADD153)与C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ和C/EBPε共同组成C/EBP蛋白家族[5],DDIT3是内质网应激通路下游的重要转录因子,主要通过促进TNFRSF10B的表达从而诱发ERS介导的细胞凋亡活动[6]。近年来的研究发现ERS与癌症[3]、心血管疾病[7]、糖尿病[8]、神经性疾病[9]等多种人类疾病的发生密切相关,同时,ERS在动物生殖调控方面也具有重要作用。
研究表明,ERS在雌性动物卵巢卵泡形成和卵母细胞成熟、受精、早期胚胎发育、妊娠和分娩等过程均有发生,同时,ERS的异常表现可能导致多种卵巢疾病[10]。Lin等[11]发现哺乳动物卵母细胞的体外成熟(in vitro maturation,IVM)和胚胎培养(in vitro culture,IVC)过程中都会发生ERS,说明ERS会影响IVM和IVC效率。Park等[12]发现猪卵丘-卵母细胞复合体(Cumulus-oocyte complexes,COCs)成熟培养44 h(MⅡ期)后DDIT3和Bip mRNA表达水平显著高于成熟培养22 h(MⅠ期),而在IVM液中添加ERS抑制剂牛磺去氧胆酸(TUDCA)和褪黑素则可以降低ERS,从而提高卵母细胞的成熟率。Zhao等[13]发现在玻璃化冷冻小鼠卵母细胞时添加TUDCA,冷冻复苏后DDIT3基因表达下调,卵母细胞的存活率显著提高。在小鼠和大鼠黄体期的后期DDIT3基因的表达量显著提高,诱导ERS,从而引起黄体退化[14-15]。ERS还发生在早期胚胎的发育阶段,在小鼠[16]、猪[12]、牛[17]等动物的囊胚阶段均检测到DDIT3的表达。患有多囊卵巢症(PCOS)的小鼠DDIT3的表达量明显增加[18],卵巢储备功能下降(DOR)患者颗粒细胞中的DDIT3 mRNA表达水平显著高于正常女性[19]。
牦牛(Bos grunniens)主要分布在中国青藏高原及邻近高山地区,能为当地牧民提供奶、肉、燃料、役力等生活生产资源,素有“高原之舟”的美誉[20]。牦牛性成熟晚、季节性发情、母牦牛产后发情率低、加之营养摄入不足和管理不科学等因素,导致牦牛多呈现两年一胎或者三年两胎,繁殖率明显低于其他牛类,提高牦牛繁殖效率的研究工作备受关注[21-22]。牦牛生活在高寒、低氧、高紫外线辐射等多种不利因素刺激的青藏高原,对牦牛DDIT3基因的研究不仅有助于进一步探究其在牦牛生殖过程中的作用,而且对高原动物生态适应性及其生殖机能的调控机制也具有一定参考价值。目前,关于牦牛DDIT3基因序列、生物信息学及组织表达特性方面尚未开展过研究。本研究以牦牛作为研究对象,通过克隆测序得到牦牛DDIT3基因的序列,并对CDS区进行生物信息学分析和蛋白质结构功能预测等。通过RT-qPCR对DDIT3基因在牦牛不同组织和不同时期生殖器官以及卵母细胞和颗粒细胞中的表达变化进行分析,为进一步探究DDIT3基因在牦牛生殖生理中的作用提供参考。
1 材料和方法
1.1 试验材料、试剂及主要仪器
本试验样品均采自四川省成都市青白江区屠宰场。采用颈动脉放血法处死母牦牛后采集3头黄体期 (卵巢表面可见突出黄体)牦牛的心、肝、脾、肺、肾、卵巢、子宫和输卵管8个组织样,用眼科剪剪至约1.0 cm×0.5 cm×0.5 cm大小后迅速放入RNase free冻存管,置于液氮带回实验室保存备用,再用同样方法分别采集卵泡期(卵巢表面分布多个明显有腔卵泡)、妊娠期(子宫角有胎儿)以及胎儿的卵巢、子宫和输卵管组织样。利用字向东等[23]的方法收集牦牛卵巢进行卵母细胞体外成熟(ⅣM)培养,分别收集GV期(0 h)、MⅠ期(12 h)和MⅡ期(24 h)卵母细胞和颗粒细胞[24]。
Single Cell-to-CtTMKit购自Invitrogen(美国)公司;TRIzol、总RNA提取试剂盒购自北京天漠科技开发有限公司;双抗、胎牛血清(FBS)购自Gibco(美国)公司;透明质酸酶、石蜡油购自Vitrolife(瑞典)公司;M199(10×)、17β-雌二醇(17β-E2)和丙酮酸钠购自Sigma(美国)公司;促卵泡素(FSH)和促黄体素(LH)购自Bioniche(加拿大)公司;RevertAid First Strand cDNA Synthesis Kit反转录试剂盒、Dream Taq Green PCR Master Mix(2×)、PowerUpTM SYBRTM Green Master Mix购自Thermo Scientific(美国)公司;DNA纯化回收试剂盒、大肠杆菌DH5α感受态细胞、pMD19-T载体、DL-2000 Marker购自成都擎科梓熙生物技术有限公司。PCR仪(ETC811)购自苏州东盛兴业科学仪器有限公司;实时荧光定量PCR仪(CFX6)购自伯乐公司;琼脂糖凝胶成像系统(CL1000)和恒温培养箱(Class100)均购自Thermo Scientific(美国)公司;体视显微镜(Stemi508)购自ZEISS(德国)公司。
1.2 总RNA的提取及反转录
参照Single Cell-to-CtTMKit试剂盒使用说明提取卵母细胞和颗粒细胞的总RNA;其他组织样总RNA用TRIzol法提取。使用紫外分光光度计检测RNA样品的浓度和纯度,选OD260/280值在1.8~2.0备用,然后使用2.0%琼脂糖凝胶电泳检测RNA的完整性。根据RevertAid First Strand cDNA Synthesis Kit反转录试剂盒使用说明书将样品RNA进行反转录为cDNA,-20 ℃保存备用。
1.3 引物设计与合成
参考GenBank中野牦牛DDIT3(登录号:XM_005901688.2)基因mRNA的预测序列,使用Primer Premier 5.0软件设计DDIT3基因的PCR引物和RT-qPCR引物;根据GenBank中牦牛的GAPDH(登录号:EU195062.1)设计RT-qPCR内参基因GAPDH的引物。所有引物(表1)由擎科梓熙(成都)生物技术有限公司合成。
表1 引物序列信息
Tab.1 Primer sequence information
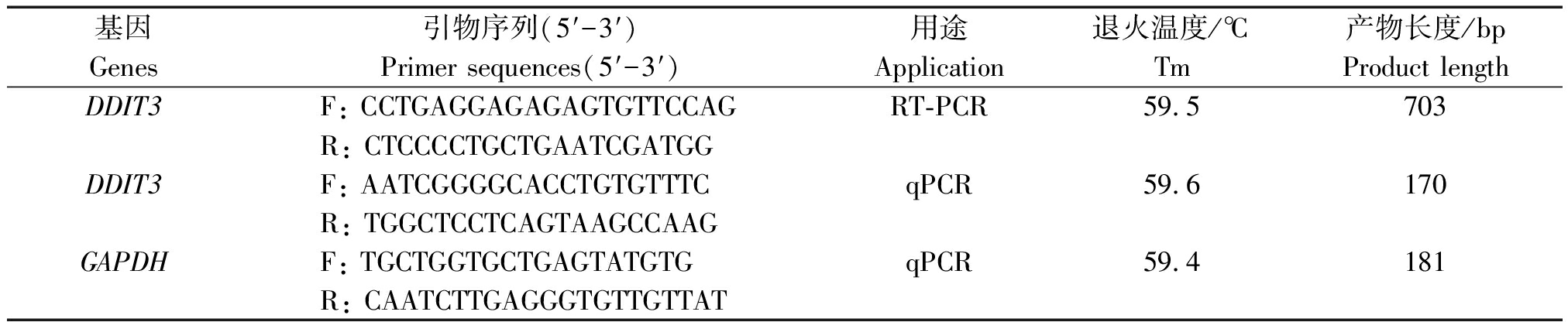
基因Genes引物序列(5′-3′)Primer sequences(5′-3′)用途Application退火温度/℃Tm产物长度/bpProduct lengthDDIT3F: CCTGAGGAGAGAGTGTTCCAGRT-PCR59.5703R: CTCCCCTGCTGAATCGATGGDDIT3F: AATCGGGGCACCTGTGTTTCqPCR59.6170R: TGGCTCCTCAGTAAGCCAAGGAPDHF: TGCTGGTGCTGAGTATGTGqPCR59.4181R: CAATCTTGAGGGTGTTGTTAT
1.4 DDIT3基因的克隆和测序
以黄体期牦牛卵巢cDNA为模板,对牦牛DDIT3基因进行PCR扩增。PCR反应为25 μL体系:cDNA模板1 μL、上下游引物各1 μL、Dream Taq Green PCR Master Mix(2×)12.5 μL、ddH2O 9.5 μL。PCR扩增程序:预变性(94 ℃,4 min);变性(94 ℃,30 s),退火(60 ℃,45 s),延伸(72 ℃,2 min),共38个循环;延伸(72 ℃,10 min),最后4 ℃保存。用2.0%琼脂糖凝胶电泳检测PCR产物,根据DNA纯化试剂盒操作说明纯化回收目的片段。将纯化后的PCR产物与pMD-19T载体连接,随后转化到DH5α感受态细胞,再均匀涂布到含Amp抗生素的LB平板上,37 ℃培养箱倒置培养过夜,挑取白色单菌落,接种到含Amp抗生素的LB液体培养基中摇床培养6 h,利用菌液PCR 鉴定阳性克隆[25],随后将阳性菌液送至擎科梓熙(成都)生物技术有限公司进行测序。
1.5 DDIT3基因的生物信息学分析
对牦牛DDIT3基因特性进行生物信息学分析,分析的具体项目和软件见表2。
表2 生物信息学分析内容及对应软件
Tab.2 Bioinformatics analysis content and corresponding software
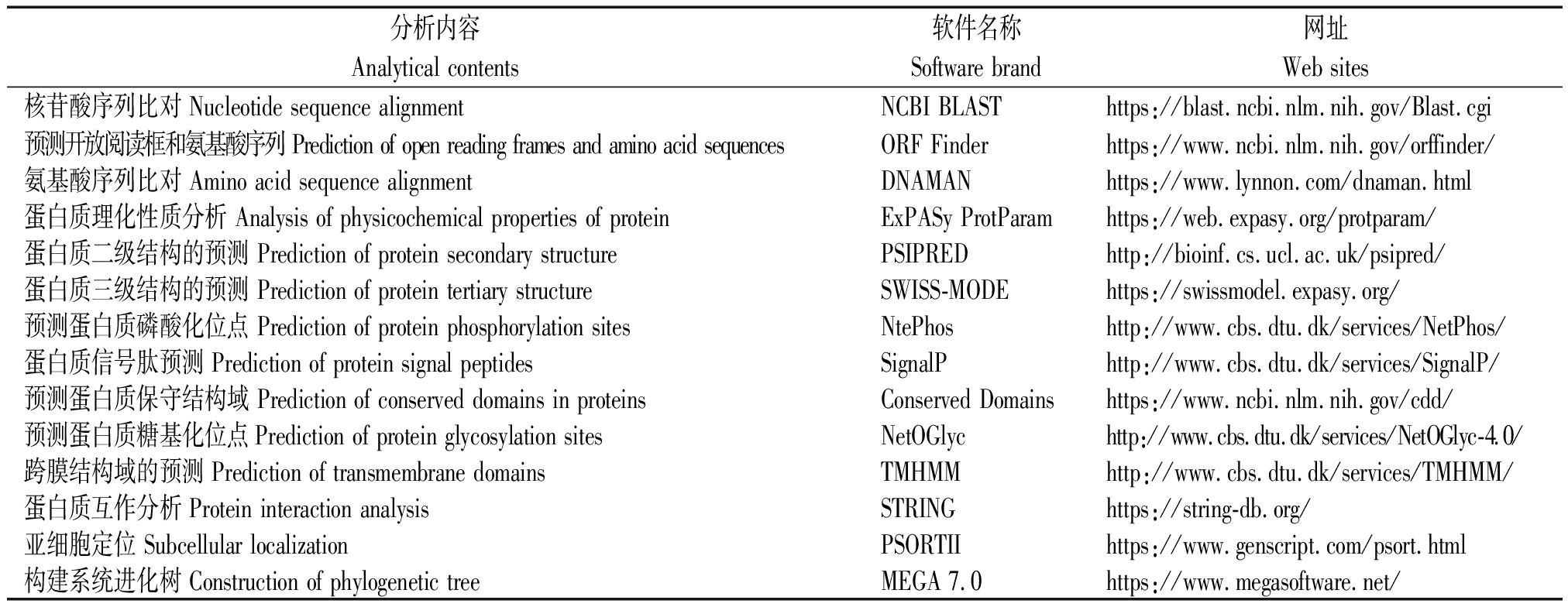
分析内容Analytical contents软件名称Software brand网址Web sites核苷酸序列比对 Nucleotide sequence alignmentNCBI BLASThttps://blast.ncbi.nlm.nih.gov/Blast.cgi预测开放阅读框和氨基酸序列 Prediction of open reading frames and amino acid sequencesORF Finderhttps://www.ncbi.nlm.nih.gov/orffinder/氨基酸序列比对 Amino acid sequence alignmentDNAMANhttps://www.lynnon.com/dnaman.html蛋白质理化性质分析 Analysis of physicochemical properties of proteinExPASy ProtParamhttps://web.expasy.org/protparam/蛋白质二级结构的预测 Prediction of protein secondary structurePSIPREDhttp://bioinf.cs.ucl.ac.uk/psipred/蛋白质三级结构的预测 Prediction of protein tertiary structureSWISS-MODEhttps://swissmodel.expasy.org/预测蛋白质磷酸化位点 Prediction of protein phosphorylation sitesNtePhoshttp://www.cbs.dtu.dk/services/NetPhos/蛋白质信号肽预测 Prediction of protein signal peptidesSignalPhttp://www.cbs.dtu.dk/services/SignalP/预测蛋白质保守结构域 Prediction of conserved domains in proteinsConserved Domainshttps://www.ncbi.nlm.nih.gov/cdd/预测蛋白质糖基化位点Prediction of protein glycosylation sitesNetOGlychttp://www.cbs.dtu.dk/services/NetOGlyc-4.0/跨膜结构域的预测 Prediction of transmembrane domainsTMHMMhttp://www.cbs.dtu.dk/services/TMHMM/蛋白质互作分析 Protein interaction analysisSTRINGhttps://string-db.org/亚细胞定位 Subcellular localizationPSORTIIhttps://www.genscript.com/psort.html构建系统进化树 Construction of phylogenetic treeMEGA 7.0https://www.megasoftware.net/
1.6 牦牛DDIT3基因的组织表达谱
采用RT-qPCR检测DDIT3基因的表达水平,反应体系为15 μL:上下游引物各0.5 μL、ddH2O 5.5 μL、PowerUpTM SYBRTM Green Master Mix 7.5 μL、各组织cDNA 1 μL。RT-qPCR反应程序:预变性(95 ℃,3 min);变性(95 ℃,10 s),退火(59.5 ℃,30 s),共39个循环。每个样品重复检测3次,记录每个样品的Ct值,根据2-ΔΔCt算法求出各组织样的相对表达量。
1.7 数据统计分析
本试验中的数据利用SPSS 21.0软件进行Duncan′s分析检测不同组间的差异显著性,其中P<0.01表示差异极显著,P<0.05表示差异显著;表达差异图利用Graphpad prism 8.02软件进行绘制。
2 结果与分析
2.1 牦牛DDIT3基因的克隆
分别以3头黄体期牦牛卵巢的cDNA为模板,通过RT-PCR扩增得到与预期长度大小一致的目的片段(图1)。通过测序得到牦牛DDIT3基因序列长度为703 bp,其中CDS区长507 bp,共编码168个氨基酸。将cDNA序列提交至NCBI,获得登录号MW506292。
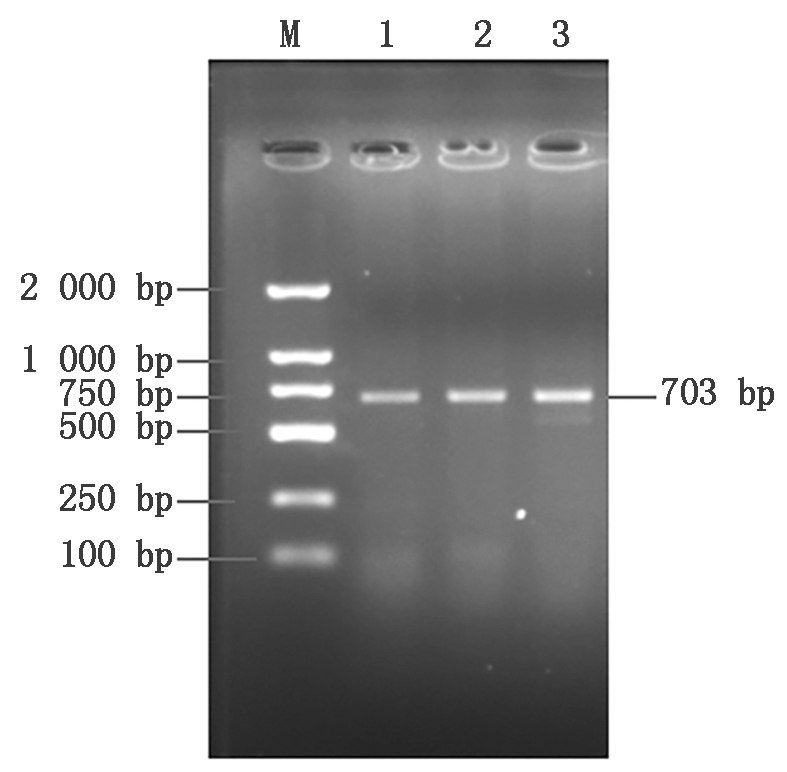
M.DL2000 DNA Marker;1-3.3头牦牛的DDIT3目的片段。
M.DL2000 DNA Marker;1-3. DDIT3 gene fragment of three yak.
图1 牦牛DDIT3基因扩增结果
Fig.1 Electrophoresis results of DDIT3 gene of yak
2.2 DDIT3基因同源性比对和构建系统进化树
利用DNAMAN将牦牛的DDIT3基因核苷酸和DDIT3蛋白质氨基酸与其他物种进行同源性比对(表3),核苷酸比对结果显示,牦牛与野牛序列相似度高达99.71%,其次是普通牛,相似性为99.58%;氨基酸序列比对结果显示,牦牛与野牛和普通牛的相似性高达100%,其次是水牛,序列相似度为99.40%,同时发现与表中其他物种的核苷酸序列和氨基酸序列的相似性均在88%以上,说明DDIT3基因在物种进化中具有高度保守性。
表3 牦牛和其他物种DDIT3基因和氨基酸序列的同源比对
Tab.3 DDIT3 nucleotide and deduced amino acid identities in yaks compared to other species %
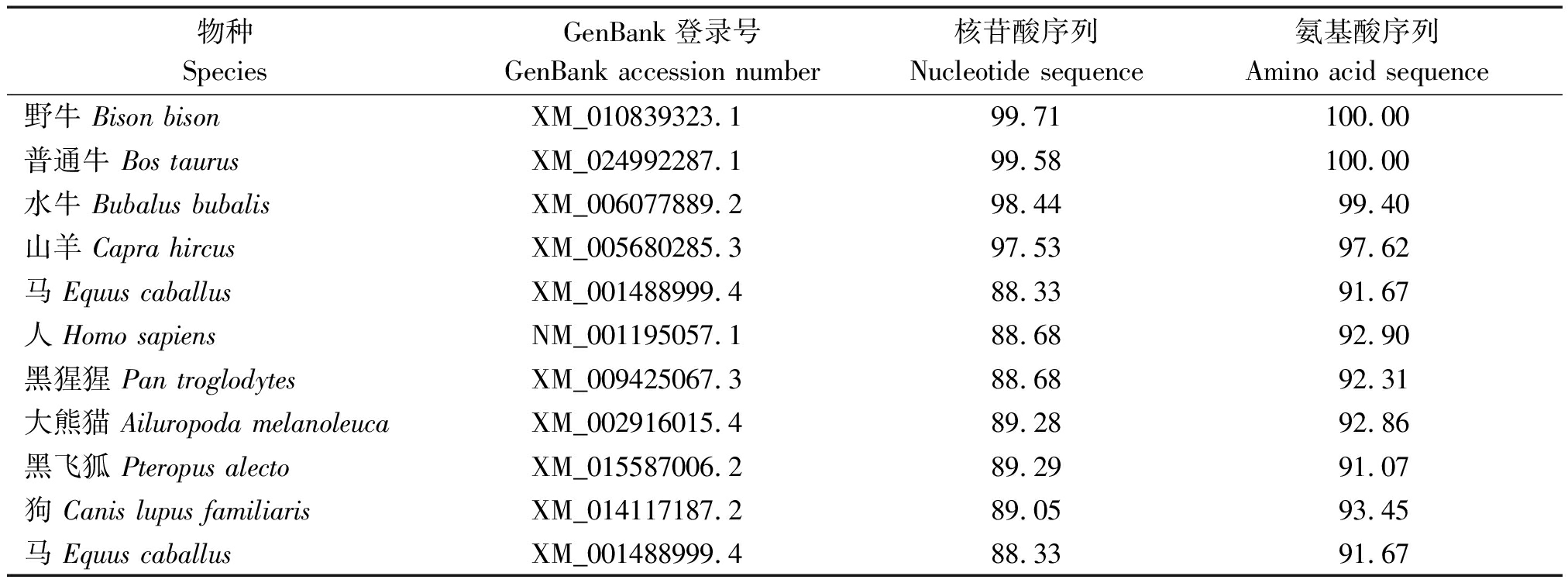
物种SpeciesGenBank登录号GenBank accession number核苷酸序列Nucleotide sequence氨基酸序列Amino acid sequence野牛 Bison bisonXM_010839323.199.71100.00 普通牛 Bos taurusXM_024992287.199.58100.00 水牛 Bubalus bubalisXM_006077889.298.4499.40 山羊 Capra hircusXM_005680285.397.5397.62马 Equus caballusXM_001488999.488.3391.67人 Homo sapiensNM_001195057.188.6892.90 黑猩猩 Pan troglodytesXM_009425067.388.6892.31大熊猫 Ailuropoda melanoleucaXM_002916015.489.2892.86黑飞狐 Pteropus alectoXM_015587006.289.2991.07狗 Canis lupus familiarisXM_014117187.289.0593.45马 Equus caballusXM_001488999.488.3391.67
为了进一步研究牦牛DDIT3基因的进化过程,利用MEGA 7.0构建牦牛DDIT3基因的系统进化树,结果显示(图2),牦牛首先与野牛聚为一类,说明牦牛DDIT3基因与野牛亲缘关系最近,这也间接证明牦牛在分类学上与野牛更接近;其次与普通牛、水牛、山羊、绵羊、羊驼聚为一类,这些动物都属于反刍动物;再与马、人、黑猩猩、狗、大熊猫聚为一类;最后与穿山甲聚为一类,与牦牛DDIT3基因亲缘关系最远的是穿山甲,说明该基因的进化符合物种的进化规律。
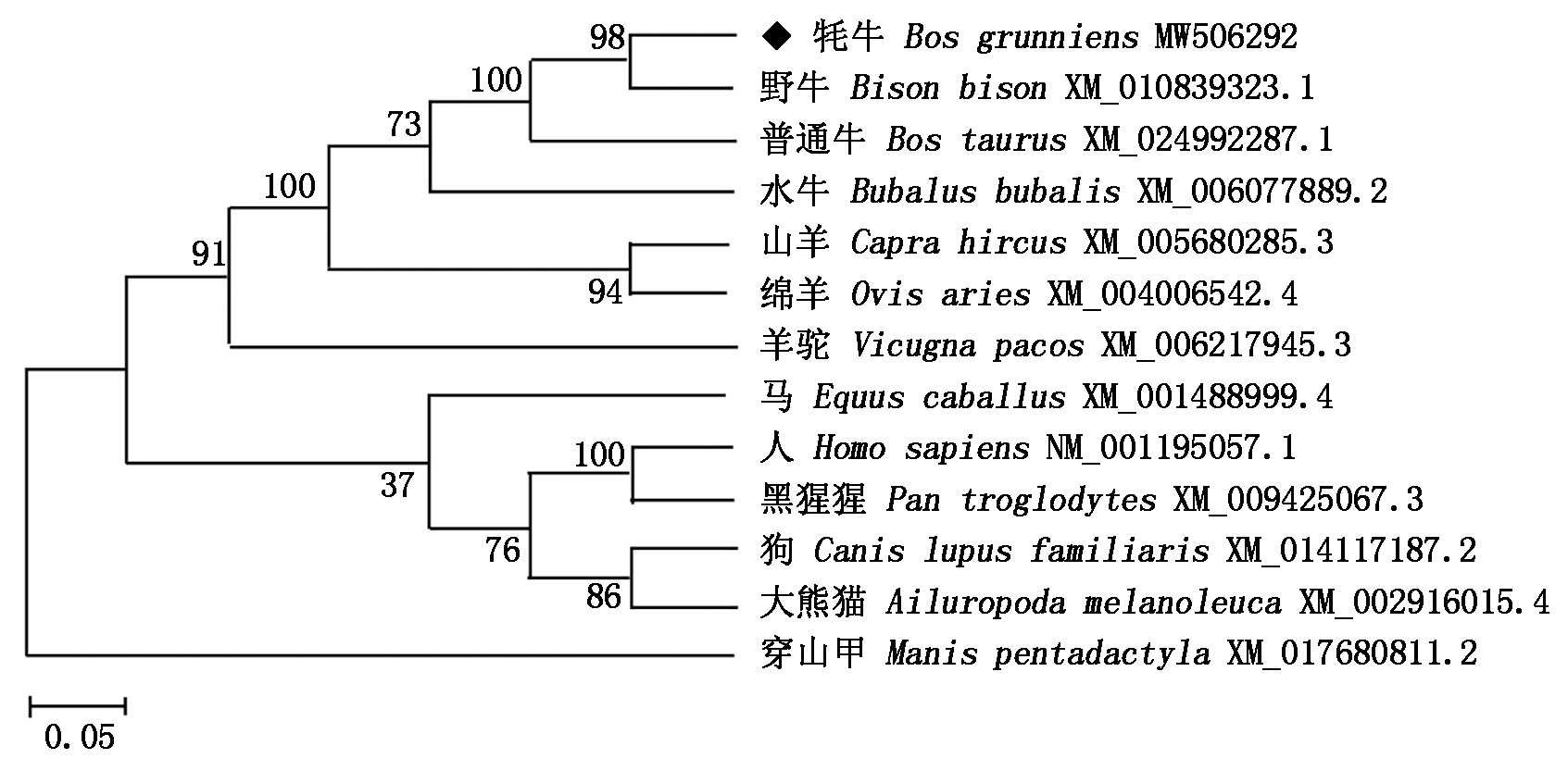
图2 DDIT3基因的系统进化树
Fig.2 Phylogenetic tree of DDIT3 gene
2.3 牦牛DDIT3蛋白质理化性质的预测
利用ExPASy Protparam tool在线软件对牦牛DDIT3的氨基酸序列进行预测分析,结果显示,该蛋白质分子式为C804H1286N240O283S5,分子质量为19.00 ku;脂肪族系数为55.83、不稳定系数为87.84、亲水性总平均值为-1.137、理论等电点为4.78、估计半衰期为30 h、消光系数为18 115;DDIT3蛋白一共包含20种氨基酸,其中含量最高的是谷氨酸(Glu),其次是丝氨酸(Ser),占比分别为17.3%,11.3%,其他氨基酸含量均低于10%,带负电荷(Asp+Glu)的氨基酸残基总数和带正电荷(Arg+Lys)的氨基酸残基总数分别为34和22。因此,可以推断DDIT3蛋白属于酸性不稳定亲水蛋白。
利用NetPhos 3.1预测牦牛DDIT3的磷酸化位点,结果显示,其包含24个磷酸化位点,其中包含18个丝氨酸(Ser)磷酸化位点、5个苏氨酸(Thr)磷酸化位点和1个酪氨酸(Tyr)磷酸化位点(图3);利用NetOGlyc 4.0预测牦牛DDIT3的糖基化位点,结果显示,其包含14个糖基化位点,其中包含12个O-糖基化位点和2个N-糖基化位点。蛋白质的亚细胞定位显示,DDIT3蛋白主要存在于细胞核(43.5%)和细胞质(30.4%)内,其次是细胞骨架(17.4%)和线粒体(8.7%)。
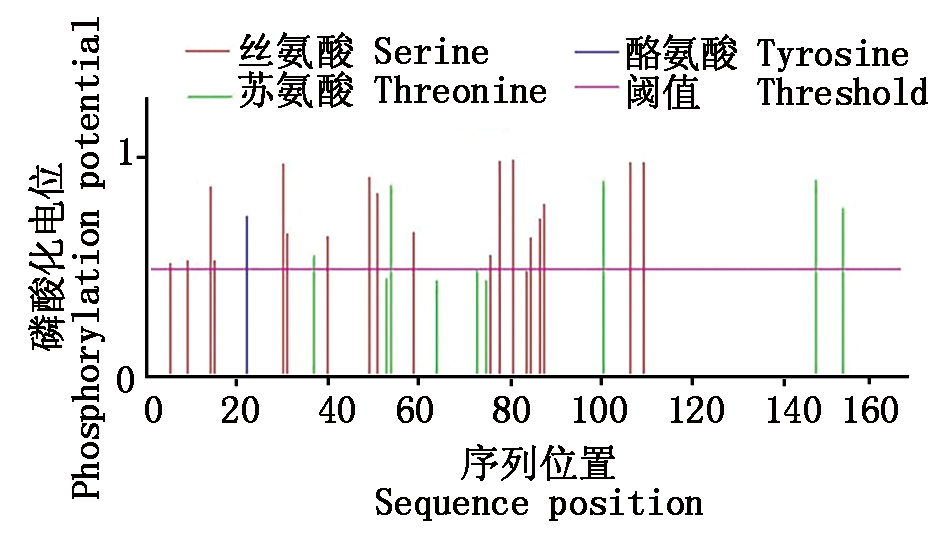
图3 牦牛DDIT3蛋白潜在的磷酸化位点分析
Fig.3 Analysis of potential phosphorylation
sites of DDIT3 protein in yak
2.4 牦牛DDIT3蛋白质结构和功能的预测
通过线上软件对DDIT3的二级结构和三级结构进行预测,结果显示,DDIT3蛋白中α-螺旋占比51.19%、无规则卷曲占比48.81%,不具有β-转角、跨膜结构、胞外结构、无序结构、信号肽序列等结构(图4-A)。三级结构(图4-B)与二级结构相吻合,牦牛DDIT3蛋白含有CDC45和bZIP 2个保守蛋白功能结构域,其中CDC45是酿酒酵母中启动DNA复制所必需的基因,碱性亮氨酸拉链因子(bZIP)是一类重要的增强子类转录因子(图4-C)。
2.5 蛋白网络互作图分析
通过STRING线上分析软件对牦牛DDIT3蛋白进行蛋白网络互作分析,结果显示,与DDIT3互作紧密的蛋白有ATF4、ATF6、XBP1、HSPA5、ATF3、BCL2L11,它们的相关性系数分别是0.990,0.978,0.978,0.946,0.932,0.928(图5)。其中ATF4能促进天冬酰胺合成酶(ASNS)的合成,与DDIT3协同作用;ATF6是一种存在于内质网的跨膜蛋白,当内质网应激诱导的蛋白水解后,它通过编码内质网伴侣基因启动子中的顺式作用元件,从而发挥核转录因子的作用;XBP1在内质网应激过程中充当转录因子,调节未折叠的蛋白反应;HSPA5在内质网内部多聚体蛋白复合物的组装中发挥重要作用,主要参与蛋白质的正确折叠和错误折叠蛋白质的降解;ATF3与cAMP反应元件结合,抑制含有ATF位点的启动子的转录;BCL2L11属于BCL-2蛋白家族,起到凋亡激活剂的作用。
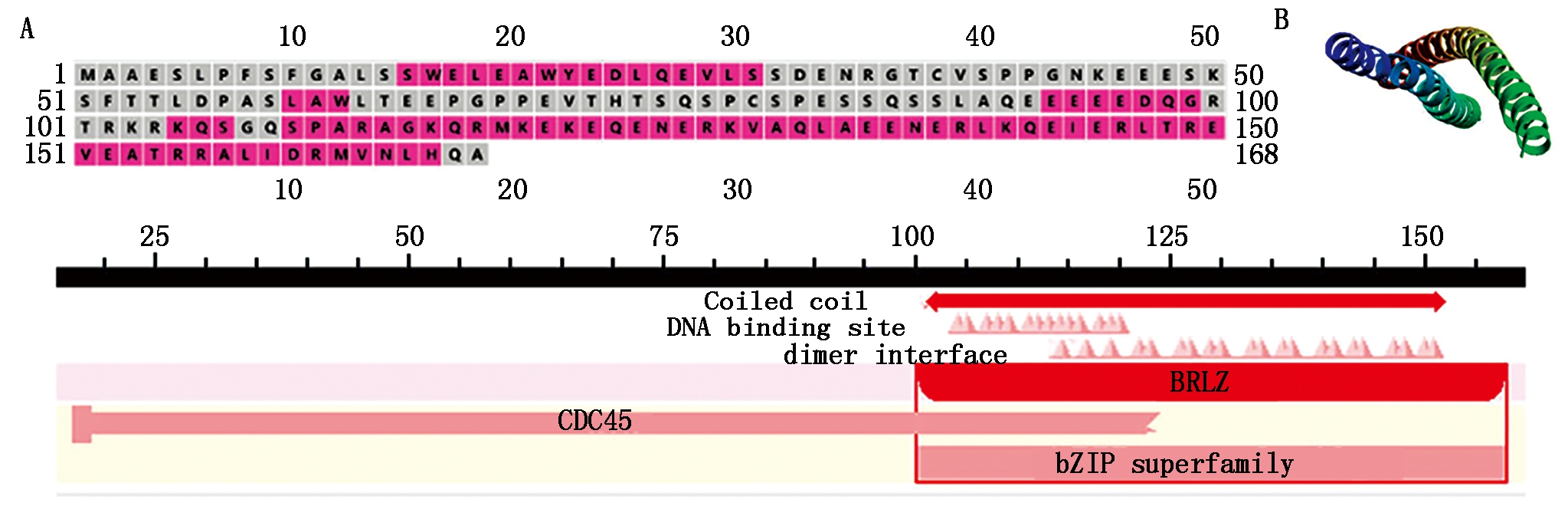
A.DDIT3蛋白的预测二级结构:其中红色代表α-螺旋,灰色代表无规则卷曲;
B.DDIT3蛋白的预测三级结构;C.预测的DDIT3蛋白保守结构域。
A.The predicted secondary structure of DDIT3 protein,in which red represents α-helix and gray represents irregular coil;
B.The predicted tertiary structure of DDIT3 protein;C.Predicted conserved domain of DDIT3 protein.
图4 牦牛DDIT3蛋白结构预测
Fig.4 Structure prediction of yak DDIT3 protein
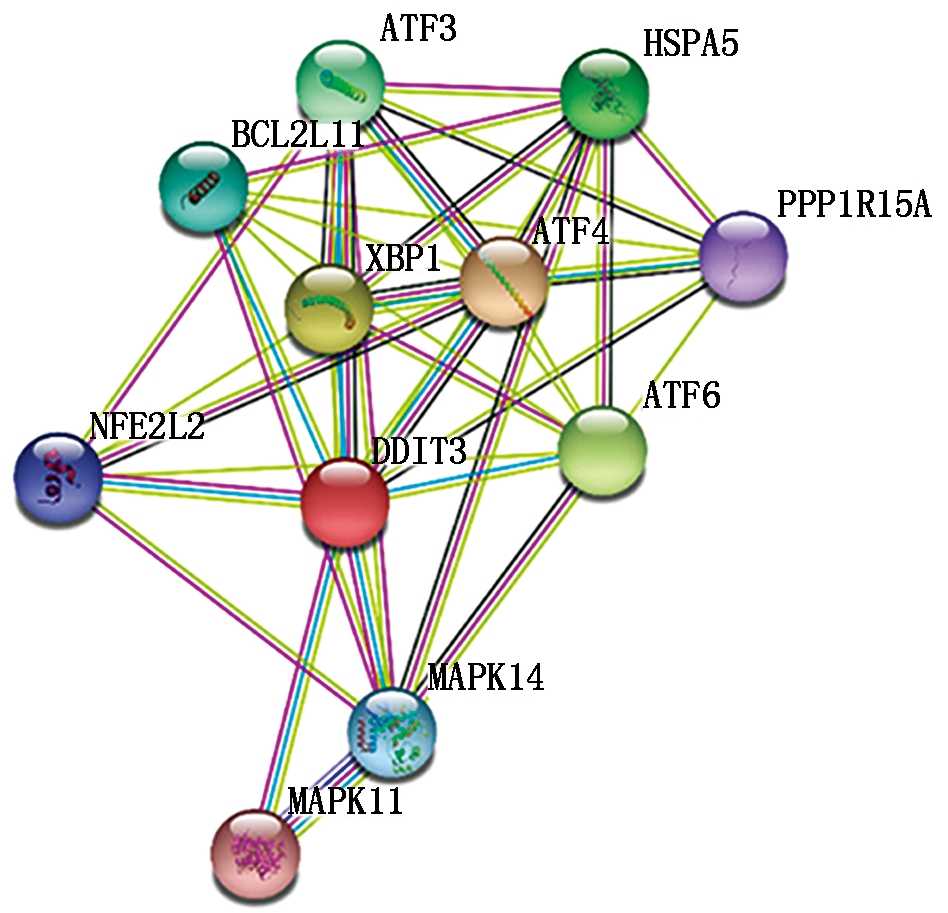
图5 牦牛DDIT3蛋白互作网络分析
Fig.5 Analysis of interaction network of yak DDIT3 protein
2.6 DDIT3基因组织表达分析
以子宫中DDIT3基因的相对表达量作为参考,利用RT-qPCR技术对牦牛心脏、肝脏、脾脏、肺、肾脏、输卵管、卵巢和子宫中DDIT3基因mRNA的表达水平进行检测。结果显示,DDIT3在这8个组织样中均有表达,其中在卵巢组织表达量最高,极显著高于其他组织样(P<0.01),其次表达量较高的是子宫和肾脏,子宫的相对表达量极显著高于脾脏(P<0.01),其他组织样中DDIT3的表达差异不显著,在所检测的组织中,脾脏的表达量最低(图6)。
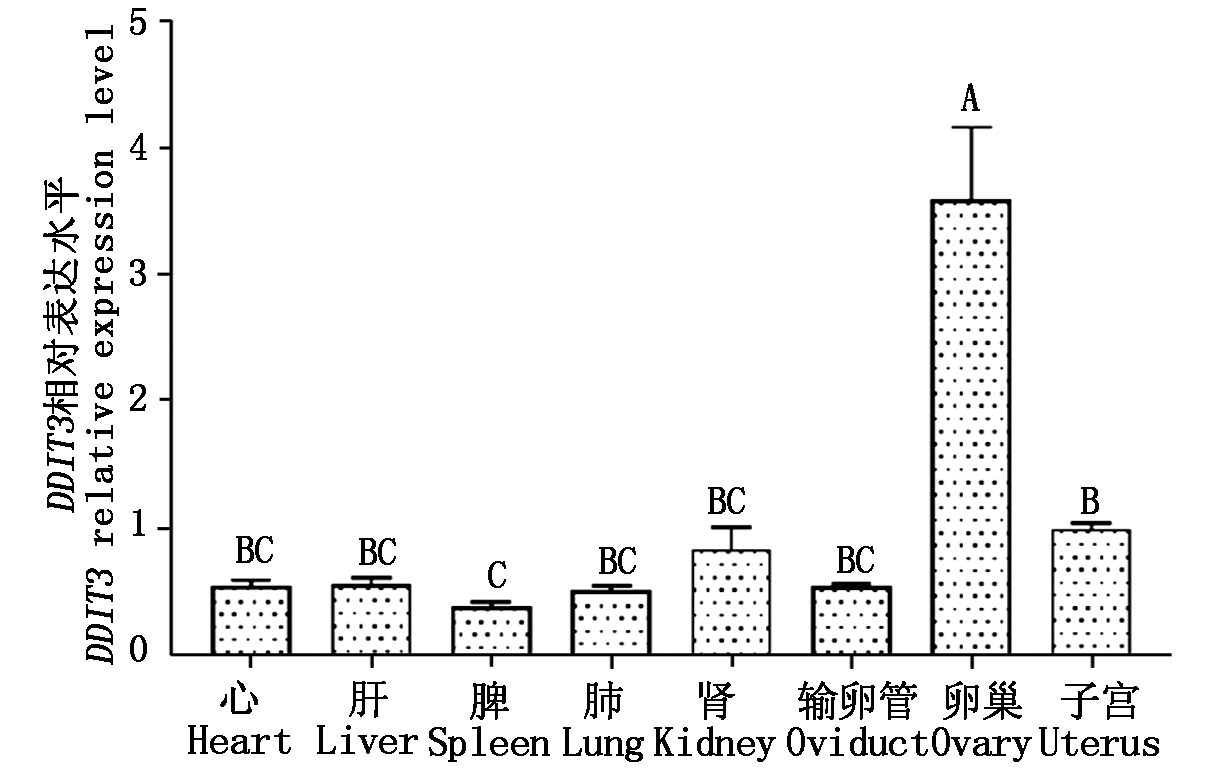
不同大写字母表示差异极显著(P<0.01);
不同小写字母表示差异显著(P<0.05)。图7-8同。
Different capital letters indicate extremely significant difference(P<0.01);
Different small letters indicate significant difference(P<0.05).
The same as Fig.7-8.
图6 牦牛DDIT3基因在不同组织的相对表达水平
Fig.6 Relative expression level of DDIT3
gene in different tissues of yak
以黄体期DDIT3基因的相对表达量作为参照,利用RT-qPCR检测牦牛不同时期卵巢、子宫和输卵管3个组织中DDIT3基因mRNA的表达水平。结果显示,妊娠期卵巢中DDIT3 mRNA表达量最高,显著高于其他3个时期(P<0.05),表达量较高的是黄体期卵巢,显著高于胎牛(P<0.05)(图7-A);在子宫中,DDIT3表达较高的是妊娠期,妊娠期显著高于卵泡期和胎牛(P<0.05),卵泡期和胎牛的表达差异不显著(图7-B);在输卵管中,DDIT3 mRNA各时期表达差异不显著(图7-C)。
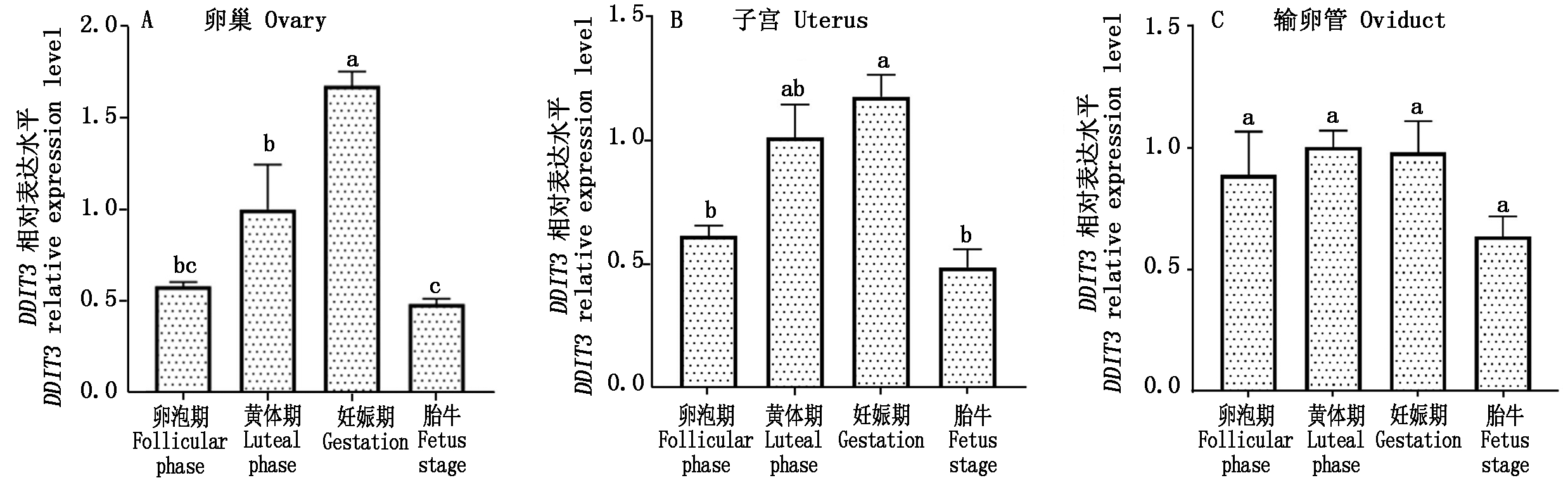
图7 牦牛DDIT3基因在生殖器官的相对表达水平
Fig.7 Relative expression level of DDIT3 gene in different reproductive organs of yak
2.7 卵母细胞及颗粒细胞中DDIT3基因的表达
以MⅡ期DDIT3基因的相对表达量作为参照,利用RT-qPCR对GV期、MⅠ期、MⅡ期卵母细胞和颗粒细胞中DDIT3基因的相对表达量进行分析。结果表明,MⅡ期卵母细胞DDIT3基因的相对表达量显著高于GV期和MⅠ期(P<0.05),而GV期与MⅠ期间的相对表达量差异不显著(图8-A);MⅡ期颗粒细胞中DDIT3的相对表达量显著高于GV期和MⅠ期(P<0.05),但GV期和MⅠ期差异不显著(图8-B),卵母细胞和颗粒细胞中DDIT3的相对表达变化趋势一致。
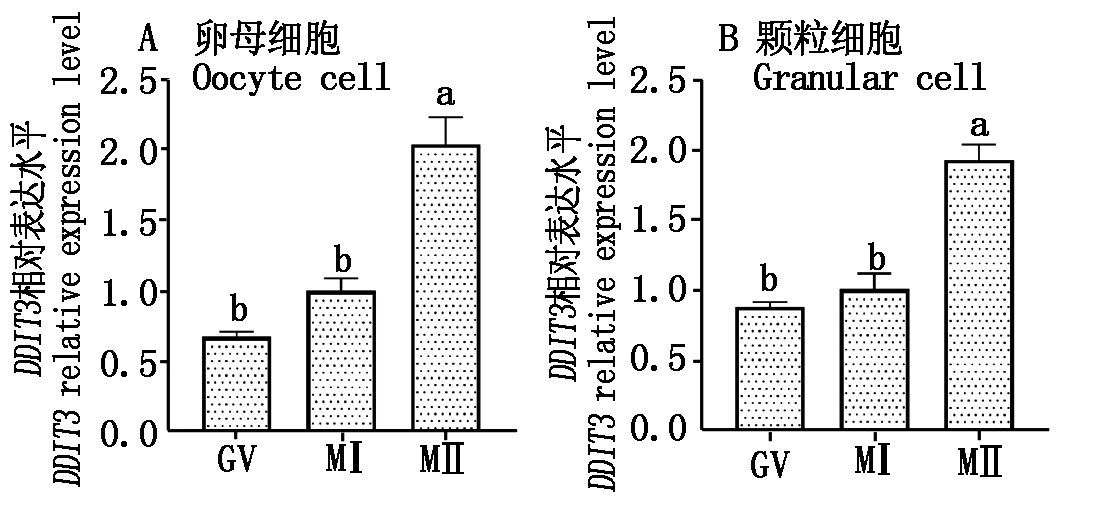
图8 牦牛DDIT3基因在卵母细胞和
颗粒细胞的相对表达水平
Fig.8 Relative expression level of DDIT3
gene in oocyte and granular cell of yak
3 讨论
内质网(ER)是真核生物中最大的细胞器之一,主要参与蛋白质折叠和成熟分泌、维持Ca2+稳态、磷脂合成等[2]。在葡萄糖不足、缺氧、Ca2+失衡和游离脂肪酸升高等生理或病理条件下会导致错误折叠蛋白质在ER中积累,进而诱导ERS的发生[3]。ERS包括PERK/eIF2α、IRE1α/XBP1和ATF6α 3条信号转导途径,研究证明,这3条途径最终均可诱导DDIT3基因的表达,从而促进细胞内凋亡过程的发生[26]。研究发现,DDIT3基因在小鼠[16]、牛[17]、猪[12]等动物生殖过程中处于动态的变化过程,其在动物生殖活动中起着重要的调控作用。牦牛是生活在高寒、低氧地区的特有畜种,但关于牦牛DDIT3基因及蛋白质的结构功能尚未见报道,本研究克隆出牦牛DDIT3基因,对其编码蛋白质的功能和理化性质进行预测,并分析了该基因的组织表达特性及其在卵母细胞发育与成熟过程中的表达情况。
本研究成功克隆出牦牛DDIT3基因,通过测序得到其完整的CDS区,在核苷酸序列比对和氨基酸序列比对中发现牦牛与野牛的同源性分别99.71%,100.00%,基因系统进化树上牦牛与野牛单独聚为一支,说明牦牛DDIT3基因的同源性与野牛最高,佐证了李齐发等[27]、郭松长等[28]认为牦牛与野牛的遗传相似性更高、亲缘关系更近的观点,为牦牛在牛亚科中的分类提供参考;在与其他物种核苷酸序列比对时发现DDIT3基因表现出物种间高度相似,说明DDIT3基因在物种进化中表现出高度保守。对牦牛DDIT3蛋白序列预测发现其含量最高的氨基酸是谷氨酸,占比17.3%,谷氨酸是下丘脑主要的兴奋性神经递质[29],它能与GnRH神经元末梢发生反应从而促进GnRH的分泌,进而促进垂体合成释放LH和FSH [30]。RT-qPCR结果显示处于黄体期的卵巢、输卵管、子宫中DDIT3的相对表达量均比卵泡期高,这可能与DDIT3的表达促进黄体期后期黄体细胞凋亡、黄体退化有关[15]。DDIT3蛋白的亚细胞定位显示其主要存在于细胞核和细胞质,说明DDIT3蛋白在细胞的遗传和代谢过程中起着重要作用。通过蛋白互作图可以发现与DDIT3联系紧密的蛋白有ATF4、ATF6、XBP1、ATF3、BCL2L11等,这与DDIT3的作用途径紧密关联。细胞内错误折叠蛋白累积导致PERK中的Bip释放,促进真核细胞中eIF2α磷酸化,eIF2α的磷酸化使错误蛋白失活,在另一途径中ATF4被同时激活,它与转录因子DDIT3结合发生作用,使行使完功能的eIF2α去磷酸化,从而使内质网恢复到正常状态,ATF4还会促使ATF3表达[26];Bip的释放也使ATF6由内质网转运到高尔基体中,由Site-1(S1P)和Site-2(S2P)剪接处理得到活性变体ATF6 p50,活性变体ATF6 p50转运到细胞核后可以促进DDIT3和抑制抗凋亡因子Mcl-1的表达来调节细胞凋亡[2];在内质网应激条件下,IRE1α被磷酸化激活,激活的IRE1α剪切编码XBP-1 mRNA内含子得到XBP-1剪接变异体(sXBP-1),sXBP-1诱导p58IPK表达从而抑制PERK活性以控制UPR反应,间接控制DDIT3的表达[3],本试验中牦牛DDIT3蛋白互作图说明了ERS 3条调节途径的紧密联系。
本试验RT-qPCR结果显示,卵巢中DDIT3基因相对表达量极显著高于其他组织,然后表达量较高的是子宫,在脾脏中表达量最低,这与人DDIT3基因的组织表达情况基本一致[31]。卵巢具有生殖(负责卵母细胞的发育成熟和排出以供受精)和激素(如雌激素、孕激素和雄激素)合成分泌的双重作用[32];子宫是早期胚胎附植、发育的场所,还具有调节卵巢功能、促进发情等功能[33]。 DDIT3基因在卵巢和子宫中的高表达说明母牦牛卵巢和子宫在发情周期中各种细胞的增殖与凋亡比其他组织活跃。研究证明,进入卵泡期之后卵母细胞生长速率逐渐增加,这可能导致细胞处于低氧状态[34],这种局部环境的变化可能会导致内质网功能障碍,进而导致未折叠和错误折叠的蛋白质积聚,从而引起ERS[35]。Lin等[36]在山羊闭锁卵泡的颗粒细胞中检测到DDIT3蛋白,非闭锁卵泡未检测到DDIT3蛋白,说明DDIT3通过ERS通路参与了卵母细胞的闭锁调控;ERS还与黄体的退化密切相关,Park等[37]发现牛和小鼠[17]的黄体期卵巢中ERS 3条信号通路均被激活,DDIT3的表达呈升高趋势,本试验也发现黄体期卵巢中DDIT3的相对表达量高于卵泡期和胎儿卵巢。本试验还发现妊娠期卵巢中DDIT3的相对表达量显著高于胎儿、卵泡期、黄体期卵巢,这说明妊娠刺激卵巢中DDIT3的高表达诱导卵泡ERS,从而抑制妊娠期卵巢卵泡的发育。Lin等[38]研究发现小鼠怀孕第5天开始,子宫中Bip表达明显上调,说明胎儿着床诱发了ERS,而Liu等[39]发现子宫ERS的持续高水平表达可能是造成早期胚胎流产,本试验RT-qPCR结果显示,妊娠期子宫DDIT3的相对表达量高,说明在高寒、低氧、营养匮乏的高原环境条件下,妊娠期牦牛的子宫也处于ERS状态,可能导致母牦牛在冬春季节流产率高。
卵母细胞与颗粒细胞间的作用密不可分,颗粒细胞可以诱导卵母细胞发生减数分裂,促进细胞质成熟;同时卵母细胞在颗粒细胞的成熟和分化中起着重要调控作用[40]。本试验RT-qPCR结果显示,DDIT3基因在牦牛各阶段卵母细胞和颗粒细胞中均有表达,但相对表达量存在差异。MⅡ期卵母细胞和颗粒细胞中DDIT3的相对表达量都显著高于GV期和MⅠ期,GV期和MⅠ期中DDIT3的表达差异不显著,这与Park等[12]在猪上的研究结果类似,本试验中卵母细胞和颗粒细胞DDIT3基因的表达变化趋势呈现出一致性。卵母细胞在成熟过程中代谢速率加快,这会导致卵母细胞内源性活性氧(ROS)增加从而出现氧化应激[41],ERS与氧化应激通常同时存在,氧化应激的存在会加快卵母细胞的衰老[42]。Zhang等[43]在培养基中添加50 μmoL 的TUDCA可以显著提高猪GV期、MⅠ期和MⅡ期卵母细胞的成熟率;Zhao等[13]也发现在玻璃化冷冻小鼠卵母细胞时添加TUDCA可以显著提高小鼠卵母细胞的存活率;Park等[12]发现可以通过褪黑素来减少体外成熟过程中的内质网应激从而改善猪卵母细胞减数分裂;杨方晓等[44]研究在培养基中添加HT-2毒素培养12 h会促进牛颗粒细胞中DDIT3的表达从而诱导ERS的发生,再添加褪黑素培养12 h后发现DDIT3的表达下调,说明颗粒细胞中ERS得到缓解。基于前人研究可以发现,DDIT3基因在卵母细胞减数分裂过程中表达上调可能对卵母细胞成熟以及早期胚胎的发育造成不良影响,但可以通过添加外源ERS抑制剂来改善这种情况,这为提高牦牛卵母细胞体外成熟效率提供了启示。
本研究成功克隆出牦牛DDIT3基因并通过测序获得其完整的CDS区,核苷酸序列比对发现牦牛DDIT3基因与野牛最接近,在进化过程中表现出高度保守;DDIT3基因在牦牛各组织中均有表达,其中在卵巢和子宫中的相对表达量较高,在妊娠期和黄体期的卵巢和子宫中表达较高,在MⅡ期卵母细胞和颗粒细胞中表达较高。说明DDIT3可能在维持母牦牛卵巢机能与妊娠以及卵泡发育与成熟过程中发挥重要的调控作用,该研究结果对于研究动物对高寒低氧环境的适应性及其对生殖机能的影响也具有一定参考价值。
[1] Phillips M J,Voeltz G K. Structure and function of ER membrane contact sites with other organelles[J].Nature Reviews Molecular Cell Biology, 2016,17(2):69-82. doi:10.1038/nrm.2015.8.
[2] Hetz C,Zhang K,Kaufman R J. Mechanisms,regulation and functions of the unfolded protein response[J].Nature Reviews Molecular Cell Biology, 2020,21(8):421-438. doi:10.1038/s41580-020-0250-z.
[3] Sisinni L,Pietrafesa M,Lepore S,Maddalena F,Condelli V,Esposito F,Landriscina M. Endoplasmic reticulum stress and unfolded protein response in breast cancer:The balance between apoptosis and autophagy and its role in drug resistance[J].International Journal of Molecular Sciences, 2019,20(4):857. doi:10.3390/ijms20040857.
[4] Xue Q H,Li C H,Chen J,Guo H M,Li D Q,Wu X L. The protective effect of the endoplasmic reticulum stress-related factors BiP/GRP78 and CHOP/Gadd153 on noise-induced hearing loss in Guinea pigs[J].Noise & Health, 2016,18(84):247-255.doi:10.4103/1463-1741.192481.
[5] Averous J,Bruhat A,Jousse C,Carraro V,Thiel G,Fafournoux P. Induction of CHOP expression by amino acid limitation requires both ATF4 expression and ATF2 phosphorylation[J].Journal of Biological Chemistry,2004,279(7):5288-5297. doi:10.1074/jbc.M311862200.
[6] Liu X G,Yue P,Zhou Z M,Khuri F R,Sun S Y. Death receptor regulation and celecoxib-induced apoptosis in human lung cancer cells[J].Journal of the National Cancer Institute,2004,96(23):1769-1780.doi:10.1093/jnci/djh322.
[7] G ll T,Balla G,Balla J. Heme,heme oxygenase,and endoplasmic reticulum stress-A new insight into the pathophysiology of vascular diseases[J].International Journal of Molecular Sciences,2019,20(15):3675.doi:10.3390/ijms20153675.
ll T,Balla G,Balla J. Heme,heme oxygenase,and endoplasmic reticulum stress-A new insight into the pathophysiology of vascular diseases[J].International Journal of Molecular Sciences,2019,20(15):3675.doi:10.3390/ijms20153675.
[8] Pandey V K,Mathur A,Kakkar P. Emerging role of Unfolded Protein Response(UPR)mediated proteotoxic apoptosis in diabetes[J].Life Sciences,2019,216(1):246-258. doi:10.1016/j.lfs.2018.11.041.
[9] Syc-Mazurek S B,Fernandes K A,Wilson M P,Shrager P,Libby R T. Together JUN and DDIT3(CHOP) control retinal ganglion cell death after axonal injury[J].Molecular Neurodegeneration,2017,12(1):71.doi:10.1186/s13024-017-0214-8.
[10] Guzel E,Arlier S,Guzeloglu-Kayisli O,Tabak M S,Ekiz T,Semerci N,Larsen K,Schatz F,Lockwood C J,Kayisli U A. Endoplasmic reticulum stress and homeostasis in reproductive physiology and pathology[J].International Journal of Molecular Sciences,2017,18(4):792.doi:10.3390/ijms18040792.
[11] Lin T,Lee J E,Kang J W,Shin H Y,Lee J B,Jin D I. Endoplasmic reticulum(ER)stress and unfolded protein response(UPR)in mammalian oocyte maturation and preimplantation embryo development[J].International Journal of Molecular Sciences,2019,20(2):409.doi:10.3390/ijms20020409.
[12] Park H J,Park J Y,Kim J W,Yang S G,Jung J M,Kim M J,Kang M J,Cho Y H,Wee G,Yang H Y,Song B S,Kim S U,Koo D B. Melatonin improves the meiotic maturation of porcine oocytes by reducing endoplasmic reticulum stress during in vitro maturation[J].Journal of Pineal Research,2018,64(2):e12458.doi:10.1111/jpi.12458.
[13] Zhao N,Liu X J,Li J T,Zhang L,Fu Y,Zhang Y J,Chen R X,Wei X Q,Wang R,Wang Y,Zhang J M. Endoplasmic reticulum stress inhibition is a valid therapeutic strategy in vitrifying oocytes[J].Cryobiology,2015,70(1):48-52. doi:10.1016/j.cryobiol.2014.12.001.
[14] Park H J,Park S J,Koo D B,Lee S R,Kong I K,Ryoo J W,Park Y I,Chang K T,Lee D S. Progesterone production is affected by unfolded protein response(UPR)signaling during the luteal phase in mice[J].Life Sciences,2014,113(1/2):60-67. doi:10.1016/j.lfs.2014.07.033.
[15] Yang Y Z,Sun M,Shan Y Y,Zheng X M,Ma H M,Ma W Z,Wang Z S,Pei X Y,Wang Y R. Endoplasmic reticulum stress-mediated apoptotic pathway is involved in corpus luteum regression in rats[J].Reproductive Sciences,2015,22(5):572-584. doi:10.1177/1933719114553445.
[16] Ali I,Liu H X,Li Z S,Ma D X,Xu L J,Shah S Z A,Ullah O,Fang A Z . Reduced glutathione alleviates tunicamycin-induced endoplasmic reticulum stress in mouse preimplantation embryos[J].The Journal of Reproduction and Development,2018,64(1):15-24.doi:10.1262/jrd.2017-055.
[17] Yoon S B,Choi S A,Sim B W,Kim J S,Mun S E,Jeong P S,Yang H J,Lee Y,Park Y H,Song B S,Kim Y H,Jeong K J,Huh J W,Lee S R,Kim S U,Chang K T. Developmental competence of bovine early embryos depends on the coupled response between oxidative and endoplasmic reticulum stress[J].Biology of Reproduction,2014,90(5):104. doi:10.1095/biolreprod.113.113480.
[18] Takahashi N,Harada M,Hirota Y,Nose E,Azhary J M,Koike H,Kunitomi C,Yoshino O,Izumi G,Hirata T,Koga K,Wada-Hiraike O,Chang R J,Shimasaki S,Fujii T,Osuga Y. Activation of endoplasmic reticulum stress in granulosa cells from patients with polycystic ovary syndrome contributes to ovarian fibrosis[J].Scientific Reports,2017,7(1):10824. doi:10.1038/s41598-017-11252-7.
[19] Jiang L L,Cui J Q,Zhang C L,Xie J K,Zhang S D,Fu D J,Duo W. Sigma-1 receptor is involved in diminished ovarian reserve possibly by influencing endoplasmic reticulum stress-mediated granulosa cells apoptosis[J].Aging, 2020,12(10):9041-9065. doi:10.18632/aging.103166.
[20] Qiu Q,Zhang G J,Ma T,Qian W B,Wang J Y,Ye Z Q,et al. The yak genome and adaptation to life at high altitude[J].Nature Genetics,2012,44(8):946-949. doi:10.1038/ng.2343.
[21] Lan D L,Xiong X R,Huang C,Mipam T D,Li J. Toward understanding the genetic basis of yak ovary reproduction:A characterization and comparative analyses of estrus ovary transcriptiome in yak and cattle[J].PLoS One,2016,11(4):e0152675. doi:10.1371/journal.pone.0152675.
[22] Xia Y,Wang Q,He X D,Chen Y,Jige M T,Zi X D. Cloning and expression analysis of the follicle-stimulating hormone receptor(FSHR)gene in the reproductive axis of female yaks(Bos grunniens)[J].Domestic Animal Endocrinology,2020,70:106383. doi:10.1016/j.domaniend.2019.07.011.
[23] 字向东,罗斌,夏威,郑玉才,熊显荣,李键,钟金城,朱江江,张正帆.基于RNA-Seq技术的牦牛体外受精胚胎发育转录组分析[J].中国农业科学,2018,51(8):1577-1589. doi:10.3864/j.issn.0578-1752.2018.08.015.
Zi X D,Luo B,Xia W,Zheng Y C,Xiong X R,Li J,Zhong J C,Zhu J J,Zhang Z F. Transcriptomic analysis of IVF embryonic development in the yak(Bos grunniens)via RNA-Seq[J].Scientia Agricultura Sinica,2018,51(8):1577-1589.
[24] 海卓,熊显荣,马鸿程,黄向月,闵星宇,李键.牦牛KDM7A表达谱分析及其在卵母细胞减数分裂进程中的表达[J].华北农学报,2020,35(6):217-224. doi:10.7668/hbnxb.20191191.
Hai Z,Xiong X R,Ma H C,Huang X Y,Min X Y,Li J. Analysis of KDM7A expression profile in yak and its expression in the process of oocyte meiosis[J].Acta Agriculturae Boreali-Sinica,2020,35(6):217-224.
[25] 李鑫,何小芳,张浩,郑建莹,王雨雪,林亚秋,王永,朱江江.山羊PHKG1基因克隆及其表达特性分析[J].华北农学报,2020,35(4):195-202.doi:10.7668/hbnxb.20190880.
Li X,He X F,Zhang H,Zheng J Y,Wang Y X,Lin Y Q,Wang Y,Zhu J J. Cloning and expression analysis of PHKG1 gene in goat[J].Acta Agriculturae Boreali-Sinica,2020,35(4):195-202.
[26] Kato H,Nishitoh H. Stress responses from the endoplasmic reticulum in cancer[J].Frontiers in Oncology,2015,5:93. doi:10.3389/fonc.2015.00093.
[27] 李齐发,李隐侠,赵兴波,潘增祥,刘振山,张庆波,屈旭光,宋大伟,董丽艳,李宁,谢庄.牦牛线粒体DNA D-loop区序列测定及其在牛亚科中分类地位的研究[J].畜牧兽医学报,2008,39(1):1-6.doi:10.3321/j.issn:0366-6964.2008.01.001.
Li Q F,Li Y X,Zhao X B,Pan Z X,Liu Z S,Zhang Q B,Qu X G,Song D W,Dong L Y,Li N,Xie Z. Sequencing D-loop region of mitochondrial DNA in yak and study on its taxonomic status in bovinae[J].Acta Veterinaria et Zootechnica Sinica,2008,39(1):1-6.
[28] 郭松长,刘建全,祁得林,杨洁,赵新全.牦牛的分类学地位及起源研究:mtDNAD-loop序列的分析[J].兽类学报,2006,26(4):325-330. doi:10.16829/j.slxb.2006.04.002.
Guo S C,Liu J Q,Qi D L,Yang J,Zhao X Q. Taxonomic placement and origin of yaks:Implications from analyses of mtDNA D-loop fragment sequences[J].Acta Theriologica Sinica, 2006,26(4):325-330.
[29] Yin D,Dong H,Wang T X,Hu Z Z,Cheng N N,Qu W M,Huang Z L. Glutamate activates the histaminergic tuberomammillary nucleus and increases wakefulness in rats[J].Neuroscience,2019,413:86-98.doi:10.1016/j.neuroscience.2019.05.032.
[30] Chaudhari N,Dawalbhakta M,Nampoothiri L. GnRH dysregulation in polycystic ovarian syndrome(PCOS)is a manifestation of an altered neurotransmitter profile[J].Reproductive Biology and Endocrinology, 2018,16(1):37. doi:10.1186/s12958-018-0354-x.
[31] Fagerberg L,Hallström B M,Oksvold P,Kampf C,Djureinovic D,Odeberg J,et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics[J].Molecular and Cellular Proteomics,2014,13(2):397-406.doi:10.1074/mcp.M113.035600.
[32] Berisha B,Schams D. Ovarian function in ruminants[J].Domestic Animal Endocrinology, 2005,29(2):305-317. doi:10.1016/j.domaniend.2005.02.035.
[33] Wray S,Prendergast C. The myometrium:From excitation to contractions and labour[J].Advances in Experimental Medicine and Biology,2019,1124:233-263. doi:10.1007/978-981-13-5895-1_10.
[34] Monniaux D,Michel P,Postel M,Clément F. Multi-scale modelling of ovarian follicular development:From follicular morphogenesis to selection for ovulation[J].Biology of the Cell, 2016,108(6):149-160.doi:10.1111/boc.201500087.
[35] Harada M,Nose E,Takahashi N,Hirota Y,Hirata T,Yoshino O,Koga K,Fujii T,Osuga Y. Evidence of the activation of unfolded protein response in granulosa and cumulus cells during follicular growth and maturation[J].Gynecological Endocrinology,2015,31(10):783-787. doi:10.3109/09513590.2015.1062862.
[36] Lin P F,Yang Y Z,Li X,Chen F L,Cui C C,Hu L Y,Li Q,Liu W,Jin Y P. Endoplasmic reticulum stress is involved in granulosa cell apoptosis during follicular atresia in goat ovaries[J].Molecular Reproduction and Development,2012,79(6):423-432.doi:10.1002/mrd.22045.
[37] Park H J,Park S J,Koo D B,Kong I K,Kim M K,Kim J M,Choi M S,Park Y H,Kim S U,Chang K T,Park C K,Chae J I,Lee D S. Unfolding protein response signaling is involved in development,maintenance,and regression of the corpus luteum during the bovine estrous cycle[J].Biochemical and Biophysical Research Communications,2013,441(2):344-350.doi:10.1016/j.bbrc.2013.10.056.
[38] Lin P F,Jin Y P,Lan X L,Yang Y Z,Chen F L,Wang N,Li X,Sun Y J,Wang A H. GRP78 expression and regulation in the mouse uterus during embryo implantation[J].Journal of Molecular Histology, 2014,45(3):259-268. doi:10.1007/s10735-013-9552-1.
[39] Liu A X,He W H,Yin L J,Lü P P,Zhang Y,Sheng J Z,Leung P C,Huang H F. Sustained endoplasmic reticulum stress as a cofactor of oxidative stress in decidual cells from patients with early pregnancy loss[J].The Journal of Clinical Endocrinology & Metabolism,2011,96(3):493-497.doi:10.1210/jc.2010-2192.
[40] 韩杰,熊显荣,蔡雯祎,杨显英,阿果约达,张燕红,李键.牦牛KDM4A基因克隆、组织表达谱及其在卵母细胞和颗粒细胞中的表达[J].畜牧兽医学报,2018,49(2):291-299.doi:10.11843/j.issn.0366-6964.2018.02.008.
Han J,Xiong X R,Cai W W,Yang X Y,A Guo Y D,Zhang Y H,Li J. Cloning of KDM4A gene and its expression in different tissues,oocyte and granulosa cell of yak[J].Acta Veterinaria et Zootechnica Sinica, 2018,49(2):291-299.
[41] Kang J T,Koo O J,Kwon D K,Park H J,Jang G,Kang S K,Lee B C.Effects of melatonin on in vitro maturation of porcine oocyte and expression of melatonin receptor RNA in cumulus and granulosa cells[J].Journal of Pineal Research,2009,46(1):22-28.doi:10.1111/j.1600-079x.2008.00602.x.
[42] Latham K E.Endoplasmic reticulum stress signaling in mammalian oocytes and embryos:Life in balance[J].International Review of Cell and Molecular Biology, 2015,316:227-265. doi:10.1016/bs.ircmb.2015.01.005.
[43] Zhang J Y,Diao Y F,Oqani R K,Han R X,Jin D I. Effect of endoplasmic reticulum stress on porcine oocyte maturation and parthenogenetic embryonic development in vitro[J].Biology of Reproduction, 2012,86(4):128,1-9.doi:10.1095/biolreprod.111.095059.
[44] 杨方晓,李莲,赵若含,王根林.褪黑素对HT-2毒素诱导的牛卵巢颗粒细胞内质网应激与自噬的影响[J].南京农业大学学报,2020,43(1):143-150. doi:10.7685/jnau.201812028.
Yang F X,Li L,Zhao R H,Wang G L. Effects of melatonin on endoplasmic reticulum stress and autophagy in bovine ovarian granulosa cells induced by HT-2 toxin[J].Journal of Nanjing Agricultural University,2020,43(1):143-150.