鹅细小病毒(Goose parvovirus,GPV)是在雏鹅和雏番鸭中引起,以厌食、腹泻和生长迟缓为典型症状的鹅细小病毒感染。该病发病率和死亡率高,一周龄内雏鹅感染GPV后死亡率可高达100%[1]。根据最新的ICTV病毒分类,GPV属于细小病毒科依赖病毒属,并与其亲缘关系密切的番鸭细小病毒(Muscovy duck parvovirus,MDPV)[2]被列为单一种,即雁形目依赖细小病毒1[3]。1956年,我国学者方定一首次报道在江苏省扬州地区发现一种能使大批雏鹅死亡的未知传染病,并于1961年用鹅胚分离到一种新病毒,他建议将该病毒定名为小鹅瘟病毒[4]。后来,研究人员发现该病毒为细小病毒,因此命名为GPV。GPV的发现被视为我国动物医学界的巨大成就之一。1978年世界家禽协会(World Poultry Association,WPA)建议把该病称为鹅细小病毒感染。目前,世界上许多国家和地区都有该病的发生[5-7]。我国已经有22个省(自治区、直辖市)有该病流行和发生的报道[8-12]。近年来GPV与其他水禽病毒共感染情况日趋普遍,带来的经济损失巨大,严重危害水禽养殖业的健康发展[13-17]。GPV为单链DNA病毒,基因组包含2 个开放阅读框(ORF),左侧ORF编码非结构蛋白NS,可编码NS1以及NS2蛋白;右侧ORF编码结构蛋白VP,可编码VP1、VP2 和VP3 3个结构蛋白,基因组两端为末端倒置重复序列(ITR)[18]。单克隆抗体自发明以来极大地推动了现代生命科学的发展,其在病毒学研究领域应用广泛[19]。尽管传统的单克隆抗体制备技术已然成熟,但其制备过程费时费力,越来越不能满足当前实践中对动物疫病诊断快速简便的要求[20]。抗体工程的出现和快速发展使人们有能力克服传统方法的缺点,通过改造抗体扬长避短,扩展了抗体应用的领域。如通过基因工程的方法克隆出杂交瘤细胞株中抗体基因的可变区序列,获得特定单抗的重链可变区(VH)和轻链可变区(VL)序列,构建入真核、原核表达载体中,就可以表达和制备有活性的重组抗体蛋白,这样不仅可以避免因杂交瘤细胞系易丢失染色体而失去应用价值、降低检测成本,还为抗体的定点基因改造进而提高亲和力打下了基础[21]。本研究通过原核表达系统实现抗 GPV NS1蛋白单克隆抗体VL、VH基因的表达,通过间接ELISA方法探究重组蛋白与GPV NS1蛋白的结合活性,制备可与GPV非结构蛋白特异性结合的基因工程抗体蛋白,为GPV检测奠定一定的物质基础。
1 材料和方法
1.1 试验材料
1.1.1 菌种、质粒、蛋白和抗体 原核表达载体pET-32a、大肠杆菌DH5α、Rosetta(DE3)、GPV感染鹅血清(琼扩试验效价1∶16)和重组GST-NS1蛋白(0.48 mg/mL)由齐齐哈尔大学生命科学与农林学院动物免疫学实验室保存。辣根过氧化物酶(HRP)标记His标签单克隆抗体购自Thermo Fisher公司;HRP标记兔抗鹅IgG由齐齐哈尔大学生命科学与农林学院动物免疫学实验室制备保存。
1.1.2 主要试剂 异丙基硫代半乳糖苷(IPTG)、DNA Marker、T4 DNA连接酶、BamHⅠ和XhoⅠ限制性内切酶购自TaKaRa公司。4氯-1-奈酚(4-CN)购自哈尔滨超峰生物科技发展有限公司。质粒提取试剂、胶回收试剂盒购自上海近岸科技有限公司。蛋白预染Marker购自Thermo Fisher公司。TMB显色液、TMB显色终止液购自上海碧云天生物技术有限公司。其余常规试剂为国产分析纯。
1.2 试验方法
1.2.1 原核表达载体构建 参考单克隆抗体杂交瘤细胞株3D9分泌的抗GPV-NS1蛋白单克隆抗体(IgM型,轻链为κ链)的VL、VH基因序列[22],依据大肠杆菌偏爱密码子进行优化后,交由苏州金唯智生物股份有限公司合成,合成质粒命名为pUC57-VL和pUC57-VH。合成基因的两端预留BamH Ⅰ和Xho Ⅰ限制性核酸内切酶酶切位点。用BamHⅠ/XhoⅠ双酶切pUC57-VL和pUC57-VH,回收目的片段VL和VH。将目的片段与同样双酶切回收后的表达载体pET-32a连接,转化大肠杆菌DH5α,涂布含氨苄青霉素(Amp)100 μg/mL的固体LB平板,37 ℃培养14~16 h。挑取单菌落接种至含有Amp 100 μg/mL的液体LB中,37 ℃培养14~16 h,提取质粒。单、双酶切鉴定质粒,交由哈尔滨博仕生物科技有限公司进行序列测定。重组质粒分别命名为pET-VL和pET-VH。
1.2.2 重组蛋白的诱导表达 将重组质粒pET-VL和pET-VH分别转化大肠杆菌Rosetta(DE3),涂布含有Amp 100 μg/mL的固体LB平板。37 ℃培养12~14 h,挑取单菌落,获得重组菌株。重组菌接种于含有Amp 100 μg/mL的液体LB培养基中,37 ℃振荡培养12~14 h。以1%比例转接新鲜的含有Amp 100 μg/mL的液体LB培养基,37 ℃振荡培养2~3 h后,菌液OD600达0.5~0.6时,加入IPTG至终浓度1.0 mmol/L,37 ℃诱导1~4 h后收获菌液沉淀,SDS-PAGE电泳分析。重组蛋白分别命名为TRX-VL和TRX-VH。
1.2.3 重组蛋白纯化及鉴定 重组蛋白经SDS-PAGE电泳后,参照参考文献[12]的方法切胶纯化。采用Bradford检测法分别对重组蛋白的含量进行测定[13]。纯化的重组蛋白经SDS-PAGE后,转印至硝酸纤维素(NC)膜,5%脱脂乳4 ℃封闭过夜,PBST洗3 遍,参照参考文献[12]的方法采用HRP标记的His标签单克隆抗体进行鉴定。
1.2.4 间接ELISA鉴定TRX-VL、TRX-VH与GST-NS1的结合活性 用0.4 μg的GST-NS1包被酶标板过夜,5% BSA封闭过夜。将重组蛋白TRX-VL和TRX-VH浓度调整为10 μg/mL,加入1∶1,1∶2,1∶5,1∶10,1∶20,1∶40,1∶80稀释的TRX-VL、TRX-VH蛋白100 μL,以TRX蛋白作为阴性对照、GPV感染鹅血清作为阳性对照,37 ℃孵育1.5 h。之后加入1∶10 000稀释的HRP标记抗His蛋白单抗或HRP标记兔抗鹅IgG,37 ℃孵育1 h。每次孵育间隔均洗涤3次。用TMB显色,用酶标仪读取OD450值。
1.2.5 阻断试验 用0.4 μg的GST-NS1包被酶标板过夜,5% BSA封闭过夜。加入1∶10,1∶100,1∶200,1∶500,1∶1 000,1∶2 000,1∶4 000稀释的GPV感染鹅血清,37 ℃孵育1.5 h。将重组蛋白TRX-VH浓度调整为10 μg/mL,加入1∶2稀释的TRX-VH蛋白100 μL,37 ℃孵育1.5 h。之后加入1∶10 000稀释的HRP标记抗His蛋白单抗,37 ℃孵育1 h。每次孵育间隔均洗涤3 次。用TMB显色,用酶标仪读取OD450值。
2 结果与分析
2.1 重组质粒酶切鉴定
构建的重组质粒pET-VL和pET-VH分别采用BamHⅠ单酶切和BamHⅠ/XhoⅠ双酶切,琼脂糖凝胶电泳检测结果表明,pET-VL经BamHⅠ单酶切获得了6 240 bp的DNA条带,BamHⅠ/XhoⅠ双酶切获得了5 900 bp的载体片段和大小为340 bp的目的条带;pET-VH经BamHⅠ单酶切获得了6 270 bp的DNA条带,BamHⅠ/XhoⅠ双酶切获得了5 900 bp的载体片段和大小为370 bp的目的条带。上述酶切结果与预期一致。测序结果证明外源基因插入载体位置与阅读框均正确。
2.2 重组蛋白TRX-VL和TRX-VH的表达
将构建的重组质粒pET-VL和pET-VH分别转化大肠杆菌Rosetta(DE3),经1.0 mmol/L IPTG诱导后1,2,3,4 h进行取样,SDS-PAGE结果表明,获得了重组蛋白TRX-VL和TRX-VH的表达,分子量分别为30.3,31.4 ku,与预期相符(图1,箭头所示)。
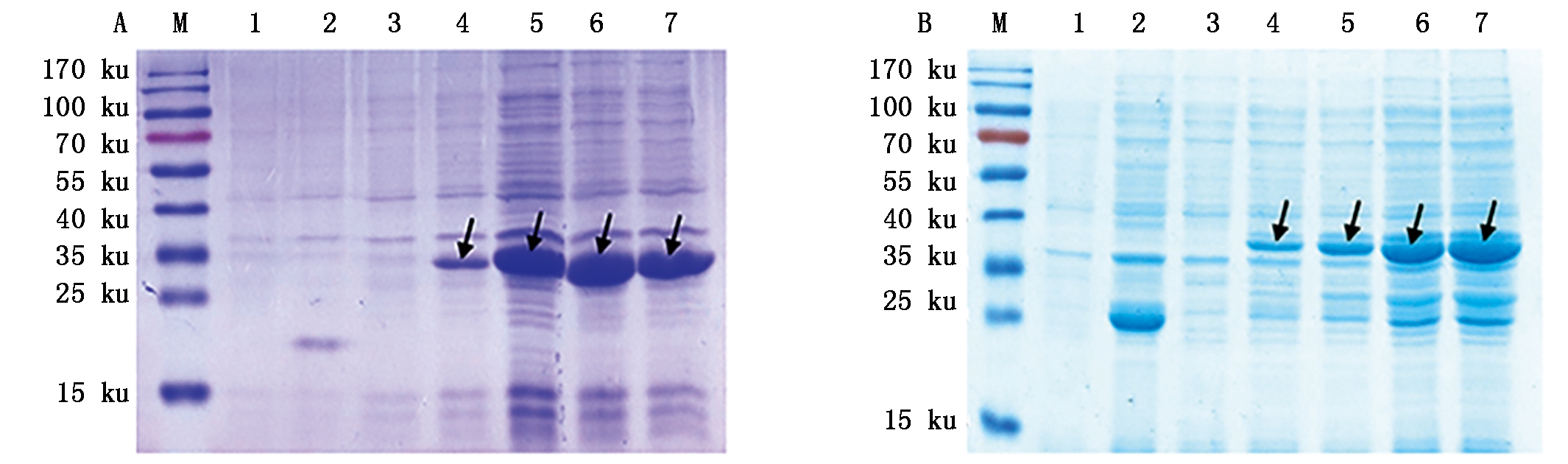
A.SDS-PAGE检测重组蛋白TRX-VL的表达:M.蛋白Marker;1.pET-32a/E.coli Rosetta(DE3)诱导前;2.诱导后4 h的pET-32a/E. coli Rosetta(DE3);3.pET-VL/E. coli Rosetta(DE3)诱导前;4-7.诱导1~4 h的pET-VL/E. coli Rosetta(DE3)。B.SDS-PAGE检测重组蛋白TRX-VH的表达:M.蛋白Marker;1.pET-32a/E. coli Rosetta(DE3)诱导前;2.诱导后4 h的pET-32a/E. coli Rosetta(DE3);3.pET-VH/E. coli Rosetta(DE3)诱导前;4-7.诱导1~4 h的pET-VH/E. coli Rosetta(DE3)。
A.Detection of recombinant protein TRX-VL by SDS-PAGE:M.Protein Marker;1.pET-32a/E.coli Rosetta(DE3)before induction;2.pET-32a/E. coli Rosetta(DE3)induced for 4 h;3.pET-VL/E. coli Rosetta(DE3)before induction;4-7.pET-VL/E. coli Rosetta(DE3)induced for 1-4 h. B.Detection of recombinant protein TRX-VH by SDS-PAGE:M.Protein Marker;1.pET-32a/E. coli Rosetta(DE3)before induction;2.pET-32a/E. coli Rosetta(DE3)induced for 4 h;3.pET-VH/E. coli Rosetta(DE3)before induction;4-7.pET-VH/E. coli Rosetta(DE3)induced for 1-4 h.
图1 重组蛋白TRX-VL和TRX-VH的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of recombinant protein TRX-VL and TRX-VH
2.3 重组蛋白TRX-VL和TRX-VH的纯化及鉴定
重组蛋白TRX-VL和TRX-VH切胶纯化,经His标签单克隆抗体鉴定的结果表明,所获得的表达蛋白为重组目的蛋白(图2)。采用Bradford检测法对重组蛋白的含量进行测定,获得重组蛋白TRX-VL和TRX-VH浓度分别为0.87,0.74 mg/mL。
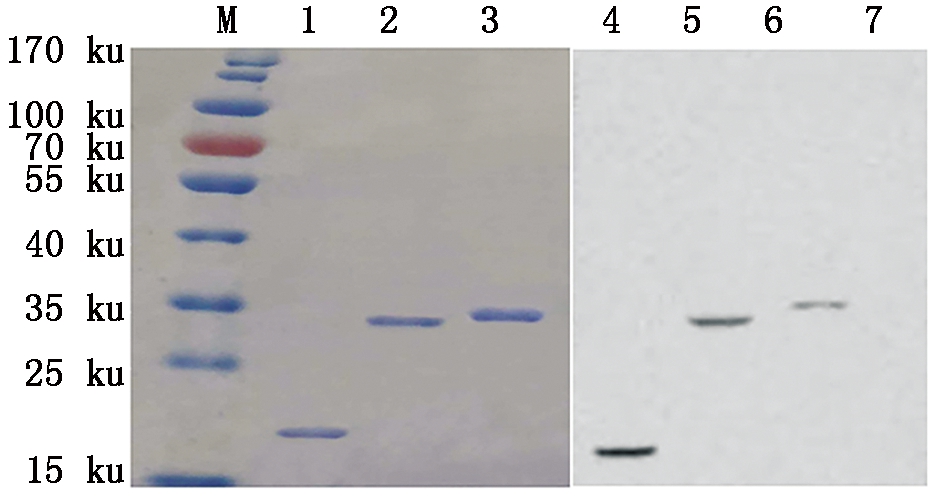
M.蛋白质Marker;1.TRX标签蛋白;2.TRX-VL;3.TRX-VH;
4.TRX标签蛋白;5.TRX-VL;6.TRX-VH;7.GST标签蛋白。
M.Protein Marker;1.TRX-tag protein;2.TRX-VL;3.TRX-VH;
4.TRX-tag protein;5.TRX-VL;6.TRX-VH;7.GST-tag protein.
图2 重组蛋白TRX-VL和TRX-VH的纯化及鉴定
Fig.2 Purification and identification of
recombinant protein TRX-VL and TRX-VH
2.4 间接ELISA鉴定TRX-VH、TRX-VL与GST-NS1的结合活性
间接ELISA鉴定结果表明,TRX-VH对GST-NS1蛋白的结合显示出了蛋白浓度相关性,结合能力随着TRX-VH浓度的降低而变弱,在TRX-VH为25 ng(1∶40)时仍显示出对抗原的一定结合活性;TRX-VL在各包被量下均没有表现出结合能力(图3)。
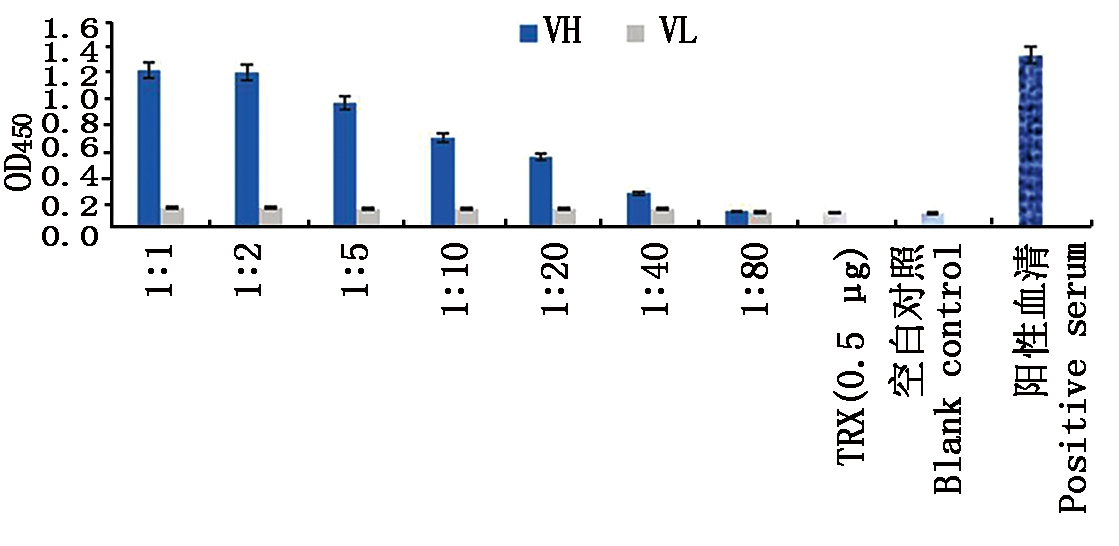
图3 重组蛋白TRX-VL和TRX-VH
与GST-NS1的结合活性检测(n=3)
Fig.3 Detection of binding activity of recombinant
protein TRX-VL and TRX-VH to GST-NS1(n=3)
2.5 阻断试验
阻断试验结果表明,用0.4 μg的GST-NS1包被后,1∶10、1∶100和1∶200稀释的GPV感染鹅血清可完全阻断TRX-VH与GST-NS1蛋白的结合。1∶500、1∶1 000、1∶2 000、1∶4 000稀释的GPV感染鹅血清阻断能力显示出浓度相关性,阻断能力随着血清浓度的降低而变弱(图4)。
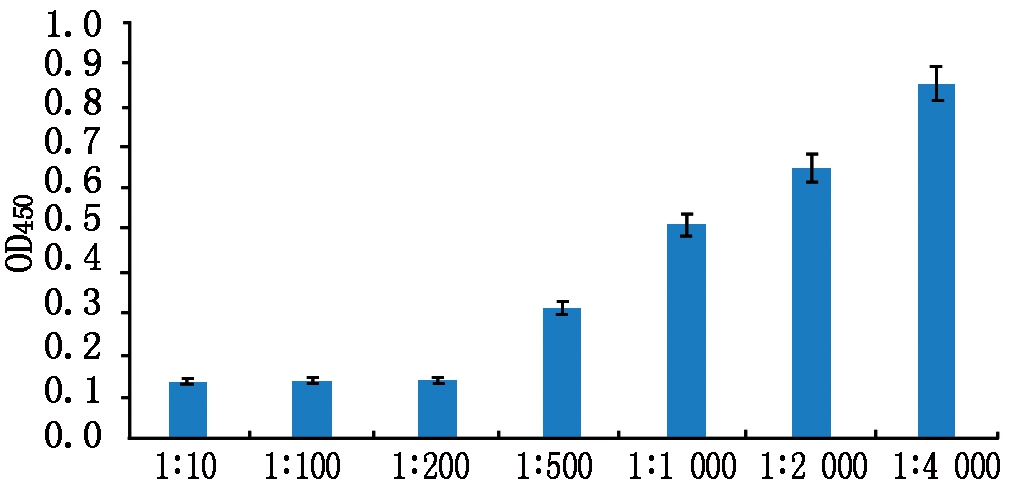
图4 重组蛋白TRX-VH和GST-NS1
结合的阻断试验(n=3)
Fig.4 Blocking test of recombinant protein
TRX-VH to GST-NS1(n=3)
3 讨论
天然抗体活性依赖于其复杂的立体结构和某些化学修饰,因此,可通过原核表达天然抗体的小分子片段获得抗体活性片段[23]。抗体的VH和VL共同组成抗原结合部位,抗体的特异性正是由这一部分决定。目前的基因工程重组抗体以构建VH和VL融合的单链抗体(Single-chain Fv,scFv)在原核生物中表达最为普遍[22]。有研究表明,VH片段在抗体与相应抗原的特异性结合过程起主要作用[24-25]。也有报道表明,单独的VL也能够与抗原结合[26],甚至有单独的可变区CDR3片段结合抗原的报道[27]。这些有活性的小分子抗体片段在临床应用上具有多方面优势,是替代多、单克隆抗体最有前途的新型抗体。本研究通过对抗GPV NS1单克隆抗体的小分子抗体片段的研究显示,重组TRX-VH蛋白可以与GST-NS1抗原结合,而TRX-VL无法与GST-NS1抗原结合。王锐[22]制备的抗GST-NS1蛋白单克隆抗体的scFv与GST-NS1重组蛋白的ELISA结合效价为1∶40,与本研究数值相当,表明VH承担了scFv的主要结合作用。由于单独的VL、VH片段不包含Fc片段,不易与常规的酶标二抗结合,给表达的抗体小分子片段的活性检测带来不便,为克服这一困难,本研究利用表达的融合蛋白上的标签蛋白作为检测标记。考虑到标签蛋白有可能影响融合蛋白的活性,本研究以TRX标签蛋白作为对照,试验结果表明,TRX标签蛋白不影响TRX-VH与GST-NS1的结合。本研究制备的具有活性的重组TRX-VH蛋白有望替代传统的多、单克隆抗体,给GPV的相关研究奠定了一定的物质基础。
[1] Shao H X,Jiang Y C,Yuan H S,Ji L F,Jin W J,Qian K,Ye J Q,Qin A J. Generation and molecular characteristics of a highly attenuated GPV strain through adaptation in GEF cells[J].BMC Veterinary Research,2020,16(1):456. doi:10.1186/s12917-020-02673-0.
[2] Shen H Q,Huang J F,Yan Z Q,Yin L J,Li Q H,Zhou Q F,Chen F. Isolation and characterization of a recombinant Muscovy duck parvovirus circulating in Muscovy ducks in South China[J].Archives of Virology,2020,165(12):2931-2936. doi:10.1007/s00705-020-04829-7.
[3] Zhang S,Yang J,Wang Z Z,Chen L,Diao Y X,Tang Y. Research Note:Development of an ELISA to distinguish between Goose parvovirus infection and vaccine immunization antibodies[J].Poultry Science,2020,99(3):1332-1340. doi:10.1016/j.psj.2019.12.012.
[4] 方定一. 小鹅瘟的介绍[J].中国畜牧兽医,1962,9(8):19-20.
Fang D Y. The introduction of gosling plague[J].Journal of China Animal Husbandry and Veterinary Medicine,1962,9(8):19-20.
[5] Matczuk A K,Chmielewska-W adyka M,Siedlecka M,Bednarek K J,Wieliczko A. Short beak and dwarfism syndrome in ducks in Poland caused by Novel goose parvovirus[J]. Animals(Basel),2020,10(12):2397.doi:10.3390/ani10122397.
adyka M,Siedlecka M,Bednarek K J,Wieliczko A. Short beak and dwarfism syndrome in ducks in Poland caused by Novel goose parvovirus[J]. Animals(Basel),2020,10(12):2397.doi:10.3390/ani10122397.
[6] ![]() Ö,Mü
Ö,Mü tak H K,Mü
tak H K,Mü tak
tak ![]() B. The first detection and characterization of Goose parvovirus(GPV)in Turkey[J].Tropical Animal Health and Production,2020,53(1):36. doi:10.1007/s11250-020-02463-8.
B. The first detection and characterization of Goose parvovirus(GPV)in Turkey[J].Tropical Animal Health and Production,2020,53(1):36. doi:10.1007/s11250-020-02463-8.
[7] Soliman M A,Erfan A M,Samy M,Mahana O,Nasef S A. Detection of Novel goose parvovirus disease associated with short beak and dwarfism syndrome in commercial ducks[J].Animals(Basel),2020,10(10):1833.doi:10.3390/ani10101833.
[8] Yan Y Q,He T Q,Li R,Zhang S Y,Wang K,Yi S S,Niu J T,Dong H,Hu G X. Molecular characterization and comparative pathogenicity of Goose parvovirus isolated from Jilin Province,northeast China[J].Avian Diseases,2019,63(3):481-485.doi:10.1637/aviandiseases-d-19-00075.
[9] Liu W J,Yang Y T,Zou H Y,Chen S J,Yang C,Tian Y B,Huang Y M. Identification of recombination in Novel goose parvovirus isolated from domesticated Jing-Xi partridge ducks in South China[J].Virus Genes,2020,56(5):600-609. doi:10.1007/s11262-020-01781-1.
[10] Li D L,Zhang L D,Chen S H,Gu J,Ding M J,Li J X. Detection and molecular characterization of two genotypes of Goose parvoviruses isolated from growing period geese and cherry valley ducks in China[J].Avian Diseases,2019,63(3):411-419. doi:10.1637/12015-121818-Reg.1.
[11] Wan C H,Liu R C,Chen C T,Cheng L F,Shi S H,Fu G H,Chen H M,Fu Q L,Huang Y. Novel goose parvovirus in domestic Linwu sheldrakes with short beak and dwarfism syndrome,China[J].Transboundary and Emerging Diseases,2019,66(5):1834-1839. doi:10.1111/tbed.13280.
[12] Bian G Z,Ma H B,Luo M P,Gong F P,Li B,Wang G P,Mohiuddin M,Liao M,Yuan J F. Identification and genomic analysis of two novel duck-origin GPV-related parvovirus in China[J].BMC Veterinary Research,2019,15(1):88. doi:10.1186/s12917-019-1833-9.
[13] Liu M M,Zhao Y,Hu D M,Huang X T,Xiong H F,Qi K Z,Liu H M. Clinical and histologic characterization of co-infection with Astrovirus and Goose parvovirus in goslings[J].Avian Diseases,2019,63(4):731-736. doi:10.1637/aviandiseases-D-19-00110.
[14] Liu H M,Hu D M,Zhu Y Q,Xiong H F,Lü X,Wei C Q,Liu M M,Yin D D,He C S,Qi K Z,Wang G J. Coinfection of Parvovirus and Astrovirus in gout-affected goslings[J].Transboundary and Emerging Diseases,2020,67(6):2830-2838. doi:10.1111/tbed.13652.
[15] Ting C H,Lin C Y,Huang Y C,Liu S S,Peng S Y,Wang C W,Wu H Y. Correlation between Goose circovirus and Goose parvovirus with gosling feather loss disease and goose broke feather disease in southern Taiwan[J]. Journal of Veterinary Science,2021,22(1):e1. doi:10.4142/jvs.2021.22.e1.
[16] Liu J,Yang X X,Hao X J,Feng Y S,Zhang Y L,Cheng Z Q. Effect of Goose parvovirus and duck Circovirus coinfection in ducks[J].Journal of Veterinary Research,2020,64(3):355-361. doi:10.2478/jvetres-2020-0048.
[17] Yang Y P,Sui N N,Zhang R H,Lan J J,Li P F,Lian C Y,Li H Q,Xie Z J,Jiang S J. Coinfection of Novel goose parvovirus-associated virus and duck Circovirus in feather sacs of Cherry Valley ducks with feather shedding syndrome[J].Poultry Science,2020,99(9):4227-4234. doi:10.1016/j.psj.2020.05.013.
[18] 朱新产,邵艳红,朱峰伟,杨丽金. 鹅细小病毒感染雏鹅的免疫球蛋白IgG/IgM变异性研究[J].华北农学报,2015,30(1):42-53.doi:10.7668/hbnxb.2015.01.008.
Zhu X C,Shao Y H,Zhu F W,Yang L J. Study on the molecular variability of immunoglobulin IgG/IgM from goslings infected Goose parvovirus[J].Acta Agriculturae Boreali-Sinica,2015,30(1):42-53.
[19] Goldberg B S,Ackerman M E. Antibody-mediated complement activation in pathology and protection[J].Immunology and Cell Biology,2020,98(4):305-317. doi:10.1111/imcb.12324.
[20] Jahanshahlu L,Rezaei N. Monoclonal antibody as a potential anti-COVID-19[J].Biomed Pharmacother,2020,129:110337. doi:10.1016/j.biopha.2020.110337.
[21] 李鹏,刘凤权,杨慧,赵丽,李霞. 锌螯合物抗体可变区的克隆鉴定、真核表达及重组抗体的三维模建[J].生物技术通报,2012(1):108-115. doi:10.13560/j.cnki.biotech.bull.1985.2012.01.016.
Li P,Liu F Q,Yang H,Zhao L,Li X. Cloning,identification and eukaryotic expression of variable region of monoclonal antibodies against chelated zinc and three dimensional modeling of recombinant antibody[J].Biotechnology Bulletin,2012(1):108-115.
[22] 王锐. 基于杂交瘤细胞单链抗体制备技术的应用—抗GPV-NS1和GoIFN-γ单链抗体的构建[D].哈尔滨:东北农业大学,2009.
Wang R. Application of single-chain antibody preparation technique based on hybridoma cell-construction of anti-GPV-NS1-ScFv and anti-Go IFN-γ-ScFv[D].Harbin:Northeast Agricultural University,2009.
[23] 管宝全,张军,罗文新,陈敏,吴婷,程通,夏宁邵. 乙型肝炎病毒pre-S1区中和抗体可变区的原核表达[J].生物工程学报,2004,20(6):901-905. doi:10.13345/j.cjb.2004.06.019.
Guan B Q,Zhang J,Luo W X,Chen M,Wu T,Cheng T,Xia N S. Prokaryotic expression of variable domain of neutralizing antibody against hepatitis B virus pre-S1[J].Chinese Journal of Biotechnology,2004,20(6):901-905.
[24] Xiao H X,Guo T L,Yang M,Qi J X,Huang C B,Hong Y Y,Gu J J,Pang X F,Liu W J,Peng R C,McCauley J,Bi Y H,Li S H,Feng J X,Zhang H L,Zhang X P,Lu X S,Yan J H,Chen L L,Shi Y,Chen W Z,Gao G F. Light chain modulates heavy chain conformation to change protection profile of monoclonal antibodies against influenza A viruses[J].Cell Discovery,2019,5:21. doi:10.1038/s41421-019-0086-x.
[25] Davies J,Riechmann L. Antibody VH domains as small recognition units[J].Nature Biotechnology,1995,13(5):475-479.doi:10.1038/nbt0595-475.
[26] ![]() L,Rojas-Trejo V M,Romero-Moreno J A,Costas M,Utrera-Espíndola I,Olamendi-Portugal T,Possani L D,Becerril B. Comparative assessment of the VH-VL and VL-VH orientations of single-chain variable fragments of scorpion toxin-neutralizing antibodies[J].Molecular Immunology,2020,122:141-147.doi:10.1016/j.molimm.2020.04.015.
L,Rojas-Trejo V M,Romero-Moreno J A,Costas M,Utrera-Espíndola I,Olamendi-Portugal T,Possani L D,Becerril B. Comparative assessment of the VH-VL and VL-VH orientations of single-chain variable fragments of scorpion toxin-neutralizing antibodies[J].Molecular Immunology,2020,122:141-147.doi:10.1016/j.molimm.2020.04.015.
[27] Damen L A A,Westerlo E M A,Versteeg E M M,Wessel T,Daamen W F,Kuppevelt T H. Construction and evaluation of an antibody phage display library targeting heparan sulfate[J].Glycoconjugate Journal,2020,37(4):445-455.doi:10.1007/s10719-020-09925-z.