细菌能够产生特有的气味-挥发性有机物(Volatile organic compounds,VOCs),能够影响其他生物的生长代谢,甚至防治植物病虫害、促进植物生长,进而提高作物的产量[1-2]。研究发现,挥发性有机物在20 ℃和0.01 kPa条件下可快速挥发进入气相状态,具有良好的细胞膜穿透性以及在空气和土壤空隙中高效率的扩散能力,从而提高对靶标微生物的抑制作用[3]。目前,既可作为植物病害生物防治因子又可促进植物生长的挥发性有机物已成为关注的重点。合理利用具抑菌促生长挥发性有机物的细菌,可减少化肥农药施用量,有助于形成环境友好的植物生产环境。
作物枯萎病和黄萎病是2种危害严重的维管束病害,其病原菌分别为尖孢镰刀菌(Fusarium oxysporum)和大丽轮枝菌(Verticillium dahliae),其中尖孢镰刀菌又有多个专化型。病原菌能够在土壤中长期存活,并且从寄主植株根部侵入后,能够进入植株的维管束中,进而扩展至植株的各个部位。维管束病害的防治非常困难,生物防治则是一条重要途径。内生细菌可在植物体内定殖,具有稳定的生存空间,从而对防治微管束病害具有独特的优势,具有良好的应用前景[4-5]。近年来,有关植物内生细菌的研究相对较多,已经从水稻、棉花、辣椒、向日葵等多种作物中分离获得内生细菌菌株,并且对多种植物病害都显示出良好的防治效果[5-9],但对其所产挥发性有机物的研究较少。菌株S258是江苏省农业科学院植物保护研究所从棉花品种泗棉3号的根部分离获得的一株内生细菌,对棉花黄萎菌和棉花枯萎菌具有拮抗活性,具有产水解酶活性和产嗜铁素活性[10]。本研究通过二分格培养皿对峙培养法测定菌株S258产生挥发性有机物对棉花黄萎菌和西瓜枯萎菌的抑菌活性以及对拟南芥的促生长作用,并且用气相色谱-质谱联用法(GC-MS)分析菌株S258挥发性有机物的组成,以期为菌株S258在病害生物防治上的应用提供理论依据,为生物农药的研究与利用提供参考。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株 内生细菌为枯草芽孢杆菌(Bacillus subtilis)S258,对照细菌菌株为大肠杆菌(Escherichia coli)DH5α,病原真菌为棉花黄萎菌(Verticillium dahliae)V08DF1和西瓜枯萎菌(Fusarium oxysporum f. sp. niveum)GY16,所有菌株均由江苏省农业科学院植物保护研究所保存。
1.1.2 供试植物 Columbia 生态型拟南芥,种子购自上海钰博科技有限公司。
1.2 试验方法
1.2.1 菌株的培养 细菌菌株用25%甘油-70 ℃保存,常规活化采用 LA 培养基,28 ℃培养 24 h后,挑取单克隆,转接于 LB 培养基中,28 ℃振荡培养24 h 后获得发酵液,用无菌水稀释到1×108 cfu/mL,备用。病原真菌采用PDA 培养基活化,28 ℃分别培养7,3 d 后备用。
1.2.2 抑菌效果测定 参照毛黎娟等[11]的方法,采用二分格平皿对峙培养法进行抑菌效果的测定。在直径9 cm的二分格培养皿的一格中加入8 mL PDA 培养基,另一格中加入8 mL LA 培养基。在LA的一侧涂布20 μL内生细菌S258的发酵液(1×108 cfu/mL),28 ℃黑暗条件培养 24 h后,在PDA的一侧中央接种取自菌落边缘的病原真菌的菌饼(Φ=5 mm),用Parafilm膜封口,28 ℃继续培养。由于不同病原真菌的生长速率不同,后续培养时间也不同。病原真菌为棉花黄萎菌时,继续培养7 d;病原真菌为西瓜枯萎菌时,继续培养3 d。观察病原真菌的生长情况,并测量病原真菌的菌落直径,计算抑菌率。以涂布大肠杆菌DH5α的平板为对照。每处理3次重复。试验数据采用SPSS统计软件进行方差分析。各处理的平均值用Duncan新复极差法进行组间差异显著性比较。
抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
1.2.3 对拟南芥的促生长效果测定 拟南芥种子种植前按照Ryu等[12]的方法进行表面消毒处理,然后4 ℃ 春化 2 d。参照Ryu等[12]的方法,采用二分格平皿对峙培养法进行促生长效果的测定。在直径9 cm的二分格培养皿的一格中加入8 mL LA培养基,另一格中加入8 mL MS培养基。将春化后的拟南芥种子置于MS培养基上,放入光照培养箱中培养3~4 d,培养条件为22 ℃,16 h/8 h 光暗周期,光照强度6 000~8 000 lx。待拟南芥种子萌发后,在LA的一侧滴加8 μL内生细菌S258的发酵液(1×108 cfu/mL),用Parafilm膜封口,放入光照培养箱中继续培养10 d后,测定拟南芥的鲜质量。以不滴加细菌的平板为空白对照。每处理3次重复。
1.2.4 内生细菌挥发性有机物的收集及组分鉴定 参照王静等[13]的方法,用顶空-固相微萃取法(Solid phase micro-extraction,SPME)收集内生细菌S258产生的挥发性有机物。固相微萃取仪以及萃取头(100 μm PDMS,65 μm PDMS/DVB,50/30 μm CAR/DVB/PDMS)都购自美国 Supelco 公司。吸取尚未冷却的LA 培养基3 mL入15 mL的无菌顶空瓶中,然后将瓶体倾斜15°角静置,待培养基凝固成LA斜面。吸取100 μL 内生细菌S258的发酵液(1×108cfu/mL)均匀涂布于顶空瓶中的LA斜面上,用含有聚四氟乙烯涂层的瓶盖封口,28 ℃黑暗条件静置培养2 d后收集挥发性有机物。以不涂布细菌悬液的处理为空白对照,从而排除培养基和萃取头涂层对细菌挥发性有机物鉴定结果的干扰。每处理3次重复。收集挥发性有机物之前,先将顶空瓶置于室温中平衡20 min,萃取头按照厂家提供的说明书进行老化,然后将SPME针插入顶空瓶,将萃取头推入到顶空瓶上部1/3 处,进行细菌挥发性有机物的收集。采样时间为30 min,结束后,收起萃取头,并拔出针管。
用GC-MS技术分析内生细菌S258的挥发性有机物组分,气相色谱质谱联用仪QP2010购自日本 Shimadzu公司。GC-MS分析的条件按照王静等[13]的方法进行。数据采集处理系统为Agilent MassHunter(B.05.02)。结果经 NIST 和 WILIY 质谱数据库自动检索,按照匹配率>80进行识别。
2 结果与分析
2.1 挥发性有机物对病原真菌的抑制效果
用二分格平皿对峙培养法测定内生细菌S258产生的挥发性有机物对病原真菌的抑制作用。结果表明,与阴性对照大肠杆菌DH5α相比,内生细菌S258产生的挥发性有机物对病原真菌具有抑制作用(图1)。其中,对棉花黄萎菌菌丝生长的抑制率达80.9%,而对西瓜枯萎菌的抑制率仅为10.1%(表1)。
表1 内生细菌S258产挥发性有机物的抑菌活性
Tab.1 The antifungal activity of the VOCs from an endophytic bacterium S258
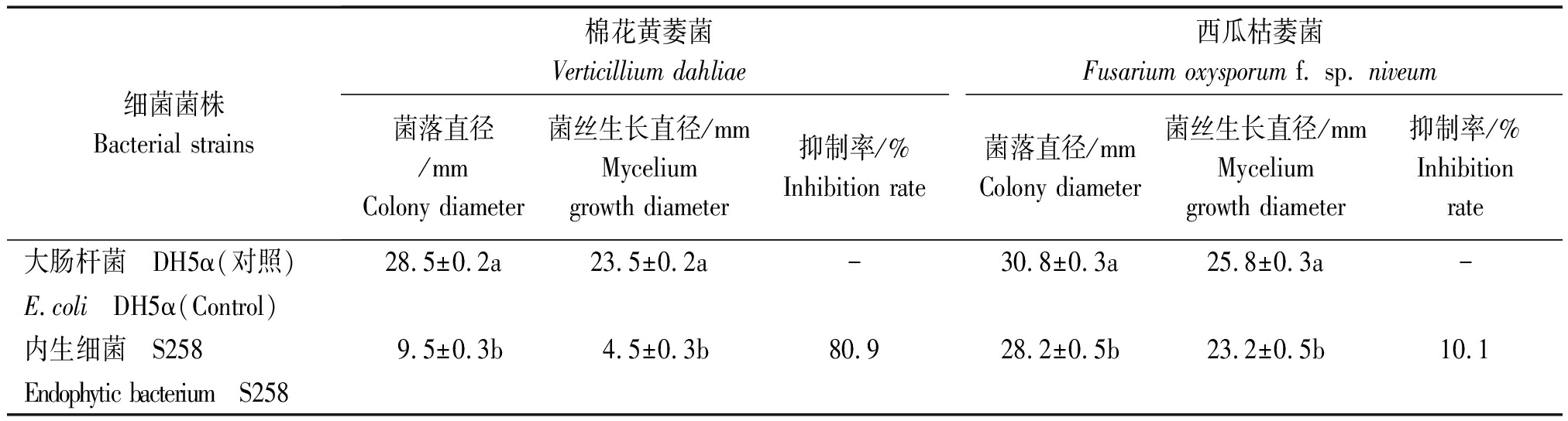
细菌菌株Bacterial strains棉花黄萎菌Verticillium dahliae西瓜枯萎菌Fusarium oxysporum f. sp. niveum菌落直径/mmColony diameter菌丝生长直径/mmMycelium growth diameter抑制率/%Inhibition rate菌落直径/mmColony diameter菌丝生长直径/mmMyceliumgrowth diameter抑制率/%Inhibitionrate大肠杆菌 DH5α(对照)28.5±0.2a23.5±0.2a-30.8±0.3a25.8±0.3a-E.coli DH5α(Control)内生细菌 S2589.5±0.3b4.5±0.3b80.928.2±0.5b23.2±0.5b10.1Endophytic bacterium S258
注:菌丝生长直径=菌落直径-菌饼直径。同列中不同小写字母表示差异显著(P<0.05)。
Note:Mycelium growth diameter=Colony diameter-Diameter of the agar disc containing mycelium. Different lowercase letters in the same column indicated significant difference(P<0.05).
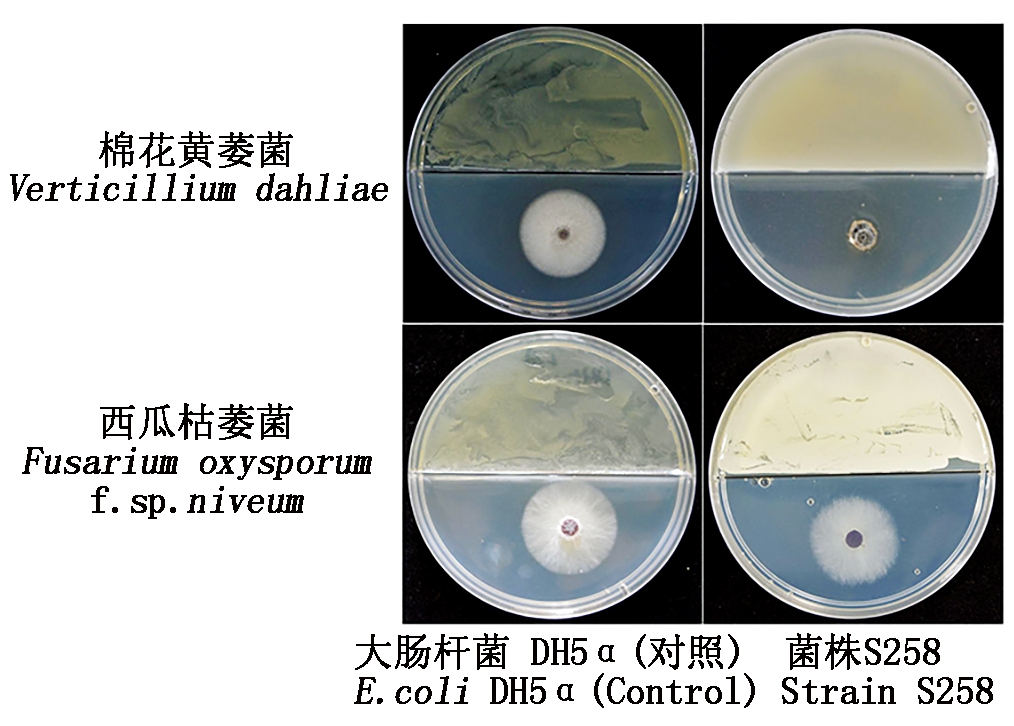
图1 内生细菌S258产挥发性有机物对
棉花黄萎菌和西瓜枯萎菌的抑菌效果
Fig.1 The antifungal activity of the VOCs from an
endophytic bacterium S258 against Verticillium dahliae
and Fusarium oxysporum f. sp. niveum
2.2 挥发性有机物对拟南芥的促生长效果
采用二分格平皿对峙培养法测定内生细菌S258所产挥发性有机物对拟南芥的促生长作用。结果表明,在不加细菌的空白对照中,拟南芥每株鲜质量为6.0 mg,而内生细菌S258的挥发性有机物对拟南芥的生长具有很强的促进作用,单株鲜质量达到32.0 mg,是空白对照的5.3倍(图2)。
2.3 挥发性有机物的组分分析
用顶空-固相微萃取法收集内生细菌S258所产挥发性有机物,并用GC-MS分析其挥发性有机物的组成。经 NIST 和 WILIY 质谱数据库自动检索,鉴定得到菌株S258产生的挥发性有机物包含30 种单体化合物,分别属于烷烃、烯烃、醇、酮、醚、醛、酯及杂环类(表2)。根据总离子流图的峰面积判断,主要气体成分为二甲基二硫醚(Dimethyl disulfide)和吲哚(Indole)。
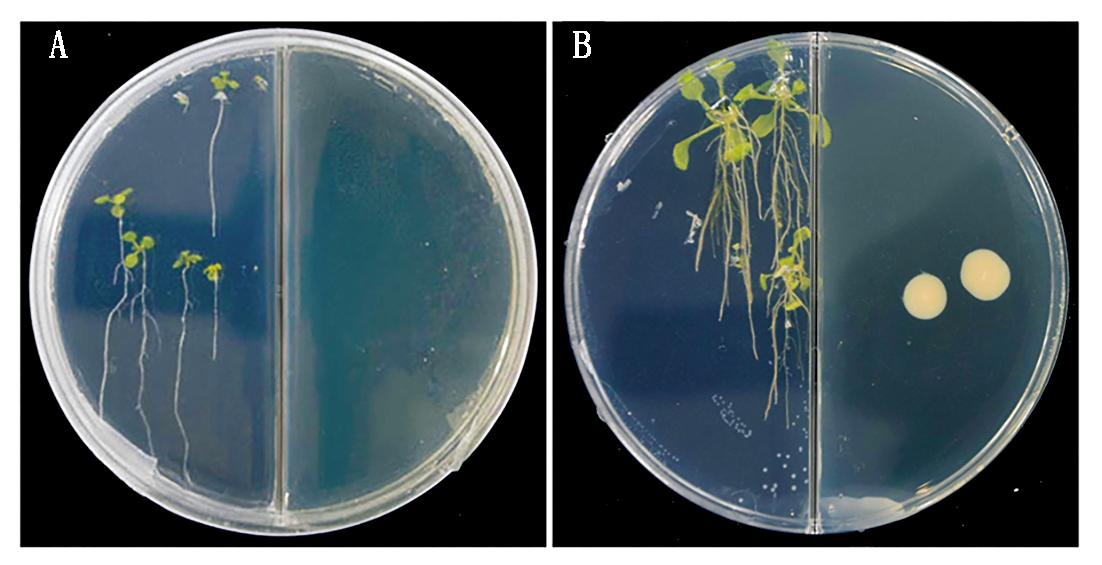
A.空白对照;B.内生细菌S258。
A.Control;B.Endophytic bacterium S258.
图2 内生细菌S258产挥发性
有机物对拟南芥的促生长效果
Fig.2 The growth promoting effect of the VOCs from
an endophytic bacterium S258 on Arabidopsis thaliana
表2 固相微萃取气质联用检测
内生细菌S258的挥发性有机物组分
Tab.2 The components analysis of the VOCs from an
endophytic bacterium S258 by SPME GC-MS
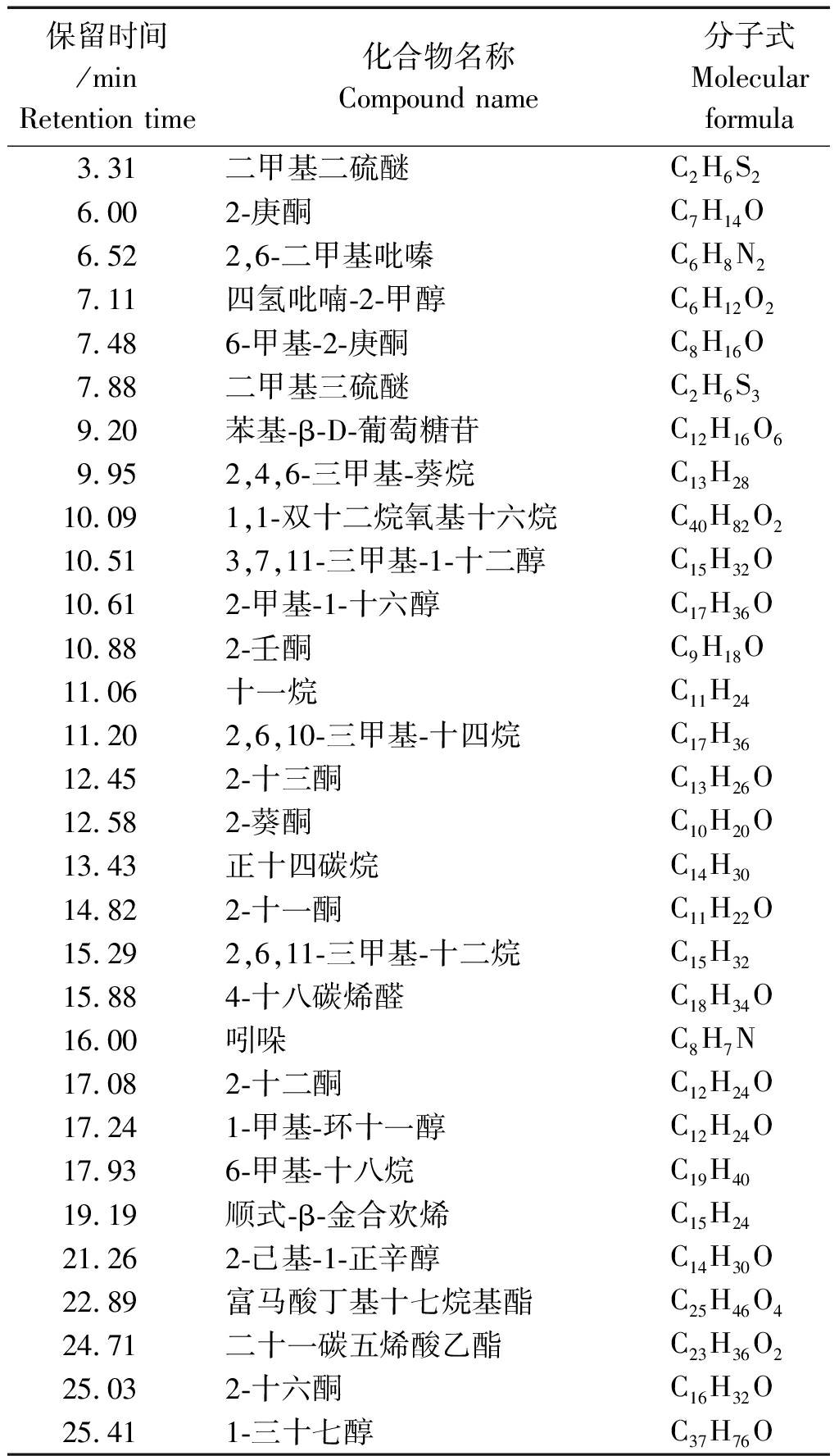
保留时间/minRetention time化合物名称Compound name分子式Molecularformula3.31二甲基二硫醚C2H6S26.002-庚酮C7H14O6.522,6-二甲基吡嗪C6H8N27.11四氢吡喃-2-甲醇C6H12O27.486-甲基-2-庚酮C8H16O7.88二甲基三硫醚C2H6S39.20苯基-β-D-葡萄糖苷C12H16O69.952,4,6-三甲基-葵烷C13H2810.091,1-双十二烷氧基十六烷C40H82O210.513,7,11-三甲基-1-十二醇C15H32O10.612-甲基-1-十六醇C17H36O10.882-壬酮C9H18O11.06十一烷C11H2411.202,6,10-三甲基-十四烷C17H3612.452-十三酮C13H26O12.582-葵酮C10H20O13.43正十四碳烷C14H3014.822-十一酮C11H22O15.292,6,11-三甲基-十二烷C15H3215.884-十八碳烯醛C18H34O16.00吲哚C8H7N17.082-十二酮C12H24O17.241-甲基-环十一醇C12H24O17.936-甲基-十八烷C19H4019.19顺式-β-金合欢烯C15H2421.262-己基-1-正辛醇C14H30O22.89富马酸丁基十七烷基酯C25H46O424.71二十一碳五烯酸乙酯C23H36O225.032-十六酮C16H32O25.411-三十七醇C37H76O
3 讨论
防治困难的维管束病害一直是生物防治应用的重点,受到人们的重视。利用内生细菌防治微管束病害,除了因为内生细菌能够在植物体内定殖之外,还有一个重要的作用机制就是产生抗菌活性物质。先前的学者大多致力于发掘微生物产生的非挥发性抗菌物质,如抗生素类、抗菌蛋白或细胞壁降解酶类[14-16],而对挥发性抗菌物质的研究相对较少。现已证明,能分泌抑菌挥发性有机物的微生物普遍存在,链霉菌、芽孢杆菌属等多属的细菌以及真菌都可以产生抗菌性挥发性有机物[3,17-19]。而且,与非挥发性抗菌物质相比,挥发性抑菌物质更加容易在环境中渗透和扩散,从而扩展到更远的距离,并能通过调节激素的代谢来调控植物的生长[20]。Ryu等[12]2003年最早发现枯草芽孢杆菌和解淀粉芽孢杆菌产生的挥发性有机物能促进拟南芥生长,随后又发现许多根际细菌的挥发性有机物都能促进植物生长。此外,还有一些细菌如假单胞菌、黏质沙雷菌以及寡养单胞菌等可以产生抑制拟南芥生长的挥发性有机物[21]。那些既可以促进植物的生长又可作为植物病害生物防治因子的挥发性有机物尤为引人注目。本研究中内生细菌S258产生的挥发性有机物既能强烈抑制棉花黄萎菌菌丝的生长,对西瓜枯萎菌也有一定的抑制作用,同时对拟南芥还具有很强的促生长作用,表明内生细菌S258能够产生具有抑菌促生长活性的挥发性有机物,是一种可开发为生防产品的微生物资源。由于拟南芥作为模式植物,可以在培养皿中生长,易于操作,本研究仅测定了内生细菌S258产生的挥发性有机物对拟南芥的促生长效果,对于其他作物的促生长效果还需要进一步检测。
微生物产生的挥发性有机物是成分复杂的混合物,目前,已鉴定超过250 种来自真菌、340种来自细菌的挥发性有机物成分[21-22]。目前,收集鉴定细菌产挥发性有机物的常用方法为顶空固相微萃取技术结合气质联用的方法,不同细菌产生挥发性有机物包含1~30 种不同的单体化合物[17,23]。本研究中,内生细菌S258产生的挥发性有机物同时具有抑制病原真菌生长和促进植物生长的作用,显示出了较高的研究和应用价值。本研究收集并分析了内生细菌S258所产挥发性有机物的组成成分,发现其包含8类30种单体化合物,主要气体成分为二甲基二硫醚和吲哚。尽管挥发性有机物表现出的抑制病原真菌和促进植物生长的活性往往是由混合物中的多种成分共同起作用的结果,人们还是通过各种方法确定了一些在微生物挥发性有机物中起作用的单物质成分[1,3]。已证实具有抑菌活性的微生物挥发性有机物组分有二甲基二硫醚(Dimethyl disulfide)、二甲基三硫醚(Dimethyl trisulfide)、2-壬酮(2-nonanone)、2-庚酮(2-heptanone)、2-葵酮(2-decanone)、三甲胺(Trimethylamine)、二乙基己醇(2-ethyl-hexanol)、对羟基苯甲醛(4-hydroxybenzaldehyde)、3-羟基-2-丁酮(3-hydroxy-2-butanone)、苯甲醛(Benzaldehyde)、N,N-二甲基辛胺(N,N-dimethyloctylamine)等[24-30]。另外,微生物挥发性有机物组分中的2,3-丁二醇(2,3-butanediol)、3-羟基-2-丁酮(3-hydroxy-2-butanone)已被证实对植物生长有促进作用并且能诱导植物抗病[12,30-31]。在本研究菌株S258所产挥发性有机物组分中的二甲基二硫醚、二甲基三硫醚、2-壬酮、2-葵酮是已证实的具有抑菌活性的物质,但是不含有已报道的具有促生长活性的物质,具体哪种物质发挥了抑菌促生长作用,还需利用纯品化合物进行活性验证才能得出结论,后续验证工作有待于进一步开展。
[1] Rajaofera M J N,Wang Y,Dahar G Y,Jin P F,Fan L X,Xu L X,Liu W B,Miao W G. Volatile organic compounds of Bacillus atrophaeus HAB-5 inhibit the growth of Colletotrichum gloeosporioides[J].Pesticide Biochemistry and Physiology,2019,156:170-176.doi:10.1016/j.pestbp.2019.02.019.
[2] Rath M,Mitchell T R,Gold S E. Volatiles produced by Bacillus mojavensis RRC101 act as plant growth modulators and are strongly culture-dependent[J].Microbiological Research,2018,208:76-84.doi:10.1016/j.micres.2017.12.014.
[3] 张清华,黄丽丽,连鑫坤,詹振亮,冯丽贞.微生物源挥发性物质及其生物防治作用研究进展[J].生态学杂志,2017,36(7):2036-2044.doi:10.13292/j.1000-4890.201707.004.
Zhang Q H,Hung L L,Lian X K,Zhan Z L,Feng L Z. Research advances in microbial volatiles and their biocontrol potential[J].Chinese Journal of Ecology,2017,36(7):2036-2044.
[4] 林玲,乔勇升,顾本康,周益军,董汉松. 植物内生细菌及其生物防治植物病害的研究进展[J].江苏农业学报,2008,24(6):969-974. doi:10.3969/j.issn.1000-4440.2008.06.049.
Lin L,Qiao Y S,Gu B K,Zhou Y J,Dong H S. Advances in the study of plant endophytic bacteria and their effects on biological control of plant diseases[J].Jiangsu Journal of Agricultural Sciences,2008,24(6):969-974.
[5] Afzal I,Shinwari Z K,Sikandar S,Shahzad S. Plant beneficial endophytic bacteria:Mechanisms,diversity,host range and genetic determinants[J].Microbiological Research,2019,221:36-49. doi:10.1016/j.micres.2019.02.001.
[6] 沙月霞,隋书婷,曾庆超,沈瑞清. 贝莱斯芽孢杆菌E69 预防稻瘟病等多种真菌病害的潜力[J].中国农业科学,2019,52(11):1908-1917.doi:10.3864/j.issn.0578-1752.2019.11.006.
Sha Y X,Sui S T,Zeng Q C,Shen R Q. Biocontrol potential of Bacillus velezensis strain E69 against rice blast and other fungal diseases[J].Scientia Agricultura Sinica,2019,52(11):1908-1917.
[7] 周京龙,冯自力,冯鸿杰,李云卿,袁媛,李志芳,魏锋,师勇强,赵丽红,孙正祥,朱荷琴,周燚. 棉花内生蜡状芽孢杆菌YUPP-10对棉花黄萎病的防治作用及机制[J].中国农业科学,2017,50(14):2717-2727.doi:10.3864/j.issn.0578-1752.2017.14.008.
Zhou J L,Feng Z L,Feng H J,Li Y Q,Yuan Y,Li Z F,Wei F,Shi Y Q,Zhao L H,Sun Z X,Zhu H Q,Zhou Y. Biocontrol effect and mechanism of cotton endophytic bacterium Bacillus cereus YUPP-10 against Verticillium wilt in Gossypium hirsutum[J].Scientia Agricultura Sinica,2017,50(14):2717-2727.
[8] Dowarah B,Agarwal H,Krishnatreya D B,Sharma P L,Kalita N,Agarwala N. Evaluation of seed associated endophytic bacteria from tolerant Chilli cv. Firingi Jolokia for their biocontrol potential against bacterial wilt disease[J].Microbiological Research,2021,248:126751. doi:10.1016/j.micres.2021.126751.
[9] Moin S,Ali S A,Hasan K A,Tariq A,Sultana V,Ara J,Ehteshamul-Haque S. Managing the root rot disease of sunflower with endophytic fluorescent Pseudomonas associated with healthy plants[J].Crop Protection,2020,130:105066. doi:10.1016/j.cropro.2019.105066.
[10] 林玲,王明江,周益军. 棉花根部拮抗枯萎病菌或黄萎病菌的可培养内生细菌多样性分析[J].棉花学报,2015,27(2):166-175. doi:10.11963/issn.1002-7807.201502010.
Lin L,Wang M J,Zhou Y J. Diversity analysis of culturable endophytic bacteria with antagonistic activity against Fusarium oxysporum f.sp.vasinfectum or Verticillium dahliae from the roots of Gossypium hirsutum[J].Cotton Science,2015,27(2):166-175.
[11] 毛黎娟,刘诚,章初龙,王国平. 白色麝香霉挥发性有机化合物的抗菌活性和组成分析[J].菌物学报,2015,34(2):269-277. doi:10.13346/j.mycosystema.130274.
Mao L J,Liu C,Zhang C L,Wang G P. Muscodor albus:Analysis of antifungal activity and components of volatile organic compounds[J].Mycosystema,2015,34(2):269-277.
[12] Ryu C M,Farag M A,Hu C H,Reddy M S,Wei H X,Paré P W,Kloepper J W. Bacterial volatiles promote growth in Arabidopsis[J].PNAS,2003,100(8):4927-4932. doi:10.1073/pnas.0730845100.
[13] 王静,曹建敏,陈德鑫,邱军,王晓强,冯超,王文静. 短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析[J].中国农业科学,2018,51(10):1908-1919. doi:10.3864/j.issn.0578-1752.2018.10.010.
Wang J,Cao J M,Chen D X,Qiu J,Wang X Q,Feng C,Wang W J. Antimicrobial effect and components analysis of volatile organic compounds from Bacillus pumilus AR03[J].Scientia Agricultura Sinica,2018,51(10):1908-1919.
[14] Wang P,Chen H F,Qian G L,Liu F Q. LetR is a TetR family transcription factor from Lysobacter controlling antifungal antibiotic biosynthesis[J].Applied Microbiology and Biotechnology,2017,101(8):3273-3282. doi:10.1007/s00253-017-8117-8.
[15] Miller C M,Miller R V,Garton-Kenny D,Redgrave B,Sears J,Condron M M,Teplow D B,Strobel G A. Ecomycins,unique antimycotics from Pseudomonas viridiflava[J].Journal of Applied Microbiology,1998,84(6):937-944. doi:10.1046/j.1365-2672.1998.00415.x.
[16] Koby S,Schickler H,Chet I C,Oppenheim A B. The chitinase encoding Tn7-based chiA gene endows Pseudomonas fluorescens with the capacity to control plant pathogens in soil[J].Gene,1994,147(1):81-83. doi:10.1016/0378-1119(94)90042-6.
[17] Xie S S,Zang H Y,Wu H J,Uddin Rajer F,Gao X W. Antibacterial effects of volatiles produced by Bacillus strain D13 against Xanthomonas oryzae pv.oryzae[J].Molecular Plant Pathology,2018,19(1):49-58.doi:10.1111/mpp.12494.
[18] Yang M G,Lu L F,Pang J,Hu Y L,Guo Q B,Li Z J,Wu S F,Liu H H,Wang C L. Biocontrol activity of volatile organic compounds from Streptomyces alboflavus TD-1 against Aspergillus flavus growth and aflatoxin production[J].Journal of Microbiology,2019,57(5):396-404. doi:10.1007/s12275-019-8517-9.
[19] Kaddes A,Fauconnier M L,Sassi K,Nasraoui B,Jijakli M H. Endophytic fungal volatile compounds as solution for sustainable agriculture[J].Molecules,2019,24(6):1065. doi:10.3390/molecules24061065.
[20] Tahir H A S,Gu Q,Wu H J,Raza W,Hanif A,Wu L M,Colman M V,Gao X W. Plant growth promotion by volatile organic compounds produced by Bacillus subtilis SYST2[J].Frontiers in Microbiology,2017,8:171.doi:10.3389/fmicb.2017.00171.
[21] Vespermann A,Kai M,Piechulla B. Rhizobacterial volatiles affect the growth of fungi and Arabidopsis thaliana[J].Applied and Environmental Microbiology,2007,73(17):5639-5641.doi:10.1128/aem.01078-07.
[22] Schulz S,Dickschat J S. Bacterial volatiles:The smell of small organisms[J].Natural Product Reports,2007,38(45):814. doi:10.1002/chin.200745263.
[23] 陈奕鹏,杨扬,桑建伟,蔡吉苗,徐春华,黄贵修.拮抗内生芽孢杆菌BEB17分离鉴定及其挥发性物质抑菌活性分析[J].植物病理学报,2018,48(4):537-546.doi:10.13926/j.cnki.apps.000174.
Chen Y P,Yang Y,Sang J W,Cai J M,Xu C H,Huang G X. Isolation and identification of antagonistic endophytic Bacillus BEB17 and analysis of antibacterial activity of volatile organic compounds[J].Acta Phytopathologica Sinica,2018,48(4):537-546.
[24] Robinson P M,McKee N D,Thompson L A A,Harper D B,Hamilton J T G.Autoinhibition of germination and growth in Geotrichum candidum[J].Mycological Research,1989,93(2):214-222.doi:10.1016/S0953-7562(89)80120-0.
[25] VAlmenar E,Auras R,Wharton P,Rubino M,Harte B. Release of acetaldehyde from β-cyclodextrins inhibits postharvest decay fungi in vitro[J].Journal of Agricultural and Food Chemistry,2007,55(17):7205-7212.doi:10.1021/jf071603y.
[26] Arrebola E,Sivakumar D,Korsten L. Effect of volatile compounds produced by Bacillus strains on postharvest decay in Citrus[J].Biological Control,2010,53(1):122-128.doi:10.1016/j.biocontrol.2009.11.010.
[27] Li Q L,Ning P,Zheng L,Huang J B,Li G Q,Hsiang T. Fumigant activity of volatiles of Streptomyces globisporus JK-1 against Penicillium italicum on Citrus microcarpa[J].Postharvest Biology and Technology,2010,58(2):157-165.doi:10.1016/j.postharvbio.2010.06.003.
[28] Wang C L,Wang Z F,Qiao X,Li Z J,Li F J,Chen M H,Wang Y R,Huang Y F,Cui H Y. Antifungal activity of volatile organic compounds from Streptomyces alboflavus TD-1[J].FEMS Microbiology Letters,2013,341(1):45-51.doi:10.1111/1574-6968.12088.
[29] Xu C K,Mo M H,Zhang L M,Zhang K Q. Soil volatile fungistasis and volatile fungistatic compounds[J].Soil Biology and Biochemistry,2004,36(12):1997-2004.doi:10.1016/j.soilbio.2004.07.020.
[30] Wu Y C,Zhou J Y,Li C G,Ma Y. Antifungal and plant growth promotion activity of volatile organic compounds produced by Bacillus amyloliquefaciens[J].Microbiology Open,2019,8(8):e00813.doi:10.1002/mbo3.813.
[31] Farag M A,Ryu C M,Sumner L W,Paré P W. GC-MS SPME profiling of rhizobacterial volatiles reveals prospective inducers of growth promotion and induced systemic resistance in plants[J].Phytochemistry,2006,67(20):2262-2268.doi:10.1016/j.phytochem.2006.07.021.