禽致病性大肠杆菌(Avian pathogenic Escherichia coli,APEC)是肠外致病性大肠杆菌(Extraintestinal pathogenic Escherichia coli,ExPEC)的一种典型病原体,会引发禽类呼吸道感染、败血症、头部肿胀综合征等多种严重的传染病[1-2],该病常与其他病原菌共同作用,引起并发感染,导致较高死亡率,从而给家禽业造成重大经济损失[3-4]。另外,研究表明APEC的基因组与人尿道致病性大肠杆菌(Urethral pathogenic Escherichia coli,UPEC)和新生儿脑膜炎大肠杆菌(Neonatal meningitis Escherichia coli,NMEC)具有高度同源性[5-7],提示APEC可能是人类肠外致病性大肠杆菌的毒力基因储存库。作为一种人畜共患病的潜在病原体,其血清型复杂多变,防治仍是当今世界性的难题。因此,APEC毒力因子的致病机制研究对养殖业发展和公共卫生安全都尤为重要。
三型分泌系统是革兰氏阴性致病菌的保守毒力因子之一[8-9],其分泌的效应蛋白是胞外菌主要的毒力致病因子[10]。ETT2作为新鉴定的大肠杆菌三型分泌系统,在致病性大肠杆菌中分布广泛[11-14],但由于其缺失严重,曾被认为是无功能的分泌系统。然而,最近已有研究证实完整的ETT2系统可以分泌毒力蛋白[15]。伴侣蛋白可以辅助效应蛋白正确折叠并易位至宿主细胞,对效应蛋白的分泌及致病作用具有重要意义。由于涉及细菌与宿主在感染过程中复杂的相互作用,ETT2分泌效应蛋白的发现和鉴定较为困难,因此,本实验室希望通过伴侣蛋白结合互作的方式寻找到与其相关的分泌效应蛋白。本实验室前期通过生物信息学分析及氨基酸比对,预测YgeG为ETT2毒力基因簇中编码的分子伴侣,并对APEC的生物被膜形成产生一定的影响[16]。经预测,该蛋白分子量较低,二级结构主要为螺旋结构,无ATP结合域,含有TPR的功能区,与大部分被证实的T3SS的分子伴侣结构高度相似[16-19],该蛋白功能尚无相关研究报道。因此,YegG有望作为伴侣蛋白在ETT2分泌蛋白的寻找方面发挥重要作用。
本研究以APEC81(AE81)为模板,通过密码子偏好性优化,构建ygeG的大肠杆菌原核表达载体pGEX-6p-1-ygeG,诱导YgeG重组蛋白表达,并对其纯化鉴定,为其功能活性鉴定及ETT2分泌蛋白的寻找奠定基础,为阐明ETT2致病机制、控制APEC感染提供理论支撑。
1 材料和方法
1.1 试验材料
1.1.1 菌株与质粒 pGEX-6p-1质粒由本实验室保存,禽致病性大肠杆菌APEC81由本实验室分离鉴定并保存,感受态细胞DH5α、BL21(DE3)购于合肥通用生物科技有限公司。
1.1.2 主要试剂 胶回收试剂盒、鼠抗GST单克隆抗体、山羊抗鼠IgG-HRP购自上海生工生物工程有限公司,质粒小量提取纯化试剂盒购自天根生化科技公司,PAGE凝胶快速配置试剂盒、蛋白上样缓冲液购自上海雅酶生物医药科技有限公司,蛋白Marker分别购自上海雅酶生物医药科技有限公司、Proteintech中国公司,GST标签蛋白纯化试剂盒购自碧云天公司,T4 DNA连接酶、BamHⅠ限制性内切酶、EcoRⅠ限制性内切酶购自赛默飞世尔科技(中国)有限公司,T4 DNA连接酶购自TaKaRa 公司。
1.2 试验方法
1.2.1 ygeG基因的分析及密码子优化 参照GenBank上O157:H7 str. Sakai基因组(GenBank:BA000007.3)中ygeG基因序列,设计ygeG基因特异引物,上游引物ygeG-F:5′-ATGGACACAGAAACAATTGA-3′,下游引物ygeG-R:5′-TTAGCCATTATCTTCTGAAT-3′,以AE81菌液为模板进行PCR扩增,将PCR产物进行琼脂糖凝胶电泳后胶回收,送至生工生物工程(南京)有限公司测序,获得AE81-ygeG基因序列。通过NCBI BlastN将测序序列与O157:H7 str. Sakai-ygeG比对同源性。利用DNA翻译氨基酸在线软件获得YgeG氨基酸序列,通过大肠杆菌密码子偏好性优化,得到用于构建原核表达载体的ygeG基因序列,送至上海生工生物工程有限公司进行基因合成。
1.2.2 ygeG基因的克隆及原核表达载体的构建 将优化后的ygeG基因序列设计原核表达特异引物,ygeG-F:5′-CGCGGATCC(BamH Ⅰ识别位点)ATGAACAAAGA
AACCATCGAAAT-3′,下游引物ygeG-R:5′-CCGGAATTC(EcoR Ⅰ识别位点)GTTATCTTCGCTGTTATCGGTCA-3′,以合成的ygeG基因片段为模板进行PCR扩增,扩增产物进行琼脂糖凝胶电泳并胶回收,送至生工生物工程(南京)有限公司测序验证。将测序正确的胶回收产物DNA片段与空载体pGEX-6p-1分别进行EcoR Ⅰ和BamH Ⅰ酶切,经琼脂糖凝胶电泳胶回收。T4 DNA连接酶将胶回收的DNA片段与载体连接后转化至大肠杆菌DH5α,重组子经菌液PCR和酶切鉴定正确后,送生工生物工程(南京)有限公司测序。
1.2.3 重组蛋白的可溶性分析 将鉴定正确的重组质粒pGEX-6p-1-ygeG转化至大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于含氨苄青霉素的LB培养基,37 ℃振荡培养至OD600 值在0.6时诱导。诱导后收集菌体,PBS重悬菌体沉淀,超声裂解至液体清亮,离心后收集上清和沉淀进行SDS-PAGE电泳验证。
1.2.4 重组蛋白诱导表达条件优化 蛋白表达量通常与诱导时间、诱导温度和IPTG终浓度有关。通过固定其他条件只改变其中一个条件来分析各单因素对pGEX-6p-1-ygeG表达量的影响。设置诱导温度分别为16,28,37 ℃,诱导时间分别为2,4,8,12,16 h,IPTG诱导终浓度分别为0.05,0.10,0.15,0.20,0.25 mmol/L。诱导后收集菌体,PBS重悬菌体沉淀,超声裂解至液体清亮,离心后收集上清进行SDS-PAGE电泳验证。
1.2.5 重组蛋白的纯化 将最优诱导表达条件下得到的蛋白上清按照GST标签蛋白纯化试剂盒说明书操作,采用SDS-PAGE电泳对纯化的蛋白进行分析。
1.2.6 Western Blot 鉴定纯化后的重组蛋白将纯化的YgeG蛋白经SDS-PAGE电泳后电转至硝酸纤维素膜上,用5%脱脂奶粉4 ℃过夜封闭,TBST洗涤3次,加入1∶5 000鼠抗GST单克隆抗体作为一抗,室温孵育2 h,TBST洗涤3次,加入1∶5 000山羊抗鼠IgG-HRP作为二抗,室温孵育1 h,TBST洗涤3次,HRP-DAB底物显色液显色。
2 结果与分析
2.1 ygeG基因的分析及密码子优化
本研究参照GenBank上O157:H7 str. Sakai基因组(GenBank:BA000007.3)中ygeG基因序列,设计ygeG基因特异引物,扩增出片段大小为486 bp的目的条带(图1),通过NCBI BlastN将测序序列与AE81中ygeG基因序列比对,其基因序列与O157:H7 str. Sakai中ygeG基因序列具有97.12%的同源性。将YgeG氨基酸序列根据密码子偏好性优化(图2)。
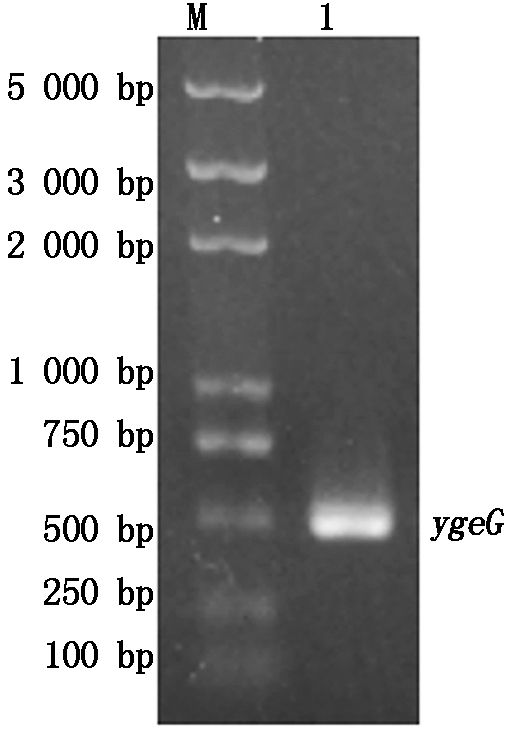
M.Trans2K Plus DNA Marker;1.基因ygeG扩增结果。
M.Trans2K Plus DNA Marker;1.Amplification results of gene ygeG.
图1 O157:H7中基因的扩增
Fig.1 Amplification results of gene in O157:H7
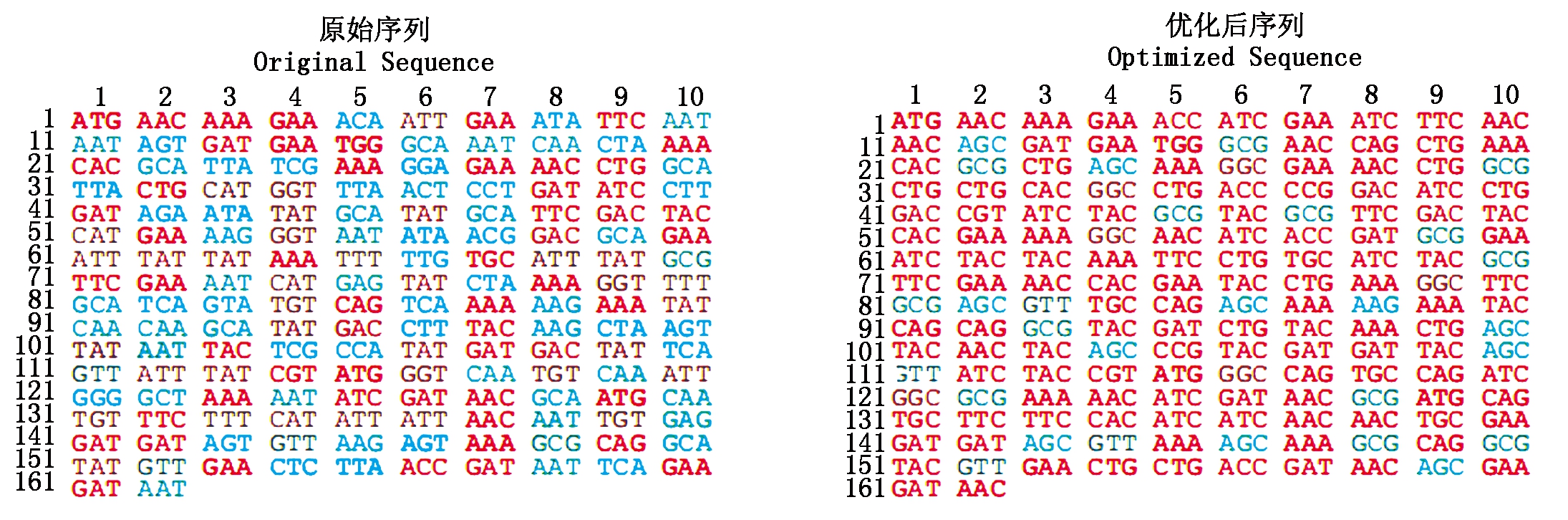
图2 密码子优化
Fig.2 Codon optimization
2.2 ygeG基因的克隆及原核表达载体的构建
以优化后合成的ygeG基因片段为模板,利用ygeG基因上下游特异优化引物进行PCR扩增,结果如图3所示,在486 bp处有特异性扩增条带,符合目的片段的大小。将ygeG基因连接原核表达载体pGEX-6p-1,转化至DH5α。利用pGEX通用引物进行菌体PCR鉴定,空载体为对照,结果与预期相符,构建好的载体扩增出692 bp条带,空载扩增出188 bp条带(图4)。阳性克隆菌提取质粒后进行酶切鉴定,结果显示目的基因条带大小与预期结果相符,可得到486 bp的目的基因条带和4 900 bp的载体条带(图5)。将经酶切验证正确的重组载体pGEX-6p-1-ygeG进行测序,测序结果表明重组表达载体构建成功。
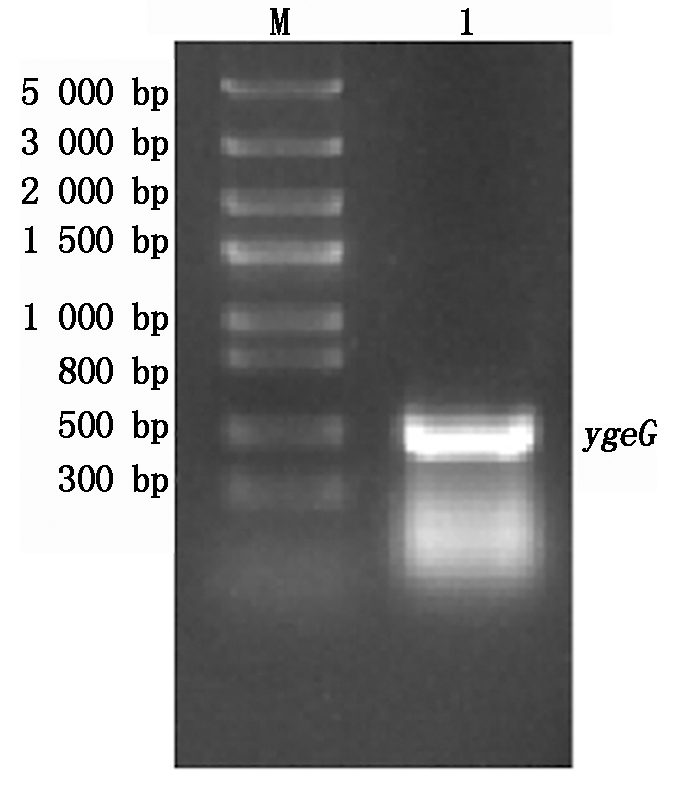
M.Trans5K DNA Marker;1.基因ygeG扩增结果。
M.Trans5K DNA Marker;1.Amplification results of gene ygeG.
图3 AE81中基因的扩增
Fig.3 Amplification results of gene in AE81
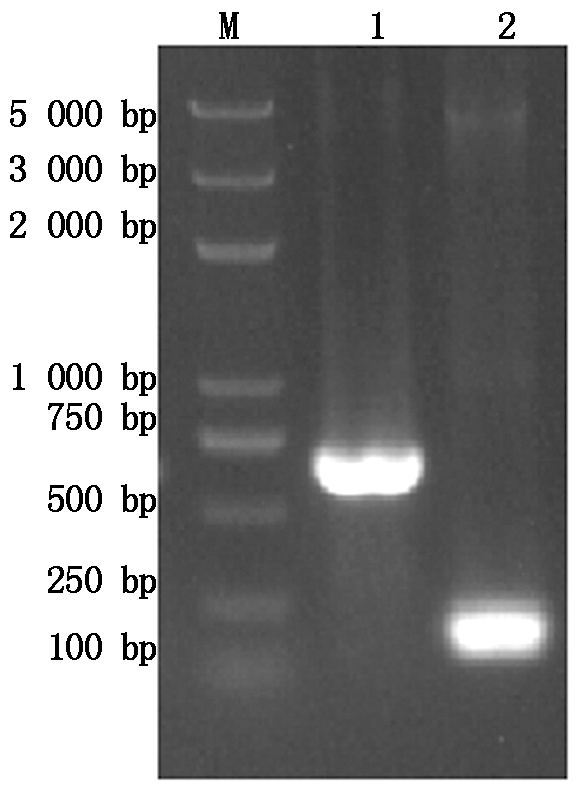
M.Trans2K Plus DNA Marker;1.pGEX-6p-1-ygeG 菌液
验证结果;2.pGEX-6p-1空载验证结果。
M.Trans2K Plus DNA Marker;1.PCR verification of pGEX-6p-1-ygeG
bacterial solution;2.PCR verification of pGEX-6p-1-ygeG empty vector.
图4 pGEX-6p-1-ygeG 菌液及pGEX-6p-1空载PCR验证
Fig.4 PCR verification of pGEX-6p-1-ygeG
bacterial solution and pGEX-6p-1 empty vector
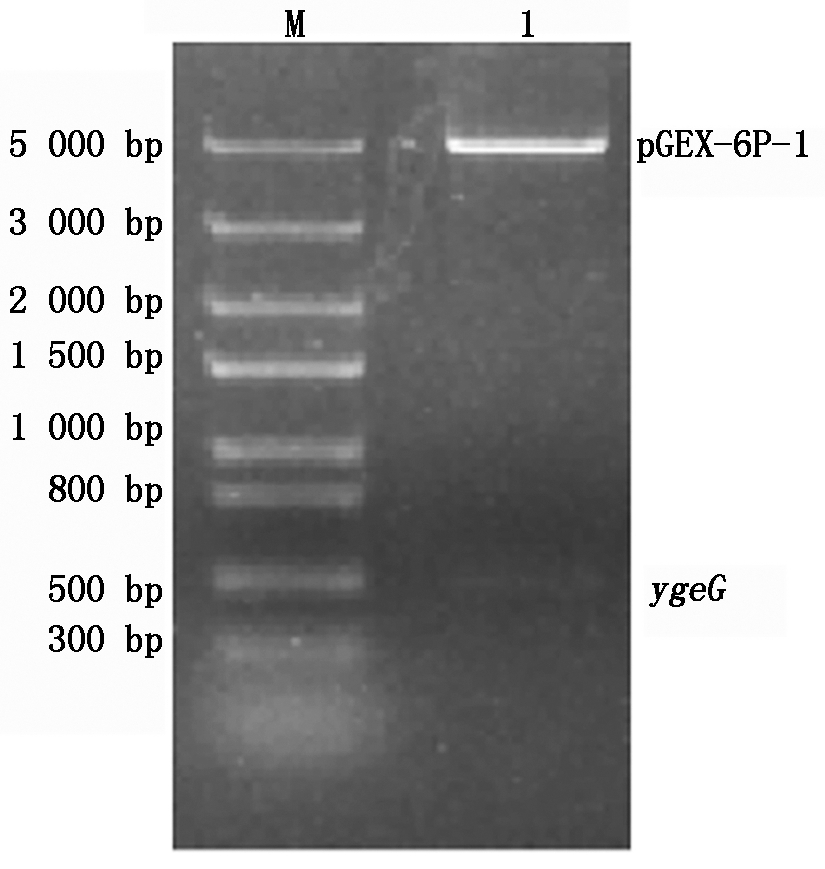
M.Trans5K DNA Marker;1.重组载体pGEX-6p-1-ygeG。
M.Trans5K DNA Marker;1.Recombinant vector pGEX-6p-1-ygeG.
图5 重组载体pGEX-6p-1-ygeG双酶切鉴定
Fig.5 Double enzyme digestion verification
of recombinant vector pGEX-6p-1-ygeG
2.3 pGEX-6p-1-YgeG重组蛋白的可溶性分析
将pGEX-6p-1-ygeG重组菌株诱导后的菌体进行超声波破碎,离心收集上清和沉淀进行SDS-PAGE分析。结果表明,与空载转化菌相比,在44 ku处有一条特异的蛋白表达条带,分子量与预期目的蛋白大小相当,表明目的蛋白在BL21(DE3)中表达。YgeG重组蛋白主要以可溶性蛋白的形式存在于菌液裂解后的上清中,包涵体中也有一定量的表达(图6)。由于蛋白主要以可溶性形式表达,且可溶性蛋白具有活性、纯化简单等优点,因此,选择从可溶性蛋白中进行后续蛋白纯化。
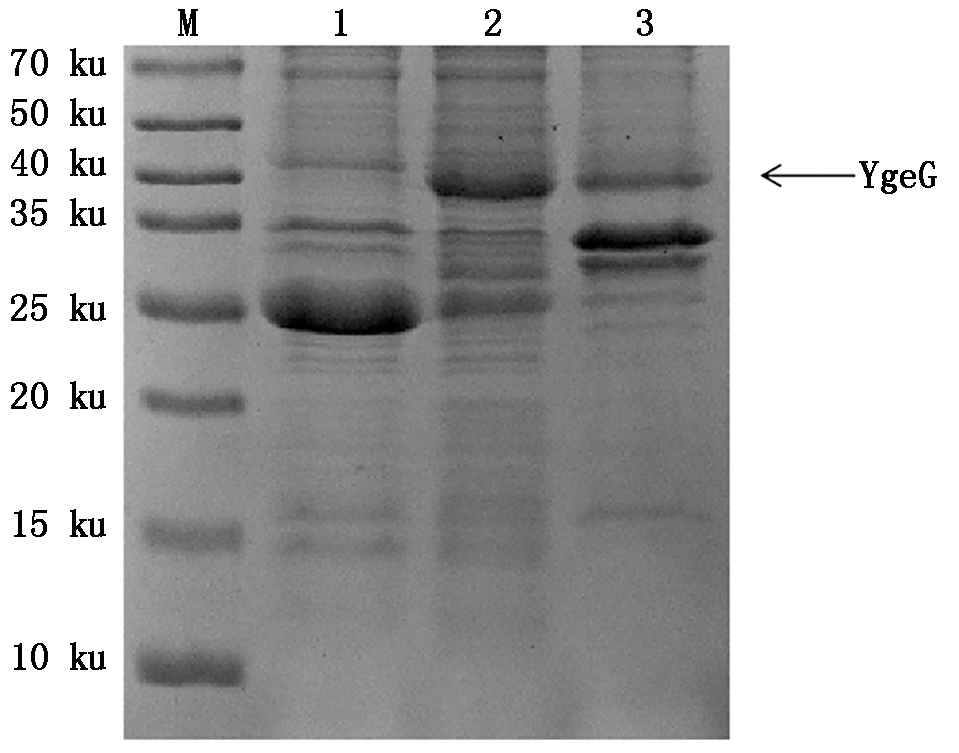
M.蛋白分子量标准;1.pGEX-6p-1空载体;2.诱导菌体
裂解上清;3.诱导菌体裂解沉淀。
M.Protein Marker;1.pGEX-6p-1 empty recombinant vector;
2.Supernatant of lysate;3.Precipitation of lysate.
图6 pGEX-6p-1-YgeG重组蛋白可溶性分析
Fig.6 Solubility analysis of
pGEX-6p-1-YgeG recombinant protein
2.4 YgeG蛋白诱导表达条件的优化及SDS-PAGE分析
2.4.1 不同诱导温度对目的蛋白表达量的影响 在OD600=0.6,IPTG终浓度为0.25 mmol/L以及诱导温度分别为16,28,37 ℃的条件下,诱导16 h离心收集菌体进行超声破碎,获得上清经15% 的SDS-PAGE检测,结果显示,随着温度的升高,可溶性目的蛋白的表达量逐渐降低,在16 ℃时,YgeG可溶性目的蛋白的表达量最高(图7)。
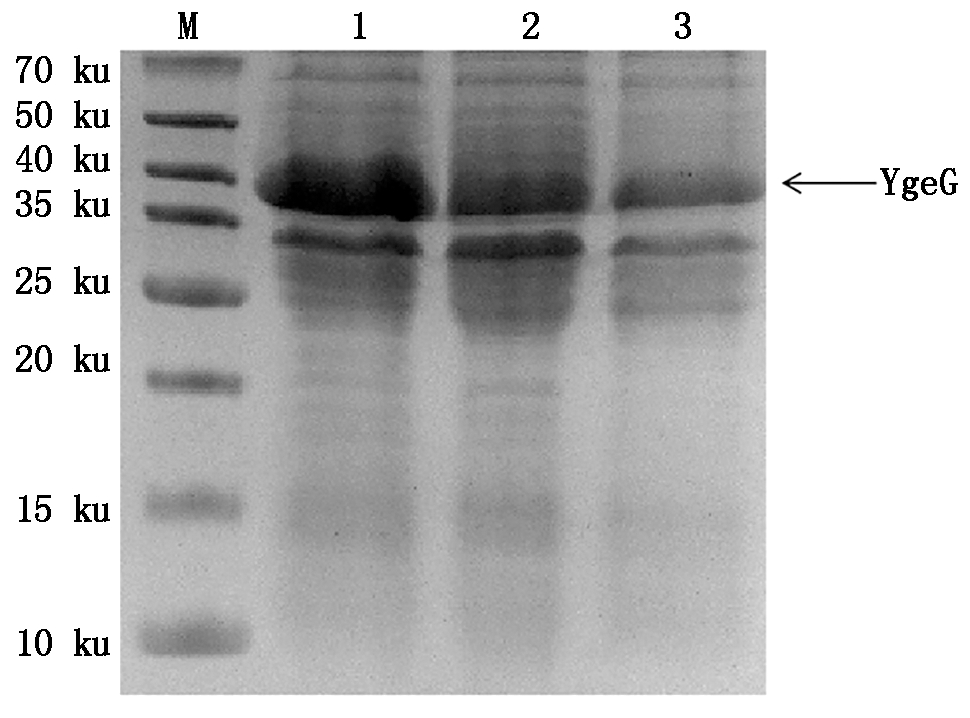
M. 蛋白分子量标准;1-3. 16,28,37 ℃
条件下IPTG诱导16 h后的上清。
M. Protein Marker;1. Supernatant induced by
IPTG at 16,28,37 ℃ for 16 h.
图7 不同诱导温度对目的蛋白表达量的影响
Fig.7 Effect of different induction temperature
on the expression of target protein
2.4.2 不同诱导时间对目的蛋白表达量的影响 在OD600=0.6,诱导时间为16 h,IPTG终浓度为0.25 mmol/L的条件下,分别诱导2,4,8,12,16 h 后进行超声破碎,获得上清经15% 的SDS-PAGE检测,结果显示,诱导16 h 时,YgeG可溶性目的蛋白的表达量最高(图8)。
2.4.3 不同IPTG终浓度对目的蛋白表达量的影响 在OD600=0.6,诱导温度为16 ℃的条件下,分别加入IPTG至终浓度为0.05,0.10,0.15,0.20,0.25 mmol/L,诱导16 h 后进行超声破碎,获得上清经15%的SDS-PAGE检测,结果显示,在IPTG终浓度为0.25 mmol/L时,YgeG可溶性目的蛋白的表达量最高(图9)。
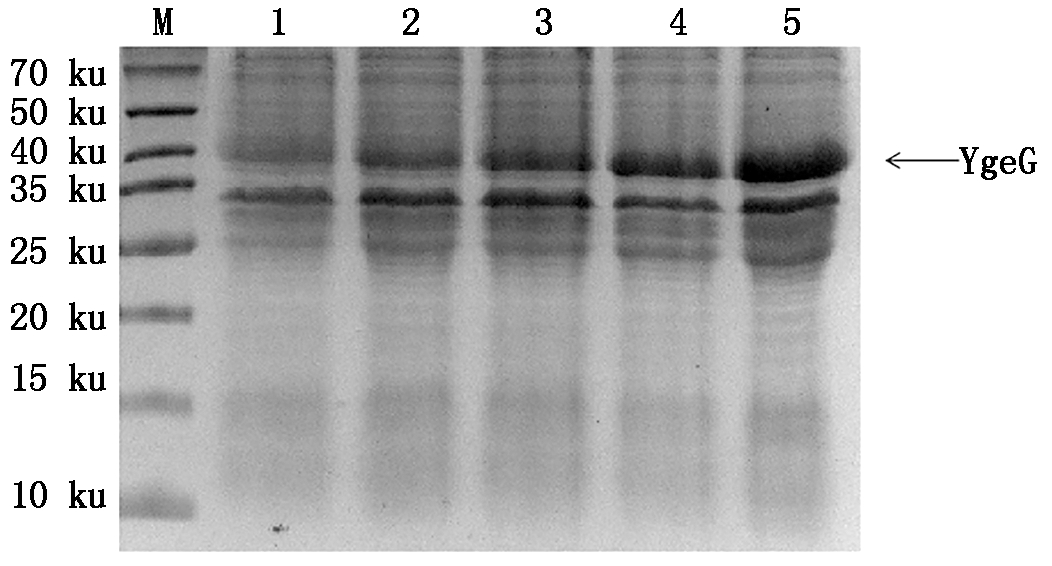
M.蛋白分子量标准;1-5.16 ℃条件下IPTG
诱导2,4,8,12,16 h后的上清。
M.Protein Marker;1-5.Supernatant after IPTG
induction at 16 ℃ for 2,4,8,12,16 h.
图8 不同诱导时间对目的蛋白表达量的影响
Fig.8 Effect of different induction time
on the expression of target protein
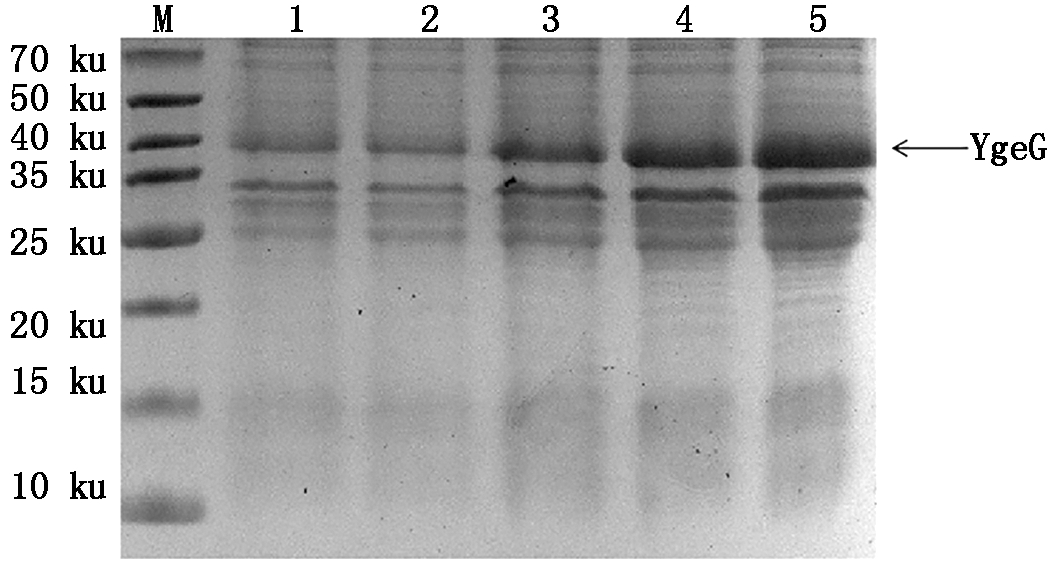
M.蛋白分子量标准;1-5.16 ℃条件下终浓度分别为0.05,0.10,
0.15,0.20,0.25 mmol/L的IPTG诱导16 h 后的上清。
M.Protein Marker;1-5.Supernatant induced by 0.05,0.10,0.15,
0.20,0.25 mmol/L IPTG at 16 ℃ for 16 h.
图9 不同IPTG终浓度对目的蛋白表达量的影响
Fig.9 Effect of different final IPTG concentrations
on the expression of target protein
2.5 pGEX-6p-1-YgeG重组蛋白的纯化
将pGEX-6p-1-YgeG重组菌株在最优条件下诱导后的菌体超声破碎后收集上清,使用GST标签蛋白纯化试剂盒将其纯化,纯化产物GST-YgeG经SDS-PAGE验证,在凝胶泳道上只显示与目的蛋白大小相符的单一条带(图10)。
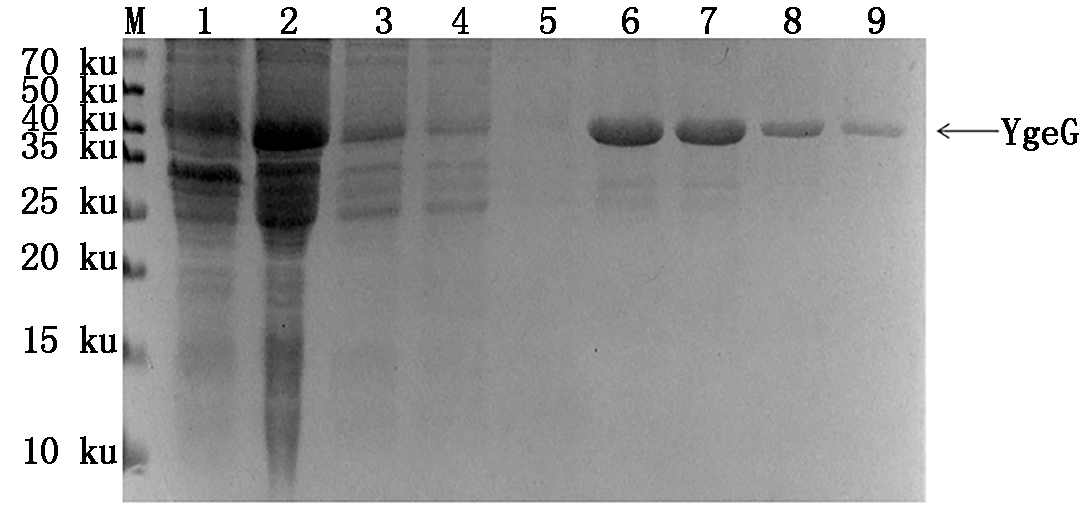
M.蛋白分子量标准;1.pGEX-6p-1空载体;2.上样流穿液;
3-5.洗涤液3-5;6-9.洗脱液6-9。
M.Protein Marker;1.pGEX-6p-1 empty recombinant vector;
2.Flow through;3-5.Wash 3-5;6-9.Elution 6-9.
图10 pGEX-6p-1-YgeG重组蛋白的纯化
Fig.10 Purification of pGEX-6p-1-YgeG
recombinant protein
2.6 pGEX-6p-1-YgeG重组蛋白Western Blot鉴定
以鼠抗GST-tag单克隆抗体为一抗,山羊抗鼠辣根过氧化物酶抗体为二抗,经Western Blot 验证,结果显示在纯化蛋白的泳道上只出现一条约为44 ku的条带(图11),可见GST-YgeG能与抗GST标签抗体发生特异性结合,说明GST-YgeG表达成功,具有较好的免疫原性和反应原性。
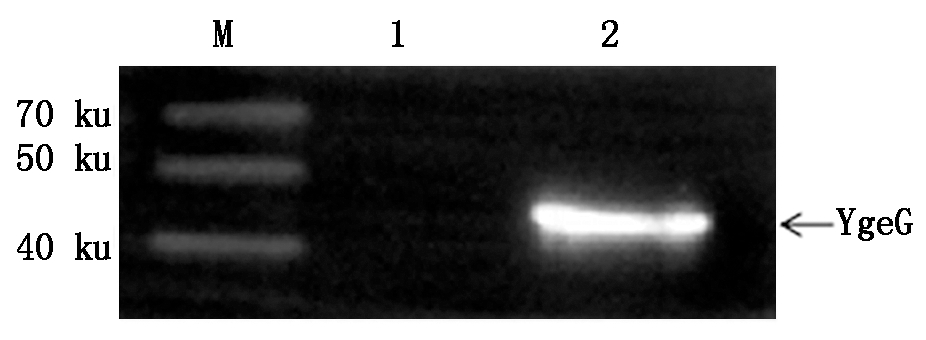
M.蛋白分子量标准;1.pGEX-6p-1空载体;
2.pGEX-6p-1-YgeG重组蛋白。
M.Protein Marker;1. pGEX-6p-1 empty vector;
2.pGEX-6p-1-YgeG recombinant protein.
图11 pGEX-6p-1-YgeG重组蛋白的Western Blot鉴定
Fig.11 Western Blot identification of
pGEX-6p-1-YgeG recombinant protein
3 结论与讨论
禽致病性大肠杆菌作为肠道外致病菌具有广泛的宿主谱,不仅是严重危害养禽业健康发展的重要病原菌,而且是人畜共患病的潜在病原体,其防治仍是当今世界性的难题[20]。研究发现,病原菌在长期进化过程中形成成熟的分泌系统和由毒力岛基因编码的效应蛋白,并且靶向地针对宿主的关键结构和生理机理进行破坏,这是许多革兰氏阴性菌普遍的致病机制之一[21-22]。大肠杆菌Ⅲ型分泌系统包括Ⅲ型分泌系统1和Ⅲ型分泌系统2,Ⅲ型分泌系统2又称ETT2毒力岛[23]。ETT2毒力岛广泛存在于大肠杆菌中,由于缺失严重,一度被认为是非功能性的Ⅲ型分泌系统,但现已被证明与毒力相关。Wang等[24]发现禽致病性大肠杆菌ETT2 ATP酶EviC缺失不仅会影响ETT2的分泌功能,还会对细菌其他的生物学特性产生影响。易正飞[15]比较了APEC野生株FJ1B与缺失株eivC 差异显著的分泌蛋白,成功筛选出ETT2参与分泌的效应因子EspE3,直接证明了ETT2参与分泌功能。
作为分泌系统的分子伴侣蛋白,其作用是结合相应的效应蛋白,保护其在胞质内不被降解,并有效地分泌、转移效应蛋白[25-26]。本实验室前期通过生物信息学预测了新的分子伴侣YgeG,该蛋白与鼠伤寒沙门氏菌Ⅲ型分泌系统易位伴侣SicA的氨基酸序列有极高的同源性,此类蛋白主要帮助沙门氏菌Ⅲ型分泌系统中转运蛋白SipB和SipC在宿主细胞膜上形成孔道,同时,蛋白YgeG与已被验证为伴侣蛋白的大肠杆菌蛋白CesD[27]、沙门氏菌蛋白SicA[28]、耶尔森菌蛋白SycD[29-30]以及志贺氏菌蛋白IpgC[31-32]的氨基酸相似度较高,这些伴侣蛋白可以协助效应蛋白的分泌。故pGEX-6p-1-ygeG的成功构建和诱导表达对于ETT2效应蛋白的寻找具有重要意义。
由于没有文献报道YgeG的功能及其在APEC中的基因序列,为了获得APEC源的YgeG蛋白,本课题组通过GenBank上O157:H7 str. Sakai基因组中ygeG基因序列设计了特异性引物,扩增出基因目的条带,通过测序、比对及翻译得到APEC-ygeG序列编码的蛋白氨基酸序列。然而,本课题组尝试了多种表达体系,均无法获得APEC-YgeG可溶性蛋白。考虑到蛋白表达具有密码子偏好性,笔者对大肠杆菌表达系统进行了密码子优化,进而终于获得APEC-YgeG可溶性蛋白表达载体,由此提示蛋白的表达系统构建过程中,密码子优化可以显著提升蛋白的可溶性表达效果。
目的蛋白是否可溶及其表达量的多少因蛋白质而异,因此,诱导表达的IPTG浓度、温度和时间可根据实际情况进行调整。IPTG是原核表达中常用的诱导剂,对外源蛋白的表达速率和积累量有一定的影响,本试验在诱导温度和时间相同的情况下,设置了5个不同浓度的IPTG,蛋白质电泳检测结果发现,重组蛋白的可溶性表达量随着IPTG浓度的增加而增加,IPTG浓度为0.25 mmol/L时的表达量明显大于其他几个浓度。通常情况下,细菌在低温条件中其生长速度及蛋白表达速度减慢,且包涵体形成减少,更有利于蛋白的可溶性表达。柴政斌等[33]发现在16 ℃时可溶重组蛋白比例明显比37 ℃时高。本试验在诱导时间和IPTG浓度相同的情况下,尝试了37,28,16 ℃过夜诱导,结果显示16 ℃过夜诱导的表达量相对较大。低温下细菌生长速度变缓,故选择通过延长诱导表达时间来增加融合蛋白的表达量,本试验在诱导温度和IPTG浓度相同的情况下,设置了5个不同的诱导时间,结果显示过夜诱导16 h的表达量相对较大。经过上述摸索,本研究选择的最优诱导表达条件为:0.25 mmol/L IPTG于16 ℃诱导16 h。在该条件下,目的蛋白YgeG得到了高效表达。
由SDS-PAGE结果分析可得,YgeG主要以可溶性蛋白的形式存在于上清中,且通过Western Blot分析可得出,该重组蛋白可与GST标签抗体发生特异性结合,在44 ku附近出现特异性印迹条带,说明表达的重组蛋白具有良好的免疫原性和反应原性。
[1] 马兴树. 禽大肠杆菌病疫苗研究进展[J].中国畜牧兽医,2015,42(1):234-244. doi:10.16431/j.cnki.1671-7236.2015.01.037.
Ma X S. Research progress on vaccines of avian colibacillosis[J].China Animal Husbandry & Veterinary Medicine,2015,42(1):234-244.
[2] Awad A M, El-Shall N A, Khalil D S, Abd El-Hack M E, Swelum A A, Mahmoud A H, Ebaid H, Komany A, Sammour R H, Sedeik M E. Incidence,pathotyping,and antibiotic susceptibility of avian pathogenic Escherichia coli among diseased broiler chicks[J].Pathogens,2020,9(2):114.
[3] Hvistendahl M. China takes aim at rampant antibiotic resistance[J].Science,2012,336(6083):795-795. doi:10.1126/science.336.6083.795.
[4] Gong J S,Xu M,Zhu C H,Miao J F,Liu X X,Xu B,Zhang J Q,Yu Y,Jia X B. Antimicrobial resistance,presence of integrons and biofilm formation of Salmonella Pullorum isolates from Eastern China(1962-2010)[J].Avian Pathology,2013,42(3):290-294. doi:10.1080/03079457.2013.788129.
[5] Tivendale K A,Logue C M,Kariyawasam S,Jordan D,Hussein A,Li G W,Wannemuehler Y,Nolan L K. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E. coli strains and are able to cause meningitis in the rat model of human disease[J].Infection and Immunity,2010,78(8):3412-3419. doi:10.1128/iai.00347-10.
[6] Mitchell N M,Johnson J R,Johnston B,Curtiss R,Mellata M. Zoonotic potential of Escherichia coli isolates from retail chicken meat products and eggs[J].Applied and Environmental Microbiology,2015,81(3):1177-1187. doi:10.1128/AEM.03524-14.
[7] Sun H Y. Deciphering alternative splicing and nonsense-mediated decay modulate expression in primary lymphoid tissues of birds infected with avian pathogenic E. coli (APEC)[J].BMC Genetics,2017,18(1):21. doi:10.1186/s12863-017-0488-4.
[8] Ewers C,Antão E M,Diehl I,Philipp H C,Wieler L H. Intestine and environment of the chicken as reservoirs for extraintestinal pathogenic Escherichia coli strains with zoonotic potential[J].Applied and Environmental Microbiology,2009,75(1):184-192. doi:10.1128/AEM.01324-08.
[9] Manges A R. Escherichia coli and urinary tract infections:The role of poultry-meat[J].Clinical Microbiology and Infection,2016,22(2):122-129.doi:10.1016/j.cmi.2015.11.010.
[10] Hotinger J A,May A E.Animal models of type Ⅲ secretion system-mediated pathogenesis[J].Pathogens. 2019,8(4):257. doi:10.3390/pathogens8040257.
[11] Makino S I,Tobe T,Asakura H,Watarai M,Ikeda T,Takeshi K,Sasakawa C. Distribution of the secondary type Ⅲ secretion system locus found in enterohemorrhagic Escherichia coli O157:H7 isolates among Shiga toxin-producing E. coli strains[J].Journal of Clinical Microbiology,2003,41(6):2341-2347. doi:10.1128/JCM.41.6.2341-2347.2003.
[12] Hartleib S,Prager R,Hedenström I,Löfdahl S,Tschäpe H. Prevalence of the new,SPI1-like,pathogenicity island ETT2 among Escherichia coli[J].International Journal of Medical Microbiology,2003,292(7/8):487-493. doi:10.1078/1438-4221-00224.
[13] Ren C P,Chaudhuri R R,Fivian A,Bailey C M,Antonio M,Barnes W M,Pallen M J. The ETT2 gene cluster,encoding a second type Ⅲ secretion system from Escherichia coli,is present in the majority of strains but has undergone widespread mutational attrition[J].Journal of Bacteriology,2004,186(11):3547-3560. doi:10.1128/JB.186.11.3547-3560.2004.
[14] Cheng D R,Zhu S Y,Su Z R,Zuo W Y,Lu H. Prevalence of the E.coli type three secretion system 2(ETT2)locus among enterotoxigenic E. coli (ETEC),shigatoxin-producing E.coli(STEC)from weaned piglets[J].African Journal of Microbiology Research,2011,5(26):4697-4701. doi:10.5897/AJMR11.768.
[15] 易正飞. Ⅲ型分泌系统2效应因子及双组分系统CpxR对禽致病性大肠杆菌毒力的影响[D].北京:中国农业科学院,2020.
Yi Z F. Effects of Escherichia Coli Type Ⅲ Secretion System 2(ETT2)effector and two-component system CpxR on the virulence of avian pathogenic Escherichia Coli[D].Beijing:Chinese Academy of Agricultural Sciences,2020.
[16] 尹磊. ETT2和phoP在禽致病性大肠杆菌生物被膜形成及致病性研究[D].合肥:安徽农业大学,2019.
Yin L. The roles of ETT2 and phoP in the biofilm formation and pathogenicity of avian pathogenic Escherichia coli[D].Hefei:Anhui Agricultural University,2019.
[17] Bröms J E,Edqvist P J,Forsberg Å,Francis M S. Tetratricopeptide repeats are essential for PcrH chaperone function in Pseudomonas aeruginosa type Ⅲ secretion[J].FEMS Microbiology Letters,2006,256(1):57-66. doi:10.1111/j.1574-6968.2005.00099.x.
[18] Büttner C R,Sorg I,Cornelis G R,Heinz D W,Niemann H H. Structure of the Yersinia enterocolitica type Ⅲ secretion translocator chaperone SycD[J].Journal of Molecular Biology,2008,375(4):997-1012. doi:10.1016/j.jmb.2007.11.009.
[19] Edqvist P J,Bröms J E,Betts H J,Forsberg Å,Pallen M J,Francis M S. Tetratricopeptide repeats in the type Ⅲ secretion chaperone,LcrH:Their role in substrate binding and secretion[J].Molecular Microbiology,2006,59(1):31-44. doi:10.1111/j.1365-2958.2005.04923.x.
[20] Johnson T J,Wannemuehler Y,Kariyawasam S,Johnson J R,Logue C M,Nolan L K. Prevalence of avian-pathogenic Escherichia coli strain O1 genomic Islands among extraintestinal and commensal E. coli isolates[J].Journal of Bacteriology,2012,194(11):2846-2853. doi:10.1128/JB.06375-11.
[21] Zhao Y Y,Gorvel J P,Méresse S. Effector proteins support the asymmetric apportioning of Salmonella during cytokinesis[J].Virulence,2016,7(6):669-678. doi:10.1080/21505594.2016.1173298.
[22] Schreiber K J,Baudin M,Hassan J A,Lewis J D. Die another day:Molecular mechanisms of effector-triggered immunity elicited by type Ⅲ secreted effector proteins[J].Seminars in Cell & Developmental Biology,2016,56:124-133. doi:10.1016/j.semcdb.2016.05.001.
[23] Mora A,López C,Dabhi G,Blanco M,Blanco J E,Alonso M P,Herrera A,Mamani R,Bonacorsi S,Moulin-Schouleur M,Blanco J. Extraintestinal pathogenic Escherichia coli O1:K1:H7/NM from human and avian origin:detection of clonal groups B2 ST95 and D ST59 with different host distribution[J].BioMed Central,2009,9(1):132.doi: 10.1186/1471-2180-9-132.
[24] Wang S H,Liu X,Xu X,Yang D H,Wang D,Han X G,Shi Y H,Tian M X,Ding C,Peng D X,Yu S Q. Escherichia coli type Ⅲ secretion system 2 ATPase EivC is involved in the motility and virulence of avian pathogenic Escherichia coli[J].Frontiers in Microbiology,2016,7:1387. doi:10.3389/fmicb.2016.01387.
[25] Ghosh P. Process of protein transport by the type Ⅲ secretion system[J].Microbiology and Molecular Biology Reviews,2004,68(4):771-795.doi:10.1128/MMBR.68.4.771-795.2004.
[26] Parsot C,Hamiaux C,Page A L. The various and varying roles of specific chaperones in type Ⅲ secretion systems[J].Current Opinion in Microbiology,2003,6(1):7-14. doi:10.1016/s1369-5274(02)00002-4.
[27] Wainwright L A,Kaper J B. EspB and EspD require a specific chaperone for proper secretion from enteropathogenic Escherichia coli[J].Molecular Microbiology,1998,27(6):1247-1260. doi:10.1046/j.1365-2958.1998.00771.x.
[28] Tucker S C,Gal n J E. Complex function for SicA,a Salmonella enterica serovar typhimurium type Ⅲ secretion-associated chaperone[J].Journal of Bacteriology,2000,182(8):2262-2268. doi:10.1128/JB.182.8.2262-2268.2000.
n J E. Complex function for SicA,a Salmonella enterica serovar typhimurium type Ⅲ secretion-associated chaperone[J].Journal of Bacteriology,2000,182(8):2262-2268. doi:10.1128/JB.182.8.2262-2268.2000.
[29] Neyt C,Cornelis G R. Role of SycD,the chaperone of the Yersinia yop translocators YopB and YopD[J].Molecular Microbiology,1999,31(1):143-156. doi:10.1046/j.1365-2958.1999.01154.x.
[30] Yang H Y,Tan Y F,Zhang T T,Tang L J,Wang J,Ke Y H,Guo Z B,Yang X M,Yang R F,Du Z M. Identification of novel protein-protein interactions of Yersinia pestis type Ⅲ secretion system by yeast two hybrid system[J].PLoS One,2013,8(1):e54121. doi:10.1371/journal.pone.0054121.
[31] Page A L,Fromont-Racine M,Sansonetti P,Legrain P,Parsot C. Characterization of the interaction partners of secreted proteins and chaperones of Shigella flexneri[J].Molecular Microbiology,2001,42(4):1133-1145. doi:10.1046/j.1365-2958.2001.02715.x.
[32] Cherradi Y,Hachani A,Allaoui.Spa13 of Shigella flexneri has a dual role:chaperone escort and export gate-activator switch of the type Ⅲ secretion system[J].Microbiology,2014,160(1):130-141. doi: 10.1099/mic.0.071712-0.
[33] 柴政斌,张更林,王学政,韩金祥. 融合蛋白GST-PADI4可溶性表达条件的优化及纯化[J].中国生物制品学杂志,2014,27(3):404-408,411.doi:10.13200/j.cnki.cjb.000201.
Chai Z B,Zhang G L,Wang X Z,Han J X. Optimization of condition for soluble expression of GST-PADI4 fusion protein and purification of expressed product[J].Chinese Journal of Biologicals,2014,27(3):404-408,411.