番茄(Lycopersicon esculentum Mill.)在我国种植面积较大,在保证蔬菜供应上占有重要地位。近年来,在番茄产区,番茄病毒病发生严重,在天津地区发生的主要病毒病有番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)、番茄褪绿病毒(Tomato chlorosis virus,ToCV)、番茄斑萎病毒(Tomato spotted wild virus,TSWV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、番茄花叶病毒(Tomato mosaic virus,ToMV)等 [1-3]。
ToMV为正义单链RNA病毒,属于帚状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus)。基因组共有4个开放阅读框,分别编码外壳蛋白(Coat Protein,CP)、运动蛋白(Movement Protein,MP)以及与复制相关的126 ku蛋白和183 ku蛋白[4]。由于ToMV与烟草花叶病毒(Tobacco mosaic virus,TMV)亲缘关系很近,所以在早期报道中,将ToMV称为TMV番茄分离物 [5]。近年来,鉴于ToMV和TMV在生物学、血清学和核酸序列等方面的不同,ToMV被作为一种独立的病毒进行研究 [6]。ToMV的寄主很多,番茄是该病的主要寄主。ToMV侵染番茄后叶片出现花叶病状,有的还会导致叶片变形,植株矮缩,甚至死亡。果实会出现着色不均,或出现凹陷的褐色病斑[7]。
近年来,天津市西青区和宝坻区的部分番茄产区陆续发现了疑似番茄花叶病毒引起的酱油果。由于其表现非常类似于由低温引起的番茄转色不良而产生的酱油果,导致很多农户错误地采取喷施营养肥和提高棚室地温的措施,病株也未见明显好转,严重影响了番茄果实的品质和产量。因此,明确这种番茄病的病原已迫在眉睫。
本研究利用小RNA 深度测序及RT-PCR 技术对天津地区番茄病株样本进行了病原的分子鉴定及基因组序列分析,旨在明确引起该病的病原,同时为该病的预防和治疗提供理论依据。
1 材料和方法
1.1 试验材料
2020年5-6月份在天津市西青区和宝坻区日光温室番茄栽培田中,采集发病的番茄果实样本,保存于-80 ℃冰箱内,用于RNA提取及后续试验。
菌株与载体:大肠杆菌DH5α,T-easy 载体均购自宝生物工程有限公司。
试剂:RNA提取试剂、RNase Inhibitor、M-MLV均购自宝生物工程有限公司。
1.2 试验方法
1.2.1 小RNA深度测序 对所采集的番茄果实的小RNA进行测序。2020年5月选取10株显症植株并各自采1个果实。从每个果实的发病部位各取0.1 g 组织,然后进行混合,提取混合样小RNA。利用试剂盒(Small RNA Sample Pre Kit,Illumina公司)构建文库,然后利用测序仪(Illumina HiSeq4000)进行深度测序,除杂后利用软件(Velvet assembler)获得拼接序列(Contigs),将拼接序列与NCBI网站(http://www.ncbi.nlm.nig.gov)病毒数据库中的已知病毒基因组序列进行比对,初步判断样品中病毒的种类。上述测序及分析工作委托上海伯豪基因科技有限公司完成。
1.2.2 RT-PCR验证 根据陈利达等[8]设计的引物检测TMV,廖富荣等[9]设计的检测ToMV的引物,陈灵芝等[10]设计的引物检测番茄斑驳病毒(Tomato mottle virus,ToMMV)(表1)。利用RT-PCR对小RNA测序结果进行验证。采用TRIzol试剂提取番茄感病果实的总RNA,以其为模板进行反转录,体系为:模板RNA 1 μL,Random引物1 μL,dNTP 0.5 μL,用DEPC处理水补足10 μL。65 ℃变性5 min,迅速置于冰上2 min,离心后,加入下列试剂:5×M-MLV Buffer 5 μL,RTaseM-MLV 1 μL,RNAase Inhibitor 0.5 μL,总体积10 μL。先用30 ℃保温10 min,然后42 ℃保温60 min,最后70 ℃保温15 min。PCR 反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环。扩增产物克隆到T-easy载体,由TaKaRa公司完成测序。对10 株田间样品进行检测,根据扩增产物的大小以及测序结果鉴定样品中的病毒种类。
表1 病毒 RT-PCR 检测引物
Tab.1 Primers for RT-PCR detection
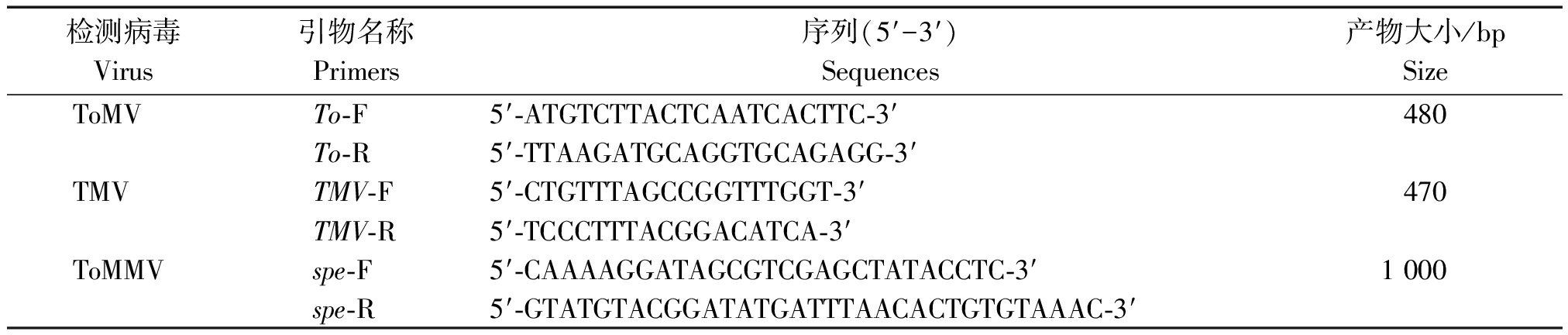
检测病毒Virus引物名称 Primers序列(5′-3′) Sequences产物大小/bpSizeToMVTo-F5′-ATGTCTTACTCAATCACTTC-3′480To-R5′-TTAAGATGCAGGTGCAGAGG-3′TMVTMV-F5′-CTGTTTAGCCGGTTTGGT-3′ 470TMV-R5′-TCCCTTTACGGACATCA-3′ToMMVspe-F5′-CAAAAGGATAGCGTCGAGCTATACCTC-3′1 000spe-R5′-GTATGTACGGATATGATTTAACACTGTGTAAAC-3′
1.2.3 ToMV天津分离物(ToMV-TJ)全基因组序列 取受侵染的番茄病株果实,抽提总RNA,以美国分离物(USA_99-1)(GenBank:KR537870.1)基因组序列为参照,参考隋雪莲[11]设计的部分引物,共设计9对覆盖全基因组的PCR引物(表2),采用RT-PCR法获得病毒基因组扩增产物。反应体系同上所述,扩增产物克隆到T-easy载体上后由TaKaRa公司完成测序。利用 DNAStar 软件对上述9对引物扩增所得产物序列进行拼接。
表2 ToMV-TJ全基因组扩增用到的PCR引物
Tab.2 Primers for determination of ToMV-TJ genomic sequence

引物名称 Primers序列 (5′-3′) Sequences产物大小/bpSizeToMV-F15′-GTATTTATTATTACAACAATTACC-3′600ToMV-R15′-ATCTCCCGTTTCAGCGTATCTGTC-3′ToMV-F25′-CAAAAGGATAGCGTCGAGCTATACCTC-3′ 798ToMV-R25′-GTATGTACGGATATGATTTAACAC-3′ToMV-F35′-GATCGTTCCGCTTTTTGACATTTG-3′811ToMV-R35′-TAGAGGGTTCCTCCACATCACGC-3′ToMV-F45′-GTTTTGAGCAGCCTACAGAAGCCAAT-3′802ToMV-R45′-CTATTACTCCCGACGAGTTCGCTCTTC-3′ToMV-F55′-GACGAAGGAAATTCTATCGAAGGTAAACTT-3′907ToMV-R55′-CAGAGATGTCACCAGTCTTTGGTG-3′ToMV-F65′-CAAGGTGAGACATATGCGGATGTGTC-3′806ToMV-R65′-CAACTTCTGTTTCGGCTGTGCTTTAAT-3′ToMV-F75′-CAAACAAGAACAAGTCCACTATTGGGC-3′803ToMV-R75′-GCACCGAGTTTTGAGATCAACTTAAGAG-3′ToMV-F85′-GCCAAGTTGTACAAGAAAAAGTACGGG-3′806ToMV-R85′-CACACAGACACAAATTCTAACGACAGGG-3′ToMV-F95′-ATCGTTCCAAACTACGCAATTACAACTAAG-3′1 128ToMV-R95′-TGGGCCCCTACCGGGGGTTC-3′
1.2.4 序列分析 利用Blast(www. ncbi. nlm.nih. gov/BLAST/)进行序列比较,利用MEGA 5.05进行进化树的构建,利用DNAStar进行序列相似性分析。
2 结果与分析
2.1 田间病株的症状
番茄植株感病后主要表现为果实表面有酱油色斑块,病斑大小不一,一般呈圆形。多从果肩开始发病,初期斑块颜色淡,后期病斑变为暗褐色至棕褐色,边缘明显,微凹陷。植株叶片和茎植无明显症状。植株感病后期坐果减少(图1)。

图1 ToMV侵染番茄引起的果实症状
Fig.1 The symptom of tomato induced by ToMV
2.2 小RNA深度测序检测番茄样品中病毒种类
对感病番茄的果实进行高通量测序,获得Raw reads共81 133 750条,去除不合格reads,得到Clean reads共79 534 404条。利用Velnet软件将测序获得的小RNA拼接组装成病毒的Contigs,经与GenBank中报道的病毒序列进行比对,其中5条比对到ToMMV,114条比对到ToMV,8条比对到TMV。测序结果初步表明,混合样品中可能含有以上3种病毒。
2.3 利用RT-PCR对小RNA测序结果的验证
利用检测ToMMV、ToMV和TMV 3种病毒的特异引物(表1),对感病果实进行RT-PCR检测。结果表明,利用检测ToMV和ToMMV特异引物To-F/R和spe-F/R均能从感病果实中扩增出预期大小的产物(图 2)。而检测TMV的特异引物不能扩增到预期产物,初步判断病原可能为ToMV和(或)ToMMV。利用表2中的引物进行扩增,并对扩增产物进行测序,将测序结果利用Blast进行比对。结果表明,扩增产物的序列与ToMV美国99-1分离物的相似性均在98%以上,证明引起番茄果实坏死斑症状的病原为ToMV。
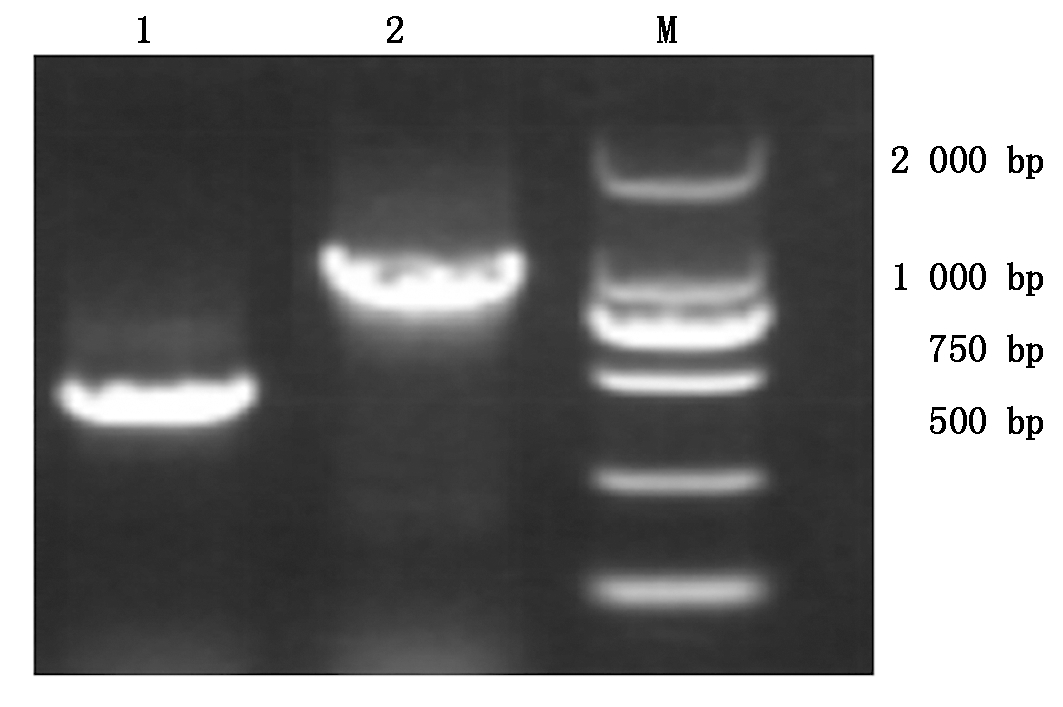
1.To-F/R引物扩增;2.spe-F/R引物扩增;M.DL2000。
1.The PCR amplified result by primer To-F/R;
2.The PCR amplified result by primer spe-F/R;M.DL2000.
图2 To-F/R和spe-F/R引物PCR扩增结果
Fig.2 The PCR amplified result by primers
To-F/R and spe-F/R
2.4 番茄花叶病毒天津分离物序列测定及分析
利用ToMV-F1/R1~ToMV-F9/R9引物,对病样进行RT-PCR检测,均得到目的条带(图3),将目的条带克隆并测序,组合后得到了ToMV-TJ的全基因组序列,提交至 GenBank数据库,登录号为MW042871。序列分析表明,ToMV-TJ全序列共6 383个核苷酸,有4个开放阅读框,分别编码126 ku的复制酶相关蛋白,183 ku的蛋白(由126 ku蛋白通读产生,与病毒复制有关),运动蛋白和外壳蛋白,这与其他地区的ToMV基因组结构一致。
利用Blast(http://www.ncbi.nlm.nih.gov/BLAST/)对天津地区发生的ToMV基因组部分序列进行比对。在众多比对结果中,选择了一些具有代表性的分离物序列进行同源性的分析。这些序列为国内已报道番茄花叶病毒分离物以及世界不同地区有代表性的分离物(表3)。
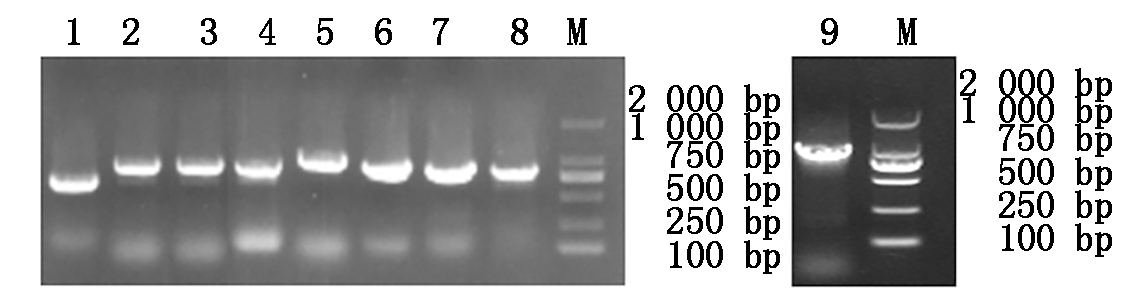
1-9.分别为引物ToMV-F1/R1~ToMV-F9/R9扩增产物;M.DL2000。
1-9.The amplified results by primer
ToMV-F1/R1-ToMV-F9/R9,respectively;M.DL2000.
图3 ToMV-F1/R1~ToMV-F9/R9引物PCR扩增
Fig.3 The PCR amplified results by primers
ToMV-F1/R1-ToMV- F9/R9
表3 其他ToMV毒株来源
Tab.3 Other sources of ToMV strains
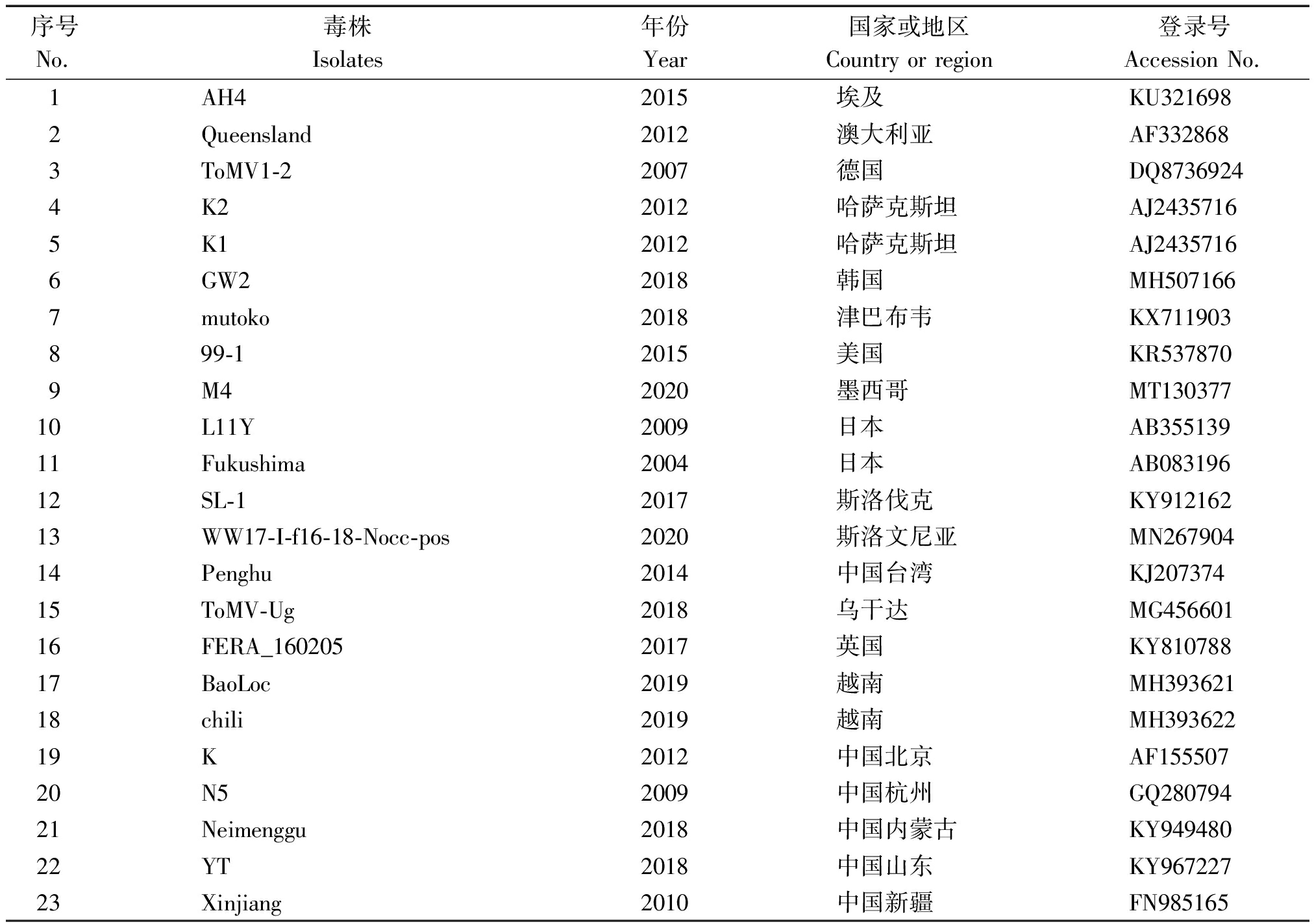
序号No.毒株Isolates年份Year国家或地区Country or region登录号Accession No.1AH42015埃及KU3216982Queensland2012澳大利亚AF332868 3ToMV1-22007德国DQ87369244K22012哈萨克斯坦AJ24357165K12012哈萨克斯坦AJ2435716 6GW22018韩国MH5071667mutoko2018津巴布韦KX711903899-12015美国KR5378709M42020墨西哥MT13037710L11Y2009日本AB35513911Fukushima2004日本AB08319612SL-12017斯洛伐克KY91216213WW17-I-f16-18-Nocc-pos2020斯洛文尼亚MN26790414Penghu2014中国台湾KJ20737415ToMV-Ug2018乌干达MG45660116FERA_1602052017英国KY81078817BaoLoc2019越南MH39362118chili2019越南MH39362219K2012中国北京AF15550720N52009中国杭州GQ28079421Neimenggu2018中国内蒙古KY94948022YT2018中国山东KY96722723Xinjiang2010中国新疆FN985165
利用MEGA 5.05软件对CP蛋白的核苷酸序列进行系统进化树分析(图4)。结果表明,大部分分离物形成一个大分支,证明这些分离物的CP蛋白进化关系很近,该蛋白很保守。天津分离物(ToMV-TJ)与美国(USA_99-1)和墨西哥(Mexico_M4)分离物关系最近。与斯洛伐克(Slovakia_SL-1)分离物的进化关系较远。该进化关系图部分地区体现出病毒的区域相似性,如哈萨克斯坦的2个分离物(Kazakhstan_K1、Kazakhstan_K2)和越南的2个分离物(Viet_Nam_BaoLoc、Viet_Nam_chili),以及中国台湾China_Taiwan_Penghu)、内蒙古(China_Neimenggu)、杭州(China_Hangzhou)分离物分别聚在了一起。

图4 CP基因进化树
Fig.4 Phylogenetic relationships of CP gene
对该基因的运动蛋白基因进行系统进化树分析(图5)。结果表明,与CP蛋白基因类似,天津分离物(ToMV-TJ)与美国(USA_99-1)和墨西哥(Mexico_M4)分离物和埃及(Egypt_AH4)关系最近。大部分分离物形成一个大分支,只有英国分离物(UK_FERA)的进化关系较远。同样地,该进化关系图部分地区
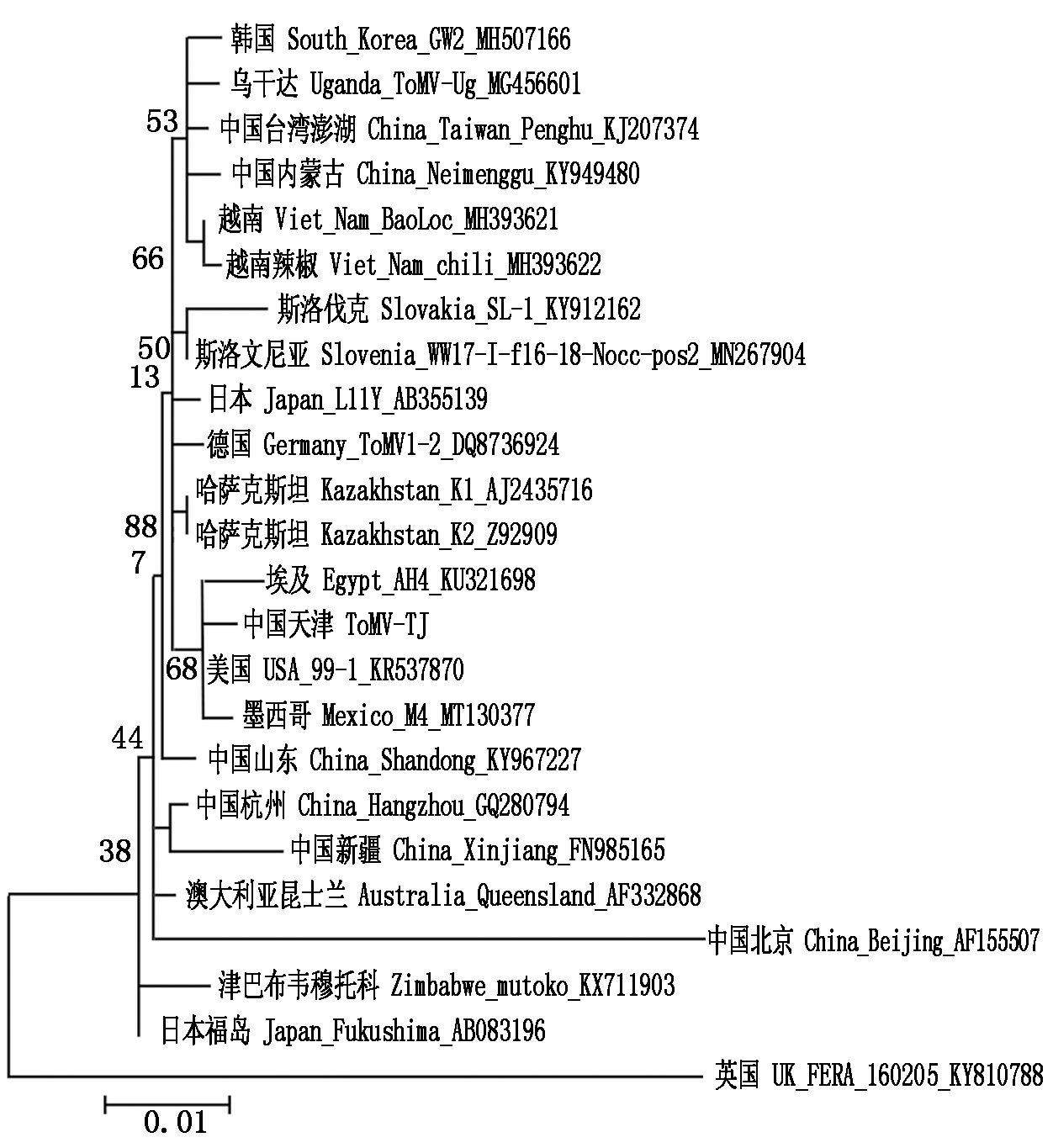
图5 MP基因进化树
Fig.5 Phylogenetic relationships of MP gene
体现出病毒的区域相似性,如哈萨克斯坦的2个分离物(Kazakhstan_K1、Kazakhstan_K2),中国新疆(China_Xinjiang)和杭州(China_Hangzhou),越南的2个分离物(Viet_Nam_BaoLoc、Viet_Nam_ chili),以及地理距离很近的斯洛文尼亚(Slovenia_WW17-I-f16-18-Nocc-pos2 )和斯洛伐克(Slovakia_SL-1)分别聚在了一起。
与前2个蛋白类似,126蛋白基因的系统进化树分析表明(图6),大部分的分离物都形成了一个大分支,天津分离物(ToMV-TJ)与美国分离物(USA_99-1)的进化关系最近。同样地,该进化关系图部分地区体现出病毒的区域相似性,如中国新疆(China_Xinjiang)、中国杭州(China_Hangzhou)、中国山东(China_Shangdong)分离物聚在一起;哈萨克斯坦的2个分离物(Kazakhstan_K1、Kazakhstan_K2)聚在一起。
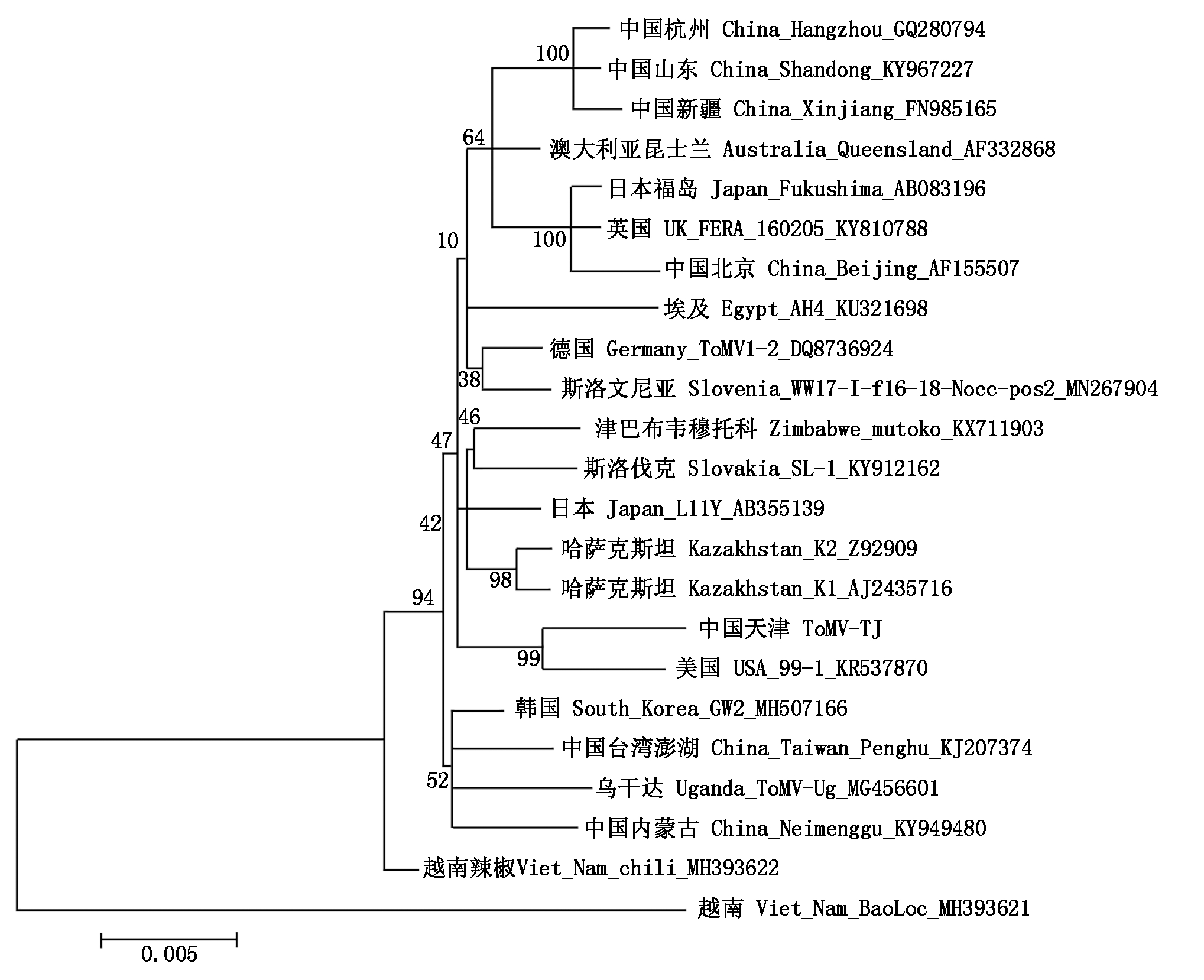
图6 126蛋白基因的系统进化树
Fig.6 Phylogenetic relationships of 126 protein gene
2.5 相似性分析
为进一步了解ToMV-TJ分离物与国内外其他地区分离物的序列相似性,利用DNAStar ClustralW软件进行了相似性分析(表4)。其中,CP蛋白基因与越南的分离物(Viet_Nam_chili)的相似性最低为79.8%,与美国(USA_99-1)的分离物相似性最高为99.8%。与其他CP蛋白基因分离物的平均相似性为95.53%。该基因编码的蛋白与哈萨克斯坦K2分离物(Kazakhstan_K2)的相似性最低为96.6%,与美国(USA_99-1)的分离物、中国新疆(China_Xinjiang)、中国山东(China_Shandong)、埃及(Egypt_AH4)、墨西哥(Mexico_M4)、韩国(South Korea_GW2)、乌干达(Uganda_ToMV0Ug)、越南(Viet_Nam_Baoloc)、英国(UK_FERA)相似性最高为100%。与其他地区分离物的平均相似性为99.10%。
表4 ToMV-TJ分离物与其他国家和地区分离物的相似性分析
Tab.4 The identities of ToMV-TJ isolate with reference ToMV in different country and regions %

序号No.分离物Isolate国家或地区Country or regionCP基因CPgeneCP蛋白CPproteinMP基因MPgeneMP蛋白MPgene126基因126gene126蛋白126protein1Queensland澳大利亚99.699.099.4100.099.499.72K中国北京99.499.099.398.599.199.03N5中国杭州98.999.599.3100.099.199.64Neimenggu中国内蒙古98.999.999.3100.099.199.65YT中国山东99.4100.099.4100.099.799.66Xinjiang中国新疆99.6100.098.9100.098.899.47AH4埃及99.4100.099.4100.098.699.28ToMV1-2德国99.198.099.4100.099.199.59L11Y日本98.999.599.4100.099.199.610L11A-Fukushima日本86.599.488.6100.087.899.511K1哈萨克斯坦98.397.599.5100.099.099.512K2哈萨克斯坦98.396.698.6100.099.099.513M4墨西哥86.3100.085.3100.014SL-1斯洛伐克97.999.599.199.798.999.615WW17-I-f16-18-Nocc-pos2斯洛文尼亚99.199.599.599.499.199.716GW2韩国99.6100.098.7100.099.099.517Penghu中国中湾98.997.099.499.798.899.518ToMV-Ug乌干达99.4100.099.2100.098.819FERA_160205英国99.4100.097.6-98.899.52099-1美国99.8100.099.8100.099.299.621BaoLoc越南80.2100.076.5100.071.199.622chili越南79.899.375.8100.064.699.724mutoko津巴布韦99.299.599.099.798.999.7平均95.5399.1095.2199.2692.7299.00
MP蛋白基因与越南的分离物(Viet_Nam_chili)的相似性最低为75.8%,与美国(USA_99-1)的分离物相似性最高为99.8%。与其他MP蛋白基因分离物的平均相似性为95.21%。该基因编码的蛋白与中国北京的分离物(China_Beijing)的相似性最低为98.5%,与美国(USA_99-1)等大部分的分离物(Australia_Queensand、China_Neimenggu、China_Shandong、China_Xinjiang、China_Hangzhou、Egypt_AH4、Germany_ToMV1-2、Japan_L11Y、Japan_Fukushima、Kazakhstan_K1、Kazakhstan_K2、Mexico_M4、South Korea_ GW2、Uganda_ToMV-Ug、Viet_Nam_Baoloc、Viet_Nam_chili)相似性为100%。平均相似性为99.26%。
126蛋白基因与越南的分离物(Viet_Nam_chili)的相似性最低为64.6%,与中国山东(China_Shandong)的分离物相似性最高为99.7%。与其他126蛋白基因分离物的平均相似性为92.72%。该基因编码的蛋白与中国北京的分离物(China_Beijing)的相似性最低为99.00%,与美国99-1等其他的分离物的相似性在99.0%~99.7%,平均相似性为99.0%。
对CP、MP和126蛋白3个基因和蛋白相似性分析表明,这3个基因在核苷酸水平的保守性CP蛋白最强,MP次之,126蛋白最弱。而在蛋白水平MP最强,CP次之,126蛋白最弱,相似性平均在99.0%以上,且蛋白的平均相似性大于核苷酸的平均相似性。这说明ToMV编码的这3个蛋白在全世界范围内的变异频率不是很高,保守性很强,而且该病毒的基因变异大部分属于无义突变。
3 讨论
Small RNA测序技术已在植物病毒鉴定中得到广泛应用[12-13]。本研究应用该技术对天津地区发生的番茄果实褐化的病原检测出3种病毒。进一步结合RT-PCR和测序技术确定该病为ToMV引起,而不是一种生理性病害,这为今后的该病防治提供了理论依据。
3.1 天津地区ToMV的序列分析
本研究中,对该病毒的外壳蛋白CP和运动蛋白MP以及编码的126蛋白进行了克隆和序列分析。通过分析可以看出,天津地区的病毒分离物与空间距离较远的美国、墨西哥分离物同源关系较近。这在一定程度上说明,此病毒的天津分离物可能是由于贸易活动随种子或种苗从国外带到本地,并进行了为害。廖富荣等[9]报道在进口的番茄种中检测出ToMV。番茄花叶病毒虽然在我国很多地方均有报道[3,14-16],但是各地发生的情况和症状不尽相同,致病的病原可能为不同的病毒株系。因此,在番茄种苗调运时还应加强检疫,避免该病毒随着番茄种苗在不同地区的调运,加速该病毒的广泛传播。
3.2 ToCV的发生和防治
近年来,在天津地区的番茄上发生的2个主病毒病为TYLCV和ToMV[1-2]。自1909年美国首次报道ToMV的发生以来,该病已广泛分布于世界各国的番茄生产区,在中国很多地方也有严重发生[7,17]。对该病的防治主要是利用抗病基因进行育种。已有研究表明,针对TMV的抗性基因Tm-2和Tm-22对ToMV有原始抗性[18-19],生产上很多番茄品种含有这些基因。因为ToMV是一个为害番茄很多年的老病害,很多品种含有对该病害的抗性基因(Tm-22),所以,没有对病情进行及时准确的诊断,造成了损失。笔者在番茄品种选育过程中也发现有很多含有Tm-22基因的材料,也能引起病毒的侵染。这可能是因为病毒基因本身发生了变异,从而突破了寄主的抗性。对于上述推测,还需通过构建突变体试验、侵染性克隆接种试验等予以验证。近年来,对于ToMV的防治也有一些其他有益的尝试,如利用纳米氧化锌增强番茄植株免疫力,提高了番茄对ToMV的抗性,消除了病毒对植株长势的不良影响,已初步显示出良好的效果[20]。
3.3 ToCV的检测
ToMV与TMV和ToMMV同是帚状病毒科烟草花叶病毒属的典型成员,亲缘关系很近,利用血清学检测这3种病毒时有很强的交叉反应,不能将病毒鉴定区分开来[4]。在本研究中,在利用小RNA深度测序技术进行病毒的鉴定后再利用RT-PCR进行验证,利用以番茄斑驳病毒基因组序列(KX898034)为模板设计的引物均能扩增出条带,但将扩增产物克隆测序后与ToMV的相似性最高,所以在对该病毒进行检测时只是做RT-PCR检测不能准确判断其是否为番茄花叶病毒,要结合测序结果进行判断。
[1] 金凤媚,薛俊,郏艳红,周祥明,王建江,刘仲齐.天津地区番茄黄化曲叶病毒DNA-A的克隆和序列分析[J].华北农学报,2011,26(1):58-62.doi:10.7668/hbnxb.2011.01.013.
Jin F M,Xue J,Jia Y H,Zhou X M,Wang J J,Liu Z Q. Cloning and sequence analysis of TYLCV DNA-A in Tianjin[J].Acta Agriculturae Boreali-Sinica,2011,26(1):58-62.
[2] 金凤媚,薛俊,宋建,于海涛,段红英.天津地区番茄褪绿病毒的分子检测与基因组部分序列分析[J].华北农学报,2016,31(2):23-27.doi:10.7668/hbnxb.2016.02.005.
Jin F M,Xue J,Song J,Yu H T,Duan H Y.Molecular detection and partial genome sequence analysis of Tomato chlorosis virus in Tianjin[J].Acta Agriculturae Boreali-Sinica,2016,31(2):23-27.
[3] 王勇,高苇,张春祥. 天津地区番茄病毒病发生情况调查及其毒源ELISA检测[J].天津农业科学,2014,20(12):1-5. doi:10.3969/j.issn.1006-6500.2014.12.001.
Wang Y,Gao W,Zhang C X. Occurrence and ELISA detection of tomato virus in Tianjin area[J].Tianjin Agricultural Sciences,2014,20(12):1-5.
[4] 冯兰香,杨荣昌,李树德,徐鹤林,杨又迪. 中国番茄TMV基因型株系分化的研究[J].园艺学报,1996,23(2):155-159.
Feng L X,Yang R C,Li S D,Xu H L,Yang Y D. A study on identification of TMV genotype strains of tomato in China[J].Acta Horticulturae Sinica,1996,23(2):155-159.
[5] 周雪平,钱秀红,刘勇,薛朝阳,李德葆.侵染番茄的番茄花叶病毒的研究[J].中国病毒学,1996,11(3):268-276.
Zhou X P,Qian X H,Liu Y,Xue C Y,Li D B. Isolation and characterization of Tomato mosaic virus from tomato[J].Virologica Sinica,1996,11(3):268-276.
[6] 彭浩然,蒲运丹,张永至,薛杨,武改霞,青玲,孙现超. ToMV外壳蛋白互作IP-L蛋白的亚细胞定位及表达分析[J].中国农业科学,2017,50(17):3344-3351. doi:10.3864/j.issn.0578-1752.2017.17.009.
Peng H R,Pu Y D,Zhang Y Z,Xue Y,Wu G X,Qing L,Sun X C. Subcellular localization and expression analyses of IP-L protein interacting with ToMV coat protein[J].Scientia Agricultura Sinica,2017,50(17):3344-3351.
[7] 曹金强,柴阿丽,谢学文,石延霞,李宝聚. 番茄花叶病毒对番茄茎部和果实危害严重[J].中国蔬菜,2016(10):84-86. doi:10.3969/j.issn.1000-6346.2016.10.020.
Cao J Q,Chai A L,Xie X W,Shi Y X,Li B J. Tomato mosaic virus(TMV)is very harmful to the stem and fruit of tomato[J].China Vegetables,2016(10):84-86.
[8] 陈利达,石延霞,谢学文,曹金强,柴阿丽,李宝聚. 我国不同地区番茄主要病毒病种类的分子检测与分析[J].华北农学报,2020,35(1):185-193.doi:10.7668/hbnxb.20190230.
Chen L D,Shi Y X,Xie X W,Cao J Q,Chai A L,Li B J. Molecular detection and analysis of main viruses of tomato in China[J].Acta Agriculturae Boreali-Sinica,2020,35(1):185-193.
[9] 廖富荣,郭木金,林石明,陈红运,陈青,黄蓬英,吴媛,谢惠明. 进境番茄种子中番茄花叶病毒的检测与鉴定[J].植物保护,2011,37(5):124-128,134.doi:10.3969/j.issn.0529-1542.2011.05.023.
Liao F R,Guo M J,Lin S M,Chen H Y,Chen Q,Huang P Y,Wu Y,Xie H M. Detection and identification of the Tomato mosaic virus in imported tomato seeds[J].Plant Protection,2011,37(5):124-128,134.
[10] 陈灵芝,张茹,魏兵强,王兰兰,高彦萍,张武. 辣椒 ToMMV 的分子鉴定[J].中国蔬菜,2018(6):39-43.
Chen L Z,Zhang R,Wei B Q,Wang L L,Gao Y P,Zhang W. Molecular identification of ToMMV in pepper[J]. China Vegetables,2018(6):39-43.
[11] 隋雪莲. 美国三种新兴蔬菜病毒病特性研究及其检测方法的建立[D].福州:福建农林大学,2017.
Sui X L. Characterization of three emerging viruses on vegetables in the United States and the development of detection methods[D].Fuzhou:Fujian Agriculture and Forestry University,2017.
[12] 崔丽艳,庞小静,齐永红,王宝霞,王德富,牛颜冰. 利用小RNA深度测序技术鉴定半夏病毒病病原[J].中国生物化学与分子生物学报,2018,34(12):1334-1341. doi:10.13865/j.cnki.cjbmb.2018.12.11.
Cui L Y,Pang X J,Qi Y H,Wang B X,Wang D F,Niu Y B. Identification of the pathogens of Pinellia ternata virus by small RNA deep sequencing[J].Chinese Journal of Biochemistry and Molecular Biology,2018,34(12):1334-1341.
[13] 范旭东,董雅凤,张尊平,张梦妍,任芳,胡国君.阳光玫瑰葡萄病毒小RNA测序鉴定及RT-PCR检测[J].植物病理学报,2019,49(6):749-755.doi:10.13926/j.cnki.apps.000396.
Fan X D,Dong Y F,Zhang Z P,Zhang M Y,Ren F,Hu G J. Small RNA sequencing and RT-PCR detection of viruses infecting Shine Muscat grapevines[J].Acta Phytopathologica Sinica,2019,49(6):749-755.
[14] 张爱红,杨菲,李希望,邸垫平,苗洪芹,潘阳,孙祥瑞,张尚卿,孙茜.河北省番茄病毒病种类鉴定及分布[J].安徽农业科学,2019,47(14):139-141.doi:10.3969/j.issn.0517-6611.2019.14.041.
Zhang A H,Yang F,Li X W,Di D P,Miao H Q,Pan Y,Sun X R,Zhang S Q,Sun Q. Identification and distribution of Tomato viruses in Hebei Province[J].Journal of Anhui Agricultural Sciences,2019,47(14):139-141.
[15] 姜玉霞,向本春,安仙丽,黄家风,汪铖华. 新疆加工番茄上番茄花叶病毒的分子鉴定[J].新疆农业科学,2008,45(3):484-489.
Jiang Y X,Xiang B C,An X L,Huang J F,Wang C H. Identification on molecular of Tomato mosaic virus of processing tomato in Xinjiang[J].Xinjiang Agricultural Sciences,2008,45(3):484-489.
[16] 吴贺,荆诗韵,刘丹,谢洪芳,詹国勤,季英华,陈虹宇,陶小荣.苏南五地(市)主要蔬菜作物的病毒种类、区域分布和发生趋势[J].植物病理学报,2021,5(3):325-333. doi:10.13926/j.cnki.apps.000527.
Wu H,Jing S Y,Liu D,Xie H F,Zhan G Q,Ji Y H,Chen H Y,Tao X R. Virus species,regional distribution and occurrence trend of main vegetable crops in five regions(cities)of southern Jiangsu Province[J].Acta Phytopathologica Sinica,2021,5(3):325-333.
[17] 郑贵彬,徐鹤林,熊助功. 我国为害番茄的病毒种群与烟草花叶病毒(TMV) 株系分化的初步鉴定[J].病毒学杂志,1988,3(1):64-70.
Zheng G B,Xu H L,Xiong Z G. A preliminary study on the virus groups of tomato and strain differentiation of Tobacco mosaic virus(TMV)in China[J].Virologica Sinica,1988,3(1):64-70.
[18] 姜国勇,王林华,黄婷婷. 番茄抗病基因Tm-22及其等位基因氨基酸序列的比较[J].园艺学报,2007,34(2):493-496. doi:10.16420/j.issn.0513-353X.2007.02.045.
Jiang G Y,Wang L H,Huang T T. Comparison of amino acid sequences on resistant gene Tm-22 and its alleles[J].Acta Horticulturae Sinica,2007,34(2):493-496.
[19] Weber H,Ohnesorge S,Silber M V,Pfitzner A J P. The Tomato mosaic virus 30 ku movement protein interacts differentially with the resistance genes Tm-2 and Tm-22[J].Archives of Virology,2004,149(8):1499-1514. doi:10.1007/s00705-004-0312-0.
[20] Sofy A R,Sofy M R,Hmed A A,Dawoud R A,Alnaggar A E M, Soliman A M,El-Dougdoug N K. Ameliorating the adverse effects of Tomato mosaic tobamovirus infecting tomato plants in egypt by boosting immunity in tomato plants using zinc oxide nanoparticles[J].Molecules,2021,26(5):1337.doi:10.3390/MOLECULES26051337.