氮(N)是植物体内许多重要化合物的组成成分,通常被称为生命元素,参与多种重要生理过程,对植物生长发育至关重要[1-3]。油菜是我国重要的油料作物之一,是国产食用植物油主要来源[4]。油菜是需氮量较高的作物,相比其他作物,油菜生产单位质量干物质所消耗的氮更多[5],施氮对我国油菜产量的贡献率超过70%,因此,氮肥的合理供给是油菜产量和品质的重要保证[6],而氮的缺乏会抑制油菜植株生长发育,最终导致其产量和品质受到影响[3]。尽管油菜对氮的需求较高,但是油菜氮肥利用率却普遍低于其他作物[7]。如何提升油菜氮肥利用率,减少肥料过量投入成为科研工作者关注的热点。
同时,化肥大量施用导致土壤中微量元素缺乏的现象也日趋严重,而中微量元素的缺乏容易造成土壤出现元素短板,氮肥效应得不到充分发挥,利用率降低[8]。因此,适当补充中微量元素是提升油菜氮效率及产量品质的有效途径。镁(Mg)是植物体内含量最丰富的二价阳离子,是植物体内多种酶的辅因子,参与植物光合作用、叶绿素合成、能量代谢、光合产物运输等过程[9],对提高作物产量、品质具有重要作用。同时,镁还能维持细胞膜的稳定性,对植物生长发育至关重要[10]。在油菜种植的主产区-长江流域,氮磷钾肥的不合理施用、密集种植模式对土壤镁的消耗、降雨量大导致土壤镁淋溶损失严重等致使土壤有效镁含量较为缺乏,油菜缺镁现象日益突出[9],镁已成为影响油菜产量、品质的重要因素。缺镁会导致油菜形态和生理上的异常,如抑制叶绿素合成以及根和叶的生长,同时还会对作物碳、氮代谢产生影响[10-11]。因此,氮、镁营养元素对油菜生长及产量、品质的影响不容忽视[12]。
氮代谢是植物体内最基本的代谢过程之一,包括氮的吸收、转运及同化。硝态氮(NO3--N)和铵态氮(NH4+-N)是植物从土壤中吸收的主要氮素来源,它们主要通过相应的转运蛋白进入植物体[11]。而氮同化是指将植株从环境中吸收的NO3-和NH4+合成氨基酸和蛋白质等含氮有机物的重要过程[13]。相关研究表明,不同氮、镁浓度会影响植株对氮素的吸收及同化路径[14]。黄海涛等[15]研究发现,氮素浓度会影响硝态氮及铵态氮在油菜植株不同部位的分布,并且,李彩凤等[16]在甜菜方面的研究表明,吸收的氮素形态比例不同也会影响氮代谢关键酶活性的变化。此外,杨利华等[17]在玉米上的研究表明,镁可以促进玉米对氮的吸收,烟草方面的研究结果也显示,当镁达到一定浓度时,会提高烟草植株氮代谢关键酶活性,来促进无机氮向有机氮的转化[18]。
目前,关于氮营养对油菜生长发育及氮代谢的影响报道[15]较多,但是针对氮、镁缺乏以及两者交互作用对油菜苗期植株氮、镁累积及氮同化影响的研究鲜有报道。因此,本研究以甘蓝型油菜品种中双11为试验材料,重点分析氮、镁胁迫处理下油菜苗期植株生物量、氮、镁含量及累积量、铵态氮与硝态氮含量以及氮同化相关酶活性等指标,系统阐明氮、镁胁迫对油菜苗期氮、镁吸收累积及氮同化的影响,以期为油菜平衡施肥及氮利用效率提升提供理论依据。
1 材料和方法
1.1 试验材料与设计
试验在中国农业科学院油料作物研究所植物生长间进行,生长间温度设置为24 ℃/20 ℃(白天/黑夜),光周期为14 h/10 h(白天/黑夜)。以甘蓝型油菜品种中双11(ZS11)为试验材料。采用营养液培养方式,设置全营养(CK)、低氮(-N)、低镁(-Mg)和低氮低镁(-N-Mg)4个处理。以改良后的1/2浓度Hoagland营养液作为全营养对照处理(CK),全营养液中N浓度为 9 500 μmol/L、Mg浓度为1 000 μmol/L;低氮(-N)处理时N浓度为237.5 μmol/L(浓度为全营养液N浓度的1/40);低镁(-Mg)处理时Mg浓度为10 μmol/L(浓度为全营养液Mg浓度的1/100);低氮低镁(-N-Mg)处理时N 浓度为237.5 μmol/L、Mg浓度为 10 μmol/L(与低氮或低镁处理时N、Mg浓度一致)。不同氮、镁处理分别用Ca(NO3)2·4H2O、KNO3、NH4NO3和MgSO4母液调节(低氮处理时去掉的硝酸钙、硝酸钾里的钙和钾分别用相应浓度的氯化钾和氯化钙补充)。所有处理营养液pH值调整至5.8~6.0。
挑选饱满一致的油菜种子用纯水浸泡30 min后用5%的NaClO溶液消毒20 min,用蒸馏水反复冲洗多次,然后均匀播撒在1/4浓度营养液浸润的纱布上,于水培箱中育苗。待油菜子叶完全展开(催芽5 d)时,选取长势一致的幼苗移栽到有孔(直径2 cm)的塑料定植板上,将根部浸入盛有不同氮、镁处理营养液的水培箱中,每7 d更换1次营养液。试验每个处理设置4次生物学重复。待不同氮、镁处理28 d后进行取样,用于植株生物量、养分含量、铵态氮硝态氮含量及氮同化相关酶活性等指标的测定。
1.2 测定项目与方法
1.2.1 植株表型观察及生物量测定 在处理28 d后对植株统一进行拍照,相机型号为NikonD800。取不同处理植株地上部和根部,于105 ℃下杀青30 min后在75 ℃下烘干至恒质量,用万分之一天平称取干质量。
1.2.2 总根长测定 用根系扫描仪(EPSON V700)获取根系图片,并用根系分析软件(WinRHIZO)分析计算总根长。
1.2.3 氮镁含量测定 油菜植株不同部位烘干至恒质量后分别粉碎,万分之一天平称取0.150 0 g,植株氮测定采用H2SO4-H2O2消煮,凯氏定氮法测定氮含量,植株镁测定采用HNO3-HClO4消煮,用ICP-OES(Optima 7000 DV,Pekin Elmer)测定镁含量,测定方法均参考土壤农化分析[19]。
氮累积量(N accumulation,NA,mg/株)=生物量×氮含量;
镁累积量(Mg accumulation,MgA,mg/株)=生物量×镁含量。
1.2.4 铵态氮、硝态氮含量及氮同化相关酶活活性测定 不同氮、镁处理油菜新叶、老叶、茎和根部铵态氮、硝态氮及NR(硝酸还原酶)、GOGAT(谷氨酸合成酶)和 GS(谷氨酰胺合成酶)均根据相应生理指标测定试剂盒(科铭,中国)说明书的方法采用试剂盒进行测定。
1.2.4 数据处理 用 Microsoft Excel 2010软件进行数据处理,用SPSS软件进行单因素方差分析,运用LSD法进行多重比较;同时运用双因素方差分析,分析低氮和低镁对不同测定指标的影响。
2 结果与分析
2.1 氮、镁胁迫对油菜苗期植株表型及生物量的影响
由图1-A可以看出,与对照相比,3种胁迫处理均抑制了油菜苗期地上部的生长,尤其是-N和-N-Mg处理,地上部症状相似,主要表现为叶片瘦小、呈黄绿色,子叶黄化,茎秆紫红色。而-Mg处理主要表现为叶片相对较小,新叶叶缘黄化,中部叶片叶色不均,脉间失绿。另一方面,综合油菜苗期植株根系表型及总根长的变化可以看到,不同处理对油菜苗期根系生长也产生了不同的影响,与对照相比,-N和-N-Mg处理明显促进了油菜主根的伸长生长,并且总根长分别显著增加了126.41%,65.63%,而-Mg处理严重抑制了根系的生长发育(图1),其总根长显著降低了44.84%(图1-B)。

柱上不同小写字母表示不同处理间差异达到0.05显著水平。图2-4同。
Different small letters above the bars mean significant difference among treatments at the 0.05 level.The same as Fig.2-4.
图1 氮、镁胁迫对油菜苗期植株表型及总根长的影响
Fig.1 Effects of nitrogen or magnesium deficiency stress on the growth performance and total roots length of rapeseed seedlings
由表1可知,与对照相比,-N处理的地上部生物量(以干质量计)显著降低,降幅为68.49%,但其根部生物量基本与对照持平,并且根冠比显著高于对照,是对照处理的3.24倍;-Mg处理的地上部生物量、根部生物量及根冠比均显著降低,降幅分别为35.49%,57.64%,34.69%;而-N-Mg处理对地上部生物量和根冠比的影响程度与-N处理接近,相比于对照,地上部显著降低69.71%,同时根冠比是对照的2.93倍,但是其对根部生物量有一定的影响,降幅为12.12%,而与对照相比差异不显著。同时,方差分析结果表明,氮镁交互作用对油菜苗期地上部和根系生物量有极显著影响(P<0.01),对根冠比则影响不显著。综合表型、总根长及生物量分析结果可知,双重胁迫下油菜更多地表现出低氮相似的症状,说明油菜苗期地上部生物量受低氮胁迫的影响大于低镁胁迫,而低镁胁迫对根系生长的抑制作用较为明显,低氮胁迫则是促进油菜苗期根系的生长,并且在根系生长发育方面氮镁存在一定的交互作用。
表1 氮、镁胁迫对油菜苗期植株生物量及根冠比的影响
Tab.1 Effects of nitrogen or magnesium deficiency stress on biomass and root-shoot ratio of rapeseed seedlings
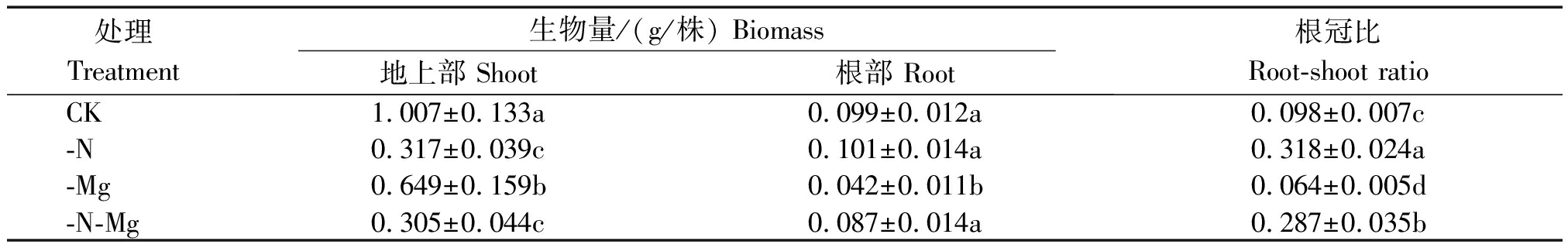
处理Treatment生物量/(g/株) Biomass地上部 Shoot根部 Root根冠比Root-shoot ratioCK1.007±0.133a0.099±0.012a0.098±0.007c-N0.317±0.039c0.101±0.014a0.318±0.024a-Mg0.649±0.159b0.042±0.011b0.064±0.005d-N-Mg0.305±0.044c0.087±0.014a0.287±0.035b
注:同列数据后不同字母表示差异达5%显著水平。
Note:Values followed by different letters in the same column mean significant at the 5% level.
2.2 氮、镁胁迫对油菜苗期植株氮镁含量及累积量的影响
如图2-A、B所示,氮、镁胁迫对油菜植株苗期氮、镁含量及累积量均有不同程度的影响。与对照相比,-N和-N-Mg处理均显著降低了油菜苗期叶片和根部氮含量,降幅分别为70.21%和50.88%,63.31%,47.14%;-Mg处理也显著降低了叶片中氮含量,降幅仅为16.97%,而-Mg处理对根部氮含量没有显著影响(图2-A)。同样,-N、-Mg和-N-Mg 3种处理对油菜苗期叶片氮累积量的影响趋势与氮含量一致,降幅分别为69.81%,15.41%,63.42%(图2-B)。总体来说,氮的缺乏对油菜叶片氮积累的影响远远超过镁的缺乏。对根部来说,与对照相比,3种胁迫处理都显著降低了根部氮的累积,尤其是-Mg处理降幅最高,达68.44%(图2-B),与氮含量的变化趋势不一致。值得一提的是,与-N和-Mg处理相比,-N-Mg根部的氮累积量显著增加,增幅分别为36.88%和62.28%(图2-B)。并且方差分析结果显示,氮、镁胁迫对油菜叶片和根部氮含量及累积量存在极显著的相互作用(P<0.01)。上述结果表明,氮、镁胁迫均会影响油菜苗期植株氮的吸收积累,并且氮的缺乏对根部和叶片氮的吸收积累影响较大,而镁的缺乏对根部氮积累的影响大于叶片。
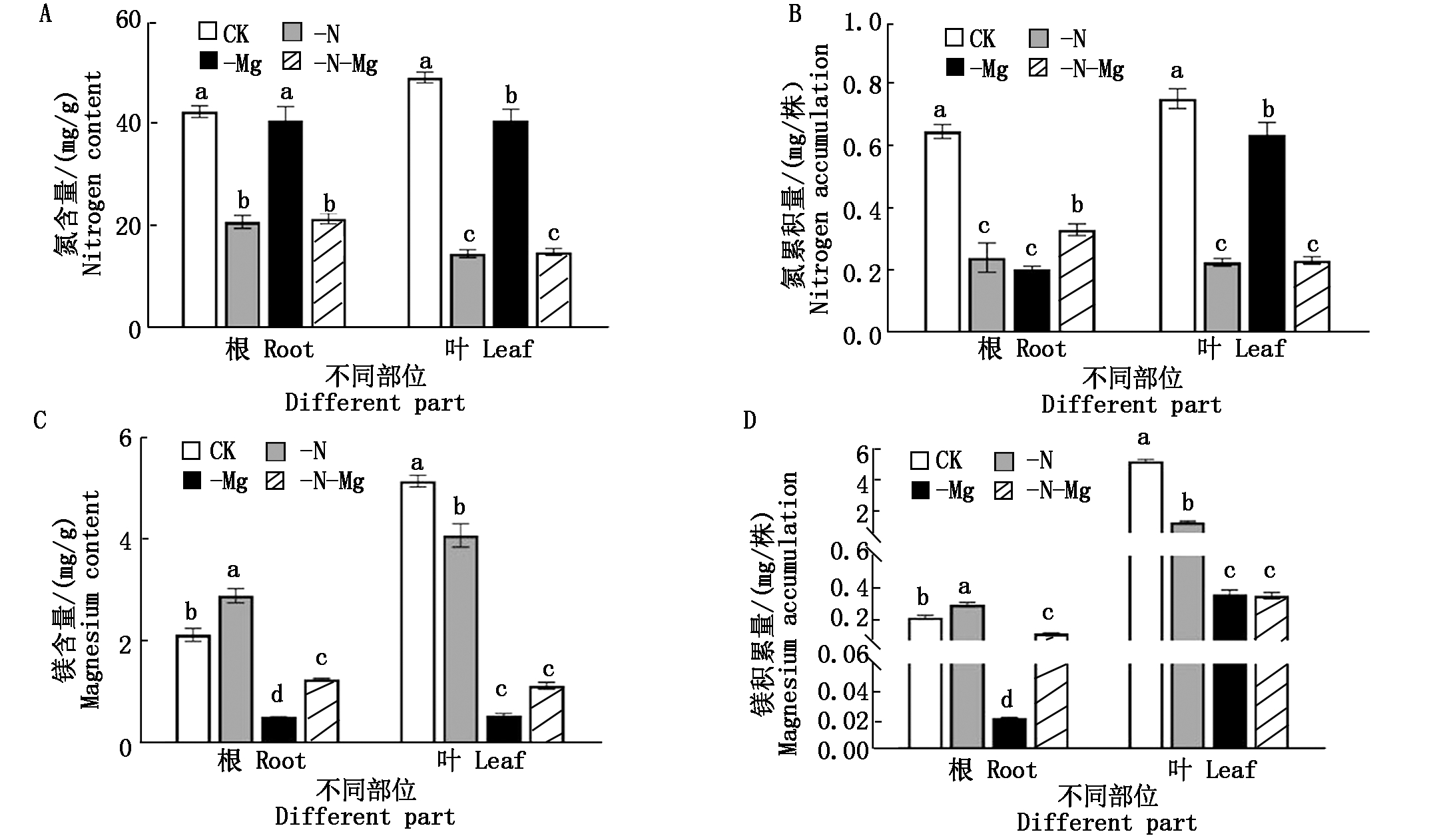
图2 氮、镁胁迫对油菜苗期植株氮镁含量及累积量的影响
Fig.2 Effects of nitrogen or magnesium deficiency stress on nitrogen and
magnesium content and accumulation amount of rapeseed seedlings
同样,氮、镁胁迫对油菜植株苗期镁含量及累积量也产生了不同程度的影响(图2-C、D),并且氮、镁胁迫对油菜叶片和根部镁含量及累积量存在极显著的相互作用(P<0.01)。与氮含量及累积量相似的是,-N、-Mg和-N-Mg 3种处理均显著降低了油菜苗期叶片的镁含量及累积量,其中镁含量降幅分别为20.76%,89.37%,77.86%(图2-C),镁累积量降幅分别为75.04%,93.14%,93.3%(图2-D)。与叶片变化趋势不同的是,氮、镁胁迫对油菜苗期根部镁含量及镁累积量影响有所差异,-Mg和-N-Mg处理显著降低了根系镁含量及累积量,降幅分别为75.48%,41.16%,但是与-Mg处理相比,-N-Mg处理镁含量及累积量均显著增加了2.40,6.68倍,尤其是镁累积量,可见-N并没有加剧-Mg的效应,并且-N处理显著增加了根部镁含量及累积量,增幅为26.35%,39.00%(图2-C、D),由此可以推测,-N-Mg处理时对油菜根部镁吸收积累产生影响的主要效应来自氮的缺乏。上述结果表明,氮、镁胁迫均会影响油菜苗期植株镁的吸收积累,镁的缺乏会显著减少根部和叶片镁的累积,氮的缺乏同样会减少叶片镁的累积,但是其能显著提升根部镁的累积。
2.3 氮、镁胁迫对油菜苗期植株硝态氮和铵态氮含量的影响
由图3-A可知,氮、镁胁迫对油菜苗期植株不同部位硝态氮含量有不同程度的影响,-N和-N-Mg处理均极显著降低了油菜苗期各部位硝态氮含量,与对照相比,老叶、茎部、根部硝态氮含量降幅均达到99%以上,并且新叶中几乎没有检测到硝态氮。另一方面,与对照相比,-Mg处理对茎部和根部硝态氮含量无显著影响,但是,其新叶和老叶硝态氮含量变化呈相反趋势,新叶硝态氮含量显著增加57.25%,老叶则显著下降52.92%。但是与-Mg处理相比,-N-Mg处理则使茎部和根部的硝态氮含量分别显著下降99.59%,99.71%。综合分析,低氮胁迫会显著降低油菜苗期植株体内的硝态氮含量,而低镁胁迫则会提高新叶并且降低老叶的硝态氮含量,总的来说,低氮胁迫对硝态氮含量的影响更为显著。同时结合方差分析可知,氮、镁胁迫对油菜新叶和老叶硝态氮含量存在极显著的交互作用(P<0.01)。
由图3-B可以看出,与对照相比,-N和-N-Mg处理对油菜苗期植株各部位铵态氮含量的影响均不显著。而-Mg处理对新叶和老叶的铵态氮含量产生了极显著的影响,与对照相比,分别增加了18.28,38.35倍,对根部也产生了显著影响,铵态氮含量增加了29.60%。以上结果表明,低镁胁迫促进了油菜根系对铵态氮的吸收,同时提高了油菜植株体内的铵态氮含量,结合方差分析结果可知,氮、镁胁迫对油菜新叶和老叶铵态氮含量存在极显著的交互作用(P<0.01)。
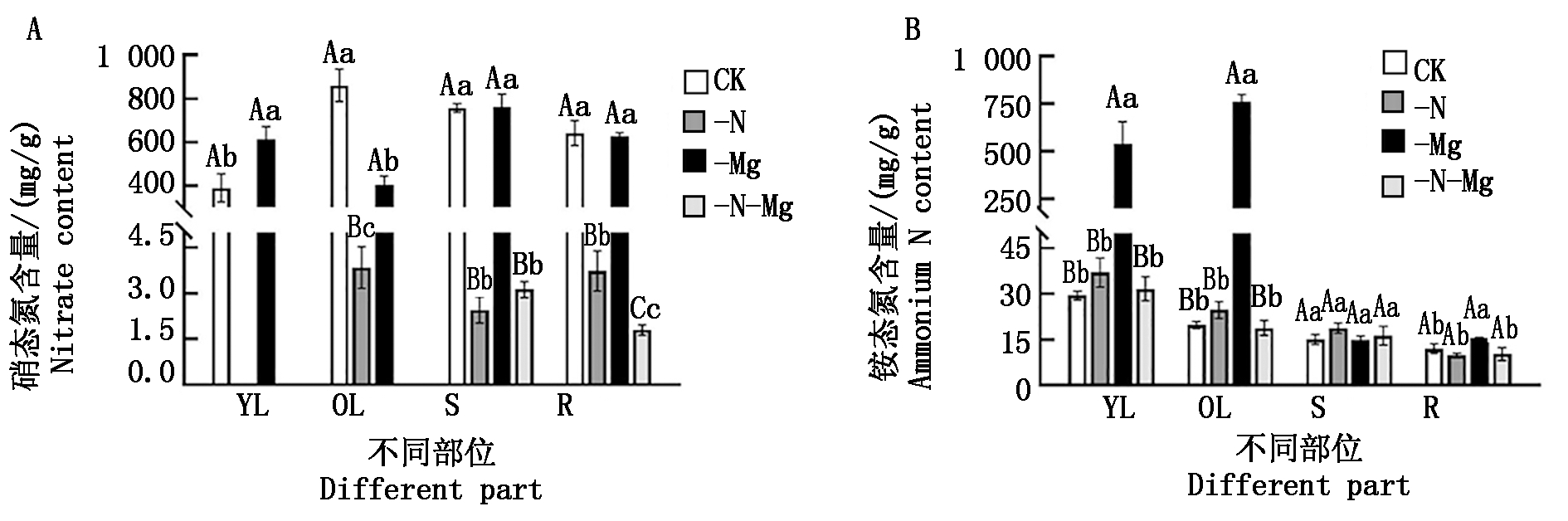
YL.新叶;OL.老叶;S.茎;R.根。图4同。
YL.Young leaf;OL.Old leaf;S.Stems;R.Root.The same as Fig.4.
图3 氮、镁胁迫对油菜植株铵态氮和硝态氮含量的影响
Fig.3 Effects of nitrogen or magnesium deficiency stress on ammonium and nitrate contents of rapeseed seedlings
2.4 氮、镁胁迫对油菜苗期氮同化相关酶活性的影响
硝酸还原酶是植物硝态氮转化为铵态氮的关键酶。由图4可知,氮、镁胁迫对油菜不同部位氮同化相关酶活性均产生不同程度的影响。其中,从图4-A硝酸还原酶活性来看,与对照相比,-N处理油菜苗期新叶、老叶和根部硝酸还原酶活性分别降低55.10%,42.24%,35.12%,茎部则显著升高65.43%;-Mg处理趋势基本与-N处理相反,油菜新叶、老叶、茎部和根部硝酸还原酶活性均显著提高,与对照相比,分别增加了54.08%,40.25%,145.73%,110.17%。进一步发现,与-Mg处理相比,-N-Mg处理下油菜新叶、老叶、茎部和根部硝酸还原酶显著下降,降幅分别为32.01%,27.35%,28.83%,34.32%;而与-N处理相比,-N-Mg处理下油菜新叶、老叶和根部硝酸还原酶活性分别显著升高133.34%,76.40%,112.76%。整体来看,在本试验条件下,低氮胁迫抑制了油菜叶片和根部硝酸还原酶的活性,而低镁胁迫则起促进作用,并且从百分比变化幅度来看,低镁胁迫对硝酸还原酶活性的影响更为显著。同时结合方差分析可知,氮、镁胁迫对油菜茎部和根部硝酸还原酶活性存在极显著的交互作用(P<0.01)。
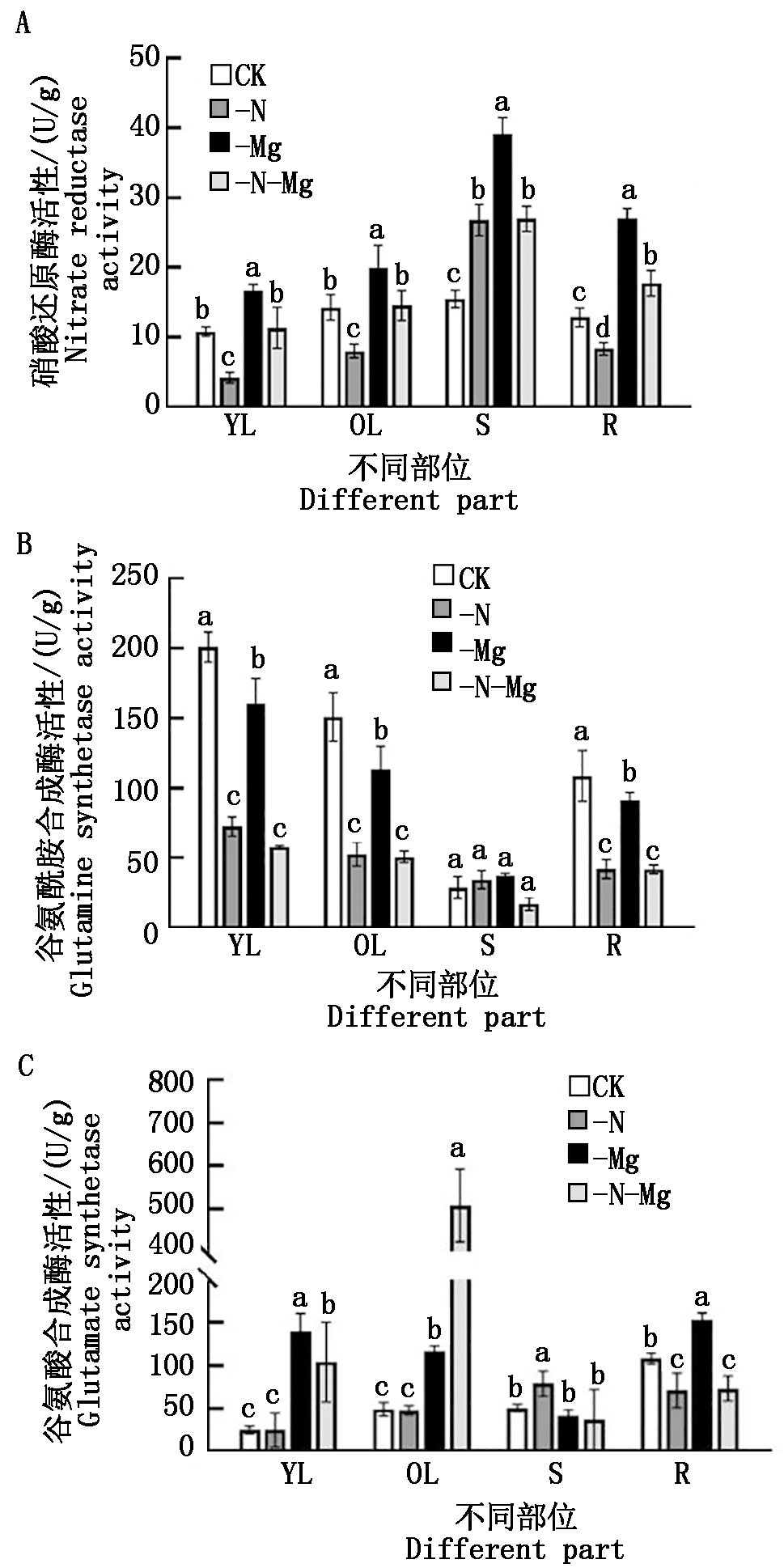
图4 氮、镁胁迫对油菜植株氮同化相关酶活性的影响
Fig.4 Effects of nitrogen or magnesium deficiency
stress on nitrogen assimilation-related enzymes
activities of rapeseed seedlings
谷氨酰胺合成酶是植物体内氮代谢的关键酶之一,在 ATP 和 Mg2+存在下,催化植物体内铵离子和谷氨酸合成谷氨酰胺。由图4-B可以看出,氮镁胁迫对油菜新叶、老叶和根部谷氨酰胺合成酶活性影响显著。与对照相比,-N、-Mg和-N-Mg处理下油菜新叶、老叶、根部谷氨酰胺合成酶活性都显著降低,-N处理下降幅分别为63.96%,65.04%,61.27%,-Mg处理下降幅分别为20.26%,24.84%,15.70%,而-N-Mg处理下降幅分别为71.22%,66.38%,61.43%。上述结果说明,低氮低镁胁迫均会显著降低油菜新叶、老叶和根部的谷氨酰胺合成酶活性,并且从百分比的变化幅度可以看出,在本试验条件下,低氮胁迫比低镁胁迫对油菜苗期植株谷氨酰胺合成酶活性的影响更大。另外,结合方差分析可知,氮、镁胁迫对油菜苗期新叶和老叶谷氨酰胺合成酶活性存在显著的交互作用(P<0.05)。
谷氨酸合成酶是植物体内氮素同化与循环的关键酶,可催化谷氨酰胺和α-酮戊二酸形成谷氨酸,与谷氨酰胺合成酶共同构成GS/GOGAT循环。从图4-C结果可以看出,氮镁胁迫对油菜不同部位谷氨酸合成酶活性有不同程度的影响。与对照相比,-N处理下油菜苗期茎部谷氨酸合成酶活性显著提升57.24%,而根部酶活性显著降低37.76%,叶片酶活性无显著变化;-Mg处理下油菜新叶、老叶和根部谷氨酸合成酶活性显著上升,增幅分别为344.48%,99.69%,39.79%。此外,可以看到,-N-Mg处理下新叶和老叶谷氨酸合成酶活性变化趋势与-Mg处理相似,谷氨酸合成酶活性分别显著提高4.13,10.29倍;并且-N-Mg处理老叶中谷氨酸合成酶活性是-Mg处理的4.35倍,而根部谷氨酸合成酶活性比-Mg处理降低52.18%。以上结果说明,低氮胁迫对油菜苗期茎部和根部谷氨酸合成酶活性的影响大于叶片,低氮会抑制根部谷氨酸合成酶活性,而低镁胁迫导致油菜苗期新叶、老叶和根部谷氨酸合成酶活性增加;并且从百分比的变化幅度来看,低镁胁迫对油菜新叶和老叶谷氨酸合成酶活性影响更大。同时结合方差分析可知,氮、镁胁迫对油菜苗期老叶和根部存在极显著的交互作用(P<0.01)。
3 讨论与结论
根系是植物吸收养分的重要器官,土壤中的养分状态会影响植株根系的生长发育,从而影响根系对养分的吸收[20]。其中,氮对植物根系形态建成,尤其是侧根发育有着至关重要的作用[1]。本研究结果发现,低氮胁迫抑制油菜苗期地上部生长,但促进根系的伸长生长,这与前人研究结果一致[21]。相关研究表明,供氮水平不同显著影响光合产物在植物体内的分配,在供氮水平较低时,植物会把更多的光合产物分配到根部,来促进根系形态建成,从而吸收更多的氮[22];相比氮来说,镁对油菜根系生长发育影响方面的研究相对较少。大豆方面的研究表明,镁可直接或间接地影响根系的发育[23]。黄瓜方面的研究也证明,镁能提高根系形态相关指标[24]。本研究也有相同发现,低镁处理下油菜苗期植株根系生物量下降、根冠比降低,表明低镁胁迫影响油菜苗期植株根系生长发育及形态建成。镁主要参与植物能量代谢过程,并能促进光合产物的合成与转化[25],推测原因是缺镁导致植株体内碳水化合物合成运输受阻,根系碳水化合物含量下降,最终导致根系发育不良。
本试验中,低氮胁迫使油菜植株地上部和根部的氮累积量都显著下降,并且对地上部影响更为严重,主要因为介质中供氮减少,导致根系氮吸收降低,导致油菜植株整体氮累积量呈下降趋势。可能由于低氮胁迫下触发根的保护机制,所以氮更多地向根部分配,致使地上部氮累积量较根部相对减少幅度大[26]。NO3-和NH4+作为根系吸收氮素的主要形式,低氮处理下其含量呈下降趋势,其中NO3-下降极为显著,而NH4+变化不明显,说明低氮胁迫对油菜苗期植株体内的NO3-含量影响更大。另一方面,镁供给水平也会影响植物对氮的吸收积累[27-29]。前人在大豆和玉米中的[27-28]研究证明,镁可促进作物对氮素的吸收,其中施镁对大豆硝态氮的吸收有促进作用[27];熊英杰[28]在玉米中的研究显示,缺镁影响氮在玉米体内的转运,本研究结果也与之相似,与对照相比,低镁处理下油菜植株地上部和根部的氮累积量显著下降。推测原因是缺镁条件下根系发育不良致使根吸收的氮素总量减少,继而影响植株对于氮的积累。并且,从铵态氮的含量变化中发现,低镁胁迫下油菜根系的铵态氮含量反而显著升高,这与前人研究结论一致,徐洋[14]在大豆的研究中证明,NH4+和Mg2+之间具有拮抗作用,植物根系吸收铵根离子后,pH值降低,H+会拮抗镁的吸收。而对于镁含量及镁累积量来说,低氮胁迫反而使其根部上升,地上部下降。这一发现与前人研究结果相似,由于低氮胁迫下根系发育较好,对Mg2+的吸收面积增加,也会使得镁含量及镁累积量上升。崔国明等[30]报道显示,镁是受根细胞壁调节的ATP酶活化因子之一,根对某些矿质元素的主动吸收需要镁的参与;而低镁处理下,油菜植株地上部和根部的镁含量和镁累积量均显著下降,推测原因是供镁减少,同时缺镁条件下根系发育不良致使根吸收的镁素减少,继而影响植株对于镁元素的积累。同时对比来看,相比-Mg处理,-N-Mg处理下油菜植株体内镁含量呈上升趋势,说明-N处理可减轻-Mg条件下油菜植株体内镁含量降低的情况。
另一方面,氮同化作为氮代谢的关键步骤,影响着氮代谢的进行,继而影响作物的生长发育及产量品质[14]。氮同化,即无机氮转变为有机氮,主要包括2个过程,首先是无机氮间的同化,即硝态氮转变为铵态氮[13]。植物根系所吸收的无机氮主要包括NO3-和NH4+ 2种形式[31],对于NO3-来说,其在硝酸还原酶(NR)和亚硝酸还原酶的作用下还原为NH4+,NH4+在细胞中需要转换至氨基酸中以躲避铵的毒害作用[32]。在谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)的作用下,铵和谷氨酸转变为谷氨酰胺,产生的谷氨酰胺将作为转运体用于胞内氮的转运。然后,谷氨酰胺在谷氨酸合成酶(GOGAT)的作用下,将酰胺基转移到α-酮戊二酸上,产生2分子的谷氨酸。部分谷氨酸与谷氨酰胺一起,参与GS/GOGAT循环,完成氮同化的第二过程,无机氮向有机氮的转变[33]。结合硝酸还原酶(NR)的活性变化可以看出,低氮胁迫降低了无机氮间的同化过程,这与前人研究结果相似,氮水平及形态对NR和GOGAT活性均有影响[15]。李彩凤等[16]发现,NR活性与植株体内硝态氮呈正比。张宏纪等[34]在甜菜上的研究发现,施氮量越低,甜菜叶片GS活性越低,且玉米方面研究进一步发现GS活性受硝态氮的影响更大[35-36]。结合本试验结果可以推测,低氮胁迫使油菜体内NO3-和NH4+含量降低,从而导致GS活性降低,抑制了油菜苗期植株体内铵态氮向有机氮的转化。
另一方面,结合NR活性变化结果可以推测低镁胁迫通过提高NR活性来促进油菜植株体内无机氮间的转化。镁离子可刺激硝NR上丝氨酸残基的蛋白激酶磷酸化,进而与阻遏蛋白相作用,从而使NR失活[37],故低镁胁迫下NR活性增强。并且,这一变化也可以解释为什么低镁胁迫下硝态氮含量下降,铵态氮含量上升。同时,本研究发现,低镁胁迫下油菜根系的GS活性降低,这与前人研究结果一致。程梦云等[18]对烟叶的研究表明,镁是谷氨酰胺合成酶的活化剂,并且能提供该反应所需的ATP,故低镁胁迫抑制了油菜苗期铵态氮向有机氮的同化过程,而有研究表明,谷氨酰胺含量增加可提高谷氨酸合成酶(GOGAT)的活性[37]。因此,本试验中,低镁胁迫下谷氨酸合成酶(GOGAT)活性显著升高可能是因为谷氨酰胺含量增加。所以低镁胁迫能够提高苗期油菜植株体内铵态氮以及NR活性,来促进无机氮间的转化,而由于植株体内谷氨酸合成酶活性的提高,进而促进铵态氮向有机氮的转化过程。
氮、镁缺乏对油菜苗期植株生长产生显著影响,均会抑制地上部的生长,而低氮会促进根系生长发育,相反,低镁则抑制根系生长。氮和镁的交互作用对油菜苗期植株氮、镁的吸收累积有显著影响,其中,氮缺乏时油菜根部镁的含量及累积量显著增加,而镁缺乏情况下油菜地上部氮含量及氮累积量均显著降低,但是,镁的缺乏会导致油菜植株NH4+含量的显著提升。进一步比较氮、镁缺乏对氮同化途径的影响发现,低氮胁迫下氮同化受到显著抑制。而低镁胁迫下NR活性和NH4+含量的显著提升,促进了油菜植株体内无机氮间的转化,并且由于GOGAT活性的提高也促进了铵态氮向有机氮的转化过程。因此,氮、镁胁迫会对油菜养分累积及同化产生不同程度的影响,生产上应保证养分的充足供应,并且注意氮镁之间的平衡。
[1] Qin L,Walk T C,Han P P,Chen L Y,Zhang S,Li Y S,Hu X J,Xie L H,Yang Y,Liu J P,Lu X,Yu C B,Tian J,Shaff J E,Kochian L V,Liao X,Liao H. Adaption of roots to nitrogen deficiency revealed by 3D quantification and proteomic analysis[J].Plant Physiology,2019,179(1):329-347. doi:10.1104/pp.18.00716.
[2] Long G Q,Li L H,Wang D,Zhao P,Tang L,Zhou Y L,Yin X H. Nitrogen levels regulate intercropping-related mitigation of potential nitrate leaching[J].Agriculture,Ecosystems & Environment,2021,319:107540. doi:10.1016/j.agee.2021.107540.
[3] 刘秋霞,任涛,廖世鹏,李小坤,丛日环,石磊,鲁剑巍. 不同氮素供应对油菜苗期生长及碳氮分配的影响[J].中国油料作物学报,2019,41(1):92-100.doi:10.7505/j.issn.1007-9084.2019.01.012.
Liu Q X,Ren T,Liao S P,Li X K,Cong R H,Shi L,Lu J W. Effect of different nitrogen application on seedling growth and allocation of carbon and nitrogen in oilseed rape(Brassica napus L.)[J].Chinese Journal of Oil Crop Sciences,2019,41(1):92-100.
[4] 杜卓霖. 利用生物技术改良油菜种子芥酸、油酸和α-亚麻酸组成[D].武汉:华中农业大学,2020. doi:10.27158/d.cnki.ghznu.2020.000473.
Du Z L. Improvement of erucic,oleic and α-linolenic acid in Brassica napus L.seeds using biotechnology[D].Wuhan:Huazhong Agricultural University,2020.
[5] Sylvester-Bradley R,Kindred D R. Analysing nitrogen responses of cereals to prioritize routes to the improvement of nitrogen use efficiency[J].Journal of Experimental Botany,2009,60(7):1939-1951. doi:10.1093/jxb/erp116.
[6] 明日,张宗急,毛玲莉,李云娟,钟丽,许显发,阳华任,唐华. 氮肥用量对油菜开花性状和籽粒产量的影响[J].西南农业学报,2021,34(4):791-797. doi:10.16213/j.cnki.scjas.2021.4.016.
Ming R,Zhang Z J,Mao L L,Li Y J,Zhong L,Xu X F,Yang H R,Tang H. Effects of different nitrogen application rates on flowering properties and seed yield of oilseed rape[J].Southwest China Journal of Agricultural Sciences,2021,34(4):791-797.
[7] Bouchet A S,Laperche A,Bissuel-Belaygue C,Snowdon R,Nesi N,Stahl A. Nitrogen use efficiency in rapeseed. A review[J].Agronomy for Sustainable Development,2016,36(2):38. doi:10.1007/s13593-016-0371-0.
[8] 安航,张欣欣. 植物缺镁胁迫研究进展[J].安徽农业科学,2020,48(9):23-26. doi:10.3969/j.issn.0517-6611.2020.09.007.
An H,Zhang X X. Research progress on magnesium deficiency stress in plants[J].Journal of Anhui Agricultural Sciences,2020,48(9):23-26.
[9] 孙娟娟. 镁耐受型油菜品种的筛选及其响应缺镁胁迫机制研究[D].重庆:西南大学,2019.
Sun J J. Screening of magnesium-tolerant Brassica napus L. and the mechanism of response to magnesium deficiency stress[D].Chongqing:Southwest University,2019.
[10] Williams L,Salt D E. The plant ionome coming into focus[J].Current Opinion in Plant Biology,2009,12(3):247-249. doi:10.1016/j.pbi.2009.05.009.
[11] 郎漫. 不同氮肥用量下镁对大豆碳氮代谢的影响[D].哈尔滨:东北农业大学,2006. doi:10.7666/d.y975958.
Lang M. Effects of Mg on C and N metabolism of soybean at different N levels[D].Harbin:Northeast Agricultural University,2006.
[12] Grzebisz W. Crop response to magnesium fertilization as affected by nitrogen supply[J].Plant and Soil,2013,368(1/2):23-39. doi:10.1007/s11104-012-1574-z.
[13] 武姣娜,魏晓东,李霞,张金飞,谢寅峰. 植物氮素利用效率的研究进展[J].植物生理学报,2018,54(9):1401-1408. doi:10.13592/j.cnki.ppj.2018.0071.
Wu J N,Wei X D,Li X,Zhang J F,Xie Y F. Research progress in nitrogen use efficiency in plants[J].Plant Physiology Journal,2018,54(9):1401-1408.
[14] 徐洋. 氮镁交互对大豆群体质量指标及碳氮代谢的影响[D].哈尔滨:东北农业大学,2008.doi:10.7666/d.y1404035.
Xu Y. Effects of N and Mg application on population quality and C and N metabolisms of soybean[D].Harbin:Northeast Agricultural University,2008.
[15] 黄海涛,荣湘民,张振华,邓建功,杨兰,简镇. 不同供氮水平下油菜植株硝态氮与铵态氮的分布差异[J].湖南农业科学,2019(1):22-25. doi:10.16498/j.cnki.hnnykx.2019.001.007.
Huang H T,Rong X M,Zhang Z H,Deng J G,Yang L,Jian Z. Distribution of nitrate-N and ammonium-N in rape plants under different nitrogen supply levels[J].Hunan Agricultural Sciences,2019(1):22-25.
[16] 李彩凤,马凤呜,赵越,李文华. 氮素形态对甜菜氮糖代谢关键酶活性及相关产物的影响[J].作物学报,2003,29(1):128-132. doi:10.3321/j.issn:0496-3490.2003.01.023.
Li C F,Ma F W,Zhao Y,Li W H. Effects of nitrogen forms on key enzyme activities and related products in sugar and nitrogen metabolism of sugar beet(Beta vulgaris L.)[J].Acta Agronomica Sinica,2003,29(1):128-132.
[17] 杨利华,郭丽敏,傅万鑫. 玉米施镁对氮磷钾肥料利用率及产量的影响[J].中国生态农业学报,2003,11(1):78-80.
Yang L H,Guo L M,Fu W X. Effect of magnesium on fertilizer-utilized coefficient of nitrogen,phosphorus and potassium as well as grain yield in maize[J].Chinese Journal of Eco-Agriculture,2003,11(1):78-80.
[18] 程梦云,苟剑喻,杨茂,赵建,彭玉龙,黄莺. 不同镁浓度对烟叶氮代谢关键酶活性的影响[J].山地农业生物学报,2019,38(2):48-51,70. doi:10.15958/j.cnki.sdnyswxb.2019.02.009.
Cheng M Y,Gou J Y,Yang M,Zhao J,Peng Y L,Huang Y. Effects of magnesium concentration on the activities of key enzymes of nitrogen metabolism in tobacco leaves[J].Journal of Mountain Agriculture and Biology,2019,38(2):48-51,70.
[19] 鲍士旦. 土壤农化分析[M].3版. 北京:中国农业出版社,2000.
Bao S D. Soil agrochemical analysis[M].3rd edition. Beijing:China Agricultural Publishing House,2000.
[20] 吴宇. 低氮诱导的水稻根系形态解剖结构变化及其对氮素吸收分配的影响[D].武汉:华中农业大学,2020. doi:10.27158/d.cnki.ghznu.2020.000579.
Wu Y. Low nitrogen induced changes of morphological and anatomical characterics and its effects on nitrogen uptake and distribution in rice[D].Wuhan:Huazhong Agricultural University,2020.
[21] 韩配配,秦璐,李银水,廖祥生,徐子先,余常兵,胡小加,谢立华,廖红. 不同营养元素缺乏对甘蓝型油菜苗期生长和根系形态的影响[J].中国油料作物学报,2016,38(1):88-97. doi:10.7505/j.issn.1007-9084.2016.01.014.
Han P P,Qin L,Li Y S,Liao X S,Xu Z X,Yu C B,Hu X J,Xie L H,Liao H. Effects of different nutrient deficiencies on growth and root morphological changes of rapeseed seedlings(Brassica napus L.)[J].Chinese Journal of Oil Crop Sciences,2016,38(1):88-97.
[22] 罗许敏. 苗期水稻根系对供氮水平的响应及其与糖积累关系的研究[D].武汉:华中农业大学,2007.
Luo X M. Responses of root-related parameters to N applications and its relations to photosynthates accumulation in the early stage of growth in rice (Oryza sativa L.)[D].Wuhan:Huazhong Agricultural University,2007.
[23] 马存金,陈剑秋,李曰鹏,任士伟. 水溶肥中镁不同含量对辣椒产量、品质和根系发育的影响[J].江苏农业科学,2019,47(13):179-182. doi:10.15889/j.issn.1002-1302.2019.13.044.
Ma C J,Chen J Q,Li Y P,Ren S W. Contents of magnesium in water-soluble fertilizer on yield,quality and root development of pepper[J].Jiangsu Agricultural Sciences,2019,47(13):179-182.
[24] 黄红荣,李建明,胡晓辉,张军,张中典,崔万军. 提高营养液镁浓度可缓解黄瓜幼苗亚低温胁迫[J].植物营养与肥料学报,2017,23(3):740-747. doi:10.11674/zwyf.15521.
Huang H R,Li J M,Hu X H,Zhang J,Zhang Z D,Cui W J. Increasing magnesium level in hydroponic solution will relieve suboptimal temperature stress to cucumber seedlings[J].Journal of Plant Nutrition and Fertilizers,2017,23(3):740-747.
[25] Verbruggen N,Hermans C. Physiological and molecular responses to magnesium nutritional imbalance in plants[J].Plant and Soil,2013,368(1/2):87-99. doi:10.1007/s11104-013-1589-0.
[26] 陈卓,胡怡凡,韩永亮. 油菜氮素吸收和根系性状对低氮胁迫的响应[J].湖北农业科学,2020,59(5):57-62. doi:10.14088/j.cnki.issn0439-8114.2020.05.011.
Chen Z,Hu Y F,Han Y L. Response of nitrogen uptake and root traits of rapeseed to the low nitrogen stress[J].Hubei Agricultural Sciences,2020,59(5):57-62.
[27] Peng W T,Qi W L,Nie M M,Xiao Y B,Liao H,Chen Z C. Magnesium supports nitrogen uptake through regulating NRT2.1/2.2 in soybean[J].Plant and Soil,2020,457(1/2):97-111. doi:10.1007/s11104-019-04157-z.
[28] 熊英杰. 外源NO对缺镁胁迫玉米幼苗生理生化特性的影响[D].南昌:南昌大学,2011. doi:10.7666/d.y1942998.
Xiong Y J. Physiological and biochemical effects of exgenous nitric oxide on seedlings of maize (Zea mays L.)under magnesium deficient stress[D].Nanchang:Nanchang University,2011.
[29] 于群英. 安徽沿淮地区土壤交换性镁含量及镁对大豆营养的影响[J].安徽农学通报,2002,8(6):60-62.doi:10.16377/j.cnki.issn1007-7731.2002.06.029.
Yu Q Y. Content of exchangeable magnesium in soil along Huaihe River in Anhui Province and effect of magnesium on soybean nutrition[J].Auhui Agricultural Science Bulletin,2002,8(6):60-62.
[30] 崔国明,张小海,李永平,杨雪彪,马映华. 镁对烤烟生理生化及品质和产量的影响研究[J].中国烟草科学,1998,19(1):5-7.
Cui G M,Zhang X H,Li Y P,Yang X B,Ma Y H. Effects of magnesium on physiology and biochemistry,quality and yield of flue-cured tobacco[J].Chinese Tobacco Science,1998,19(1):5-7.
[31] 刘涛. 氮供应对油菜叶片氮形态分配与光合氮利用效率的影响机制[D].武汉:华中农业大学,2018.
Liu T. Mechanisms underlying the effects of nitrogen supply on leaf nitrogen-forms partitioning and photosynthetic nitrogen use efficiency of Brassica napus[D].Wuhan:Huazhong Agricultural University,2018.
[32] 康晓育,孙协平,常聪,马锋旺,邹养军. 氮素形态对不同苹果砧木幼苗生长的影响[J].西北农林科技大学学报(自然科学版),2013,41(6):133-138. doi:10.13207/j.cnki.jnwafu.2013.06.026.
Kang X Y,Sun X P,Chang C,Ma F W,Zou Y J. Effects of nitrogen forms on growth of different Malus rootstock seedlings[J].Journal of Northwest A & F University (Natural Science Edition),2013,41(6):133-138.
[33] 莫良玉,吴良欢,陶勤南. 高等植物GS/GOGAT循环研究进展[J].植物营养与肥料学报,2001,7(2):223-231. doi:10.3321/j.issn:1008-505X.2001.02.018.
Mo L Y,Wu L H,Tao Q N. Research advances on GS/GOGAT cycle in higher plants[J].Journal of Plant Nutrition and Fertilizers,2001,7(2):223-231.
[34] 张宏纪,马凤鸣,李文华,闫桂萍. 不同形态氮素对甜菜谷氨酰胺合成酶活性的影响[J].黑龙江农业科学,2001(6):7-10. doi:10.3969/j.issn.1002-2767.2001.06.003.
Zhang H J,Ma F M,Li W H,Yan G P. Effect of different nitrogen forms on goltamate synthetase activities in sugar beet(Beta vulgaris L.)[J].Heilongjiang Agricultural Science,2001(6):7-10.
[35] 吕丽华,陶洪斌,王璞,赵明,赵久然,鲁来清. 施氮量对夏玉米碳、氮代谢和氮利用效率的影响[J].植物营养与肥料学报,2008,14(4):630-637.doi:10.11674/zwyf.2008.0403.
Lü L H,Tao H B,Wang P,Zhao M,Zhao J R,Lu L Q. The effect of nitrogen application rate on carbon and nitrogen metabolism and nitrogen use efficiency of summer maize[J].Journal of Plant Nutrition and Fertilizers,2008,14(4):630-637.
[36] 白文钦,胡明瑜,王春萍,蒋晓英,雷开荣,吴红. 氮素在植物中的利用综述[J].江苏农业科学,2020,48(4):1-11. doi:10.15889/j.issn.1002-1302.2020.04.001.
Bai W Q,Hu M Y,Wang C P,Jiang X Y,Lei K R,Wu H.Utilization of nitrogen in plants:A review[J].Jiangsu Agricultural Sciences,2020,48(4):1-11.
[37] Stewart P,Globig S. Plant physiology[M].Sabine:Apple Academic Press,2011.