小麦品质主要包括3个方面,外观品质、营养品质和加工品质,由于小麦的最终用途不同,对它的品质要求也不相同[1]。其中最重要的便是小麦的加工品质,它主要与小麦面粉加工的面团的弹性和延展性等物理特征相关[2]。影响小麦加工品质的主要因素是小麦胚乳中的储藏蛋白。储藏蛋白主要由醇溶蛋白、谷蛋白和 Avenin-like蛋白组成。醇溶蛋白是决定小麦面团延展性的重要因素[3],它是通过氢键、分子内二硫键以及疏水性形成的单链蛋白,且无半胱氨酸残基,可分为α、β、γ、ω 4种类型[4]。谷蛋白是通过分子间二硫键结合形成的高分子量线性聚合物,主要影响小麦面团的粘弹性[3-4]。Avenin-like蛋白是2006年在小麦胚乳中发现的一种新型储藏蛋白,对小麦面粉的弹性有重要影响[5],可以提高小麦面粉的加工品质。根据结构的不同,Avenin-like蛋白可分为 a型和 b 型,a 型蛋白比 b 型蛋白少1个含120个氨基酸的重复序列[5]。b 型蛋白编码284个氨基酸,其中包含18或19个半胱氨酸残基,在 N 端和 C 端重复区有很高的保守性[5]。
微量掺粉试验是通过体外表达并纯化得到目的蛋白,利用化学试剂将目的蛋白整合至基础面粉,最终测定该混合面粉的品质参数来评价其对小麦品质贡献。该方法常用于小麦谷蛋白亚基作用的评价中[6-8],同样也适用于Avenin-like蛋白的品质评价,魏慧等[9]将国内主栽小麦品种中的Avenin-like蛋白通过体外原核表达、纯化后,进行微量掺粉试验,证实该蛋白能有效提高面粉的加工品质;同时发现Avenin-like基因较为保守,在供试的国内小麦主栽品种中呈现很低的多态性。
节节麦(Aegilops tauschii Cosson,DD,2n=2x=14)是普通小麦野生近缘物种,是普通小麦 D 染色体组的二倍体供体物种[10]。它丰富的遗传多样性可通过远缘杂交导入到普通小麦中,从而改良普通小麦品种。中国科学院西北高原生物研究所麦类作物分子育种学科组前期从108份节节麦中鉴定了13个Avenin-like b基因新的变异类型,从分子层面解析了它们的核苷酸和氨基酸变异情况[11]。但是这些新变异类型对面粉加工品质的影响还不得而知。
本研究通过大肠杆菌的体外诱导表达并抽提表达蛋白进行微量掺粉试验,评价这些源自节节麦的新型 Avenin-like b蛋白对面粉加工品质的影响。旨在鉴定优异等位变异类型,为挑选能用于小麦优质育种的节节麦亲本提供科学依据。
1 材料和方法
1.1 试验材料
本学科组前期鉴定的13个源自节节麦的Avenin-like b基因(TaALPb7D-A、TaALPb7D-B、TaALPb7D-C、TaALPb7D-D、TaALPb7D-E、TaALPb7D-F、TaALPb7D-G、TaALPb7D-H、TaALPb7D-I、TaALPb7D-J、TaALPb7D-K、TaALPb7D-L、TaALPb7D-M)[11](表1)和已成功构建的重组表达载体质粒 pET32a-Avenin-like b。
表1 13个Avenin-like b 基因及其对应NCBI登录号
Tab.1 13 Avenin-like b genes
and their NCBI accession numbers
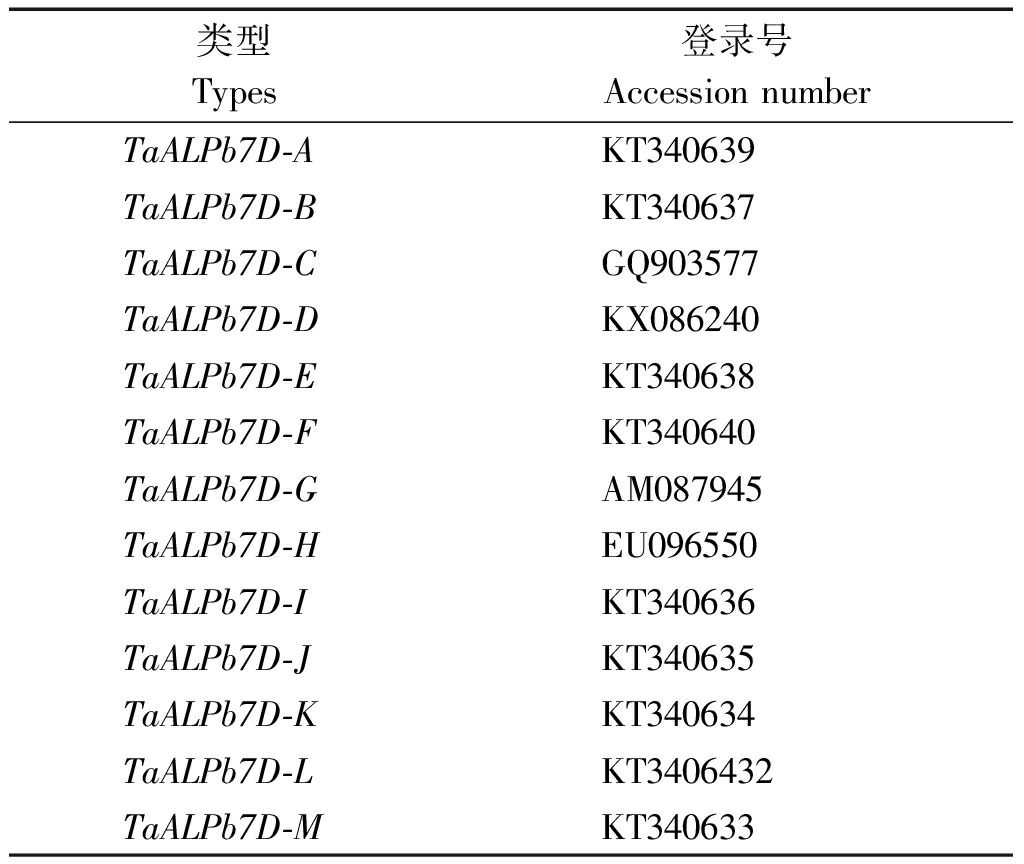
类型Types登录号Accession numberTaALPb7D-AKT340639TaALPb7D-BKT340637TaALPb7D-CGQ903577TaALPb7D-DKX086240TaALPb7D-EKT340638TaALPb7D-FKT340640TaALPb7D-GAM087945TaALPb7D-HEU096550TaALPb7D-IKT340636TaALPb7D-JKT340635TaALPb7D-KKT340634TaALPb7D-LKT3406432TaALPb7D-MKT340633
1.2 试验方法
1.2.1 重组蛋白的蛋白诱导表达和包涵体蛋白纯化 将pET32a-Avenin-like b质粒转化大肠杆菌BL21,挑选阳性单菌落至 3 mL LB 液体培养基(卡那霉素)中,37 ℃ 培养过夜。取菌液 100 μL 接种于 100 mL LB 液体培养基(卡那霉素)中振荡培养过夜,取 100 mL 菌液接种于 2 000 mL LB 液体培养基中,37 ℃ 扩大培养至OD600 约 0.6,降低培养温度到 30 ℃。加入 IPTG 诱导剂至终浓度0.5 mmol/L,30 ℃ 继续振荡培养 3~4 h,8 000 r/min离心3 min收集菌体,重悬于50 mL预冷NTA-0缓冲液中,冰浴30 min。超声破碎菌体,参数设置为功率200 W、工作3 s、暂停4 s、时间25~30 min,16 000 r/min 4 ℃离心50 min,收集上清以及沉淀。取少量上清及沉淀进行SDS-PAGE检测,剩余上清及沉淀置于4 ℃保存备用。使用纯化试剂盒进行包涵体蛋白纯化。
1.2.2 包涵体蛋白复性和复性蛋白纯化 以2倍体积的 3 mol/L盐酸胍稀释蛋白溶液,在 4 ℃ 环境下以注射器逐滴加入 200 mL 复性液(pH值8.0)中,转速调节至最大,搅拌 24 h,降低转速,搅拌24 h。取蛋白溶液于透析袋中,用PEG 20000 浓缩体积至50~100 mL。4 ℃ 在 PBS 缓冲液透析过夜,取蛋白溶液,以 PEG 20000 浓缩体积至 2~4 mL,4 ℃ 以 PBS 缓冲液透析过夜。取蛋白溶液进行 SDS-PAGE 检测。使用纯化试剂盒进行复性蛋白纯化。
1.2.3 重组蛋白的品质评价 用 10 g 微量粉质仪对重组蛋白的品质进行评价。选用青海省主栽小麦品种高原448(GY448)的面粉为基础面粉,进行掺粉试验,具体方法参考魏慧等[9]。
1.2.4 数据分析 采用Excel绘制图表,用SPSS 19.0对数据进行显著性检验。不同处理间的比较采用Duncan′s新复极差法(P<0.01)。
2 结果与分析
2.1 重组蛋白的诱导表达和纯化
将重组表达载体pET32a-Avenin-like b转化至BL21大肠杆菌中,经过 IPTG 诱导表达,最终在离心沉淀物的包涵体蛋白中获得Avenin-like b 蛋白(图1),13个基因的蛋白表达产物分别命名TaALPb7D-A~M。His SUMO tag 为 16 ku,Avenin-like b基因编码蛋白分子量约为 32 ku,因此,重组蛋白质分子量约 48 ku。经 SDS-PAGE 检测,重组蛋白分子量大小符合预期,Avenin-like b 蛋白成功诱导表达。
纯化后的包涵体蛋白经过滴定法复性后进行 SDS-PAGE 检测,结果显示只有一条带,融合蛋白的大小正常、纯度较高,可进行后续复性蛋白纯化(图1-B)。大量表达获得的重组蛋白包涵体经复性及 Ni-NTA 纯化技术获得重组蛋白 125 mg,纯度达 85%。
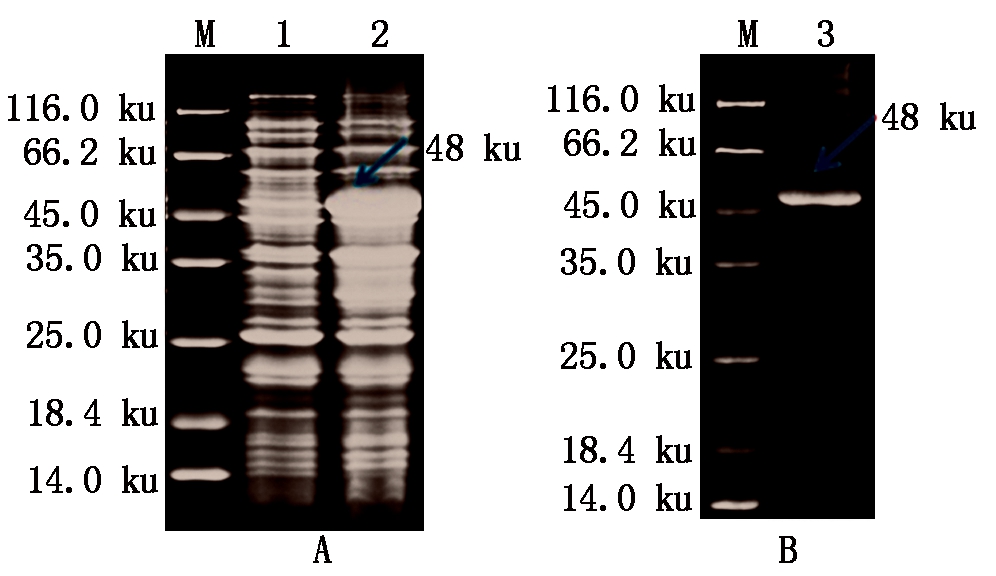
A. 诱导表达破碎后的菌液蛋白质电泳;B.纯化后Avenin-like b蛋白质电泳;M.蛋白分子量标准;1.上清液;2.诱导表达破碎后的沉淀;3.纯化后目的蛋白;箭头.所指为重组蛋白。
A.Induction the expression of broken bacterial fluid protein;B.Purified Avenin-like b protein;M.Protein molecular weight standard;1.Supernatant protein;2.The induced expression of precipitate after crushing;3.Purified target protein;The arrow is the recombinant protein.
图1 诱导表达的Avenin-like b 蛋白SDS-PAGE 电泳检测
Fig.1 SDS-PAGE analysis of induced Avenin-like b protein
2.2 重组蛋白的品质评价
由表2可知,在TaALPb7D-A~M 13个表达产物中,只有DTT+ KIO3处理下粉质的形成时间降低7 s,减少5.98%,而稳定时间增加8.11%, 断裂时间增加3.23%。其他各处理下粉质的形成时间均极显著提高,提高了12.82%~38.46%。其中TaALPb7D-F处理下粉质的形成时间达到162 s,较GY448提高38.46%,且较各处理差异均极显著(P<0.01)。
表2 节节麦中纯化 Avenin-like b 蛋白粉质参数
Tab.2 Effect of purified Avenin-like b protein on the farinograph parameters
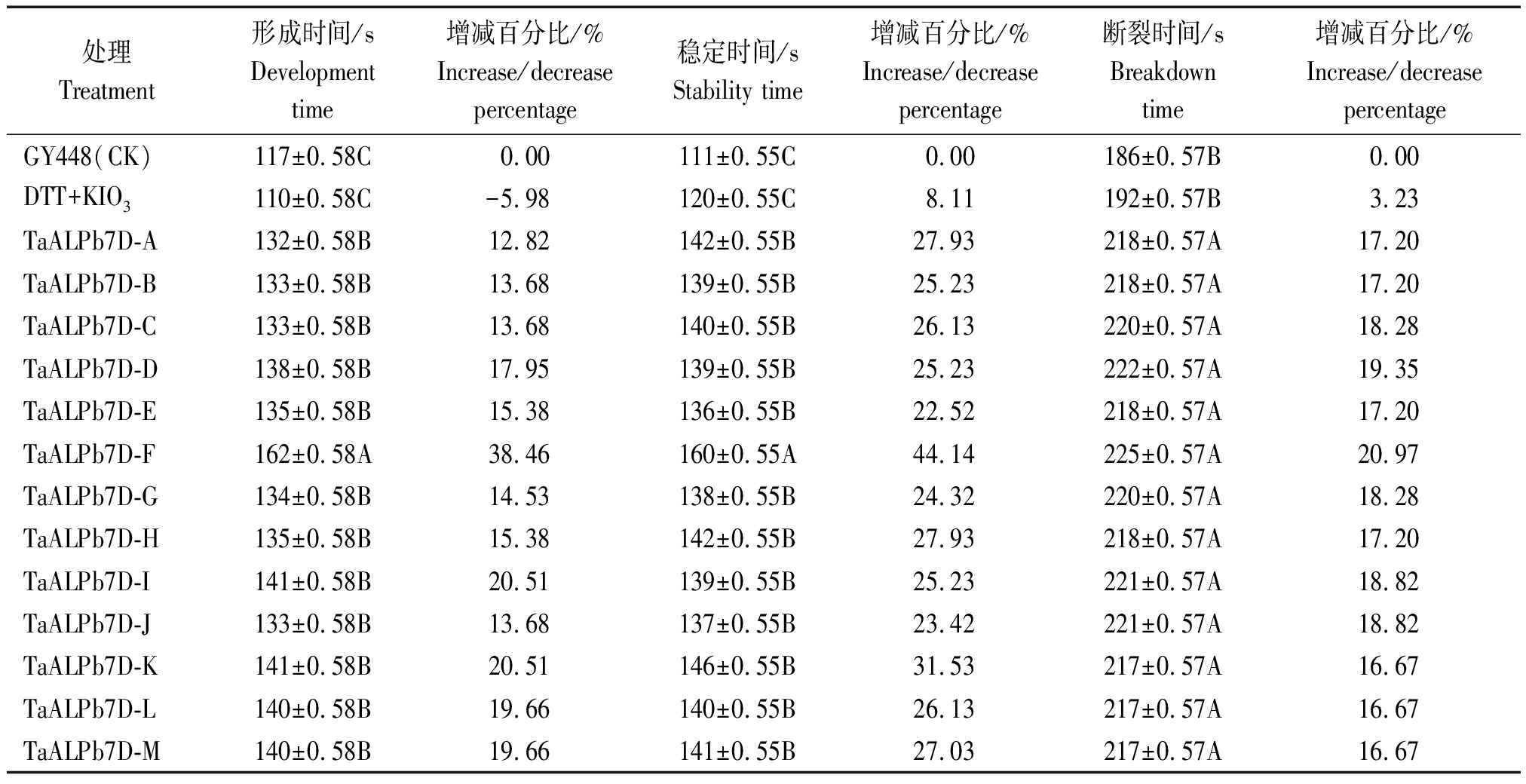
处理Treatment形成时间/sDevelopment time增减百分比/%Increase/decrease percentage稳定时间/sStability time增减百分比/%Increase/decrease percentage断裂时间/sBreakdown time增减百分比/%Increase/decrease percentageGY448(CK)117±0.58C0.00111±0.55C0.00186±0.57B0.00DTT+KIO3110±0.58C-5.98120±0.55C8.11192±0.57B3.23TaALPb7D-A132±0.58B12.82142±0.55B27.93218±0.57A17.20TaALPb7D-B133±0.58B13.68139±0.55B25.23218±0.57A17.20TaALPb7D-C133±0.58B13.68140±0.55B26.13220±0.57A18.28TaALPb7D-D138±0.58B17.95139±0.55B25.23222±0.57A19.35TaALPb7D-E135±0.58B15.38136±0.55B22.52218±0.57A17.20TaALPb7D-F162±0.58A38.46160±0.55A44.14225±0.57A20.97TaALPb7D-G134±0.58B14.53138±0.55B24.32220±0.57A18.28TaALPb7D-H135±0.58B15.38142±0.55B27.93218±0.57A17.20TaALPb7D-I141±0.58B20.51139±0.55B25.23221±0.57A18.82TaALPb7D-J133±0.58B13.68137±0.55B23.42221±0.57A18.82TaALPb7D-K141±0.58B20.51146±0.55B31.53217±0.57A16.67TaALPb7D-L140±0.58B19.66140±0.55B26.13217±0.57A16.67TaALPb7D-M140±0.58B19.66141±0.55B27.03217±0.57A16.67
注:不同大写字母代表0.01水平的差异显著;GY448.高原448;DTT+ KIO3.氧化还原剂。
Note:The capital letters represent the significant difference at 0.01;GY448.Gaoyuan 448;DTT+ KIO3.Redox agent.
不同处理下粉质参数的稳定时间变化为111~160 s,较GY448各处理下蛋白质粉质的稳定时间均提高,提高了22.52%~44.14%。其中DTT+ KIO3处理下粉质的稳定时间提高9 s,较GY448差异不显著(P<0.01);其他各处理较GY448稳定时间均极显著提高,其中TaALPb7D-F处理下粉质参数稳定时间为160 s,与GY448相比,稳定时间提高44.14%,二者差异极显著(P<0.01)。
与GY448相比,各处理下粉质断裂时间较稳定时间、形成时间显著提高,提高了16.67%~20.97%。其为186~225 s,各处理下粉质的断裂时间均增加,与GY448相比,DTT+ KIO3处理下粉质断裂时间差异不显著,加入TaALPb7D-A~M处理下差异均极显著(P<0.01)。TaALPb7D-F处理下粉质断裂时间最长为225 s,且较GY448,断裂时间极显著提高20.97%(P<0.01)。
由表3可知,各处理下粉质的稳定时间变异系数最高为8.30%,稳定时间次之为7.72%,断裂时间变异系数最低为5.00%,说明在不同添粉处理下形成时间和稳定时间离散度较大;而断裂时间离散度相对较小,性状相对稳定。即相较于对面团断裂时间影响的差异,不同类型的节节麦Avenin-like b蛋白对面团的形成时间和稳定时间影响的差异会更大一些。
表3 不同处理下各参数变异情况分析
Tab.3 Analysis of the variation of various parameters under different treatments
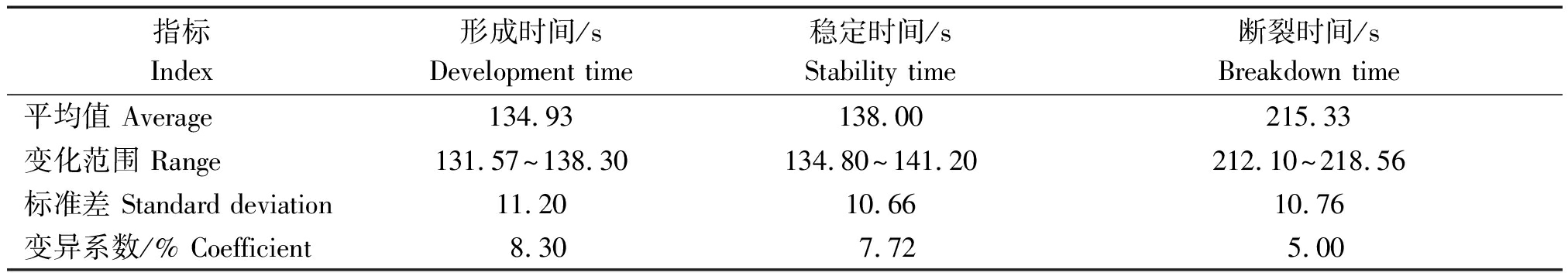
指标Index形成时间/sDevelopment time稳定时间/sStability time断裂时间/sBreakdown time平均值 Average134.93138.00215.33变化范围 Range131.57~138.30134.80~141.20212.10~218.56标准差 Standard deviation11.2010.6610.76变异系数/% Coefficient8.307.725.00
3 讨论与结论
品质基因不同变异类型的功能评价,经典的方法有基因工程法(转基因)和多代回交构建近等基因系法。但是这2种方法在小麦中应用都比较困难,一是因为普通小麦的转基因效率比较低,二是由于相比其他模式植物(如拟南芥),普通小麦生长周期较长(较短时间内获得近等基因系困难)。而且,常规的小麦面粉品质评价,需要足够多的小麦种子来提供大量的面粉。而对于源自节节麦的 Avenin-like b 基因新变异类型的品质评价,若选用上述常规方法,无疑难度还会进一步增加(涉及远缘杂交、繁殖效率等困难)。而像本研究采用体外蛋白质微量掺粉试验[9-12],可在筛选到 Avenin-like b 基因新变异类型之后,立刻对其进行体外原核表达,获得微量蛋白即可初步检测其品质特性,实现 Avenin-like b 基因新变异类型的高通量品质评价,为优良变异类型的高效育种利用赢得时间。
类燕麦贮藏蛋白(Avenin-like)最大特点是它们都含有较多的半胱氨酸残基(Cys),已报道的 Avenin-like b 普遍含有 18 个半胱氨酸 [13-15],较之前报道的小麦和燕麦贮藏蛋白都要多(麦醇溶蛋白和麦谷蛋白各自均含有不超过10个半胱氨酸残基)。半胱氨酸残基(Cys)是构成蛋白质分子内和分子间二硫键的结构基础,二硫键在小麦贮藏蛋白结构连接中占有重要地位。高分子量麦谷蛋白中半胱氨酸残基的数量和所处的位置直接影响着面粉的烘烤品质,含有优质亚基 1Dx5 的面粉之所以比含有普通1Dx2亚基的面粉烘烤品质优良,就是因为在 1Dx5 亚基的中央重复区前部比 1Dx2 亚基多了一个半胱氨酸残基[16-19]。魏慧等[9]在基础粉中加入 Avenin-like 蛋白表达纯化物后,小麦面粉的形成时间显著提高了38.46%,面团弹性显著提升,其稳定时间和断裂时间也得到显著提升。Ma等[20]通过对Avenin-like蛋白转基因株系品质测定也得出同样的结论。本研究结果显示,这13个源自节节麦的 Avenin-like b 蛋白均极显著提高小麦面粉的形成时间、稳定时间和断裂时间,这与前人研究结果一致[9-12]。或许正是由于 Avenin-like b 蛋白中这些多达18个的半胱氨酸残基帮助了面粉加工品质的提升。
综上所述,与小麦基础面粉相比节节麦中的Avenin-like b 蛋白能极显著提高普通小麦面粉的加工品质。
[1] 李金峰,刘骏,张金霞,简俊涛,李林峰,李天富. 小麦品质影响因素及改良途径分析[J].农业科技通讯,2018(6):214-216. doi:10.3969/j.issn.1000-6400.2018.06.070.
Li J F,Liu J,Zhang J X,Jian J T,Li L F,Li T F. Analysis of influencing factors and improvement methods of wheat quality[J].Bulletin of Agricultural Science and Technology,2018(6):214-216.
[2] 刘建军,何中虎,Pena R J,赵振东. 1BL/1RS易位对小麦加工品质的影响[J].作物学报,2004,30(2):149-153. doi:10.3321/j.issn:0496-3490.2004.02.011.
Liu J J,He Z H,Pena R J,Zhao Z D. Effect of 1BL/1RS translocation on grain quality and noodle quality in bread wheat[J].Acta Agronomica Sinica,2004,30(2):149-153.
[3] Chen F G,Xu C H,Chen M Z,Wang Y H,Xia G M. A new α-gliadin gene family for wheat breeding:Somatic introgression line 11-12 derived from Triticum aestivum and Agropyron elongatum[J].Molecular Breeding,2008,22(4):675-685.doi:10.1007/s11032-008-9208-0.
[4] Shewry P R,Halford N G,Tatham A S,Popineau Y,Lafiandra D,Belton P S. The high molecular weight subunits of wheat glutenin and their role in determining wheat processing properties[J].Advances in Food and Nutrition Research,2003,45:219-302. doi:10.1016/s1043-4526(03)45006-7.
[5] Kan Y C,Wan Y F,Beaudoin F,Leader D J,Edwards K,Poole R,Wang D W,Mitchell R A C,Shewry P R. Transcriptome analysis reveals differentially expressed storage protein transcripts in seeds of Aegilops and wheat[J].Journal of Cereal Science,2006,44(1):75-85.doi:10. 1016/j. jcs. 2006. 04. 004.
[6] Ferrante P,Cristina G M,Larroque O,Volpi C,D′Ovidio R,Lafiandra D,Masci S. Effect of incorporation of an i-type low-molecular-weight glutenin subunit and a modified γ-gliadin in durum and in bread wheat doughs as measured by micro-mixographic analyses[J].Journal of Cereal Science,2006,44(2):194-202.doi:10.1016/j.jcs.2006.06.004.
[7] 王延鹏. 簇毛麦低分子量谷蛋白基因克隆、染色体定位及体外功能鉴定[D].杨凌:西北农林科技大学,2011:14-28.
Wang Y P. Cloning,chromosomal location and in vitro functional analysis of three novel LMW-GS from Dasypyrum villosum[D].Yangling:Northwest A&F University,2011:14-28.
[8] 杨华,高翔,陈其皎,赵万春,董剑,李晓燕. 簇毛麦新型HMW-GS的序列分析及加工品质效应鉴定[J].作物学报,2014,40(4):600-610. doi:10.3724/SP.J.1006.2014.00600.
Yang H,Gao X,Chen Q J,Zhao W C,Dong J,Li X Y. Isolation,characterization and farinograph analysis of novel HMW-GSs from Dasypyrum villosum[J].Acta Agronomica Sinica,2014,40(4):600-610.
[9] 魏慧,董剑,陈其皎,高翔,王蕾,李晓燕,赵万春,吴丹. 小麦avenin-like的克隆、原核表达与品质效应研究[J].中国农业科学,2012,45(4):607-616. doi:10.3864/j.issn.0578-1752.2012.04.001.
Wei H,Dong J,Chen Q J,Gao X,Wang L,Li X Y,Zhao W C,Wu D. Cloning,prokaryotic expression and quality effective analysis of avenin-like genes from wheat cultivars[J].Scientia Agricultura Sinica,2012,45(4):607-616.
[10] Wang S L,Li X H,Wang K,Wang X Z,Li S S,Zhang Y Z,Guo G F,Zeller F J,Hsam S L K,Yan Y M. Phylogenetic analysis of C,M,N,and U genomes and their relationships with Triticum and other related genomes as revealed by LMW-GS genes at Glu-3 loci[J].Genome,2011,54(4):273-284. doi:10.1139/g10-119.
[11] Cao D,Wang H X,Zhang B,Liu B L,Liu D C,Chen W J,Zhang H G. Genetic diversity of avenin-like b genes in Aegilops tauschii Coss[J].Genetica,2018,146(1):45-51. doi:10.1007/s10709-017-9995-5.
[12] Chen P,Li R,Zhou R,He G,Shewry P. Heterologous expression and dough mixing studies of a novel cysteine-rich avenin-like protein[J].Cereal Research Communications,2010,38(3):406-418.doi:10.1556/CRC.38.2010.3.11.
[13] Vensel W H,Tanaka C K,Cai N,Wong J H,Buchanan B B,Hurkman W J. Developmental changes in the metabolic protein profiles of wheat endosperm[J].Proteomics,2005,5(6):1594-1611. doi:10.1002/pmic.200401034.
[14] Chen X Y,Cao X Y,Zhang Y J,Islam S,Zhang J J,Yang R C,Liu J J,Li G Y,Appels R,Keeble-Gagnere G,Ji W Q,He Z H,Ma W J. Genetic characterization of cysteine-rich type-b avenin-like protein coding genes in common wheat[J].Scientific Reports,2016,6:30692. doi:10.1038/srep30692.
[15] Shewry P R,Tatham A S. The prolamin storage proteins of cereal seeds:Structure and evolution[J].The Biochemical Journal,1990,267(1):1-12. doi:10.1042/bj2670001.
[16] Payne P I. Genetics of wheat storage proteins and the effect of allelic variation on bread-making quality[J].Annual Review of Plant Physiology,1987,38:141-153.doi:10.1146/ANNUREV.PP.38.060187.001041.
[17] Shewry P R,Halford N G,Tatham A S. High molecular weight subunits of wheat glutenin[J].Journal of Cereal Science,1992,15(2):105-120.doi:10.1016/s0733-5210(09)80062-3.
[18] Gupta R B,MacRitchie F. Allelic variation at glutenin subunit and gliadin loci,Glu-1,Glu-3 and Gli-1 of common wheats. Ⅱ. biochemical basis of the allelic effects on dough properties[J].Journal of Cereal Science,1994,19(1):19-29.doi:10.1016/j.fm.2006.07.004.
[19] Wieser H. Chemistry of gluten proteins[J].Food Microbiology,2007,24(2):115-119.doi:10.1016/j.fm.2006.07.004.
[20] Ma F Y,Li M,Li T T,Liu W,Liu Y Y,Li Y,Hu W,Zheng Q,Wang Y Q,Li K X,Chang J L,Chen M J,Yang G X,Wang Y S,He G Y. Overexpression of avenin-like b proteins in bread wheat(Triticum aestivum L.)improves dough mixing properties by their incorporation into glutenin polymers[J].PLoS One,2013,8(7):e66758. doi:10.1371/journal.pone.0066758.