小麦产量是穗数、穗粒数以及千粒质量三因素协调优化的结果,其中千粒质量的遗传力较大,较为稳定[1],增加千粒质量是小麦产量育种的主要目标之一。研究表明,粒质量是数量性状,受主效和微效多基因控制[2-3]。随着分子生物学和比较基因组学的发展,在水稻和小麦的粒质量形成分子机制方面取得了一些重要研究进展,许多粒质量相关数量性状位点被鉴定出来,一些粒质量基因被成功克隆,并开发了相关功能分子标记[4-5]。这些研究成果为分子标记辅助选择技术在小麦育种中的应用奠定了基础。
籽粒大小是粒质量形成的重要影响因素[6]。Su等[7]根据水稻粒宽基因OsGW2信息,在普通小麦中同源克隆得到TaGW2基因,该基因编码具有E3泛素连接酶功能的蛋白质,位于小麦第6同源染色体上并靠近着丝粒,在TaGW2-6A启动子区检测到的2个SNP,形成2种单倍型Hap-6A-A(-593A和-739G)和Hap-6A-G(-593G和-769A),以-593位A/G多态性为基础,设计了酶切扩增多态性序列(CAPS)标记以区分2个单倍型。对265个中国小麦品种进行基因型和关联分析发现,单倍型Hap-6A-A与小麦粒宽、千粒质量显著相关,能够使小麦千粒质量增加3 g以上,并且抽穗早、成熟早。利用不同研究群体对小麦粒宽和千粒质量相关QTL的定位结果也显示,在小麦染色体6AS的TaGW2-6A位点附近检测到了影响小麦粒宽和千粒质量的QTL[8-11],这些研究为 TaGW2-6A对粒质量和千粒质量的调控功能提供了更多证据。
细胞壁转化酶(CWI)是库器官发育和碳分配的关键酶,与籽粒质量密切相关[12-15]。Ma等[16]在小麦2AL染色体上克隆得到细胞壁转化酶基因(TaCwi-A1),发现该基因有2种单倍型TaCwi-A1a和TaCwi-A1b,其中单倍型TaCwi-A1a与高千粒质量有关,单倍型TaCwi-A1b与低千粒质量有关。谷氨酰胺合成酶(GS)在谷类作物的生长、氮利用和产量潜力中起着关键作用[17-18]。Li等[19]从普通小麦中国春和小偃54的2A、2B和2D染色体上克隆了谷氨酰胺合成酶基因(TaGS2),对2D染色体上TaGS2-D1基因的编码区序列分析发现,有2种单倍型TaGS2-D1a和TaGS2-D1b,关联分析发现,TaGS2-D1a能够提高小麦的产量和氮素利用效率。小麦蔗糖合成酶基因TaSus-2B参与小麦淀粉合成及胚乳形成,并最终影响籽粒质量[20]。Jiang等[21]从小麦2B染色体上克隆到TaSus2-2B基因,其有2种单倍型TaSus2-2Ba和TaSus2-2Bb,关联分析表明TaSus2-2Ba能够显著增加小麦千粒质量。
当前对作物产量相关基因的发掘研究进展较快,而利用价值评估方面,尤其是多个粒质量相关基因的综合效应分析研究报道较少[4]。为此,本研究对48份国外引进小麦种质进行了千粒质量表型鉴定,并利用4个粒质量相关功能分子标记TaCwi-A1、TaGW2-6A、TaGS2-D1、TaSus2-2B进行粒质量基因单倍型类型和分布检测,以评价粒质量基因功能分子标记的有效性及4个粒质量基因不同单倍型组合的综合遗传效应,筛选具有较好粒质量性状遗传改良潜力的小麦种质,为粒质量基因功能分子标记和外引种质在国内小麦育种中的利用提供一些科学依据。
1 材料和方法
1.1 试验材料
参试材料包括48份国外小麦种质,分别引自智利、日本、墨西哥、法国等10多个国家,其中Kanto107、Manital、Opata、Pastor、Norin61、Salmone、Glenlea、RL6077、Madsen、Attila、Pavon共11份材料,由山东省农业科学院作物研究所资源库提供,其他材料由河南科技学院小麦中心保存和提供。
1.2 粒质量相关性状测定
小麦品种(系)于2019-2020年种植在河南科技学院朗公庙试验基地,随机区组设计,2个重复,行长4 m,行距25 cm,2行区,采用常规标准试验田管理方法,适时收获,脱粒。从每个品种(系)中数取500粒小麦种子,3次重复,分别称质量,并计算千粒质量平均值。
1.3 DNA提取和分子标记检测
在每个品种(系)中取3株小麦的叶片混合,采用Lagudah等[22]方法提取其基因组DNA,并用1%的琼脂糖凝胶进行电泳检测。将DNA原液稀释至100 ng/μL工作液浓度,置于4 ℃冰箱保存备用。
利用Su等[7]开发的CAPS标记(Hap-6A-P1和Hap-6A-P2)检测TaGW2-6A基因的单倍型;利用Ma等[16]开发的一对显性互补功能标记(CWI21和CWI22)检测TaCwi-A1基因的单倍型;利用Li等[19]等开发的功能分子标记检测TaGS2-D1基因的单倍型;利用Jiang等[21]开发的一对显性互补功能标记(Sus2-1和Sus2-2)检测TaSus2-2B基因的单倍型。以上分子标记引物均由生工生物工程(上海)股份有限公司合成,引物详细信息见表1。PCR反应体系为20 μL,内含2×Taq Master Mix(北京康为世纪生物有限公司)10 μL,上下游引物(10 μmol/L)各0.8 μL,模板DNA(100 ng/μL)1 μL,ddH2O 7.4 μL。PCR扩增反应程序:95 ℃ 预变性4 min;94 ℃变性30 s,55.0~61.5 ℃ 退火30 s,72 ℃延伸50 s,32~35个循环;72 ℃延伸5 min。TaGW2-6A(Hap-6A-P2)分子标记扩增产物在2%的琼脂糖凝胶上进行电泳检测,其余TaGW2-6A(Hap-6A-P1)、TaCwi-A1、TaGS2-D1、TaSus2-2B等分子标记扩增产物的电泳检测均使用1%的琼脂糖凝胶,电泳后在凝胶成像系统中扫描成像,拍照保存。
表1 分子标记的引物信息
Tab.1 Primer information of molecular markers
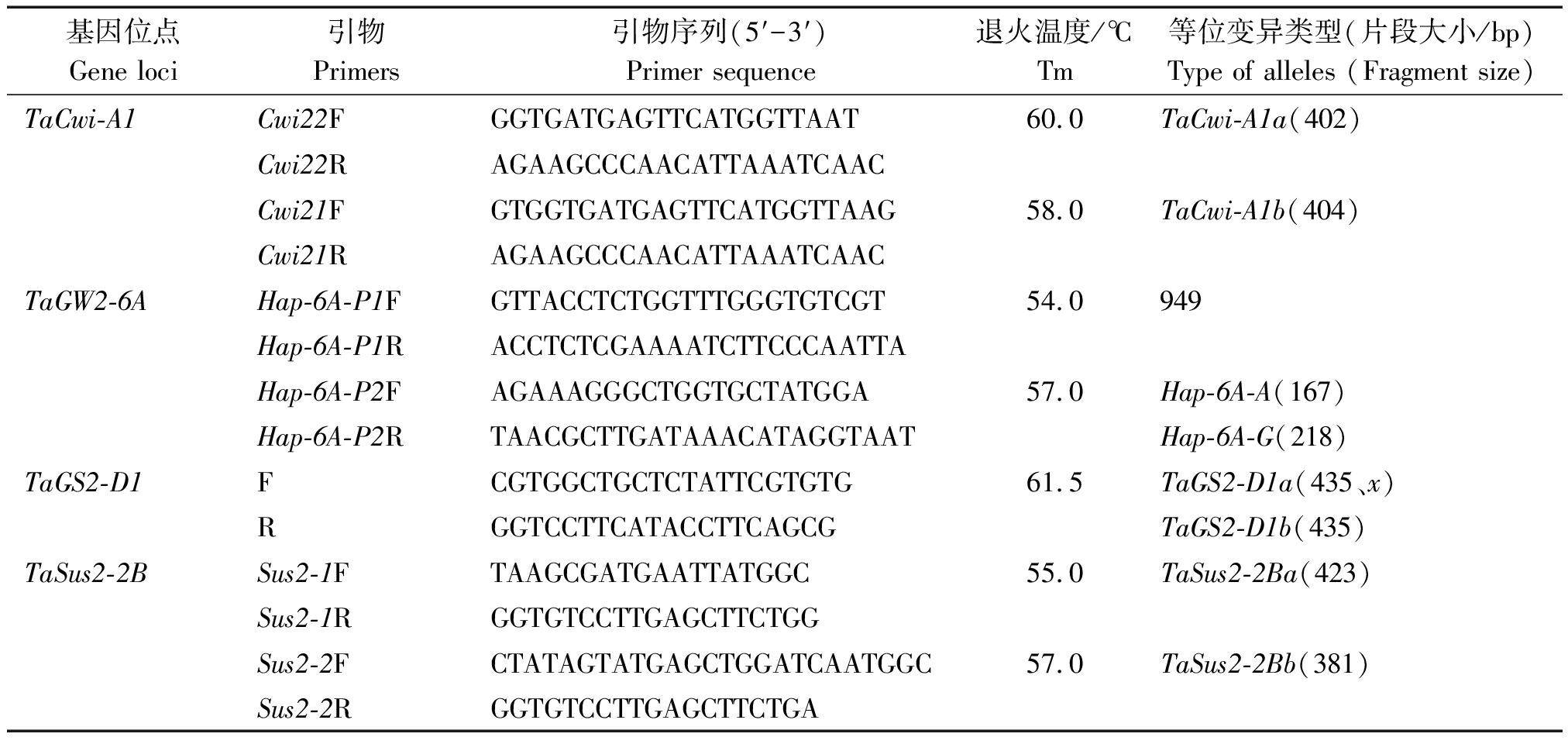
基因位点Gene loci引物Primers引物序列(5′-3′)Primer sequence退火温度/℃Tm等位变异类型(片段大小/bp)Type of alleles (Fragment size)TaCwi-A1Cwi22FGGTGATGAGTTCATGGTTAAT60.0TaCwi-A1a(402) Cwi22RAGAAGCCCAACATTAAATCAACCwi21FGTGGTGATGAGTTCATGGTTAAG58.0TaCwi-A1b(404) Cwi21RAGAAGCCCAACATTAAATCAACTaGW2-6AHap-6A-P1FGTTACCTCTGGTTTGGGTGTCGT54.0949 Hap-6A-P1RACCTCTCGAAAATCTTCCCAATTAHap-6A-P2FAGAAAGGGCTGGTGCTATGGA57.0Hap-6A-A(167)Hap-6A-P2RTAACGCTTGATAAACATAGGTAATHap-6A-G(218)TaGS2-D1FCGTGGCTGCTCTATTCGTGTG61.5TaGS2-D1a(435、x)RGGTCCTTCATACCTTCAGCGTaGS2-D1b(435)TaSus2-2BSus2-1FTAAGCGATGAATTATGGC55.0TaSus2-2Ba(423)Sus2-1RGGTGTCCTTGAGCTTCTGGSus2-2FCTATAGTATGAGCTGGATCAATGGC57.0TaSus2-2Bb(381)Sus2-2RGGTGTCCTTGAGCTTCTGA
1.4 统计分析
试验数据整理使用Excel 2016软件,不同粒质量基因及组合间千粒质量的差异显著性分析使用SPSS 25.0软件。
2 结果与分析
2.1 TaCwi-A1基因在供试小麦种质中的单倍型类型和分布
利用TaCwi-A1基因的一对显性互补功能标记(CWI21和CWI22)对48份小麦外引种质进行检测(图1),高千粒质量TaCwi-A1a单倍型的扩增条带为402 bp,低千粒质量TaCwi-A1b单倍型的扩增条带为404 bp,检测结果显示,1份小麦种质KPL-1未扩增出条带,37份小麦种质酶切得到402 bp特异性条带,占供试材料的77.1%,7份小麦种质酶切得到404 bp特异性条带,占供试材料的14.6%,3份小麦种质(Kanto107、Salmone和硬质博莱特)均扩增出402,404 bp 2个特异性条带,占供试材料的6.3%,为位点杂合型(表2)。
表2 48份外引种质中粒质量基因单倍型类型及千粒质量
Tab.2 Haplotypes of grain weight genes and thousand kernels weight of 48 introduced germplasms
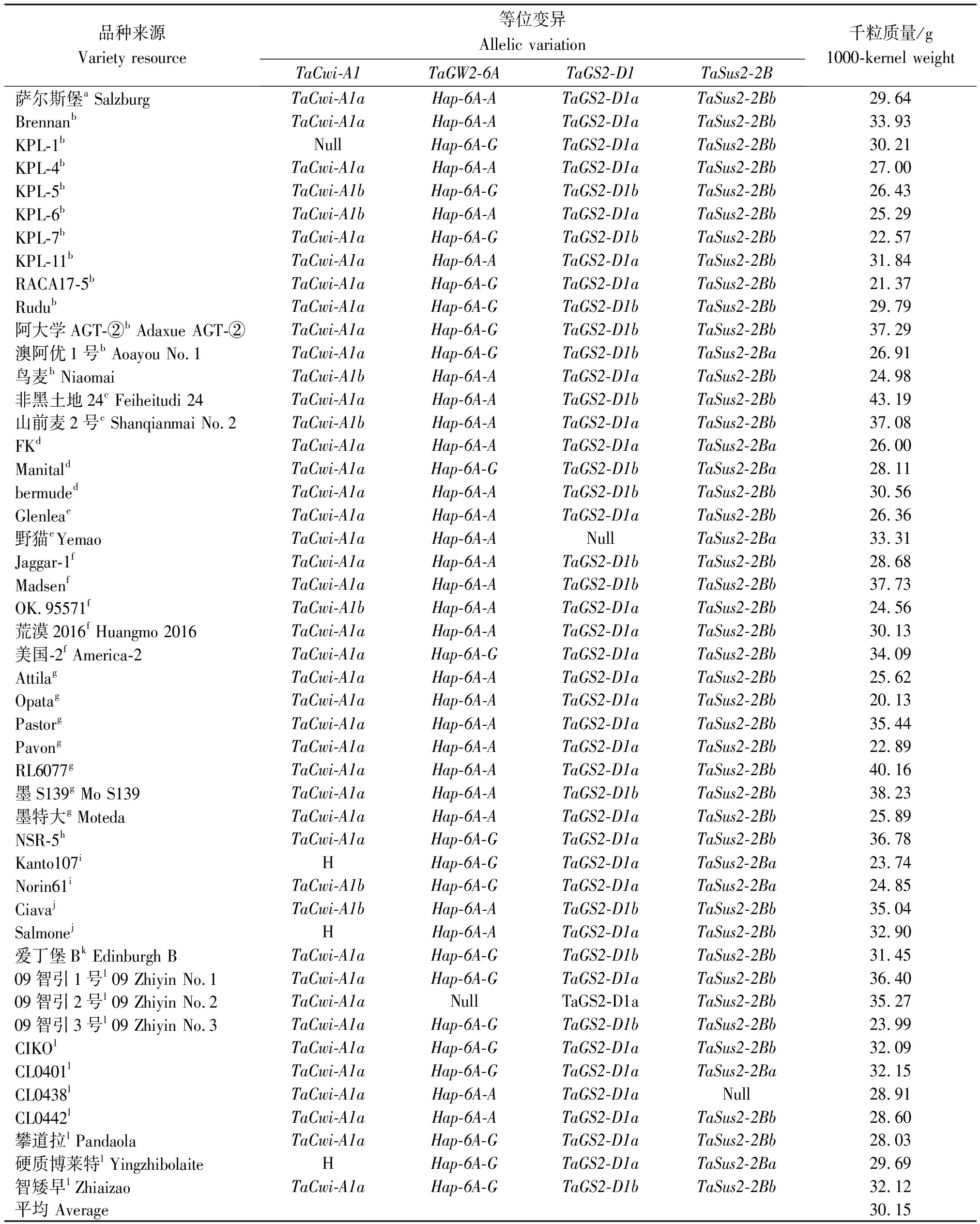
品种来源Variety resource等位变异Allelic variationTaCwi-A1TaGW2-6ATaGS2-D1TaSus2-2B千粒质量/g1000-kernel weight萨尔斯堡a SalzburgTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb29.64BrennanbTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb33.93KPL-1bNullHap-6A-GTaGS2-D1aTaSus2-2Bb30.21KPL-4bTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb27.00KPL-5bTaCwi-A1bHap-6A-GTaGS2-D1bTaSus2-2Bb26.43KPL-6bTaCwi-A1bHap-6A-ATaGS2-D1aTaSus2-2Bb25.29KPL-7bTaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb22.57KPL-11bTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb31.84RACA17-5bTaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb21.37RudubTaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb29.79阿大学AGT-②b Adaxue AGT-②TaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb37.29澳阿优1号b Aoayou No.1TaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Ba26.91鸟麦b NiaomaiTaCwi-A1bHap-6A-ATaGS2-D1aTaSus2-2Bb24.98非黑土地24c Feiheitudi 24TaCwi-A1aHap-6A-ATaGS2-D1bTaSus2-2Bb43.19山前麦2号c Shanqianmai No.2TaCwi-A1bHap-6A-ATaGS2-D1aTaSus2-2Bb37.08FKdTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Ba26.00ManitaldTaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Ba28.11bermudedTaCwi-A1aHap-6A-ATaGS2-D1bTaSus2-2Bb30.56GlenleaeTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb26.36野猫eYemaoTaCwi-A1aHap-6A-ANullTaSus2-2Ba33.31Jaggar-1fTaCwi-A1aHap-6A-ATaGS2-D1bTaSus2-2Bb28.68MadsenfTaCwi-A1aHap-6A-ATaGS2-D1bTaSus2-2Bb37.73OK.95571fTaCwi-A1bHap-6A-ATaGS2-D1aTaSus2-2Bb24.56荒漠2016f Huangmo 2016TaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb30.13美国-2f America-2TaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb34.09AttilagTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb25.62OpatagTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb20.13PastorgTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb35.44PavongTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb22.89RL6077gTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb40.16墨S139g Mo S139TaCwi-A1aHap-6A-ATaGS2-D1bTaSus2-2Bb38.23墨特大g MotedaTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb25.89NSR-5hTaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb36.78Kanto107iHHap-6A-GTaGS2-D1aTaSus2-2Ba23.74Norin61iTaCwi-A1bHap-6A-GTaGS2-D1aTaSus2-2Ba24.85CiavajTaCwi-A1bHap-6A-ATaGS2-D1bTaSus2-2Bb35.04SalmonejHHap-6A-ATaGS2-D1aTaSus2-2Bb32.90爱丁堡Bk Edinburgh BTaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb31.4509智引1号l 09 Zhiyin No.1TaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb36.4009智引2号l 09 Zhiyin No.2TaCwi-A1aNullTaGS2-D1aTaSus2-2Bb35.2709智引3号l 09 Zhiyin No.3TaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb23.99CIKOlTaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb32.09CL0401lTaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Ba32.15CL0438lTaCwi-A1aHap-6A-ATaGS2-D1aNull28.91CL0442lTaCwi-A1aHap-6A-ATaGS2-D1aTaSus2-2Bb28.60攀道拉l PandaolaTaCwi-A1aHap-6A-GTaGS2-D1aTaSus2-2Bb28.03硬质博莱特l YingzhibolaiteHHap-6A-GTaGS2-D1aTaSus2-2Ba29.69智矮早l ZhiaizaoTaCwi-A1aHap-6A-GTaGS2-D1bTaSus2-2Bb32.12平均 Average30.15
注:a.小麦材料来源于奥地利;b.小麦材料来源于澳大利亚;c.小麦材料来源于俄罗斯;d.小麦材料来源于法国;e.小麦材料来源于加拿大;f.小麦材料来源于美国;g.小麦材料来源于墨西哥;h.小麦材料来源于南斯拉夫;i.小麦材料来源于日本;j.小麦材料来源于意大利;k.小麦材料来源于英国;l.小麦材料来源于智利;H.杂合基因型;Null.未检测到目标条带。
Note:a.Wheat material is from Austria;b.Wheat material is from Australia;c.Wheat material is from Russia;d.Wheat material is from France;e.Wheat material is from Canada;f.Wheat material is from America;g.Wheat material is from Mexico;h.Wheat material is from Yugoslavia;i.Wheat material is from Japan;j.Wheat material is from Italy;k.Wheat material is from England;l.Wheat material is from Chile;H.Heterozygous genotype;Null.No target band is detected.
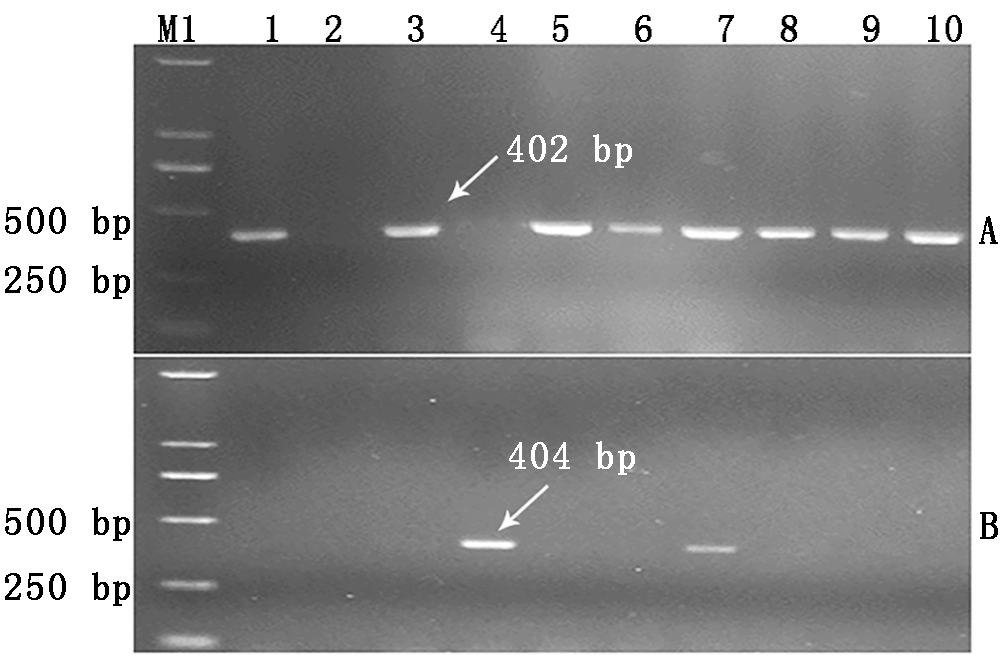
A.TaCwi-A1a单倍型的检测结果;B.TaCwi-A1b单倍型的检测结果。M1.DNA Marker DL2000;1.澳阿优1号;2.KPL-1;3.阿大学AGT-②;4.鸟麦;5.攀道拉;6.智矮早;7.硬质博莱特;8.CL0401;9.CL0438;10.CL0442。
A. Detection results of TaCwi-A1a haplotype;B.Detection results of TaCwi-A1b haplotype. M1.DNA Marker DL2000;1.Aoayou No.1;2.KPL-1;3.Adaxue AGT-②;4.Niaomai;5.Pandaola;6.Zhiaizao;7.Yingzhibolaite;8.CL0401;9.CL0438;10.CL0442.
图1 部分外引种质TaCwi-A1分子标记检测结果
Fig.1 Detection results of some introduced
germplasms by TaCwi-A1 marker
2.2 TaGW2-6A基因在供试小麦种质中的单倍型类型和分布
利用TaGW2-6A基因的CAPS分子标记(Hap-6A-P1和Hap-6A-P2)对48份外引小麦种质进行检
测(图2),首先用Hap-6A-P1引物扩增出949 bp条带,以之为模板,再用Hap-6A-P2引物进行扩增,扩增的产物经Taq Ⅰ限制性内切酶酶切,可切出167,218 bp条带,分别对应于高千粒质量、低千粒质量单倍型Hap-6A-A和Hap-6A-G。检测结果显示,1份小麦种质09智引2号未扩增出条带,27份小麦种质酶切出167 bp特异性条带,占供试材料的56.3%,20份小麦种质酶切得到218 bp特异性条带,占供试材料的41.7%(表2)。
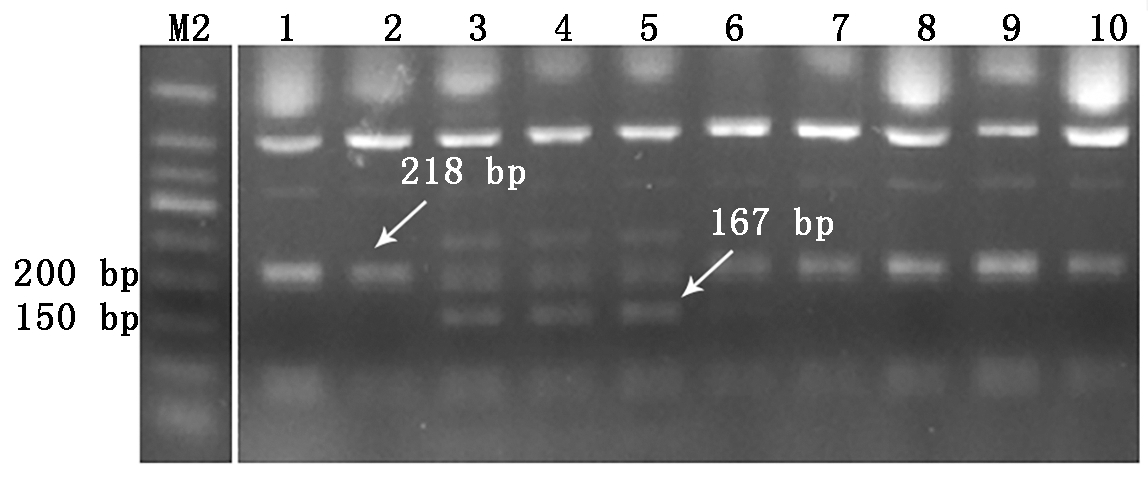
M2.50 bp DNA Ladder;1.CL0438;2.CL0442;3.09智引1号;
4.Kanto107;5.Manital;6.Opata;7.Glenlea;8.Madsen;9.Attila;10.Salmone。
M2. 50 bp DNA Ladder;1.CL0438;2.CL0442;3.09Zhiyin No.1;
4.Kanto107;5.Manital;6.Opata;7.Glenlea;8.Madsen;9.Attila;10.Salmone.
图2 部分外引种质TaGW2-6A分子标记检测结果
Fig.2 Detection results of some introduced
germplasms by TaGW2-6A marker
2.3 TaGS2-D1基因在供试小麦种质中的单倍型类型和分布
利用TaGS2-D1基因特异性引物对48份小麦种质进行检测(图3),结果显示,1份小麦种质野猫未扩增出条带,32份小麦种质,为高千粒质量TaGS2-D1a单倍型,占供试材料的66.7%,15份小麦种质,为低千粒质量TaGS2-D1b单倍型,占供试材料的31.3%(表2)。
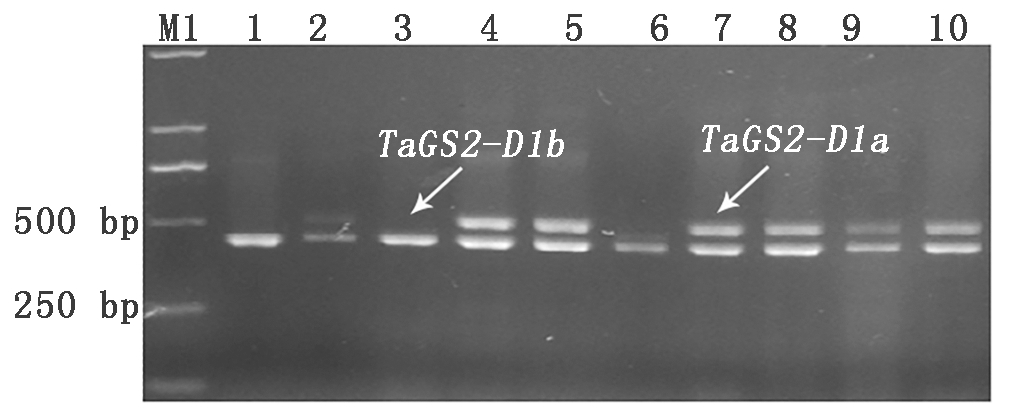
M1.DNA Marker DL2000;1.澳阿优1号;2.KPL-1;3.阿大学AGT-②;4.鸟麦;5.攀道拉;6.智矮早;7.硬质博莱特;8.CL0401;9.CL0438;10.CL0442。图4同。
M1.DNA Marker DL2000;1.Aoayou No.1;2.KPL-1;3.Adaxue AGT-②;4.Niaomai;5.Pandaola;6.Zhiaizao;7.Yingzhibolaite;8.CL0401;9.CL0438;10.CL0442.The same as Fig.4.
图3 部分外引种质TaGS2-D1分子标记检测结果
Fig.3 Detection results of some introduced
germplasms by TaGS2-D1 marker
2.4 TaSus2-2B基因在供试小麦种质中的单倍型类型和分布
利用TaSus2-2B基因的一对显性互补功能标记(Sus2-1和Sus2-2)对48份小麦种质进行检测(图4),Sus2-1引物扩增出423 bp条带,Sus2-2引物扩增出381 bp条带,分别对应于高千粒质量、低千粒质量单倍型。检测结果显示,1份小麦种质CL0438未扩增出特异性条带,8份小麦种质扩增出423 bp条带,占供试材料的16.7%,为高千粒质量TaSus2-2Ba单倍型,39份小麦种质扩增出381 bp条带,占供试材料的81.3%,为低千粒质量TaSus2-2Bb单倍型(表2)。
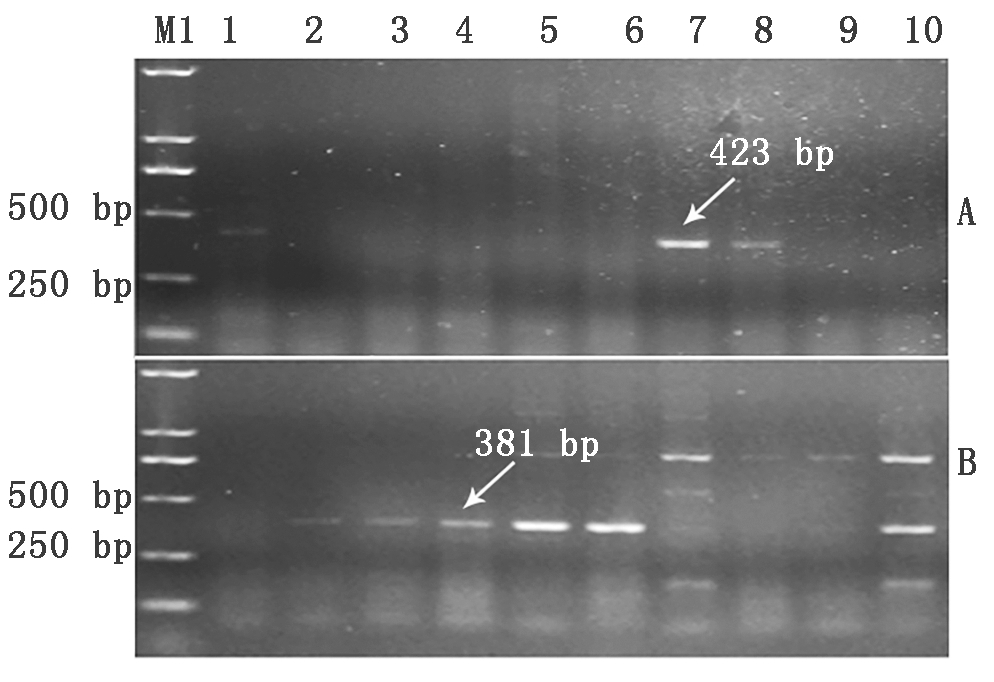
A.TaSus2-2Ba单倍型的检测结果;B.TaSus2-2Bb单倍型的检测结果。
A.Detection results of TaSus2-2Ba haplotype;
B.Detection results of TaSus2-2Bb haplotype.
图4 部分外引种质TaSus2-2B分子标记检测结果
Fig.4 Detection results of some introduced germplasms
by TaSus2-2B marker
2.5 基因单倍型及其组合对小麦千粒质量的影响
本研究中48份小麦外引种质材料的平均千粒质量为30.15 g,变异范围为20.13~43.19 g,超平均千粒质量种质材料占45.8%(表2)。各粒质量相关基因均包含2种单倍型,就单个基因2种单倍型的平均千粒质量比较来看(表3),TaCwi-A1基因高千粒质量单倍型TaCwi-A1a的平均千粒质量高于低千粒质量单倍型TaCwi-A1b,差异达到显著水平,且TaCwi-A1a在供试小麦种质材料中占比较高,为优势单倍型;TaGW2-6A基因的高千粒质量单倍型Hap-6A-A的平均千粒质量高于低千粒质量单倍型Hap-6A-G,差异达到显著水平,并且Hap-6A-A在供试小麦种质材料中的占比也高于Hap-6A-G,基本属于优势单倍型;TaGS2-D1基因的高千粒质量单倍型TaGS2-D1a在供试小麦种质材料中占比虽高于低千粒质量单倍型TaGS2-D1b,但是平均千粒质量却显著低于TaGS2-D1;TaSus2-2B基因的高千粒质量单倍型TaSus2-2Ba在供试小麦种质材料中占比不仅低于低千粒质量单倍型TaSus2-2Bb,其平均千粒质量也显著低于TaSus2-2Bb单倍型。
表3 不同单倍型对小麦种质千粒质量的影响
Tab.3 Effects of different haplotypes on the 1000-kernel weight of wheat germplasms
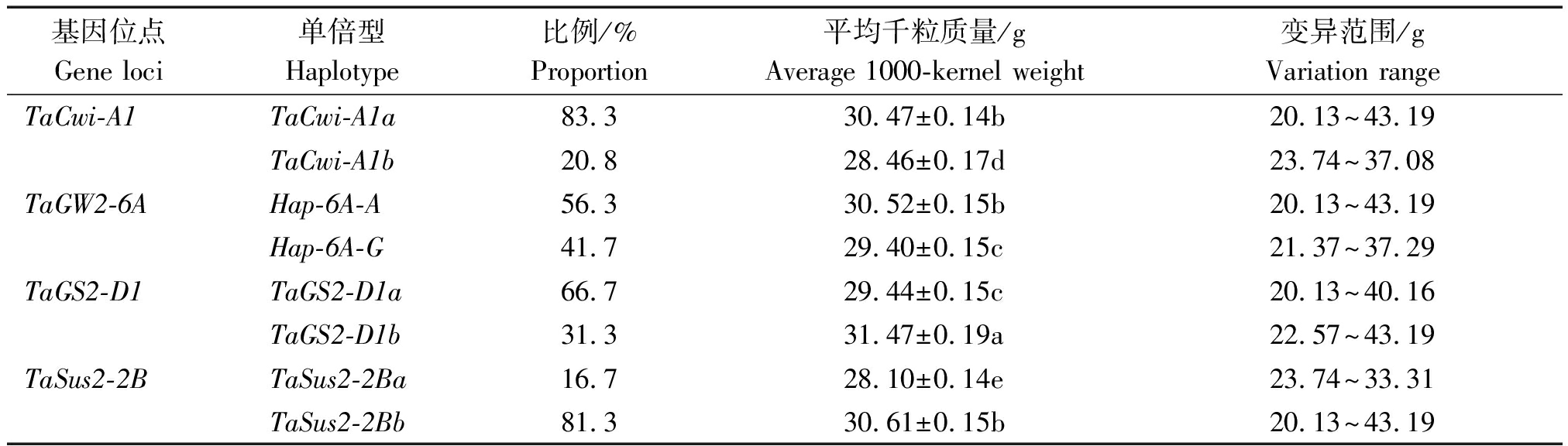
基因位点Gene loci单倍型Haplotype比例/%Proportion平均千粒质量/gAverage 1000-kernel weight变异范围/gVariation rangeTaCwi-A1TaCwi-A1a83.330.47±0.14b20.13~43.19TaCwi-A1b20.828.46±0.17d23.74~37.08TaGW2-6AHap-6A-A56.330.52±0.15b20.13~43.19Hap-6A-G41.729.40±0.15c21.37~37.29TaGS2-D1TaGS2-D1a66.729.44±0.15c20.13~40.16TaGS2-D1b31.331.47±0.19a22.57~43.19TaSus2-2BTaSus2-2Ba16.728.10±0.14e23.74~33.31TaSus2-2Bb81.330.61±0.15b20.13~43.19
注:不同小写字母表示平均千粒质量在0.05水平差异显著。表4同。
Note:Different lowercase letters indicate that the average thousand kernels weight has a significant difference at 0.05 level.The same as Tab.4.
4个千粒质量相关基因的单倍型组合中,以TaCwi-A1a/Hap-6A-A/TaGS2-D1a/TaSus2-2Bb在供试材料中占比最高,为33.3%,平均千粒质量为29.32 g,TaCwi-A1a/Hap-6A-G/TaGS2-D1b/TaSus2-2Ba在供试材料中占比最低,为4.2%,平均千粒质量为27.51 g(表4)。在单倍型组合中,TaCwi-A1a/Hap-6A-A/TaGS2-D1b/TaSus2-2Bb在供试材料中占比为10.4%,平均千粒质量最高,达到35.68 g,其次是TaCwi-A1a/Hap-6A-G/TaGS2-D1a/TaSus2-2Bb组合,在供试材料中占比为12.5%,平均千粒质量达到31.46 g。就总体趋势而言,含有相同单倍型组合的种质材料在供试材料中占比高的,其平均千粒质量也高,在供试材料中占比低的,其平均千粒质量也相对较低。
表4 部分单倍型组合对小麦种质千粒质量的影响
Tab.4 Effects of some haplotype combinations on the 1000-kernel weight of wheat germplasms
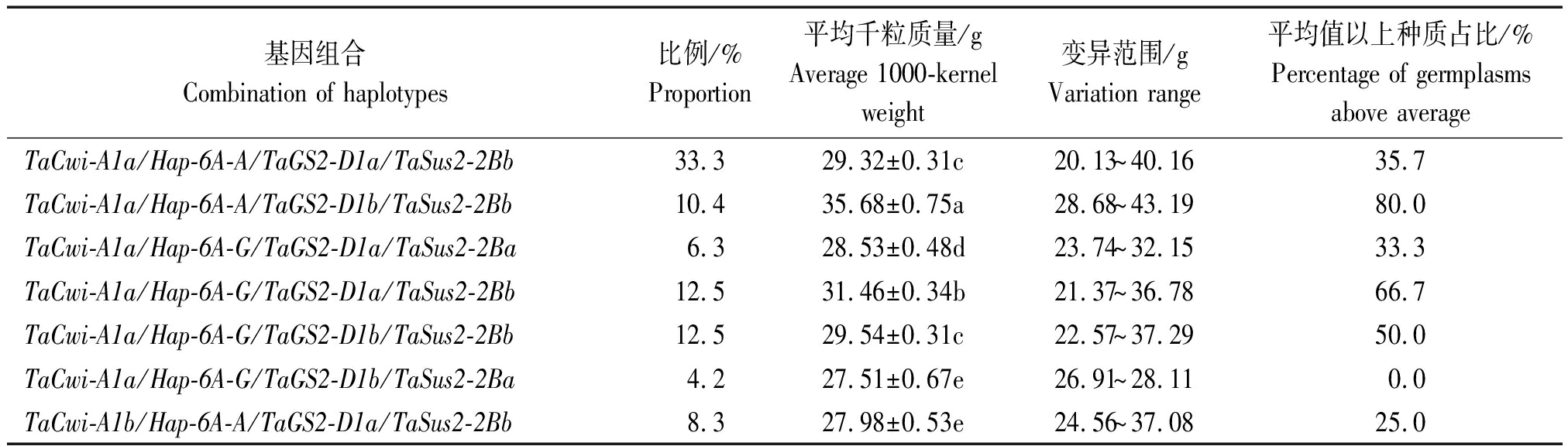
基因组合Combination of haplotypes比例/%Proportion平均千粒质量/gAverage 1000-kernel weight变异范围/gVariation range平均值以上种质占比/%Percentage of germplasmsabove averageTaCwi-A1a/Hap-6A-A/TaGS2-D1a/TaSus2-2Bb33.329.32±0.31c20.13~40.1635.7TaCwi-A1a/Hap-6A-A/TaGS2-D1b/TaSus2-2Bb10.435.68±0.75a28.68~43.1980.0TaCwi-A1a/Hap-6A-G/TaGS2-D1a/TaSus2-2Ba6.328.53±0.48d23.74~32.1533.3TaCwi-A1a/Hap-6A-G/TaGS2-D1a/TaSus2-2Bb12.531.46±0.34b21.37~36.7866.7TaCwi-A1a/Hap-6A-G/TaGS2-D1b/TaSus2-2Bb12.529.54±0.31c22.57~37.2950.0TaCwi-A1a/Hap-6A-G/TaGS2-D1b/TaSus2-2Ba4.227.51±0.67e26.91~28.110.0TaCwi-A1b/Hap-6A-A/TaGS2-D1a/TaSus2-2Bb8.327.98±0.53e24.56~37.0825.0
3 结论与讨论
小麦粒质量在产量三因素中受遗传特性影响最大,与单位面积穗数和穗粒数无负相关关系,相对独立[23]。在稳定单位面积穗数和穗粒数的前提下,增加粒质量对提高小麦产量效果显著[24]。随着分子生物学和比较基因组学的发展,很多小麦粒质量相关基因被克隆出来,并基于基因序列开发出功能分子标记,能够大大提高小麦分子育种效率。然而,其在育种实践中的利用价值评价,尤其是综合遗传效应评价还较少[4,25]。
寇程等[26]利用开发的TaGW2基因的CAPS标记对国内外316份小麦品种(系)进行单倍型类型检测,发现Hap-6A-A和Hap-6A-G类型在粒质量、粒长和粒宽上差异显著。相吉山等[27]研究表明,TaCwi-A1基因的分子标记可以较好地区分小麦千粒质量大小,能够应用于小麦粒质量的分子标记辅助育种。本研究结果显示,TaGW2-6A基因单倍型Hap-6A-A、TaCwi-A1基因的单倍型TaCwi-A1a均为高千粒质量等位变异,且与低千粒质量单倍型在粒质量上的差异达到显著水平,所得结果与前人[26-27]研究一致。表明TaGW2-6A和TaCwi-A1基因在不同环境下的遗传效应都较为稳定,分子标记与平均千粒质量表型的一致性较好,可以用于小麦育种中优异种质千粒质量的鉴定和筛选。TaSus2-2B基因单倍型TaSus2-2Ba在外引小麦种质中的平均千粒质量显著低于单倍型TaSus2-2Bb,这与Jiang等[21]的研究不一致。时佳等[28]对219份新疆小麦品种(系)的TaSus2-2B基因检测也显示,单倍型TaSus2-2Bb的平均千粒质量显著高于单倍型TaSus2-2Ba。其原因可能在于,小麦的蔗糖合成酶基因对小麦千粒质量有着重要影响,然而该基因又对环境条件变化较为敏感,从而造成了上述研究结果不一致的情况[28]。另外,在48份外引种质中TaGS2-D1基因的单倍型TaGS2-D1a占比高于单倍型TaGS2-D1b,而平均千粒质量显著低于单倍型TaGS2-D1b,这与宋晓朋等[29]的研究结果并不一致。一直以来,对小麦千粒质量的研究所用群体多为重组自交系、DH群体或者回交群体,这些群体多基于千粒质量差异较大的亲本衍生而来,因此具有遗传背景狭窄的缺点[30],并且在不同环境和遗传背景中的遗传效应研究还较少。在本试验中,48份小麦种质材料来自国外10多个国家,整体的遗传多样性非常高,分析认为,单个基因对粒质量相关性状的影响可能会被其他籽粒表型相关基因影响所掩盖,从而导致研究结果的差异。以上结果也表明,粒质量性状由多基因控制,对多个粒质量相关基因进行综合遗传效应分析是十分必要的,有利于在小麦分子育种实践中的有效应用。
对外引种质中4个粒质量基因的单倍型部分组合研究结果显示,含有相同单倍型组合的种质材料在供试材料中占比高的,其平均千粒质量也相对较高。表明这些国外引进的小麦种质资源本身具有较好的遗传基础,聚合了一些优异的粒质量相关基因,这对于拓宽国内小麦的遗传基础有一定作用。
通过对48份国外引进小麦种质的4种粒质量相关基因等位变异类型检测和千粒质量性状测定,鉴定出一些含有粒质量相关优异等位变异基因的小麦种质资源。在较高遗传多样性的情况下,验证了TaCwi-A1基因和TaGW2-6A基因的优异等位变异类型遗传效应的稳定性,以及发现TaSus2-2B基因和TaGS2-D1基因容易受到环境和其他粒质量相关基因影响的特点,提出对于粒质量相关基因进行综合遗传效应分析的必要性。本研究为外引种质的有效利用和分子标记辅助选择技术在小麦粒质量相关性状改良中的应用提供了一些科学依据。
[1] Giura A,Saulescu N N. Chromosomal location of genes controlling grain size in a large grained selection of wheat(Triticum aestivum L.)[J].Euphytica,1996,89(1):77-80. doi:10.1007/BF00015722.
[2] Kuchel H,Williams K J,Langridge P,Eagles H A,Jefferies S P. Genetic dissection of grain yield in bread wheat. I. QTL analysis[J].Theoretical and Applied Genetics,2007,115(8):1029-1041. doi:10.1007/s00122-007-0629-7.
[3] Gegas V C,Nazari A,Griffiths S,Simmonds J,Fish L,Orford S,Sayers L,Doonan J H,Snape J W. A genetic framework for grain size and shape variation in wheat[J].The Plant Cell,2012,22(4):1046-1056. doi:10.1105/tpc.110.074153.
[4] 吕广德,孙宪印,亓晓蕾,王超,王瑞霞,孙盈盈,牟秋焕,米勇,钱兆国,吴科. 普通小麦粒重相关基因克隆的研究进展[J].麦类作物学报,2017,37(10):1301-1308. doi:10.7606/j.issn.1009-1041.2017.10.05.
Lü G D,Sun X Y,Qi X L,Wang C,Wang R X,Sun Y Y,Mu Q H,Mi Y,Qian Z G,Wu K. Research progress of gene cloning related to grain weight in common wheat[J].Journal of Triticeae Crops,2017,37(10):1301-1308.
[5] 康艺维,陈玉宇,张迎信. 水稻粒型基因克隆研究进展及育种应用展望[J].中国水稻科学,2020,34(6):479-490. doi:10.16819/j.1001-7216.2020.9135.
Kang Y W,Chen Y Y,Zhang Y X. Research progress and breeding prospects of grain size associated genes in rice[J].Chinese Journal of Rice Science,2020,34(6):479-490.
[6] Sun S Y,Wang L,Mao H L,Shao L,Li X H,Xiao J H,Ouyang Y D,Zhang Q F. A G-protein pathway determines grain size in rice[J].Nature Communications,2018,9(1):851. doi:10.1038/s41467-018-03141-y.
[7] Su Z Q,Hao C Y,Wang L F,Dong Y C,Zhang X Y. Identification and development of a functional marker of TaGW2 associated with grain weight in bread wheat(Triticum aestivum L.)[J].Theoretical and Applied Genetics,2011,122(1):211-223. doi:10.1007/s00122-010-1437-z.
[8] Huang X Q,Kempf H,Ganal M W,Röder M S. Advanced backcross QTL analysis in progenies derived from a cross between a German elite winter wheat variety and a synthetic wheat(Triticum aestivum L.)[J].Theoretical and Applied Genetics,2004,109(5):933-943. doi:10.1007/s00122-004-1708-7.
[9] Huang X Q,Cloutier S,Lycar L,Radovanovic N,Humphreys D G,Noll J S,Somers D J,Brown P D. Molecular detection of QTLs for agronomic and quality traits in a doubled haploid population derived from two Canadian wheats(Triticum aestivum L.)[J].Theoretical and Applied Genetics,2006,113(4):753-766. doi:10.1007/s00122-006-0346-7.
[10] Sun X Y,Wu K,Zhao Y,Kong F M,Han G Z,Jiang H M,Huang X J,Li R J,Wang H G,Li S S. QTL analysis of kernel shape and weight using recombinant inbred lines in wheat[J].Euphytica,2008,165(3):615-624. doi:10.1007/s10681-008-9794-2.
[11] Sun X C,Marza F,Ma H X,Carver B F,Bai G H.Mapping quantitative trait loci for quality factors in an inter-class cross of US and Chinese wheat[J].Theoretical and Applied Genetics,2010,120(5):1041-1051. doi:10.1007/s00122-009-1232-x.
[12] Tang G Q,Lüscher M,Sturm A. Antisense repression of vacuolar and cell wall invertase in transgenic carrot alters early plant development and sucrose partitioning[J].The Plant Cell,1999,11(2):177-189. doi:10.1105/tpc.11.2.177.
[13] Sturm A. Invertases. Primary structures,functions,and roles in plant development and sucrose partitioning[J].Plant Physiology,1999,121(1):1-8.doi:10.1104/pp.121.1.1.
[14] Chourey P S,Jain M,Li Q B,Carlson S J. Genetic control of cell wall invertases in developing endosperm of maize[J].Planta,2006,223(2):159-167. doi:10.1007/s00425-005-0039-5.
[15] Wang E T,Wang J J,Zhu X D,Hao W,Wang L Y,Li Q,Zhang L X,He W,Lu B R,Lin H X,Ma H,Zhang G Q,He Z H. Control of rice grain-filling and yield by a gene with a potential signature of domestication[J].Nature Genetics,2008,40(11):1370-1374. doi:10.1038/ng.220.
[16] Ma D Y,Yan J,He Z H,Wu L,Xia X C. Characterization of a cell wall invertase gene TaCwi-A1 on common wheat chromosome 2A and development of functional markers[J].Molecular Breeding,2012,29(1):43-52. doi:10.1007/s11032-010-9524-z.
[17] Miflin B J,Habash D Z. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops[J].Journal of Experimental Botany,2002,53(370):979-987.doi:10.1093/jexbot/53.370.979.
[18] Tobin A K,Yamaya T. Cellular compartmentation of ammonium assimilation in rice and barley[J].Journal of Experimental Botany,2001,52(356):591-604. doi:10.1093/jexbot/52.356.591.
[19] Li X P,Zhao X Q,He X,Zhao G Y,Li B,Liu D C,Zhang A M,Zhang X Y,Tong Y P,Li Z S. Haplotype analysis of the genes encoding glutamine synthetase plastic isoforms and their association with nitrogen-use-and yield-related traits in bread wheat[J].New Phytologist,2011,189(2):449-458. doi:10.1111/j.1469-8137.2010.03490.x.
[20] Kleczkowski L A,Kunz S,Wilczynska M. Mechanisms of UDP-glucose synthesis in plants[J].Critical Reviews in Plant Sciences,2010,29(4):191-203. doi:10.1080/07352689.2010.483578.
[21] Jiang Q Y,Hou J,Hao C Y,Wang L F,Ge H M,Dong Y S,Zhang X Y. The wheat(T.aestivum)sucrose synthase 2 gene(TaSus2)active in endosperm development is associated with yield traits[J].Functional & Integrative Genomics,2011,11(1):49-61. doi:10.1007/s10142-010-0188-x.
[22] Lagudah E S,Appels R,McNeil D. The Nor-D3 locus Triticum tauschii:natural variation and genetic linkage to markers in chromosome 5[J].G nome,1991,34(3):387-395.doi:10.1139/g91-060.
[23] Cui F,Ding A M,Li J,Zhao C H,Li X F,Feng D S,Wang X Q,Wang L,Gao J R,Wang H G. Wheat kernel dimensions:How do they contribute to kernel weight at an individual QTL level?[J].Journal of Genetics,2011,90(3):409-425. doi:10.1007/s12041-011-0103-9.
[24] 张福彦,范家霖,陈晓杰,陈锋,齐红志,王嘉欢,程仲杰,杨保安,张建伟. 小麦粒重相关基因的遗传定位和分子标记辅助育种进展[J].植物遗传资源学报,2020,21(3):507-516. doi:10.13430/j.cnki.jpgr.20191107002.
Zhang F Y,Fan J L,Chen X J,Chen F,Qi H Z,Wang J H,Cheng Z J,Yang B A,Zhang J W. Genetic localization and marker assisted breeding of grain weight-related genes in common wheat[J].Journal of Plant Genetic Resources,2020,21(3):507-516.
[25] 周军,李魁印,张立,彭琴,徐如宏,任明见. 242份小麦品种(系)成株期抗条锈病鉴定及分子标记检测[J].河南农业科学,2020,49(6):84-97. doi:10.15933/j.cnki.1004-3268.2020.06.011.
Zhou J,Li K Y,Zhang L,Peng Q,Xu R H,Ren M J. Identification of adult-plant resistance to stripe rust and molecular marker detection of Yr gene in 242 wheat varieties(lines)[J].Journal of Henan Agricultural Sciences,2020,49(6):84-97.
[26] 寇程,高欣,李立群,李扬,王中华,李学军. 小麦粒重基因TaGW2-6A等位变异的组成分析及育种选择[J].作物学报,2015,41(11):1640-1647. doi:10.3724/SP.J.1006.2015.01640.
Kou C,Gao X,Li L Q,Li Y,Wang Z H,Li X J. Composition and selection of TaGW2-6A alleles for wheat kernel weight[J].Acta Agronomica Sinica,2015,41(11):1640-1647.
[27] 相吉山,穆培源,桑伟,聂迎彬,徐红军,庄丽,崔凤娟,韩新年,邹波. 小麦粒重基因TaCwi-A1功能标记CWI22、CWI21的验证及应用[J].中国农业科学,2014,47(13):2671-2709. doi:10.3864/j.issn.0578-1752.2014.13.019.
Xiang J S,Mu P Y,Sang W,Nie Y B,Xu H J,Zhuang L,Cui F J,Han X N,Zou B. Validation and application of function markers CWI22 and CWI21 of TaCwi-A1 gene related to wheat kernel weight[J].Scientia Agricultura Sinica,2014,47(13):2671-2709.
[28] 时佳,白璐,任毅,穆培源,梁晓东,玛依拉,耿洪伟. 新疆小麦TaGW2-6A、TaCwi-A1、TaSus2-2B等位变异对粒重的影响及应用[J].分子植物育种,2018,16(3):848-858. doi:10.13271/j.mpb.016.000848.
Shi J,Bai L,Ren Y,Mu P Y,Liang X D,Ma Y L,Geng H W. Effects and application of allelic variation of TaGW2-6A,TaCwi-A1 and TaSus2-2B on grain weight of Xinjiang wheat[J].Molecular Plant Breeding,2018,16(3):848-858.
[29] 宋晓朋,王宇娟,武炳瑾,马文洁,张德强,周丽敏,孙道杰.黄淮麦区部分小麦和国外引进小麦GS2等位基因的检测及其与农艺性状的关联分析[J].麦类作物学报,2016,36(3):281-286.doi: 10.7606/j.issn.1009-1041.2016.03.04.
Song X P,Wang Y J,Wu B J,Ma W J,Zhang D Q,Zhou L M,Sun D J. Allelic variations of TaGS2 genes and their association with agronomic traits in wheat cultivars from Huang-Huai wheat region in China and overseas[J].Journal of Triticeae Crops,2016,36(3):281-286.
[30] 刘永伟,周硕,王雪征,孙果忠,朱金永,韩秋芬,李春杰,赵和,王海波. 粒重基因TaCwi-A1等位变异在黄淮麦区小麦品种(系)中的分布及功能分析[J].华北农学报,2017,32(2):131-137. doi:10.7668/hbnxb.2017.02.020.
Liu Y W,Zhou S,Wang X Z,Sun G Z,Zhu J Y,Han Q F,Li C J,Zhao H,Wang H B. Functional analysis and distribution of allelic variations of TaCwi-A1 gene related to kernel weight in Yellow and Huai river valleys facultative wheat zone[J].Acta Agriculturae Boreali-Sinica,2017,32(2):131-137.