MYB(v-MYB avian myeloblastosis viral)是一类在植物中普遍存在的转录因子。30 a前,人们从玉米(Zea mays)中鉴定出了第一个植物MYB基因-COLORED1(C1),C1基因编码的MYB结构域蛋白是合成玉米糊粉中花青素所必需的蛋白 [1]。从那时起,植物MYB基因的功能得到了人们的广泛关注。20 a前,拟南芥基因组序列发表,首次对植物MYB基因进行了全面的描述和分类 [2]。之后MYB基因在拟南芥、玉米、水稻、矮牵牛花、金鱼草、葡萄、白杨、苹果和番茄等植物中的功能也通过遗传和分子分析得到了证实 [3-4]。
MYB基因表达的蛋白具有高度保守的DNA结合结构域:MYB结构域,该结构域通常由至多4个重复序列(R1、R2、R3、R4)组成,每个重复序列包含52个氨基酸,能够形成3个α螺旋。并且每个重复序列的第二和第三螺旋会与3个规则间隔的色氨酸残基形成螺旋-转角-螺旋(HTH)结构,其中色氨酸残基构成了三维HTH结构中的疏水核心 [5]。MYB蛋白可分为1R-MYB/MYB-related、R2R3-MYB、3R-MYB、4R-MYB(4个R1/R2的重复)4种不同的亚类 [6-7]。迄今分离出的大多数植物MYB基因编码的DNA结合域由2个重复序列构成,这2个重复序列与动物c-MYB蛋白的R2和R3重复序列最相似 [8-10]。
研究发现,MYB基因是microRNA(miRNAs)和ta-siRNA(ta-siRNAs)的靶点 [11],同时MYB转录因子也是其他调控因子的直接靶点 [12]。MYB转录因子在植物中可以发挥很多功能,例如调控初级和次级代谢,影响细胞生命活动,控制花青素和黄酮醇的生物合成 [13],调控植物生长发育 [14],参与植物对生物和非生物胁迫的响应等 [15]。
迄今为止,人们已经研究和报道了很多MYB家族基因在拟南芥中的功能:AtMYB30被证明在控制下胚轴细胞伸长的油菜素内酯途径中发挥重要作用 [16];AtMYB60和AtMYB96能够通过ABA信号级联调控气孔运动[17]、干旱胁迫和抗病性 [18];AtMYB23与AtMYB5联合调控毛状体的伸长和分支 [19-20],AtMYB5还调控外种皮分化 [21];AtMYB16/MIXTA控制花瓣表皮细胞的形状 [22],和AtMYB17一起作为早期花序发育和种子萌发的调控因子 [23];MYB28和MYB29参与植物胺胁迫响应的调节 [24];AtMYB103调控纤维素的生物合成 [25];AtMYB61发挥多效作用,影响木质素沉积 [26]、黏液生成 [27]和气孔孔径 [28]。之前的研究发现,AtMYB54参与了盐胁迫响应,在抗逆中发挥了一定功能。阐明MYB蛋白在生长发育和干旱胁迫的功能和调控作用,能够为预测MYB蛋白在小麦等其他植物物种中的功能提供坚实的基础。
本研究主要对拟南芥和小麦中MYB54在不同物种之间的保守性、蛋白结构、表达模式、高温胁迫进行了研究分析,并在拟南芥中对MYB54蛋白的诱导表达,转录活性进行初步探究,为MYB54在植物中的功能研究提供理论基础,以期能在作物产量应用中提供帮助。
1 材料和方法
1.1 试验材料
本研究选择的植物材料为兰兹贝格(Landsberg erecta)野生型拟南芥(Arabidopsis thaliana),载体构建所用的菌株为大肠杆菌(Escherichia coli)DH5α,蛋白诱导所用的菌株为大肠杆菌BL21(DE3),酵母菌株为Y2HGold,此材料都为刘西岗实验室保存。限制性内切酶、RNA反转录试剂盒与RT-PCR mix为Thermo公司购买,胶回收试剂盒为Biomiga公司购买。酵母转化试剂盒为北京Coolaber公司购买。
1.2 试验方法
1.2.1 MYB54的生物信息学分析 利用NCBI(http://www.ncbi.nlm.nih.gov)网站和TAIR网站(http://www.arabidopsis.org)对MYB54的蛋白序列进行搜索,并将蛋白序列导入到https://plants.ensembl.org/index.html网站中进行不同物种之间的同源对比,利用MEGA 10软件对不同物种之间的MYB54蛋白进行进化学分析。同时利用DNAMAN软件预测MYB54的蛋白质结构;利用同源模型服务软件SWISS-MODEL(http://www.swissmodel.expasy.org/)预测MYB54蛋白三维空间结构。
1.2.2 MYB54在拟南芥中的不同部位的表达量分析 选取16 h光照/8 h黑暗条件下生长了40 d的野生型拟南芥植株,取全根、莲座叶、茎生叶、花序以及果荚组织。利用TRIzol法提取总RNA,利用反转录试剂盒反转录为cDNA后进行RT-PCR检测,内参基因为UBQ5。反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。
1.2.3 高温和低温处理下拟南芥幼苗MYB54的表达量分析 将野生型Ler的种子用75%乙醇消毒后,铺在1/2MS培养基中,在22 ℃,16 h光照/8 h黑暗条件下生长8 d后,将幼苗分别放入4,30 ℃进行高温和低温处理,2 h后全苗取样,进行RNA提取,反转录后利用RT-PCR测定MYB54的表达量。反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL,内参基因为UBQ5。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。
1.2.4 热胁迫下小麦中MYB54基因的表达量分析 将大小均一饱满的KN9204小麦种子,用2.5%次氯酸钠浸泡2 min,随后再用蒸馏水冲洗3次,冲洗干净后,均匀摆放在盛有蛭石的培养皿中,并将种子放入22 ℃培养箱中,在16 h光照,8 h黑暗条件中萌发,待小麦长至一叶一心时期在4 ℃进行春化处理28 d,随后将幼苗移栽进培养土中(营养土∶蛭石=1∶1),在12 h光照(18 ℃),12 h黑暗(13 ℃)进行培养,待幼苗长至两叶一心时,分别进行4 ℃冷处理和30 ℃热处理,处理2 h后全苗取材,随后利用RNA提取试剂盒和反转录试剂盒获取cDNA进行RT-PCR检测,反应总体系为10 μL,2×RT-PCR mix 5 μL,cDNA 1 μL,引物(Forward+Reverse)1 μL,ddH2O 3 μL,内参基因为GAPDH。反应程序为:95 ℃预变性5 min;94 ℃变性15 s,55 ℃退火15 s,68 ℃延伸30 s,45个循环;72 ℃制备溶解曲线。所用引物为表1所示。
表1 引物序列
Tab.1 Primer sequence

引物名称Primer name引物序列(5′-3′)Primer sequence用途UsingAtMYB54-RT-FACAATACGGTCCTCACAATTGGAACGMYB54 RT-PCR分析AtMYB54-RT-RACCATCTGTTCCCATGGATCCGATGAGMYB54 RT-PCR分析AtMYB54-EcoR1-FGAATTCATGTGCAGCCGAGGCCATTG构建融合蛋白AtMYB54-Sal11-RGTCGACGGCAGAGTTTCCAACGGATA构建融合蛋白TraesMYB54-RT-FGTCCTTGTGCCCGAGAGGCCACTGGMYB54 RT-PCR分析TraesMYB54-RT-RGTGCGCCGCTAGCAGACGCTCCTCCMYB54 RT-PCR分析UBQ5-QFAATGTGAAGGCGAAGATCCAAMYB54 RT-PCR分析UBQ5-QRACGGAGACGGAGGACGAGATMYB54 RT-PCR分析GAPDH-QFTTAGACTTGCGAAGCCAGCAMYB54 RT-PCR分析GAPDH-QRAAATGCCCTTGAGGTTTCCCMYB54 RT-PCR分析
1.2.5 MYB54蛋白相关表达载体的构建 利用snapgene软件对MYB54基因 CDS序列以及pGEX-4T-1,pGBKT7表达载体进行酶切位点分析,用EcoR Ⅰ和Sal Ⅰ 2个酶切位点对目的基因和载体进行酶切回收,25 ℃条件下,用T4连接酶将MYB54基因 CDS序列与pGST-4T-1与pGBKT7载体连接,随后将重组质粒转入大肠杆菌DH5α中,加500 μL无抗LB培养液,并均匀涂布在氨苄霉素LB培养基上37 ℃培养12~16 h,挑取20个单菌落进行PCR鉴定,对鉴定出的阳性菌落提取质粒,利用BamH Ⅰ进行酶切验证,将酶切正确的重组质粒送金唯智公司(GENEWIZ)进行测序。
1.2.6 pGEX-4T-1-MYB54蛋白诱导纯化 考马斯亮蓝染色以及Western Blot检测 将构建好的pGEX-4T-1-MYB54重组质粒利用热激法转入大肠杆菌BL21(DE3)菌株中,37 ℃过夜培养。挑取单菌落加入5 mL氨苄抗性的LB培养液中,37 ℃摇床中220 r/min培育12~14 h,后转入250 mL的氨苄抗性的LB培养液中扩培4~5 h,待菌液OD600值达到0.6时加入IPTG,使其终浓度为0.3 μmol/L,分别在18 ℃过夜诱导,30 ℃诱导6 h,37 ℃诱导4 h。诱导结束后收集菌液,利用超声仪对菌液进行超声破碎,将超声后的上清加入GST凝胶树脂进行蛋白纯化,在4 ℃摇床中孵育4~6 h,将纯化出的GST-MYB54蛋白进行SDS-PAGE电泳后,考马斯亮蓝染色,并选取最适诱导条件下的纯化蛋白进行Western Blot检测。
1.2.7 MYB54在酵母中的转录激活活性分析 利用酵母双杂交系统对MYB54的转录活性进行分析,构建重组质粒pGBKT7-MYB54用于转化酵母菌株。首先将酵母菌株Y2HGold在YPDA固体培养基上划线,30 ℃倒置培养2~3 d,挑取直径2~3 mm的单克隆于3 mL YPDA培养液中,30 ℃,250 r/min摇床培养8 h,吸取100 μL~10 mL YPDA中,30 ℃,250 r/min摇床培养12~16 h,直至OD600 达到 0.5左右。提前将1.5 mL离心管,枪头,ddH2O高温灭菌。用1.5 mL的离心管1 000 r/min离心2 min收集菌体2次,倒去上清并用1 mL无菌ddH2O重悬酵母;目的是洗去残留的YPDA培养液,再次室温1 000 r/mim离心2 min收集菌体,倒去上清并加入 1 mL 10× TE/LiAc,500 μL PEG8000和10 μL Carrier DNA 溶液重悬酵母;同时加入pGBKT7-MYB54重组质粒或pADT7空质粒作为对照。振荡混匀后30 ℃水浴 30 min,每 10 min 上下颠倒混匀1次。静置过夜后在42 ℃水浴锅中热激30 min,每10 min上下颠倒混匀1次。3 000 r/min离心5 min后,倒掉上清加入100 μL无菌水,重悬菌体后铺在SD-Leu/-Trp的培养基上,30 ℃培养2~3 d后,转接到SD-Leu/-Trp/-His/-Ade培养基中继续培养3~4 d后,观察酵母生长状况。
2 结果与分析
2.1 MYB54系统进化树分析以及氨基酸序列对比
利用生物信息学软件,将拟南芥中的MYB54蛋白序列与欧洲油菜(Brassica napus)、芥蓝(Brassica oleracea)、白菜(Brassica rapa)、亚麻荠(Camelina sativa)、圆锥南芥(Arabis alpina A)、大豆(Glycine max)、烟草(Nicotiana attenuata)、水稻(Oryza sativa)、高粱(Sorghum bicolor)、谷子(Setaria italica)、小麦(Triticum aestivum)和番茄(Solanum lycopersicum)进行了蛋白同源性分析,如图1所示,拟南芥中的MYB54蛋白与十字花科中的芥蓝、白菜、亚麻荠等同源性比较接近,分别达到了87%,87%,81%,与禾本科植物高粱、谷子和水稻的同源性较低,分别为54%,57%,47%,与小麦和番茄的同源性为42%。同时,通过图2中MYB54的氨基酸序列比对可以看出,在不同物种之间,MYB54具有非常保守的一段氨基酸序列,这段序列包含20个氨基酸片段,位于MYB-like DNA-binding 结构域之中。
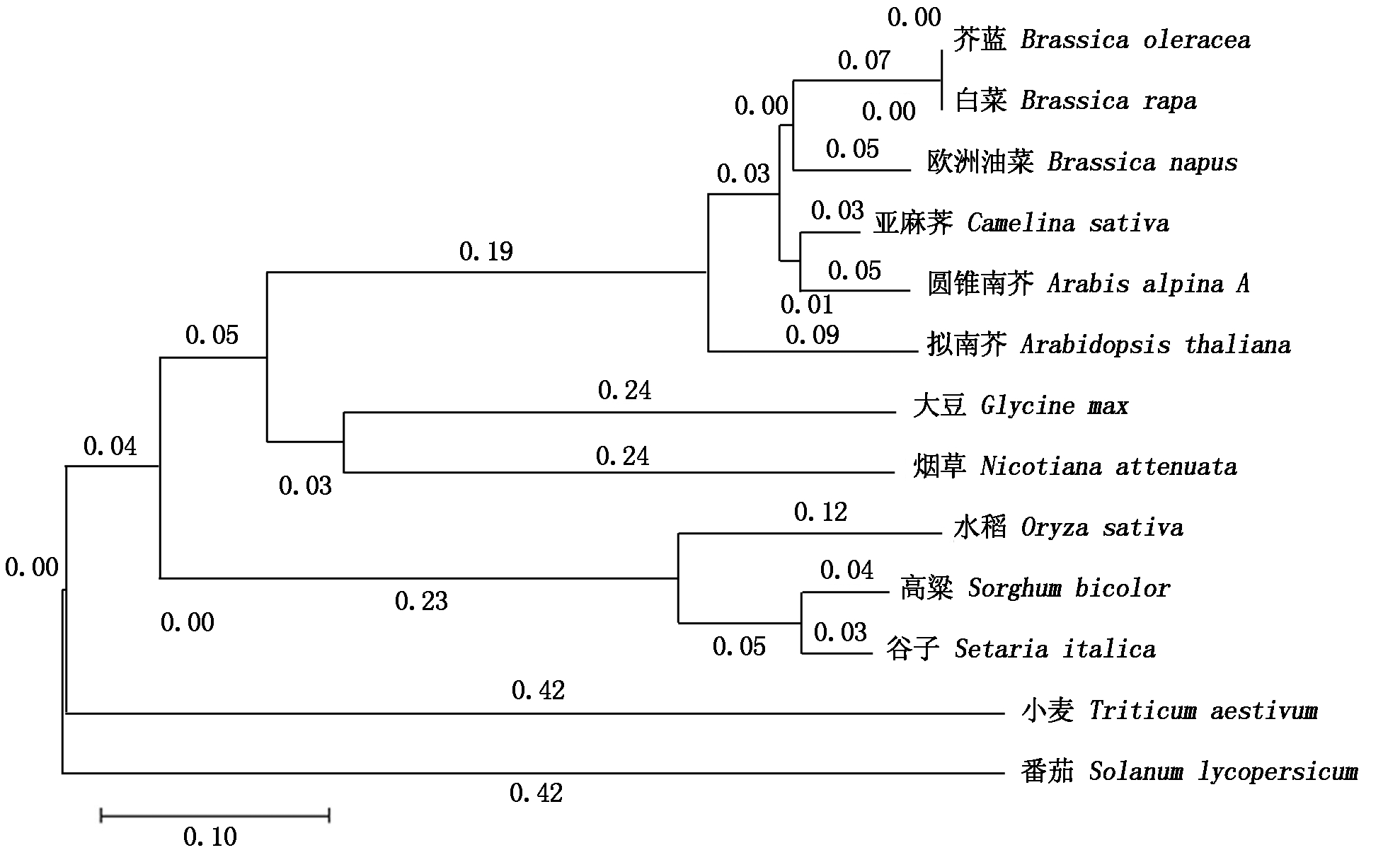
图1 系统进化树分析
Fig.1 Phylogenetic tree analysis
2.2 MYB54氨基酸序列的生物信息学分析
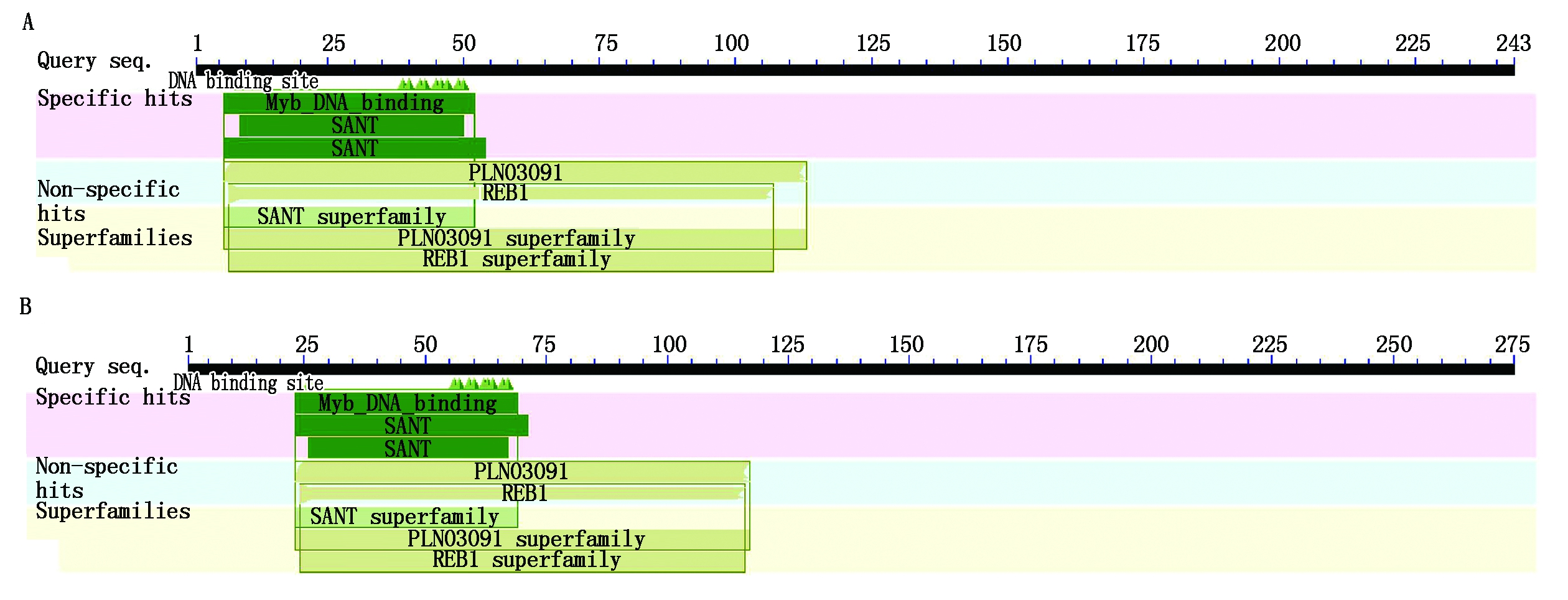
小麦作为我国主要的粮食作物之一,其中基因功能的研究对小麦育种具有重要的意义和价值,随后笔者利用 NCBI(http://www.ncbi.nlm.nih.gov)网站对MYB54蛋白分别在拟南芥和小麦中的氨基酸序列进行分析比对,结果如图3-5所示,拟南芥中MYB54蛋白具有243个氨基酸,相对分子质量为28.169 ku,等电点为10.17。小麦中MYB54蛋白具有275个氨基酸,相对分子质量为29.881 ku,等电点为10.005 4,对比图3-A、B可以看出,MYB54在小麦和拟南芥中存在非常保守的蛋白结构域,例如MYB-like DNA-binding结构域,该结构域在小麦和拟南芥中都存在,包含MYB蛋白的DNA结合结构域,以及与核小体滑动相关的SANT(“SWI3,ADA2,N-CoR and TFIIB”)结构域[29]。用同源模型服务软件 SWISS-MODEL(http://www.swissmodel.expasy.org/)分别对拟南芥和小麦中的MYB54蛋白进行三维空间结构的预测,结果如图4-A和图5-A所示。拟南芥中MYB54蛋白在第84位疏水性最高,峰值为2.15,在第157位亲水性最高,峰值为-1.71,结合ProtPram预测的平均亲水性为0.03,分析可知该蛋白为亲水性蛋白。小麦中MYB54蛋白在第1位疏水性最高,峰值为2.83,在第82位亲水性最高,峰值为-1.58,平均亲水性为0.04,预测为亲水性蛋白。同时对拟南芥和小麦中MYB54蛋白的二级结构进行预测,拟南芥MYB54蛋白包含96个螺旋,36个折叠,111个卷曲。小麦MYB54蛋白包含87个螺旋,48个折叠以及140个卷曲(图4-B-D和图5-B-D)。综合以上数据,可以看出小麦中MYB54蛋白与拟南芥中MYB54蛋白在保守结构域、亲水性、二级结构以及三级结构都十分相似,所以对拟南芥中MYB54蛋白的研究能够为预测小麦中MYB54蛋白功能提供有力的理论依据。

图2 MYB54氨基酸序列同源对比
Fig.2 MYB54 amino acid homology comparison
A.拟南芥MYB54蛋白序列;B.小麦MYB54蛋白序列。
A. Arabidopsis MYB54 protein sequence;B. Wheat MYB54 protein sequence.
图3 MYB54蛋白序列分析
Fig.3 MYB54 protein sequence analysis
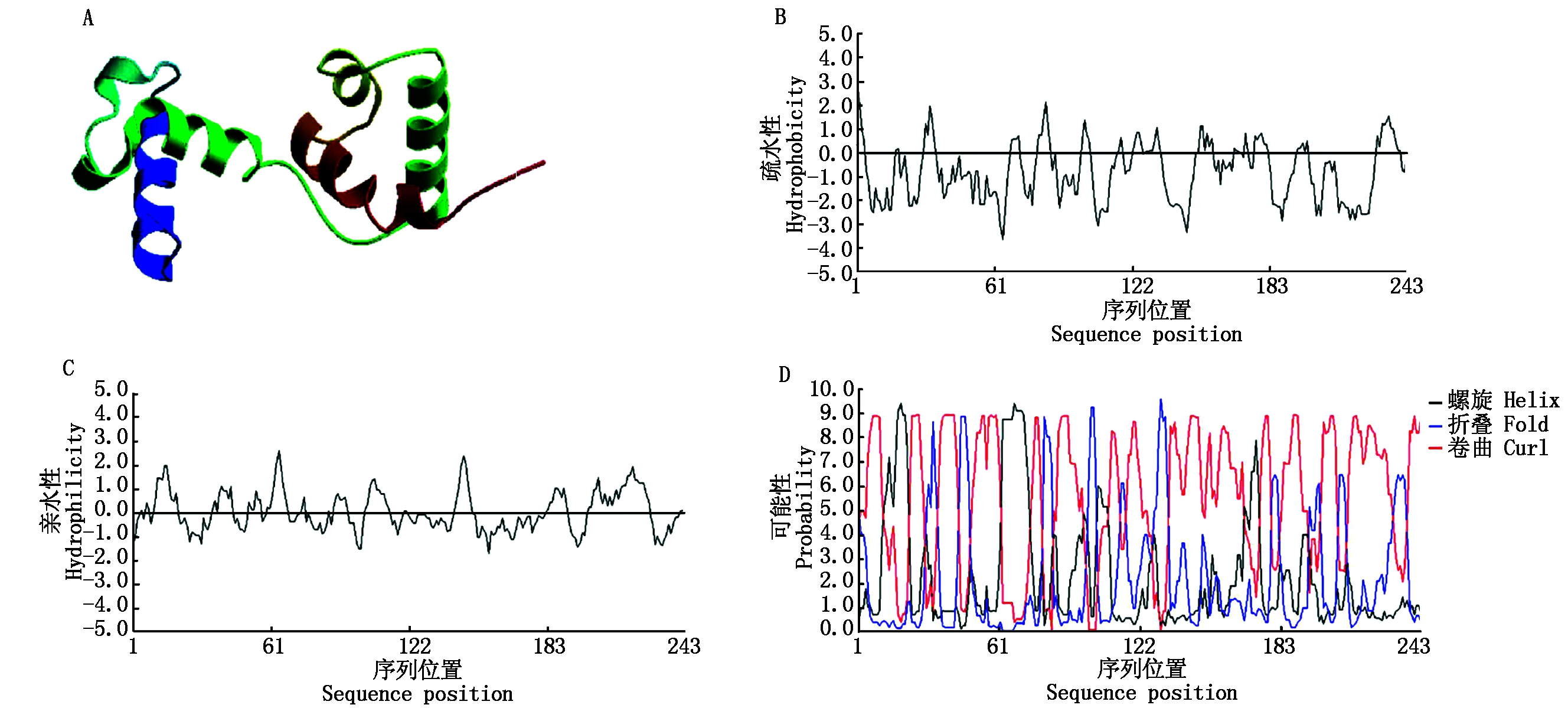
A.蛋白质三级结构预测;B.疏水性预测;C.亲水性预测;D.蛋白质二级结构预测。图5同。
A.Prediction of tertiary structure of proteins;B.Hydrophobicity prediction;C. Hydrophilicity prediction;
D. Protein secondary structure prediction;The same as Fig.5.
图4 拟南芥MYB54蛋白质生物信息学分析
Fig.4 MYB54 protein bioinformatics analysis in Arabidopsis

图5 小麦MYB54蛋白质生物信息学分析
Fig.5 MYB54 protein bioinformatics analysis in wheat
2.3 MYB54基因在拟南芥不同组织的表达量分析
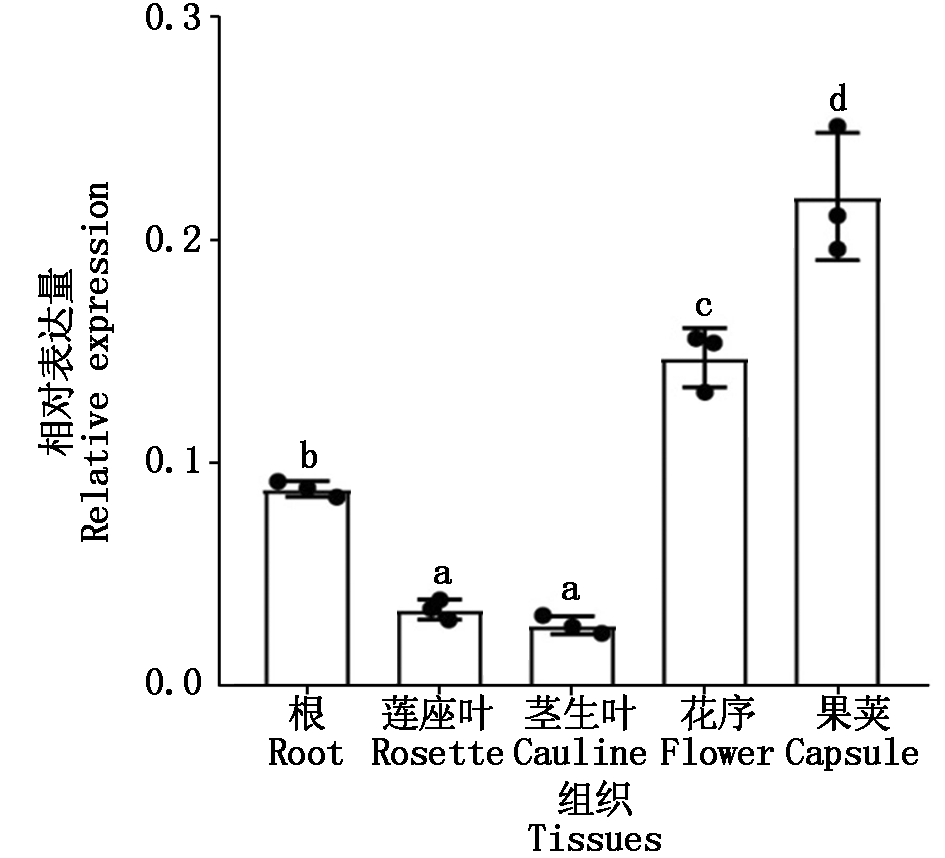
以拟南芥野生型(Ler)为材料,利用RT-PCR分别对根、莲座叶、茎生叶、花、果荚中的MYB54表达量进行分析,结果如图6所示,在这些组织中MYB54均有表达,但在果荚中的表达量最高,在花序和根中的表达量次之,在莲座叶和茎生叶中的表达量最少。综合以上结果,猜测MYB54可能在生殖发育过程中起着重要的作用。
2.4 拟南芥MYB54基因在高温和低温处理下的表达量分析
对野生型幼苗进行高温和低温处理,2 h后检测MYB54基因的表达量,结果如图7所示,高温处理后,MYB54基因的表达显著降低,表明MYB54能够响应高温胁迫,而在低温处理后,MYB54基因的表达量与对照组没有显著差异,这与前人在热胁迫中MYB54功能的研究相印证。
2.5 小麦MYB54基因在高温和低温处理下的表达量分析
随后对两叶一心时期的小麦幼苗进行高温和低温处理,2 h后检测了MYB54基因的表达变化,结果如图8所示,高温处理之后,MYB54的表达量与对照组相比下降1/2,低温处理之后,MYB54的表达量与对照组相比没有显著差异,这些结果与拟南芥中MYB54基因的变化趋势一致,表明MYB54对热较敏感,高温可以抑制MYB54的表达。
n=3,采用t检验分析数据的显著性;不同字母表示数据之间差异显著(P<0.05)。图7-8同。
n=3,t test was used to analyze the significance of the data;Different letters indicated significant differences between the data(P<0.05).The same as Fig.7-8.
图6 拟南芥不同组织中MYB54基因的表达
Fig.6 MYB54 gene expression in different tissues of Arabidopsis thaliana
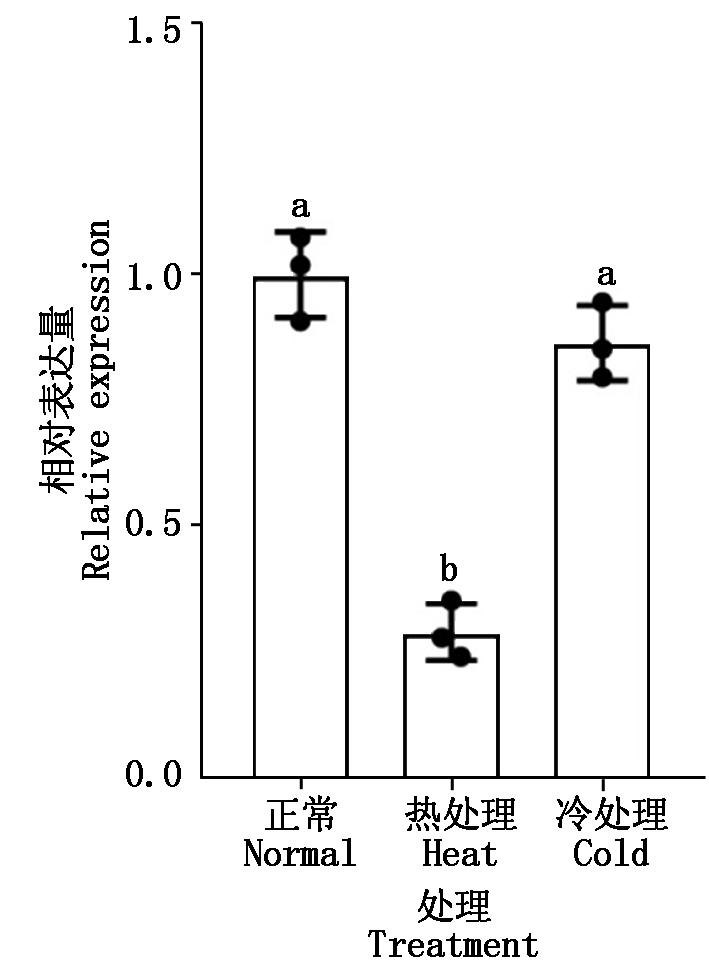
图7 高温和低温胁迫下拟南芥MYB54基因的表达
Fig.7 Expression of MYB54 gene under high and low temperature stress in Arabidopsis
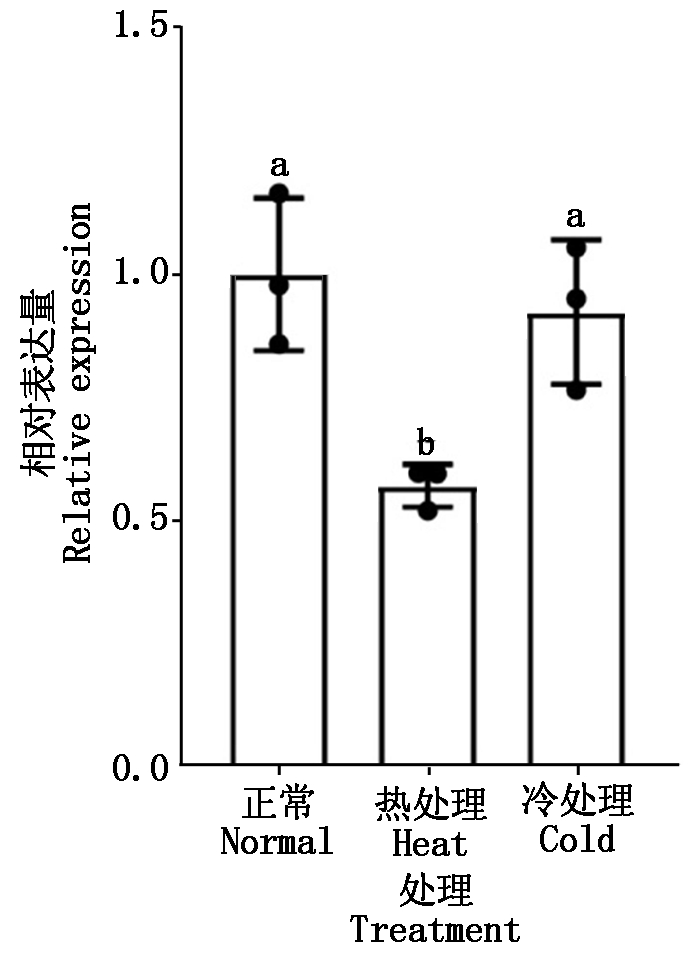
图8 高温和低温胁迫下小麦MYB54基因的表达
Fig.8 Expression of MYB54 gene under high and low temperature stress in wheat
2.6 MYB54蛋白的诱导纯化以及Western Blot分析
为了探索pGEX-4T-1-MYB54融合蛋白的最适诱导纯化条件,分别在18,30,37 ℃对该蛋白进行诱导,之后通过凝胶电泳和考马斯亮蓝染色对诱导纯化结果进行分析。MYB54蛋白分子量大小约为27 ku,GST蛋白分子量大小约为26 ku,故融合蛋白分子量大小约为53 ku。结果如图9所示,18,30,37 ℃条件下,蛋白都可以被正常诱导(泳道2-4),并且在超声后的上清液(泳道5-7)和沉淀中(泳道8-9)都可以检测到融合蛋白,随后将蛋白利用GST凝胶树脂进行纯化,结果发现,在37 ℃条件下纯化出的蛋白数量更多(泳道13)。随后对37 ℃条件下纯化出的融合蛋白利用GST抗体进行Western Blot检测,结果如图10所示,pGEX-4T-1-MYB54融合蛋白可以正确的表达翻译。
2.7 MYB54转录激活活性分析
MYB54作为转录因子来发挥功能,转录因子具有转录激活或转录抑制活性,为了验证MYB54的转录激活活性,利用了酵母双杂交GAL4系统进行验证,GAL4含有DNA结合结构域(DNA-Binding domain)BD和转录激活结构域(Transcription-activating domain)AD。将MYB54基因的CDS连接到pGBKT7载体上,构建了MYB54-BD,如果MYB54蛋白具有转录自激活活性,即使没有与其他蛋白质相互作用也可以启动下游报告基因的表达。将构建好的MYB54-BD与不带有其他表达蛋白的空AD共同转入酵母中,在四缺培养基中进行培养,结果如图11所示,MYB54-BD与空AD依然能够在四缺培养基上生长,空AD和空BD不能在四缺培养基上生长,这一结果表明MYB54在酵母中具有转录激活活性。
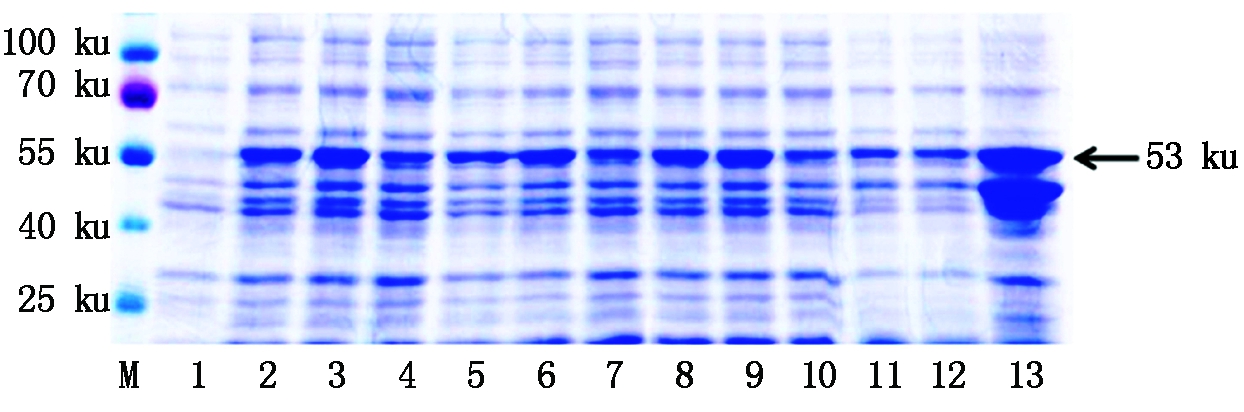
M.蛋白Marker;1.蛋白诱导前;2-4.分别在18,30,37 ℃条件下诱导后的蛋白;5-7.分别在18,30,37 ℃条件下诱导后蛋白的超声上清;8-10.分别在18,30,37 ℃条件下诱导后蛋白的超声沉淀;11-13.分别在18,30,37 ℃条件下纯化的蛋白。
M. Protein Marker;1. Before protein induction;2-4. Proteins induced at 18,30,37 ℃,respectively;5-7. Ultrasonic supernatant of proteins induced at 18,30,37 ℃,respectively;8-10. Ultrasonic precipitation of protein after induction at 18,30,37 ℃,respectively;11-13. Proteins purified at 18,30,37 ℃,respectively.
图9 MYB54蛋白的诱导纯化
Fig.9 Induction purification of MYB54 protein
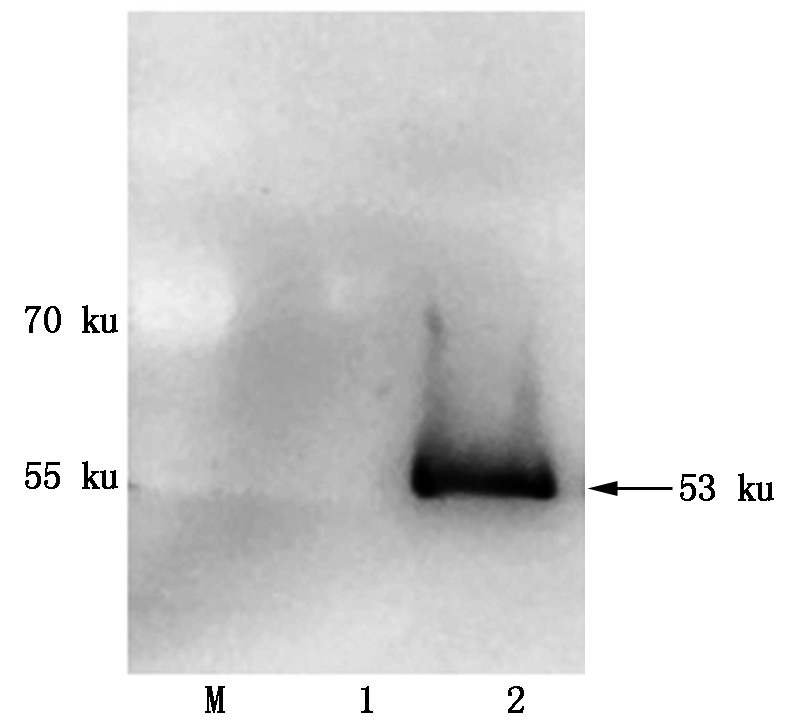
M.蛋白Marker;1.GST凝胶树脂;2.纯化的GST-MYB54蛋白。
M.Protein Marker;1.GST gel resin;2.Purified GST-MYB54 protein.
图10 MYB54蛋白的Western Blot检测
Fig.10 Western Blot detection of MYB54 protein
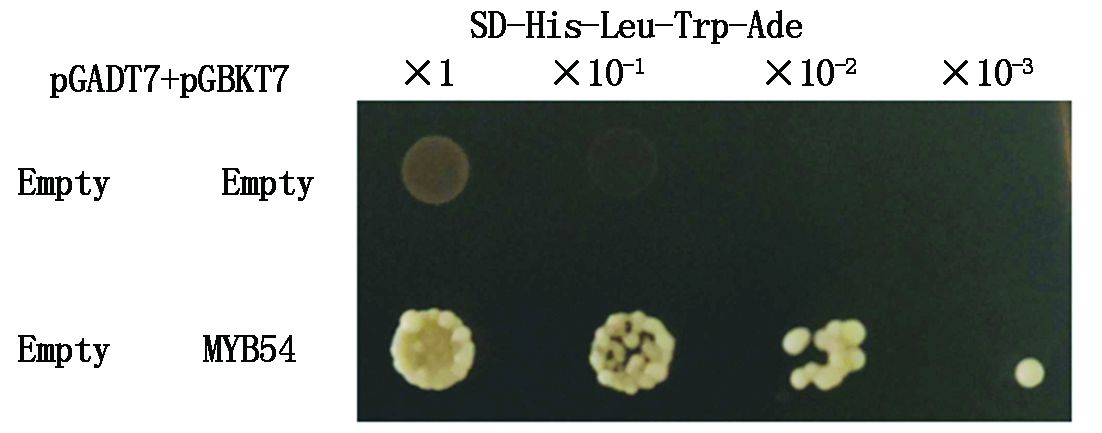
图11 酵母双杂交系统检测MYB54基因自激活活性
Fig.11 Yeast two-hybrid system to detect the self-activating activity of MYB54 gene
3 结论与讨论
MYB蛋白包含了非常保守的MYB DNA-binding结构域,该结构域通常由至多4个重复序列(R1、R2、R3、R4)组成,植物中MYB相关蛋白通常包含2个螺旋-转角-螺旋(HTH)结构,即R2和R3重复序列[30]。据估计,拟南芥含有超过100个R2R3-MYB基因。功能数据表明,这些基因在次级代谢的调节、细胞形状的控制、抗病性和激素反应中发挥重要作用。对拟南芥中MYB蛋白家族的MYB54蛋白进行了研究,研究发现,拟南芥中的MYB54蛋白与十字花科的同源性比较接近,与禾本科植物的同源性较低。MYB54蛋白在小麦和拟南芥中的保守结构域、亲水性、二级结构以及三级结构都十分相似,因此,探明模式植物拟南芥中MYB54蛋白的功能对小麦等农作物的研究具有重要的参考意义。MYB54基因在根、莲座叶、茎生叶、花、果荚中均有表达,暗示该基因在植物各个部位的生长发育都可能起到一定的调控作用,但在果荚中的表达量最高,因此,猜测MYB54可能在生殖发育过程中起着重要的作用。拟南芥和小麦中,经过高温处理后,MYB54的表达量都显著降低,这也暗示着MYB54在对热胁迫的响应中发挥着重要功能。MYB54蛋白的诱导条件并不严格,在18,30,37 ℃温度条件下,都可以被成功诱导,但在37 ℃温度下纯化的蛋白数量更多,Western Blot检测表明MYB54蛋白可以在体外正确翻译表达。利用酵母GAL4体系发现MYB54作为转录因子,具有转录激活活性。拟南芥MYB基因家族中依然有90%的MYB基因功能尚未被完全了解,对MYB54蛋白进行了基础的研究和初步的探索,以期为发掘更多的MYB蛋白家族功能提供理论基础和参考指导。
[1] Marocco A,Wissenbach M,Becker D,Paz-Ares J,Saedler H,Salamini F,Rohde W. Multiple genes are transcribed in Hordeum vulgare and Zea mays that carry the DNA binding domain of the myb oncoproteins[J].Molecular and General Genetics,1989,216(2/3):183-187.doi: 10.1007/BF00334354.
[2] Stracke R,Werber M,Weisshaar B. The R2R3-MYB gene family in Arabidopsis thaliana[J].Current Opinion in Plant Biology,2001,4(5):447-456.doi:10.1016/s1369-5266(00)00199-0.
[3] Xiao R X,Zhang C,Guo X R,Li H,Lu H. MYB transcription factors and its regulation in secondary cell wall formation and lignin biosynthesis during xylem development[J].International Journal of Molecular Sciences,2021,22(7):3560.doi:10.3390/ijms22073560.
[4] Gates D J,Strickler S R,Mueller L A,Olson B J S C,Smith S D. Diversification of R2R3-MYB transcription factors in the tomato family solanaceae[J].Journal of Molecular Evolution,2016,83(1/2):26-37. doi:10.1007/s00239-016-9750-z.
[5] Jiang C K,Rao G Y. Insights into the diversification and evolution of R2R3-MYB transcription factors in plants[J].Plant Physiology,2020,183(2):637-655.doi:10.1104/pp.19.01082.
[6] Ito M.Conservation and diversification of three-repeat Myb transcription factors in plants[J].Journal of Plant Research,2005,118(1):61-69.doi:10.1007/s10265-005-0192-8.
[7] Haga N,Kato K,Murase M,Araki S,Kubo M,Demura T,Suzuki K,Müller I,Voss U,Jürgens G,Ito M. R1R2R3-Myb proteins positively regulate cytokinesis through activation of KNOLLE transcription in Arabidopsis thaliana[J].Development,2007,134(6):1101-1110.doi: 10.1242/dev.02801.
[8] Wang X D,Angelis N,Thein S L. MYB-A regulatory factor in hematopoiesis[J].Gene,2018,665:6-17.doi:10.1016/j.gene.2018.04.065.
[9] Kaspar P,Prochazka J,Efenberkova M,Juhasz A,Novosadova V,Sedlacek R. c-Myb regulates tumorigenic potential of embryonal rhabdomyosarcoma cells[J].Scientific Reports,2019,9(1):6342.doi:10.1038/s41598-019-42684-y.
[10] Bender J,Fink G R. A Myb homologue,ATR1,activates tryptophan gene expression in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(10):5655-5660.doi:10.1073/pnas.95.10.5655.
[11] Allen R S,Li J Y,Stahle M I,Dubroué A,Gubler F,Millar A A.Genetic analysis reveals functional redundancy and the major target genes of the Arabidopsis miR159 family[J].PNAS,2007,104(41):16371-16376.doi:10.1073/pnas.0707653104.
[12] Wang B H,Luo Q,Li Y P,Yin L F,Zhou N N,Li X N,Gan J H,Dong A W.Structural insights into target DNA recognition by R2R3-MYB transcription factors[J].Nucleic Acids Research,2020,48(1):460-471.doi:10.1093/nar/gkz1081.
[13] Yan H L,Pei X N,Zhang H,Li X,Zhang X X,Zhao M H,Chiang V L,Sederoff R R,Zhao X Y. MYB-Mediated regulation of anthocyanin biosynthesis[J].Int J Mol Sci,2021,22(6):3103.doi:10.3390/ijms22063103.
[14] Ma D W,Constabel C P.MYB repressors as regulators of phenylpropanoid metabolism in plants[J].Trends in Plant Science,2019,24(3):275-289.doi:10.1016/j.tplants.2018.12.003.
[15] Chen L H,Hu B,Qin Y H,Hu G B,Zhao J T. Advance of the negative regulation of anthocyanin biosynthesis by MYB transcription factors[J]. Plant Physiology and Biochemistry,2019,136:178-187.doi:10.1016/j.plaphy.2019.01.024.
[16] Li L,Yu X F,Thompson A,Guo M,Yoshida S,Asami T,Chory J,Yin Y H.Arabidopsis MYB30 is a direct target of BES1 and cooperates with BES1 to regulate brassinosteroid-induced gene expression[J]. The Plant Journal,2009,58(2):275-286.doi:10.1111/j.1365-313X.2008.03778.x.
[17] Zhang J,Zhou H,Zhou M J,Ge Z L,Zhang F,Foyer C H,Yuan X X,Xie Y J.The coordination of guard-cell autonomous ABA synthesis and DES1 function in situ regulates plant water deficit responses[J].Journal of Advanced Research,2021,27:191-197.doi:10.1016/j.jare.2020.07.013.
[18] Seo P J,Park C M.MYB96-mediated abscisic acid signals induce pathogen resistance response by promoting salicylic acid biosynthesis in Arabidopsis[J].New Phytologist,2010,186(2):471-483.doi:10.1111/j.1469-8137.2010.03183.x.
[19] Kirik V,Lee M M,Wester K,Herrmann U,Zheng G,Oppenheimer D,Schiefelbein J,Hulskamp M. Functional diversification of MYB23 and GL1 genes in trichome morphogenesis and initiation[J].Development,2005,132(7):1477-1485.doi:10.1242/dev.01708.
[20] Li S F,Milliken O N,Pham H,Seyit R,Napoli R,Preston J,Koltunow A M,Parish R W.The Arabidopsis MYB5 transcription factor regulates mucilage synthesis,seed coat development,and trichome morphogenesis[J].The Plant Cell,2009,21(1):72-89.doi:10.1105/tpc.108.063503.
[21] Gonzalez A,Mendenhall J,Huo Y J,Lloyd A.TTG1 complex MYBs,MYB5 and TT2,control outer seed coat differentiation[J].Developmental Biology,2009,325(2):412-421.doi:10.1016/j.ydbio.2008.10.005.
[22] Baumann K,Perez-Rodriguez M,Bradley D,Venail J,Bailey P,Jin H,Koes R,Roberts K,Martin C.Control of cell and petal morphogenesis by R2R3 MYB transcription factors[J].Development,2007,134(9):1691-1701.doi:10.1242/dev.02836.
[23] Zhang Y F,Cao G Y,Qu L J,Gu H Y.Characterization of Arabidopsis MYB transcription factor gene AtMYB17 and its possible regulation by LEAFY and AGL15[J].Journal of Genetics and Genomics,2009,36(2):99-107. doi:10.1016/S1673-8527(08)60096-X.
[24] Coleto I,Bejarano I,Marí![]() A J,Medina J,Rioja C,Burow M,Marino D.Arabidopsis thaliana transcription factors MYB28 and MYB29 shape ammonium stress responses by regulating Fe homeostasis[J].New Phytologist,2021,229(2):1021-1035.doi:10.1111/nph.16918.
A J,Medina J,Rioja C,Burow M,Marino D.Arabidopsis thaliana transcription factors MYB28 and MYB29 shape ammonium stress responses by regulating Fe homeostasis[J].New Phytologist,2021,229(2):1021-1035.doi:10.1111/nph.16918.
[25] MacMillan C P,Birke H,Chuah A,Brill E,Tsuji Y,Ralph J,Dennis E S,Llewellyn D,Pettolino F A. Tissue and cell-specific transcriptomes in cotton reveal the subtleties of gene regulation underlying the diversity of plant secondary cell walls[J].BMC Genomics,2017,18(1):539.doi:10.1186/s12864-017-3902-4.
[26] Matías-Hern ndez L,Jiang W M,Yang K,Tang K X,Brodelius P E,Pelaz S.AaMYB1 and its orthologue AtMYB61 affect terpene metabolism and trichome development in Artemisia annua and Arabidopsis thaliana[J]. The Plant Journal,2017,90(3):520-534.doi:10.1111/tpj.13509.
ndez L,Jiang W M,Yang K,Tang K X,Brodelius P E,Pelaz S.AaMYB1 and its orthologue AtMYB61 affect terpene metabolism and trichome development in Artemisia annua and Arabidopsis thaliana[J]. The Plant Journal,2017,90(3):520-534.doi:10.1111/tpj.13509.
[27] Penfield S,Meissner R C,Shoue D A,Carpita N C,Bevan M W.MYB61 is required for mucilage deposition and extrusion in the Arabidopsis seed coat[J].The Plant Cell,2001,13(12):2777-2791.doi:10.1105/tpc.010265.
[28] Liang Y K,Dubos C,Dodd I C,Holroyd G H,Hetherington A M,Campbell M M.AtMYB61,an R2R3-MYB transcription factor controlling stomatal aperture in Arabidopsis thaliana[J].Current Biology,2005,15(13):1201-1206.doi:10.1016/j.cub.2005.06.041.
[29] Bucholc K,Skrajna A,Adamska K,Yang X C,Krajewski K,Poznański J,Dadlez M,Domiński Z,Zhukov I. Structural analysis of the SANT/Myb domain of FLASH and YARP proteins and their complex with the C-Terminal fragment of NPAT by NMR spectroscopy and computer simulations[J].International Journal of Molecular Sciences,2020,21(15):5268.doi:10.3390/ijms21155268.
[30] Ogata K,Hojo H,Aimoto S,Nakai T,Nakamura H,Sarai A,Ishii S,Nishimura Y. Solution structure of a DNA-binding unit of Myb:a helix-turn-helix-related motif with conserved tryptophans forming a hydrophobic core[J].PNAS,1992,89(14):6428-6432.doi:10.1073/pnas.89.14.6428.