番鸭细小病毒病是由番鸭细小病毒(Muscovy duck parvovirus,MDPV)引起的主要发生在3周内的雏番鸭的一种急性传染病,俗称番鸭“三周病”[1-3]。患病番鸭表现以腹泻、软脚和喘气为主要特征,发病率40%~50%,死亡率在50%~80%,对番鸭饲养业的危害极大[4-6]。MDPV为细小病毒科细小病毒亚科依赖细小病毒属成员,根据最新版ICTV病毒分类,MDPV 和与其亲缘关系密切的鹅细小病毒(Goose parvovirus,GPV)[7]被列为单一种,即雁形目依赖细小病毒1[8]。MDPV 基因组为约5.1 kb的单链DNA,基因组两端为末端倒置重复序列(ITR)[9]。基因组包含2 个开放阅读框(ORF),左侧ORF编码非结构蛋白NS,受P9启动子调控,通过对mRNA的选择性剪切可生成NS1以及NS2蛋白[10-11];右侧ORF 编码结构蛋白VP,受P41启动子调控,通过对mRNA选择性剪切以及起始密码子的选择性使用可编码VP1、VP2 和VP3 3个结构蛋白[12-13]。有研究表明,鸭真核翻译延伸因子1(Eukaryotic translation elongation factor 1A1,eEF1A1)可与鹅细小病毒VP1蛋白产生相互作用,并参与了GPV的增殖过程[14]。NS蛋白作为调节蛋白与MDPV的复制增殖有关,推测其可能与宿主eEF1A1产生互作。本研究通过大肠杆菌表达MDPV YL08株NS1蛋白、北京鸭eEF1A1蛋白和浙东白鹅eEF1A1蛋白,并通过GST pull-down 进行了体外验证重组蛋白NS1与水禽eEF1A1的相互作用试验,旨在为MDPV与宿主细胞蛋白互作及其复制机制的研究奠定一定的理论和物质基础。
1 材料和方法
1.1 试验材料
1.1.1 菌种、质粒和抗体 质粒pET-32a、pGEX-6P-1,E.coli菌种DH5α和Rosetta(DE3)由齐齐哈尔大学动物免疫学研究室保存。MDPV YL08株感染番鸭血清、HRP标记兔抗鸭IgG由齐齐哈尔大学动物免疫学研究室制备保存。辣根过氧化物酶(HRP)标记GST、His标签单克隆抗体购自Thermo Fisher公司。PierceTM GST Protein Interaction Pull-Down Kit购自Thermo Fisher公司。
1.1.2 主要试剂 T4 DNA连接酶、BamH Ⅰ和Xho Ⅰ限制性核酸内切酶购自TaKaRa公司。高保真KOFTaq酶、dNTP mix和4氯-1-奈酚(4-CN)购自哈尔滨超峰生物科技发展有限公司。异丙基硫代半乳糖苷(IPTG)、氨苄青霉素(Amp)购自北京索莱宝科技有限公司。质粒小提试剂盒、胶回收小提试剂盒购自Omega 公司。蛋白预染Marker购自Thermo Fisher公司。
1.2 试验方法
1.2.1 原核表达载体构建 参照GenBank中收录的北京鸭eEF1A1和浙东白鹅eEF1A1基因序列(GenBank登录号:XM_027454993、XM_013172141),根据大肠杆菌偏爱密码子进行优化,由苏州金唯智生物股份有限公司合成,合成质粒命名为pUC57-DeEF1A1和pUC57-GeEF1A1。合成基因的两端预留BamHⅠ和XhoⅠ限制性核酸内切酶酶切位点。北京鸭、浙东白鹅eEF1A1基因全长1 389 bp,编码462 个氨基酸。用BamHⅠ和XhoⅠ双酶切含有MDPV YL08株[15]NS1基因的重组质粒pUC57-NS1、pUC57-DeEF1A1和pUC57-GeEF1A1,回收目的片段NS1、DeEF1A1和GeEF1A1。利用T4 DNA连接酶将目的片段分别插入至pGEX-6p-1或pET-32a的BamHⅠ和XhoⅠ多克隆位点之间,转化DH5α,涂布固体LB平板(Amp,100 μg/mL),37 ℃培养14 h。挑取单个菌落于液体LB(Amp 100 μg/mL)中,37 ℃培养14 h,提取质粒。单(BamH Ⅰ)、双酶切(BamH Ⅰ和XhoⅠ)鉴定质粒。相应质粒由哈尔滨博仕生物科技有限公司进行序列测定。重组质粒分别命名为pGEX-DeEF1A1、pET-GeEF1A1、pET-NS1和pGEX-NS1。
1.2.2 重组蛋白的诱导表达 重组质粒pGEX-DeEF1A1、pET-GeEF1A1、pET-NS1和pGEX-NS1分别转化Rosetta(DE3),涂布含有Amp 100 μg/mL的固体LB平板。37 ℃培养12~14 h,挑取单菌落,获得重组菌株。重组菌首先接种含有Amp 100 μg/mL的液体LB培养基中,37 ℃振荡培养12~14 h。再以1%比例转接新鲜的含有Amp 100 μg/mL的液体LB培养基,37 ℃振荡培养至菌液OD600达0.5~0.6时,加入IPTG(终浓度至1.0 mmol/L),37 ℃继续振荡培养,分时段收获菌液沉淀,SDS-PAGE电泳分析重组蛋白表达情况。重组蛋白分别命名为GST-DeEF1A1、TRX-GeEF1A1、TRX-NS1和GST-NS1。
1.2.3 重组蛋白GST-DeEF1A1和TRX-GeEF1A1的纯化及鉴定 SDS-PAGE电泳后,参照文献[16]采用切胶纯化法纯化重组蛋白。采用Bradford检测法分别对重组蛋白的含量进行测定[17]。参照文献[16]的方法采用HRP标记的GST或His标签单克隆抗体进行Western Blot鉴定。
1.2.4 重组蛋白TRX-NS1和GST-NS1的纯化及鉴定 重组蛋白TRX-NS1和GST-NS1的纯化及HRP标记的GST或His标签单克隆抗体进行鉴定的过程同1.2.3。Western Blot鉴定重组蛋白TRX-NS1和GST-NS1的抗原性。纯化的重组蛋白经SDS-PAGE后电转印至NC膜上,采用5%脱脂乳溶液封闭,4 ℃过夜,用PBST溶液重复洗涤3次,10 min/次,浸入PBS溶液1∶200稀释的MDPV感染番鸭血清中,4 ℃过夜。弃去一抗稀释液,用PBST溶液洗涤NC膜3 遍,10 min/次。然后用PBS溶液洗涤NC膜1 遍,10 min/次。把NC膜浸入PBS溶液1∶1 000稀释的HRP标记兔抗鸭IgG中,4 ℃过夜。弃去二抗溶液,用无磷酸盐缓冲液洗涤NC膜,共3遍,10 min/次。将NC膜移至新鲜配制的4-CN溶液中,放入恒温箱中,37 ℃避光显色5 min。经观察,当显色颜色深度合适时,用去离子水洗涤,终止显色反应。
1.2.5 GST pull-down验证 GST-DeEF1A1与TRX-NS1、GST-NS1与TRX-GeEF1A1的互作。
1.2.5.1 诱饵蛋白的固定 参照PierceTM GST Protein Interaction Pull-Down Kit说明书,按照TBS 缓冲液和裂解液1∶1的体积比混合制备洗液;每对组合(GST-DeEF1A1/TRX-NS1、GST-NS1/TRX-GeEF1A1)设置1组试验组,5组对照组;吸取试剂盒中的谷胱甘肽琼脂糖树脂加入滤柱中,50 μL/滤柱;加入400 μL洗液,盖上顶帽,上下温和地颠倒8~10 次,使树脂充分平衡,打开底塞,把滤柱放入一个收集管中;室温下离心 1 min,5 000 r/min,弃掉收集管中的洗液,重新插入滤柱;重复上述洗涤步骤 4 次;将重组蛋白GST-DeEF1A1、GST-NS1和GST蛋白分别用洗液稀释至1 mg/mL;将每个滤柱底部盖上,顶部打开,将稀释好的重组蛋白GST-DeEF1A1、GST-NS1和GST蛋白500 μL加入滤柱中;4 ℃,温和摇动孵育30 min;去掉滤柱底部的塞子,将滤柱置于收集管中;室温5 000 r/min,离心 1 min;加入 600 μL的洗液,按照前述洗涤步骤重复洗涤 4 次。
1.2.5.2 重组蛋白TRX-NS1、TRX-GeEF1A1的捕获 将重组蛋白TRX-NS1、TRX-GeEF1A1和TRX蛋白分别用洗液稀释至1 mg/mL;向1.2.5.1中已经固定有重组蛋白GST-DeEF1A1、GST-NS1或GST蛋白的滤柱中加入稀释好的重组TRX-NS1蛋白或TRX蛋白样品 500 μL,4 ℃孵育1 h,每隔 10 min温和摇动1次;室温离心1 min,5 000 r/min;加入600 μL的洗液,按照前述洗涤步骤重复洗涤 4 次。
1.2.5.3 诱饵-捕获蛋白的洗脱 用洗液配置0.031 g/mL的谷胱甘肽洗脱缓冲液;向1.2.5.2中充分洗涤后的滤柱中加入 250 μL的洗脱液,不断地温和摇动,作用 5 min,室温5 000 r/min,离心1 min,收集管内液体置于冰上保存。
1.2.5.4 洗脱液Western Blot分析 将1.2.5.3制备的洗脱液进行Western Blot分析。将转印有上述各组洗脱液成分的NC膜放入含5%脱脂乳的封闭液中4 ℃封闭过夜。将封闭液倒掉,用PBST洗涤NC膜,共3遍,10 min/次。然后用PBS洗涤NC膜1 遍,10 min。然后将其放入10 mL同时含有1∶100 PBS稀释HRP标记的His和GST标签的混合单克隆抗体,4 ℃过夜。弃去混合单抗稀释液。用PBST洗涤NC膜2 遍,10 min/次。然后用PBS洗涤NC膜1 遍,10 min/次。将NC膜移至新鲜配制的4-CN溶液中,放入37 ℃恒温箱中,避光显色,5 min后观察,去离子水洗涤使反应终止。
1.2.6 水禽eEF1A1的氨基酸序列比对及3D结构建模 使用DNAMAN软件对北京鸭eEF1A1与浙东白鹅eEF1A1氨基酸序列进行比对。通过SWISS-MODEL(https://swissmodel.expasy.org/interactive/)进行2 种eEF1A1的3D结构同源建模。
2 结果与分析
2.1 重组质粒酶切鉴定
构建的重组质粒pET-GeEF1A1、pET-NS1、pGEX-DeEF1A1和pGEX-NS1分别采用BamHⅠ单酶切和BamHⅠ、XhoⅠ双酶切,经琼脂糖凝胶电泳检测,结果表明,酶切结果与预期一致。测序结果表明,目的基因插入载体的位置和阅读框均正确。
2.2 重组蛋白的表达
重组质粒分别转化Rosetta(DE3),IPTG诱导后1,2,3,4 h分时段进行取样,SDS-PAGE结果表明,获得了重组蛋白GST-DeEF1A1、TRX-GeEF1A1、TRX-NS1和GST-NS1的表达,分子量分别为76.9,67.9,89.5,98.6 ku,与预期相符(图1,箭头所示)。
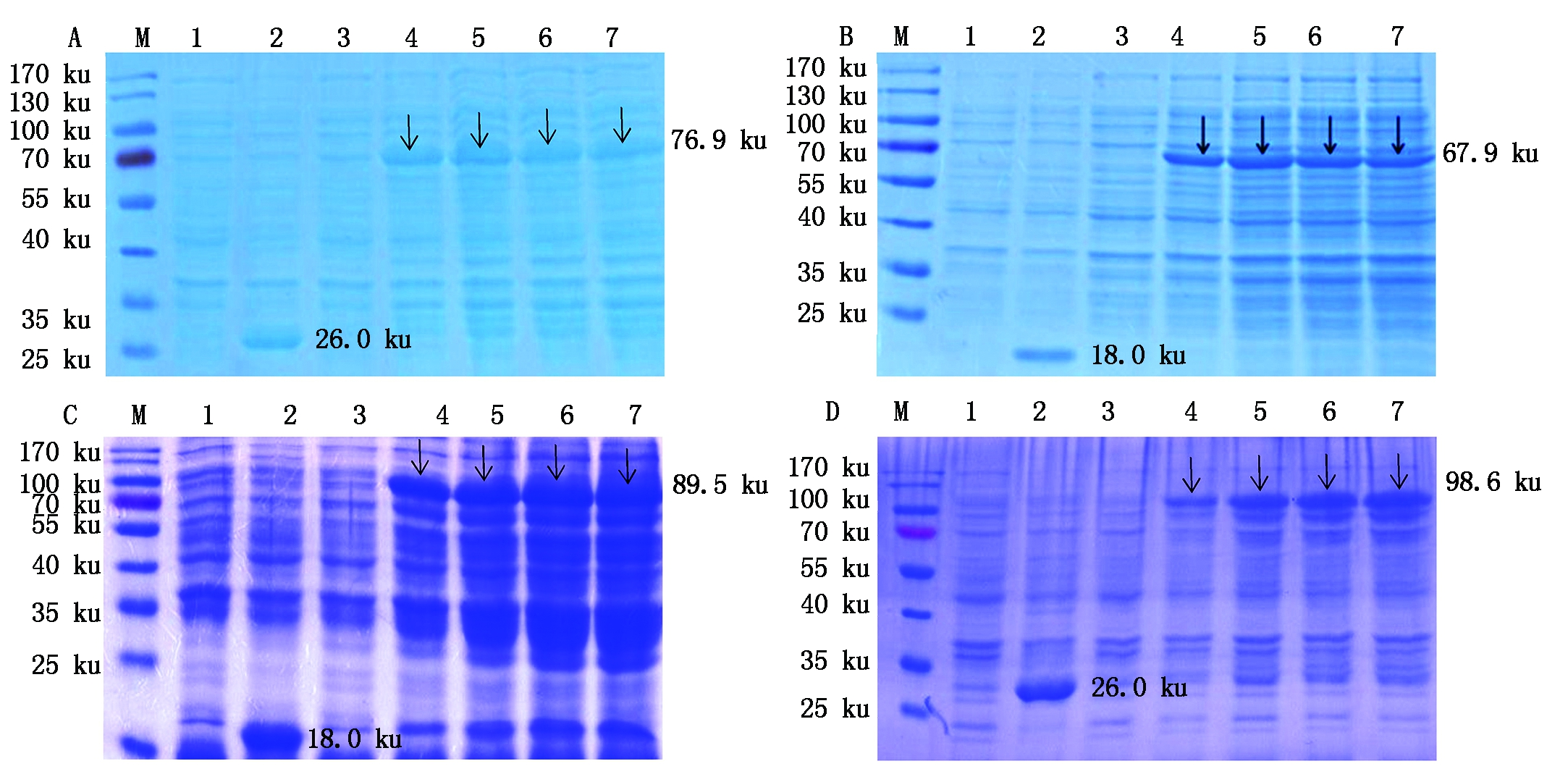
A.SDS-PAGE检测重组蛋白GST-DeEF1A1的表达:M.蛋白Marker;1.诱导前的pGEX-6p-1/E.coli Rosetta(DE3);2.诱导后4 h的pGEX-6p-1/E.coli Rosetta(DE3);3.未诱导的pGEX-DeEF1A1/E. coli Rosetta(DE3)重组菌;4-7. 诱导1~4 h的pGEX-DeEF1A1/E. coli Rosetta(DE3)重组菌。B. SDS-PAGE检测重组蛋白TRX-GeEF1A1的表达:M.蛋白Marker;1.诱导前的pET-32a/E.coli Rosetta(DE3);2.诱导后4 h的pET-32a/E.coli Rosetta(DE3);3.未诱导的pET-GeEF1A1/E. coli Rosetta(DE3)重组菌;4-7. 诱导1~4 h的pET-GeEF1A1/E. coli Rosetta(DE3)重组菌。C.SDS-PAGE检测重组蛋白TRX-NS1的表达:M.蛋白Marker;1.诱导前的pET-32a/E.coli Rosetta(DE3);2.诱导后4 h的pET-32a/E.coli Rosetta(DE3);3.未诱导的pET-NS1/E.coli Rosetta(DE3)重组菌;4-7.诱导1~4 h的pET-NS1/E. coli Rosetta(DE3)重组菌。D.SDS-PAGE检测重组蛋白GST-NS1的表达。M.蛋白Marker;1.诱导前的pGEX-6p-1/E.coli Rosetta(DE3);2. 诱导后4 h的pGEX-6p-1/E.coli Rosetta(DE3);3. 未诱导的pGEX-NS1/E.coli Rosetta(DE3)重组菌;4-7. 诱导1~4 h的pGEX-NS1/E. coli Rosetta(DE3)重组菌。
A.Detection of recombinant protein GST-DeEF1A1 by SDS-PAGE:M. Protein Marker;1.pGEX-6p-1/E.coli Rosetta(DE3)before induction;2. pGEX-6p-1/E.coli Rosetta(DE3)induced for 4 h;3. pGEX-DeEF1A1/E. coli Rosetta(DE3)before induction;4-7. pGEX-DeEF1A1/E. coli Rosetta(DE3)induced for 1-4 h.B.Detection of recombinant protein TRX-GeEF1A1 by SDS-PAGE:M. Protein Marker;1.pET-32a/E.coli Rosetta(DE3)before induction;2. pET-32a/E.coli Rosetta(DE3)induced for 4 h;3. pET-GeEF1A1/E. coli Rosetta(DE3)before induction;4-7. pET-GeEF1A1/E. coli Rosetta(DE3)induced for 1-4 h.C.Detection of recombinant protein TRX-NS1 by SDS-PAGE:M. Protein Marker;1. pET-32a/E.coli Rosetta(DE3)before induction;2.pET-32a/E.coli Rosetta(DE3)induced for 4 h;3. pET-NS1/E. coli Rosetta(DE3)before induction;4-7. pET-NS1/E. coli Rosetta(DE3)induced for 1-4 h.D.Detection of recombinant protein GST-NS1 by SDS-PAGE:M. Protein Marker;1.pGEX-6p-1/E.coli Rosetta(DE3)before induction;2.pGEX-6p-1/E.coli Rosetta(DE3)induced for 4 h;3. pGEX-NS1/E. coli Rosetta(DE3)before induction;4-7. pGEX-6p-NS1/E. coli Rosetta(DE3)induced for 1-4 h.
图1 重组蛋白的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of recombinant protein
2.3 重组蛋白GST-DeEF1A1和TRX-GeEF1A1的鉴定
基于GST、His标签单克隆抗体的Western Blot鉴定的结果表明,所获得的表达蛋白为重组目的蛋白(图2)。Bradford法测定重组蛋白GST-DeEF1A1的浓度为1.13 mg/mL,获得重组蛋白TRX-GeEF1A1的浓度为1.31 mg/mL。
2.4 重组蛋白TRX-NS1和GST-NS1的纯化及鉴定
重组蛋白TRX-NS1和GST-NS1切胶纯化。经GST、His标签单克隆抗体鉴定的结果表明,所获得的表达蛋白为重组目的蛋白。重组蛋白TRX-NS1和GST-NS1可与MDPV感染番鸭血清特异性结合,抗原性良好(图3)。采用Bradford检测法对重组蛋白的含量进行测定,获得重组蛋白TRX-NS1和GST-NS1浓度分别为1.33,1.26 mg/mL。
2.5 GST pull-down验证GST-DeEF1A1与TRX-NS1、GST-NS1与TRX-GeEF1A1的互作
GST-DeEF1A1+TRX-NS1试验组洗脱液经Western Blot 分析,与抗His和抗GST的混合单克隆抗体作用,分别得到89.5 ku大小的重组蛋白TRX-NS1的条带和76.9 ku大小的GST-DeEF1A1重组蛋白条带;对照组GST-DeEF1A1+TRX的洗脱液经Western Blot 分析得到大小为76.9 ku的重组蛋白GST-DeEF1A1条带;对照组GST+TRX-NS1的洗脱液经Western Blot 分析得到大小为26.8 ku的标签蛋白GST条带;对照组GST+TRX的洗脱液经Western Blot 分析得到大小为26.8 ku的标签蛋白GST条带(图4-A)。上述结果说明MDPV NS1蛋白可以和北京鸭eEF1A1在体外相互作用。
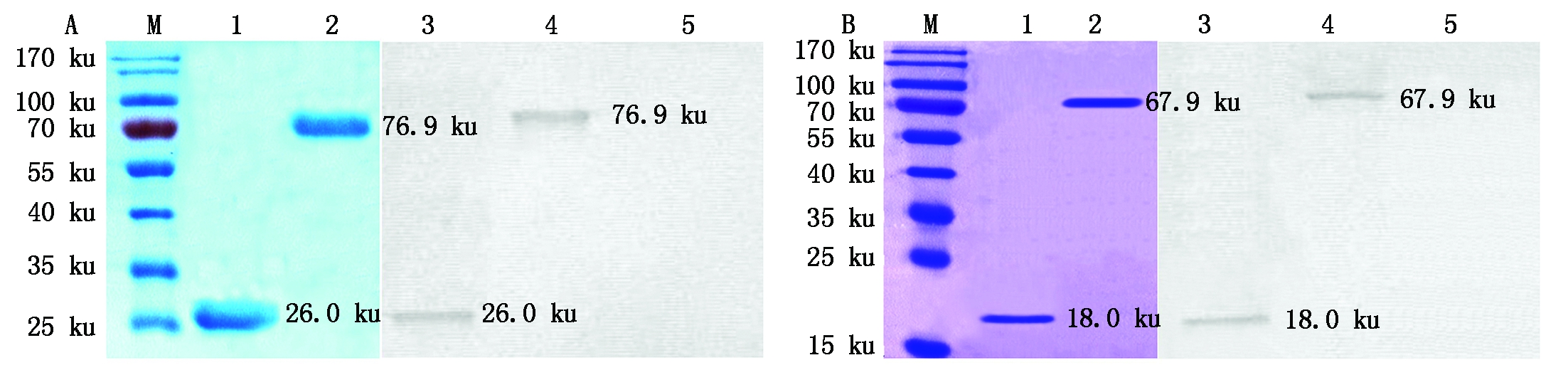
A.重组蛋白GST-DeEF1A1纯化和鉴定结果:M. 蛋白质Marker;1.GST标签蛋白;2.GST-DeEF1A1;3.GST蛋白;4.GST-DeEF1A1;5.TRX蛋白。B.重组蛋白TRX-GeEF1A1纯化和鉴定结果:M.蛋白质Marker;1.TRX标签蛋白;2.TRX-GeEF1A1;3.TRX蛋白;4.TRX-GeEF1A1;5.GST蛋白。
A.Purification and identification of recombinant protein GST-DeEF1A1:M.Protein Marker;1.GST protein;2.GST-DeEF1A1;3.GST protein;4.GST-DeEF1A1;5.TRX protein.B.Purification and identification of recombinant protein TRX-GeEF1A1:M.Protein Marker;1.TRX protein;2.TRX-GeEF1A1;3.TRX protein;4.TRX-GeEF1A1;5.GST protein.
图2 重组蛋白GST-DeEF1A1和TRX-GeEF1A1的纯化及鉴定
Fig.2 Purification and identification of recombinant protein GST-DeEF1A1 and TRX-GeEF1A1

M. 蛋白质Marker;1.纯化的TRX标签蛋白;2. 纯化的TRX-NS1蛋白;3. 纯化的GST标签蛋白;4. 纯化的GST-NS1蛋白;5. His单抗鉴定TRX标签蛋白;6. His单抗鉴定TRX-NS1蛋白;7. GST标签蛋白;8. GST单抗鉴定GST标签蛋白;9. GST单抗鉴定GST-NS1;10. TRX标签蛋白;11. TRX标签蛋白;12. GST标签蛋白;13. MDPV感染血清鉴定TRX-NS1;14. MDPV感染血清鉴定GST-NS1。
M. Protein Marker;1. Purified TRX protein;2. Purified TRX-NS1 protein;3. Purified GST protein;4. Purified GST-NS1 protein;5. TRX protein identified by anti-His MoAb;6. TRX-NS1 protein identified by anti-His MoAb;7. GST protein;8. GST protein identified by anti-GST MoAb;9. GST-NS1 protein identified by anti-GST MoAb;10. TRX protein;11. TRX protein;12. GST protein;13. TRX-NS1 protein identified by anti-MDPV sera;14. GST-NS1 identified by anti-MDPV sera.
图3 重组蛋白TRX-NS1和GST-NS1的纯化及鉴定
Fig.3 Purification and identification of recombinant protein TRX-NS1 and GST-NS1
GST-NS1+TRX-GeEF1A1试验组洗脱液经 Western Blot 分析,与抗His和抗GST的混合单克隆抗体作用,仅得到98.6 ku大小的重组蛋白GST-NS1的条带;对照组GST-NS1+TRX的洗脱液经Western Blot 分析得到大小为98.6 ku的重组蛋白GST-NS1条带;对照组GST+ TRX-GeEF1A1的洗脱液经Western Blot 分析得到大小为26.8 ku的标签蛋白GST条带;对照组GST +TRX的洗脱液经Western Blot 分析得到大小为26.8 ku的标签蛋白GST条带(图4-B)。上述结果说明MDPV NS1蛋白不能和浙东白鹅eEF1A1在体外相互作用。
2.6 水禽eEF1A1的氨基酸序列比对及3D结构建模
氨基酸序列比对结果显示,北京鸭eEF1A1与浙东白鹅eEF1A1蛋白相似性为98.7%,只是在102-106 aa,108 aa有差异,北京鸭eEF1A1为102MITGT106Q108,浙东白鹅eEF1A1为102LFSFF106K108,其他位置完全一致(图5)。
3D结构建模结果如图6所示。2种蛋白空间结构高度类似,主要包含4个结构域,其中第一结构域和第二结构域富含α螺旋结构,第二结构域和第四结构域富含β折叠结构。二者在一维结构上的差异蛋白102MITGT106Q108形成第二结构域的第一个α螺旋结构(圆圈处)。
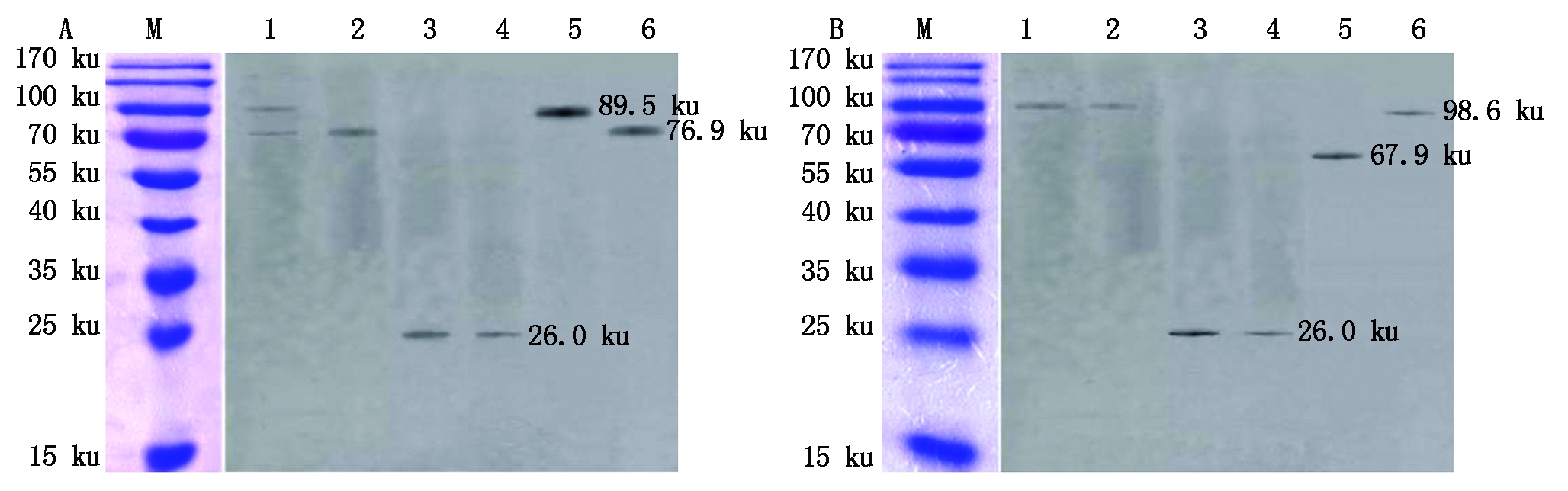
A:M.蛋白Marker;1.GST-DeEF1A1+TRX-NS1;2.GST-DeEF1A1+TRX;3.GST+TRX-NS1;4.GST+TRX;5.TRX-NS1 input;6.柱子空载GST-DeEF1A1。B:M.蛋白Marker;1.GST-NS1+TRX-GeEF1A1;2.GST-NS1+TRX;3.GST+TRX-GeEF1A1;4.GST+TRX;5.TRX-GeEF1A1 input;6.柱子空载GST-NS1。
A:M.Protein Marker;1.GST-DeEF1A1+TRX-NS1;2.GST-DeEF1A1+TRX;3.GST+TRX-NS1;4.GST+TRX;5.TRX-NS1 input;6.Column combined with GST-DeEF1A1.B:M.Protein Marker;1.GST-NS1+TRX-GeEF1A1;2.GST-NS1+TRX;3.GST+TRX-GeEF1A1;4.GST+TRX;5.TRX-GeEF1A1 input;6.Column combined with GST-NS1.
图4 GST pull-down验证GST-DeEF1A1与TRX-NS1、GST-NS1与TRX-GeEF1A1的互作
Fig.4 GST pull-down to verify the interaction between GST-DeEF1A1 and TRX-NS1,GST-NS1 and TRX-GeEF1A1

图5 水禽eEF1A1氨基酸序列相似性比对
Fig.5 Amino acid sequence similarity alignment of waterfowl eEF1A1
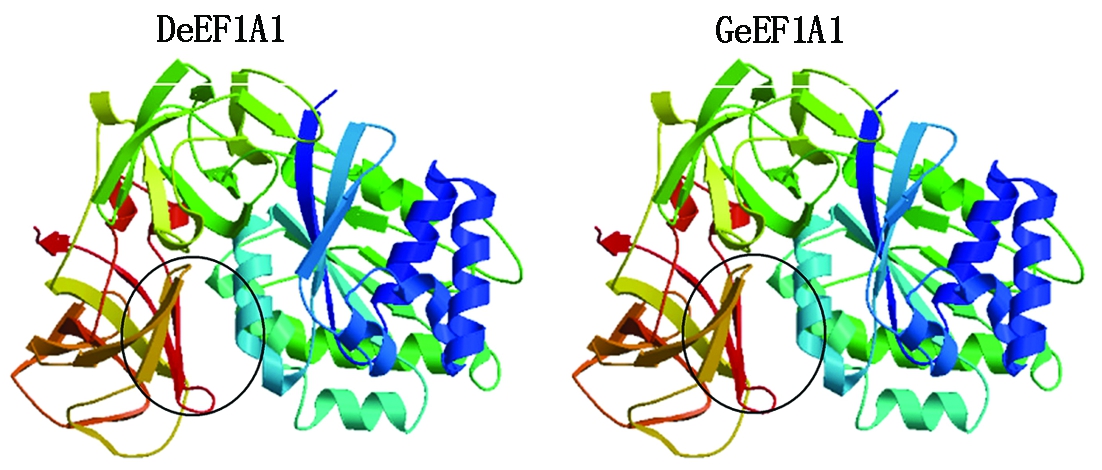
图6 水禽eEF1A1的3D结构建模
Fig.6 3D structural modeling of waterfowl eEF1A1
3 结论与讨论
真核翻译延伸因子包括eEF1A(eukaryotic translation elongation factor 1A)、eEF1B(eukaryotic translation elongation factor 1B)和eEF2(eukaryotic translation elongation factor 2),三者共同参与蛋白质合成过程,发挥肽链延伸作用[18]。eEF1A包含eEF1A1和eEF1A2 2种亚型。eEF1A1和eEF1A2在多肽延伸过程中承担相似的功能,但二者表达模式具有一定的组织差异性[19-20]。eEF1A在细胞增殖、凋亡以及肿瘤发生和病毒复制方面也发挥着重要作用[21],其中eEF1A参与RNA病毒复制的报道较多,而参与DNA病毒生命周期过程的报道较少。张双[14]采用GST pull-down技术证明鸭eEF1A1与GPV VP1可形成蛋白复合物,前者可影响GPV在鸭胚成纤维细胞表面的吸附,并具有抑制GPV增殖作用。而后,又将pcDNA3.0-eEF1A1转染到鸭胚成纤维细胞中,同时用GPV感染细胞,证明在细胞内,eEF1A1表达量的增加可促进GPV增殖。推测eEF1A1可能是在GPV启动子代病毒复制过程中起辅助作用。本研究通过GST pull-down 技术验证重组NS1蛋白与水禽eEF1A1的相互作用,分析结果表明,MDPV NS1蛋白可以和北京鸭eEF1A1在体外相互作用而不能与浙东白鹅eEF1A1在体外相互作用。北京鸭eEF1A1与浙东白鹅eEF1A1只是在102-106 aa和108 aa有差异,北京鸭eEF1A1为 102MITGT106Q108,浙东白鹅eEF1A1为102LFSFF106K108,其他位置完全一致,推测NS1蛋白与北京鸭eEF1A1、浙东白鹅eEF1A1在体外互作的差异性可能与这7个氨基酸有关。通过SWISS-MODEL进行水禽eEF1A1的同源3D结构建模结果表明,2种蛋白空间结构高度类似,二者在一维结构上的差异蛋白102MITGT106Q108(102LFSFF106K108)形成第二结构域的第一个α螺旋结构。推测该螺旋结构与第二结构域其他2个α螺旋所围成的空腔可能是MDPV NS1蛋白与水禽eEF1A1的互作结合位点;第二结构域的第一个α螺旋结构的差异可能是MDPV NS1蛋白可以和北京鸭eEF1A1在体外相互作用而不能与浙东白鹅eEF1A1在体外相互作用的原因。
[1] 林锋强,程晓霞,朱小丽,陈少莺,江丹丹. 福建省番鸭细小病毒病流行病学及病原研究[J].中国家禽,2019,41(13):15-19. doi:10.16372/j.issn.1004-6364.2019.13.004.
Lin F Q,Cheng X X,Zhu X L,Chen S Y,Jiang D D. Epidemiology and pathogen of Muscovy duck parvovirus disease in Fujian Province[J].China Poultry,2019,41(13):15-19.
[2] Wang J Y,Mi Q L,Wang Z X,Jia J Y,Li Y L,Zhu G Q. Sole recombinant muscovy duck parvovirus infection in muscovy ducklings can form characteristic intestinal embolism[J].Veterinary Microbiology,2020,242:108590. doi:10.1016/j.vetmic.2020.108590.
[3] Wan C H,Cheng L F,Chen C T,Liu R C,Shi S H,Fu G H,Chen H M,Fu Q L,Huang Y.A duplex PCR assay for the simultaneous detection and differentiation of Muscovy duck parvovirus and goose parvovirus[J].Molecular and Cellular Probes,2019,47:101439. doi:10.1016/j.mcp.2019.101439.
[4] 甘一波. 2016-2018年广西病死番鸭细小病毒感染检测[J].中国动物检疫,2019,36(6):12-15. doi:10.3969/j.issn.1005-944X.2019.06.004.
Gan Y B. Detection of parvovirus infection in dead muscovy ducks in Guangxi from 2016 to 2018[J].China Animal Health Inspection,2019,36(6):12-15.
[5] Wan C H,Shi S H,Chen C T,Chen H M,Cheng L F,Fu Q L,Fu G H,Liu R C,Huang Y. Development of a PCR assay for detection and differentiation of Muscovy duck and goose parvoviruses based on NS gene characterization[J].The Journal of Veterinary Medical Science,2018,80(12):1861-1866. doi:10.1292/jvms.18-0256.
[6] Wan C H,Chen C T,Cheng L F,Chen H M,Fu Q L,Shi S H,Fu G H,Liu R C,Huang Y. Specific detection of Muscovy duck parvovirus infection by TaqMan-based Real-time PCR assay[J].BMC Veterinary Research,2018,14(1):267. doi:10.1186/s12917-018-1600-3.
[7] 朱新产,邵艳红,朱峰伟,杨丽金.鹅细小病毒感染雏鹅的免疫球蛋白IgG/IgM变异性研究[J].华北农学报,2015,30(1):42-53. doi:10.7668/hbnxb.2015.01.008.
Zhu X C,Shao Y H,Zhu F W,Yang L J. Study on the molecular variability of immunoglobulin IgG/IgM from goslings infected Goose parvovirus[J].Acta Agriculturae Boreali-Sinica,2015,30(1):42-53.
[8] Shen H Q,Huang J F,Yan Z Q,Yin L J,Li Q H,Zhou Q F,Chen F. Isolation and characterization of a recombinant muscovy duck parvovirus circulating in muscovy ducks in South China[J].Archives of Virology,2020,165(12):2931-2936. doi:10.1007/s00705-020-04829-7.
[9] Wang J Y,Wang Z X,Jia J Y,Ling J Y,Mi Q L,Zhu G Q. Retrospective investigation and molecular characteristics of the recombinant Muscovy duck parvovirus circulating in muscovy duck flocks in China[J].Avian Pathology,2019,48(4):343-351. doi:10.1080/03079457.2019.1605145.
[10] Li P,Lin S,Zhang R,Chen J,Sun D,Lan J,Song S,Xie Z,Jiang S. Isolation and characterization of novel Goose parvovirus-related virus reveal the evolution of waterfowl parvovirus[J].Transboundary and Emerging Diseases,2018,65(2):e284-e295. doi:10.1111/tbed.12751.
[11] Dong J W,Bingga G L,Sun M H,Li L L,Liu Z C,Zhang C H,Guo P J,Huang Y,Zhang J F. Application of high-resolution melting curve analysis for identification of Muscovy duck parvovirus and goose parvovirus[J].Journal of Virological Methods,2019,266:121-125. doi:10.1016/j.jviromet.2018.12.018.
[12] Wang J Y,Ling J Y,Wang Z X,Huang Y,Zhu J Z,Zhu G Q. Molecular characterization of a novel Muscovy duck parvovirus isolate:evidence of recombination between classical MDPV and Goose parvovirus strains[J].BMC Veterinary Research,2017,13(1):327. doi:10.1186/s12917-017-1238-6.
[13] Lin S,Wang S,Cheng X X,Xiao S F,Chen X Q,Chen S L,Chen S Y,Yu F S. Development of a duplex SYBR Green I-based quantitative real-time PCR assay for the rapid differentiation of Goose and Muscovy duck parvoviruses[J].Virology Journal,2019,16(1):6. doi:10.1186/s12985-018-1111-7.
[14] 张双. 鸭胚成纤维细胞翻译延伸因子对鹅细小病毒增殖的影响[D].长春:吉林农业大学,2015.
Zhang S. Influence of translation extension factor in DEF on proliferation of Goose parvovirus[D].Changchun:Jilin Agricultural University,2015.
[15] Yu T F,Li M.Identification of recombination among VP1 gene of Muscovy duck parvovirus from the Mainland of China[J].Veterinary Microbiology,2016,195:78-80. doi:10.1016/j.vetmic.2016.09.010.
[16] 于天飞,董慧莹,谢鹏宇,孙婉姝,尹海畅,黎明,于志丹. 猪传染性胃肠炎病毒膜蛋白亲和肽的原核表达及其病毒亲和性分析[J].华北农学报,2019,34(5):224-230. doi:10.7668/hbnxb.201751554.
Yu T F,Dong H Y,Xie P Y,Sun W S,Yin H C,Li M,Yu Z D. Prokaryotic expression of affinity peptides to membrane protein of Transmissible gastroenteritis virus and analysis of viral affinity activity[J].Acta Agriculturae Boreali-Sinica,2019,34(5):224-230.
[17] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:42-46.
Wang J Z,Fan M. Protein technology handbook[M].Beijing:Science Press,2000:42-46.
[18] White K M,Rosales R,Yildiz S,Kehrer T,Miorin L,Moreno E,et al.Plitidepsin has potent preclinical efficacy against SARS-CoV-2 by targeting the host protein eEF1A[J].Science,2021,371(6532):926-931.doi:10.1126/science.abf4058.
[19] Hassan M K,Kumar D,Patel S A,Dixit M.EEF1A2 triggers stronger ERK mediated metastatic program in ER negative breast cancer cells than in ER positive cells[J].Life Sciences,2020,262:118553. doi:10.1016/j.lfs.2020.118553.
[20] Guo M,Li Y N,Wang Y,Li Z K,Li X H,Zhao P K,Li C L,Lü J,Liu X,Du X Y,Chen Z W.eEF1A2 exacerbated insulin resistance in male skeletal muscle via PKCβ and ER stress[J].The Journal of Endocrinology,2020,244(1):25-40. doi:10.1530/JOE-19-0051.
[21] Abbas W,Kumar A,Herbein G.The eEF1A proteins:At the crossroads of oncogenesis,apoptosis,and viral infections[J].Frontiers in Oncology,2015,5:75. doi:10.3389/fonc.2015.00075.