猪链球菌病属于国家规定的二类动物疫病,是由猪链球菌(Streptococcus suis,SS)感染引起的人畜共患传染病。该病以急性败血症、关节炎、脑膜炎和急性死亡为主要特征,各年龄段的猪均可发病,且对低日龄仔猪危害尤为严重,临床上猪链球菌常与猪繁殖与呼吸综合征病毒、猪圆环病毒2型和副猪嗜血杆菌混合感染或继发感染,导致猪群发病率和死亡率明显上升,严重制约我国乃至世界生猪养殖业的健康发展[1]。感染猪链球菌的病猪及其相关制品具有传染性,主要感染养殖业和食品加工从业者,引起脑膜炎、心内膜炎、中毒性休克,甚至死亡,死亡率可达17.8%,给全球公共卫生安全带来巨大隐患[2-3]。快速高效的早期诊断对传染性疾病的控制与治疗具有重要作用,因此,开展猪链球菌新型检测技术的研究,丰富猪链球菌检测技术平台,对防止猪链球菌的传播与流行,保障我国生猪养殖业的发展及从业人员的健康具有重要意义。
根据菌体荚膜的抗原特性,目前,猪链球菌共有35个血清型(1~34型和1/2型),其中2型(SS2)分布范围最广、毒力最强,对猪的致死率最高,血清1、7和9型也是目前临床上较常见的致病血清型,猪链球菌往往多种血清型混合感染或先后感染[4]。猪链球菌的检测方法包括病原学诊断和血清学诊断,其中病原学诊断主要以细菌分离鉴定、普通PCR、荧光定量PCR等分子生物学手段为主。细菌分离鉴定是细菌性传染病诊断的金标准,但该过程繁琐费时费力,加之临床多病原混合感染严重,样品采集和保存不当常常导致病原菌分离失败。猪链球菌的血清学诊断方法主要有凝集试验、ELISA、胶体金免疫层析方法、荧光检测方法等,这类方法简便快速,但与分子生物学检测方法相比,灵敏度相对较低,假阳性较多[5-7]。猪链球菌的主要毒力因子谷氨酸脱氢酶 (Glutamate dehydrogenase,GDH),具有良好的免疫原性,且编码基因保守性较好,常作为猪链球菌分子生物学检测的靶标基因[8]。目前,已建立多种关于猪链球菌的PCR检测方法,其中普通PCR具有经济、高效的特点,使用频率较高,但该方法检测敏感性相对较低,无法适应微量检测需求,荧光定量PCR检测灵敏度比普通PCR高10倍以上,但仪器设备及试剂耗材昂贵,基层推广应用较难[9]。近年来,随着材料学的高速发展,研究发现纳米材料除了在药物、疫苗等生命领域具有重要作用,也适用于检测试剂盒开发,如纳米PCR技术。纳米PCR技术是纳米材料学与现代分子生物学相结合的新型技术,通过在PCR反应体系中添加一定量的纳米金属颗粒,利用其加强启动DNA聚合酶、调节DNA聚合酶活性、增强体系导热性能等特点,缩短反应时间,促进特异性产物的扩增,提高PCR检测方法的灵敏度[10]。目前,该新型检测技术已逐步应用到非洲猪瘟、猪流行性乙型脑炎、禽传染性关节炎及犬细小病毒感染等动物疫病的检测中,但该技术在细菌性疫病中的应用鲜见报道[11-14]。因此,本研究旨在针对SS感染,试图寻求一种更高效、更快捷的检测方法,通过加入纳米颗粒建立猪链球菌纳米PCR检测技术,为我国猪链球菌的基层防控及检验检疫提供技术储备。
1 材料和方法
1.1 主要试剂
胰蛋白胨大豆肉汤培养基(TSB)为OXOID公司产品,新生犊牛血清为四季青生物制品有限公司产品,烟酰胺腺嘌呤二核苷酸(NAD)为南京生兴生物技术有限公司产品。细菌DNA提取试剂盒为大连宝生物科技有限公司产品,2×PCR Buffer、Taq酶、DL2000 DNA Marker等为南京诺唯赞生物科技有限公司产品,纳米PCR试剂盒为上海沪峥生物科技有限公司产品。
1.2 菌株
血清1、2、7和9型的猪链球菌(SS)、血清7型的猪胸膜肺炎放线杆菌(APP)、血清5型的副猪嗜血杆菌(H.parasuis)、猪大肠杆菌(swine E.coli)、猪沙门氏菌(S.suis)、猪葡萄球菌(S.hyicus)由广东省农业科学院动物卫生研究所猪病研究室提供。
1.3 细菌培养与基因组DNA提取
用TSB培养基(含10%犊牛血清,30 mg/L NAD)37 ℃ 220 r/min分别培养1.2的菌株12 h,12 000 r/min离心5 min获得细菌团块。按照1.1中的细菌DNA提取试剂盒说明书,抽提不同细菌的DNA,经紫外线分光光度计测定浓度后,保存在-20 ℃备用。
1.4 猪链球菌纳米PCR引物设计与合成
以猪链球菌谷氨酸脱氢酶基因(gdh)为模板,用Primer 5.0软件设计特异性引物,SS-F:5′-CATGGACAGATAAAGATGGA-3′,SS-R:5′-CAGCGTATTCTGTCAAACGA-3′,目的片段大小为687 bp,经生工生物工程(上海)股份有限公司合成引物,用ddH2O将引物稀释至10 pmol/μL,保存在-20 ℃备用。
1.5 猪链球菌纳米PCR反应体系优化
以猪链球菌的DNA为模板,PCR扩增SS的gdh基因。纳米PCR反应体系与普通PCR反应体系均预设定为16.0 μL:10 pmol/μL的上、下游引物各1 μL、dNTPs(2.5 mmol/L)1 μL、MgCl2(25 mmol/L)1 μL、PCR Taq酶(5 U/μL)0.2 μL、DNA(50 ng/μL)1 μL、 ddH2O 补齐,纳米PCR使用2×Nano PCR Buffer,普通PCR反应使用2×PCR Buffer,均各加8 μL。扩增程序为:94 ℃ 30 s,60 ℃ 35 s,72 ℃ 40 s,35个循环。PCR产物用1%琼脂糖凝胶分离,并用天能凝胶成像系统拍照。
利用梯度PCR仪依次优化退火温度和引物浓度,根据琼脂糖核酸电泳结果,判定最佳的退火温度和引物浓度,明确纳米PCR反应体系。设定梯度PCR仪的退火温度为51~60 ℃,按照预设反应体系加样后,进行PCR反应,确定最佳退火温度;保持细菌DNA及其他组分用量不变,依次增加引物浓度,引物使用量从0.6 μL开始,以0.1 μL递增至1.9 μL,按照已确定的退火温度进行PCR反应,明确最佳引物浓度。
1.6 猪链球菌纳米PCR特异性试验
以临床常见的几种主要的猪细菌性病原,SS(2型)、APP(7型)、H. parasuis (5型)、swine E. coli、S. suis、S. hyicus的DNA为模板,按已优化的纳米PCR反应条件进行PCR扩增,判定该方法对猪链球菌的特异性。同时,提取猪链球菌在我国流行的其他主要致病血清型菌株,1(SS-1型)、7(SS-7型)和9型(SS-9)的基因组DNA,并用该方法进行检测,判定本研究建立的纳米PCR方法对猪链球菌不同血清型菌株的特异性。
1.7 猪链球菌纳米PCR敏感性试验
取培养过夜的SS菌液,通过倍比稀释后进行平板计数,根据菌液浓度,将细菌调整至1×109 cfu/mL,然后10倍浓度梯度稀释至1×10 cfu/mL,按照1.5已优化的反应体系分别进行纳米PCR、普通PCR扩增。PCR产物经琼脂糖核酸电泳后,比较纳米PCR和普通PCR对SS检测敏感度,重复3次试验。
1.8 猪链球菌纳米PCR重复性试验
提取猪链球菌(1×106 cfu/mL)基因组DNA,并将其稀释10,100倍,以上述3个梯度的DNA作为模板,每个浓度梯度设3个重复,进行重复性试验。
1.9 猪链球菌临床样品检测
提取疑似猪链球菌感染的44份临床样品的DNA,分别用普通PCR及本研究建立的纳米PCR方法进行样品检测,并统计阳性率。
2 结果与分析
2.1 猪链球菌纳米PCR反应体系及条件的优化
依次优化退火温度(图1)和引物浓度(图2)后,猪链球菌纳米PCR的反应体系如下:上、下游引物(10 pmol/μL)各1.1 μL、dNTPs(2.5 mmol/L)1 μL、MgCl2(25 mmol/L)1 μL、Taq酶(5 U/μL)0.2 μL、DNA(50 ng/μL)1 μL、2×Nano PCR Buffer 8.0 μL、ddH2O补足16.0 μL。扩增程序为:94 ℃ 30 s,53 ℃ 35 s,72 ℃ 40 s,循环35个反应。
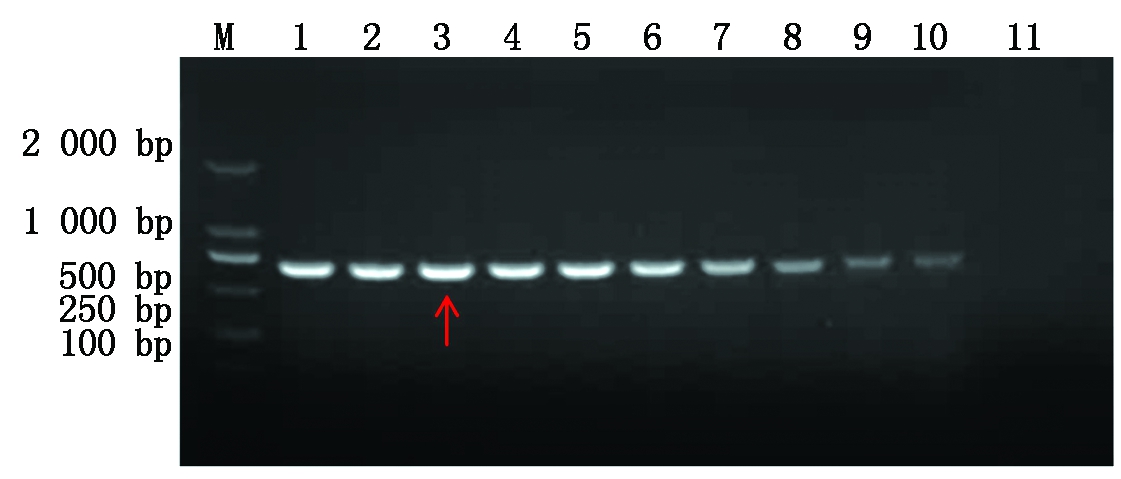
M.DNA分子质量标准DL2000;1-10.51~60 ℃;11.H2O。
M.DL2000 DNA Marker;1-10.51-60 ℃;11.H2O.
图1 优化猪链球菌纳米PCR退火温度
Fig.1 Optimizing the annealing temperature of nano PCR for Streptococcus suis
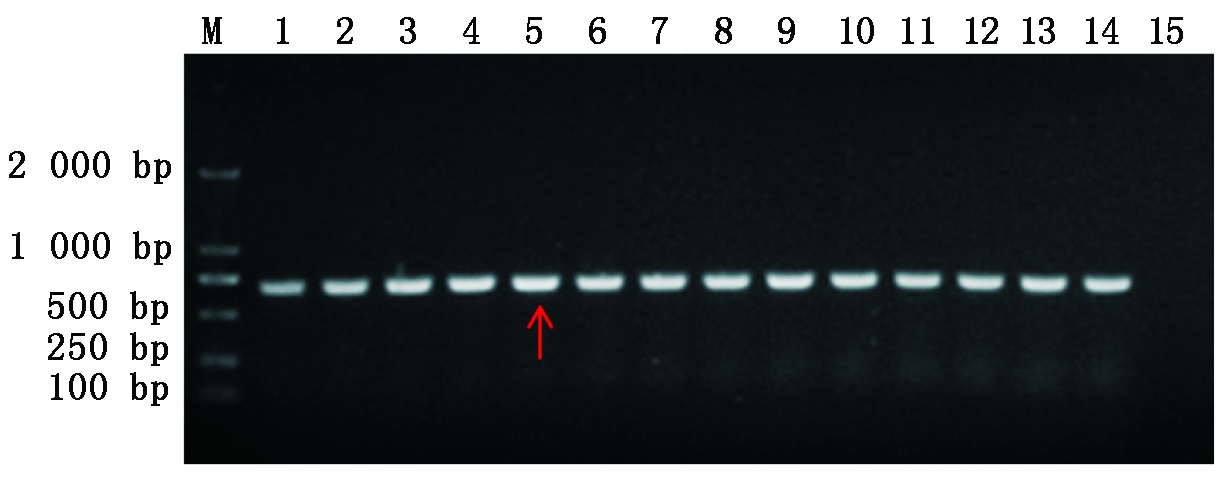
M.DNA分子质量标准DL2000;1-14.0.6~1.9 μL;15.H2O。
M.DL2000 DNA Marker;1-14.0.6-1.9 μL;15.H2O.
图2 优化猪链球菌纳米PCR引物浓度
Fig.2 Optimizing the primer concentration of nano PCR for Streptococcus suis
2.2 猪链球菌纳米PCR特异性试验
以SS(2型)、APP(7型)、H. parasuis (5型)、swine E. coli、S. suis、S. hyicus的DNA为模板,同时以H2O作为阴性对照,按照1.5已优化的纳米PCR反应条件扩增。经电泳检测表明,仅有SS(2型)的DNA样品扩增得到687 bp的DNA片段,其余细菌样品的PCR结果均为阴性,说明本研究建立的猪链球菌纳米PCR方法与其他细菌无交叉反应,具有良好的种属特异性(图3)。然后,用该方法检测我国流行的猪链球菌其他主要致病血清型菌株1(SS-1型)、7(SS-7型)和9型(SS-9)的基因组DNA,同时设立阴性对照,结果显示,该方法能同时识别1、2、7和9型的猪链球菌(图4)。综上,表明该方法特异性良好。
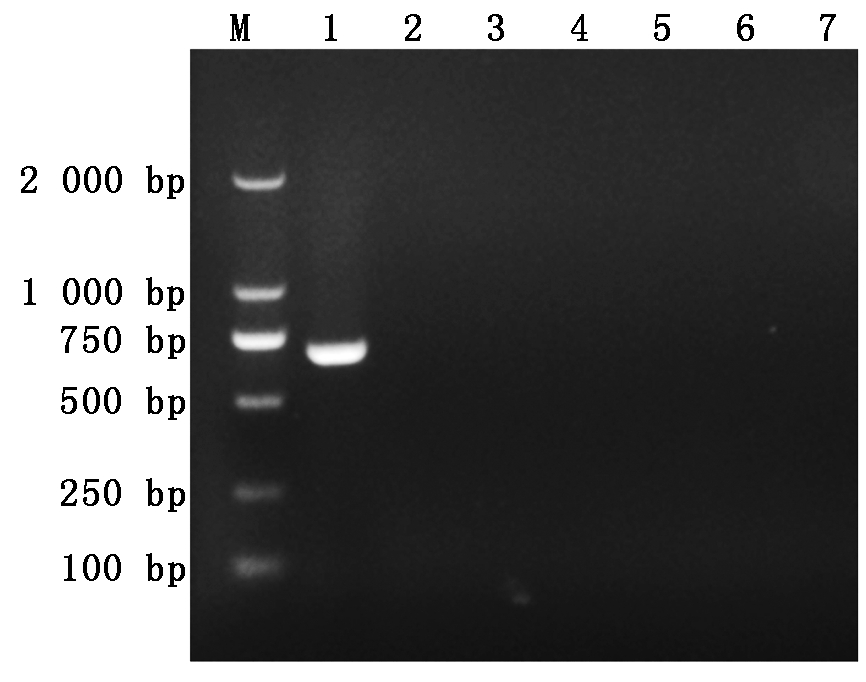
M.DNA分子质量标准DL2000;1.猪链球菌(2型);2.猪传染性胸膜肺炎放线杆菌;3.副猪嗜血杆菌;4.猪大肠杆菌;5.猪沙门氏菌;6.猪葡萄球菌;7.H2O。
M. DL2000 DNA Marker;1.Streptococcus suis (Serotype 2);2.Actinobacillus pleuropneumoniae;3.Haemophilus parasuis;4.swine Escherichia coli;5.Salmonella suis; 6.Staphylococcus hyicus;7.H2O.
图3 猪链球菌纳米PCR种属特异性试验
Fig.3 Genus specificity test of nano PCR for Streptococcus suis
2.3 猪链球菌纳米PCR敏感性试验
先用TSB液体培养基培养猪链球菌12 h,经平板计数法测定猪链球菌菌落总数后,将细菌的浓度调整至1×109 cfu/mL,用灭菌水将链球菌按10倍浓度梯度依次稀释至10 cfu/mL,进行纳米PCR及普通PCR扩增。反应结束后进行琼脂糖凝胶核酸电泳。结果如下图所示,纳米PCR和普通PCR对猪链球菌的检测下限分别为10,103 cfu/mL,表明本研究建立的猪链球菌纳米PCR灵敏度显著增加,其敏感性比普通PCR提高了100倍(图5)。
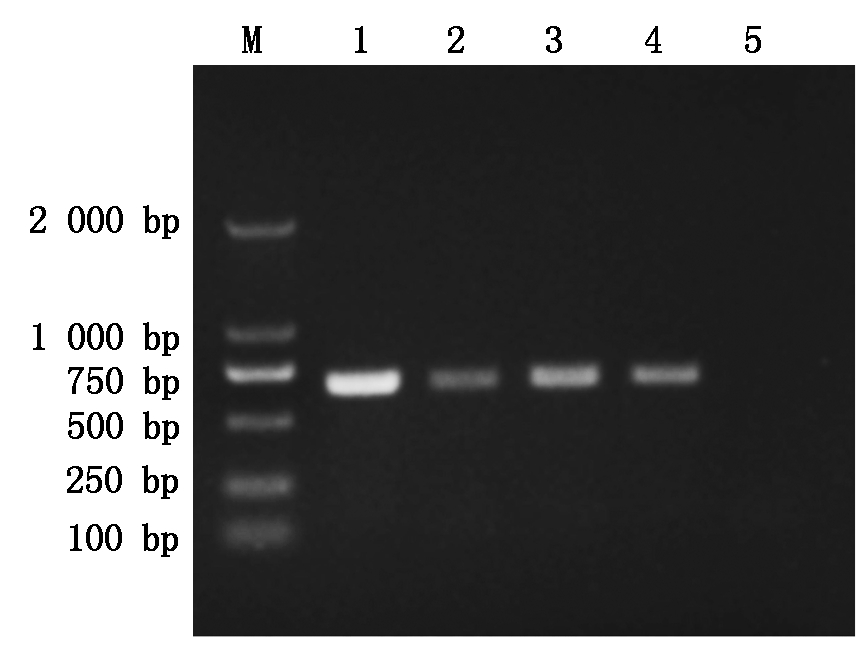
M.DNA分子质量标准DL2000;1. 猪链球菌-1型;2.猪链球菌-2型;3.猪链球菌-7型;4.猪链球菌-9型;5.H2O。
M. DL2000 DNA Marker;1.Streptococcus suis serotype 1;2.Streptococcus suis serotype 2;3.Streptococcus suis serotype 7;4.Streptococcus suis serotype 9;5.H2O.
图4 猪链球菌血清型特异性试验
Fig.4 Specificity test of the serotype of Streptococcus suis by nano PCR
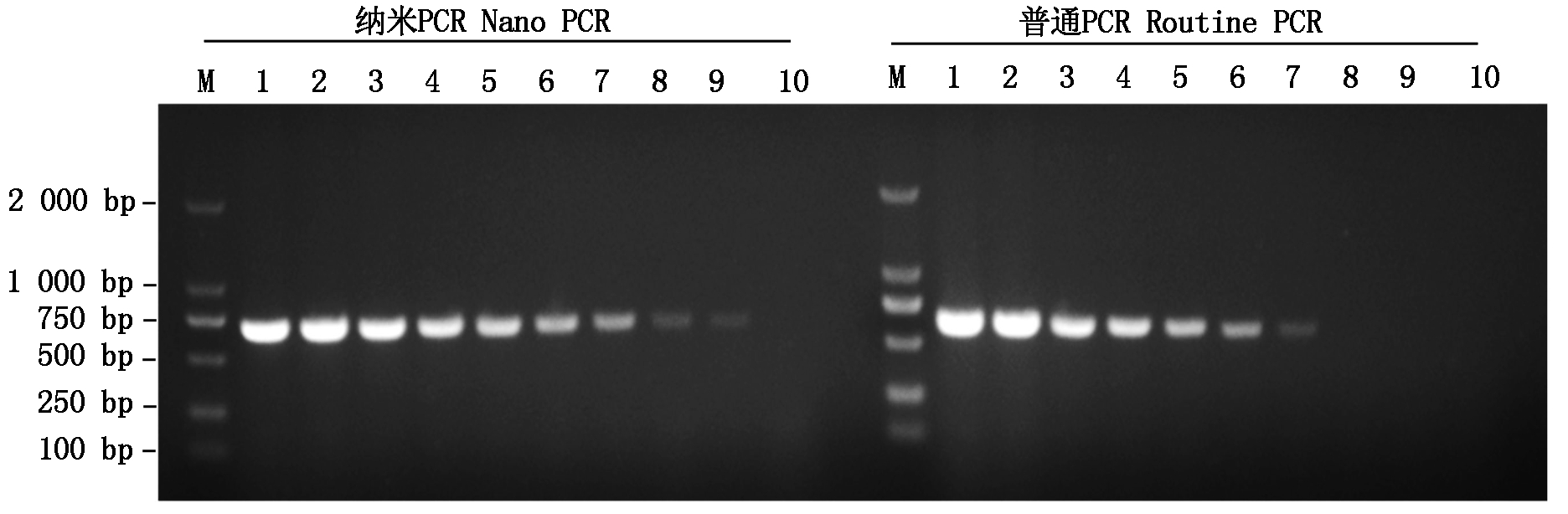
M.DNA分子质量标准DL2000;1-9. 109~10 cfu/mL;10.H2O。
M.DL2000 DNA Marker;1-9. 109-10 cfu/mL;10.H2O.
图5 猪链球菌纳米PCR敏感性试验
Fig.5 Sensitivity test of Streptococcus suis nano PCR assay
2.4 猪链球菌纳米PCR重复性试验结果
提取猪链球菌(1×106 cfu/mL)基因组DNA,并将其进行3个浓度梯度稀释,每个梯度设3个重复,进行重复性试验。结果表明,不同浓度梯度的SS基因组DNA均能有效扩增,说明该方法稳定性好(图6)。
2.5 临床样品检测结果
根据临床症状,收集来自广东不同地区的44份疑似猪链球菌感染的病料,按照1.3的方法提取上述样品中的DNA,分别用猪链球菌的常规PCR方法和本研究建立的纳米PCR方法检测,结果经统计发现猪链球菌普通PCR和纳米PCR方法对该菌的阳性检出率分别为54.5%(24/44),72.7%(32/44),且纳米PCR检测出的阳性、阴性样品与普通PCR检测结果100%符合,可见纳米PCR不仅准确度较好,检出率与普通PCR相比提高18.2百分点,显著提高了猪链球菌感染的检验检疫率(表1)。
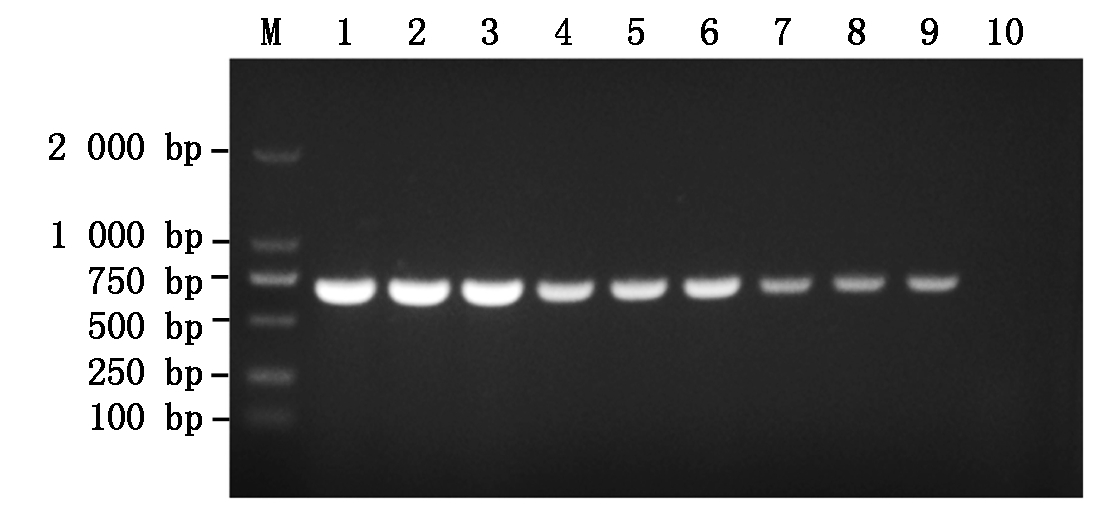
M.DNA分子质量标准DL2000;1-3. 1×106 cfu/mL;
3-6. 1×105 cfu/mL;7-9. 1×104 cfu/mL;10. H2O。
M. DL2000 DNA Marker;1-3.1×106 cfu/mL;
3-6.1×105 cfu/mL;7-9. 1×104 cfu/mL;10.H2O.
图6 猪链球菌纳米PCR重复性试验
Fig.6 Repeatability test of Streptococcus suis nano PCR assay
表1 猪链球菌纳米PCR临床样品检测结果
Tab.1 The results of clinical sample testing by nano PCR for Streptococcus suis
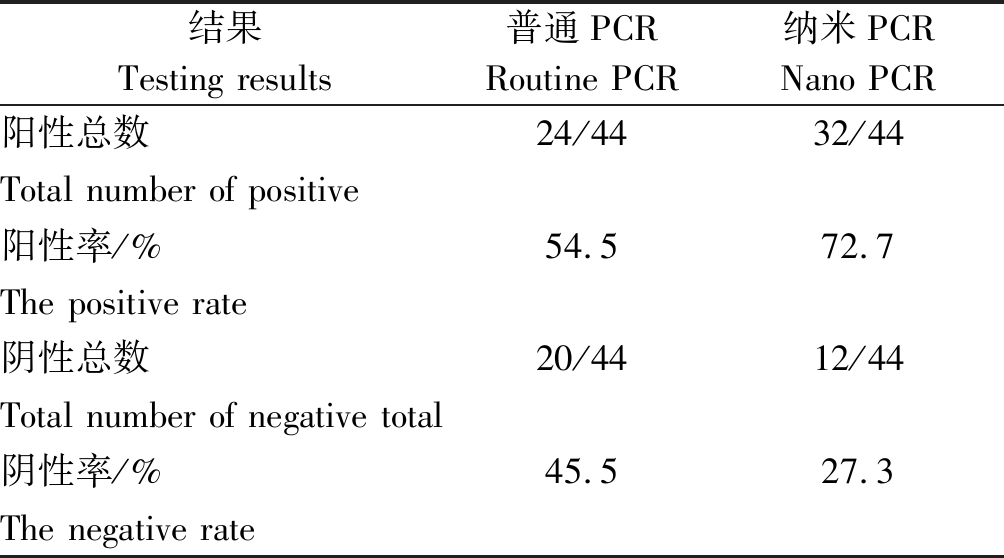
结果Testing results普通PCRRoutine PCR纳米PCRNano PCR阳性总数24/4432/44Total number of positive阳性率/%54.572.7The positive rate阴性总数20/4412/44Total number of negative total阴性率/%45.527.3The negative rate
3 讨论
纳米PCR技术是在PCR反应体系中添加1~100 nm的纳米金属颗粒,形成纳米流体,将PCR技术从均相体系扩展到纳米粒子表面。金属纳米粒子优良的热传导性,提高了PCR反应体系的升温和降温速度,利于模板和引物的高效配对,增加扩增的特异性与反应速率[15]。通过扫描电镜和透射电镜观察发现,纳米材料能够附着于DNA分子和Taq酶表面。研究发现,纳米材料能够和DNA分子进行非共价结合,调节反应体系中DNA的聚合及稳定性,降低模板Tm,进而提升扩增效率;纳米粒子还能与游离的Taq酶进行可逆结合,动态调节Taq酶的更替频率,进一步提高PCR扩增效率[10,16]。纳米材料还能通过电荷效应等极大地提高反应物组分的动力学接触,从而提高PCR反应效率,减少DNA的用量,提高PCR的扩增效率和敏感性[17]。目前,纳米粒子在长片段PCR、反复扩增PCR、实时定量PCR等方面已取得较好应用结果,报道表明,纳米PCR方法比常规PCR方法敏感性可提高10~1 000倍,显著改进了PCR反应的扩增效率与特异性[18]。可见,纳米材料具有传统PCR反应添加剂无法达到的特殊效果,为PCR反应的优化,提供了新思路、新技术。将纳米PCR技术应用于动物疫病研究中,可为动物疫病的早期诊断及控制提供更加高效准确的检测技术平台。目前,该技术在多种动物病毒性疫病的检测中敏感性显著提高,但细菌性动物疫病的检测中鲜少用到该技术。
猪链球菌是猪场中常见的重要细菌性病原,通过昆虫媒介、粪口途径、呼吸道途径,甚至垂直传播,感染不同年龄段的猪,仔猪感染表现为急性败血症和脑脑炎,病程较短死亡率极高,中猪多表现为化脓性淋巴结炎[19]。目前,该病遍布全球,常呈地方性爆发流行,该菌现有35个血清型,其中2型猪链球菌流行范围最广泛,此外,1、7、9型也是较常见的致病性血清型,且2、9型对人具有感染性,世界多地区曾有感染病例报道,可见猪链球菌是重要的人畜共患病病原,具有重要公共卫生安全意义[20]。建立高效的分子诊断手段有利于从源头上监测该病的流行情况,利于早期感染的检测与控制。本研究通过引入纳米金属颗粒,提高PCR反应效率和敏感性,建立了以谷氨酸脱氢酶基因为检测靶标的猪链球菌纳米PCR检测方法。该方法满足临床上多血清型混合感染的检测需求,能同时检测到1、2、7和9型4个主要流行血清型,与其他猪场常见的细菌性病原猪胸膜肺炎放线杆菌、副猪嗜血杆菌、大肠杆菌、沙门氏菌、葡萄球菌均无交叉反应,且与传统PCR方法相比,敏感性提高100倍。临床样品检测结果显示,本研究建立的纳米PCR方法大大提升了猪链球病的检出效率,虽然该技术无法区分猪链球菌具体血清型,但该技术能同时检测出目前流行的4个主要致病血清型,且阳性样本的检出率比普通PCR高18.2百分点,可作为猪链球菌感染早期诊断的高效筛查技术。综上,本研究建立的猪链球菌纳米PCR检测方法不仅实用性强,特异好,且检测敏感度更佳,为猪链球菌病的临床诊断和检测提供了新的技术支持。
[1] Gottschalk M,Xu J G,Calzas C,Segura M. Streptococcus suis:A new emerging or an old neglected zoonotic pathogen?[J].Future Microbiology,2010,5(3):371-391. doi:10.2217/fmb.10.2.
[2] Segura M. Streptococcus suis:an emerging human threat[J].The Journal of Infectious Diseases,2009,199(1): 4-6. doi:10.1086/594371.
[3] Jiang F,Guo J J,Cheng C,Gu B. Human infection caused by Streptococcus suis serotype 2 in China:report of two cases and epidemic distribution based on sequence type[J].BMC Infectious Diseases,2020,20(1):223. doi:10.1186/s12879-020-4943-x.
[4] Hlebowicz M,Jakubowski P,Smiatacz T. Streptococcus suis meningitis:epidemiology,clinical presentation and treatment[J].Vector-Borne and Zoonotic Diseases, 2019,19(8):557-562.doi:10.1089/vbz.2018.2399.
[5] 张玲梅,王豪举.猪链球菌检测技术研究进展[J].中国生物工程杂志,2020,40(4):84-90.doi:10.13523/j.cb.1909042.
Zhang L M,Wang H J. Research progress in Streptococcus suis detection technology[J]. China Biotechnology,2020,40(4):84-90.
[6] Nakayama T,Zhao J Z,Takeuchi D,Kerdsin A,Chiranairadul P,Areeratana P,Loetthong P,Pienpringam A,Akeda Y,Oishi K. Colloidal gold-based immunochromatographic strip test compromising optimised combinations of anti-S.suis capsular polysaccharide polyclonal antibodies for detection of Streptococcus suis[J]. Biosensors and Bioelectronics,2014,60:175-179.doi:10.1016/j.bios.2014.03.074.
[7] Xia X J,Wang L,Shen Z Q,Qin W H,Hu J H,Jiang S J,Li S G. Development of an Indirect Dot-PPA-ELISA using glutamate dehydrogenase as a diagnostic antigen for the rapid and specific detection of Streptococcus suis and its application to clinical specimens[J].Antonie Van Leeuwenhoek, 2017,110(4):585-592. doi:10.1007/s10482-016-0825-z.
[8] Okwumabua O,O′Connor M,Shull E. A polymerase chain reaction (PCR) assay specific for Streptococcus suis based on the gene encoding the glutamate dehydrogenase[J].FEMS Microbiology Letters,2003,218(1):79-84. doi:10.1111/j.1574-6968.2003.tb11501.x.
[9] 杨慧敏,樊明明,吕玉金. 猪链球菌病实验室检测技术研究进展[J].现代牧业,2019,3(4):47-50.
Yang H M,Fan M M,Lü Y J. Progress on laboratory diagnosis technology for Streptococcus suis[J].Modern Animal Husbandry,2019,3(4):47-50.
[10] 米丽娟,朱红平,张晓东,胡钧,樊春海. “纳米粒子PCR”中纳米金与聚合酶相互作用机制探讨[J].科学通报,2007,52(8):893-897.doi:10.3321/j.issn:0023-074x.2007.08.007.
Mi L J,Zhu H P,Zhang X D,Hu J,Fan C H. Mechanism of interaction between gold nanoparticles and polymerase in nanoparticle PCR[J].Chinese Science Bulletin[J],2007,52(8):893-897.
[11] 柴瑞影,华荣虹,袁万哲,孙继国.猪流行性乙型脑炎病毒纳米PCR检测方法的建立[J].中国兽医学报,2017,37(3):471-474.doi:10.16303/j.cnki.1005-4545.2017.03.15.
Chai R Y,Hua R H,Yuan W Z,Sun J G. Establishment of nano PCR assay for detection of the Japanese encephalitis virus[J].Chinese Journal of Veterinary Science,2017,37(3):471-474.
[12] 崔宇超,彭永刚,马兴杰,崔尚金. 猪细小病毒高效纳米PCR检测方法的建立[J].中国预防兽医学报,2014,36(4):286-288.doi:10.3969/j.issn.1008-0589.2014.04.08.
Cui Y C,Peng Y G,Ma X J,Cui S J. Establishment of nanoPCR assay for detection of the Porcine parvovirus[J].Chinese Journal of Preventive Veterinary Medicine ,2014,36(4):286-288.
[13] 郑丽,任卫科,路超,田向学,王利丽,李秀丽,鄢明华. 禽呼肠孤病毒纳米PCR检测方法的建立与应用[J].中国兽医科学,2018,48(6):700-706. doi:10.16656/j.issn.1673-4696.2018.0108.
Zheng L,Ren W K,Lu C,Tian X X,Wang L L,Li X L,Yan M H. Establishment and application of nano PCR assay for detection of Avian reovirus[J].Chinese Veterinary Science ,2018,48(6):700-706.
[14] 崔尚金,胡泉博,刘业兵. 非洲猪瘟病毒高效纳米PCR检测方法的建立及初步应用[J].中国预防兽医学报,2012,34(10):807-809. doi:10.3969/j.issn.1008-0589.2012.10.12.
Cui S J,Hu Q B,Liu Y B. The development of nanometer PCR assay for detection of the Africa swine fever virus[J].Chinese Journal of Preventive Veterinary Medicine,2012,34(10):807-809.
[15] Li M,Lin Y C,Wu C C,Liu H S. Enhancing the efficiency of a PCR using gold nanoparticles[J].Nucleic Acids Research,2005,33(21):e184. doi:10.1093/nar/gni183.
[16] 李彧媛,章春笋. 纳米金对PCR扩增效率影响的机制探讨[J].激光生物学报,2011,20(4):427-433.doi:10.3969/j.issn.1007-7146.2011.04.001.
Li Y Y,Zhang C S. Mechanism of the effects of gold nanoparticles on polymerase chain reaction efficiency[J].Acta Laser Biology Sinica,2011,20(4):427-433.
[17] Rudramurthy G R,Swamy M K. Potential applications of engineered nanoparticles in medicine and biology:an update[J].Journal of Biological Inorganic Chemistry,2018,23(8):1185-1204. doi:10.1007/s00775-018-1600-6.
[18] 翟新验,刘祥,原霖,付雯,刘林青,杜建,张淼洁. 纳米PCR技术及其在动物疫病检测领域的应用[J].中国兽医学报,2019,39(3):603-608. doi:10.16303/j.cnki.1005-4545.2019.03.38.
Zhai X Y,Liu X,Yuan L,Fu W,Liu L Q,Du J,Zhang M J. Nano PCR technique and its application on detection of animal diseases[J].Chinese Journal of Veterinary Science, 2019,39(3):603-608.
[19] 赵拴友. 猪链球菌病的研究进展[J].畜禽业,2018,29(5):100-101. doi:10.19567/j.cnki.1008-0414.2018.05.066.
Zhao S Y.Research progress of Swine Streptococcosis[J].Livestock and Poultry Industry,2018,29(5):100-101.
[20] Kerdsin A,Hatrongjit R,Gottschalk M,Takeuchi D,Hamada S,Akeda Y,Oishi K. Emergence of Streptococcus suis serotype 9 infection in humans[J].J Microbiol Immunol Infect, 2017,50(4): 545-546. doi:10.1016/j.jmii.2015.06.011.