烟粉虱(Bemisia tabaci Gennadius)作为我国重要的农业入侵害虫,寄主范围广泛,遗传结构复杂,目前研究发现烟粉虱至少是由44个隐种组成的复合群[1]。由于烟粉虱MED隐种(Q烟粉虱)比MEAM1隐种(B烟粉虱)具有更强的抗药性和寄主适应性[2-4],在我国很多地区MED隐种已成为危害当地作物的优势隐种。烟粉虱作为一种重要的媒介昆虫,其传播植物病毒造成的危害比自身危害更为严重。Fiallo-Olivé 等[5]报道由烟粉虱传播的番茄褪绿病毒(Tomato chlorosis virus,ToCV)现已扩散至全球35个国家和地区。我国于2012年在北京保护地栽培番茄上首次报道了ToCV的发生[6],该病毒在我国迅速传播蔓延,目前已在主要番茄种植区普遍暴发、流行,防控形势严峻[7-10]。
ToCV不能通过汁液摩擦传播,只能依靠媒介昆虫以半持久方式传播[11-12]。Shi 等[13]研究表明,烟粉虱MED隐种对ToCV的获毒、持毒和传毒能力明显高于MEAM1隐种。植物病毒作为一种异源物质,媒介昆虫取食获毒后可能会通过调节自身的防御反应或调节反应改变对带毒植株的适应度,而昆虫体内的解毒酶和保护酶在这一生理过程中发挥着关键作用[14-17]。前期的研究发现,烟粉虱取食番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)侵染的番茄72 h和30 d后,体内羧酸酯酶(Carboxylesterase,CarE)和谷胱甘肽S-转移酶(Glutathione S-transferase,GST)活性先升高后降低;细胞色素P450酶(Cytochrome P450,P450)和过氧化物酶(Peroxidase,POD)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)活性则持续升高[14]。褐飞虱(Nilaparvata lugens Stal)、白背飞虱(Sogatella furcifera Horváth)取食南方黑条水稻矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)侵染的水稻后,成虫和若虫体内保护酶SOD、POD、CAT活性均随取食时间的延长而增加[18]。而麦二叉蚜(Schizaphis graminum Rondani)取食大麦黄矮病毒(Barley yellow dwarf virus,BYDV)侵染的小麦后,体内保护酶POD、SOD、CAT活性和解毒酶碱性磷酸酶(Alkaline phosphatase,AKP)、乙酰胆碱酯酶(Acetylcholinesterase,AchE)活性却显著降低[15]。从适应度角度来看,Li 等[19]研究发现,烟粉虱MED隐种取食ToCV侵染的番茄植株,繁殖力显著降低,产卵期和雌成虫寿命显著缩短,这可能是由于解毒酶基因表达水平升高需要消耗更多能量,因此导致其在发病番茄植株上的适合度下降。Luan等[20]研究B烟粉虱取食中国番茄黄化曲叶病毒(Tomato yellow leaf curl China virus,TYLCCNV)侵染的烟草,也发现烟粉虱通过降低解毒酶活性来降低能量消耗,从而提高其在带毒烟草上的适合度。媒介昆虫获毒后其体内解毒酶和保护酶活性的不同变化可能因媒介昆虫、病毒以及寄主植物种类的不同而异。除基因表达水平会发生变化外,差异基因参与的代谢通路、生物学功能也是需要重点关注的部分。Kaur 等[21]对烟粉虱MEAM1隐种取食ToCV侵染番茄的转录组研究发现,其代谢通路、信号转导、运输和分解代谢、受体等代谢通路发生变化。
目前,国内外关于烟粉虱对ToCV传播特性、传毒机制以及适应度等方面的研究已有广泛报道[22-28],但从基因水平揭示烟粉虱取食ToCV侵染番茄引起生理防御从而改变适应度的研究还鲜有报道。为明确取食ToCV侵染寄主番茄对烟粉虱防御反应的影响,本研究通过转录组测序和实时荧光定量PCR研究烟粉虱MED隐种取食ToCV侵染番茄和健康番茄6,12,24,48 h,体内解毒酶P450、GST、CarE和保护酶SOD、POD、CAT基因表达和代谢功能的变化,以期进一步阐明烟粉虱取食ToCV获毒后的防御机制,丰富烟粉虱-植物病毒-寄主植物间的互作理论,为田间ToCV有效防控提供科学依据。
1 材料和方法
1.1 供试昆虫与植物
供试昆虫:无毒烟粉虱MED隐种在养虫室内以棉花(冀棉-616)为寄主继代饲养,并定期检测烟粉虱种群纯度。饲养条件:温度(T)=(26± 1)℃,相对湿度(RH)= 60%~80%,光周期(L∶D)=16 h∶8 h。
供试植物:试验所用番茄品种为齐达利(瑞士先正达公司),为市场主栽品种,抗(耐)番茄黄化曲叶病毒。将番茄种子播在装有育苗基质的75穴育苗盘中,置于25~27 ℃的智能温室内用防虫网(孔径=0.15 mm)隔离培养,待植株长至3叶期定植于花盆中(Φ = 12 cm)备用。
ToCV感病番茄植株:用微虫笼将带毒MED隐种成虫接在3叶期健康番茄植株上取食48 h移去成虫,并将叶片上烟粉虱的卵清除干净。将番茄植株置于25~27 ℃智能温室内用防虫网(孔径=0.15 mm)隔离培养,30 d后选择具有明显发病症状并经RT-PCR检测被ToCV侵染的植株备用。
1.2 转录组样品的制备
将健康初羽化的烟粉虱雌成虫用微虫笼夹在感病番茄植株和健康番茄植株叶片背面,分别取食6,12,24,48 h后,收集至EP管内,用液氮速冻,置于-80 ℃保存。每个处理3个生物学重复,共24个样本,每个样本供试烟粉虱300头。
1.3 转录组测序及分析
采集的烟粉虱样品利用Invitrogen公司的TRIzol RNA Extraction Kit提取其总RNA,纯化后根据琼脂糖凝胶电泳、Nanodrop等技术检测所得RNA的完整度、纯度和浓度,将合格样品委托北京诺禾致源科技股份有限公司完成基因组测序。原始序列数据经过滤软件去除不合格的reads后获得高质量的clean reads,再根据HISAT软件进行基因组序列比对分析(参考基因组:ftp://whiteflvenomics.org/pub/MEAM1/)获得readcount数据。采用HTSeq软件对各样品进行基因表达水平分析,使用的模型为union。基因差异表达分析的输入数据为基因表达水平分析中得到的read count数据,通过DESeq或TMM标准化后,进行差异分析。按照p-adjusted(q-value)<0.05的标准筛选差异表达基因[29]。
1.4 实时荧光定量PCR验证
从烟粉虱取食24 h样品测序结果中分别选取3种解毒酶和3种保护酶基因(Bta02803、Bta12080、Bta04439、Bta11281、Bta13466、Bta01915),进行qRT-PCR验证,以β-actin作为内参基因。利用Primer Premier 5.0 软件分别设计6条基因的检测引物,本研究所用到的所有引物序列信息见表1。采用Invitrogen公司的TRIzol RNA Extraction Kit提取烟粉虱样品总RNA,根据反转录试剂盒(PrimeScriptTM 1st Strand cDNA Synthesis Kit)说明书合成第一链cDNA用于PCR反应。荧光定量反应按照以下步骤进行:cDNA 1 μL,上游引物(10 μmol/L)和下游引物(10 μmol/L)各1 μL,2×ULtra SYBR Mixture 12.5 μL,RNase-Free Water 补充到25 μL。反应液在95 ℃预变性10 min,再按照95 ℃变性15 s、60 ℃退火10 s、72 ℃延伸10 s循环40次,收集荧光信号。每个样品包括3个生物学重复和3个技术重复。
表1 所用引物序列信息
Tab.1 The specific primers used

基因编号Gene ID注释Annotation引物 (5′-3′)Primer sequence (5′-3′)产物/bpPCR productionBta02803细胞色素P450F: TGCTGTGCTGGTGTTGTTTT195R: ACAACAGGACCGTCACTAGGBta12080谷胱甘肽S-转移酶F:AGACACTTATCACTCGGCCG151R:AGATTGAAGTGCGTACAGAATTGBta04439羧酸酯酶F:TCCGATTGCCAGTACCACTT189R:CTCTTCCATCCCTCGTCCTCBta011281超氧化物歧化酶F:TTCATTCGGGCTTCCTCAGT228R:CTGTGATGAAAACTGGCGCTBta13466过氧化物酶F:ATGGTTATGCAGTGGGGTCA187R:TTTCGCCGAACTGAGCAAAABta01915过氧化氢酶F:GTTCAGGTCCTTTGGCAGTC202R:ACTATGGGTCCCCATTTTCCβ-actinF:AATTCAACACACCAGCGCTC191R:CCGCACGGTTTGAAAGGAAT
1.5 数据统计与分析
根据公式2-ΔΔCt计算烟粉虱体内解毒酶和保护酶基因的相对表达量,默认对照组基因相对表达量为1。酶基因相对表达量采用平均值±标准误差表示,并利用软件SPSS 23.0 Tukey's进行显著性差异分析(P<0.05)。
2 结果与分析
2.1 RNA-Seq相关性分析
本研究中所有时间点的3个生物学试验操作是可重复的且变异不大,为确保后续的差异基因分析结果更为可靠,利用样本间基因表达水平相关性来进行检验和评估。相关系数越接近1,表明样品之间表达模式相似度越高。由图1可以看出,每个时间点的3个生物学重复样本之间相关性系数均在0.967以上,且绝大多数高于0.99,说明同组内生物学重复一致性较好。由于试验大背景以及设计所限,各组时间点之间间隔较近,试验组和对照组所有样本之间相关系数都不低,说明烟粉虱取食带毒番茄和健康番茄的48 h内转录组基因表达模式大致是相同的。

图1 各样本间相关系数图
Fig.1 Correlation index among samples
2.2 烟粉虱MED隐种取食ToCV侵染番茄对其体内解毒酶基因转录水平的影响
烟粉虱MED隐种取食感染ToCV侵染番茄,高通量测序共检测出其体内33个P450基因转录水平发生变化,其中表达量上调基因23个、下调基因11个。在P450所有上调基因中,烟粉虱取食获毒6 h检测出9个基因转录水平发生变化,12 h检测出8个,24 h检测出17个,48 h检测出6个(图2)。在P450所有下调基因中,烟粉虱取食获毒6 h未检测出转录水平发生变化的基因,12 h检测出1个,24 h检测出8个,48 h检测出5个(图2)。此外,一些基因在烟粉虱取食获毒不同时间点发生持续性表达差异,如Bta02803基因在6,24,48 h均发生上调,Bat02034基因在24,48 h发生上调(表2);Bta10847基因在12,48 h发生下调,Bta11611基因在24,48 h发生下调(表3);但是并未发现在4个时间点均发生过表达或低表达的P450基因。差异表达程度最大的P450基因为Bta04697,出现在烟粉虱取食获毒后24 h,差异表达倍数达到4.65。
烟粉虱MED隐种取食感染ToCV侵染番茄,高通量测序共检测出其体内11个GST基因转录水平发生变化,其中表达量上调基因6个、下调基因5个。烟粉虱取食获毒6 h有4个GST基因出现上调,1个GST基因出现下调;12 h有1个GST基因发生上调,2个GST基因发生下调;24 h共有6个GST基因出现上调,2个GST基因出现下调;48 h上调、下调GST基因各检测出2个(图2)。在所有GST上调基因中,Bta09332、Bta12080、Bta12671、Bta14179在不同时间点均被检测出;在GST下调基因中,Bta15447在6,24,48 h均发生低表达(表2-3)。Bta12671基因在烟粉虱取食获毒6 h发生上调,12 h发生下调,在24,48 h又恢复过表达。差异表达程度最大的GST基因为Bta12671,出现在烟粉虱取食获毒后48 h,差异表达倍数达到1.74。
烟粉虱MED隐种取食感染ToCV侵染番茄,高通量测序共检测出其体内6个CarE基因转录水平发生变化(图2)。烟粉虱取食获毒6 h有2个CarE基因Bta04439、Bta06821发生上调,无下调基因;12 h有2个CarE基因Bta03563、Bta08899发生上调,无下调基因;24 h有3个CarE基因Bta04439、Bta04538、Bta06821出现上调,1个CarE基因Bta08027出现下调;而48 h未发现转录水平发生变化的CarE基因(表2-3)。在发生转录水平变化的CarE基因中,Bta04439和Bta06821在6,24 h同时出现上调,差异表达程度最大的CarE基因为Bta04439,出现在烟粉虱取食获毒后24 h,差异表达倍数为0.99。
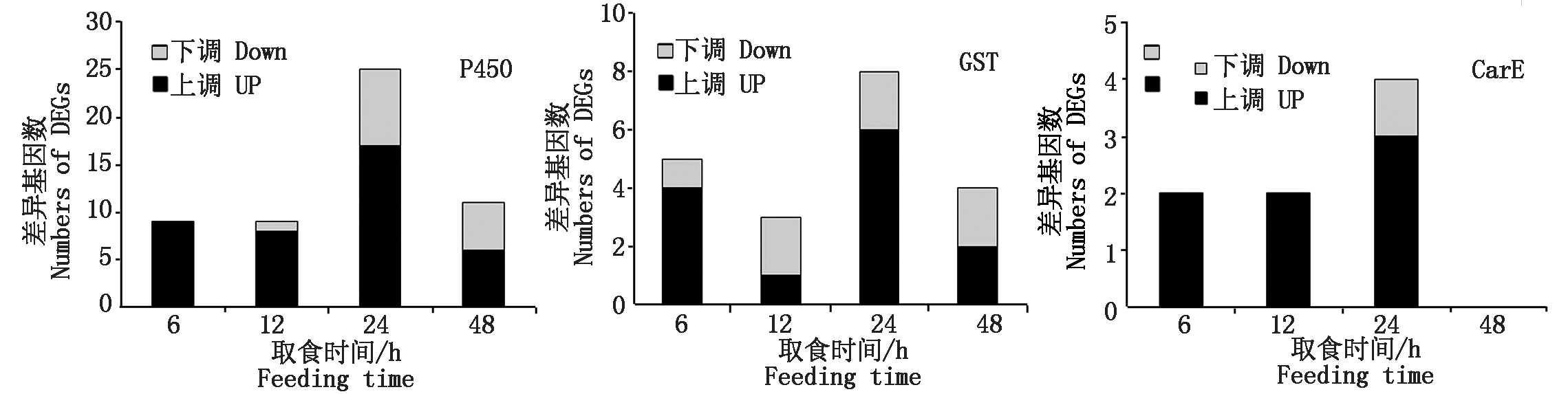
图2 烟粉虱MED隐种取食ToCV侵染番茄不同时间解毒酶基因上调和下调基因数量
Fig.2 Numbers of up-regulated and down-regulated genes of detoxification enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different times
表2 烟粉虱MED隐种取食ToCV侵染番茄不同时间解毒酶基因的上调情况
Tab.2 Up-regulated detoxification enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different times
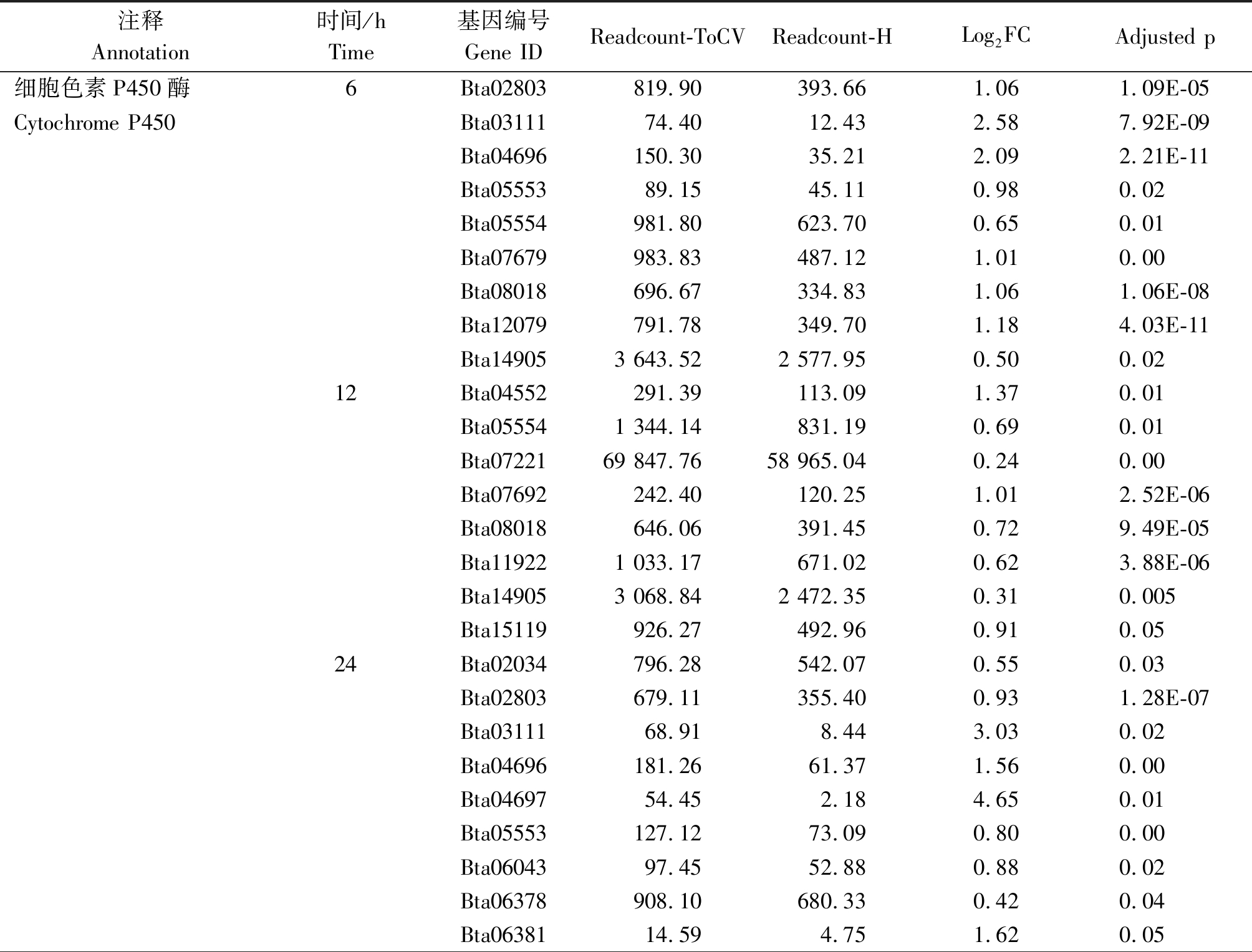
注释Annotation时间/hTime基因编号Gene IDReadcount-ToCVReadcount-HLog2FCAdjusted p细胞色素P450酶6Bta02803819.90393.661.061.09E-05Cytochrome P450Bta0311174.4012.432.587.92E-09Bta04696150.3035.212.092.21E-11Bta0555389.1545.110.980.02Bta05554981.80623.700.650.01Bta07679983.83487.121.010.00Bta08018696.67334.831.061.06E-08Bta12079791.78349.701.184.03E-11Bta149053 643.522 577.950.500.0212Bta04552291.39113.091.370.01Bta055541 344.14831.190.690.01Bta0722169 847.7658 965.040.240.00Bta07692242.40120.251.012.52E-06Bta08018646.06391.450.729.49E-05Bta119221 033.17671.020.623.88E-06Bta149053 068.842 472.350.310.005Bta15119926.27492.960.910.0524Bta02034796.28542.070.550.03Bta02803679.11355.400.931.28E-07Bta0311168.918.443.030.02Bta04696181.2661.371.560.00Bta0469754.452.184.650.01Bta05553127.1273.090.800.00Bta0604397.4552.880.880.02Bta06378908.10680.330.420.04Bta0638114.594.751.620.05
表2(续)
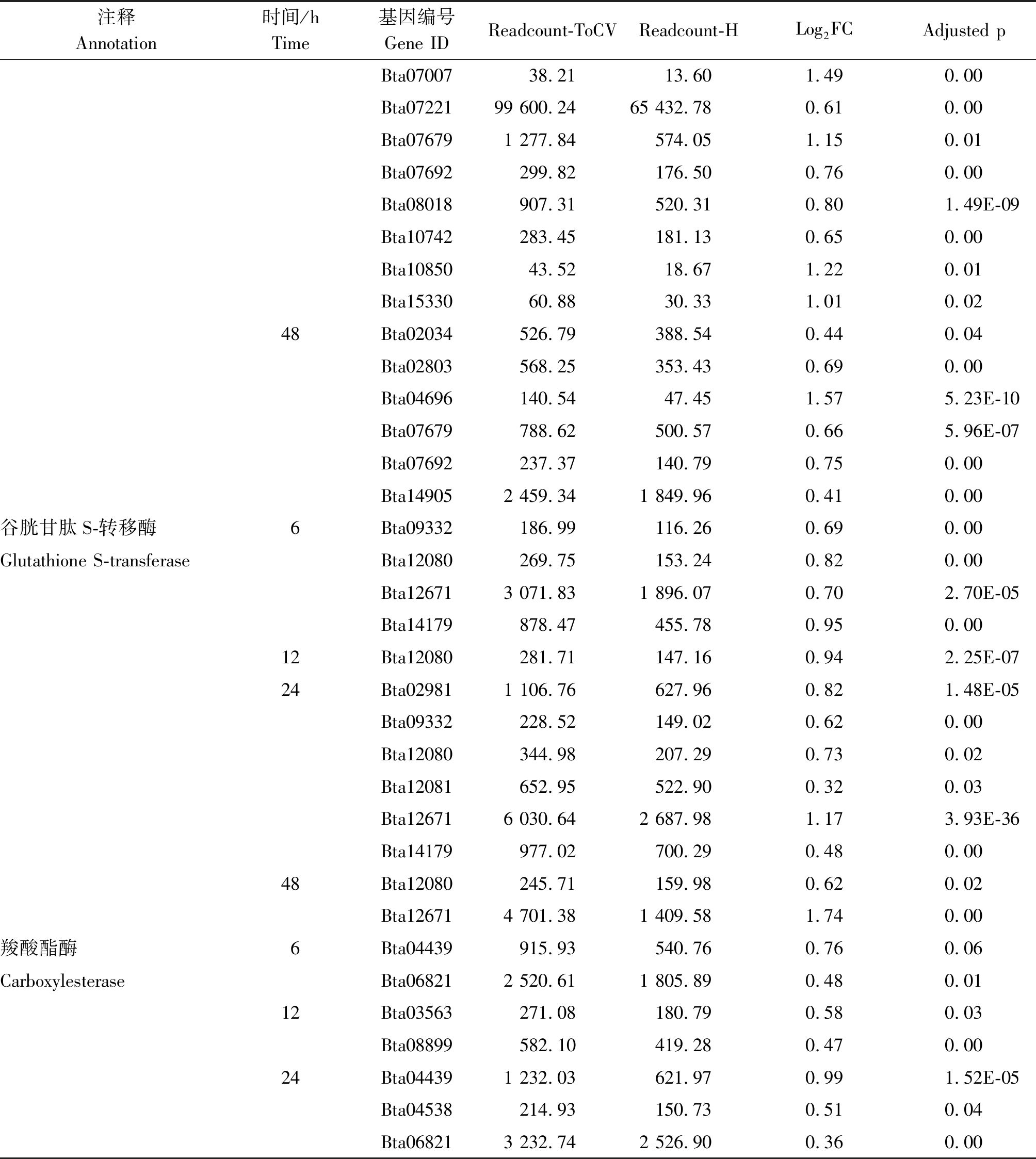
注释Annotation时间/hTime基因编号Gene IDReadcount-ToCVReadcount-HLog2FCAdjusted pBta0700738.2113.601.490.00Bta0722199 600.2465 432.780.610.00Bta076791 277.84574.051.150.01Bta07692299.82176.500.760.00Bta08018907.31520.310.801.49E-09Bta10742283.45181.130.650.00Bta1085043.5218.671.220.01Bta1533060.8830.331.010.0248Bta02034526.79388.540.440.04Bta02803568.25353.430.690.00Bta04696140.5447.451.575.23E-10Bta07679788.62500.570.665.96E-07Bta07692237.37140.790.750.00Bta149052 459.341 849.960.410.00谷胱甘肽S-转移酶6Bta09332186.99116.260.690.00Glutathione S-transferaseBta12080269.75153.240.820.00Bta126713 071.831 896.070.702.70E-05Bta14179878.47455.780.950.0012Bta12080281.71147.160.942.25E-0724Bta029811 106.76627.960.821.48E-05Bta09332228.52149.020.620.00Bta12080344.98207.290.730.02Bta12081652.95522.900.320.03Bta126716 030.642 687.981.173.93E-36Bta14179977.02700.290.480.0048Bta12080245.71159.980.620.02Bta126714 701.381 409.581.740.00羧酸酯酶6Bta04439915.93540.760.760.06CarboxylesteraseBta068212 520.611 805.890.480.0112Bta03563271.08180.790.580.03Bta08899582.10419.280.470.0024Bta044391 232.03621.970.991.52E-05Bta04538214.93150.730.510.04Bta068213 232.742 526.900.360.00
注:FC(Fold Change)是样品1与样品2 的readcount比值;Log2FC>0说明表达量上调。表3-5同。
Note:FC(Fold Change)means the readcount ratio of sample 1 and sample 2;Log2FC>0 means expression up-regulation.The same as Tab.3-5.
2.3 烟粉虱取食ToCV侵染番茄对其体内保护酶基因转录水平的影响
烟粉虱MED隐种取食ToCV侵染番茄,高通量测序共检测出2个SOD基因转录水平发生变化(图3),其中Bta11281基因在6,24,48 h均发生过表达(表4)。烟粉虱取食获毒24 h检测到另一个SOD基因表达显著下调(表5)。Bta11281在烟粉虱取食获毒6 h时差异表达倍数达1.72,差异程度最大。此外,分析还发现5个POD基因表达水平发生变化,其中表达量上调基因4个、表达量下调基因1个。差异表达程度最大的POD基因为Bta13466,出现在烟粉虱取食获毒6 h,差异表达倍数为2.48。尽管高通量测序有检测到CAT基因的存在,但该基因在烟粉虱取食获毒6,12,24,48 h均未发生转录水平的差异变化。从数量上看,差异表达保护酶基因的数量远小于解毒酶基因数量,说明解毒酶的活跃度更高。
表3 烟粉虱MED隐种取食ToCV侵染番茄不同时间解毒酶基因的下调情况
Tab.3 Down-regulated detoxification enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different times
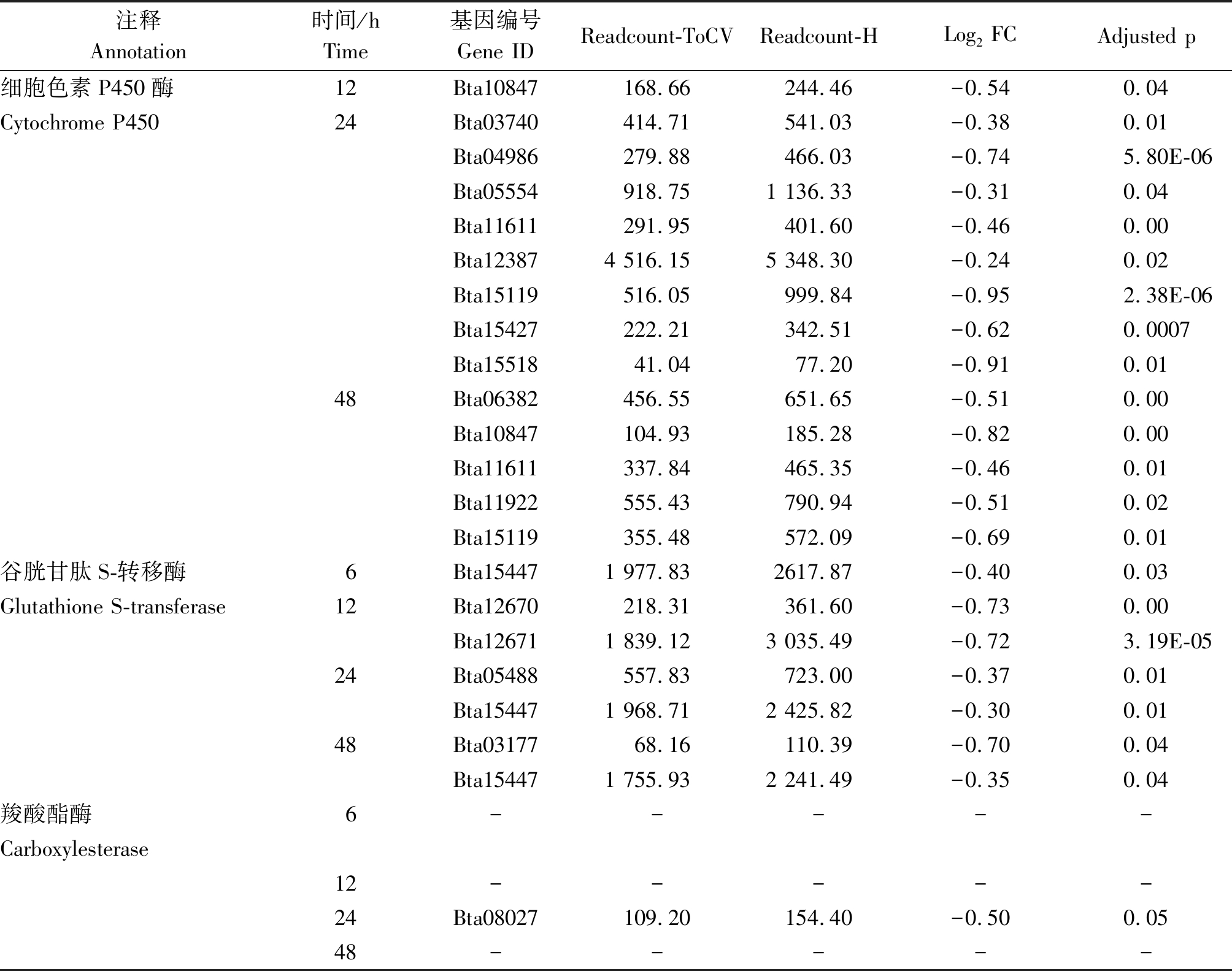
注释Annotation时间/hTime基因编号Gene IDReadcount-ToCVReadcount-HLog2 FCAdjusted p细胞色素P450酶12Bta10847168.66244.46-0.540.04Cytochrome P45024Bta03740414.71541.03-0.380.01Bta04986279.88466.03-0.745.80E-06Bta05554918.751 136.33-0.310.04Bta11611291.95401.60-0.460.00Bta123874 516.155 348.30-0.240.02Bta15119516.05999.84-0.952.38E-06Bta15427222.21342.51-0.620.0007Bta1551841.0477.20-0.910.0148Bta06382456.55651.65-0.510.00Bta10847104.93185.28-0.820.00Bta11611337.84465.35-0.460.01Bta11922555.43790.94-0.510.02Bta15119355.48572.09-0.690.01谷胱甘肽S-转移酶6Bta154471 977.832617.87-0.400.03Glutathione S-transferase12Bta12670218.31361.60-0.730.00Bta126711 839.123 035.49-0.723.19E-0524Bta05488557.83723.00-0.370.01Bta154471 968.712 425.82-0.300.0148Bta0317768.16110.39-0.700.04Bta154471 755.932 241.49-0.350.04羧酸酯酶6 -----Carboxylesterase 12 -----24Bta08027109.20154.40-0.500.0548-----
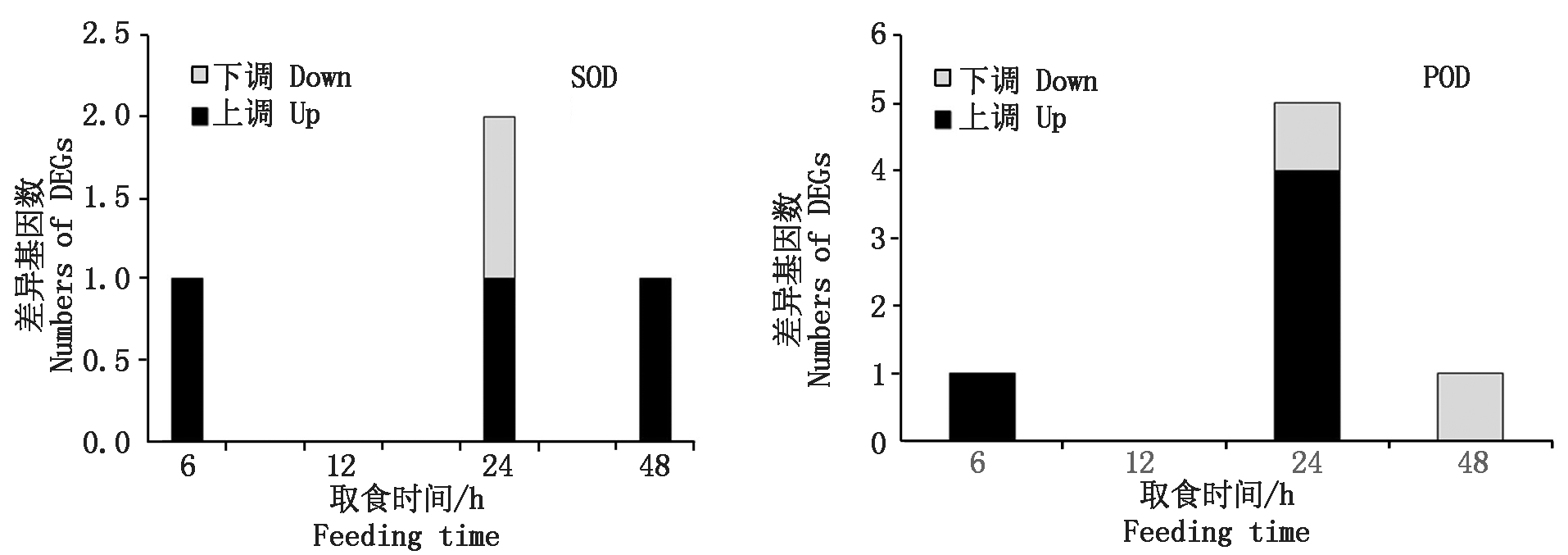
图3 烟粉虱MED隐种取食ToCV侵染番茄不同时间保护酶基因上调、下调基因数量
Fig.3 Numbers of up-regulated and down-regulated genes of protective enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different times
2.4 烟粉虱取食ToCV侵染番茄体内解毒酶和保护酶基因的荧光定量PCR验证分析
选3个解毒酶基因和3个保护酶基因进行实时荧光定量PCR验证分析(图4)。结果表明,烟粉虱取食获毒6,24,48 h,解毒酶P450基因相对表达量分别是对照组的1.25,2.46,5.61倍,均显著高于对照组(P<0.05)与转录组结果一致;12 h相对表达量是对照组的0.88倍,二者间无显著差异(P>0.05),与转录组结果一致。GST基因相对表达量在烟粉虱取食获毒6,12,24,48 h均显著高于对照组(P<0.05),分别是对照组的1.90,1.70,1.93,2.22倍,也与转录组差异分析结果相同;与GST基因相反,CarE基因在烟粉虱取食获毒4个时间点其表达量与对照组均无显著差异(P > 0.05),但在转录组分析中,该基因(Bta04439)分别在6,24 h发生过表达(表2)。
表4 烟粉虱MED隐种取食ToCV侵染番茄不同时间保护酶基因上调情况
Tab.4 Up-regulated protective enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different time points
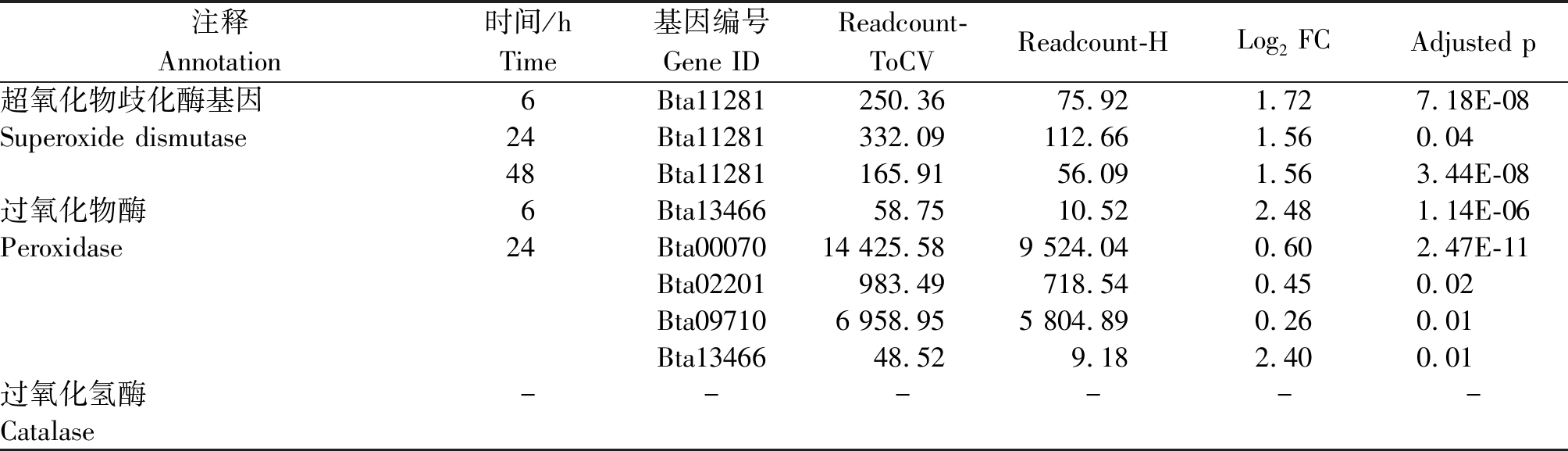
注释Annotation时间/hTime基因编号Gene IDReadcount-ToCVReadcount-HLog2 FCAdjusted p超氧化物歧化酶基因6Bta11281250.3675.921.727.18E-08Superoxide dismutase24Bta11281332.09112.661.560.0448Bta11281165.9156.091.563.44E-08过氧化物酶6Bta1346658.7510.522.481.14E-06Peroxidase24Bta0007014 425.589 524.040.602.47E-11Bta02201983.49718.540.450.02Bta097106 958.955 804.890.260.01Bta1346648.529.182.400.01过氧化氢酶------Catalase
表5 烟粉虱MED隐种取食ToCV侵染番茄不同时间保护酶基因下调情况
Tab.5 Down-regulated protective enzyme genes in B. tabaci MED feeding on ToCV-infected tomato at different times
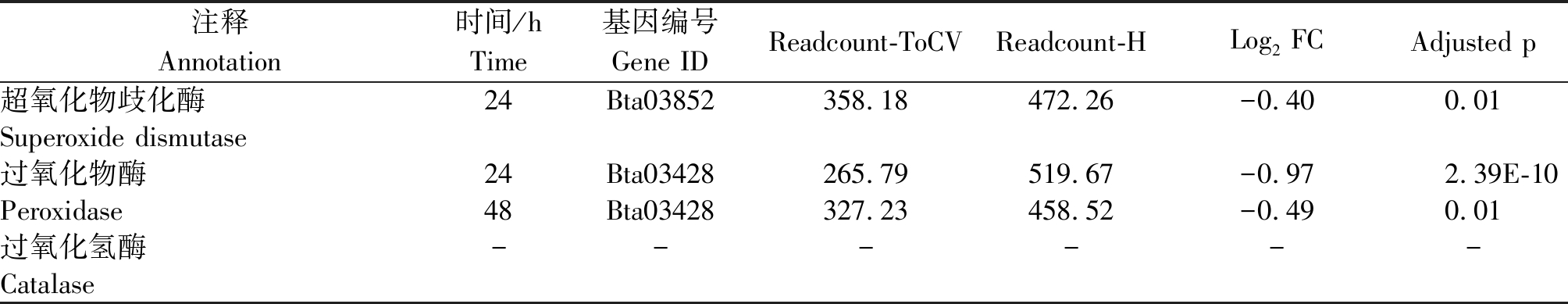
注释Annotation时间/hTime基因编号Gene IDReadcount-ToCVReadcount-HLog2 FCAdjusted p超氧化物歧化酶24 Bta03852358.18472.26-0.400.01Superoxide dismutase过氧化物酶24 Bta03428265.79519.67-0.972.39E-10Peroxidase48 Bta03428327.23458.52-0.490.01过氧化氢酶------Catalase
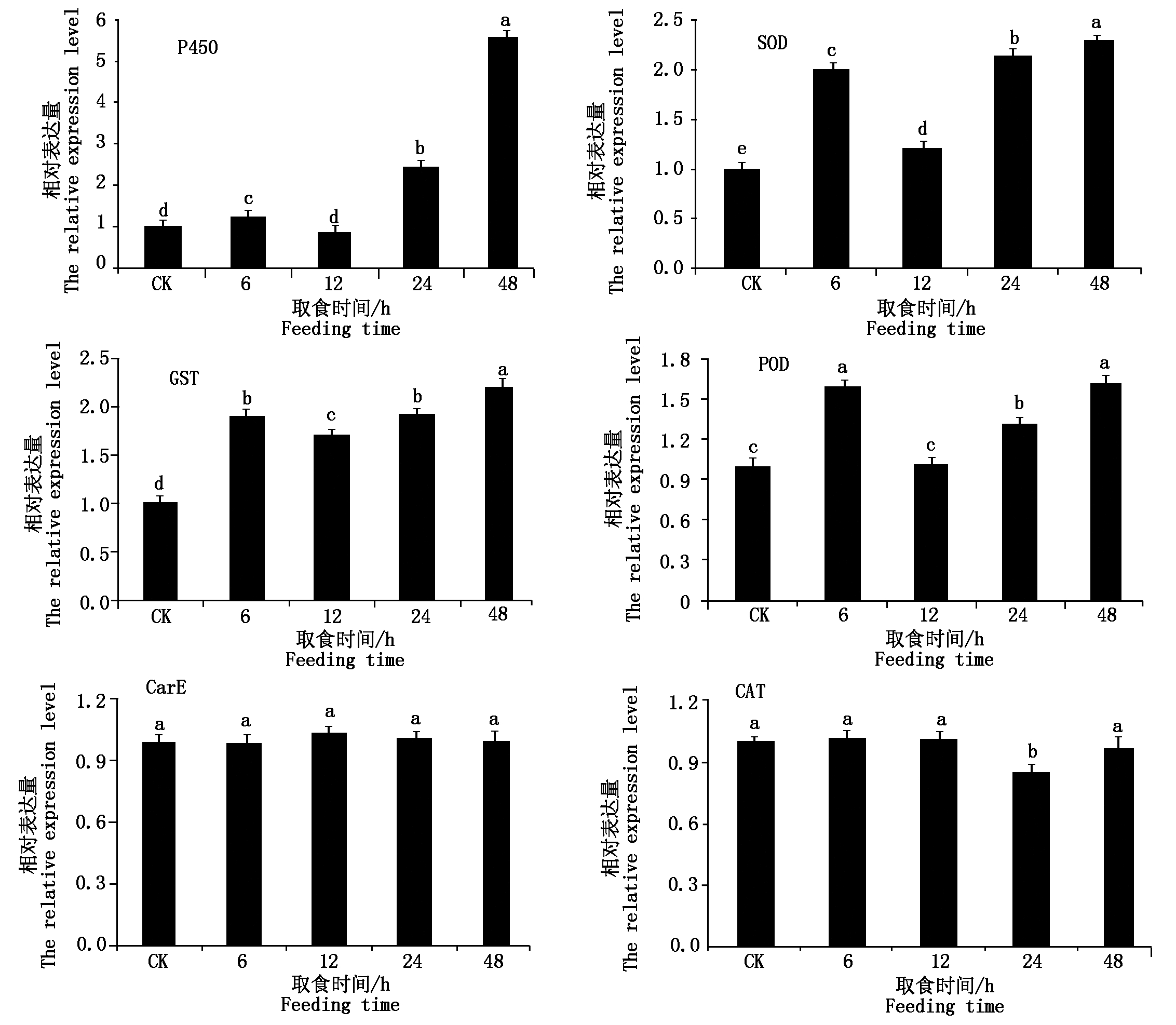
图中数据为平均值±标准误差,不同小写字母表示利用Tukey′s 方差检验在P<0.05水平差异显著。
Datas are mean ± s,different letters indicate significant difference at P<0.05 level by Tukey′s test.
图4 烟粉虱MED隐种取食ToCV侵染番茄不同时间解毒酶和保护酶基因的相对表达量
Fig.4 The relative expression of detoxification and protective enzyme genes of B. tabaci MED feeding on ToCV-infected tomato at different times
烟粉虱取食获毒6,12,24,48 h,保护酶SOD基因相对表达量分别是对照组的2.00,1.22,2.14,2.30倍,均显著高于对照组(P<0.05);该基因在转录组分析中12 h并未出现差异表达(表4),其余3个时间点均过表达,因此,荧光定量PCR结果与转录组结果略有不同。POD基因相对表达量在烟粉虱取食获毒6,24,48 h分别是对照组的1.58,1.32,1.62倍,均显著高于对照组(P<0.05);12 h相对表达量是对照组的1.02倍,二者无显著差异(P>0.05);转录组分析中,该基因仅在6,24 h出现过表达,而12,48 h均未发现与对照组有显著差异(P>0.05)(表4),2种方法对于48 h的差异表达水平分析存在不同。除此之外,CAT基因相对表达量在烟粉虱取食获毒6,12,48 h分别是对照组的1.01,1.01,0.98倍,与对照组均无显著差异(P>0.05),24 h相对表达量是对照组的0.85倍,转录水平被显著抑制(P<0.05)。该CAT基因在转录组数据分析中任意时间点均未出现表达水平的显著差异,而qPCR显示该基因在24 h表达量被显著抑制,与转录组分析结果有所不同,其他3个时间点分析结果一致。
2.5 差异表达基因功能分析
对差异表达基因进行GO富集分析,共注释到生物过程、细胞组分及分子功能三部分。烟粉虱获毒后6 h,差异表达基因主要富集到单一有机物过程、膜固有组件和转运活性;获毒后12 h,差异表达基因主要富集到有机氮化合物代谢、核糖体和分子功能上;获毒后24 h,细胞进程、细胞组分以及结构分子活性对应的差异表达基因最多;获毒后48 h,大部分差异表达基因注释到细胞进程、膜部分和底物特异性跨膜。由于烟粉虱获毒后12,24 h是基因转录活跃度的两个极端,因此,重点分析了这2个时间点下差异表达基因的GO功能特征。从生物过程来看,烟粉虱获毒后12 h主要富集到氧化还原过程和唾液腺细胞自噬性细胞死亡过程(图5),而获毒后24 h差异表达基因参与胞内细胞器、核糖体、核糖和蛋白复合物等过程(图6)。在细胞组分方面,获毒后12 h只有少量差异表达基因被注释到fusome,而获毒后24 h差异表达基因富集的代谢通路很多,如胞内细胞器、核糖体、核糖和蛋白复合物、细胞组分、高分子复合物等。在分子功能层面,烟粉虱获毒后12 h差异表达基因主要富集到催化活性、氧化还原酶活性和角质层结构组成等(图5);获毒后24 h差异表达基因主要参与核糖体结构组成、结构分子活性(图6)。可以看出,虽然取食时间上只相差12 h,但2个时间点下烟粉虱体内基因参与的生物学功能完全不同,获毒后12 h烟粉虱体内涉及角质层结构组成和唾液腺细胞自噬性细胞死亡过程基因显著上调。为了进一步了解烟粉虱获毒后基因表达的生物学功能变化,本研究还进行了KEGG功能注释。与对照组相比,烟粉虱取食带毒番茄后差异表达基因主要参与代谢通路、淀粉和蔗糖代谢、碳代谢、核糖体等路径。其中,烟粉虱获毒后6 h,淀粉和蔗糖代谢(adjusted P=0.02)、半乳糖代谢(adjusted P=0.017)存在显著性差异(adjusted P=1.16E-08);获毒后12 h,溶酶体(adjusted P=1.79E-11)、淀粉和蔗糖代谢(adjusted P=1.16E-08)、半乳糖代谢(adjusted P=2.93E-08)途径出现显著性差异。除此之外,其他时间点下代谢通路均未达到显著性差异(adjusted P>0.05)。参与溶酶体途径的差异基因主要编码组织蛋白酶和硫酸酯酶,在生物体中起分解代谢作用。遗憾的是,大部分解毒酶和保护酶差异基因在GO注释和KEGG代谢通路分析上没有发现显著性差异(adjusted P>0.05)。
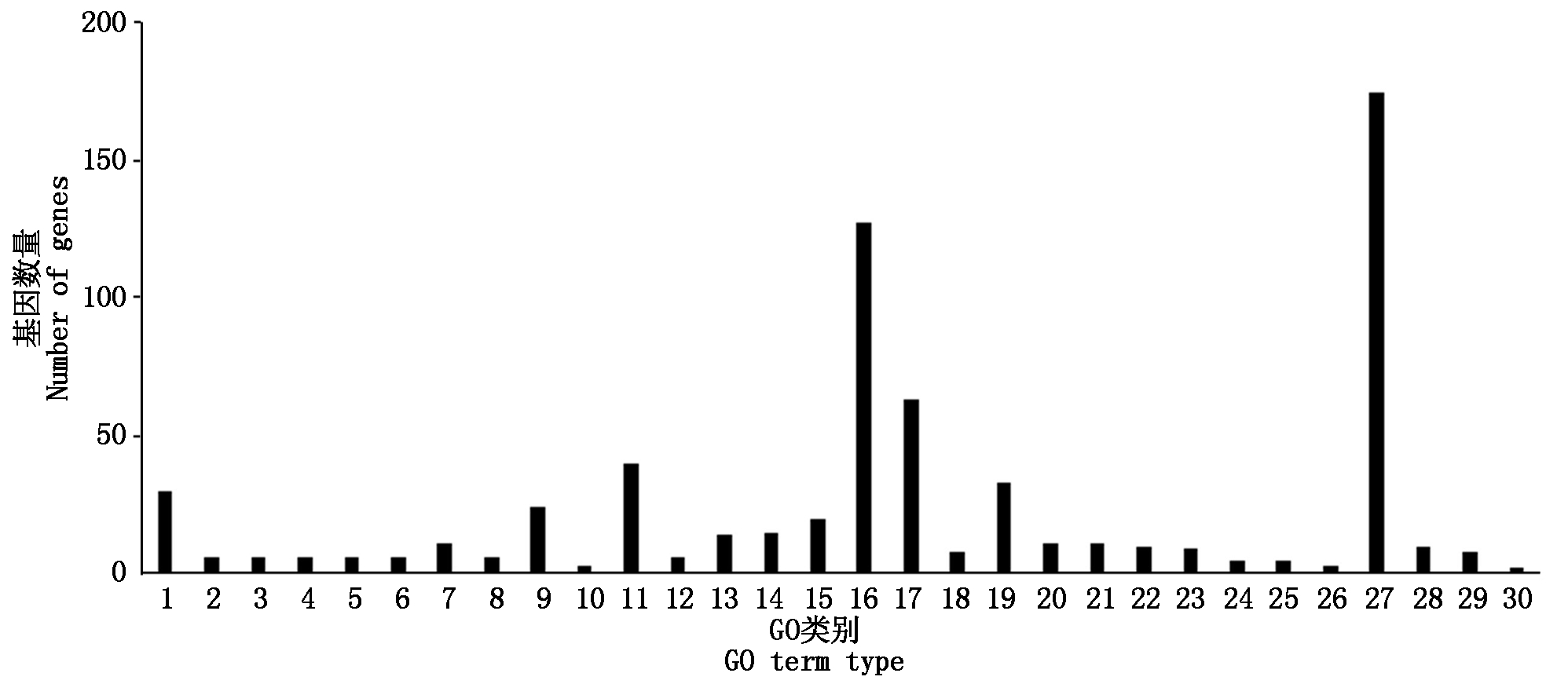
GO类别分三大类: 生物过程包括1. 氧化还原过程;2. 唾液腺细胞自噬性细胞死亡;3. 自噬性细胞死亡;4. 几丁质代谢过程;5. 含葡萄糖胺化合物代谢过程;6. 刚毛发育;7. 核糖体合成;8. 氨基糖代谢过程;9. 有机氮化合物生物合成过程;10. 乙醛酸代谢过程;11. 有机氮化合物代谢过程;细胞组分包括12. 融合体;13. 核糖体;分子功能包括14. 作用于糖基键的水解酶活性;15. 结构分子活性;16. 催化活性;17. 水解酶活性;18. 角质层结构组成;19. 氧化还原酶活性;20. 铁离子结合;21. 核糖体结构组成;22. 单氧酶活性;23. 辅酶结合;24. 几丁质结合;25. NAD结合;26. 羟甲基、甲酰基及相关转移酶活性;27. 分子功能;28. 辅因子结合;29. 作用于供体的CH-OH基团的氧化还原酶活性;30. 作用于线性酰胺中的碳氮(而非肽键)的水解酶活性。
GO term type was divided into three categories: The biological process included 1. Oxidation-reduction process; 2. Salivary gland cell autophagic cell death; 3. Autophagic cell death; 4. Chitin metabolic process; 5. Glucosamine-containing compound metabolic process; 6. Chaeta development; 7. Ribosome biogenesis; 8. Amino sugar metabolic process; 9. Organonitrogen compound biosynthetic process; 10. Glyoxylate metabolic process; 11. Organonitrogen compound metabolic process; The cellular component included 12. Fusome; 13. Ribosome; The molecular function included 14. Hydrolase activity, acting on glycosyl bonds; 15. Structural molecule activity; 16. Catalytic activity; 17. Hydrolase activity; 18. Structural constituent of cuticle; 19. Oxidoreductase activity; 20. Iron ion binding; 21. Structural constituent of ribosome; 22. Monooxygenase activity; 23. Coenzyme binding; 24. Chitin binding; 25. NAD binding; 26. Hydroxymethyl-, formyl- and related transferase activity; 27. Molecular function; 28. Cofactor binding; 29. Oxidoreductase activity, acting on CH-OH group of donors; 30. Hydrolase activity, acting on carbon-nitrogen (but not peptide) bonds, in linear amidines.
图5 烟粉虱取食ToCV侵染番茄12 h后差异表达基因GO富集
Fig.5 GO enrichment of DEGs of B. tabaci MED feeding on ToCV-infected tomato for 12 h
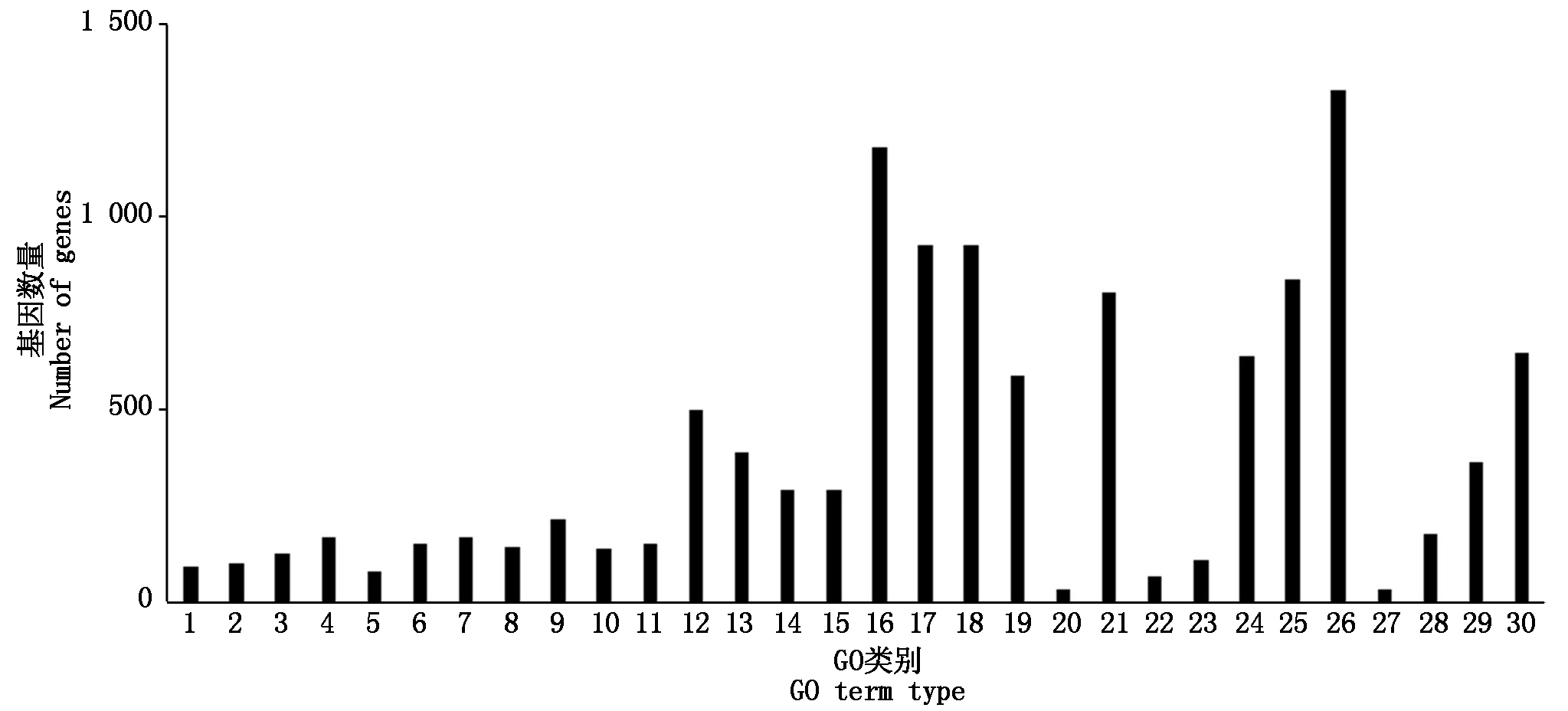
GO类别分三大类: 生物过程包括1. 核糖体生物合成;2. 核糖体蛋白复合物合成;3. 肽代谢过程;4. 细胞酰胺代谢过程;5. 肽生物合成过程;6. 有机氮化合物生物合成过程;7. 转化;8. 酰胺生物合成过程;9. 有机含氮化合物代谢过程;10. 细胞氮化合物代谢过程;11. 前体代谢产物和能量发生;12. 细胞过程;13. 细胞呼吸;14. 细胞组分合成;15. 基因表达;细胞组分包括16. 核糖体;17. 核糖和蛋白复合物;18. 高分子复合物;19. 胞内非膜结合细胞器;20. 非膜结合细胞器;21. 细胞组分;22. 细胞;23. 细胞组分;24. 核糖体亚基;25. 细胞内部分;26. 胞内细胞器;27. 细胞内部分;28. 细胞器;分子功能包括29. 核糖体结构组成;30. 结构分子活性。
GO term type was divided into three categories: The biological process included 1. Ribosome biogenesis; 2. Ribonucleoprotein complex biogenesis; 3. Peptide metabolic process; 4. Cellular amide metabolic process; 5. Peptide biosynthetic process; 6. Organonitrogen compound biosynthetic process; 7. Translation; 8. Amide biosynthetic process; 9. Organonitrogen compound metabolic process; 10.Cellular nitrogen compound metabolic process; 11. Generation of precursor metabolites and energy; 12.Cellular process; 13.Cellular respiration; 14. Cellular component biogenesis; 15. Gene expression; The cellular component included 16. Ribosome; 17. Ribonucleoprotein complex; 18. Macromolecular complex; 19. Intracellular non-membrane-bounded organelle; 20. Non-membrane-bounded organelle; 21.Cellular component; 22. Cell; 23. Cell part; 24.Ribosomal subunit; 25. Intracellular part; 26. Intracellular organelle; 27. Intracellular; 28. Organelle; The molecular function included 29. Structural constituent of ribosome; 30.Structural molecule activity.
图6 烟粉虱取食ToCV侵染番茄24 h后差异表达基因GO富集
Fig.6 GO enrichment of DEGs of B. tabaci MED feeding on ToCV-infected tomato for 24 h
3 讨论与结论
媒介昆虫-植物病毒-寄主植物在长期进化过程中形成了复杂的互作关系,媒介昆虫取食被植物病毒感染的寄主植物会通过调整自身的防御反应以适应病毒的侵入。本研究发现,当烟粉虱MED隐种取食感染ToCV番茄后,其体内解毒酶基因被不同程度诱导过表达或抑制表达,但总体上过表达基因占主导地位。3种解毒酶基因中,编码P450和GST的基因数及表达差异程度高于CarE,表明烟粉虱在与ToCV、寄主植物互作过程中P450和GST基因可能更活跃。此外,从烟粉虱获毒不同时间点看,24 h参与的解毒酶基因数最多且差异表达程度较高,说明烟粉虱在取食ToCV 24 h具有较强的解毒代谢能力。P450基因家族的差异基因数量先升高后降低,可能是由于病毒等外源物质诱导了媒介昆虫体内P450的活性,随着病毒量增加,昆虫又通过降低解毒酶活性来减少能量的消耗 [14]。另外2种解毒酶GST和CarE平均表达量先降低后升高,说明昆虫体内3种主要解毒酶基因可能在不同时间发挥不同的协同作用。除解毒酶外,昆虫体内的保护酶系统在受到外界刺激或外源物质诱导时也会发生应激反应。刘烁安等[30]研究表明,螺旋粉虱(Aleurodicus dispersus Russell)感染蜡蚧轮枝菌(Verticillum lecanii (Zimm.)Gam & Zare)后其体内SOD活力显著高于对照组。而Kaur等[21]研究发现,B烟粉虱取食ToCV 获毒24 h,体内SOD基因表达量显著上调。本研究中,烟粉虱MED隐种取食感染ToCV番茄后,体内SOD、POD、CAT基因在转录水平上发生不同程度的变化,从基因参与数量上来说远远少于解毒酶基因,这可能与基因对外源物质的敏感性不同有关。与取食健康番茄相比,烟粉虱取食获毒6,24,48 h,SOD Bta11281基因表达量均显著上调,而 POD有4个基因在取食获毒24 h表达量显著升高,这说明烟粉虱取食ToCV获毒后,体内免疫反应被激活,大量保护酶被合成。而CAT在4个获毒时间点的基因表达量均无显著差异,说明SOD和POD发挥主要保护功能。荧光定量PCR验证结果与转录组测序结果大体一致,但一些基因在个别时间点下的定量PCR分析与转录组结果不同,这可能是由于2种技术的检测原理、敏感性、差异表达判定标准以及操作人员技术水平不同导致的。
本研究发现,诸多解毒酶和保护酶基因在烟粉虱取食ToCV侵染番茄前后发生差异表达,但其在基因功能和代谢通路上没有明显差异。然而通过对差异表达基因进行GO富集分析发现,烟粉虱获毒后12 h差异基因参与的细胞组分、分子功能、生物过程与其他3个时间点显著不同,涉及表皮结构组成和唾液腺细胞自噬性细胞死亡的生物学过程存在组间显著性差异,且注释上的基因显著上调;而其他时间点的差异表达基因主要富集在氨基酸、蛋白质的生物合成上。KEGG代谢通路分析表明,溶酶体途径仅在这一时间出现显著差异,涉及基因主要编码组织蛋白酶和硫酸酯酶。当烟粉虱取食ToCV侵染番茄后,病毒首先随着植物汁液经过烟粉虱的口针,然后进入食道,穿过中肠进入血淋巴,最后侵染唾液腺并随着唾液一起分泌至健康番茄植株中。He等[31]研究发现,番茄黄曲叶病毒可在烟粉虱唾液腺内复制,唾液腺细胞自噬性细胞死亡会导致唾液腺组织降解,这个过程可能与病毒侵染有关。而本研究在24,48 h并未再发现有基因注释到此过程,说明唾液腺降解只是一个短暂过程。通常情况下,唾液腺细胞自噬性细胞死亡只出现在昆虫变态发育过程中的幼虫阶段,且是在一个完全封闭的蛹体内进行[32],但成虫体内未见相关报道,此为本研究的首次发现。将注释到该过程的基因进行追溯,发现均为组织蛋白酶F。组织蛋白酶是一个庞大的蛋白家族,主要存在于溶酶体中,发挥蛋白质降解功能。组织蛋白酶F参与MHC‖调节的抗原呈现作用,是机体免疫的一种机制。因此,该过程可能与烟粉虱调控自身免疫状态应对病毒入侵有关。
关于烟粉虱取食ToCV侵染番茄的转录组研究已有报道[21,33-34],但取食时间点主要集中在24,48 h。本研究进行了6,12,24,48 h 4个时间的转录组分析,结果发现,烟粉虱在应对ToCV感染过程中基因活跃度并不是持续增强或持续降低,而是有一个转折点即12 h。该时间点下,烟粉虱体内包括解毒酶、保护酶在内的防御基因数量、转录水平最低,基因功能上也呈现出与其他时间点截然相反的结果。由此可见,烟粉虱取食ToCV侵染番茄可能引起了其解毒酶、保护酶基因表达的改变,并通过溶酶体途径调控自身免疫应对ToCV入侵。研究结果有助于进一步阐明烟粉虱取食ToCV获毒后的防御机制,丰富烟粉虱-植物病毒-寄主植物间的互作理论,为田间ToCV的有效防控提供科学依据。
[1] Bello V H,Watanabe L F M,Fusco L M,de Marchi B R,da Silva F B,Gorayeb E S,Moura M F,de Souza I M,Muller C,Salas F J S,Yuki V A,de Freitas Bueno R C O,Pavan M A,Krause-Sakate R. Outbreaks of Bemisia tabaci Mediterranean species in vegetable crops in São Paulo and Paran States,Brazil[J].Bulletin of Entomological Research,2020,110(4):487-496. doi:10.1017/S0007485319000841.
States,Brazil[J].Bulletin of Entomological Research,2020,110(4):487-496. doi:10.1017/S0007485319000841.
[2] Rao Q,Luo C,Zhang H,Guo X,Devine G J. Distribution and dynamics of Bemisia tabaci invasive biotypes in central China[J].Bulletin of Entomological Research,2011,101(1):81-88. doi:10.1017/S0007485310000428.
[3] Pan H P,Chu D,Ge D Q,Wang S L,Wu Q J,Xie W,Jiao X G,Liu B M,Yang X,Yang N N,Su Q,Xu B Y,Zhang Y J. Further spread of and domination by Bemisia tabaci (Hemiptera:Aleyrodidae)biotype Q on field crops in China[J].Journal of Economic Entomology,2011,104(3):978-985. doi:10.1603/ec11009.
[4] Yao F L,Zheng Y,Huang X Y,Ding X L,Zhao J W,Desneux N,He Y X,Weng Q Y. Dynamics of Bemisia tabaci biotypes and insecticide resistance in Fujian Province in China during 2005-2014[J].Scientific Reports,2017,7:40803. doi:10.1038/srep40803.
[5] Fiallo-Olivé E,Navas-Castillo J. Tomato chlorosis virus,an emergent plant virus still expanding its geographical and host ranges[J].Molecular Plant Pathology,2019,20(9):1307-1320. doi:10.1111/mpp.12847.
[6] Zhao R N,Wang R,Wang N,Fan Z F,Zhou T,Shi Y C,Chai M. First report of Tomato chlorosis virus in China[J].Plant Disease,2013,97(8):1123. doi:10.1094/PDIS-12-12-1163-PDN.
[7] 周涛,杨普云,赵汝娜,师迎春,原锴,范在丰. 警惕番茄褪绿病毒在我国的传播和危害[J].植物保护,2014,40(5):196-199. doi:10.3969/j.issn.0529-1542.2014.05.038.
Zhou T,Yang P Y,Zhao R N,Shi Y C,Yuan K,Fan Z F. Alarming the transmission and damage of Tomato chlorosis virus in China[J]. Plant Protection,2014,40(5):196-199.
[8] 王翠琳,冯佳,孙晓辉,王少立,赵静,刘金亮,竺晓平. 北方四省区番茄褪绿病毒的分子鉴定[J].植物保护,2017,43(2):141-145. doi:10.3969/j.issn.0529-1542.2017.02.024.
Wang C L,Feng J,Sun X H,Wang S L,Zhao J,Liu J L,Zhu X P. Molecular identification of Tomato chlorosis virus from four provinces or autonomous region in Northern China[J].Plant Protection,2017,43(2):141-145 .
[9] 王志荣,王孝宣,杜永臣,高建昌,国艳梅,黄泽军. 番茄褪绿病毒病研究进展[J].园艺学报,2016,43(9):1735-1742. doi:10.16420/j.issn.0513-353x.2016-0571.
Wang Z R,Wang X X,Du Y C,Gao J C,Guo Y M,Huang Z J. Research progress on Tomato chlorosis virus disease[J].Acta Horticulturae Sinica,2016,43(9):1735-1742.
[10] 魏可可,李洁,丁天波,褚栋. 番茄褪绿病毒在国内外的分布、鉴别方法及粉虱传毒特性的研究进展[J].中国蔬菜,2018(1):19-24.
Wei K K,Li J,Ding T B,Chu D. Research progress on distribution,identification method of Tomato chlorosis virus (ToCV)and white fly transmission characteristics[J]. China Vegetables,2018(1):19-24.
[11] Wisler G C,Duffus J E,Liu H Y,Li R H. Ecology and epidemiology of whitefly-transmitted clostero viruses[J].Plant Disease,1998,82(3):270-280. doi:10.1094/PDIS.1998.82.3.270.
[12] Wintermantel W M,Cortez A A,Anchieta A G,Gulati-Sakhuja A,Hladky L L. Co-infection by two criniviruses alters accumulation of each virus in a host-specific manner and influences efficiency of virus transmission[J].Phytopathology®,2008,98(12):1340-1345. doi:10.1094/PHYTO-98-12-1340.
[13] Shi X B,Tang X,Zhang X,Zhang D Y,Li F,Yan F,Zhang Y J,Zhou X G,Liu Y. Transmission efficiency,preference and behavior of Bemisia tabaci MEAM1 and MED under the influence of Tomato chlorosis virus[J].Frontiers in Plant Science,2017,8:2271. doi:10.3389/fpls.2017.02271.
[14] 曹增,王金娜,张友军,吴青君,谢文,王少丽. 烟粉虱取食感染 TYLCV 番茄对其解毒酶和保护酶活性的影响[J].植物保护,2015,41(6):103-108,112. doi:10.3969/j.issn.0529-1542.2015.06.018.
Cao Z,Wang J N,Zhang Y J,Wu Q J,Xie W,Wang S L. Effects of feeding on TYLCV-infected tomato on detoxification enzyme and protective enzymes of Bemisia tabaci (Gennadius)[J].Plant Protection,2015,41(6):103-108,112.
[15] 孟琳钦,李丹丹,苏丹,赵惠燕,胡祖庆. 取食感染大麦黄矮病毒小麦后麦二叉蚜体内保护酶和解毒酶活性变化[J].植物保护学报,2019,46(3):707-708. doi:10.13802/j.cnki.zwbhxb.2019.2018059.
Meng L Q,Li D D,Su D,Zhao H Y,Hu Z Q. Activities of protective and detoxifying enzymes in spring-grain aphid Schizaphis graminum(Hemiptera:Aphididae)fed on wheat infected with Barley yellow dwarf virus[J].Journal of Plant Protection,2019,46(3):707-708.
[16] Lozinskaya Y L,Slepneva I A,Khramtsov V V,Glupov V V. Changes of the antioxidant status and system of generation of free radicals in hemolymph of Galleria mellonella larvae at microsporidiosis[J].Journal of Evolutionary Biochemistry and Physiology,2004,40(2):119-125. doi:10.1023/B:JOEY.0000033802.97996.65.
[17] 刘建业,钱蕾,可芮,陈晓燕,李正跃,桂富荣. CO2浓度升高对取食不同寄主的西花蓟马和花蓟马生理酶活性的影响[J].植物保护学报,2017,44(1):45-53. doi:10.13802/j.cnki.zwbhxb.2017.2015101.
Liu J Y,Qian L,Ke R,Chen X Y,Li Z Y,Gui F R. Effects of elevated carbon dioxide on the activities of physiological enzymes in thrips Frankliniella occidentalis and F. intonsa fed on different host plants[J].Journal of Plant Protection,2017,44(1):45-53.
[18] 陈晨,蒋德春,杨洪,金道超. 南方水稻黑条矮缩病对褐飞虱和白背飞虱体内三种保护酶活性的影响[J].环境昆虫学报,2016,38(1):113-118. doi:10.3969/j.issn.1674-0858.2016.01.14.
Chen C,Jiang D C,Yang H,Jin D C. Effects of southern Rice black streaked dwarf virus on defense enzymes in brown planthopper and white-blacked planthopper[J].Journal of Environmental Entomology,2016,38(1):113-118.
[19] Li J,Ding T B,Chi H,Chu D. Effects of Tomato chlorosis virus on the performance of its key vector,Bemisia tabaci,in China[J].Journal of Applied Entomology,2018,142(3):296-304.doi:10.1111/jen.12477.
[20] Luan J B,Wang Y L,Wang J,Wang X W,Liu S S. Detoxification activity and energy cost is attenuated in whiteflies feeding on Tomato yellow leaf curl China virus-infected tobacco plants[J].Insect Molecular Biology,2013,22(5):597-607. doi:10.1111/imb.12048.
[21] Kaur N,Chen W B,Zheng Y,Hasegawa D K,Ling K S,Fei Z J,Wintermantel W M. Transcriptome analysis of the white fly, Bemisia tabaci MEAM1 during feeding on tomato infected with the crinivirus,Tomato chlorosis virus,identifies a temporal shift in gene expression and differential regulation of novel orphan genes[J].BMC Genomics,2017,18(1):370. doi:10.1186/s12864-017-3751-1.
[22] Navas-Castillo J,Camero R,Bueno M,Moriones E. Severe yellowing outbreaks in tomato in Spain associated with infections of Tomato chlorosis virus[J].Plant Disease,2000,84(8):835-837.doi:10.1094/PDIS.2000.84.8.835.
[23] 代惠洁,程琳,竺晓平,刘永杰,赵静.烟粉虱传播的番茄褪绿病毒和番茄黄化曲叶病毒对不同番茄品种的复合侵染[J].植物保护学报,2017,44(3):453-459. doi: 10.13802/j.cnki.zwbhxb.2017.2016090.
Dai H J,Cheng L,Zhu X P,Liu Y J,Zhao J. Co-infections of Tomato chlorosis virus and Tomato yellow leaf curl virus transmitted by tobacco white fly Bemisia tabaci to different tomato varieties[J].Journal of Plant Protection,2017,44(3):453-459.
[24] Fereres ![]() M F,Favaro C F,Azevedo K E,Landi C H,Maluta N K,Bento J M,Lopes J R. Tomato infection by whitefly-transmitted circulative and non-circulative viruses induce contrasting changes in plant volatiles and vector behaviour[J].Viruses,2016,8(8):225. doi:10.3390/v8080225.
M F,Favaro C F,Azevedo K E,Landi C H,Maluta N K,Bento J M,Lopes J R. Tomato infection by whitefly-transmitted circulative and non-circulative viruses induce contrasting changes in plant volatiles and vector behaviour[J].Viruses,2016,8(8):225. doi:10.3390/v8080225.
[25] Orfanidou C G,Pappi P G,Efthimiou K E,Katis N I,Maliogka V I. Transmission of Tomato chlorosis virus (ΤοCV)by Bemisia tabaci biotype Q and evaluation of four weed species as viral sources[J].Plant Disease,2016,100(10):2043-2049. doi:10.1094/PDIS-01-16-0054-RE.
[26] 李娇娇,于毅,张秀霞,竺晓平,刘永光,张安盛. Q型烟粉虱成虫传播番茄褪绿病毒的能力[J].植物保护学报,2018,45(2):228-234. doi:10.13802/j.cnki.zwbhxb.2018.2016063.
Li J J,Yu Y,Zhang X X,Zhu X P,Liu Y G,Zhang A S. Transmission of Tomato chlorosis virus (ToCV)by Bemisia tabaci biotype Q adults[J]. Journal of Plant Protection,2018,45(2):228-234.
[27] 唐鑫. Q烟粉虱传播番茄褪绿病毒(Tomato chlorosis virus,ToCV)的特性机制研究[D].长沙: 湖南农业大学,2018.
Tang X. Characteristic research of the mechnisam on Bemisia tabaci Q transmission Tomato chlorosis virus[D].Changsha:Hunan Agricultural University,2018.
[28] Shi X B,Wang X Z,Zhang D Y,Zhang Z H,Zhang Z,Cheng J,Zheng L M,Zhou X G,Tan X Q,Liu Y. Silencing of odorant-binding protein gene OBP3 using RNA interference reduced virus transmission of Tomato chlorosis virus[J].International Journal of Molecular Sciences,2019,20(20):4969. doi:10.3390/ijms20204969.
[29] Anders S,Huber W. Differential expression analysis for sequence count data[J].Nature Precedings,2010,11(10):R106. doi:10.1186/gb-2010-11-10-r106.
[30] 刘烁安,符悦冠,黄武仁,付步礼,曾东强. 螺旋粉虱感染蜡蚧轮枝菌对其保护酶和解毒酶活性的影响[J].植物保护,2013,39(3):7-11,17. doi:10.3969/j.issn.0529-1542.2013.03.002.
Liu S A,Fu Y G,Huang W R,Fu B L,Zeng D Q. Variation in the activities of protective and detoxification enzymes in Aleurodicus dispersus infected by Verticillium lecanii[J].Plant Protection,2013,39(3):7-11,17.
[31] He Y Z,Wang Y M,Yin T Y,Fiallo-Oliv E,Liu Y Q,Hanley-Bowdoin L,Wang X W. A plant DNA virus replicates in the salivary glands of its insect vector via recruitment of host DNA synthesis machinery[J].Proceedings of the National Academy of Sciences of the United States of America,2020,117(29):16928-16937. doi:10.1073/pnas.1820132117.
[32] 黄志君,曾文年,胡占英. 昆虫唾液腺的研究进展[J].广东蚕业,2007,41(2):44-48.
Huang Z J,Zeng W N,Hu Z Y. Progress of study on insect salivary gland[J].Guangdong Sericulture,2007,41(2):44-48.
[33] Ding T B,Li J,Chen E H,Niu J Z,Chu D. Transcriptome profiling of the whitefly Bemisia tabaci MED in response to single infection of Tomato yellow leaf curl virus,Tomato chlorosis virus,and their Co-infection[J].Frontiers in Physiology,2019,10:302. doi:10.3389/fphys.2019.00302.
[34] Hasegawa D K,Chen W B,Zheng Y,Kaur N,Wintermantel W M,Simmons A M,Fei Z J,Ling K S. Comparative transcriptome analysis reveals networks of genes activated in the whitefly,Bemisia tabaci when fed on tomato plants infected with Tomato yellow leaf curl virus[J].Virology,2018,513:52-64. doi:10.1016/j.virol.2017.10.008.