20世纪80年代至今,我国粮食产量增加73%,同时化肥用量增加476%,农业生产所用氮肥利用率仅为30%左右[1]。传统农业对化肥的过度依赖,破坏了土壤养分平衡与微生物群落的稳定[2],严重威胁着资源与环境安全,不利于农业可持续发展。生物有机肥是肥菌兼具的新一代微生物肥料,凭借其绿色安全、节约资源的优势成为我国农业绿色、可持续发展的突破口[3]。有研究表明[4-5],生物有机肥替代部分化肥,有利于改善土壤养分循环、增加土壤酶活性、提高作物产量与品质。刘雷等[6]研究发现,增施生物有机肥显著提高了根际土壤酶的活性,改善了土壤肥力水平。此外,生物有机肥中含有的大量促生菌,在促进根系生长,增强作物抗病、抗逆性方面发挥不可替代的作用[7-8]。Chen等[9]研究发现,生物有机肥使土壤微生物多样性与丰富度升高,土壤养分循环与有机质的代谢更加旺盛,显示出更高的生产力以及更强的抗病、抗逆性[10]。陆海飞等[11]研究发现,配施生物有机肥后,土壤细菌群落多样性与丰富度指数显著增加。因此,通过生物有机肥调控土壤微生物群落结构与活动,在保证产量的基础上,减少化肥的施用,对于解决过量施肥带来的环境污染问题、实现“绿色农业”具有重要的意义[12]。
小麦是我国重要的粮食作物,保障其产量持续稳定地增加,关乎国家的粮食安全。将生物有机肥应用于麦田土壤,利用其可改善土壤养分循环、调节根际微生物区系、提高产量与品质,探索生物有机肥替代部分化肥的科学比例与用量,对于促进我国农业经济发展具有重要意义。目前,关于生物有机肥替代部分化肥对小麦产量构成、生育期内酶活影响的报道较多,但是通过高通量测序技术,研究生物有机肥对小麦根际微生物群落结构调控机制尚不多见。
本试验以大田小麦为研究对象,探索生物有机肥替代部分化肥对小麦根际土壤养分、酶活、土壤细菌群落结构的影响,并通过冗余分析研究上述环境因子与细菌群落结构的相关性,旨在为改良传统施肥模式,促进化肥的减量增效,推进生物有机肥规模化应用提供理论支持。
1 材料和方法
1.1 试验地概况
试验地点位于山西省临汾市洪洞县秦壁村(36°13′40.03″N,111°42′1.85″E),平均海拔为530 m,属温带季风气候,年平均温度12.3 ℃,年平均降水量493.3 mm,土壤类型为褐土。
1.2 试验材料
供试小麦品种为莘麦818,由山东莘州种业有限公司育种;供试化肥为复合肥料(N∶P2O5∶K2O=25∶14∶6);供试生物有机肥的有机质含量≥45%,功能菌种为枯草芽孢杆菌(Bacillus subtilis)(有效活菌数≥1.0×109 cfu/g),由太原山大新科技发展有限公司生产。
1.3 试验方法
1.3.1 试验设计 试验于2019年10月9日至2020年6月10日进行,采用随机区组设计,共设4个处理,每个处理3次重复。小区面积50.0 m2(25.0 m×2.0 m)。试验设计方案见表1。
表1 试验设计方案
Tab.1 Design of experimental treatment
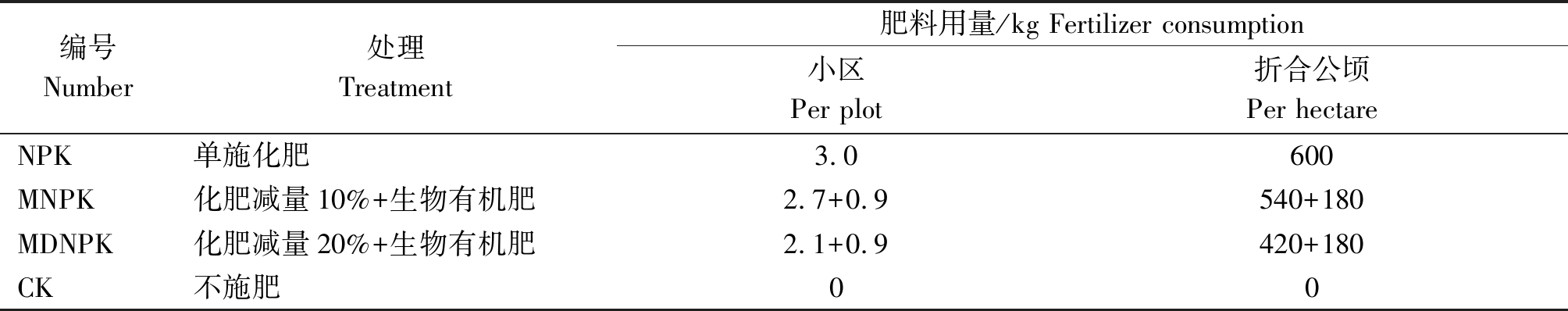
编号Number处理Treatment肥料用量/kg Fertilizer consumption小区Per plot折合公顷Per hectareNPK单施化肥3.0600MNPK化肥减量10%+生物有机肥2.7+0.9540+180MDNPK化肥减量20%+生物有机肥2.1+0.9420+180CK不施肥00
1.3.2 样品采集与处理 2020年4月18日,在小麦的拔节期采集土壤样品。采用五点取样法,去除表层浮土后,收集0~20 cm小麦根际部位土样,混合均匀,其中一部分土样自然风干后过0.2 mm筛,用于后续土壤养分含量的测定;另一部分土壤样品在4 ℃环境下保存,用于土壤酶活的测定和土壤DNA的提取。
1.3.3 土壤细菌 总DNA提取与PCR扩增使用PowerSoil DNA Isolation Kit(MoBio)试剂盒提取土壤总DNA;采用1.2%琼脂糖凝胶电泳检测提取DNA的大小与完整性,采用Nanodrop 2000检测提取DNA的纯度。
采用通用引物338F对细菌16S rRNA的V3~V4区进行特异性扩增,在338F的3′端添加特异的Barcode序列区分样品。PCR反应体系为25 μL;反应条件为:98 ℃预变性 2 min;98 ℃变性15 s,55 ℃复性30 s,72 ℃延伸30 s,共25个循环;72 ℃延伸5 min,反应结束,产物混匀后通过2.0%的琼脂糖凝胶电泳检测,并将产物进行纯化,回收目标片段,按照各样本测序的需用量,将各产物等摩尔数混合。文库的构建与高通量测序委托上海派森诺生物科技股份有限公司完成,测序平台为Illumina MiSeq平台。
1.4 测定项目及方法
1.4.1 土壤养分含量 土壤有机质(SOM)含量测定采用低温外热重铬酸钾比色法;全氮(TN)含量测定采用凯氏定氮法;速效磷(AP)含量测定采用钼锑抗比色法;速效钾(AK)含量测定采用火焰分光光度计法[13]。
1.4.2 土壤酶活测定 土壤脲酶(Solid-Urease,S-UE)活性测定采用苯酚-次氯酸钠比色法;蔗糖酶(Solid-Sucrase,S-SC)活性测定采用3,5-二硝基水杨酸比色法;中性磷酸酶(Soild-neutral-phosphatase,S-NP)活性测定采用磷酸苯二钠比色法。所用土壤脲酶、蔗糖酶和中性磷酸酶试剂盒均购于南京建成生物工程研究所。
1.4.3 小麦产量的测定 于6月10日在小麦收获期测定小麦产量。各处理随机选取3个1 m2的样点,对小麦株高、穗粒数、千粒质量和产量进行统计。
1.5 数据处理与统计分析
测序结果首先运用Qiimev1.8.0软件识别疑问序列,调用USEARCH检查并剔除嵌合体序列,获得Effective Tags;随后采用序列比对软件UCLUSTv5.2.236对得到的Effective Tags按照97%的相似度进行OTU聚类[14],并选取其中出现频率最高的序列作为代表序列,最终通过数据库分析确定各OTU对应的分类水平[15]。
数据处理与统计分析采用Microsoft Excel 2010 和SPSS 23.0 软件进行,采用Canoco for Windows 5.0软件对土壤养分、酶活和细菌群落结构的相关性进行冗余分析(Redundancy analysis,RDA)。
2 结果与分析
2.1 不同处理对根际土壤养分含量的影响
土壤养分含量反映土壤的肥力水平,直接影响作物的生长状况。由表2可知,CK处理SOM、AP和AK养分含量均为最低;与NPK处理相比,生物有机肥替代部分化肥(MNPK、MDNPK)提高了根际土壤有机质、总氮、速效磷、速效钾含量,其中,化肥减量10%+生物有机肥(MNPK)处理有机质、总氮、速效磷、速效钾含量均最高,较NPK处理分别增加17.4%,12.4%,16.2%,19.2%。
表2 不同处理对小麦根际土壤养分含量的影响
Tab.2 Effects of different treatments on the nutrient content of wheat rhizosphere soil
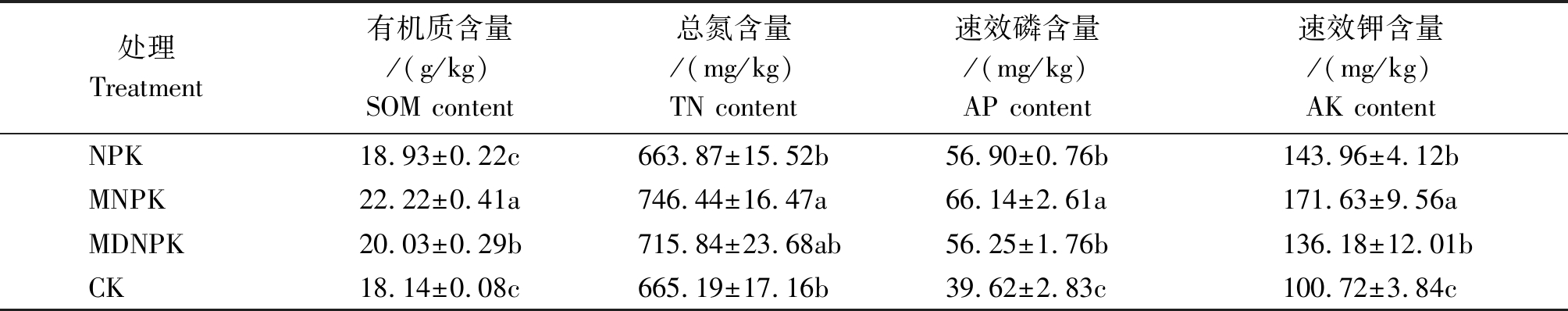
处理Treatment有机质含量/(g/kg)SOM content总氮含量/(mg/kg)TN content速效磷含量/(mg/kg)AP content速效钾含量/(mg/kg)AK contentNPK18.93±0.22c663.87±15.52b56.90±0.76b143.96±4.12bMNPK22.22±0.41a746.44±16.47a66.14±2.61a171.63±9.56aMDNPK20.03±0.29b715.84±23.68ab56.25±1.76b136.18±12.01bCK18.14±0.08c665.19±17.16b39.62±2.83c100.72±3.84c
注:表中数值均为平均值±标准误差;同一指标数值后不同小写字母表示差异显著(P<0.05)。表3-5同。
Note:Data in the table are the average value of the measured data of wheat straw±standard error; Different lowercase letters indicated significant difference among treatment at P<0.05 level. The same as Tab.3-5.
2.2 不同处理对根际土壤酶活的影响
脲酶是促进土壤氮素循环的关键酶,可以增加土壤中铵态氮的含量,促进植物根系对氮素的吸收利用[16]。蔗糖酶又称转化酶,参与土壤碳素循环过程,与土壤中有机质含量和根际微生物丰富度、多样性密切相关[17]。磷酸酶是一种水解性酶,能促进土壤脱磷,提高土壤中有效磷的含量。由表3可知,CK处理的土壤脲酶、蔗糖酶和中性磷酸酶的活性均为最低;与NPK相比,生物有机肥替代部分化肥(MNPK、MDNPK)处理提高了土壤脲酶、蔗糖酶和中性磷酸酶的活性,其中,MNPK处理S-UE与S-SC活性较NPK处理分别显著升高19.0%和9.7%(P<0.05);MNPK和MDNPK处理,S-NP活性较NPK处理分别显著升高18.3%,21.2%(P<0.05),但MNPK和MDNPK处理间差异不显著。结果表明,MNPK处理显著增加了土壤中S-UE、S-SC、S-NP的活性,与土壤养分含量结果变化一致。
表3 不同处理对小麦根际土壤酶活影响
Tab.3 Effects of different treatments on soil enzyme activities in wheat rhizosphere mg/g
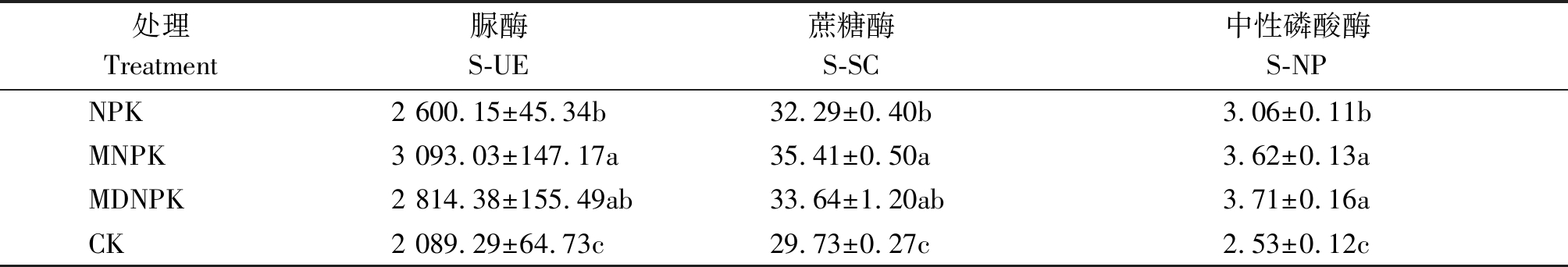
处理Treatment脲酶S-UE蔗糖酶S-SC中性磷酸酶S-NPNPK2 600.15±45.34b32.29±0.40b3.06±0.11bMNPK3 093.03±147.17a35.41±0.50a3.62±0.13aMDNPK2 814.38±155.49ab33.64±1.20ab3.71±0.16aCK2 089.29±64.73c29.73±0.27c2.53±0.12c
2.3 测序结果分析
16S rRNA高通量测序得到的初始序列经质量筛查后,共得到642 180条有效序列,基于97%的相似性进行归并与划分,一共得到12 452个OTU,分别属于29门93纲190目293科528属。通过对不同处理细菌群落OTU变化的Venn图分析,结果发现(图1),CK、NPK、MNPK、MDNPK这4个处理分别得到5 990,5 942,6 034,5 690个OTU;4个处理共有的OTU数有2 073个;特有的OTU数分别为1 640,2 089,1 577,1 460个,其中,NPK处理中特有的OTU数占总OTU数的51.3%,说明仅施化肥会使小麦根际土壤细菌群落OTU数发生显著变化。
Chao1指数和ACE指数用于评价群落丰富度,其中,Chao1指数用于估计群落样本中的OTU数,能更好地评价低丰度物种的分布状况,ACE指数用来估计群落样本中的OTU数,体现了某一OTU在样本中出现的概率;Shannon指数和Simpson指数用于评价群落多样性与均匀度。由表4可知,NPK处理Chao1指数、ACE指数、Shannon指数、Simpson指数均为最低,其中,NPK处理的Chao1指数和ACE指数显著低于MNPK与MDNPK处理。说明只施化肥显著降低了土壤细菌群落丰富度,生物有机肥替代部分化肥有助于恢复土壤细菌群落多样性与丰富度。
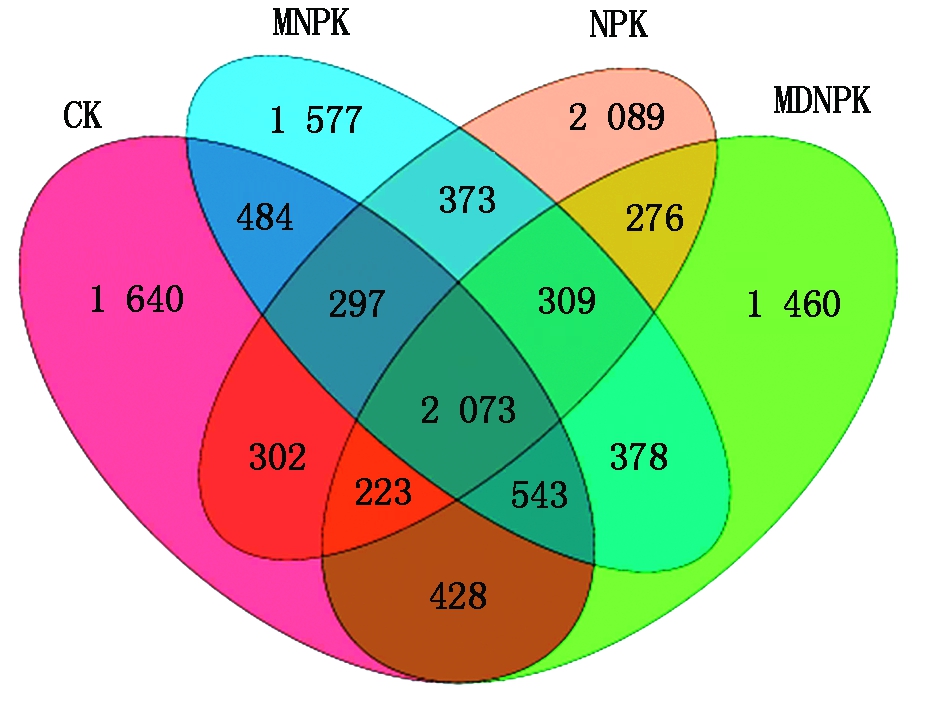
图1 不同处理土壤细菌群落OTU Venn图
Fig.1 Venn diagram of soil bacterial community OTUs in soil samples from different treatments
表4 不同处理土壤细菌多样性指数统计
Tab.4 Diversity indices statistical results of soil bacterial communities in different treatments
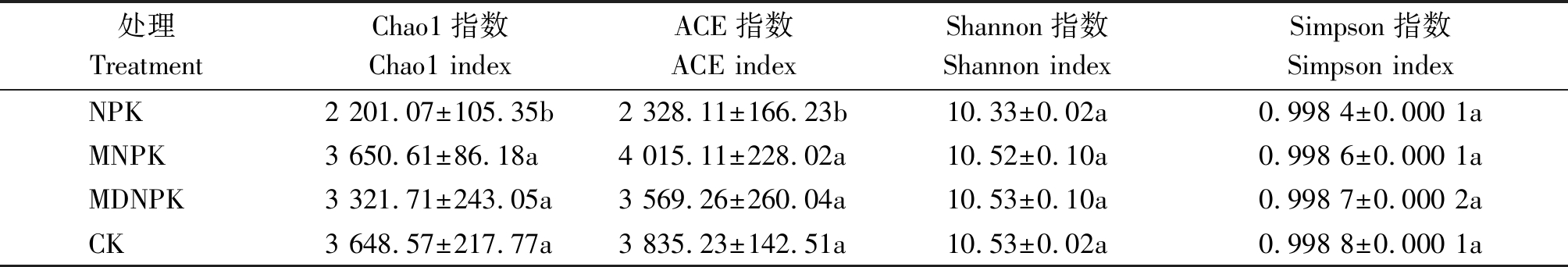
处理TreatmentChao1指数Chao1 indexACE指数ACE indexShannon指数Shannon indexSimpson指数Simpson indexNPK2 201.07±105.35b2 328.11±166.23b10.33±0.02a0.998 4±0.000 1aMNPK3 650.61±86.18a4 015.11±228.02a10.52±0.10a0.998 6±0.000 1aMDNPK3 321.71±243.05a3 569.26±260.04a10.53±0.10a0.998 7±0.000 2aCK3 648.57±217.77a3 835.23±142.51a10.53±0.02a0.998 8±0.000 1a
2.4 不同分类水平上的物种注释及分析
2.4.1 基于细菌门水平上群落结构变化 各处理门水平上细菌群落结构如图2所示,在相对丰度前10的门中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)为优势菌门,在CK、NPK、MNPK、MDNPK这4个处理中,变形菌门的丰度最高,占29.7%~36.0%;放线菌门占15.4%~17.8%;酸杆菌门占14.6%~19.0%,绿弯菌门占11.4%~12.3%;芽单胞菌门占6.7%~10.9%。在CK、NPK、MNPK、MDNPK这4个处理中,5个优势菌门的丰度分别为86.0%,86.9%,87.2%,85.1%,无显著差异。拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、己科河菌门(Rokubacteria)、髌骨细菌门(Patescibacteria)、疣微菌门(Verrucomicrobia)、硝化螺旋菌门(Nitrospirae)等其他菌门丰度较低,为劣势菌门。与NPK处理相比,MNPK与MDNPK处理的变形菌门丰度显著升高(P<0.05),MNPK处理的芽单胞菌门丰度显著升高(P<0.05),其余菌门丰度并无显著变化。结果表明,生物有机肥替代部分化肥使变性菌门、芽单胞菌门这些功能菌门丰度升高,且能够平衡根际土壤中优势菌门的丰度。
2.4.2 基于细菌属水平上群落结构变化 由图3可知,不同处理间细菌群落组成及分布相似,选取丰度前20菌属进行分析,相对丰度>1%的一共有11个菌属。与CK处理相比,MNPK处理丰度升高的有鞘氨醇单胞菌属(Sphingomonas)、水沉积物杆菌属(Ilumatobacter)、溶杆菌属(Lysobacter)、藤黄色单胞菌属(Luteimonas)、野野村菌属(Nonomuraea)、Iamia、马赛菌属(Massilia)等7个菌属;赭黄嗜盐囊菌属(Haliangium)、MND1、RB41、Subgroup_10这4个菌属丰度降低,其中,Subgroup_10丰度显著降低(P<0.05)。与CK处理相比,MDNPK处理丰度升高的有鞘氨醇单胞菌属、水沉积物杆菌属、溶杆菌属、马赛菌属、藤黄色单胞菌属这5个菌属,其中,鞘氨醇单胞菌属丰度显著升高(P<0.05);MND1、野野村氏菌zamia、RB41、Iamia、Subgroup_10、赭黄嗜盐囊菌属这6个菌属丰度降低,其中,赭黄嗜盐囊菌属丰度显著降低(P<0.05)。结果表明,生物有机肥部分替代化肥使小麦根际土壤中鞘氨醇单胞菌属、水沉积物杆菌属、溶杆菌属、马赛菌属丰度升高,赭黄嗜盐囊菌属、Subgroup_10丰度降低,但不会影响优势菌属的种类。

图2 不同处理对细菌门水平相对丰度的影响
Fig.2 Effects of different treatments on the relative abundance of the bacterial phyla
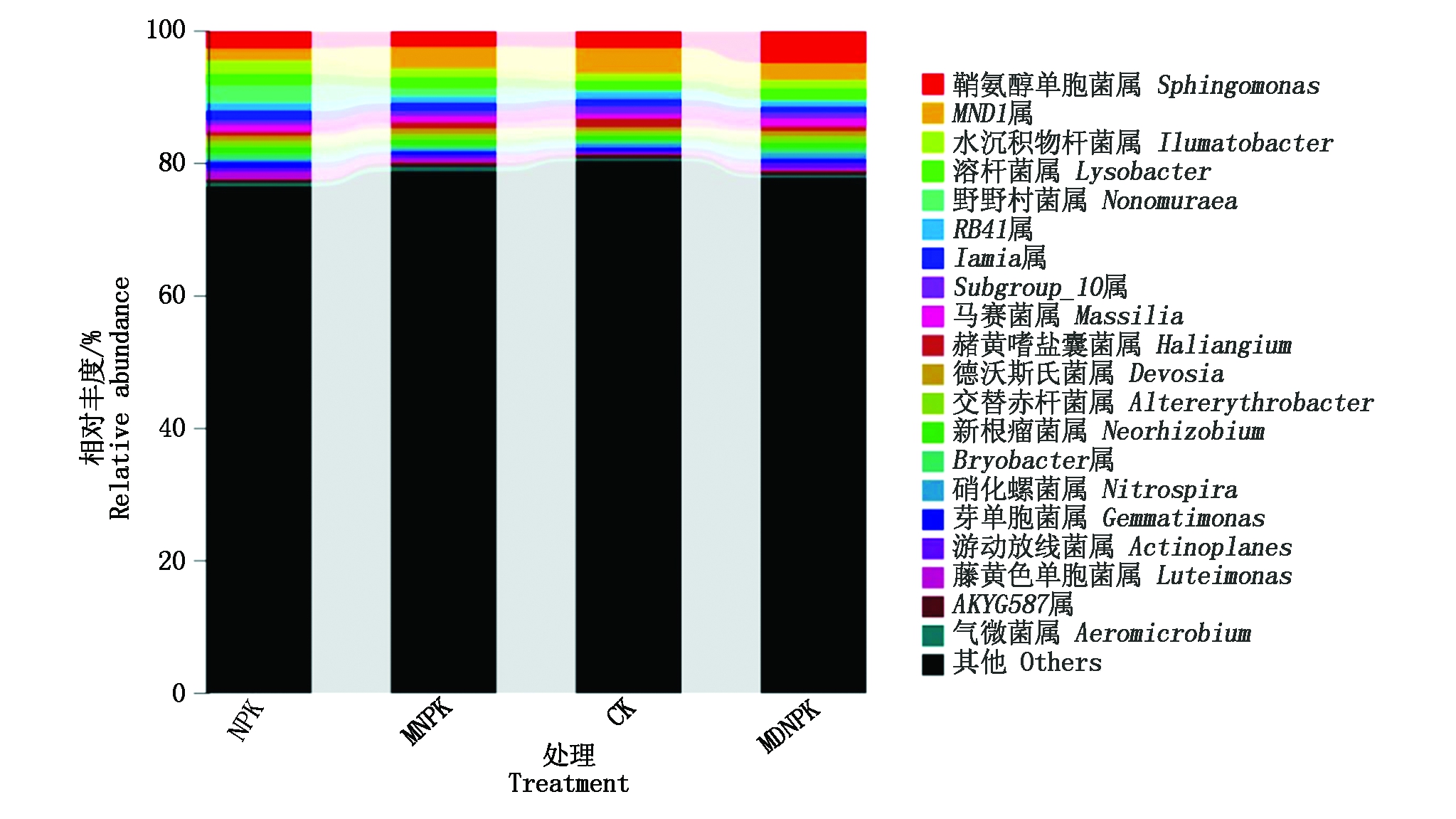
图3 不同处理对细菌属水平相对丰度的影响
Fig.3 Effects of different treatments on the relative abundance of the bacterial genera
2.5 土壤细菌群落结构与环境因子的关系
有研究表明,不同的环境因子会影响土壤细菌的群落结构[18-19]。本研究采用冗余分析研究土壤养分含量、酶活对属水平上细菌群落结构的影响,由图4可知,土壤养分与酶活一共解释了77.9%的细菌群落结构变化,第1轴与第2轴分别解释了响应变量的51.8%和16.1%。进一步分析发现,S-NP(P=0.034)和S-SC(P=0.016)是影响细菌群落结构的主要因子;S-NP、S-SC、TN与鞘氨醇单胞菌属、溶杆菌属、交替红色杆菌属、硝化螺旋菌属的丰度正相关,与RB41丰度负相关;S-UE、SOM、AP、AK与水沉积物杆菌属、野野村菌属、Iamia、马赛菌属、德沃斯氏菌属、新根瘤菌属、Bryobacter丰度正相关,与MND1、Subgroup_10、赭黄嗜盐囊菌属丰度负相关。
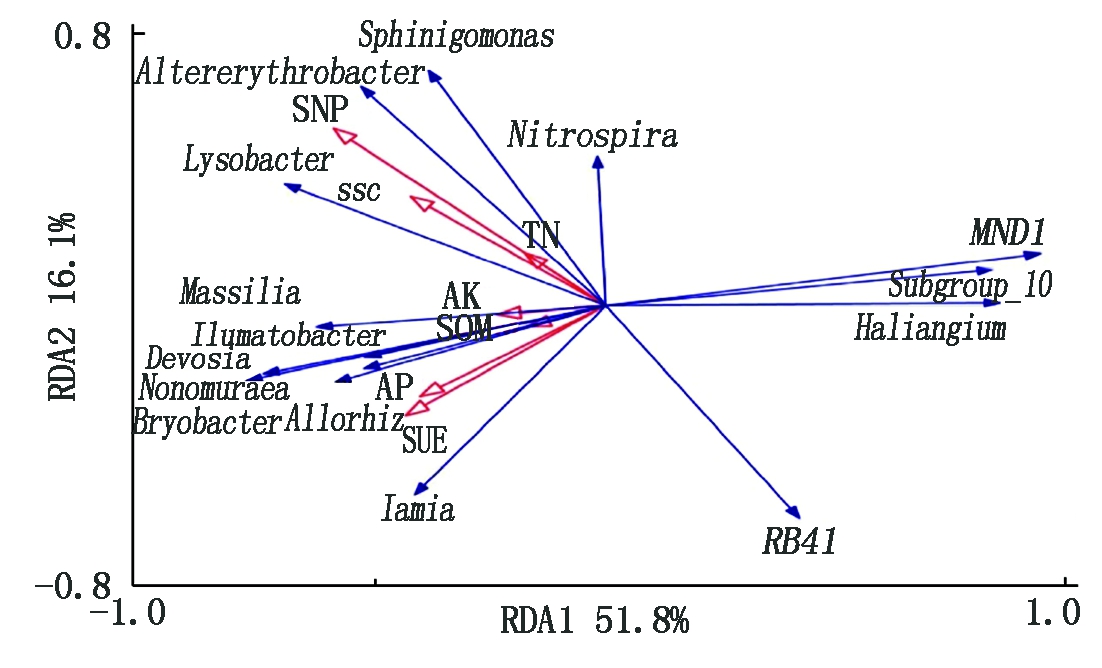
图4 属水平上细菌相对丰度与土壤
养分含量、酶活的冗余分析(RDA)
Fig.4 Redundancy analysis (RDA)among the relative abundance of the bacterial genera,soil nutrient content and enzyme activities
2.6 不同处理对小麦产量的影响
由表5可知,与单施化肥处理(NPK)相比,生物有机肥替代部分化肥处理对小麦株高、穗粒数和千粒质量等农艺性状均没有显著影响,与NPK处理相比,MNPK与MDNPK处理小麦产量显著提高9.3%,4.4%(P<0.05)。与单施化肥相比,生物有机肥替代部分化肥处理可以保证小麦产量。
3 结论与讨论
3.1 生物有机肥替代部分化肥对根际土壤养分与酶活的影响
植物根际是植物根系、土壤、微生物相互作用的一个微区域。土壤酶活性反映土壤微生物的活性,能更迅速反映不同施肥处理对土壤养分水平的影响[20],在土壤有机质分解与其他养分循环过程中发挥着重要作用[21-22]。土壤养分含量与土壤酶活共同反映土壤的肥力与功能水平,直接影响作物的生长状况,是评价土壤健康水平的重要指标。
表5 不同处理对小麦农艺性状及产量的影响
Tab.5 Effects of different treatments on agronomic trait and yield of wheat
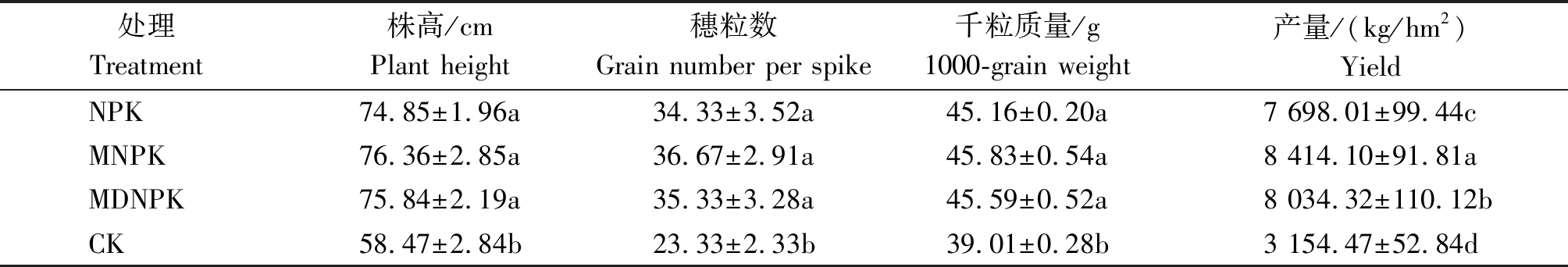
处理Treatment株高/cmPlant height穗粒数Grain number per spike千粒质量/g1000-grain weight产量/(kg/hm2)YieldNPK74.85±1.96a34.33±3.52a45.16±0.20a7 698.01±99.44cMNPK76.36±2.85a36.67±2.91a45.83±0.54a8 414.10±91.81aMDNPK75.84±2.19a35.33±3.28a45.59±0.52a8 034.32±110.12bCK58.47±2.84b23.33±2.33b39.01±0.28b3 154.47±52.84d
本研究结果表明,与NPK处理相比,MNPK与MDNPK处理后,小麦根际土壤养分SOM、TN、AP、AK含量与土壤酶S-UE、S-SC、S-NP活性均有增加的趋势,且MNPK处理效果最佳,说明化肥与生物有机肥合理组合,能够显著提高土壤养分含量与酶活水平。生物有机肥中含有大量有机质与丰富养分,能改善根际微环境,促进土壤养分的循环与积累,使土壤养分更加均衡,根系能更充分利用土壤养分,有助于土壤酶活性升高[23]。因此,生物有机肥替代部分化肥提高了土壤养分SOM、TN、AP、AK的含量以及土壤S-UE、S-SC、S-N活性,这与文献报道[24-25]的结果相一致。
3.2 生物有机肥替代部分化肥对根际土壤细菌群落的影响
生物有机肥中含有大量促生菌,根际促生菌是土壤微环境的重要组成部分,参与到有机质的分解、养分的转化等一系列土壤生物代谢过程,能降低过量施肥造成的生态退化,帮助修复土壤微生态,抑制土壤传播疾病。本试验对小麦根际土壤细菌群落进行高通量测序发现,生物有机肥替代部分化肥后土壤中变形菌门丰度明显升高,放线菌门丰度降低。变形菌门是一类具有固氮作用的功能微生物,其丰度升高,有利于土壤中氮素的积累和转化利用[26-27],放线菌门适宜生活于有机质含量较低的环境中,肥料中有机质的输入导致放线菌门丰度降低;相反酸杆菌门、拟杆菌门适宜于生活在养分含量高的环境中,故二者丰度呈现增加的趋势[28-29]。根际土壤中富集了鞘氨醇单胞菌属、溶杆菌属、硝化螺菌属、马赛菌属等一些具有促生和生防作用的功能菌属,其中,硝化螺菌属是一类硝化细菌,将土壤中的亚硝酸盐氧化为硝酸盐,供植物吸收利用;马赛菌属会定殖在植物根上[30],产生IAA和嗜铁素,从而促进植物生长[31-32]。
RDA分析显示,S-SC与S-NP活性是引起细菌群落结构变化的主要因素。生物有机肥替代部分化肥后,S-SC与S-NP活性与鞘氨醇单胞菌属、溶杆菌属、交替赤杆菌属、硝化螺菌属正相关,AK含量与水沉积物杆菌属、马赛菌属、新根瘤菌属呈正相关,这与Cheng等[33]的研究结果基本一致。结果表明,生物有机肥替代部分化肥能提高土壤养分有效性和酶活性,增强作物根际效应,定向富集具有生物防治与促生作用的功能微生物菌群,最终促进作物产量的提高。
目前,过量施肥导致化肥利用率过低,土壤养分结构与菌群多样性失衡等问题急需解决,通过调整传统“大水大肥”的施肥模式,探索适宜的生物有机肥替代化肥比例,可为解决该问题提供新的思路。本研究发现,生物有机肥替代10%化肥与常规施肥相比,小麦产量显著增加,但考虑到细菌群落组成与功能之间的复杂关系,短期施肥可能不足以使细菌群落结构发生稳定的差异,需要进行长期定位试验。后续关于小麦在不同土壤环境下,生物有机肥替代化肥最适比例仍有待进一步研究。
[1] 沈仁芳,孙波,施卫明,赵学强. 地上-地下生物协同调控与养分高效利用[J].中国科学院院刊,2017,32(6):566-574. doi:10.16418/j.issn.1000-3045.2017.06.003.
Shen R F,Sun B,Shi W M,Zhao X Q. Interactions between above-and below-ground organisms for nutrient-efficient utilization[J].Bulletin of Chinese Academy of Sciences,2017,32(6):566-574.
[2] Zhong W H,Gu T,Wang W,Zhang B,Lin X G,Huang Q R,Shen W S. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J].Plant and Soil,2010,326(1/2):511-522. doi:10.1007/s11104-009-9988-y.
[3] 张瑞福,颜春荣,张楠,李俊,沈其荣. 微生物肥料研究及其在耕地质量提升中的应用前景[J].中国农业科技导报,2013,15(5):8-16. doi:10.3969/j.issn.1008-0864.2013.05.02.
Zhang R F,Yan C R,Zhang N,Li J,Shen Q R. Studies on microbial fertilizer and its application prospects in improving arable land quality[J].Journal of Agricultural Science and Technology,2013,15(5):8-16.
[4] 姜莉莉,王开运,武玉国,王开元,王红艳. 施用生物有机肥对番茄果实品质及土壤生物学特性的影响[J].华北农学报,2020,35(6):141-147. doi:10.7668/hbnxb.20191308.
Jiang L L,Wang K Y,Wu Y G,Wang K Y,Wang H Y. Effect of application of bioorganic fertilizer on tomatoes fruit quality and soil biological characteristics[J].Acta Agriculturae Boreali-Sinica,2020,35(6):141-147.
[5] 胡诚,刘东海,乔艳,刘友梅,李双来,陈云峰. 施用生物有机肥对土壤酶活性及作物产量的影响[J].华北农学报,2017,32(S1):308-312. doi:10.7668/hbnxb.2017.S1.053.
Hu C,Liu D H,Qiao Y,Liu Y M,Li S L,Chen Y F. Effect of biological organic manure on soil enzyme activity and crop yields[J].Acta Agriculturae Boreali-Sinica,2017,32(S1):308-312.
[6] 刘雷,王梦亮,王俊红,高小音. 不同施肥方式对玉米生育期内根际土壤酶活性的影响[J].华北农学报,2018,33(6):199-204. doi:10.7668/hbnxb.2018.06.027.
Liu L,Wang M L,Wang J H,Gao X Y. Study on the activities of rhizosphere soil enzyme in different fertilization modes during maize growth[J].Acta Agriculturae Boreali-Sinica,2018,33(6):199-204.
[7] 沈仁芳,赵学强. 土壤微生物在植物获得养分中的作用[J].生态学报,2015,35(20):6584-6591. doi:10.5846/stxb201506051140.
Shen R F,Zhao X Q. Role of soil microbes in the acquisition of nutrients by plants[J].Acta Ecologica Sinica,2015,35(20):6584-6591.
[8] 崔仕春,杨秀芬,郑兴耘,杨怀文. 生物有机肥控制小麦全蚀病及作用机理初探[J].中国生物防治学报,2016,32(1):112-118. doi:10.16409/j.cnki.2095-039x.2016.01.017.
Cui S C,Yang X F,Zheng X Y,Yang H W. Efficiency and mechanism of bio-organic fertilizer in suppressing wheat take-all pathogen Gaeumannomyces graminis var.tritici[J].Chinese Journal of Biological Control,2016,32(1):112-118.
[9] Chen Q L,Cui H L,Su J Q,Penuelas J,Zhu Y G. Antibiotic resistomes in plant microbiomes[J].Trends in Plant Science,2019,24(6):530-541. doi:10.1016/j.tplants.2019.02.010.
[10] Bakker P A H M,Pieterse C M J,de Jonge R,Berendsen R L. The soil-borne legacy[J].Cell,2018,172(6):1178-1180. doi:10.1016/j.cell.2018.02.024.
[11] 陆海飞,郑金伟,余喜初,周惠民,郑聚锋,张旭辉,刘晓雨,程琨,李恋卿. 长期无机有机肥配施对红壤性水稻土微生物群落多样性及酶活性的影响[J].植物营养与肥料学报,2015,21(3):632-643. doi:10.11674/zwyf.2015.0310.
Lu H F,Zheng J W,Yu X C,Zhou H M,Zheng J F,Zhang X H,Liu X Y,Cheng K,Li L Q. Microbial community diversity and enzyme activity of red paddy soil under long-term combined inorganic-organic fertilization[J].Journal of Plant Nutrition and Fertilizers,2015,21(3):632-643.
[12] Frąc M,Hannula S E,Be ka M,Jędryczka M. Fungal biodiversity and their role in soil health[J].Frontiers in Microbiology,2018,9:707. doi:10.3389/fmicb.2018.00707.
ka M,Jędryczka M. Fungal biodiversity and their role in soil health[J].Frontiers in Microbiology,2018,9:707. doi:10.3389/fmicb.2018.00707.
[13] 南京农业大学. 土壤农化分析[M].北京:中国农业出版社,1994.
Nanjing Agricultural University. Soil agro-chemistry analysis[M].Beijing:China Agricultural Press,1994.
[14] Edgar R C. Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461. doi:10.1093/bioinformatics/btq461.
[15] Quast C,Pruesse E,Yilmaz P,Gerken J,Schweer T,Yarza P,Peplies J,Glöckner F O. The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J].Nucleic Acids Research,2013,41(D1): D590-D596. doi:10.1093/nar/gks1219.
[16] 贺文员,宋清晖,杨尚霖,宋福强. 生物有机肥对水稻土壤酶活性及微生物群落结构的影响[J].中国农学通报,2019,35(27):106-113. doi:10.11924/j.issn.1000-6850.casb18040010.
He W Y,Song Q H,Yang S L,Song F Q. Biological fertilizer:effects on enzyme activity and microbial community structure in rice soil[J].Chinese Agricultural Science Bulletin,2019,35(27):106-113.
[17] Mikhailouskaya N,Bogdevitch I. Relations of enzyme activities with different fractions of soil organic matter[J].Transfusion,2009,42(2):175-182. doi:10.1111/j.1537-2995.2006.01027.
[18] 李玉娇,刘星,吴大付,陈碧华,任秀娟,唐蛟. 温室黄瓜连作对土壤真菌数量和群落结构的影响[J].华北农学报,2020,35(1):194-204. doi:10.7668/hbnxb.20190712.
Li Y J,Liu X,Wu D F,Chen B H,Ren X J,Tang J. Effects of continuous cropping of greenhouse cucumber on soil fungal abundance and community structure Province[J].Acta Agriculturae Boreali-Sinica,2020,35(1):194-204.
[19] 靳东升,张强,张变华,郜春花,李建华,卢晋晶. 种植植物对煤矸石填埋区复垦土壤真菌多样性及养分含量的影响[J].华北农学报,2020,35(5):206-213. doi:10.7668/hbnxb.20190997.
Jin D S,Zhang Q,Zhang B H,Gao C H,Li J H,Lu J J. Effect of planting plants on fungi diversity and nutrients in reclaimed soil of coal gangue landfill area[J].Acta Agriculturae Boreali-Sinica,2020,35(5):206-213. doi:10.7668/hbnxb.20190997.
[20] 黄媛媛,马慧媛,黄亚丽,邢慧珍,徐炳雪,贾振华,郑立伟. 生物有机肥和化肥配施对冬小麦产量及土壤生物指标的影响[J].华北农学报,2019,34(6):160-169. doi:10.7668/hbnxb.20190218.
Huang Y Y,Ma H Y,Huang Y L,Xing H Z,Xu B X,Jia Z H,Zheng L W. Effects of applying bio-organic fertilizer and reducing chemical fertilizer on production and soil biological indexes of winter wheat[J].Acta Agriculturae Boreali-Sinica,2019,34(6):160-169.
[21] 肖琼,王齐齐,邬磊,蔡岸冬,王传杰,张文菊,徐明岗. 施肥对中国农田土壤微生物群落结构与酶活性影响的整合分析[J].植物营养与肥料学报,2018,24(6):1598-1609. doi:10.11674/zwyf.18241.
Xiao Q,Wang Q Q,Wu L,Cai A D,Wang C J,Zhang W J,Xu M G. Fertilization impacts on soil microbial communities and enzyme activities across China's croplands:A meta-analysis[J].Journal of Plant Nutrition and Fertilizers,2018,24(6):1598-1609.
[22] Marcote I,Hern ndez T,García C,Polo A. Influence of one or two successive annual applications of organic fertilisers on the enzyme activity of a soil under barley cultivation[J].Bioresource Technology,2001,79(2):147-154. doi:10.1016/s0960-8524(01)00048-7.
ndez T,García C,Polo A. Influence of one or two successive annual applications of organic fertilisers on the enzyme activity of a soil under barley cultivation[J].Bioresource Technology,2001,79(2):147-154. doi:10.1016/s0960-8524(01)00048-7.
[23] 石柯,董士刚,申凤敏,龙潜,姜桂英,刘芳,刘世亮. 小麦播量与减氮对潮土微生物量碳氮及土壤酶活性的影响[J].中国农业科学,2019,52(15):2646-2663. doi:10.3864/j.issn.0578-1752.2019.15.009.
Shi K,Dong S G,Shen F M,Long Q,Jiang G Y,Liu F,Liu S L. Effects of wheat seeding rate with nitrogen fertilizer application reduction on soil microbial biomass carbon,nitrogen and enzyme activities in fluvo-aquic soil in Huang-Huai plain[J].Scientia Agricultura Sinica,2019,52(15):2646-2663.
[24] 王宁,南宏宇,冯克云. 化肥减量配施有机肥对棉田土壤微生物生物量、酶活性和棉花产量的影响[J].应用生态学报,2020,31(1):173-181. doi:10.13287/j.1001-9332.202001.022.
Wang N,Nan H Y,Feng K Y. Effects of reduced chemical fertilizer with organic fertilizer application on soil microbial biomass,enzyme activity and cotton yield[J].Chinese Journal of Applied Ecology,2020,31(1):173-181.
[25] 卢钰升,顾文杰,李集勤,杨少海,刘兰,李淑玲,石超宏,黎婉玲,吴杭涛. 化肥有机替代对烤烟产质量、土壤理化性质及酶活性的影响[J].中国农学通报,2020,36(16):22-27.
Lu Y S,Gu W J,Li J Q,Yang S H,Liu L,Li S L,Shi C H,Li W L,Wu H T. Effects of organic fertilizer partial substitution for chemical fertilizer on yield,soil physic-chemical properties and enzyme activities of flue-cured tobacco[J].Chinese Agricultural Science Bulletin,2020,36(16):22-27.
[26] Liu J J,Sui Y Y,Yu Z H,Shi Y,Chu H Y,Jin J,Liu X B,Wang G H. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of Northeast China[J].Soil Biology and Biochemistry, 2014,70:113-122. doi:10.1016/j.soilbio.2013.12.014.
[27] 隋心,张荣涛,杨立宾,许楠,柴春荣,王继丰,付晓玲,钟海秀,邢军会. 模拟氮沉降对三江平原小叶章湿地土壤细菌多样性的影响[J].草业科学,2016,33(4):589-598. doi:10.11829/j.issn.1001-0629.2015-0444.
Sui X,Zhang R T,Yang L B,Xu N,Chai C R,Wang J F,Fu X L,Zhong H X,Xing J H. Effect of simulation nitrogen depositions on bacterial diversity of Deyeuxia angustifolia in wetland of Sanjiang Plain[J].Pratacultural Science,2016,33(4):589-598.
[28] Qiao C C,Penton C R,Xiong W,Liu C,Wang R F,Liu Z Y,Xu X,Li R,Shen Q R. Reshaping the rhizosphere microbiome by bio-organic amendment to enhance crop yield in a maize-cabbage rotation system[J]. Applied Soil Ecology,2019,142:136-146. doi:10.1016/j.apsoil.2019.04.014.
[29] 马晓英,马琨,周艳,冶秀香,杨金娟,牛红霞,马玲. 土壤细菌群落组成对有机与无机培肥措施的响应[J].西北农业学报,2019,28(10):1698-1707. doi:10.7606/j.issn.1004-1389.2019.10.017.
Ma X Y,Ma K,Zhou Y,Ye X X,Yang J J,Niu H X,Ma L. Response of soil bacteria community structure to application of inorganic and organic fertilizer[J].Acta Agriculturae Boreali-Occidentalis Sinica,2019,28(10):1698-1707.
[30] Ofek M,Hadar Y,Minz D.Ecology of root colonizing Massilia(Oxalobacteraceae)[J].PLoS One,2012,7(7):e40117. doi:10.1371/journal.pone.0040117.
[31] Kuffner M,De Maria S,Puschenreiter M,Fallmann K,Wieshammer G,Gorfer M,Strauss J,Rivelli A R,Sessitsch A. Culturable bacteria from Zn-and Cd-accumulating Salix caprea with differential effects on plant growth and heavy metal availability[J].Journal of Applied Microbiology,2010,108(4):1471-1484. doi:10.1111/j.1365-2672.2010.04670.x.
[32] Hrynkiewicz K,Baum C,Leinweber P. Density,metabolic activity,and identity of cultivable rhizosphere bacteria on Salix viminalis in disturbed arable and landfill soils[J].Journal of Plant Nutrition and Soil Science,2010,173(5):747-756. doi:10.1002/jpln.200900286.
[33] Cheng H Y,Zhang D Q,Huang B,Song Z X,Ren L R,Hao B Q,Liu J,Zhu J H,Fang W S,Yan D D,Li Y,Wang Q X,Cao A C. Organic fertilizer improves soil fertility and restores the bacterial community after 1,3-dichloropropene fumigation[J].The Science of the Total Environment,2020,738:140345. doi:10.1016/j.scitotenv.2020.140345.