褪黑素(N-乙酰基-5-甲氧基色胺,Melatonin)是一种吲哚胺类激素,可参与调节动物昼夜节律,改善睡眠,调节性行为和视网膜生理,提高机体免疫功能,减缓机体衰老,治疗癌症等[1-3]。Van Tassel和O′Neill[4]采用放射性免疫测定法和气相色谱质谱联用方法首次在高等植物牵牛花和番茄果实中检测到褪黑素,自此打开了植物褪黑素的研究之门。褪黑素可以调节植物的生长发育,调控光合效率及叶片衰老,增强植物对冷热、渗透、氧化、病菌等胁迫的耐受性[5-7]。
近年来,随着工业的迅猛发展和人类活动的增加,大气中臭氧的含量日益减少。臭氧减少后将导致到达地面的UV-B辐射增加,从而对地面植物产生重要的影响,成为公认的全球十大环境问题之一。UV-B辐射除对生物体产生毒害作用外,UV-B 辐射增强可以使植物植株矮化、叶面积减少、发育迟缓、光合作用和蒸腾作用下降、影响各种酶活性、产量降低、作物品质发生变化、影响整个植物生态系统[8-11]。
已有研究证明,UV-B辐射会对马铃薯的形态和生理产生不良影响。增强的UV-B 辐射使马铃薯株高降低、节距缩短、叶面积减小、叶片解剖结构不同程度增厚;非腺毛的密度和叶片气孔增加明显,腺毛有增多趋势,净光合速率、气孔导度等参数均受到抑制,光能利用效率明显降低,叶片中过氧化氢酶、过氧化物酶、超氧化物歧化酶、苯丙氨酸解氨酶活性均表现出下降趋势,总叶绿素含量持续降低,丙二醛含量逐渐增加[12-14]。也有研究表明,褪黑素能有效缓解UV-B辐射带来的伤害。以拟南芥为试材研究褪黑素在UV-B 胁迫中的作用发现,UV-B使褪黑素合成酶基因SNAT、COMT和ASMT的表达量升高[15]。在UV-B辐射条件下对湖北海棠施加褪黑素发现,1 μmol/L的褪黑素溶液能显著减轻UV-B辐射对光合参数、叶绿素荧光参数、气孔开度、叶绿素含量和叶片膜损伤的抑制作用,褪黑素处理还与UV-B胁迫下叶片抗氧化酶(抗坏血酸过氧化物酶、过氧化氢酶和过氧化物酶)活性和表达的提高以及H2O2含量的下降有关,在UV-B胁迫下,绿原酸、根皮苷和槲皮素-3-半乳糖苷等酚类物质的含量也有所增加,而褪黑激素的加入使这些酚类化合物的含量进一步升高[16]。
目前,褪黑素应用于马铃薯的研究主要集中在应对马铃薯晚疫病,研究发现褪黑素可抑制马铃薯晚疫病菌丝生长,改变细胞超微结构,降低其抗逆能力,显著减轻马铃薯晚疫病。褪黑素与杀菌剂对马铃薯晚疫病的协同抗真菌作用表明,褪黑素可降低剂量水平,提高杀菌剂对马铃薯晚疫病的防治效果[17-18]。但是,尚未有研究报道UV-B辐射下褪黑素对马铃薯光合特性等的影响。因此,本研究采用不同浓度的褪黑素处理不同UV-B辐射下马铃薯幼苗,测定植株高度、光合特性、荧光特性、Rubisco活性和PEPC活性,拟探讨UV-B辐射下褪黑素对马铃薯的响应机制,为揭示UV-B辐射下褪黑素对马铃薯植株的防御机制提供科学依据。
1 材料和方法
1.1 试验地及试验品种
在云南省昆明市北郊(25°08′N,102°45′E)进行盆栽试验,该试验地海拔1 966 m,年平均温度15.1 ℃,降水以降雨为主,年降雨量1 000 mm,1 a内干湿季分明,年平均蒸发量为175.1 mm,平均相对湿度为74%,全年无霜期341 d。试验品种为合作88马铃薯。
1.2 试验设计
本研究于2020年5-9月进行,盆栽中使用的土壤基质为泥炭土与蛭石2∶1比例加水搅拌制成,花盆大小为高度30 cm,底部直径27 cm,内径31 cm,外径38 cm,在花盆的中央播种萌芽种薯1个,使用1/5霍格兰营养液浇灌,待苗长至15 cm时进行试验处理。
褪黑素设置6个浓度:0,25,50,100,150,200 μmol/L。选用波长为290~320 nm的紫外线灯管进行UV-B辐射,辐射剂量用VLX-3W 紫外辐射计(法国RADIOMETER 公司生产,标准带宽为295~395 nm,中心波长312 nm)测定,灯管位于植株上方。设置4个辐射强度:T0为太阳光自然照射、T1=2.5 KJ/(m2·d)、T2=5.0 KJ/(m2·d)、T3=7.5 KJ/(m2·d),随着植株的长高调整灯管高度以保持整个辐照期间辐射剂量一致,对照组在植株上方安装空灯架,使得对照和处理之间的自然光照条件一致。
盆栽放置位置如图1所示。每个处理3株,重复3次,即每个辐射强度下放置18盆马铃薯,每3盆为一个处理,浇一个浓度的褪黑素溶液,一共216盆。每天10:00-15:00 进行5 h 的辐照处理(阴雨天除外),每隔2 d用紫外辐射计测定辐射强度,调整灯管与马铃薯之间的距离,同时花盆旋转90°保证植株接受辐照的均匀性。处理14 d后取马铃薯幼苗倒三叶进行试验。
A.T0处理;B.T1处理;C.T2处理;D.T3处理;a.不含褪黑素的营养液浇灌;b.含25 μmol/L褪黑素的营养液浇灌;c.含50 μmol/L褪黑素的营养液浇灌;d.含100 μmol/L褪黑素的营养液浇灌;e.含150 μmol/L褪黑素的营养液浇灌;f.含200 μmol/L褪黑素的营养液浇灌。
A.CK treatment;B.T1 treatment;C.T2 treatment;D.T3 treatment;a.Watering with nutrient solution without melatonin;b.Watering with nutrient solution containing 25 μmol/L melatonin;c.Watering with nutrient solution containing 50 μmol/L melatonin;d.Watering with nutrient solution containing 100 μmol/L melatonin;e.Watering with nutrient solution containing 150 μmol/L melatonin;f.Watering with nutrient solution containing 200 μmol/L melatonin.
图1 马铃薯盆栽大棚种植
Fig.1 Potato planting diagram in greenhouse
1.3 测定指标及方法
采用标尺测定株高;使用Li-6400XT光合-荧光仪(Li-Cor,美国)测定光合参数;使用DualPAM-100测量系统(Walz,德国)进行叶绿素荧光参数测定;采用分光光度法测定Rubisco和PEPC活性。
1.4 数据统计与分析
试验中所得数据采用SPSS 19.0(SPSS,美国芝加哥)软件进行统计学分析,利用单因素方差(One-way ANOVA)分析法,处理间均值比较使用Duncan多重比较法进行差异显著分析,当P<0.05为差异显著;用Excel 2016软件作图。
2 结果与分析
2.1 外源褪黑素对UV-B辐射下马铃薯株高的影响
由表1可以看出,增强UV-B辐射可降低马铃薯植株的高度,在增强UV-B辐射下褪黑素可在一定程度内提高株高。在相同增强UV-B辐射不同褪黑素浓度处理下:T0和T1条件下,25 μmol/L褪黑素浓度浇灌下的马铃薯植株最高;T2条件下50 μmol/L褪黑素浓度浇灌下的马铃薯植株最高;T3条件下100 μmol/L褪黑素浓度浇灌下的马铃薯植株最高。在相同褪黑素浓度不同增强UV-B辐射处理下:不施加褪黑素时T1条件下马铃薯植株最高;施加褪黑素时T1条件下5个浓度处理的马铃薯株高比其他光照条件下相同褪黑素处理的马铃薯植株都高。综合2种处理条件,在T1条件下,施加25 μmol/L褪黑素浓度时,马铃薯植株最高。
2.2 外源褪黑素对UV-B辐射下马铃薯光合参数的影响
由图2可以看出,增强UV-B辐射可降低马铃薯的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),当施加褪黑素后可以在一定程度内提高这些光合参数。在相同增强UV-B辐射不同褪黑素浓度处理下:T0条件下25 μmol/L褪黑素浓度处理的马铃薯植株Pn最高,T1和 T2条件下50 μmol/L褪黑素浓度处理的马铃薯植株Pn最高,T3条件下100 μmol/L褪黑素浓度处理的马铃薯植株Pn最高;由于气孔导度会影响胞间CO2浓度和蒸腾速率,所以三者的变化趋势相同,T0条件下25 μmol/L褪黑素浓度处理的马铃薯植株Gs、Ci、Tr最高,T1和 T2条件下50 μmol/L褪黑素浓度处理的马铃薯植株Gs、Ci、Tr最高,T3条件下100 μmol/L褪黑素浓度处理的马铃薯植株Gs、Ci、Tr最高。在相同褪黑素浓度不同增强UV-B辐射处理下:在不施加褪黑素和25 μmol/L褪黑素浓度处理,T0条件下马铃薯植株的Pn、Gs、Ci、Tr最高;在其他褪黑素浓度处理下,T1条件下的马铃薯Pn、Gs、Ci、Tr最高。综合两种处理条件,在T0条件下,施加25 μmol/L褪黑素浓度时,马铃薯的Pn、Gs、Ci、Tr最高。
表1 外源褪黑素对UV-B辐射下马铃薯株高的影响
Tab.1 Effects of exogenous melatonin on plant height of potato under UV-B radiation cm
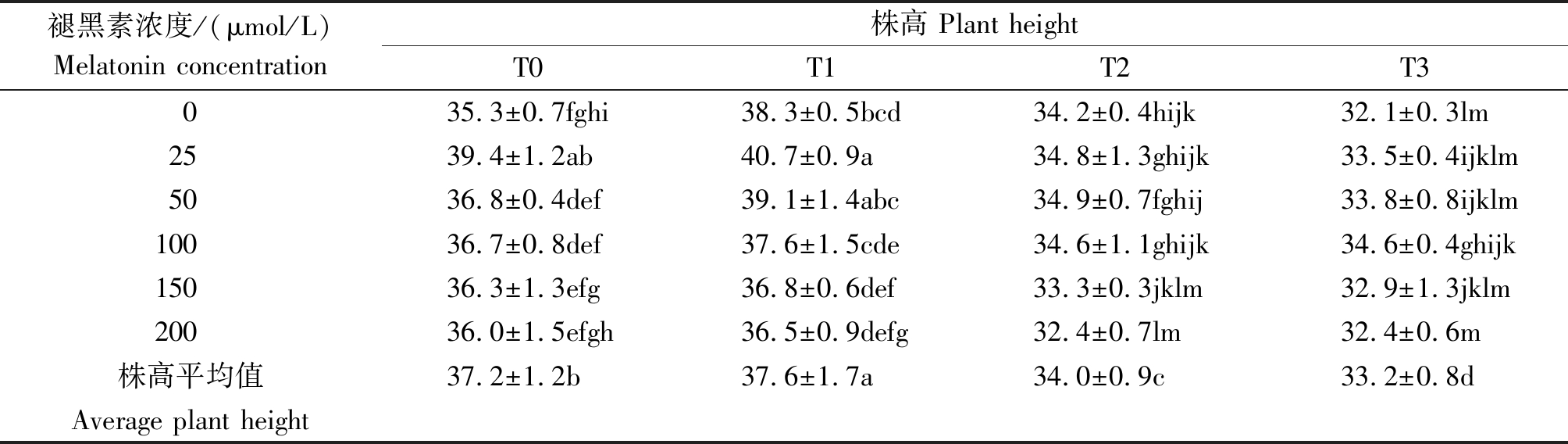
褪黑素浓度/(μmol/L)Melatonin concentration株高 Plant heightT0T1T2T3035.3±0.7fghi38.3±0.5bcd34.2±0.4hijk32.1±0.3lm2539.4±1.2ab40.7±0.9a34.8±1.3ghijk33.5±0.4ijklm5036.8±0.4def39.1±1.4abc34.9±0.7fghij33.8±0.8ijklm10036.7±0.8def37.6±1.5cde34.6±1.1ghijk34.6±0.4ghijk15036.3±1.3efg36.8±0.6def33.3±0.3jklm32.9±1.3jklm20036.0±1.5efgh36.5±0.9defg32.4±0.7lm32.4±0.6m株高平均值37.2±1.2b37.6±1.7a34.0±0.9c33.2±0.8dAverage plant height
注:不同字母表示不同处理具有显著差异(P<0. 05)。
Note:Different letters indicate significant difference among treatments(P<0. 05).
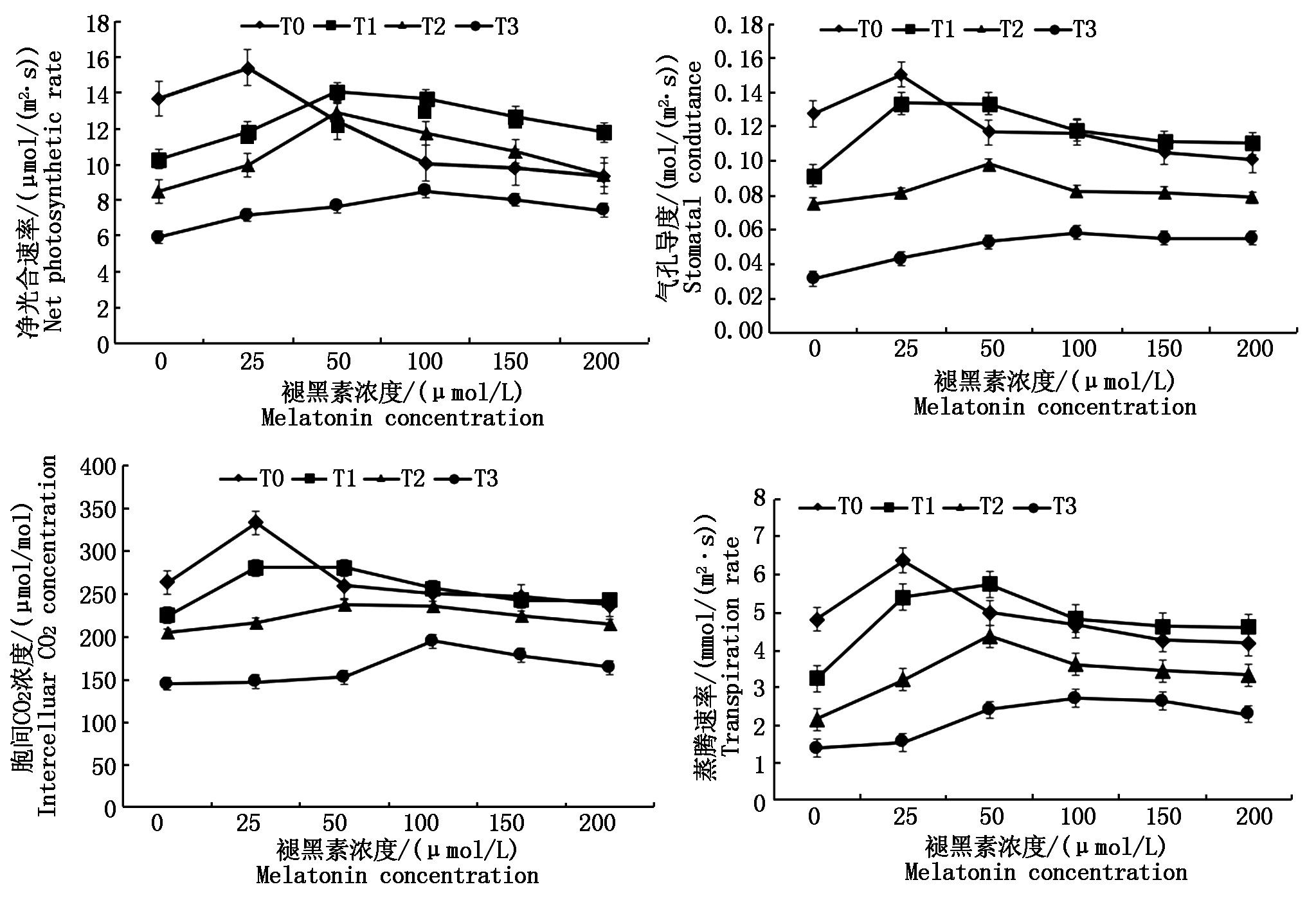
图2 外源褪黑素对马铃薯光合参数的影响
Fig.2 Effect of exogenous melatonin on photosynthetic parameters of potato
2.3 外源褪黑素对UV-B辐射下马铃薯荧光参数的影响
由图3可以看出,增强UV-B辐射可降低马铃薯的最大光化学量子效率(Fv/Fm)、表观电子传递速率(ETR)、光化学淬灭系数(qP),当施加褪黑素后可以在一定程度内提高这些荧光参数;增强UV-B辐射可提高马铃薯的非光化学淬灭系数(NPQ),施加褪黑素后可使其减少。在相同增强UV-B辐射不同褪黑素浓度处理下:T0条件下Fv/Fm的差异不显著,T1条件下25,50 μmol/L褪黑素浓度处理的马铃薯Fv/Fm最高,T2条件下50 μmol/L褪黑素浓度处理的马铃薯Fv/Fm最高,T3条件下100 μmol/L褪黑素浓度处理的马铃薯Fv/Fm最高;T0条件下和T1条件下25 μmol/L褪黑素浓度处理的马铃薯ETR最高,T2条件下50 μmol/L褪黑素浓度处理的马铃薯ETR最高,T3条件下100 μmol/L褪黑素浓度处理的马铃薯ETR最高;T0和T1条件下25 μmol/L褪黑素浓度处理的马铃薯qP最高,T2条件下50 μmol/L褪黑素浓度处理的马铃薯qP最高,T3条件下100 μmol/L褪黑素浓度处理的马铃薯qP最高;T0条件下0,25 μmol/L褪黑素浓度处理的马铃薯NPQ最低,T1条件下25 μmol/L褪黑素浓度处理的马铃薯NPQ最低,T2条件下50 μmol/L褪黑素浓度处理的马铃薯NPQ最低,T3条件下100 μmol/L褪黑素浓度处理的马铃薯NPQ最低。在相同褪黑素浓度不同增强UV-B辐射处理下:无论褪黑素的浓度如何,T0条件下的Fv/Fm、ETR都最高;除T1、T2条件下50 μmol/L褪黑素浓度处理下qP高于其他UV-B辐射的qP外,其他的褪黑素浓度处理下都是自然光照条件下的qP最高;除T1条件下200 μmol/L褪黑素浓度处理时NPQ低于其他UV-B辐射的NPQ外,其他的褪黑素浓度处理下都是T0条件下的NPQ最低。综合2种处理条件,在T0和T1条件下,施加25,50 μmol/L褪黑素浓度时,马铃薯的Fv/Fm最高;在T0条件下,施加25 μmol/L褪黑素浓度时,马铃薯的ETR最高;在T0条件下,施加25 μmol/L褪黑素浓度时,马铃薯的qP最高;在T0条件下,施加0,25 μmol/L褪黑素浓度时,马铃薯的NPQ最低。

不同字母表示不同处理具有显著差异(P<0.05,Tukey test) 。图4-5同。
Different letters indicate significant difference among treatments (P<0. 05,Tukey test).The same as Fig.4-5.
图3 外源褪黑素对马铃薯荧光参数的影响
Fig.3 Effect of exogenous melatonin on potato fluorescence parameters
2.4 外源褪黑素对UV-B辐射下马铃薯主要光合酶的影响
2.4.1 外源褪黑素对Rubisco的影响 由图4可以看出,UV-B增强后,Rubisco活性降低,施加外源褪黑素后能在一定程度内增强其活性。在相同增强UV-B辐射不同褪黑素浓度处理下:T0和T1条件下,施加50 μmol/L褪黑素时Rubisco活性最高;T2和T3条件下,施加100 μmol/L褪黑素时Rubisco活性最高。在相同褪黑素浓度不同增强UV-B辐射处理下:不施加褪黑素和施加25 μmol/L褪黑素时,T0条件下Rubisco活性最高;施加50,100,150,200 μmol/L褪黑素时,都是T1条件下Rubisco活性最高。综合2种处理条件,T1条件下施加50 μmol/L褪黑素时Rubisco活性最高。

图4 外源褪黑素对马铃薯1,5-二磷酸核酮糖羧化酶的影响
Fig.4 Effect of exogenous melatonin on potato
1,5-bisphosphate ribulose carboxylase
2.4.2 外源褪黑素对磷酸烯醇式丙酮酸羧化酶(PEPC)的影响 由图5可以看出,UV-B增强后,磷酸烯醇式丙酮酸羧化酶(PEPC)活性降低,施加外源褪黑素后能在一定程度内增强其活性。在相同增强UV-B辐射不同褪黑素浓度处理下:T0和T1条件下,施加25 μmol/L褪黑素时PEPC活性最高;T2和T3条件下,施加50 μmol/L褪黑素时PEPC活性最高。在相同褪黑素浓度不同增强UV-B辐射处理下:不施加褪黑素时,T0条件下PEPC活性最高;施加25,50,100,150 μmol/L褪黑素时,都是T1条件下PEPC活性最高;施加200 μmol/L褪黑素时,T0条件下PEPC活性最高。综合2种处理条件,T1条件下施加25 μmol/L褪黑素时PEPC活性最高。
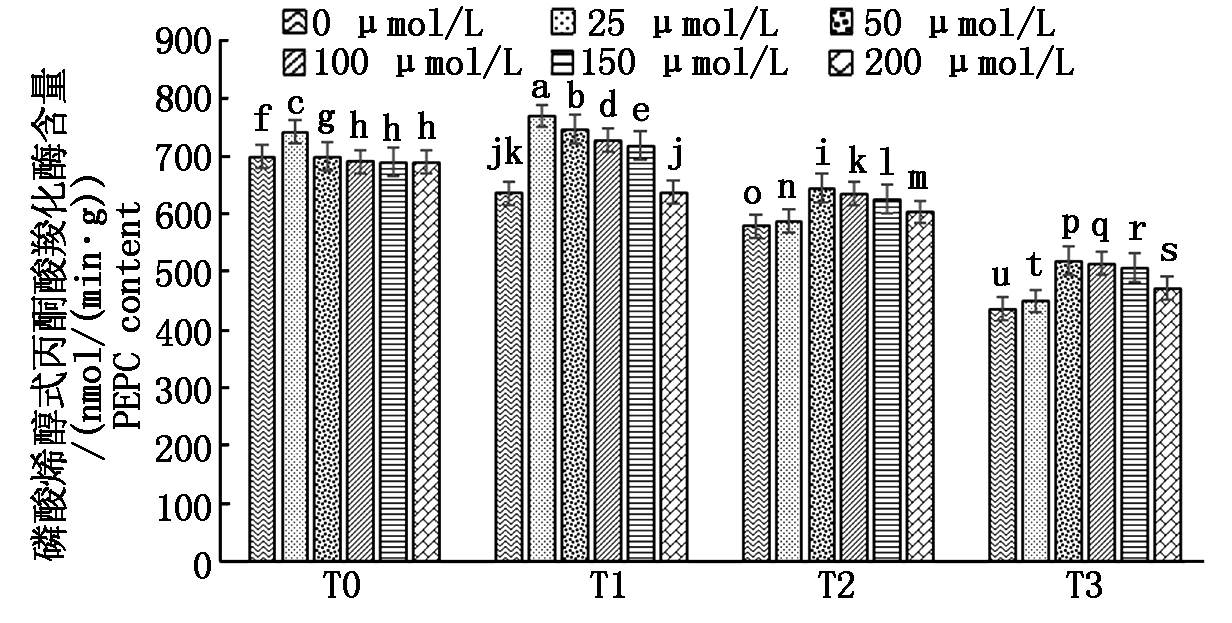
图5 外源褪黑素对马铃薯磷酸烯醇式丙酮酸羧化酶的影响
Fig.5 Effect of exogenous melatonin on potato phosphatepyruvate carboxylase
3 讨论与结论
UV-B辐射既可以使植物的表型发生改变,也会使植物自身产生有毒性的活性氧自由基,这些活性氧自由基会攻击植物的DNA、核酸、蛋白质等,导致植物光合速率下降,破坏细胞膜结构,最终导致细胞自溶[19-21]。褪黑素具有极强的抗氧化能力,其抗氧化能力高于抗坏血酸、生育酚、谷胱甘肽等抗氧化剂,它能够清除羟基自由基、羰基自由基等活性氧自由基及一些活性氮自由基,还能通过激发抗氧化酶的生物合成来提高细胞的抗氧化能力,以此缓解环境胁迫及生物胁迫对高等植物造成的损伤,加强植物抗逆性[22]。
黄益宗等[23]在研究外源褪黑素对砷胁迫下水稻幼苗生长的影响时发现,砷胁迫下施加褪黑素可增高水稻高度;邹京南等[24]在研究外源褪黑素对干旱胁迫条件下大豆苗期光合及生理的影响时发现,褪黑素能缓解干旱胁迫下大豆株高的减少;侯雯等[25]在研究外源褪黑素对低温胁迫下玉米幼苗生长和生理特性的影响时发现,褪黑素有利于缓解低温胁迫对玉米幼苗株高的影响。以上研究表明,褪黑素能缓解非生物胁迫对植物株高的影响。马铃薯受到增强UV-B辐射后株高明显降低,施加褪黑素后该现象得到改善。在T1条件下,施加25 μmol/L褪黑素浓度时,马铃薯植株最高,研究结果与上述研究结果类似。
光合作用影响植物生长发育过程。光合作用的主要影响因素是光照,光照主要通过光照强度、光质和光照时间3种形式对植物的生长发育和形态变化进行调节和影响[26]。作为植物进行光合作用的重要外部环境因素,不同的光照强度对植物光合作用和生长产生不同的影响。Pn、Ci、Tr、Gs是光合作用的重要指标,可以反映植物的光合能力强弱。本试验中马铃薯各个光合参数的变化趋势相同,增强UV-B辐射会降低光合参数,施加褪黑素后各个参数有所增加,在自然光照条件下,施加25 μmol/L褪黑素浓度时各指标最优,说明一定的褪黑素浓度和UV-B辐射能提高马铃薯的光合能力。
叶绿素荧光动力学参数反映光能的吸收和转化、能量的传递与分配、反应中心的活性,以及光合作用的光抑制与光破坏状态等光合系统的“内在性特点”[27]。Fv/Fm是PSⅡ最大光化学量子产量,反映PSⅡ的潜在活性[28],受到胁迫时该值会降低;ETR越高说明叶片细胞的相对光合电子传递能力较强;qP是光化学淬灭即PSⅡ天线色素吸收的光能用于光化学电子传递的份额,一定程度上qP也反映了PS Ⅱ反应中心开放的程度;NPQ是非光化学淬灭,是植物的一种保护机制,PS Ⅱ天线色素吸收了过量的光能而不能及时耗散时会以热的形式耗散,否则会对光合机构造成破坏[29]。本试验中Fv/Fm、qP、ETR在增强UV-B辐射下明显降低,施加褪黑素后有所升高,NPQ在增强UV-B辐射下明显升高,施加褪黑素后有所下降,在自然光照条件下,施加25 μmol/L褪黑素浓度时大多数参数都是最优的。
Rubisco是植物光合作用反映固定CO2的关键酶,它参与光呼吸途径,消耗光合产物,对提高植物的光合效率至关重要[29];PEPC,其酶活性是Rubisco活性的60倍,对 CO2亲和力大,是C4植物具有高效光合作用的关键,研究发现将C4型PEPC基因导入C3植物中能提高其光合效率[30]。本试验中Rubisco和PEPC在受到增强UV-B胁迫后都有所降低,施加外源褪黑素后,T1条件下施加50 μmol/L褪黑素时Rubisco活性最高,T1条件下施加25 μmol/L褪黑素时PEPC活性最高,本试验结果与孙建磊[31]、张振文[32]、罗璇[33]、丁在松[34]等用非生物胁迫手段处理黄瓜、木薯、小麦、谷子、水稻后Rubisco和PEPC的结果与光合、荧光参数变化结果一致。Rubisco和PEPC 2种酶活的变化趋势与光合、荧光参数的变化趋势一致,说明2种酶与光合作用密切相关且一定浓度的褪黑素能提高其活性。
在增强UV-B辐射下施加外源褪黑素能在一定程度使马铃薯植株增高,光合能力增强,Rubisco和PEPC活性提高。但随着褪黑素浓度升高这些指标下降,说明过高的褪黑素浓度会对植物造成损伤。
[1] Ahn J H,Kim M,Park S,Jang W,Park J,Oh E,Cho J W,Kim J S,Youn J. Prolonged-release melatonin in Parkinson′s disease patients with a poor sleep quality:A randomized trial[J].Parkinsonism & Related Disorders,2020,75:50-54. doi:10.1016/j.parkreldis.2020.03.029.
[2] 张罗丽,瞿小妹. 褪黑素与形觉剥夺性近视的关系[J].中华眼视光学与视觉科学杂志,2017,19(8):509-512. doi:10.3760/cma.j.issn.1674-845X.2017.08.011.
Zhang L L,Qu X M. The relationship between melatonin and form deprivation myopia[J].Chinese Journal of Optometry Ophthalmology and Visual Science,2017,19(8):509-512.
[3] Premratanachai A,Suwanjang W,Govitrapong P,Chetsawang J,Chetsawang B. Melatonin prevents calcineurin-activated the nuclear translocation of nuclear factor of activated T-cells in human neuroblastoma SH-SY5Y cells undergoing hydrogen peroxide-induced cell death[J].Journal of Chemical Neuroanatomy,2020,106:101793. doi:10.1016/j.jchemneu.2020.101793.
[4] Van Tassel D L,O′Neill S D. Melatonin:identifcation of a potential dark signal in plants[J].Plant Physiology,1993,1(102):659.
[5] 张杰,顾红,程大伟,张威远,郭西智,张洋,陈锦永. 植物褪黑素研究[J].江西农业学报,2018,30(6):39-48. doi:10.19386/j.cnki.jxnyxb.2018.06.09.
Zhang J,Gu H,Cheng D W,Zhang W Y,Guo X Z,Zhang Y,Chen J Y. Research of plant melatonin[J].Acta Agriculturae Jiangxi,2018,30(6):39-48.
[6] 欧品莉,韩雨航,李琳琳.外源褪黑素对番茄灰霉病抗性及抗氧化酶系统的影响[J].绿色科技,2019(11):145-146.doi:10.16663/j.cnki.lskj.2019.11.061.
Ou P L,Han Y H,Li L L. Effects of exogenous melatonin on resistance to gray mold and antioxidant enzyme system in tomato[J].Journal of Green Science and Technology,2019(11):145-146.
[7] 曹晶晶,于子超,张颖,李保华,梁文星,王彩霞. 外源褪黑素对苹果采后灰霉病的防效及防御酶活性的影响[J].植物生理学报,2017,53(9):1753-1760.doi:10.13592/j.cnki.ppj.2017.0197.
Cao J J,Yu Z C,Zhang Y,Li B H,Liang W X,Wang C X. Control efficiency of exogenous melatonin against postharvest apple grey mold and its influence on the activity of defensive enzymes[J].Plant Physiology Journal,2017,53(9):1753-1760.
[8] 褚润,陈年来,韩国君,李良. 三种UV-B辐射强度下香蒲的生长和抗氧化状况[J].湿地科学,2020,18(1):32-39. doi:10.13248/j.cnki.wetlandsci.2020.01.005.
Chu R,Chen N L,Han G J,Li L. Growth and antioxidant status of Typha orientalis under 3 kinds of UV-B radiation intensities[J].Wetland Science,2020,18(1):32-39.
[9] 刘英,于雪莹,于莉莉,杜丹丹,李德文,唐中华.UV-B辐射下不同树龄杜仲叶片光合及部分生理特性的变化[J].东北林业大学学报,2020,48(6):42-46,50.doi:10.13759/j.cnki.dlxb.2020.06.009.
Liu Y,Yu X Y,Yu L L,Du D D,Li D W,Tang Z H. Changes of photosynthetic and physiological characteristics in Eucommia ulmoides oliver leaves of different tree ages under UV-B radiation[J]. Journal of Northeast Forestry University,2020,48(6):42-46,50.
[10] 涂云,杨正聪,权佳锋,蔡昊城,柳文凤,杨东,任汝周,卢红.UV-B辐射强度对烟苗生长及抗氧化酶的影响[J].贵州农业科学,2019,47(4):13-18. doi:10.19759/j.cnk i.2164-4993.2020.04.008.
Tu Y , Yang Z C ,Quan J F, Cai W C, Liu W F,Yang D, Ren R Z, Lu H. Effects of enhanced UV-B radiation on growth and antioxidant enzyme of flue-cured tobacco[J].Guizhou Agricultural Sciences,2019,47(4):13-18.
[11] 娄运生,张震,武君. UV-B增强对作物生产影响的研究回顾与展望[J].农业环境科学学报,2020,39(4):812-821. doi:10.11654/jaes.2020-0042.
Lou Y S,Zhang Z,Wu J. Crop growth,yield and quality as affected by ultraviolet-B(UV-B)radiation elevating[J].Journal of Agro-Environment Science,2020,39(4):812-821.
[12] 李俊,杨玉皎,王文丽,郭华春. UV-B辐射增强对马铃薯叶片结构及光合参数的影响[J].生态学报,2017,37(16):5368-5381. doi:10.5846/stxb201605271025.
Li J,Yang Y J,Wang W L,Guo H C. Effects of enhanced UV-B radiation on potato leaf structure and photosynthetic parameters[J].Acta Ecologica Sinica,2017,37(16):5368-5381.
[13] 李俊,牛金文,杨芳,肖继坪,郭华春. 不同马铃薯品种(系)对增强UV-B辐射的形态响应[J].中国生态农业学报,2016,24(6):770-779.doi:10.13930/j.cnki.cjea.151229.
Li J,Niu J W,Yang F,Xiao J P,Guo H C. Morphological responses of potato varieties(lines)to enhanced UV-B radiation[J].Chinese Journal of Eco-Agriculture,2016,24(6):770-779.
[14] 张新永,郭华春,戴华峰. 增强UV-B辐射对彩色马铃薯叶片中相关保护酶活性的影响[J].西北植物学报,2009,29(5):968-974. doi:10.3321/j.issn:1000-4025.2009.05.018.
Zhang X Y,Guo H C,Dai H F. Effects of supplemental ultraviolet-B radiation on activities of the related protective enzymes in the leaves of chromatic potato[J].Acta Botanica Boreali-Occidentalia Sinica,2009,29(5):968-974.
[15] 马征.拟南芥褪黑素响应UV-B胁迫的功能和其合成酶表达研究[D].西安:西北大学,2019:13-14.
Ma Z. Study on the function of Arabidopsis melatonin in response to UV-B stress and the expression of its synthase[D].Xi'an:Northwest University,2019:13-14.
[16] Wei Z W,Li C,Gao T T,Zhang Z J,Liang B W,Lü Z S,Zou Y J,Ma F W. Melatonin increases the performance of Malus hupehensis after UV-B exposure[J].Plant Physiology and Biochemistry,2019,139:630-641. doi:10.1016/j.plaphy.2019.04.026.
[17] Zhang S M,Zheng X Z,Reiter R J,Feng S,Wang Y,Liu S,Jin L,Li Z G,Datla R,Ren M Z. Melatonin attenuates potato late blight by disrupting cell growth,stress tolerance,fungicide susceptibility and homeostasis of gene expression in Phytophthora infestans[J].Frontiers in Plant Science,2017,8:1993. doi:10.3389/fpls.2017.01993.
[18] 张蜀敏. 新型致病疫霉抑菌剂的筛选及抑菌机制研究[D].重庆:重庆大学,2018:16-21.
Zhang S M. Screening and mechanism of novel inhibitor against Phytophthora infestans[D].Chongqing:Chongqing University,2018:16-21.
[19] Ma M,Wang P,Yang R Q,Zhou T,Gu Z X. UV-B mediates isoflavone accumulation and oxidative-antioxidant system responses in germinating soybean[J].Food Chemistry,2019,275(5):628-636.doi:10.1016/j.foodchem.2018.09.158.
[20] Pereira D T,Pereira B,Fonseca A,Ramlov F,Maraschin M, lvarez-G
lvarez-G mez F,Figueroa F L,Schmidt É C,Bouzon Z L,Simioni C. Effects of ultraviolet radiation(UV-A+UV-B)on the antioxidant metabolism of the red macroalga species Acanthophora spicifera (rhodophyta,ceramiales)from different salinity and nutrient conditions[J].Photochemistry and Photobiology,2019,95(4):999-1009. doi:10.1111/php.13094.
mez F,Figueroa F L,Schmidt É C,Bouzon Z L,Simioni C. Effects of ultraviolet radiation(UV-A+UV-B)on the antioxidant metabolism of the red macroalga species Acanthophora spicifera (rhodophyta,ceramiales)from different salinity and nutrient conditions[J].Photochemistry and Photobiology,2019,95(4):999-1009. doi:10.1111/php.13094.
[21] Hahn M B,Smales G J,Seitz H,Solomun T,Sturm H. Ectoine interaction with DNA:Influence on ultraviolet radiation damage[J].Physical Chemistry Chemical Physics,2020,22(13):6984-6992.doi:10.1039/D0CP00092B.
[22] 方荧,刘风珍,张昆,张秀荣,朱素青,赵炎,万勇善. UV-B辐射增强影响作物生长发育的研究进展[J].山东农业科学,2018,50(6):183-188. doi:10.14083/j.issn.1001-4942.2018.06.034.
Fang Y,Liu F Z,Zhang K,Zhang X R,Zhu S Q,Zhao Y,Wan Y S. Research advances in effect of enhanced UV-B radiation on growth and development of crops[J].Shandong Agricultural Sciences,2018,50(6):183-188.
[23] 黄益宗,蒋航,王农,刘岩,胡红青. 外源褪黑素对砷胁迫下水稻幼苗生长的影响[J].生态学杂志,2018,37(6):1738-1743.doi:10.13292/j.1000-4890.201806.020.
Huang Y Z,Jiang H,Wang N,Liu Y,Hu H Q. Effects of exogenous melatonin on the growth of rice seedlings under As stress[J].Chinese Journal of Ecology,2018,37(6):1738-1743.
[24] 邹京南,金喜军,王孟雪,张明聪,任春元,于奇,胡国华,张玉先. 外源褪黑素对干旱胁迫条件下大豆苗期光合及生理的影响[J].大豆科学,2018,37(6):896-905. doi:10.11861/j.issn.1000-9841.2018.06.0896.
Zou J N,Jin X J,Wang M X,Zhang M C,Ren C Y,Yu Q,Hu G H,Zhang Y X. Effects of exogenous melatonin on photosynthesis and physiology of soybean seedlings under drought stress[J].Soybean Science,2018,37(6):896-905.
[25] 侯雯,杜卓,王丽,李林,张凯,路运才. 外源褪黑素对低温胁迫下玉米幼苗生长和生理特性的影响[J].中国糖料,2020,42(2):33-37.doi:10.13570/j.cnki.scc.2020.02.006.
Hou W,Du Z,Wang L,Li L,Zhang K,Lu Y C. Effects of exogenous melatonin on maize seedlings growth and physiological traits under low temperature stress[J].Sugar Crops of China,2020,42(2):33-37.
[26] 岳高峰,韩志强,薛志伟,刘辉,马丽婷.不同遮阴对牡丹花期和光合特性的影响[J].江苏农业科学,2020,48(17):166-170.doi:10.15889/j.issn.1002-1302.2020.17.032.
Yue G F,Han Z Q,Xue Z W,Liu H,Ma L T. Effects of different shading on flowering period and photosynthetic characteristics of peony[J].Jiangsu Agricultural Sciences,2020,48(17):166-170.
[27] 圣倩倩,戴安琪,宋敏,唐睿,祝遵凌.NO2胁迫下两种鹅耳枥的光合生理特性变化[J].南京林业大学学报(自然科学版),2021,45(2):10-16.doi:10.3969/j.issn.1000-2006.202006062.
Sheng Q Q,Dai A Q,Song M,Tang R,Zhu Z L. Photosynthetic physiological characteristics of two kinds of hornbean under NO2 stress[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2021,45(2):10-16.
[28] 张超,梁峥,贾民隆,曹冬梅. 秋季露地低温对野生和栽培萱草光合特性的影响[J].北方园艺,2020(18):78-86. doi:10.11937/bfyy.20200451.
Zhang C,Liang Z,Jia M L,Cao D M. Effects of low temperature on photosynthesis of wild and cultivated daylilies(Hemerocallis fulva)grown under open field in autumn[J].Northern Horticulture,2020(18):78-86.
[29] 何亚飞,李霞,谢寅峰. Rubisco与Rubisco活化酶的分子机理研究进展[J].分子植物育种,2017,15(8):3295-3301. doi:10.13271/j.mpb.015.003295.
He Y F,Li X,Xie Y F. Advances in molecular mechanisms of rubisco and rubisco activase[J].Molecular Plant Breeding,2017,15(8):3295-3301.
[30] 孙伟博,宫新栋,周燕,李红岩. 转玉米PEPC和PPDK基因杨树苗期的光合生理特性[J].林业科学,2020,56(7):33-43.
Sun W B,Gong X D,Zhou Y,Li H Y. Photosynthetic characteristics of transgenic poplars with maize PEPC and PPDK gene at young plant stage[J].Scientia Silvae Sinicae,2020,56(7):33-43.
[31] 孙建磊,王崇启,肖守华,高超,李利斌,曹齐卫,王晓,董玉梅,焦自高. 弱光对黄瓜幼苗光合特性及Rubisco酶的影响[J].核农学报,2017,31(6):1200-1209. doi:10.11869/j.issn.100-8551.2017.06.1200.
Sun J L,Wang C Q,Xiao S H,Gao C,Li L B,Cao Q W,Wang X,Dong Y M,Jiao Z G. Effect of low light on photosynthesis and rubisco of cucumber seedlings[J].Journal of Nuclear Agricultural Sciences,2017,31(6):1200-1209.
[32] 张振文,林立铭,余厚美,李开绵,陈松笔. 温度对木薯叶片叶绿素荧光及Rubisco酶的影响[J].江西农业学报,2017,29(1):1-5.doi:10.19386/j.cnki.jxnyxb.2017.01.01.
Zhang Z W,Lin L M,Yu H M,Li K M,Chen S B. Effects of temperature on chlorophyll fluorescence parameters and rubisco activity in cassava leaves[J].Acta Agriculturae Jiangxi,2017,29(1):1-5.
[33] 罗璇,郭彤,胡银岗. 小麦和谷子C4光合途径关键酶活性及其与光合和蒸腾的关系[J].麦类作物学报,2014,34(8):1083-1091.
Luo X,Guo T,Hu Y G. Comparative study on the activities of the key enzymes involved in C4 photosynthesis pathway and their correlations with photosynthetic and transpiration rate in wheat and foxtail millet[J].Journal of Triticeae Crops,2014,34(8):1083-1091.
[34] 丁在松,周宝元,孙雪芳,赵明. 干旱胁迫下PEPC过表达增强水稻的耐强光能力[J].作物学报,2012,38(2):285-292. doi:10.3724/SP.J.1006.2012.00285.
Ding Z S,Zhou B Y,Sun X F,Zhao M. High light tolerance is enhanced by overexpressed PEPC in rice under drought stress[J].Acta Agronomica Sinica,2012,38(2):285-292.