土壤盐碱化是全球农业的主要环境威胁,影响着全球约20%的耕地和近1/2的灌溉土地,导致土壤进一步退化[1]。我国是世界盐碱地大国,耕地盐碱化面积为 7.6×106 hm2,近 1/5 耕地发生盐碱化,其影响正变得越来越严重。东北地区是我国土地盐碱化最严重的地区之一,同时也是世界三大苏打盐碱土集中分布区之一[2]。盐化土壤中含有大量的可溶盐,盐分的增加降低了土壤水势,导致植物吸水困难,对植物造成氧化胁迫、离子毒性、渗透胁迫和代谢紊乱,从而影响植物的生长发育和光合作用[3-4]。除上述危害外,碳酸钠和碳酸氢钠等形成的碱化土壤,还会对植物造成碱环境的危害,即高pH值对植物的伤害[5]。目前,国内外科学家在植物耐盐分子机制研究方面进行了大量工作,但多数研究集中在响应盐胁迫的分子机制,而对碱胁迫研究极少,由此很难分析天然盐碱地综合胁迫反应背后的耐性机制。植物在遭受盐碱胁迫时会产生大量活性氧(Reactive oxygen species,ROS),如不及时清除,会对自身正常的生长发育造成很大影响,包括抑制SOD、POD和CAT等的活性;降低叶绿素的含量,抑制植物的光合作用;破坏细胞膜的稳定性,使膜质中不饱和脂肪酸过氧化作用产物 MDA过分累积,进而降低植物的抗逆性[6]。
高粱(Sorghum bicolor (L.)Moench)具有耐旱、耐涝、耐盐碱、耐瘠薄、耐高温和耐干热风等特点,可在高温、低洼和盐碱等边际性土地上进行种植,具有粮饲、造酒、帚用、编织和替代能源等多种用途[7]。高粱的根系是摄取、运输和储存土壤水分和养分的关键器官,也是抵御逆境胁迫的第一屏障[8]。根系结构的变化会影响物质运输、激素合成和信号转导,因此,良好的根系有利于高粱在盐碱环境中提高自身的稳定性,提高其对盐碱胁迫的耐受性[9]。
研究者利用酵母双杂交发现了与VirE2(Type IV Secretion System Single-stranded DNA Binding Protein VirE2)相互作用的拟南芥蛋白并且命名为AtVIP1(Arabidopsis thaliana VirE2-interacting Protein 1)[10-12]。AtVIP1属于拟南芥bZIP(Basic Leucine-Zipper)家族的IX亚家族,因具有2个拷贝的NLS(Nuclear Location Sequence)序列,表明此蛋白可以定位于细胞核中[13]。目前,针对VIP1转录因子的相关研究主要集中在模式植物拟南芥上,且重点关注核质穿梭现象及机制。VIP1及其同系物可以与钙调蛋白相互作用,它们的核质穿梭需要钙信号[14];还可能通过14-3-3蛋白解离使VIP1去磷酸化诱导核定位[15],或通过PP2A介导VIP1去磷酸化而入核[16]。研究表明,VIP1可能影响农杆菌转化效率[17],还可能涉及硫的利用、淀粉积累、渗透胁迫信号传导和触摸诱导的根运动[18-21]。但VIP1是否影响植物对苏打盐碱胁迫的抗性还未见报道。据此,本研究使用苏打盐碱胁迫液对异源过表达拟南芥Atvip1转基因高粱进行处理,通过表型和抗逆生理相关指标分析来研究转录因子VIP1对高粱抵抗盐碱胁迫的影响,为高粱耐盐碱分子育种提供新的靶基因资源。
试验采用沙培法,选用穴高40 mm、上口径40 mm、下口径15 mm、单容积40 mL 的72 孔穴育苗盘。高粱野生型资源为P898012,将拟南芥转录因子VIP1基因构建35S-Atvip1过表达载体,通过农杆菌介导法,以高粱幼胚为外植体通过遗传转化获得异源过表达Atvip1基因的转基因高粱株系,经实时荧光定量PCR法检测,转基因高粱株系中已转入外源拟南芥的Atvip1基因且过表达,后代经纯化后留种备用。本研究中所用转基因种子为T4,由黑龙江八一农垦大学生命科学技术学院植物基因功能实验室提供,命名为Atvip1-7-T4高粱。
1.2.1 高粱幼苗培养与处理 挑选籽粒饱满大小均一的种子,先用蒸馏水将种子洗2~3次,用75%酒精浸泡2~3 min,后用蒸馏水冲洗2~3次,再用2% 次氯酸钠浸泡3~4 min,最后用蒸馏水冲洗5~6次,将消毒后的种子用蒸馏水萌动12 h。在培养皿中铺入3 层滤纸,每皿加入10 mL蒸馏水,将萌动后的种子均匀摆放在滤纸上,每皿120 粒,25 ℃、16 h/8 h 人工气候培养箱中培养24 h。挑选发芽一致的种子移栽至72孔育苗穴盘中(一苗一穴),每2 d用Hoagland营养液浇灌1次,培养条件为25 ℃、16 h/8 h。待幼苗长至三叶一心时,用Hoagland营养液配置NaHCO3∶Na2CO3为5∶1的胁迫液(75 mmol/L,pH 值9.63)进行胁迫处理。在0,4,12,24,72,120 h时取样进行生长指标测定,同时把部分根系用液氮速冻后置于-150 ℃冰箱冻存,用于生理指标测定。试验中分为2组,野生型(WT)和过表达Atvip1转基因株系(TR),每组试验重复3次。
1.2.2 高粱根系形态分析 利用单反照相机记录每时间点的幼苗生长状态。根系形态指标用万深LA-S系列植物图像分析仪(根系分析独立版)进行扫描并分析指标参数(根长、表面积、体积)。
1.2.3 高粱抗性相关指标测定 叶绿素含量测定利用CID bio-science公司生产的叶绿素测定仪进行测定。根系超氧化物歧化酶(SOD)总活性、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、谷胱甘肽还原酶(GR)和抗超氧阴离子自由基![]() 活性测定均利用南京建成科技有限公司生产的试剂盒进行。丙二醛(MDA)含量测定采用硫代巴比妥酸法[22]。
活性测定均利用南京建成科技有限公司生产的试剂盒进行。丙二醛(MDA)含量测定采用硫代巴比妥酸法[22]。
1.2.4 高粱幼苗盐碱胁迫差异转录组测序 取盐碱胁迫0,4,24,72 h的TR和WT组高粱整株幼苗,利用TRIzol试剂提取总RNA,设置3次生物学重复,干冰储存运输,送至上海拜谱生物科技有限公司转录组测序。对于具有生物重复的样品,用DEseq对2个条件/组进行差异表达分析。DEseq提供了利用基于负二项分布的模型确定数字基因表达数据中差异表达的统计例程。所得的P值使用Benjamini和Hochberg的方法进行调整,以控制错误发现率。DEseq发现P<0.01的基因被分配为差异表达基因(DEG)。
利用IBM SPSS Statistic 20软件进行数据统计分析,采用独立样品t检验(Independent-Samples t Test),通过最小显著性差异(LSD)检验对2个处理组数据进行比较。P<0.05、P<0.01或P<0.001表示数据具有统计学意义。利用WPS EXCEL 2016进行数据计算,Prism 8软件进行作图。
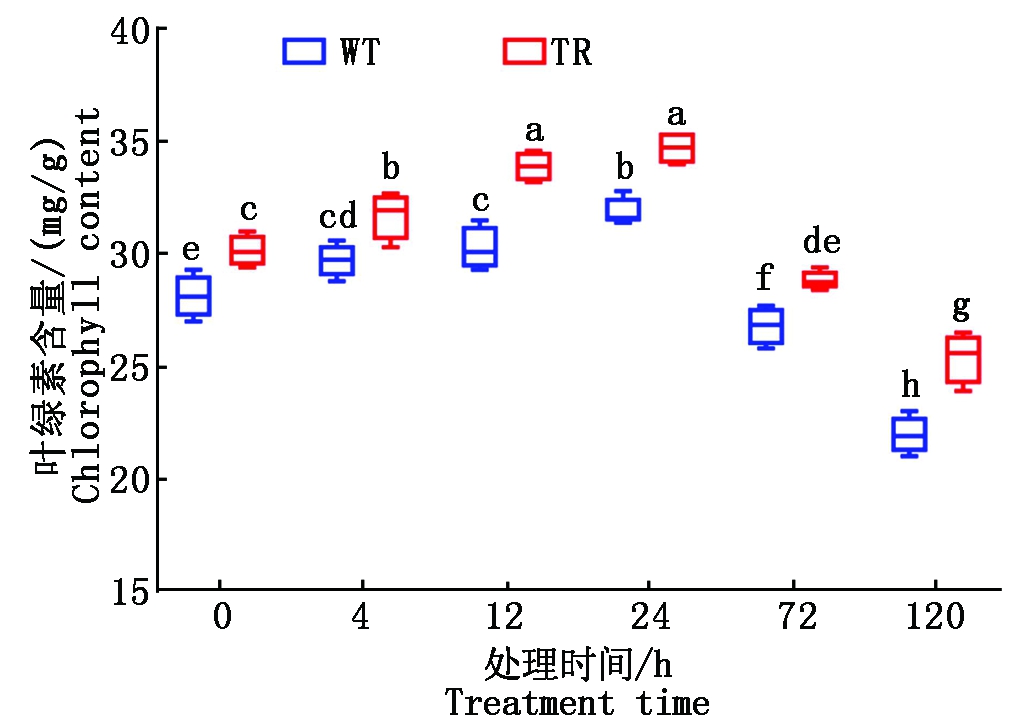
大量研究显示,在苏达盐碱胁迫下,植物生长发育缓慢,根系发育不良,新枝生长数少,影响植株的外部形态。盐碱胁迫下2个处理组表型结果如图1。在0 h,WT 组高粱只有主根,TR组高粱根系侧根多,且在茎基部生出1~2条侧根。从4~120 h,WT 组高粱主根在胁迫早期4 h就开始褐化,并逐渐加剧,根基部腐败严重;而TR组高粱主根褐化出现较晚且症状轻。在24 h,WT组幼苗新叶出现卷曲,TR组新叶正常伸展;72 h,WT 组高粱生长被抑制,新叶蜷缩萎蔫;TR组新叶才开始出现卷曲。120 h后,WT组地上部底部叶片褐化,顶部叶片枯黄干缩;TR组老叶和新叶的伸展较好,叶片只有部分黄化。盐碱胁迫对高粱叶绿素含量的影响如图2,WT 组和TR 组的叶绿素含量均呈先上升后下降的变化趋势,在24 h叶绿素含量达到最大值,但TR组叶绿素含量在各时间段内均显著高于WT 组。可见盐碱胁迫在24 h后对高粱光合作用的抑制效果较明显,转基因高粱可有效缓解盐碱胁迫带来的危害。

A.整株及地上部生长情况。B.地下部生长情况。WT.野生型;TR.过表达Atvip1基因植株。
A.Growth of whole plant and aboveground parts. B.The growth of the underground part. WT. Wild type;TR.Plants with overexpression of Atvip1 gene.
图1 盐碱胁迫对高粱表型的影响
Fig.1 Effects of saline-alkali stress on sorghum phenotype
在盐碱胁迫下,根系生长形态的优良决定植株的发育情况。盐碱胁迫后WT和TR组高粱根系的表面积、体积、根尖数、分叉数动态结果如图3。2组高粱根系生长随胁迫时间延长出现先升高后降低的趋势,在0~12 h,TR组高粱的表面积、体积、根尖数呈上升趋势,显著高于WT 组高粱,但分叉数差异不显著。在24 h,TR组高粱显著优于WT组高粱,各指标达到最大值。在72~120 h,2组高粱的根系生长指标降低,但TR组高粱生长指标除分叉数外均显著高于WT 组高粱。
不同小写字母表示处理间差异显著(P<0.05)。图3-5同。
The different small letters indicate significant differences among treatments(P<0.05).The same as Fig.3-5.
图2 盐碱胁迫对高粱叶绿素含量的影响
Fig.2 Effects of saline-alkali stress on chlorophyll content of sorghum
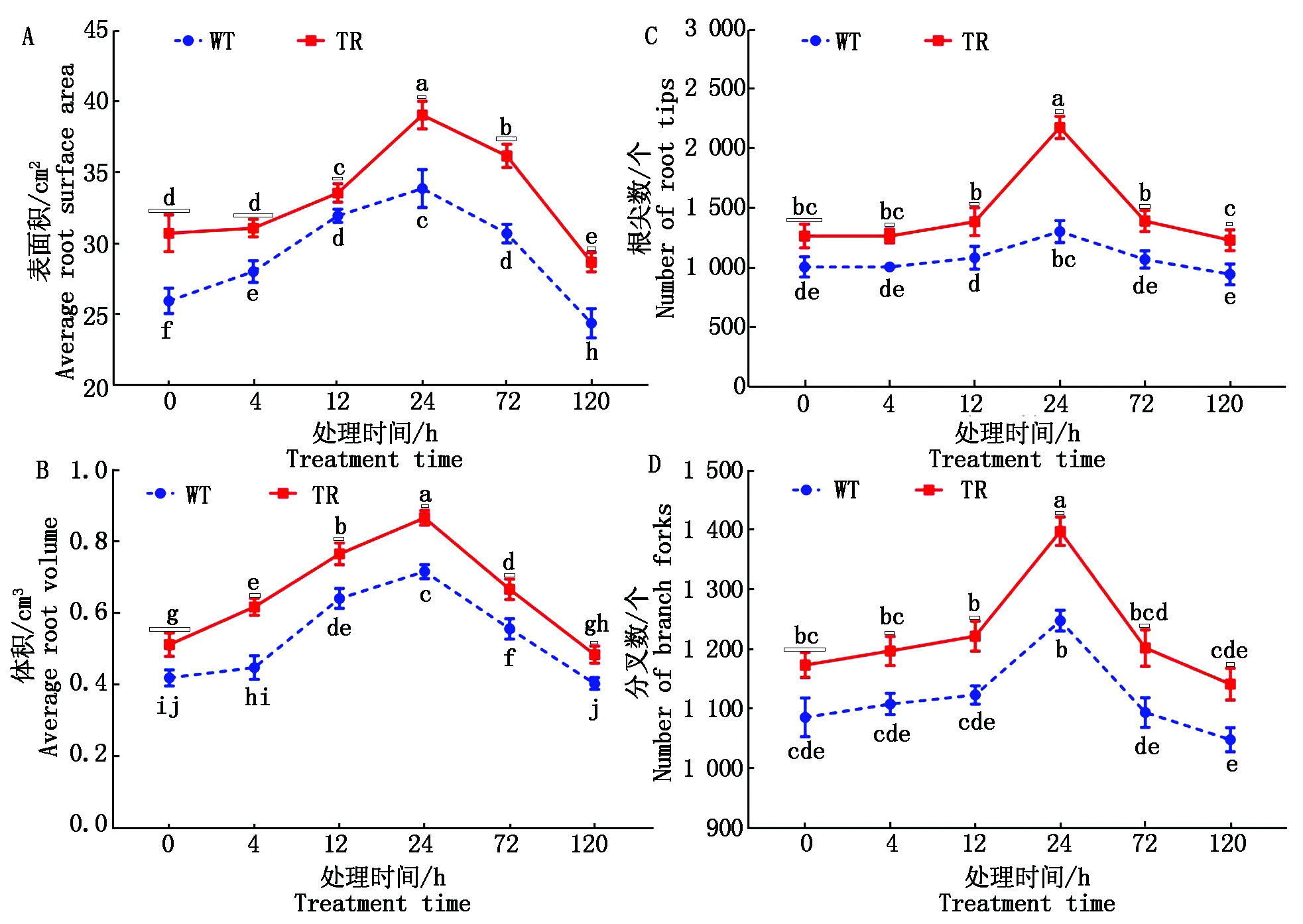
图3 盐碱胁迫对高粱根系生长相关指标的影响
Fig.3 Effects of saline-alkali stress on the growth indexes of sorghum roots
如图4所示,抗超氧阴离子自由基活力可反映高粱根系![]() 的抑制能力,胁迫24 h内,抗
的抑制能力,胁迫24 h内,抗![]() 活力逐渐升高,随后下降,且TR组抗
活力逐渐升高,随后下降,且TR组抗![]() 活力显著高于WT组高粱(图4-A)。由图4可知,在0 h,WT组的SOD、CAT和POD等抗氧化酶活性都显著高于TR组,而GR的活性显著低于TR组,GSH-PX活性在2组中无显著性差异;从4~72 h,TR组SOD、CAT和GR活性均显著高于WT组(图4-A、B、E),GSH-PX酶活性在12~72 h均显著高于WT组(图4-F),而POD活性仅在12~24 h显著高于WT组(图4-D);在120 h,TR组仅CAT和GSH-PX酶活性显著高于WT组。从时间上来看,24 h,除CAT外,TR组各酶活性均达到最高值。从TR组酶活性动态变化来看,胁迫早期(4~12 h),SOD、CAT和GR作用明显;胁迫中期(24~72 h),所有酶均发挥作用;胁迫后期(120 h),CAT和GSH-PX起重要作用;CAT酶在抵抗盐碱胁迫的全过程中均发挥作用。其中,变化幅度最大的酶是CAT和GR,CAT酶活性在12 h升高了2.47倍,GR酶活性在12 h升高了2倍。
活力显著高于WT组高粱(图4-A)。由图4可知,在0 h,WT组的SOD、CAT和POD等抗氧化酶活性都显著高于TR组,而GR的活性显著低于TR组,GSH-PX活性在2组中无显著性差异;从4~72 h,TR组SOD、CAT和GR活性均显著高于WT组(图4-A、B、E),GSH-PX酶活性在12~72 h均显著高于WT组(图4-F),而POD活性仅在12~24 h显著高于WT组(图4-D);在120 h,TR组仅CAT和GSH-PX酶活性显著高于WT组。从时间上来看,24 h,除CAT外,TR组各酶活性均达到最高值。从TR组酶活性动态变化来看,胁迫早期(4~12 h),SOD、CAT和GR作用明显;胁迫中期(24~72 h),所有酶均发挥作用;胁迫后期(120 h),CAT和GSH-PX起重要作用;CAT酶在抵抗盐碱胁迫的全过程中均发挥作用。其中,变化幅度最大的酶是CAT和GR,CAT酶活性在12 h升高了2.47倍,GR酶活性在12 h升高了2倍。

图4 盐碱胁迫下高粱根系抗氧化酶系统动态变化
Fig.4 Dynamic changes of antioxidant enzyme system in sorghum roots under saline-alkali stress
MDA是具有细胞毒性的物质,能与膜结构上的酶和蛋白质相结合,发生交联作用而使其失活,从而导致膜结构被破坏。由图5可知,胁迫初期0,4 h,TR组根系MDA含量显著高于WT组;在12 h,TR组根系MDA含量快速下降,且显著低于WT 组;在 24,72,120 h,TR组高粱根系MDA含量开始增加,但仍显著低于WT组。可见,在盐碱胁迫24 h内,异源过表达Atvip1基因高粱可将MDA控制在较低水平。
对差异转录中发现的DEGs进行COG功能预测和分类。在1 413 个NR位点中,510 个 DEGs被归为COG分类。因一个DEG可以被分配给多个COG功能,因此,共获得611 个COG 功能注释,这些注释被分为25 个功能类别(图6)。其中,防御机制类别中有62个COG功能注释,占10.15%。在各个时间内,防御机制所涉及的DEGs数量占比较大(图6中红色箭头所示),而在4 h,防御相关的差异基因最多。
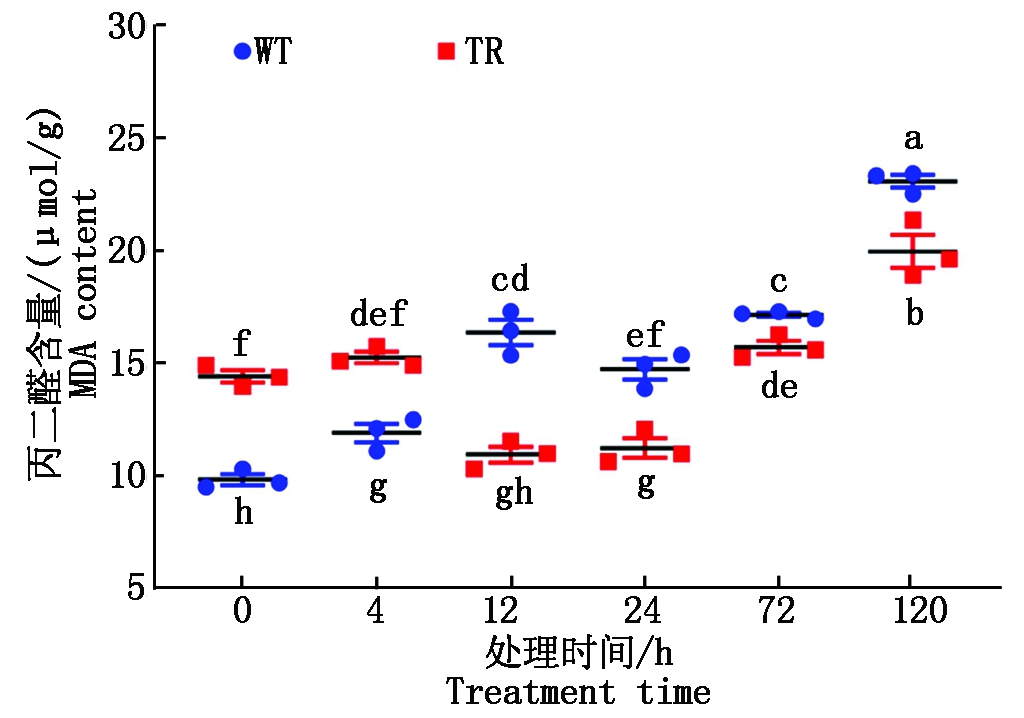
图5 盐碱胁迫对高粱MDA含量的影响
Fig.5 Effects of saline-alkali stress on MDA content of sorghum
为进一步分析在胁迫过程中,抗氧化酶在转录水平上的差异表达情况,本研究从转录组测序数据中筛选出这5类抗氧化酶差异表达基因共42 个,并针对基因表达量(FPKM值)采用TR组/WT组的差异倍数进行热图分析(图7)。结果显示,7个SOD基因,包括Cu,Zn-SOD(Sb02g042170、Sb01g035350、Sb07g023950和Sb01g042660)和Fe,Mn-SOD(Sb10g002970、Sb09g011450和Sb06g025970);22个POD基因、3个CAT基因、3个GR基因和7个GSH-PX基因在TR和WT 2组中不同时间上的表达量存在差异;与WT组相比,TR组同一类酶的各个相关基因表达水平在不同时间上有上调和下调2种方式,各基因转录水平上与抗氧化酶蛋白水平上在各时间表达不完全一致,它们之间没有明显的相关性。

图6 DEGs的COG注释分类统计
Fig.6 DEGs COG annotated classification chart
盐碱危害是导致作物产量降低的主要因素之一,对植物的生长发育具有明显的抑制效应,生物量的积累也会下降。为了适应盐碱环境,植物通常改变自身形态和生理代谢来维持生存[23-24]。根是首先接触盐碱胁迫的器官,在盐碱感应中起重要作用[25-26]。植物受盐碱胁迫后,大量失水或吸水困难,导致植物渗透系统失控,从而大量减产[27]。VIP1是bZIP转录因子,是MPK3的靶标,被认为与植物防御反应有关[16]。Lapham等[28]发现,vip1突变体植株对盐生长的耐受性发生改变,表明vip1在盐胁迫中起作用,但其具体作用机制未知。本研究中,与野生型WT组相比,过表达Atvip1基因的TR组无论是地上部还是地下部均对苏打盐碱胁迫具有较强抗性,体现为根系表面积和体积增大,根尖数及分叉数增多,根部褐化晚且根基部腐败较轻。地上部幼苗新叶伸展及生长受抑制较小,叶绿素含量显著高于野生型。可见,过表达Atvip1基因可通过降低盐碱胁迫对植株光合作用和生长发育的影响,从而提高高粱抗性。
前人研究表明,盐碱胁迫会显著增加植物ROS的累积,改变细胞膜的通透性,影响物质运输,![]() 是生物体内ROS的主要来源,过量
是生物体内ROS的主要来源,过量![]() 可致植物组织损伤[29-30]。随着盐碱胁迫时间的累积,H2O2在植物体内会大量积累,植物体内的保护酶系统的活性逐渐升高[31],MDA也是衡量植物是否受到胁迫的常用指标,结合抗氧化酶系统如SOD、CAT、POD、GR和GSH-PX等活性来确定植物对胁迫环境的耐受性程度[32-34]。本研究中,TR组在盐碱胁迫后,抗氧化酶活性在不同时间段显著增强,胁迫早期,SOD、CAT和GR作用明显;胁迫中期,所有酶均发挥作用;胁迫后期,CAT和GSH-PX起重要作用;CAT在TR组高粱抵抗盐碱胁迫的全过程中均发挥作用。高活性的GR有利于GSH-PX的形成,为清除活性氧提供还原力。可见,与WT组相比,过表达Atvip1基因可正调控盐碱胁迫下抗氧化酶的活性,使得对活性氧的清除能力显著增强。MDA含量呈现先降低再升高的趋势,表明高粱幼苗生长受到了明显抑制,但TR组MDA含量在12 h之后较WT组低,说明过表达Atvip1基因可显著缓解盐碱胁迫导致的高粱幼苗ROS积累,降低MDA的累积,保护了细胞膜的稳定性,从而增强高粱对盐碱胁迫的抗性。
可致植物组织损伤[29-30]。随着盐碱胁迫时间的累积,H2O2在植物体内会大量积累,植物体内的保护酶系统的活性逐渐升高[31],MDA也是衡量植物是否受到胁迫的常用指标,结合抗氧化酶系统如SOD、CAT、POD、GR和GSH-PX等活性来确定植物对胁迫环境的耐受性程度[32-34]。本研究中,TR组在盐碱胁迫后,抗氧化酶活性在不同时间段显著增强,胁迫早期,SOD、CAT和GR作用明显;胁迫中期,所有酶均发挥作用;胁迫后期,CAT和GSH-PX起重要作用;CAT在TR组高粱抵抗盐碱胁迫的全过程中均发挥作用。高活性的GR有利于GSH-PX的形成,为清除活性氧提供还原力。可见,与WT组相比,过表达Atvip1基因可正调控盐碱胁迫下抗氧化酶的活性,使得对活性氧的清除能力显著增强。MDA含量呈现先降低再升高的趋势,表明高粱幼苗生长受到了明显抑制,但TR组MDA含量在12 h之后较WT组低,说明过表达Atvip1基因可显著缓解盐碱胁迫导致的高粱幼苗ROS积累,降低MDA的累积,保护了细胞膜的稳定性,从而增强高粱对盐碱胁迫的抗性。

图7 高粱抗氧化系统关键酶基因量差异倍数表达热图
Fig.7 Heat map of key enzyme gene expression in antioxidant system of sorghum
分析盐碱胁迫下WT组和TR组转录组数据,DEGs的COG功能显示,胁迫4 h,参与防御机制的差异基因所占的比重大幅度增加,在24,72 h时仍保持较高占比。筛选获得了42个与SOD、CAT、POD、GR和GSH-PX等抗氧化酶相关的差异基因,TR组酶活性动态变化有上调、下调2种调节方式,这与张贝贝[35]研究甜瓜对盐碱胁迫响应的转录组分析的结果类似。本研究中抗性酶在基因水平和蛋白水平表达情况存在差异,原因可能有2种:一方面是取样不同,差异转录组测序是针对整个植株开展,而抗性酶活性测定仅针对根系进行;另一方面是分子调控机制,基因的表达存在短时间应激高表达,但大部分基因在应激过后还会下降,而蛋白可能维持一个相对长时间的上调;同时一个基因可能会有多个转录本,且还存在转录调控和翻译后修饰等过程。
从盐碱胁迫的时间节点可以看出,盐碱胁迫4 h后,高粱已启动了基因表达、抗氧化酶活性升高和防御机制增强等过程,且该过程一直持续至24 h。盐碱胁迫24 h是一个重要节点,在这之前植物通过积极调控体内各种生理生化代谢过程来抵御胁迫造成的伤害,从而保障生长发育顺利进行;24 h之后,由于胁迫的持续影响,导致代谢过程和生长发育均受到严重抑制。过表达Atvip1基因高粱在整个胁迫过程中无论在代谢过程还是生长发育方面均表现出较强的抗性,表明该基因的转入提高了高粱对氧化胁迫的耐受力,在响应盐碱胁迫中发挥着重要的作用,但该基因具体作用的分子机制还有待于进一步研究。
[1] Guo R,Yang Z Z,Li F,Yan C R,Zhong X L,Liu Q,Xia X,Li H R,Zhao L. Comparative metabolic responses and adaptive strategies of wheat(Triticum aestivum)to salt and alkali stress[J].BMC Plant Biology,2015,15:170. doi:10.1186/s12870-015-0546-x.
[2] 倪秀珍,张强. 抗盐植物研究进展[J].特产研究,2004,26(4):58-62. doi:10.3969/j.issn.1001-4721.2004.04.019.
Ni X Z,Zhang Q. The research progress on the salt-and-alkali-resistance-plant[J].Special Wild Economic Animal and Plant Research,2004,26(4):58-62.
[3] 张佳环,王贺,金哲宇,高明瑞,杨福,李景鹏,张治安. 苏打盐碱地水稻秆腐菌核病危害特征及其防治关键技术[J].吉林农业大学学报,2020:1-7.doi:10.13327/j.jjlau.2020.5256.
Zhang J H,Wang H,Jin Z Y,Gao M R,Yang F,Li J P,Zhang Z A. Effects of sclerotiniose blight of rice stem rot on 1000-grain weight and chalkiness rate of rice in soda saline-alkali soil and the control effect of silicon fertilizer on the disease[J].Journal of Jilin Agricultural University,2020:1-7.
[4] Mahajan S,Pandey G K,Tuteja N. Calcium-and salt-stress signaling in plants:Shedding light on SOS pathway[J].Archives of Biochemistry and Biophysics,2008,471(2):146-158. doi:10.1016/j.abb.2008.01.010.
[5] 闫永庆,王文杰,朱虹,刘兴亮,石溪婵,祖元刚. 盐碱胁迫对青山杨光合特性的影响[J].东北农业大学学报,2010,41(2):31-38.doi:10.3969/j.issn.1005-9369.2010.02.007.
Yan Y Q,Wang W J,Zhu H,Liu X L,Shi X C,Zu Y G. Effect of saline-alkali stress on photosynthetic characteristics of Qingshan poplar[J].Journal of Northeast Agricultural University,2010,41(2):31-38.
[6] Tanou G,Job C,Rajjou L,Arc E,Belghazi M,Diamantidis G,Molassiotis A,Job D. Proteomics reveals the overlapping roles of hydrogen peroxide and nitric oxide in the acclimation of Citrus plants to salinity[J].The Plant Journal,2009,60(5):795-804.doi:10.1111/j.1365-313x.2009.04000.x.
[7] 黎大爵.首届全国甜高粱会议论文摘要及培训班讲义[M].北京:科学出版社,1995:190.
Li D J. The first national sweet sorghum conference paper abstract and training class handout[M].Beijing:Science Press,1995:190.
[8] Den Herder G,Van Isterdael G,Beeckman T,De Smet I. The roots of a new green revolution[J].Trends in Plant Science,2010,15(11):600-607.doi:10.1016/j.tplants.2010.08.009.
[9] Larson J E,Funk J L. Seedling root responses to soil moisture and the identification of a belowground trait spectrum across three growth forms[J].The New Phytologist,2016,210(3):827-838. doi:10.1111/nph.13829.
[10] Citovsky V,DE Vos G,Zambryski P. Single-stranded DNA binding protein encoded by the virE locus of Agrobacterium tumefaciens[J].Science,1988,240(4851):501-504. doi:10.1126/science.240.4851.501.
[11] Ziemienowicz A,Merkle T,Schoumacher F,Hohn B,Rossi L. Import of Agrobacterium T-DNA into plant nuclei:Two distinct functions of VirD2 and VirE2 proteins[J].The Plant Cell,2001,13(2):369-383. doi:10.1105/tpc.13.2.369.
[12] Li J X,Krichevsky A,Vaidya M,Tzfira T,Citovsky V. Uncoupling of the functions of the Arabidopsis VIP1 protein in transient and stable plant genetic transformation by Agrobacterium[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(16):5733-5738.doi:10.1073/pnas.0404118102.
[13] Dingwall C,Laskey R A. Nuclear targeting sequences-a consensus?[J].Trends in Biochemical Sciences,1991,16(12):478-481.doi:10.1016/0968-0004(91)90184-w.
[14] Tsugama D,Liu S K,Fujino K,Takano T. Calcium signalling regulates the functions of the bZIP protein VIP1 in touch responses in Arabidopsis thaliana[J].Annals of Botany,2018,122(7):1219-1229. doi:10.1093/aob/mcy125.
[15] Takeo K,Ito T. Subcellular localization of VIP1 is regulated by phosphorylation and 14-3-3 proteins[J].FEBS Letters,2017,591(13):1972-1981. doi:10.1002/1873-3468.12686.
[16] Yoon H S,Fujino K,Liu S K,Takano T,Tsugama D. VIP1,a bZIP protein,interacts with the catalytic subunit of protein phosphatase 2A in Arabidopsis thaliana[J].Plant Signaling & Behavior,2020,15(2):1706026. doi:10.1080/15592324.2019.1706026.
[17] Tzfira T,Rhee Y,Chen M H,Kunik T,Citovsky V. Nucleic acid transport in plant-microbe interactions:The molecules that walk through the walls[J].Annual Review of Microbiology,2000,54:187-219. doi:10.1146/annurev.micro.54.1.187.
[18] Wu Y,Zhao Q,Gao L,Yu X M,Fang P,Oliver D J,Xiang C B. Isolation and characterization of low-sulphur-tolerant mutants of Arabidopsis[J].Journal of Experimental Botany,2010,61(12):3407-3422. doi:10.1093/jxb/erq161.
[19] Chen J,Yi Q,Cao Y,Wei B,Zheng L J,Xiao Q L,Xie Y,Gu Y,Li Y P,Huang H H,Wang Y B,Hou X B,Long T D,Zhang J J,Liu H M,Liu Y H,Yu G W,Huang Y B. ZmbZIP91 regulates expression of starch synthesis-related genes by binding to ACTCAT elements in their promoters[J].Journal of Experimental Botany,2016,67(5):1327-1338. doi:10.1093/jxb/erv527.
[20] Tsugama D,Liu S,Takano T. Analysis of functions of VIP1 and its close homologs in osmosensory responses of Arabidopsis thaliana[J].PLoS One,2014,9(8):e103930. doi:10.1371/journal.pone.0103930.
[21] Tsugama D,Liu S K,Takano T. The bZIP protein VIP1 is involved in touch responses in Arabidopsis roots[J].Plant Physiology,2016,171(2):1355-1365. doi:10.1104/pp.16.00256.
[22] 高俊凤. 植物生理学实验指导[M].北京:高等教育出版社,2006.
Gao J F. Experimental guidance for plant physiology[M].Beijing:Higher Education Press,2006.
[23] Bistgani Z E,Hashemi M,Dacosta M,Craker L,Maggi F,Morshedloo M R. Effect of salinity stress on the physiological characteristics,phenolic compounds and antioxidant activity of Thymus vulgaris L. and Thymus daenensis Celak[J].Industrial Crops and Products,2019,135:311-320. doi:10.1016/j.indcrop.2019.04.055.
[24] Muchate N S,Nikalje G C,Rajurkar N S,Suprasanna P,Nikam T D. Plant salt stress:Adaptive responses,tolerance mechanism and bioengineering for salt tolerance[J].The Botanical Review,2016,82(4): 371-406. doi:10.1007/s12229-016-9173-y.
[25] Galvan-Ampudia C S,Julkowska M M,Darwish E,Gandullo J,Korver R A,Brunoud G,Haring M A,Munnik T,Vernoux T,Testerink C. Halotropism is a response of plant roots to avoid a saline environment[J].Current Biology,2013,23(20):2044-2050. doi:10.1016/j.cub.2013.08.042.
[26] Robbins N E,Trontin C,Duan L N,Dinneny J R. Beyond the barrier:Communication in the root through the endodermis[J].Plant Physiology,2014,166(2):551-559. doi:10.1104/pp.114.244871.
[27] 盛彦敏,石德成,尚洪兴,许月. 不同程度中碱性复合盐对向日葵生长的影响[J].东北师大学报(自然科学版),1999(4): 65-69.
Sheng Y M,Shi D C,Shang H X,Xu Y. The effect on growth of sunflower to mixed salts with various natural and alkaline[J].Journal of Northeast Normal University(Natural Science Edition),1999(4): 65-69.
[28] Lapham R,Lee L Y,Tsugama D,Lee S,Mengiste T,Gelvin S B. VIP1 and its homologs are not required for Agrobacterium-mediated transformation,but play a role in botrytis and salt stress responses[J].Frontiers in Plant Science,2018,9:749. doi:10.3389/fpls.2018.00749.
[29] 仪泽会,毛丽萍,赵婧. 嫁接对复合盐碱胁迫下青椒幼苗生长、抗氧化能力及渗透调节能力的影响[J].植物生理学报,2020,56(9):1943-1954.doi:10.13592/j.cnki.ppj.2019.0604.
Yi Z H,Mao L P,Zhao J. Effects of grafting on growth,antioxidant capacity and osmotic adjustment capacity of green pepper seedlings under mixed salt-alkali stress[J].Plant Physiology Journal,2020,56(9):1943-1954.
[30] Zhang J L,Shi H Z. Physiological and molecular mechanisms of plant salt tolerance[J].Photosynthesis Research,2013,115(1):1-22. doi:10.1007/s11120-013-9813-6.
[31] Zhang H H,Li X,Guan Y P,Li M B,Wang Y,An M J,Zhang Y H,Liu G J,Xu N,Sun G Y. Physiological and proteomic responses of reactive oxygen species metabolism and antioxidant machinery in mulberry(Morus alba L.)seedling leaves to NaCl and NaHCO3 stress[J].Ecotoxicology and Environmental Safety,2020,193:110259. doi:10.1016/j.ecoenv.2020.110259.
[32] 刘铎,丛日春,高卫东,党宏忠,李庆梅,刘德玺,杨庆山. 盐碱胁迫对柳树抗氧化酶的影响[J].水土保持通报,2017,37(5):53-57. doi:10.13961/j.cnki.stbctb.2017.05.009.
Liu D,Cong R C,Gao W D,Dang H Z,Li Q M,Liu D X,Yang Q S. Effects of salt and alkali stresses on antioxidases of willow[J].Bulletin of Soil and Water Conservation,2017,37(5):53-57.
[33] 刘萍,王彦,程丽君,秦瑞鑫. 盐碱胁迫对合欢种子萌发及酶活性影响[J].滨州学院学报,2018,34(2):51-55. doi:10.13486/j.cnki.1673-2618.2018.02.009.
Liu P,Wang Y,Cheng L J,Qin R X. Effect of saline-alkali stress on seed germination and enzyme activity of Albizzia julibrissin durazz[J].Journal of Binzhou University,2018,34(2):51-55.
[34] 李晓雅,赵翠珠,程小军,贾庆利,李长圣,刘明喆,Lu Chaofu,张猛. 盐胁迫对亚麻荠幼苗生理生化指标的影响[J].西北农业学报,2015,24(4):76-83. doi:10.7606/j.issn.1004-1389.2015.04.013.
Li X Y,Zhao C Z,Cheng X J,Jia Q L,Li C S,Liu M Z,Lu C F,Zhang M. Effects of salt stress on physiological and biochemical indexes of Camelina sativa seedlings[J].Acta Agriculturae Boreali-Occidentalis Sinica,2015,24(4):76-83.
[35] 张贝贝.甜瓜对盐碱胁迫的形态学与生理生化响应和转录组分析[D].福州:福建农林大学,2019.
Zhang B B. Response of melon to Saline-alkali stress at morphological,physiological,biochemical and transcriptome levels[D].Fuzhou: Fujian Agriculture and Forestry University,2019.