萝卜为典型的异花授粉植物,自交衰退严重,其杂种优势明显。利用细胞质雄性不育(Cytoplasmic male sterility,CMS)进行杂交制种是当前萝卜杂种优势利用的主要途径,具有杂种一代纯度高、制种成本低、亲本不易流失等优点[1-2]。1968年,日本学者小仓首次发现萝卜细胞质雄性不育类型Ogura CMS,后续又有UK-1、Kosena、NWB及DCGMS胞质类型被发现[3-6]。2005年,韩国学者首次报道NWB CMS,与Ogura CMS相比该胞质类型花药上有约1/2无功能花粉,与来自多个国家的74份材料进行测交均未发现其恢复材料[5]。2008年,韩国学者从乌兹别克斯坦引进的萝卜材料中发现DCGMS CMS,该胞质类型花药特征与NWB CMS相似,石蜡切片分析表明败育发生在单核小孢子时期,药室内有未被染色的花粉粒,同时该胞质可扩增出NWB CMS特异分子条带,推测2种胞质可能为同一类型[6]。张丽等[7]研究表明,NWB CMS败育发生在单核小孢子时期,主要表现为绒毡层轻度液泡化,药室内仍有未染色的花粉粒空壳,进一步验证NWB CMS与DCGMS CMS相似。Park等[8]通过线粒体基因组测序推测orf463为DCGMS CMS不育主控基因。随后,Yamagishi等[9]发现orf463基因广泛存在于黑萝卜(普通萝卜的一个变种)中,且同一黑萝卜线粒体中DCGMS CMS线粒体结构类型与已测序日本黑萝卜线粒体结构类型并存,只是不同材料2种类型的亚计量不同。Wang等[10]通过对NWB CMS线粒体基因组测序发现,NWB CMS与日本黑萝卜线粒体基因组序列与结构完全一致,与DCGMS CMS仅存在结构上的差异,是同分异构型,以上两项研究从分子与基因组水平证实NWB CMS与DCGMS CMS属于同一不育胞质类型。
有关NWB CMS及DCGMS CMS恢复材料及恢复基因遗传研究的报道较少且比较复杂,Lee等[6]从一份来自俄罗斯的材料(R171)及一份未知来源的材料(R121)中找到DCGMS CMS恢复基因。Kim等[11]进一步研究了R171与R121中DCGMS CMS恢复基因的遗传规律,证实R171含2个以上基因,R121含1个基因。随后,Cho、Lee等[12-13]分别利用萝卜基因组与拟南芥的共线性,将Rfd1定位于拟南芥3号染色体,区间大小分别为220 kb及83 kb,但在区域内未找到编码PPR相关蛋白的基因,说明DCGMS CMS恢复基因可能不属于编码PPR相关蛋白的常见恢复基因类型。Yamagishi、Wang等[9-10]均证实DCGMS/NWB CMS恢复基因主要存在于黑萝卜和欧洲萝卜中,不同恢复材料,其遗传规律不同,所含基因对数各异。
NWB CMS及其恢复基因相关研究主要集中在日韩,国内有关研究极少,至今其不育主控基因orf463未被验证,恢复基因也未被克隆。NWB CMS胞质相对于Ogura CMS恢复材料较少,更易筛选保持系,对萝卜杂交品种选育具有重要意义。但恢复材料较少限制了不育机制及核质互作机理的研究,同时导致育种者难以利用花粉败育的NWB CMS萝卜资源。本研究通过对不同核背景下NWB CMS败育特征及不同材料恢复基因的遗传规律分析,可为国内研究者对该胞质及其恢复基因的深入研究与育种应用提供理论依据。
1 材料和方法
1.1 试验材料
供试材料A1~A4为4个稳定的萝卜细胞质雄性不育系,其中A1为Ogura CMS,A2~A4为以韩国世农种苗世农301为不育源经过连续6代回交转育而成的NWB CMS不育系(世农301经认证为NWB CMS);B1~B4为不育系相应保持系;R1~R5为具有NWB CMS育性恢复功能的恢复系(表1);遗传规律分析所用F1、F2、BC1群体为A2与R1~R5创制获得。所有材料于2019年11月4日种植于四川省农业科学院水稻高粱研究所德阳市大同试验基地,2020年4月进行育性鉴定及各项试验。
表1 供试保持系及恢复系来源、类型及育性
Tab.1 The origin,variety types and fertility of the maintainer and restorer lines used in the experiments
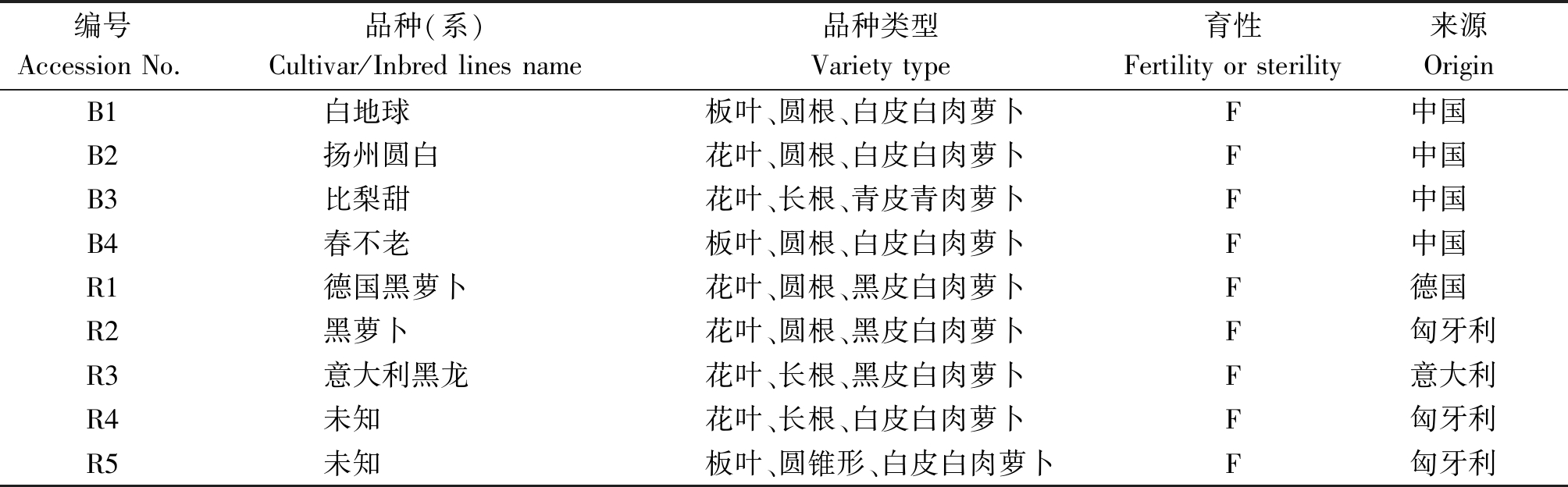
编号Accession No.品种(系)Cultivar/Inbred lines name品种类型Variety type育性Fertility or sterility 来源OriginB1白地球板叶、圆根、白皮白肉萝卜F中国B2扬州圆白花叶、圆根、白皮白肉萝卜F中国B3比梨甜花叶、长根、青皮青肉萝卜F中国B4春不老板叶、圆根、白皮白肉萝卜F中国R1德国黑萝卜花叶、圆根、黑皮白肉萝卜F德国R2黑萝卜花叶、圆根、黑皮白肉萝卜F匈牙利R3意大利黑龙花叶、长根、黑皮白肉萝卜F意大利R4未知花叶、长根、白皮白肉萝卜F匈牙利R5未知板叶、圆锥形、白皮白肉萝卜F匈牙利
1.2 不同核背景NWB CMS不育系花器形态观察
萝卜盛花期观察Ogura CMS(A1)与不同核背景下NWB CMS(A2~A4)花器形态,并拍照记录。
1.3 石蜡切片
石蜡切片法观察正常可育材料B1及4个细胞质雄性不育系花粉粒的发育过程。选取不同大小花蕾,置于 FAA 固定液中(甲醛∶冰醋酸∶70% 酒精=5∶5∶90,体积比),4 ℃过夜。参照张丽等[7]的方法对固定后花蕾进行脱水→透明→石蜡包埋→切片,贴片后用甲苯胺蓝进行染色,最后于光学显微镜(Nikon Eclipse E100)下观察并拍照。
1.4 电镜扫描
取NWB CMS不育系A4花药上无功能花粉与其相应保持系B4花药上正常花粉,用2.5%的戊二醛固定,参照衡双平[14]的方法,对固定花粉进行抽真空→缓冲液洗涤→锇酸再固定→缓冲液洗涤→乙醇梯度脱水→临界点干燥等一系列处理。随后,将样品用少量导电胶固定在样品台上,进行样品喷金,最后在塞维尔(谷歌)生物电镜平台用扫描电子显微镜(Hitachi SU8010)进行照相。
1.5 群体构建与遗传规律分析
2018年4月利用NWB CMS材料A2分别与不同恢复材料杂交获得F1材料,2019年4月F1材料自交获得F2群体,同时以F1为父本回交获得BC1群体,2020年4月对F2及BC1群体进行育性鉴定,然后对育性调查结果进行χ2检验分析。
2 结果与分析
2.1 不同核背景NWB CMS不育系花器形态特征分析
如图1所示,不同核背景NWB CMS不育系雄蕊特征不同。保持系来源扬州圆白的不育系A2其花药瘦小、干瘪,花丝短缩,花药上无肉眼可见花粉,雄蕊显著低于柱头与Ogura CMS不育系A1特征相似;保持系来源比梨甜的不育系A3花药饱满,花丝正常,但花药上无可见花粉;保持系来源春不老的不育系A4花药饱满,花丝正常,花药上有可见花粉,花粉量约为其保持系的1/3,花粉测交验证无活性。虽然3个不同核背景下的NWB CMS不育系开花后花器形态特征明显不同,但三者也具有共同特征,即与正常可育株一样,在开花前用手捏花蕾均有黄色液体溢出,随着花蕾变大,A2与A3溢出的黄色液体逐渐减少,直至消失,而Ogura CMS不育系不同大小花蕾手捏均溢出白色透明液体。

A. Ogura CMS 不育系A1;B. NWB CMS不育系A2;
C. NWB CMS不育系A3;D. NWB CMS不育系A4。
A. Ogura CMS sterile line A1;B. NWB CMS sterile line A2;
C. NWB CMS sterile line A3;D. NWB CMS sterile line A4.
图1 4个萝卜不育系花器形态
Fig.1 The flower morphology of four CMS lines
2.2 NWB CMS不育系花粉败育过程
通过石蜡切片法观察4个细胞质雄性不育系花粉败育过程发现,NWB CMS不育系败育时期及败育方式与Ogura CMS不育系明显不同,但3个花器形态差异的NWB CMS不育系败育开始时期一致(图2)。花粉母细胞时期4个不育系花药与可育对照花药没有差异(图2-A-E)。Ogura CMS不育系A1花药在四分体时期开始败育,表现为绒毡层细胞膨大,液泡化,而NWB CMS不育系(A2~A4)花药与正常可育胞质一样(图2-F-J)。在单核小孢子时期3个不同核背景的NWB CMS绒毡层细胞膨大明显,开始液泡化,而Ogura CMS绒毡层液泡化加剧,严重挤压小孢子生存空间,小孢子开始降解,仅有少量残留在药室内(图2-K-O)。随着花药发育时期的推进,正常胞质绒毡层开始降解,释放出可染色的成熟花粉粒。而Ogura CMS不育系的绒毡层与小孢子完全降解,形成空的药室。3个不同核背景的NWB CMS不育系药室差异明显,花期花药干瘪无花粉的A2绒毡层彻底降解,药室结构皱缩变形,花粉粒内含物降解,仅剩变形空壳紧紧挤在一起,呈条状(导致无法散粉);花期花药饱满无粉的A3药室内结构正常,有极少量花粉粒空壳附着在药室壁;花期花药饱满有无功能花粉的A4药室内有大量未被染色的花粉粒空壳(图2-P-T),三者花药发育后期药室石蜡切片细胞学结构差异,很好地解释了其花药形态差异形成的原因。
对NWB CMS不育系A4及其保持系B4上的花粉粒进行扫描电镜分析发现,不育系上花粉粒外壁雕纹与保持系没有差异,但其沿花粉粒3个萌发沟凹陷呈多面体,而保持系花粉粒饱满(图3),这与Lee等[6]的研究结果相似,只是因材料差异花粉粒形状明显不同。

B1.Ogura CMS保持系;A1.Ogura CMS不育系;A2~A4.3个不同核背景NWB CMS不育系。
B1.Ogura CMS maintainer line;A1.Ogura CMS sterile line;A2-A4.Three NWB CMS lines with different nuclear genome.
图2 萝卜正常可育与4个不育系花粉发育过程比较
Fig.2 The pollen development stages of one normal and four sterile lines

A. NWB CMS不育系A4花粉;B. NWB CMS保持系B4花粉。
A. The grains of NWB CMS sterile line A4;B. The grains of NWB CMS maintainer line B4.
图3 NWB CMS不育系A4及其保持系B4花粉粒形态
Fig.3 The morphology pollen grains of NWB CMS sterile line A4 and its maintainer line B4
2.3 恢复基因遗传规律分析
以NWB CMS不育系A2为母本,5个欧洲来源的萝卜为父本杂交获得的F1群体表现全可育,在此基础上构建F2、BC1群体进行育性鉴定。由表2可知,5个材料所含恢复基因均具有完全显性质量性状的特征,不同材料所含恢复基因对数不同。其中,不育系A2与R1构建的F2群体可育株与不育株实际分离比为62.57∶1,χ2=0.030 0,小于![]() 符合3对基因63∶1育性分离比,同时其BC1群体可育株与不育株实际分离比为7.04∶1,χ2=0.001 6,小于
符合3对基因63∶1育性分离比,同时其BC1群体可育株与不育株实际分离比为7.04∶1,χ2=0.001 6,小于![]() 经χ2测验符合3对基因7∶1育性分离比,说明材料R1中含有3对完全显性恢复基因;不育系A2与材料R2、R3、R4构建的F2及BC1群体育性分离比经χ2测验均符合2对完全显性基因遗传特性;不育系A2与材料R5的F2及BC1群体育性实际分离比分别为3.68∶1,1.24∶1,经χ2测验符合1对完全显性基因遗传特性。
经χ2测验符合3对基因7∶1育性分离比,说明材料R1中含有3对完全显性恢复基因;不育系A2与材料R2、R3、R4构建的F2及BC1群体育性分离比经χ2测验均符合2对完全显性基因遗传特性;不育系A2与材料R5的F2及BC1群体育性实际分离比分别为3.68∶1,1.24∶1,经χ2测验符合1对完全显性基因遗传特性。
表2 F2、BC1群体育性表现
Tab.2 The fertile performance of F2 and BC1 genetic groups
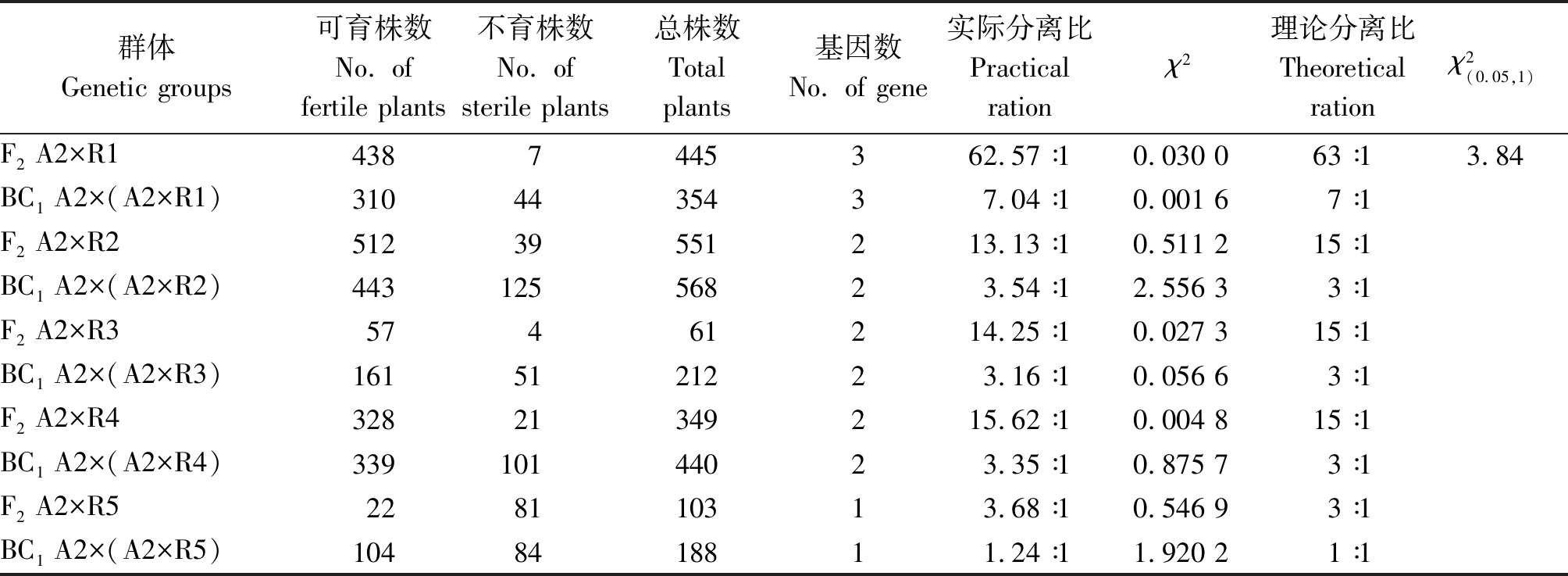
群体Genetic groups可育株数No. of fertile plants不育株数No. of sterile plants总株数Total plants基因数No. of gene实际分离比Practical rationχ2理论分离比Theoretical rationχ2(0.05,1)F2 A2×R14387445362.57∶10.030 063∶13.84BC1 A2×(A2×R1)3104435437.04∶10.001 67∶1F2 A2×R251239551213.13∶10.511 215∶1BC1 A2×(A2×R2)44312556823.54∶12.556 33∶1F2 A2×R357461214.25∶10.027 315∶1BC1 A2×(A2×R3)1615121223.16∶10.056 63∶1F2 A2×R432821349215.62∶10.004 815∶1BC1 A2×(A2×R4)33910144023.35∶10.875 73∶1F2 A2×R5228110313.68∶10.546 93∶1BC1 A2×(A2×R5)1048418811.24∶11.920 21∶1
3 结论与讨论
本研究发现不同核背景的NWB CMS不育系花药败育表型存在差异,花药呈干瘪无可见花粉、饱满无可见花粉、饱满有可见花粉3种形态,这与Nahm、Lee等[5-6]研究结果有差异,但有关胡萝卜胞质不育的研究也发现同一胞质类型存在不同败育特征[15]。大部分研究发现,植物不育系花药的败育与绒毡层细胞有关,绒毡层细胞的过度生长与膨大及绒毡层细胞的提前解体均是导致不育的原因[16-19]。通过对3个不同花药表型的NWB CMS不育系石蜡切片分析发现:3个不育系均在单核小孢子时期开始败育,表现为绒毡层细胞开始膨大,液泡化,这与张丽等[7]的研究结果一致,但最后三者药室内花粉粒降解程度不同,导致花期表型差异。因此,通过形态观察不能对不育胞质类型进行有效分类,需要利用细胞学、分子学或线粒体基因组学等方式进行准确鉴定。
Lee等[6]筛选到2份对DCGMS CMS具有恢复功能的材料,其中1份来自俄罗斯的材料含有纯合显性恢复基因,1份未知来源的材料含有杂合恢复基因。随后诸多研究均证实NWB CMS具有多个恢复基因,且材料来源主要集中在黑萝卜、欧洲萝卜与野萝卜中[9-11,20]。本研究在3份黑萝卜与2份欧洲萝卜材料中找到NWB CMS恢复基因,且基因对数因材料而异,与前人研究结果相似。至今仅获得DCGMS CMS恢复基因Rfd1的精细定位,初步分析其不属于编码PPR结构蛋白的基因,相关基因仍未被克隆。
萝卜中存在大量Ogura CMS恢复基因,选育Ogura CMS不育系较困难[20],而NWB CMS恢复基因在萝卜中分布极少,因此,NWB CMS可提高萝卜杂交品种选育效率,且极易配制出花粉败育的F1杂交品种,可很好保护育种者的知识产权。但与此同时,现今市场上流通的NWB CMS杂交品种均不育,恢复材料的缺乏导致此类品种的优良性状难以利用,长此以往将导致大量萝卜种质资源的丢失。后续应加强NWB CMS不育及恢复机制、恢复基因定位与克隆等理论基础的研究,对萝卜乃至整个十字花科作物的育种应用具有重要的意义。
[1] 汪隆植,何启伟.中国萝卜[M]. 北京:科学技术文献出版社,2005:310-314.
Wang L Z,He Q W. Chinese radish[M]. Beijing:Scientific and Technical Documentation Press,2005:310-314.
[2] 何启伟,石惠莲,安振琴,郎丰庆,赵双宜,张燕君,粟翼玟,周同度.中国萝卜雄性不育性遗传规律的研究[J].山东农业科学,1993(4):5-8.
He Q W,Shi H L,An Z Q,Lang F Q,Zhao S Y,Zhang Y J,Su Y W,Zhou T D.Study on the genetic law of male sterility in Chinese radish[J].Shandong Agricultural Sciences,1993(4):5-8.
[3] Ogura H. Studies on the new male sterility in Japanese radish with special reference to the utilization of this sterility towards the practical raising of hybrid seeds[M].Japan:Kagoshima University,1968:39-78.
[4] Yamagishi H,Terachi T.Molecular and biological studies on male-sterile cytoplasm in the Cruciferae. Ⅲ. Distribution of Ogura-type cytoplasm among Japanese wild radishes and Asian radish cultivars [J].Theor Appl Genet,1996,93(3):325-332.doi:10.1007/BF00223172.
[5] Nahm S H,Lee H J,Lee S W,Joo G Y,Harn C H,Yang S G,Min B W. Development of a molecular marker specific to a novel CMS line in radish (Raphanus sativus L.)[J]. Theor Appl Genet,2005,111(6):1191-1200. doi:10.1007/s00122-005-0052-x.
[6] Lee Y P,Park S,Lim C,Kim H,Lim H,Ahn Y,Sung S K,Yoon M K,Kim S. Discovery of a novel cytoplasmic male-sterility and its restorer lines in radish (Raphanus sativus L.)[J]. Theor Appl Genet,2008,117(6):905-913. doi:10.1007/s00122-008-0830-3.
[7] 张丽,王庆彪,郑鹏婧.萝卜雄性不育细胞质的鉴定与分类[J]. 华北农学报,2014,29(5):125-129.doi:10.7668/hbnxb.2014.05.021.
Zhang L,Wang Q B,Zheng P J. Identification and classification of different male sterile cytoplasms in radish[J]. Acta Agriculturae Boreali-Sinica,2014,29(5):125-129.
[8] Park J Y,Lee Y P,Lee J,Choi B S,Kim S,Yang T J. Complete mitochondrial genome sequence and identification of a candidate gene responsible for cytoplasmic male sterility in radish (Raphanus sativus L.) containing DCGMS cytoplasm[J]. Theor Appl Genet,2013,126:1763-1774. doi:10.1007/s00122-013-2090-0.
[9] Yamagishi H,Tanaka Y,Shiiba S,Hashimoto A,Fukunaga A,Terachi T.Mitochondrial orf463 causing male sterility in radish is possessed by cultivars belonging to the′Niger′ group[J]. Euphytica,2019,215(6):1-8.doi:10.1007/s10681-019-2437-y.
[10] Wang Y P,Wang Q B,Hao W,Li J X,Qi M X,Zhang L. Mitochondrial genome sequencing reveals orf463a may induce male sterility in NWB cytoplasm of radish[J]. Genes,2020,11(1):74. doi:10.3390/genes11010074.
[11] Kim K,Lee Y P,Lim H,Han T,Sung S K,Kim S. Identification of Rfd1,a novel restorer-of-fertility locus for cytoplasmic male-sterility caused by DCGMS cytoplasm and development of simple PCR markers linked to the Rfd1 locus in radish (Raphanus sativus L.)[J]. Euphytica,2010,175(1):79-90. doi:10.1007/s10681-010-0190-3.
[12] Cho Y C,Lee Y P,Park B S,Han T H,Kim S. Construction of a high-resolution linkage map of Rfd1,a restorer-of-fertility locus for cytoplasmic male sterility conferred by DCGMS cytoplasm in radish(Raphanus sativus L.) using synteny between radish and Arabidopsis genomes[J]. Theor Appl Genet,2012,125(3):467-477. doi:10.1007/s00122-012-1846-2.
[13] Lee Y P,Cho Y,Kim S. A high-resolution linkage map of the Rfd1,a restorer-of-fertility locus for cytoplasmic male sterility in radish (Raphanus sativus L.) produced by a combination of bulked segregant analysis and RNA-Seq[J]. Theor Appl Genet,2014,127(10):2243-2252. doi:10.1007/s00122-014-2376-x.
[14] 衡双平.油菜hau CMS线粒体基因组和不育基因的研究[D].武汉:华中农业大学,2015.
Heng S P.The mitochondrial genomes and functions of hau cytoplasm male sterility gene in Brassica[D].Wuhan:Huazhong Agricultural University,2015.
[15] Wolyn D J,Chahal A. Nuclear and cytoplasmic interactions for petaloid male-sterile accessions of wild carrot (Daucus carota L.)[J].Journal of the American Society for Horticultural Science,1998,123(5):849-853. doi:10.21273/JASHS.123.5.849.
[16] Kawanake T,Ariizumi T,Kawai-Yamada M,Uchimiya H,Toriyama K. Abolition of the tapetum suicide program ruins microsporogenesis [J]. Plant and Cell Physiology,2006,47(6):784-787.doi:10.1093/pcp/pcj039.
[17] Vizcay-Barrena G,Wilson Z A. Altered tapetal PCD and pollen wall development in the Arabidopsis ms1 mutant[J].J Exp Bot,2006,57(11):2709-2717.doi:10.1093/jxb/erl032.
[18] Smart C J,Monéger F,Leaver C J.Cell-specific regulation of gene expression in mitochondria during anther development in sunflower [J].The Plant Cell,1994,6(6):811-825.doi:10.1105/tpc.6.6.811.
[19] Balk J,Leaver C J. The PET1-CMS mitochondrial mutation in sunflower is associated with premature programmed cell death and cytochrome c release[J].The Plant Cell,2001,13(8):1803-1818.doi: 10.1105/tpc.010116.
[20] Yamagishi H,Terachi T.Cytoplasmic male sterility and mitochondrial genome variations in radish [M]//Nishi T,Kitashiba H.The Radish Genome.Cham,The Switzerland:Springer Press,2017:98-103.doi:10.1007/978-3-319-59253-4.