小麦是世界主要粮食作物之一,不断提高产量、品质和抗逆性是小麦育种的主要目标[1]。近几十年来,干旱已经成为影响小麦生产的主要非生物因素之一,随着全球气候变暖,预计干旱的严重程度和发生频率会进一步增加[2-3]。因此,选育小麦强抗旱性品种将是促进小麦生产持续高产、稳产的有效途径[4-5]。随着分子生物学和基因组学的深入研究,小麦抗旱性分子机制得以逐渐解析,并发现了一些与抗旱性相关的功能基因和紧密连锁的分子标记,分子标记与常规育种相结合有利于提升小麦抗旱性育种效率。
植物在干旱等非生物因素胁迫下会产生渗透胁迫、离子胁迫和由于活性氧积累而产生的次级氧化胁迫[6]。铁结合蛋白(Ferritin,Fer)是一种存在于植物体内的铁储藏蛋白,具有调节植物体内铁吸收与释放以及提高植物抗氧化胁迫能力的功能[7]。鞠丽萍等[8]利用强抗旱和弱抗旱小麦品种中TaFer基因在染色体A1上的序列差异,设计出共显性标记FerA1-intrl,在150份小麦材料中检测出2种变异类型,分别是TaFer-A1a(167 bp条带)和TaFer-A1b(170 bp条带),单倍型TaFer-A1a材料的萌发期抗旱性极显著高于单倍型TaFer-A1b。硫氧还蛋白(Thioredoxin,Trx)是一类在生物体内广泛分布的高度保守低分子质量蛋白质,具有多种生物学功能,参与调节体内氧化还原反应平衡,调节细胞生长,抑制凋亡,调节抗逆基因表达和抗氧化胁迫过程[9-11]。张帆等[12]在普通小麦5B染色体短臂上克隆了1个硫氧还蛋白超家族新基因TaNRX-B1,开发了2对显性互补STS标记,在150份小麦品种(系)中检测到2种与抗旱性相关的变异类型,分别为抗旱型TaNRX-B1a(841 bp条带)和敏感型TaNRX-B1b(870 bp条带)。刘芳军等[13]对117份宁夏小麦品种(系)以及孙晓燕等[14]对137份内蒙古春小麦品种(系)育种材料进行了FerA1-intrl标记和TaNRX-B1标记检测分析,结果表明,2个分子标记对小麦抗旱性进行选择是有效的。
小麦花前可溶性碳水化合物(Water soluble carbohydrate,WSC)占茎鞘总干质量的40%以上[15],是籽粒灌浆的重要碳源,对籽粒产量的贡献率在20%左右,在干旱胁迫条件下贡献率可高达50%以上[16]。果聚糖是小麦茎鞘中WSC的主要存在形式,最高可达茎鞘WSC的85%,当茎鞘 WSC 转运时,果聚糖外切水解酶(Fructan exohydrolase,FEH)将果聚糖催化降解为蔗糖,再运输到籽粒中,对小麦高产稳产具有重要作用[17-18]。Zhang等[19-20]利用2个普通小麦材料Westonia和Kauz克隆了3个1-FEH相关基因,其中位于6B染色体的1-FEH w3基因是催化果聚糖降解的主要基因,序列分析表明,在其启动子上游279 bp的位置存在1个SNP位点,进一步分析发现,该位点与小麦品种Westonia在干旱条件下的高千粒质量相关,小麦品种Kauz虽然也是耐旱品种,但是在干旱条件下的千粒质量低于Westonia。据此设计出1对CAPS标记,用以区分高千粒质量抗旱型Westonia type(102 bp条带)和低千粒质量抗旱型Kauz type(116 bp条带)。
脱水反应元件结合蛋白(DREB)属于AP2/ERF转录因子家族成员,能够调控一些干旱、高盐和低温等相关基因的表达,在植物抗逆境胁迫过程中发挥着重要作用[21]。雷梦林等[22]研究发现,在PEG、NaCl、ABA和低温胁迫下,Dreb-A1、Dreb-B1基因在叶片和幼根中均上调表达。王计平等[23]对43份小麦材料进行苗期抗旱性鉴定,其中人工合成六倍体小麦W7984的抗旱性等级为中等抗旱性,普通小麦Opata 85为干旱敏感。Wei等[24]利用2个小麦材料Opata85和W7984克隆TaDreb基因,序列分析发现,位于TaDreb-B1基因片段上的内含子具有2个SNP (646 bp和770 bp位置)差异,根据基因770 bp处的 SNP(A/C)设计等位基因特异性PCR(Allele specific PCR,AS-PCR )引物,将TaDreb-B1基因定位于3B染色体长臂上,开发的多态性分子标记TaDreb-B1在人工合成六倍体小麦W7984中扩增出2条带(616 bp条带和低于600 bp的条带),为抗旱型TaDreb-B1a,而在普通小麦Opata85中只扩增出1条616 bp条带,为干旱敏感型TaDreb-B1b。
黄淮麦区是我国小麦主产区,生长期内降水量少,干旱天气对小麦生产影响较大,近年来受全球变暖影响,干旱天气更是频发[25-26]。因此,在小麦育种中应特别注重亲本材料抗旱性的鉴定及改良。为此,对48份国外引进的小麦种质进行相对发芽率表型鉴定,并利用4个小麦抗旱性相关基因1-feh-w3、Dreb-B1、NRX-B1和FerA1的分子标记进行抗旱性检测,以评价这些抗旱性相关分子标记的有效性,筛选抗旱能力突出的抗旱基因组合及相关小麦种质,为小麦育种中的亲本选择和抗旱性分子标记利用提供科学依据。
1 材料和方法
1.1 试验材料
48份国外小麦种质分别引自澳大利亚、墨西哥、法国、智利等10多个国家,其中Madsen、Attila、Pavon、Pastor、Norin61、Salmone、Kanto107、Manital、Opata、Glenlea、RL6077共11份材料,由山东省农业科学院作物研究所资源库提供,其余材料由河南科技学院小麦中心保存并提供。
1.2 萌发期抗旱性鉴定
按照小麦抗旱性鉴定评价技术规范(GB/T 21127—2007)测定小麦种子的相对发芽率(20% PEG-6000溶液培养7 d的小麦种子发芽率与蒸馏水培养7 d的小麦种子发芽率的比值)。根据相对发芽率数值划分抗旱等级,分为极强(相对发芽率≥90.0%)、强(70.0%~89.9%)、中等(50.0%~69.9%)、弱(30.0%~49.9%)、极弱(相对发芽率≤29.9%)5个等级[27]。
1.3 DNA提取和分子标记检测
小麦基因组总DNA采用CTAB法提取,将DNA原液稀释至100 ng/μL质量浓度,置于4 ℃保存备用。
4个抗旱性相关基因 1-feh-w3(CAPs分子标记)、Dreb-B1(AS-PCR)、FerA1(SSR分子标记)和NRX-B1(STS分子标记)的分子标记引物均由上海赛默飞世尔科技有限公司合成,引物信息见表1。PCR扩增体系为20 μL,包含2×Taq Master Mix 10 μL(北京康为世纪生物有限公司)、10 μmol/L正反向引物各0.6 μL、100 ng/μL DNA模板1 μL、ddH2O 7.8 μL。PCR反应扩增程序为:95 ℃预变性4 min;94 ℃变性40 s,52~58 ℃退火40 s,72 ℃延伸1 min,32~35个循环;最后72 ℃延伸5 min。
表1 4个分子标记的引物信息
Tab.1 Primer information of 4 molecular markers

基因位点Gene loci引物Primer引物序列(5′-3′)Primer sequence退火温度/℃Tm等位变异片段/bpType of alleles (Fragments size)1-feh-w36BPF2CTCCGCATCTCACCACAGATC58Westonia type (102)6B60RTTGGCTCATGGAGTCATGGGTCKauz type (116)Dreb-B1P40ATATGGATTGCCTTGATGCA56TaDreb-B1a(616、x)P18RTTGTGCTCCTCATGGGTACTTTaDreb-B1b(616)NRX-B1aNaFCATGGCTCTTCCTGTGCG52TaNRX-B1a (841)NRCTGAATCGCTATGGAAAGNRX-B1bNbFTCTCCCGCACTGTGCCTG56TaNRX-B1b (870)NRCTGAATCGCTATGGAAAGFerA1FFCAACGAGCAGATCAAGTGAG56TaFer-A1a (167)FRGAAATCATAGCGGAAACAGATaFer-A1b (170)
1-feh-w3基因的CAPs分子标记 PCR扩增产物长度为241 bp,使用限制性内切酶BsoBⅠ对扩增产物进行酶切,15 μL酶切体系包括限制性内切酶BsoBⅠ 0.3 μL、DNA 10 μL、10×NEBuffer 1.5 μL、ddH2O 3.2 μL,然后将酶切产物使用12%非变性聚丙烯酰胺凝胶进行电泳检测。Dreb-B1基因的分子标记根据基因770 bp处的 SNP设计等位基因特异性PCR(AS-PCR)引物,NRX-B1基因的分子标记为显性互补STS标记,它们的扩增产物使用1.5%琼脂糖凝胶进行电泳检测,然后用凝胶成像系统拍照保存。FerA1基因的分子标记为 SSR分子标记,扩增产物用12%非变性聚丙烯酰胺凝胶进行电泳检测,银染后分析结果。
1.4 统计分析
使用软件Excel 2016、SPSS 25.0进行数据统计分析。参考张海萍等[28]的方法,对含有该等位基因的品种赋值为“1”,不含该等位基因的品种赋值为“0”,采用SPSS 25.0进行分子标记单倍型与相对发芽率的相关性分析,利用Spearman相关分析模型评估每个等位基因与相对发芽率的相关显著性。
2 结果与分析
2.1 48份小麦外引种质的种子相对发芽率
相对发芽率测定结果显示,48份小麦外引种质材料相对发芽率为34.9%~94.5%,平均相对发芽率为70.0%(表2),种质材料的相对发芽率间存在明显差异。其中,抗旱性等级达极强、强、中等、弱和极弱的种质材料分别为3,22,16,7,0份,占到供试材料的6.3%,45.8%,33.3%,14.6%和0;中等及以上抗旱等级的种质材料占85.4%;其中,种质墨S139、CL0442、Salmone的相对发芽率分别为94.5%,93.8%,93.0%,达极强抗旱等级(表2)。
表2 48份外引种质中抗旱基因单倍型类型及相对发芽率
Tab.2 Haplotypes and relative germination rate of drought resistant genes in 48 introduced germplasms

材料名称 Cultivars (lines) 相对发芽率/%Relative germination rate1-feh-w3等位变异类型Type of allelic variance tested with1-feh-w3Dreb-B1等位变异类型Type of allelic variance tested with Dreb-B1FerA1等位变异类型Type of allelic variance tested with FerA1NRX-B1等位变异类型Type of allelic variance tested with NRX-B1萨尔斯堡 Salzburga62.9Westonia typeTaDreb-B1bHTaNRX-B1aBrennanb72.2Westonia typeTaDreb-B1aHTaNRX-B1aKPL-1b82.3Westonia typeTaDreb-B1aHNullKPL-4b89.9Westonia typeTaDreb-B1aHTaNRX-B1bKPL-5b45.2Westonia typeTaDreb-B1aHTaNRX-B1bKPL-6b80.6Westonia typeTaDreb-B1aHTaNRX-B1aKPL-7b77.6Westonia typeTaDreb-B1aHTaNRX-B1bKPL-11b67.2Westonia typeTaDreb-B1aHTaNRX-B1aRACA17-5b61.1Westonia typeTaDreb-B1aHTaNRX-B1aRudub45.1Westonia typeTaDreb-B1aHTaNRX-B1b阿大学AGT-② Adaxue AGT-②b62.6Westonia typeTaDreb-B1aTaFer-A1bNull澳阿优1号 Aoayou No.1b54.0Kauz typeTaDreb-B1aHTaNRX-B1b鸟麦 Niaomaib81.8Westonia typeTaDreb-B1aHTaNRX-B1b非黑土地24 Feiheitudi 24c36.7Kauz typeTaDreb-B1aHTaNRX-B1b山前麦2号Shanqianmai No.2c65.5Kauz typeTaDreb-B1aHTaNRX-B1aFKd54.1Westonia typeTaDreb-B1bHTaNRX-B1aManitald60.2Westonia typeTaDreb-B1bHTaNRX-B1bbermuded84.9Westonia typeTaDreb-B1bHTaNRX-B1bGlenleae53.4Kauz typeTaDreb-B1bHTaNRX-B1a野猫Yemaoe78.5Kauz typeTaDreb-B1aHTaNRX-B1aJaggar-1f80.7Westonia typeTaDreb-B1aHTaNRX-B1bMadsenf82.5Westonia typeTaDreb-B1aHTaNRX-B1bOK.95571f78.7Kauz typeTaDreb-B1bHTaNRX-B1a荒漠2016 Huangmo 2016f89.9Westonia typeTaDreb-B1aHTaNRX-B1a美国-2 America-2f78.9Kauz typeTaDreb-B1bHTaNRX-B1aAttilag68.0Westonia typeTaDreb-B1bHTaNRX-B1aOpatag76.9Kauz typeTaDreb-B1aHTaNRX-B1aPastorg69.0Kauz typeTaDreb-B1bHTaNRX-B1aPavong69.3Kauz typeTaDreb-B1aHTaNRX-B1aRL6077g64.2Westonia typeTaDreb-B1aHTaNRX-B1a墨S139 Mo S139g94.5Kauz typeTaDreb-B1aHTaNRX-B1b墨特大 Motedag38.6Kauz typeTaDreb-B1bHTaNRX-B1aNSR-5h86.1Westonia typeTaDreb-B1bHTaNRX-B1bKanto107i49.0Westonia typeTaDreb-B1bHTaNRX-B1aNorin61i83.4Westonia typeTaDreb-B1bHTaNRX-B1aCiavaj85.7Westonia typeTaDreb-B1bHTaNRX-B1bSalmonej93.0Westonia typeTaDreb-B1aHTaNRX-B1a爱丁堡B Edinburgh Bk84.6Westonia typeTaDreb-B1aHTaNRX-B1b09智引1号 09Zhiyin No.1l56.2Kauz typeTaDreb-B1bHTaNRX-B1a09智引2号09Zhiyin No.2l56.6Kauz typeTaDreb-B1bHNull09智引3号 09Zhiyin No.3l34.9Westonia typeTaDreb-B1aTaFer-A1bNull
表2(续)
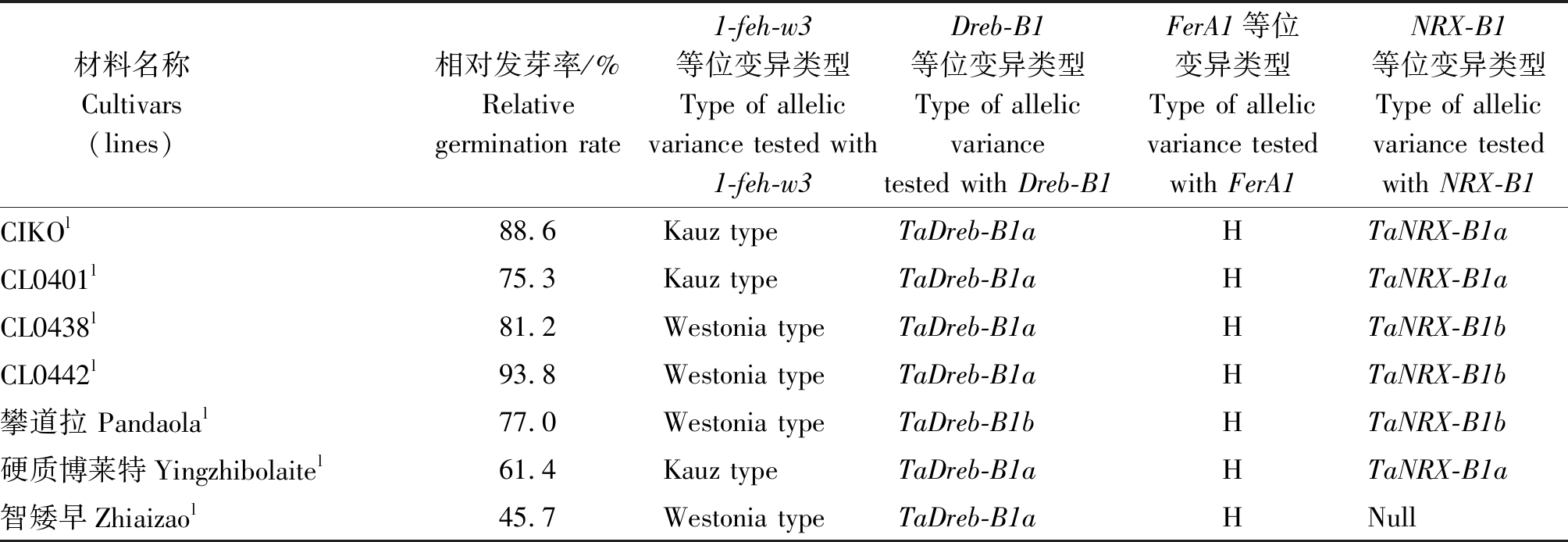
材料名称 Cultivars (lines) 相对发芽率/%Relative germination rate1-feh-w3等位变异类型Type of allelic variance tested with1-feh-w3Dreb-B1等位变异类型Type of allelic variance tested with Dreb-B1FerA1等位变异类型Type of allelic variance tested with FerA1NRX-B1等位变异类型Type of allelic variance tested with NRX-B1CIKOl88.6Kauz typeTaDreb-B1aHTaNRX-B1aCL0401l75.3Kauz typeTaDreb-B1aHTaNRX-B1aCL0438l81.2Westonia typeTaDreb-B1aHTaNRX-B1bCL0442l93.8Westonia typeTaDreb-B1aHTaNRX-B1b攀道拉 Pandaolal77.0Westonia typeTaDreb-B1bHTaNRX-B1b硬质博莱特Yingzhibolaitel61.4Kauz typeTaDreb-B1aHTaNRX-B1a智矮早Zhiaizaol45.7Westonia typeTaDreb-B1aHNull
注:a.小麦材料来源于奥地利;b.小麦材料来源于澳大利亚;c.小麦材料来源于俄罗斯;d.小麦材料来源于法国;e.小麦材料来源于加拿大;f.小麦材料来源于美国;g.小麦材料来源于墨西哥;h.小麦材料来源于南斯拉夫;i.小麦材料来源于日本;j.小麦材料来源于意大利;k.小麦材料来源于英国;l.小麦材料来源于智利;H.杂合基因型;Null.未检测到目标条带。
Note:a.Wheat material is from Austria;b.Wheat material is from Australia;c.Wheat material is from Russia;d.Wheat material is from France;e.Wheat material is from Canada;f.Wheat material is from America;g.Wheat material is from Mexico;h.Wheat material is from Yugoslavia;i.Wheat material from Japan;j.Wheat material from Italy;k.Wheat material from England;l.Wheat material from Chile;H.Heterozygous genotype;Null.No target band is detected.
2.2 1-feh-w3基因的分子标记检测
利用1-feh-w3基因的CAPs分子标记(引物6BPF2、6B60R)对48份外引小麦种质进行检测,扩增产物长为241 bp,再经限制性内切酶BsoBⅠ酶切,切出102 bp条带的为Westonia type,切出116 bp条带的为Kauz type。结果显示,31份小麦种质酶切切出102 bp特异性条带,为高千粒质量抗旱型Westonia type,占64.6%,其余17份小麦种质酶切切出116 bp特异性条带,为低千粒质量抗旱型Kauz type,占35.4%(图1、表2)。
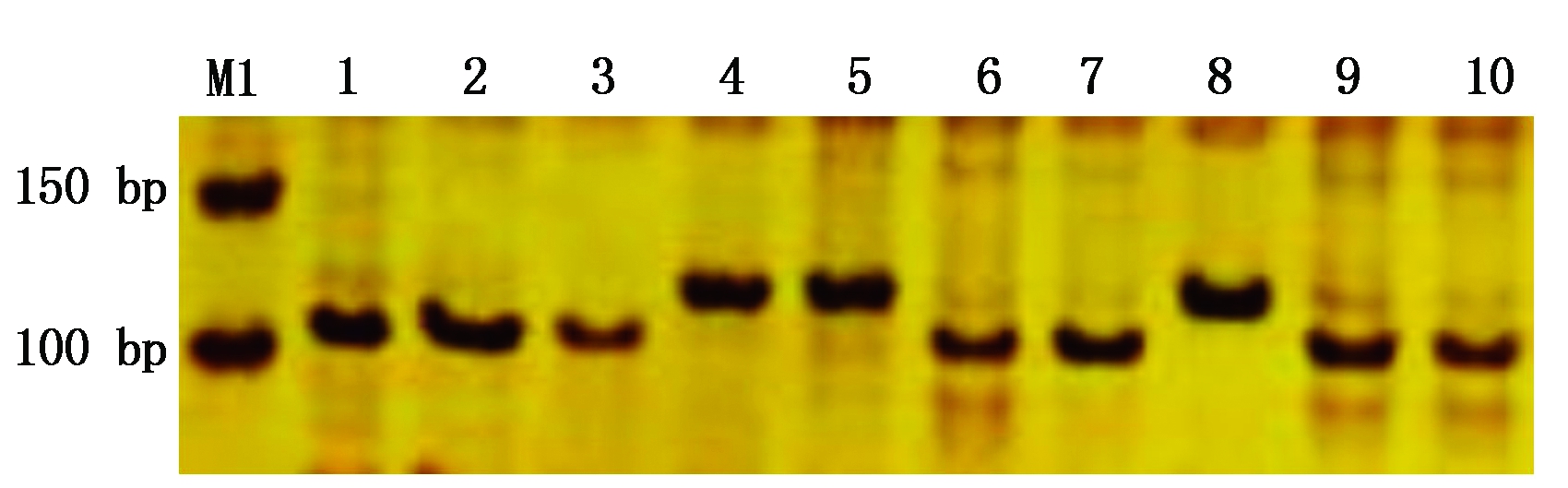
M1.50 bp DNA Ladder;1.鸟麦;2.攀道拉;3.智矮早;4.硬质博莱特;5.CL0401;6.CL0438;7.CL0442;8.09智引1号;9.Kanto 107;10.Manital。
M1. 50 bp DNA Ladder;1.Niaomai;2.Pandaola;3. Zhiaizao;4.Yingzhibolaite;5.CL0401;6.CL0438;7.CL0442;8.09Zhiyin No.1;9.Kanto107;10.Manital.
图1 标记1-feh-w3对部分外引种质的检测结果
Fig.1 Detection results of some introduced germplasms by 1-feh-w3 marker
2.3 Dreb-B1基因的分子标记检测
利用Dreb-B1基因序列770 bp处的SNP设计AS-PCR引物(P40、P18R),对48份外引种质进行检测,其中扩增产物有2条带(1条为616 bp,1条小于616 bp)的为抗旱型TaDreb-B1a,扩增产物只有1条616 bp特异性条带的为干旱敏感型TaDreb-B1b。结果显示,17份小麦种质扩增出1条616 bp特异性条带,为干旱敏感型TaDreb-B1b,占35.4%,其余31份小麦种质扩增出2条特异性条带,为抗旱型TaDreb-B1a,占64.6%(图2、表2)。
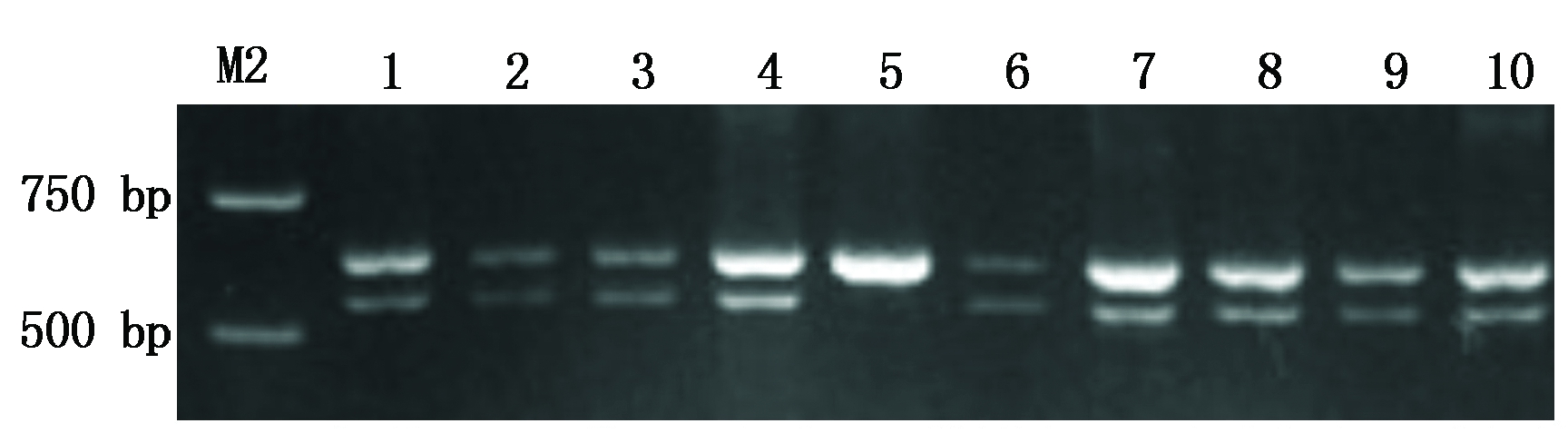
M2.DNA Marker DL2000;1.澳阿优1号;2.KPL-1;3.阿大学AGT-②;4.鸟麦;5.攀道拉;6.智矮早;7.硬质博莱特;8.CL0401;9.CL0438;10.CL0442。
M2. DNA Marker DL2000;1.Aoayou No.1;2.KPL-1;3.Adaxue AGT-②;4.Niaomai;5.Pandaola;6.Zhiaizao;7.Yingzhibolaite;8.CL0401;9.CL0438;10.CL0442.
图2 标记TaDreb-B1对部分外引种质的检测结果
Fig.2 Detection results of some introduced germplasms by TaDreb-B1 marker
2.4 NRX-B1基因的分子标记检测
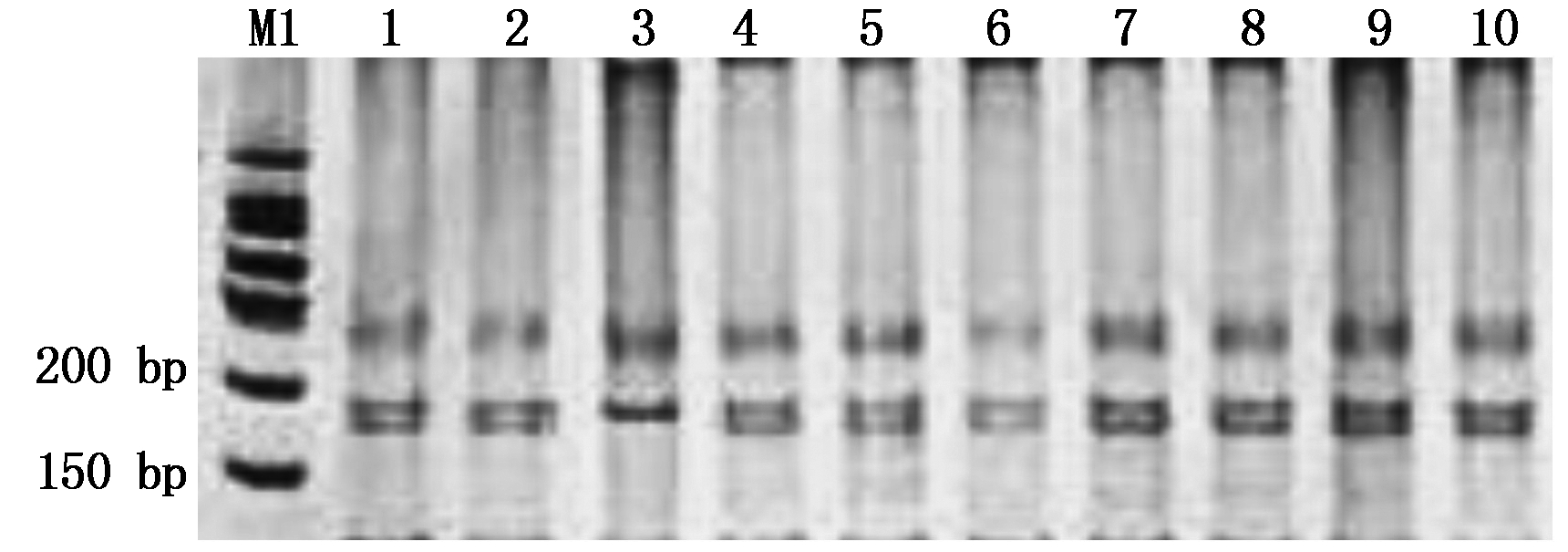
利用NRX-B1基因显性互补STS标记对48份外引种质进行检测,在25份小麦种质中扩增出抗旱型TaNRX-B1a单倍型的841 bp特异性条带,占52.1%;在18份小麦种质中扩增出干旱敏感型TaNRX-B1b单倍型的870 bp特异性条带,占37.5%;48份外引种质中有5份小麦种质没有扩增出条带,占10.4%(图3、表2)。
2.5 FerA1基因的分子标记检测
利用FerA1基因的共显性STS标记对48份外引小麦种质进行检测,结果显示,有2份小麦种质扩增出170 bp特异性条带,为干旱敏感型TaFer-A1b单倍型,占4.2%;其余46份小麦种质均同时扩增出167,170 bp 2条带,为FerA1基因杂合型位点,占95.8%(图4、表2)。
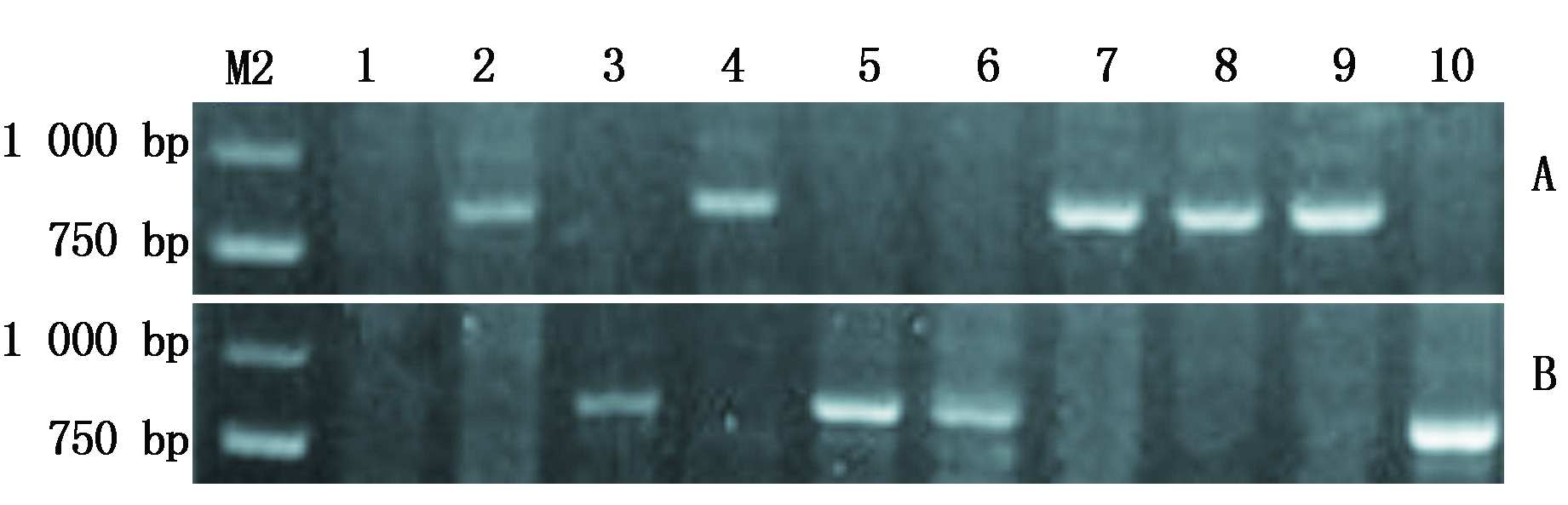
A. TaNRX-B1a单倍型的检测结果;B.TaNRX-B1b单倍型的检测结果;M2.DNA Marker DL2000;1.09智引3号;2.墨特大;3.墨S139;4.萨尔斯堡;5.爱丁堡B;6.非黑土地24;7.OK.95571;8.美国-2;9.野猫;10.NSR-5。
A.Detection results of TaNRX-B1a haplotype;B.Detection results of TaNRX-B1b haplotype;M2.DNA Marker DL2000;1.09Zhiyin No.3;2.Moteda;3.Mo S139;4.Salzburg;5.Edinburgh B;6.Feiheitudi 24;7.OK.95571;8.America-2;9.Yemao;10.NSR-5.
图3 标记TaNRX-B1对部分外引种质的检测结果
Fig.3 Detection results of some introduced germplasms by TaNRX-B1 marker
M1.50 bp DNA Ladder;1.澳阿优1号;2.KPL-1;3.阿大学AGT-②;4.鸟麦;5.攀道拉;6.智矮早;7.硬质博莱特;8.CL0401;9.CL0438;10.CL0442。
M1.50 bp DNA Ladder;1.Aoayou No.1;2.KPL-1;3.Adaxue AGT-②;4.Niaomai;5.Pandaola;6.Zhiaizao;7.Yingzhibolaite;8.CL0401;9.CL0438;10.CL0442.
图4 标记FerA1-intrl对部分外引种质的检测结果
Fig.4 Detection results of some introduced germplasms by FerA1-intrl marker
2.6 基因单倍型与相对发芽率的关系及相关性分析
本研究中,每个抗旱相关基因均包含2种单倍型,就单个基因2种单倍型的平均相对发芽率来看,1-feh-w3基因的Westonia type 单倍型与Kauz type单倍型没有显著差异;Dreb-B1基因和FerA1基因各自的2种单倍型间差异均达显著水平;NRX-B1基因的TaNRX-B1b单倍型平均相对发芽率略高于TaNRX-B1a,但差异不显著(表3)。其中,TaDreb-B1a单倍型的平均相对发芽率最高,为72.75%,TaFer-A1(H)单倍型平均相对发芽率次之,为70.94%。
4个抗旱性基因单倍型与平均相对发芽率的相关性分析结果显示,1-feh-w3基因的单倍型Westonia type和Kauz type,NRX-B1基因的单倍型TaNRX-B1a和TaNRX-B1b与相对发芽率相关性不显著;Dreb-B1基因的TaDreb-B1a单倍型与相对发芽率呈显著正相关,TaDreb-B1b单倍型与相对发芽率呈显著负相关;FerA1基因的TaFer-A1(H)单倍型与相对发芽率呈显著正相关,TaFer-A1b单倍型与相对发芽率呈显著负相关(表3)。
在外引种质材料中,4个基因共有10种单倍型组合类型(表4),单倍型组合Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b占总数比例最高,为20.8%,达强抗旱性等级,Kauz type/TaDreb-B1b/TaFer-A1(H)的比例最低,为2.1%,达中等抗旱性等级。平均相对发芽率最高的单倍型组合是Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a,达77.35%,其次Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b,为75.82%,Kauz type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a,为75.39%,以上单倍型组合均达到强抗旱性等级;平均相对发芽率最低的单倍型组合是Westonia type/TaDreb-B1a/TaFer-A1b,为48.16%,且未检测到TaNRX-B1基因的单倍型,为弱抗旱性等级。Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a、Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b、Kauz type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a单倍型组合类型中,中等及以上抗旱性等级种质材料分别占该组合类型的100.0%,90.0%,100.0%(表4)。
表3 不同基因单倍型对种子相对发芽率的影响及相关性分析
Tab.3 Performance of seed relative germination rate of different haplotypes and correlation analysis
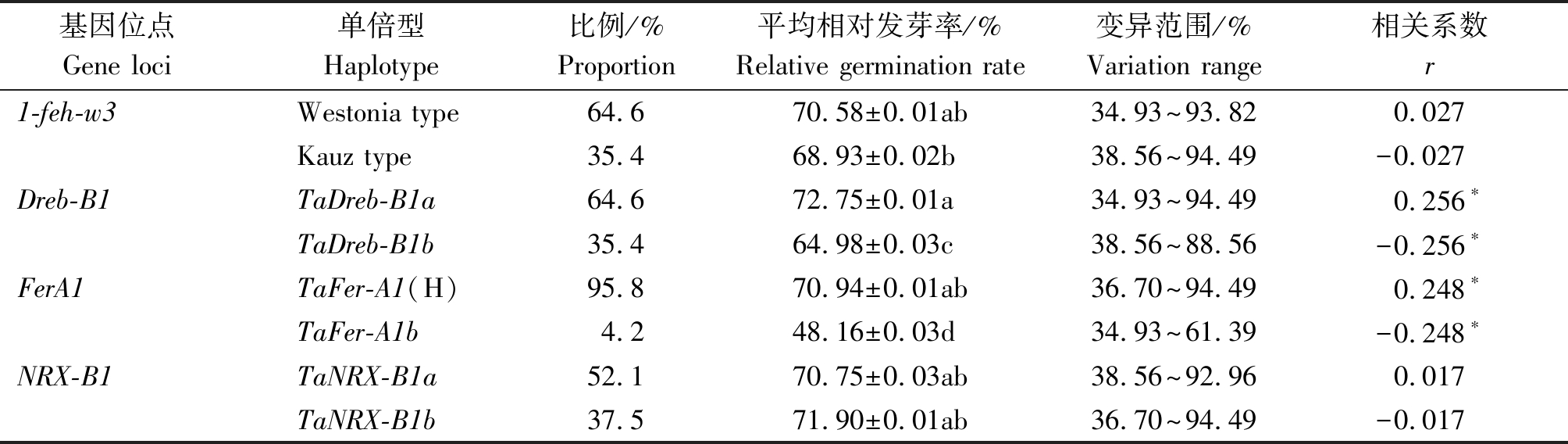
基因位点Gene loci单倍型Haplotype 比例/%Proportion平均相对发芽率/%Relative germination rate变异范围/%Variation range相关系数r1-feh-w3Westonia type64.670.58±0.01ab34.93~93.820.027Kauz type35.468.93±0.02b38.56~94.49-0.027Dreb-B1TaDreb-B1a64.672.75±0.01a34.93~94.490.256∗TaDreb-B1b35.464.98±0.03c38.56~88.56-0.256∗FerA1TaFer-A1(H)95.870.94±0.01ab36.70~94.490.248∗TaFer-A1b4.248.16±0.03d34.93~61.39-0.248∗NRX-B1TaNRX-B1a52.170.75±0.03ab38.56~92.960.017TaNRX-B1b37.571.90±0.01ab36.70~94.49-0.017
注:不同小写字母表示含有不同单倍型的种质平均相对发芽率在0.05水平差异显著;*.在0.05水平上显著相关。表4同。
Note:Different lowercase letters indicate that different haplotypes have significant difference at 0.05 level;*.Significant correlation at 0.05 level.The same as Tab.4.
表4 不同单倍型组合对种子相对发芽率的影响
Tab.4 Performance of seed relative germination rate of different haplotype combinations %
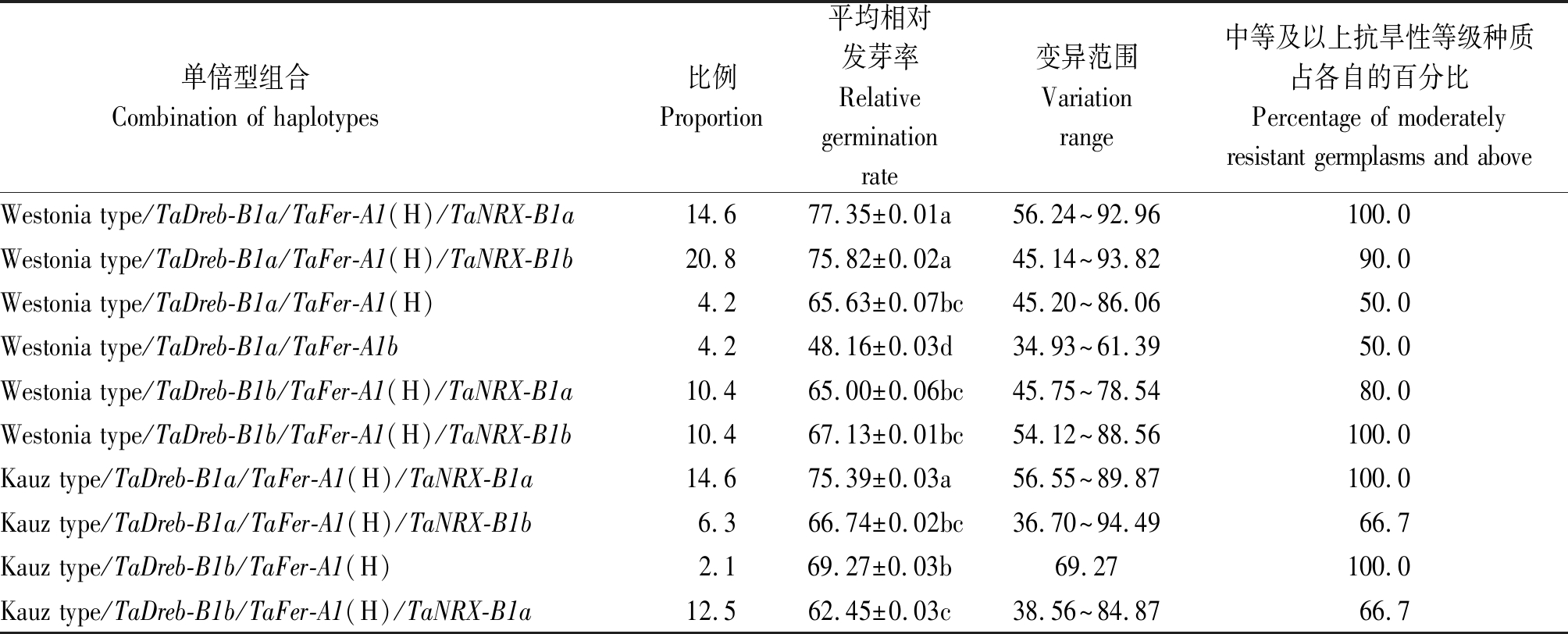
单倍型组合 Combination of haplotypes 比例Proportion平均相对发芽率Relative germination rate变异范围Variation range中等及以上抗旱性等级种质占各自的百分比Percentage of moderately resistant germplasms and aboveWestonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a14.677.35±0.01a56.24~92.96100.0Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b20.875.82±0.02a45.14~93.8290.0Westonia type/TaDreb-B1a/TaFer-A1(H)4.265.63±0.07bc45.20~86.0650.0Westonia type/TaDreb-B1a/TaFer-A1b4.248.16±0.03d34.93~61.3950.0Westonia type/TaDreb-B1b/TaFer-A1(H)/TaNRX-B1a10.465.00±0.06bc45.75~78.5480.0Westonia type/TaDreb-B1b/TaFer-A1(H)/TaNRX-B1b10.467.13±0.01bc54.12~88.56100.0Kauz type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a14.675.39±0.03a56.55~89.87100.0Kauz type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b6.366.74±0.02bc36.70~94.4966.7Kauz type/TaDreb-B1b/TaFer-A1(H)2.169.27±0.03b69.27100.0Kauz type/TaDreb-B1b/TaFer-A1(H)/TaNRX-B1a12.562.45±0.03c38.56~84.8766.7
3 结论与讨论
相对发芽率与抗旱指数呈极显著正相关关系,能在一定程度上反映小麦全生育期的抗旱性,是评估小麦抗旱性的重要指标[29]。虽然对于小麦抗旱相关基因位点的研究取得了较多进展,但相关抗旱性分子标记在小麦育种中的应用还较为有限[30]。张帆等[12]利用开发的TaNRX-B1基因抗旱性分子标记对150份小麦品种(系)进行检测,平均相对发芽率达到中等及以上抗旱性等级品种(系)占70.0%,TaNRX-B1a单倍型的平均相对发芽率显著高于TaNRX-B1b单倍型。刘芳军等[13]利用TaFer-A1和TaNRX-B1基因的抗旱性分子标记 对117份宁夏小麦品种(系)进行检测,并鉴定了种子萌发期的相对发芽率,结果显示,宁夏小麦种子萌发期平均相对发芽率达到73.3%,中等及以上抗旱性等级品种(系)占75.2%;TaFer-A1 和TaNRX-B1基因的分子标记检测结果与平均相对发芽率表型一致性较好,可以用于小麦抗旱性的鉴定和筛选。孙晓燕等[14]利用TaFer-A1 和TaNRX-B1基因的抗旱性分子标记对137份内蒙古春小麦育种材料进行检测,有58份材料属于抗旱基因型。本研究中,48份外引小麦种质的平均相对发芽率达到70.0%,而中等及以上抗旱性等级的种质材料占到85.4%,明显超过以上国内研究中的抗旱小麦种质的比例。可能的原因是,一直以来从不同地区引进的小麦种质资源对改良国内小麦的产量性状、品质性状和抗逆性等起到了重要作用[31],一般都具有优良的农艺性状,经过优选引入国内,总体上来说平均抗旱水平相对高出一些。
本研究中,TaDreb-B1a单倍型的平均相对发芽率最高,为72.75%,TaFer-A1(H)单倍型平均相对发芽率为70.94%,两者均与平均相对发芽率表型呈显著正相关关系,且TaDreb-B1a单倍型与TaDreb-B1b单倍型,TaFer-A1(H)单倍型与TaFer-A1b单倍型的平均相对发芽率差异均达到显著水平,说明Dreb-B1和FerA1基因的抗旱性分子标记可用于小麦抗旱性的鉴定和筛选。而1-feh-w3和NRX-B1基因的抗旱性分子标记与供试材料的平均相对发芽率相关并不显著。1-feh-w3基因的Westonia type单倍型与Kauz type单倍型,NRX-B1基因的TaNRX-B1a单倍型与TaNRX-B1b单倍型间平均相对发芽率差异均不显著。分析认为,1-feh-w3基因的单倍型Westonia type与Kauz type的抗旱性表型差异研究是基于小麦品种Westonia和Kauz为亲本创制的DH系,在其他小麦品种(系)中的验证研究还未见报道,在本研究中的检测效果并不理想。NRX-B1基因的单倍型TaNRX-B1a与TaNRX-B1b在前人研究中具有显著差异,对小麦抗旱性检测是有效的[13-14],但并未进行相关性分析,基因效应大小也不明确,而在本研究中显示检测效果并不理想,还有待进一步验证。
10种单倍型组合的平均相对发芽率值大小与各基因抗旱性单倍型累加结果基本一致。平均相对发芽率以单倍型组合Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a最高,Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b次之,Kauz type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1a稍低于Westonia type/TaDreb-B1a/TaFer-A1(H)/TaNRX-B1b。除此之外,单倍型组合Westonia type/TaDreb-B1b/TaFer-A1(H)/TaNRX-B1a的平均相对发芽率低于Westonia type/TaDreb-B1b/TaFer-A1(H) /TaNRX-B1b,充分表明NRX-B1基因在本研究中对抗旱性的检测是无效的。小麦抗旱性是由众多基因控制的复杂数量性状,虽然许多抗旱相关基因被克隆出来,但涉及不同代谢通路,抗旱机制十分复杂,而且受环境因素的影响也较大[29],这就需要进一步加强基因功能及其调控研究,并使用更多的小麦品种(系)对相关抗旱性分子标记的有效性进行充分验证。
本研究对48份小麦外引种质材料的相对发芽率进行测定,利用4个分子标记检测所含抗旱性基因单倍型类型,鉴定出一些抗旱种质资源。并首次验证了抗旱性相关基因Dreb-B1分子标记的有效性,初步证明了1-feh-w3基因2种单倍型对抗旱性选择是无效的。研究结果为外引种质的有效利用和抗旱性分子标记辅助选择技术在小麦育种中的应用提供了一些科学依据。
[1] 汪颖.我国小麦抗旱性研究进展[J].园艺与种苗,2011,31(2):95-97.doi:10.3969/j.issn.2095-0896.2011.02.032.
Wang Y. Research progress on drought resistance of wheat in China[J].Horticulture & Seed,2011,31(2):95-97.
[2] Hirschi M,Seneviratne S I,Alexandrov V,Boberg F,Boroneant C,Christensen O B,Formayer H,Orlowsky B,Stepanek P.Observational evidence for soil-moisture impact on hot extremes in southeastern Europe[J].Nature Geoscience,2011,4(1):17-21.doi:10.1038/ngeo1032.
[3] Mueller B,Seneviratne S I.Hot days induced by precipitation deficits at the global scale[J].Proceedings of the National Academy of Sciences,2012,109(31):12398-12403.doi:10.1073/pnas.1204330109.
[4] Araus J L,Slafer G A,Royo C,Serret M D.Breeding for yield potential and stress adaptation in cereals[J]. Critical Reviews in Plant Sciences,2008,27(6):377-412.doi:10.1080/07352680802467736.
[5] Parry M A,Wang J,Araus J L.New technologies,tools and approaches for improving crop breeding[J].Journal of Integrative Plant Biology,2012,54(4):210-214.doi:10.1111/j.1744-7909.2012.01114.x.
[6] 赵燕昊,曹跃芬,孙威怡,戎均康.小麦抗旱研究进展[J].植物生理学报,2016,52(12):1795-1803. doi:10.13592/j.cnki.ppj.2016.0299.
Zhao Y H,Cao Y F,Sun W Y,Rong J K.The research advances in drought resistance in wheat[J].Plant Physiology Journal,2016,52(12):1795-1803.
[7] 周志钦.植物铁结合蛋白基因研究现状[J].生物技术,2001,11(3):29-33.doi:10.3969/j.issn.1004-311X.2001.03.012.
Zhou Z Q.Studies of the ferritin gene in plants[J].Biotechnology,2001,11(3):29-33.
[8] 鞠丽萍,张帆,蒋雷,金秀锋,王轩,付晓洁,张晓科,刘书慧,王宏礼.小麦TaFer-A1基因抗旱相关分子标记的开发[J].麦类作物学报,2013,33(5):901-906.doi:10.7606/j.issn.1009-1041.2013.05.009.
Ju L P,Zhang F,Jiang L,Jin X F,Wang X,Fu X J,Zhang X K,Liu S H,Wang H L.Development of a specific molecular marker of TaFer-A1 for improving drought resistance in wheat[J].Journal of Triticeae Crops,2013,33(5):901-906.
[9] Arnér E S,Holmgren A.Physiological functions of thioredoxin and thioredoxin reductase[J].European Journal of Biochemistry,2000,267(20):6102-6109.doi:10.1046/j.1432-1327.2000.01701.x.
[10] Yano H.Ongoing applicative studies of plant thioredoxins[J].Molecular Plant,2014,7(1):4-13. doi:10.1093/mp/sst124.
[11] Shi B B,Zhao X B,Li M,Dong Z H,Yang Q C,Wang Y,Gao H F,Day B,Ma Q. Wheat thioredoxin (TaTrxh1) associates with RD19-like cysteine protease TaCP1 to defend against stripe rust fungus through modulation of programmed cell death[J]. Molecular Plant-Microbe Interactions,2021,34(4):426-438. doi:10.1094/mpmi-11-20-0304-r.
[12] 张帆,蒋雷,鞠丽萍,金秀锋,王轩,张晓科,王宏礼,付晓洁.一个普通小麦Trx超家族新基因TaNrx的克隆与抗旱相关标记开发[J].作物学报,2014,40(1):29-36.doi:10.7606/j.issn.1009-1041.2015.11.07.
Zhang F,Jiang L,Ju L P,Jin X F,Wang X,Zhang X K,Wang H L,Fu X J.Cloning a novel gene TaNRX of Trx superfamily and developing its molecular markers related to drought resistance in common wheat[J].Acta Agronomica Sinica,2014,40(1):29-36.
[13] 刘芳军,王宪国,桂安胜,杨杰,白升升,马棫灵,张晓科,陈东升.宁夏小麦TaNrx-B1和TaFer-A1基因组成及其与相对发芽率的关系[J].麦类作物学报,2015,35(11):1506-1511.doi:10.7606/j.issn.1009-1041.2015.11.07.
Liu F J,Wang X G,Gui A S,Yang J,Bai S S,Ma Y L,Zhang X K,Chen D S.Composition of TaNrx-B1 and TaFer-A1 genes and the association with relative germination rate of Ningxia wheat[J].Journal of Triticeae Crops,2015,35(11):1506-1511.
[14] 孙晓燕,魏旭,赵春芝,杨燕.春小麦育种材料抗旱性和穗发芽抗性分子标记鉴定[J].麦类作物学报,2016,36(1):36-43.doi:10.7606/j.issn.1009-1041.2016.01.05.
Sun X Y,Wei X,Zhao C Z,Yang Y.Identification of drought and PHS tolerance with molecular markers in spring wheats [J].Journal of Triticeae Crops,2016,36(1):36-43.
[15] Winzeler M,Dubois D,Nösberger J.Absence of fructan degradation during fructan accumulation in wheat stems[J].Journal of Plant Physiology,1990,136(3):324-329.doi:10.1016/S0176-1617(11)80057-X.
[16] Wardlaw I F,Willenbrink J.Mobilization of fructan reserves and changes in enzyme activities in wheat stems correlate with water stress during kernel filling[J].New Phytologist,2000,148(3):413-422.doi:10.1046/j.1469-8137.2000.00777.x.
[17] Aggarwal P K,Sinha S K.Effect of water stress on grain growth and assimilate partitioning in two cultivars of wheat contrasting in their yield stability in a drought-environment[J].Annals of Botany,1984,53(3):329-340. doi:10.1093/oxfordjournals.aob.a086697.
[18] Ruuska S A,Rebetzke G J,van Herwaarden A F,Richards R A,Fettell N A,Tabe L,Jenkins C L D.Genotypic variation in water-soluble carbohydrate accumulation in wheat[J].Functional Plant Biology,2006,33(9):799-809. doi:10.1071/fp06062.
[19] Zhang J J,Huang S,Fosu-Nyarko J,Dell B,McNeil M,Waters I,Moolhuijzen P,Conocono E,Appels R.The genome structure of the 1-FEH genes in wheat (Triticum aestivum L.):new markers to track stem carbohydrates and grain filling QTLs in breeding[J].Molecular Breeding,2008,22(3):339-351.doi:10.1007/s11032-008-9179-1.
[20] Zhang J J,Xu Y J,Chen W,Dell B,Vergauwen R,Biddulph B,Khan N,Luo H,Appels R,Vanden Ende W.A wheat 1-FEH w3 variant underlies enzyme activity for stem WSC remobilization to grain under drought[J].The New Phytologist,2015,205(1):293-305.doi:10.1111/nph.13030.
[21] Liu Q,Kasuga M,Sakuma Y,Abe H,Miura S,Yamaguchi-Shinozaki K,Shinozaki K.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,in Arabidopsis[J].The Plant Cell,1998,10(8):1391-1406.doi:10.1105/tpc.10.8.1391.
[22] 雷梦林,毛新国,昌小平,刘霞,景蕊莲.小麦TaDREB1的功能标记作图和表达特性分析[J].农业生物技术学报,2019,27(2):229-236.doi:10.3969/j.issn.1674-7968.2019.02.005.
Lei M L,Mao X G,Chang X P,Liu X,Jing R L.Functional marker mapping and expression characteristics analysis of gene TaDREB1 in wheat (Triticum aestivum L.)[J].Journal of Agricultural Biotechnology,2019,27(2):229-236.
[23] 王计平,毛新国,李润植,景蕊莲.小麦钙网蛋白基因TaCRT-A多态性及其定位[J].应用生态学报,2012,23(9):2536-2542.doi:10.13287/j.1001-9332.2012.0351.
Wang J P,Mao X G,Li R Z,Jing R L.Sequence polymorphism and mapping of wheat Ca2+-binding protein TaCRT-A gene[J].Chinese Journal of Applied Ecology,2012,23(9):2536-2542.
[24] Wei B,Jing R L,Wang C S,Chen J B,Mao X G,Chang X P,Jia J Z.Dreb1 genes in wheat (Triticum aestivum L.):development of functional markers and gene mapping based on SNPs [J].Molecular Breeding,2009,23(1):13-22.doi:10.1007/s11032-008-9209-z.
[25] 徐建文,居辉,梅旭荣,刘勤,杨建莹.近30年黄淮海平原干旱对冬小麦产量的潜在影响模拟[J].农业工程学报,2015,31(6):150-158.doi:10.3969/j.issn.1002-6819.2015.06.021.
Xu J W,Ju H,Mei X R,Liu Q,Yang J Y.Simulation on potential effects of drought on winter wheat in Huang-Huai-Hai Plain from 1981 to 2010[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(6):150-158.
[26] 黎世民,张红利,王来刚,郑国清,郭燕,高建华.基于格网和模糊聚类的河南省冬小麦气象干旱风险区划与分析[J].河南农业科学,2020,49(11):172-180.doi:10.15933/j.cnki.1004-3268.2020.11.023.
Li S M,Zhang H L,Wang L G,Zheng G Q,Guo Y,Gao J H.Winter wheat agrometeorological drought zoning and analysis in Henan Province based on grid and fuzzy clustering algorithm[J].Journal of Henan Agricultural Sciences,2020,49(11):172-180.
[27] 冀天会,张灿军,谢惠民,杨子光,郭军伟,孟丽梅,马雯.小麦品种抗旱性鉴定产量指标的比较研究[J].中国农学通报,2006,22(1):103-106.doi:10.3969/j.issn.1000-6850.2006.01.027.
Ji T H,Zhang C J,Xie H M,Yang Z G,Guo J W,Meng L M,Ma W.A comparative study on yield index of wheat varieties drought resistance[J].Chinese Agricultural Science Bulletin,2006,22(1):103-106.
[28] 张海萍,常成,游光霞,张秀英,闫长生,肖世和,司红起,卢杰,马传喜.中国小麦微核心种质及地方品种籽粒休眠特性的分子标记鉴定[J].作物学报,2010,36(10):1649-1656.doi:10.3724/SP.J.1006.2010.01649.
Zhang H P,Chang C,You G X,Zhang X Y,Yan C S,Xiao S H,Si H Q,Lu J,Ma C X.Identification of molecular markers associated with seed dormancy in mini core collections of Chinese wheat and landraces[J].Acta Agronomica Sinica,2010,36(10):1649-1656.
[29] 杨子光,张灿军,冀天会,郭军伟,孟丽梅,张珂.小麦抗旱性鉴定方法及评价指标研究V苗期抗旱指标的比较研究[J].中国农学通报,2008,24(1):156-159.
Yang Z G,Zhang C J,Ji T H,Guo J W,Meng L M,Zhang K.Study on resistance drought identify method and evaluation index of wheat V the comparative study on resistance drought index of wheat in seedling[J].Chinese Agricultural Science Bulletin,2008,24(1):156-159.
[30] 刘莉,裴磊,卫云宗.抗旱节水小麦分子遗传育种研究进展[J].分子植物育种,2020,18(1):282-295. doi:10.13271/j.mpb.018.000282.
Liu L,Pei L,Wei Y Z.Research advances in molecular breeding of drought resistance and water saving in wheat[J].Molecular Plant Breeding,2020,18(1):282-295.
[31] 程西永,陈平,许海霞,詹克慧,董中东,王勋,崔党群.不同国家小麦种质资源遗传多样性研究[J].麦类作物学报,2009,29(5):803-808.doi:10.7606/j.issn.1009-1041.2009.05.011.
Cheng X Y,Chen P,Xu H X,Zhan K H,Dong Z D,Wang X,Cui D Q.Genetic diversity of wheat germplasm from different countries[J].Journal of Triticeae Crops,2009,29(5):803-808.