锌指蛋白(Zinc finger protein,ZFP)是植物中最大的转录因子家族之一,在植物生长发育和逆境响应中均起着重要作用。ZFP最早是在非洲爪蟾(Xenopus laevis)的卵母细胞中发现的[1]。锌指蛋白均具有保守的锌指结构域,根据其序列结构和功能的不同,将其分为C8、C6、C4、C2H2、C3H、C3HC4、C2HC、C2HC5和C4HC3 9种类型[2]。近些年研究发现,拟南芥中的CCCH型锌指蛋白HUA1参与了开花过程的调控[3];麻疯树锌指蛋白JcZFP8在烟草中异源表达,发现其可能通过激素信号转导途径间接调控烟草的毛状体发育[4];蓖麻锌指蛋白RcDof参与调控其植株矮化[5];沙冬青C2H2型锌指蛋白基因AmZFP1的转录水平在干旱或者低温胁迫下均明显升高,推测其可能在沙冬青的抗旱和抗寒过程中起重要调节作用[6]。此外,Huang等[7]发现过表达OsZFP245基因的水稻株系中脯氨酸含量升高,活性氧清除能力增强,其耐受低温和干旱胁迫的能力显著提高。可见,锌指蛋白在植物冷响应中发挥了重要作用。
牡丹(Paeonia suffruticosa Andr.)是原产中国的名贵木本花卉[8],观赏价值和经济价值极高。反季节催花是牡丹产业的重要组成部分,其关键问题是解除花芽内休眠[9]。越来越多的证据表明,低温是打破花芽内休眠的有效途径[10]。前期利用抑制消减文库筛选到可能与内休眠解除相关的线粒体磷酸转移子(Mitochondrial phosphate transporter,PsMPT),该基因受低温累积诱导,调控能量代谢,促进休眠解除[11-12];并证明其启动子中的MYC为响应低温的顺式作用元件[13]。最近,通过酵母单杂交筛选到一个可能与MYC序列相互作用的锌指蛋白PsZFP1。本研究克隆了PsZFP1的开放阅读框(ORF)并对其进行了生物信息学、表达特性和转录因子特性分析,构建原核表达载体并转化BL21,最后将表达出的可溶性重组蛋白纯化,旨在为进一步研究PsZFP1参与调控牡丹花芽休眠解除机制提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 试验材料 4~5年生牡丹品种鲁菏红(Paeonia suffruticosa Luhehong)的健壮植株(购自山东菏泽牡丹研究所)。
1.1.2 质粒及菌种 质粒pGBKT7和酵母菌株Y187购自CLONTECH公司;克隆载体质粒pMD18-T购自TaKaRa公司;大肠杆菌DH5α、农杆菌GV3101和质粒pBI121由青岛农业大学植物遗传与发育实验室保存;大肠杆菌BL21和原核表达载体pET28a+由郭宝太教授馈赠。
1.1.3 主要试剂 各种限制性内切酶、T4 DNA连接酶、DNA Marker、Protein Marker、SMARTTM RACE cDNA Amplification Kit (Clontech)、PrimeScript® RT Master Mix (Perfect Real Time)和SYBR®Premix Ex TaqTM (Tli RNase H Plus)均购自大连的TaKaRa公司;RNAprep pure Plant Kit和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;SanPrep柱式质粒小量抽提试剂盒和Ni-NTA重力预装柱购自上海生工生物工程有限公司;化学试剂均为国产分析纯。
1.1.4 材料处理及取样 将4~5 年生牡丹鲁菏红的健壮植株分别在4 ℃冷库中处理0,7,14,21,28 d后,选取健壮顶端花芽,剥去外层鳞片,液氮速冻,-80 ℃保存备用。
1.2 试验方法
1.2.1 RNA的提取和检测 采用RNAprep pure Plant Kit(DP441)提取花芽的总RNA,然后利用1%甲醛变性琼脂糖凝胶电泳和微量ND 1000分光光度计(Thermo)分别对提取的总RNA进行质量和浓度检测。
1.2.2 PsZFP1的全长cDNA扩增及生物信息学分析 设计特异引物PsZFP1-5′(表1)与SMARTTM RACE cDNA Amplification Kit中的自带引物UPM配对使用。以牡丹花芽的总RNA为模板,按照试剂盒说明书进行5′-RACE扩增。将回收的5′-RACE扩增片段连接转化和测序拼接后,得到PsZFP1基因的全长cDNA序列。用EditSeq软件分析PsZFP1序列的开放阅读框序列,用MEGA 6.0软件进行该蛋白的系统进化树分析。
1.2.3 PsZFP1基因ORF的克隆 根据PsZFP1的开放阅读框(Open Reading Frame,ORF)设计带有不同酶切位点的引物(表1),以cDNA为模板,采用EasyTaq® DNA Polymerase(全式金,北京)扩增目的基因。经连接转化、菌落PCR和质粒双酶切鉴定得到阳性克隆,将其送至擎科生物公司测序。获得的PsZFP1基因的ORF用于构建不同载体,进行PsZFP1的亚细胞定位、转录激活分析和原核表达。
1.2.4 PsZFP1的亚细胞定位 将1.2.3中扩增得到的PsZFP1 的ORF(不含终止密码子)构建到pBI121-GFP载体上,获得pBI121-PsZFP1-GFP表达载体。将pBI121-GFP(对照)和pBI121-PsZFP1-GFP分别转化农杆菌,侵染烟草(Nicotiana benthamiana)叶片,暗培养24 h,光照培养72 h后使用激光共聚焦显微镜观察,利用荧光染料DAPI(4,6-diamidino-2-phenylindole)指示细胞核位置。
表1 本研究中所用引物
Tab.1 Primers used in this study
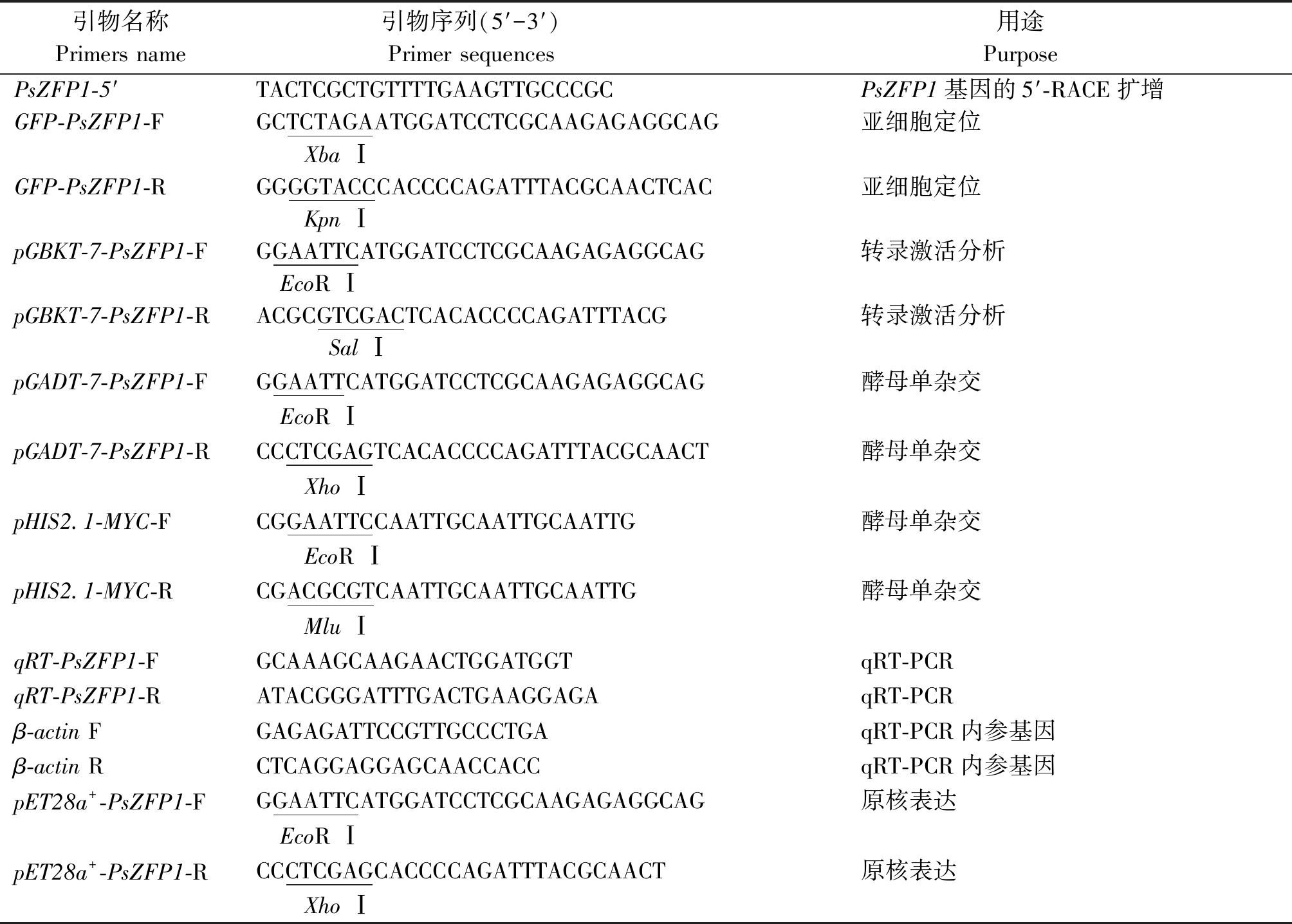
引物名称Primers name引物序列(5′-3′) Primer sequences 用途 Purpose PsZFP1-5′TACTCGCTGTTTTGAAGTTGCCCGCPsZFP1基因的5′-RACE扩增GFP-PsZFP1-FGCTCTAGAATGGATCCTCGCAAGAGAGGCAG亚细胞定位 Xba ⅠGFP-PsZFP1-RGGGGTACCCACCCCAGATTTACGCAACTCAC亚细胞定位 Kpn ⅠpGBKT-7-PsZFP1-FGGAATTCATGGATCCTCGCAAGAGAGGCAG转录激活分析 EcoR ⅠpGBKT-7-PsZFP1-RACGCGTCGACTCACACCCCAGATTTACG转录激活分析 Sal ⅠpGADT-7-PsZFP1-FGGAATTCATGGATCCTCGCAAGAGAGGCAG酵母单杂交 EcoR ⅠpGADT-7-PsZFP1-RCCCTCGAGTCACACCCCAGATTTACGCAACT酵母单杂交 Xho ⅠpHIS2.1-MYC-FCGGAATTCCAATTGCAATTGCAATTG酵母单杂交 EcoR ⅠpHIS2.1-MYC-RCGACGCGTCAATTGCAATTGCAATTG酵母单杂交 Mlu ⅠqRT-PsZFP1-FGCAAAGCAAGAACTGGATGGTqRT-PCRqRT-PsZFP1-RATACGGGATTTGACTGAAGGAGAqRT-PCRβ-actin FGAGAGATTCCGTTGCCCTGAqRT-PCR内参基因β-actin RCTCAGGAGGAGCAACCACCqRT-PCR内参基因pET28a+-PsZFP1-FGGAATTCATGGATCCTCGCAAGAGAGGCAG原核表达 EcoR ⅠpET28a+-PsZFP1-RCCCTCGAGCACCCCAGATTTACGCAACT原核表达 Xho Ⅰ
1.2.5 PsZFP1的转录激活分析 将 PsZFP1 ORF重组到pGBKT7载体上,pGBKT7(对照)和pGBKT7-PsZFP1分别转化酵母菌株Y187,并在SD/-Trp、SD/-Trp/-His/-Ade和含有X-α-gal的SD/-Trp/-His/-Ade培养基上培养3~5 d,观察并拍照。
1.2.6 PsMPT启动子与PsZFP1蛋白互作检测 将PsMPT基因启动子序列中的低温响应元件MYC的三重复序列重组到pHIS2.1载体上,获得pHIS2.1-MYC重组诱饵表达质粒。将PsZFP1 的ORF重组到pGADT7载体上,获得pGADT7-PsZFP1重组质粒。将pHIS2.1-MYC分别与 pGADT7(对照)和pGADT7-PsZFP1共同转化酵母菌株Y187,在SD-Leu/-Trp培养4 d后,挑取单菌落分别溶于200 μL灭菌超纯水中,并分别吸取原液、稀释10,100倍的稀释液各2 μL,按浓度依次点在SD/-His/-Leu/-Trp/50 mmol/L 3-AT培养基上培养3~5 d,观察并拍照。
1.2.7 PsZFP1的表达特性分析 分别以4 ℃处理 0,7,14,21,28 d的牡丹花芽cDNA为模板,采用qRT-PCR技术检测PsZFP1基因在低温解除休眠过程中的转录水平,所用引物见表1,qRT-PCR体系按照SYBR Premix Ex TaqTM Ⅱ(TaKaRa)配制,在Applied Biosystems Quant Studio TM 5(ABI,美国)荧光定量PCR系统上运行。以牡丹的Actin基因为内参,用2-ΔΔCt法进行数据分析。3个生物学重复。
1.2.8 PsZFP1的原核表达及纯化 将PsZFP1 ORF插入到原核表达载体pET28a+,经PCR和酶切鉴定后,将重组质粒pET28a+-PsZFP1转化至菌株BL21。选取阳性克隆至含Kan的 LB液体培养基中培养。提取水溶性蛋白和包涵体,进行 SDS 聚丙烯酰胺凝胶电泳,考马斯亮蓝染色后,再用脱色液脱色至蛋白条带清晰可见。重组蛋白使用Ni-NTA亲和层析技术分离纯化,并利用SDS-PAGE检测。
2 结果与分析
2.1 PsZFP1基因的5′-RACE扩增及生物信息学分析
以牡丹花芽的总RNA为模板,反转录合成cDNA,然后对PsZFP1基因进行5′-RACE扩增,结果如图1所示。测序结果显示,扩增得到的5′-RACE序列为987 bp,与本实验室前期获得的PsZFP1基因的序列进行拼接后,获得PsZFP1基因的全长cDNA序列为1 313 bp,包含5′-UTR序列204 bp,3′-UTR序列194 bp,最大ORF为915 bp,编码304个氨基酸。推测该蛋白的理论分子量约为31.829 ku,等电点(pI)为9.41,推测其分子式为C1379H2159N417O415S19,不稳定系数36.8,为亲水性的稳定蛋白,具有CCCH保守结构域(图2)。用MEGA 6.0软件构建牡丹PsZFP1与其他12个物种ZFP的系统进化树,发现牡丹PsZFP1与葡萄VvZFP的亲缘关系最近(图3)。
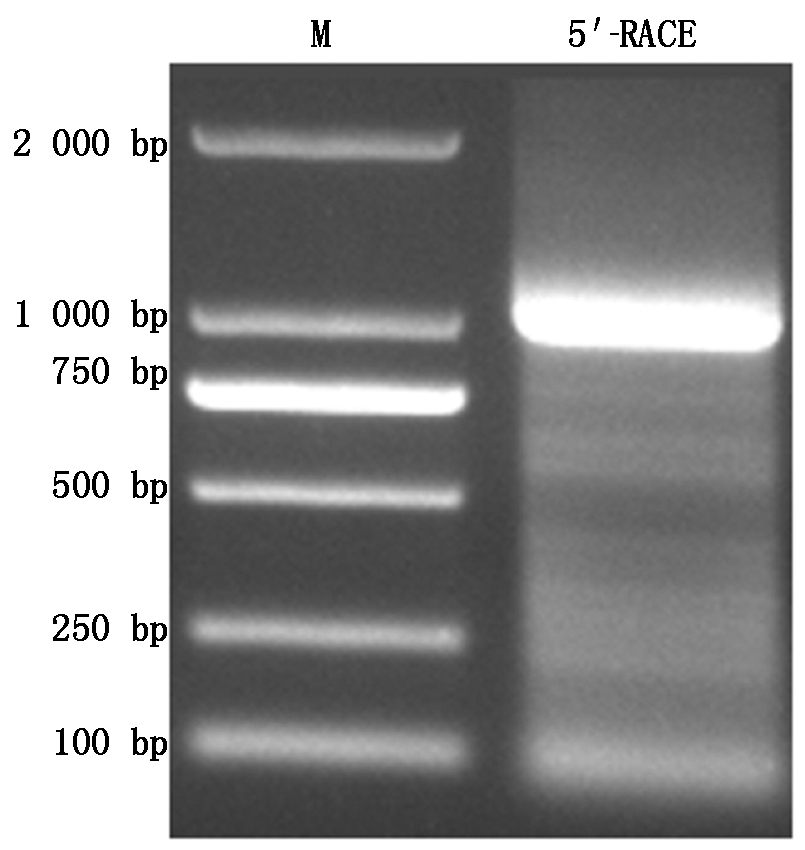
图1 PsZFP1的5′-RACE扩增产物
Fig.1 5′-RACE amplification products of PsZFP1
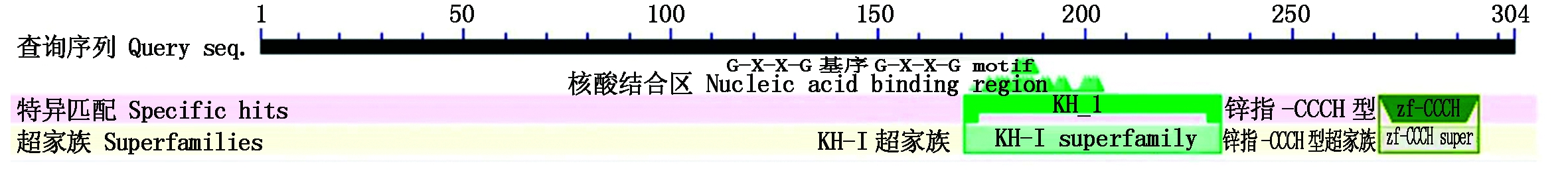
图2 PsZFP1保守结构域预测
Fig.2 Prediction of conserved domain for PsZFP1
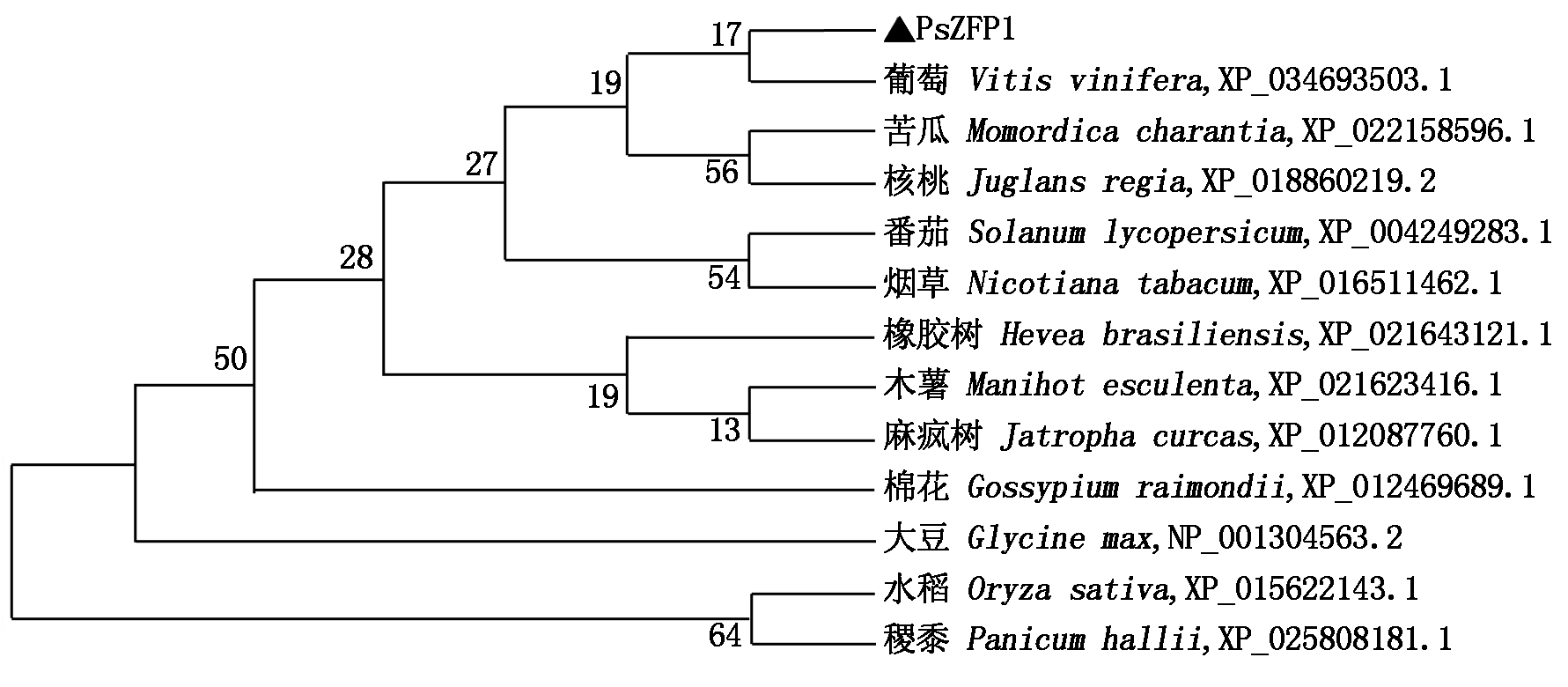
PsZFP1用▲标记。
PsZFP1 was marked with ▲.
图3 牡丹PsZFP1与其他物种ZFP蛋白的系统进化树分析
Fig.3 Phylogenetic tree of Paeonia suffruticosa PsZFP1 and other species ZFPs
2.2 PsZFP1基因的ORF扩增
以牡丹花芽的cDNA为模板,PCR扩增含有不同酶切位点的PsZFP1的ORF序列,得到与预期大小一致的特异条带(图4),用于构建不同载体进行后续试验。
2.3 PsZFP1的亚细胞定位
利用荧光显微镜观察PsZFP1的亚细胞定位,发现其定位于细胞核中(图5)。
2.4 PsZFP1的转录激活分析
如图6所示,含有pGBKT7的酵母菌株Y187(对照菌)可以在SD/-Trp培养基上生长,但在SD/-Trp/-His/-Ade和含有X-α-gal的SD/-Trp/-His/-Ade培养基上均无法生长。而含有pGBKT7-PsZFP1的酵母菌株Y187(重组菌)在3种培养基上均可生长,且在含有X-α-gal的SD/-Trp/-His/-Ade培养基上生长的菌落显蓝色,这表明PsZFP1具有转录激活活性。
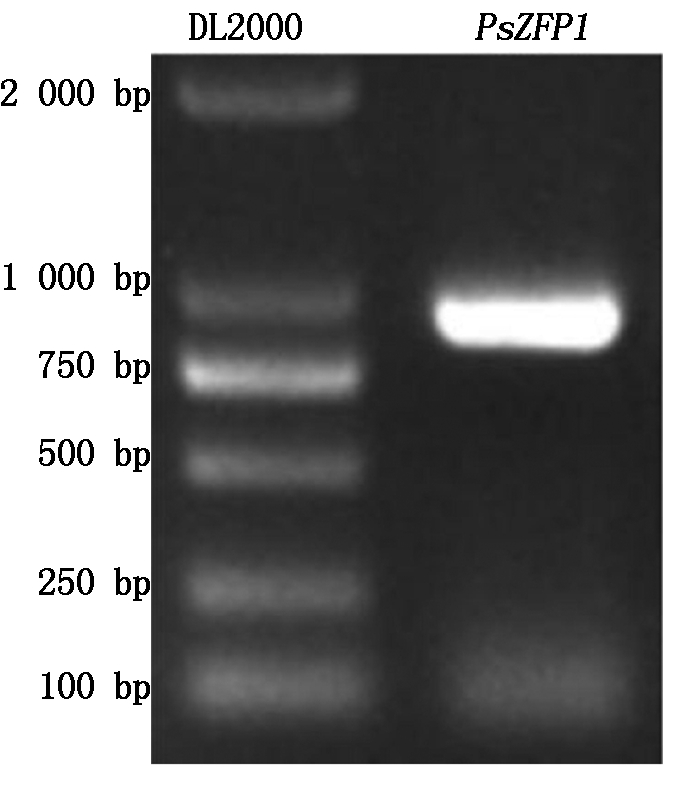
图4 PsZFP1的ORF扩增产物
Fig.4 The PCR amplification product of PsZFP1 ORF
2.5 PsMPT启动子与PsZFP1蛋白互作检测
如图7所示,只有含pGADT7-PsZFP1+pHIS2.1-MYC的酵母菌株Y187可以在TDO(SD/-His/-Leu/-Trp/+50 mmol/L 3-AT)培养基上生长,而含pGADT7+pHIS2.1-MYC的酵母菌株Y187(对照菌)不能在TDO培养基上生长,表明PsZFP1可以与PsMPT启动子的MYC元件互作。
2.6 PsZFP1的表达特性分析
为研究PsZFP1基因的表达是否受低温累积诱导,本研究利用qRT-PCR技术分析了PsZFP1基因在低温处理不同时间的花芽中的表达模式。结果表明,PsZFP1基因的表达量随低温天数的增加呈上调趋势,在低温21 d时其表达水平达到峰值,但在低温28 d时表达量显著下降(图8)。
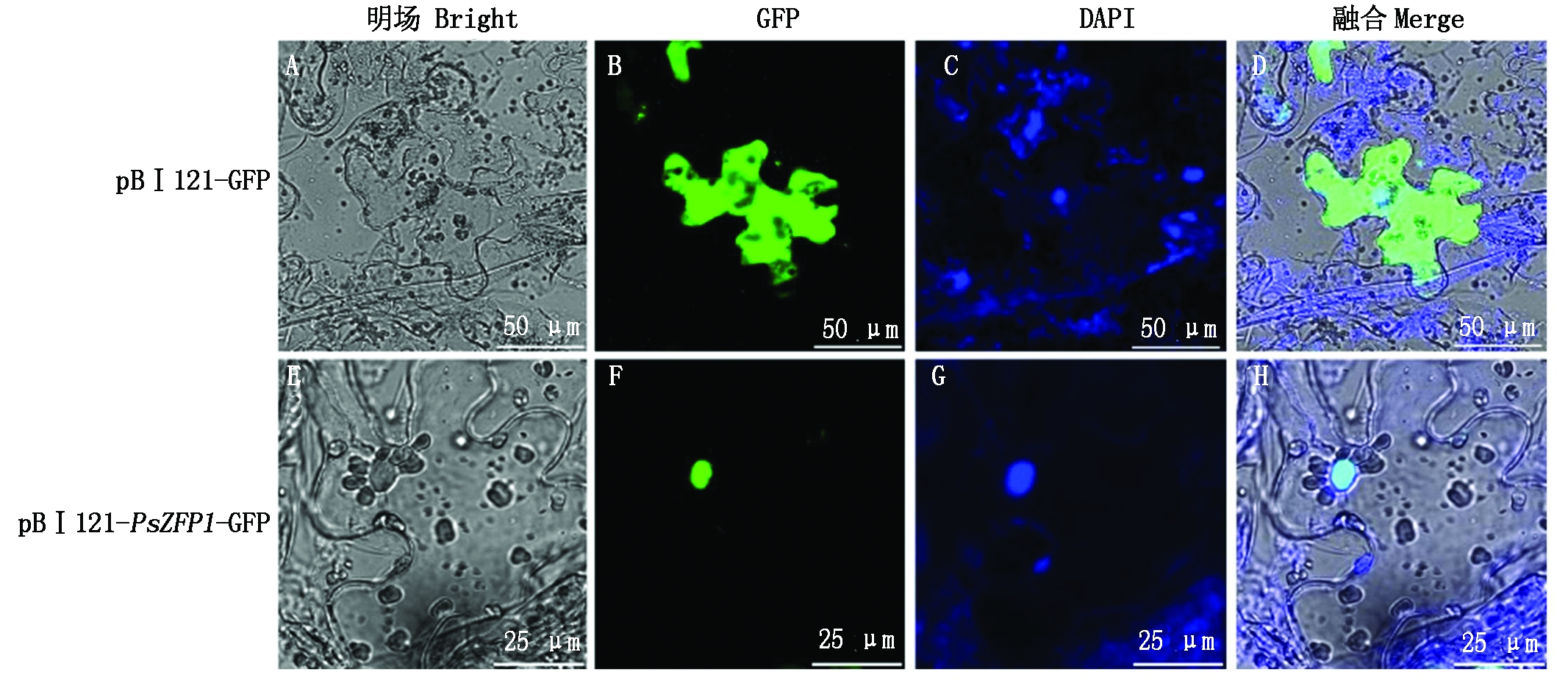
图5 PsZFP1的亚细胞定位
Fig.5 Subcellular localization of PsZFP1
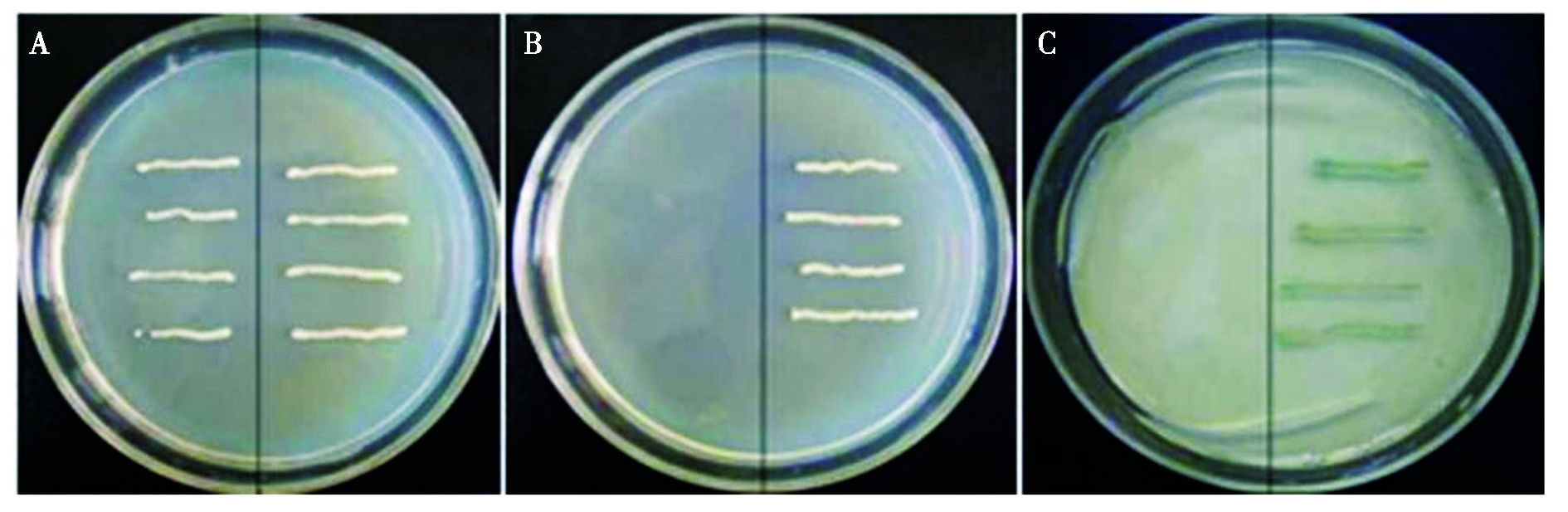
A.SD/-Trp;B.SD/-Trp/-His/-Ade;C.SD/-Trp/-His/-Ade + X-α-gal;A、B和C中培养皿的左侧和右侧分别为pGBKT7和pGBKT7-PsZFP1。
A.SD/-Trp;B.SD/-Trp/-His/-Ade;C.SD/-Trp/-His/-Ade + X-α-gal;The left and right sides of A,B and C were pGBKT7 and pGBKT7-PsZFP1,respectively.
图6 PsZFP1的转录激活分析
Fig.6 Transactivation analysis of PsZFP1
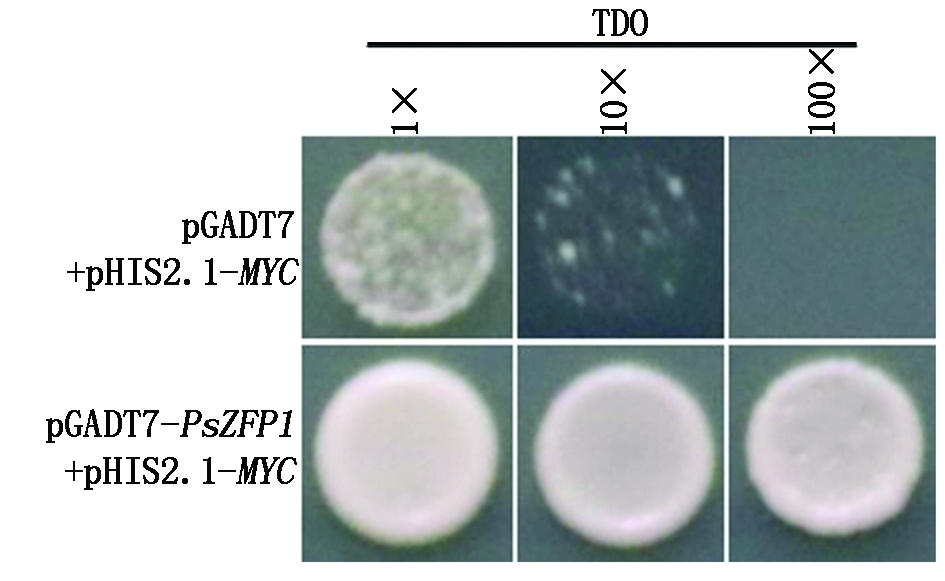
图7 PsMPT 启动子序列MYC与PsZFP1蛋白相互作用检测
Fig.7 Interaction measurements of PsMPT promoter fragment MYC and PsZFP1 protein
2.7 PsZFP1的原核表达及纯化
经IPTG诱导后,含重组质粒pET28a+-PsZFP1的原核表达菌株BL21表达出分子量约为37 ku的重组蛋白,且重组蛋白主要集中在包涵体中(图9-A)。利用Ni-NTA亲和层析技术纯化重组蛋白,SDS-PAGE检测结果显示成功获得较为纯净的重组蛋白(图9-B)。
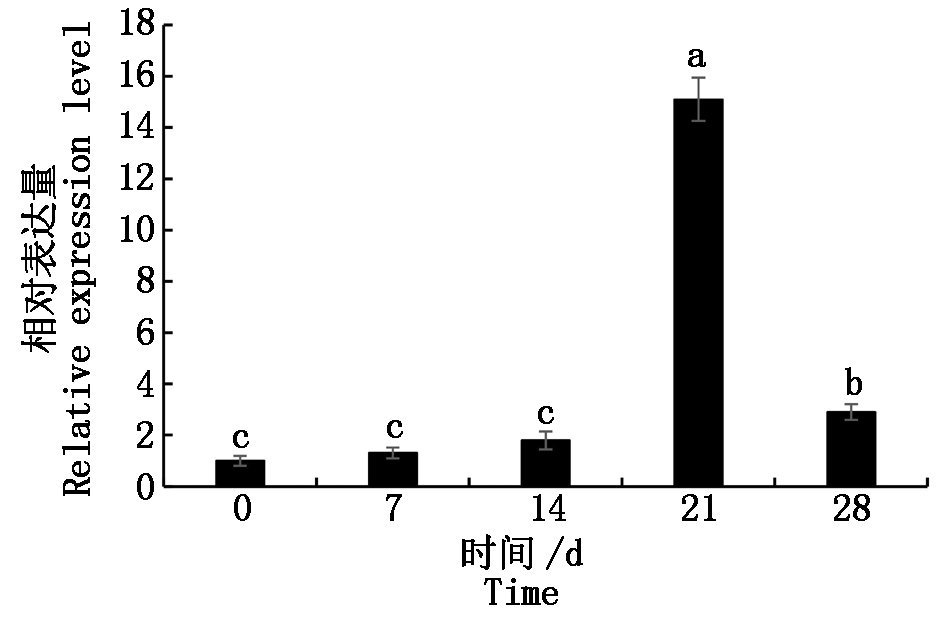
不同字母表示显著差异P<0.05。
Different letters indicate significant differences P<0.05 .
图8 PsZFP1 在低温处理不同时间的牡丹花芽中的表达模式
Fig.8 The relative expression level of PsZFP1 gene in tree peony bud after different chilling treatments
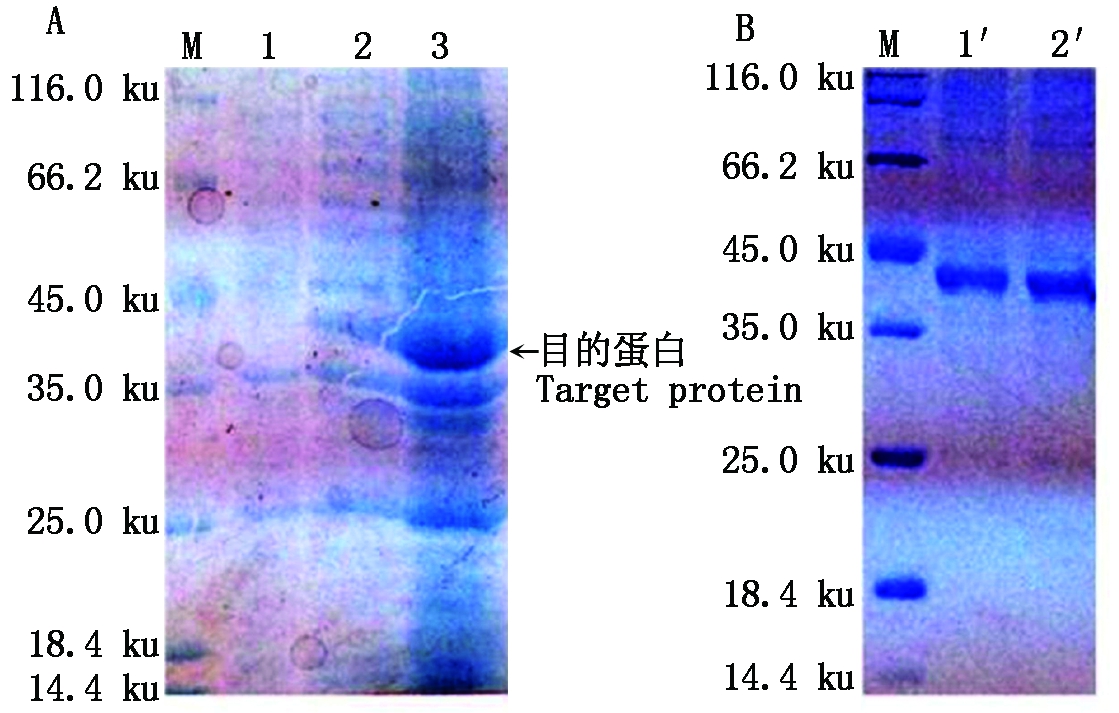
M.蛋白质标准分子量;1.未诱导pET28a+-PsZFP1;2.IPTG诱导pET28a+-PsZFP1的上清液;3.IPTG诱导pET28a+-PsZFP1的包涵体;1′和2′.纯化后的PsZFP1蛋白。
M.Standard molecular weight of proteins;1.Recombinant strain without IPTG induction;2.The supernatant of recombinant strain with IPTG induction;3.The inclusion body of recombinant strain with IPTG induction;1′ and 2′.The purified protein of PsZFP1.
图9 PsZFP1 的原核表达及纯化
Fig.9 The prokaryotic expression and purification of the PsZFP1
3 结论与讨论
CCCH型锌指蛋白含有由3个半胱氨酸残基和1个组氨酸残基组成的CCCH锌指结构,通过与RNA、DNA或蛋白质结合直接或间接调控相关靶基因、蛋白质的表达[14-15]。研究表明,甘薯的CCCH型锌指蛋白IbC3H18是1种核转录激活剂,可调控活性氧清除、ABA信号传导、光合作用和离子传递等相关途径的一些非生物胁迫响应基因的表达[16]。拟南芥AtC3H14蛋白也具有转录激活作用,可与靶基因如多聚半乳糖醛酸酶基因的RNA结合,并且参与其靶基因的转录后调控[17]。从橡胶树中分离的蛋白HbCZF1,具有CCCH型锌指结构,可与HMG1基因的启动子结合激活3-羟基-3-甲基戊二酰辅酶A还原酶的表达,调控天然橡胶的生物合成[18]。Zhang等[19]发现水稻的CCCH锌指蛋白ⅡP4可以抑制次生壁的合成。水稻OsDOS过表达株系的叶片衰老显著延迟,而Osdos突变株的叶片衰老进程明显加快[20]。棉花蛋白GhZFP1具有CCCH型结构,过表达GhZFP1的烟草植株的抗立枯丝核菌能力和耐盐能力均增强[21]。拟南芥的AtC3H7过表达植株的抗盐胁迫能力更强[22]。近期研究发现,多种PvC3Hs对柳枝稷的抗寒性起调控作用,过表达PvC3H72的柳枝稷株系在4 ℃下的耐寒性明显增强。PvC3H72与ICE1-CBF-COR调节因子和ABA应答基因共同提高了柳枝稷的抗寒性[23]。在水稻中,低温胁迫可诱导CCCH型锌指蛋白OsTZF5基因的表达[24]。可见,CCCH型锌指蛋白功能是多样化的。
本研究对牡丹PsZFP1和不同物种中ZFP蛋白的系统进化树分析结果显示,PsZFP1与葡萄的VvZFP同源性较高。PsZFP1蛋白的理化性质预测结果表明,该蛋白为亲水性的稳定蛋白,具有CCCH保守结构域。PsZFP1蛋白亚细胞定位和转录激活活性的试验证实,PsZFP1蛋白定位于细胞核,且具有转录激活活性,因而具备转录因子的特性。这与Huang等[7]证实水稻锌指蛋白OsZFP245定位于细胞核,具有反式激活活性的研究结果相似。
本研究的实时定量分析结果显示,在低温0~21 d,PsZFP1表达水平缓慢上调,在低温21 d时急剧升高,表明该基因受低温累积所诱导。PsZFP1与前期筛选到的线粒体磷酸转移子基因的表达规律一致[11]。休眠解除时需要大量能量满足花芽生理状态和生长状态的转换,作为能量(ATP)合成的关键基因,PsMPT表达量此时急剧上升[11-12],与这一需求相吻合。酵母单杂发现PsZFP1可结合在PsMPT启动子上,表明PsZFP1可能是在转录水平上调控PsMPT表达的重要因子。因此推测:伴随着低温的累积,PsZFP1表达水平不断升高,促进了PsZFP1蛋白积累,进而激活了PsMPT的转录和表达,最终促进了牡丹花芽的能量代谢和休眠解除[11-13]。因此,PsZFP1参与了牡丹花芽内休眠的调控,本研究发现了CCCH锌指蛋白新的功能。进一步构建了原核表达载体pET28a+-PsZFP1,并在适宜条件下进行了诱导表达及纯化,获得了较为纯净的PsZFP1蛋白,为后期研究PsZFP1蛋白的功能,及其参与低温响应的调控机制,解析牡丹花芽休眠解除的分子机理提供理论基础。
[1] Miller J,McLachlan A D,Klug A. Repetitive zinc-binding domains in the protein transcription factor ⅢA from Xenopus oocytes[J]. The EMBO Journal,1985,4(6):1609-1614. doi:10.1002/j.1460-2075.1985.tb03825.x.
[2] Sun T,Shi X W,Friso G,Van Wijk K,Bentolila S,Hanson M R. A zinc finger motif-containing protein is essential for chloroplast RNA editing[J]. PLoS Genetics,2015,11(3):e1005028. doi:10.1371/journal.pgen.1005028.
[3] Li J J,Jia D X,Chen X M. HUA1,a regulator of stamen and carpel identities in Arabidopsis,codes for a nuclear RNA binding protein[J]. The Plant Cell,2001,13(10):2269-2281. doi:10.1105/tpc.010201.
[4] Shi X D,Gu Y X,Dai T W,Wu Y,Wu P,Xu Y,Chen F. Regulation of trichome development in tobacco by JcZFP8,a C2H2 zinc finger protein gene from Jatropha curcas L.[J]. Gene,2018,658:47-53. doi:10.1016/j.gene.2018. 02.070.
[5] 孙华军,李国瑞,黄凤兰,李跃,丛安琪,李威,齐蒙,陈永胜. 蓖麻矮化相关基因RcDof的克隆及分析[J]. 华北农学报,2016,31(4):63-67. doi:10.7668/hbnxb.2016.04.011.
Sun H J,Li G R,Huang F L,Li Y,Cong A Q,Li W,Qi M,Chen Y S. Cloning and analysis of RcDof gene associated with castor dwarfing[J]. Acta Agriculturae Boreali-Sinica,2016,31(4):63-67.
[6] 任美艳,王志林,郭慧琴,薛敏,殷玉梅,王茅雁. 沙冬青C2H2型锌指蛋白基因AmZFP1的克隆与表达分析[J]. 华北农学报,2017,32(2):8-13. doi:10.7668/hbnxb.2017.02.002.
Ren M Y,Wang Z L,Guo H Q,Xue M,Yin Y M,Wang M Y. Cloning and expression analysis of AmZFP1,a C2H2-type ZFP gene from Ammopiptanthus mongolicus[J]. Acta Agriculturae Boreali-Sinica,2017,32(2):8-13.
[7] Huang J,Sun S J,Xu D Q,Yang X,Bao Y M,Wang Z F,Tang H J,Zhang H S. Increased tolerance of rice to cold,drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger protein ZFP245[J]. Biochemical and Biophysical Research Communications,2009,389(3):556-561. doi:10.1016/j.bbrc.2009.09.032.
[8] 喻衡. 牡丹[M]. 上海:上海科学技术出版社,1998:1-7.
Yu H. Peaonia suffruticosa[M]. Shanghai:Shanghai Science and Technology Press,1998:1-7.
[9] 赵海军. 牡丹春节催花技术[M]. 北京:中国农业出版社,2002:27-32.
Zhao H J. Flower forcing techniques of tree peony in winter[M]. Beijing:China Agriculture Press,2002:27-32.
[10] Fulton T A,Hall A J,Catley J L. Chilling requirements of Paeonia cultivars [J]. Scientia Horticulturae,2001,89(3):237-248. doi:10.1016/S0304-4238(00)00237-5.
[11] Huang X,Xue T T,Dai S L,Gai S P,Zheng C C,Zheng G S. Genes associated with the release of dormant buds in tree peony(Paeonia suffruticosa)[J]. Acta Physiologiae Plantarum,2008,30(6):797-806. doi:10.1007/s11738-008-0184-0.
[12] Huang X,Zhu W,Dai S L,Gai S P,Zheng G S,Zheng C C. The involvement of mitochondrial phosphate transporter in accelerating bud dormancy release during chilling treatment of tree peony (Paeonia suffruticosa)[J]. Planta,2008,228(4):545-552. doi:10.1007/s00425-008-0757-6.
[13] Zhang Y X,Sun T Z,Liu S Q,Dong L,Liu C Y,Song W W,Liu J J,Gai S P. MYC cis-elements in PsMPT promoter is involved in chilling response of Paeonia suffruticosa[J]. PLoS One,2016,11(5):e0155780. doi:10.1371/journal.pone.0155780.
[14] Pomeranz M C,Hah C,Lin P C,Kang S G,Finer J J,Blackshear P J,Jang J C. The Arabidopsis tandem zinc finger protein AtTZF1 traffics between the nucleus and cytoplasmic foci and binds both DNA and RNA[J]. Plant Physiology,2010,152(1):151-165. doi:10.1104/pp.109.145656.
[15] Pradhan S,Kant C,Verma S,Bhatia S. Genome-wide analysis of the CCCH zinc finger family identifies tissue specific and stress responsive candidates in chickpea (Cicer arietinum L.)[J]. PLoS One,2017,12(7):e0180469. doi:10.1371/journal.pone.0180469.
[16] Zhang H,Gao X R,Zhi Y H,Li X,Zhang Q,Niu J B,Wang J,Zhai H,Zhao N,Li J G,Liu Q C,He S Z. A non-tandem CCCH-type zinc-finger protein,IbC3H18,functions as a nuclear transcriptional activator and enhances abiotic stress tolerance in sweet potato[J]. The New Phytologist,2019,223(4):1918-1936. doi:10.1111/nph.15925.
[17] Kim W C,Kim J Y,Ko J H,Kang H,Kim J,Han K H. AtC3H14,a plant-specific tandem CCCH zinc-finger protein,binds to its target mRNAs in a sequence-specific manner and affects cell elongation in Arabidopsis thaliana[J].The Plant Journal,2014,80(5):772-784. doi:10.1111/tpj.12667.
[18] Guo D,Yi H Y,Li H L,Liu C,Yang Z P,Peng S Q. Molecular characterization of HbCZF1,a Hevea brasiliensis CCCH-type zinc finger protein that regulates hmg1[J]. Plant Cell Reports,2015,34(9):1569-1578. doi:10.1007/s00299-015-1809-6.
[19] Zhang D M,Xu Z P,Cao S X,Chen K L,Li S C,Liu X L,Gao C X,Zhang B C,Zhou Y H. An uncanonical CCCH-tandem zinc-finger protein represses secondary wall synthesis and controls mechanical strength in rice[J]. Molecular Plant,2018,11(1):163-174. doi:10.1016/j.molp.2017.11.004.
[20] Kong Z S,Li M N,Yang W Q,Xu W Y,Xue Y B. A novel nuclear-localized CCCH-type zinc finger protein,OsDOS,is involved in delaying leaf senescence in rice[J]. Plant Physiology,2006,141(4):1376-1388. doi:10.1104/pp.106.082941.
[21] Guo Y H,Yu Y P,Wang D,Wu C A,Yang G D,Huang J G,Zheng C C. GhZFP1,a novel CCCH-type zinc finger protein from cotton,enhances salt stress tolerance and fungal disease resistance in transgenic tobacco by interacting with GZIRD21A and GZIPR5[J].New Phytologist,2009,183(1):62-75. doi:10.1111/j.1469-8137.2009. 02838.x.
[22] Seok H Y,Nguyen L V,Park H Y,Tarte V N,Ha J M,Lee S Y,Moon Y H. Arabidopsis non-TZF gene AtC3H17 functions as a positive regulator in salt stress response[J]. Biochemical and Biophysical Research Communications,2018,498(4):954-959. doi:10.1016/j.bbrc.2018.03.088.
[23] Xie Z N,Lin W J,Yu G H,Cheng Q,Xu B,Huang B R. Improved cold tolerance in switchgrass by a novel CCCH-type zinc finger transcription factor gene,PvC3H72,associated with ICE1-CBF-COR regulon and ABA-responsive genes[J]. Biotechnology for Biofuels,2019,12(1):224. doi:10.1186/s13068-019-1564-y.
[24] Selvaraj M G,Jan A,Ishizaki T,Valencia M,Dedicova B,Maruyama K,Ogata T,Todaka D,Yamaguchi-Shinozaki K,Nakashima K,Ishitani M. Expression of the CCCH-tandem zinc finger protein gene OsTZF5 under a stress-inducible promoter mitigates the effect of drought stress on rice grain yield under field conditions[J]. Plant Biotechnology Journal,2020,18(8):1711-1721. doi:10.1111/pbi.13334.