二穗短柄草 (Brachypodium distachyon) 属于禾本科,早熟禾亚科,一年生的温带禾本科植物,其植株矮小(5~50 cm)、生活期短 (一般为70 d左右)、自花授粉、繁殖能力强、要求的生活条件简单且易转化、基因组小、遗传资源丰富[1]。与拟南芥相比,二穗短柄草与很多重要的禾谷类作物如小麦、大麦、玉米、水稻、高粱等有更近的亲缘关系,是温带禾本科植物功能基因组学研究的理想模式植物。而与水稻相比,二穗短柄草与麦类作物(如六倍体作物小麦)的亲缘关系更近,因此,利用二穗短柄草来研究作物基因的表达模式和作用机制,将极大地加速麦类作物功能基因组学的研究[2],为麦类作物的分子育种提供一定的帮助。
随着人类社会的快速发展,人口数量急剧增加,生态环境日益恶化。这些恶劣的环境对植物的生长发育、生理生化等多种代谢途径造成了严重影响,甚至会造成作物的大面积减产乃至绝收。植物中的AP2/EREBP 转录因子超家族,在植物生长发育[3-4]以及逆境应答[5-8]通路中扮演着极其重要的角色。其中的DREB转录因子,属于AP2/EREBP转录因子超家族中的CBF/DREB 亚家族,在植物抗冷、干旱、盐等逆境胁迫起着重要作用。因此,对二穗短柄草中的DREB类转录因子基因的克隆与表达分析,将为其后续功能的进一步研究打下一定的基础。
第一个 AP2/EREBP转录因子是在1994年从拟南芥中分离并鉴定出来的,它主要调控花的发育过程[9]。在拟南芥中CBF/DREB蛋白与其他AP2/ERF蛋白的区别在于,CBF/DREB蛋白的AP2结构域两侧存在一组保守的CBF/DREB特征序列即PKK/RPAGRxKFxETRHP和DSAWR域。植物CBF/DREB家族中的成员在转基因侧金盏花[6]、短柄草[10]和玉米[11]植株中能有效地提高转基因植物的抗冻性。目前已从大麦[12]、水稻[13]、小麦[14]等单子叶植物和拟南芥[15]、大豆[16]、烟草[17]、棉花[18]等双子叶植物中分离和鉴定出大量DERB转录因子。而在二穗短柄草中的研究报道却较少,本研究利用RT-PCR方法从二穗短柄草中克隆了一个BdDREB1H基因,然后探索了其在根、茎、叶3种组织的表达模式,最后比较了它在冷(4 ℃)、干旱(PEG)、盐(NaCl)和氧化(H2O2)4种非生物胁迫处理下的表达模式,为在二穗短柄草乃至整个禾本科的DREB蛋白的功能研究提供参考。
1 材料和方法
1.1 材料与试剂
二穗短柄草BD21、酵母菌株AH109为江汉大学系统生物学研究院保存。大肠杆菌感受态细胞DH5a和Trans1-T1、pEASY-Blunt Cloning Vector、反转录试剂盒和实时荧光定量(SYBR Green)PCR 试剂盒购于南京诺唯赞生物科技有限公司;TRIzol试剂购自Invitrogen公司;胶回收试剂盒、Marker 和质粒提取试剂盒购于天根生化科技有限公司;酵母SD培养基及其他相关培养基购自Clontech生物公司;PrimeSTAR 高保真酶、限制性内切酶和T4 DNA 连接酶购于TaKaRa公司;引物合成与测序均在苏州金唯智完成(表1)。
表1 引物序列和注释
Tab.1 Primer sequence and its annotation

引物 Primer 序列(5′-3′) Sequence 注释 Annotation CB1F1TGC(TCTAGA)ATGGACGCGGCCGACTCC基因克隆,括号中代表酶切位点CB1R1CGC(GGATCC)GTAGTTCCAGAGCGTGGCCTCBdUBC18-FGGAGGCACCTCAGGTCATTT内参基因BdUBC18-RATAGCGGTCATTGTCTTGCGqCB1FAATCTGAAATCCAGCAGCAAGReal-time检测qCB1RTGCGAGGACGACGAGGAACBF1SBCG(GAATTC)ATGGACGCGGCCGACTCCCC酵母EcoR Ⅰ酶切位点(括号中)CBF1RBCG(GGATCC)TCAGTAGTTCCAGAGCGTGGCC酵母BamH Ⅰ酶切位点(括号中)
1.2 总RNA的提取及cDNA第一条链的合成
挑选饱满的二穗短柄草种子,剥去表皮播种在润湿的3~4层纱布上,25 ℃培养。定期观察,补充水分,以保持纱布湿润。14~21 d后取生长状态良好的二穗短柄草整株幼苗,用TRIzol试剂提取二穗短柄草的总RNA,然后利用南京诺唯赞生物科技有限公司的反转录试剂盒进行cDNA第一链的合成。
1.3 BdDREB1H基因的克隆
根据二穗短柄草DREB1H基因(GenBank accession:XM_010240091.3)的核酸序列,用Prime 5软件设计用于该基因克隆的特异性引物(表1)。以得到的cDNA为模板,CB1F1/CB1R1为引物进行PCR扩增,反应程序如下:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环。用1%琼脂糖凝胶电泳检测并回收735 bp的目标片段,目标片段连接到T载体(pEASY-Blunt Cloning Vector)上,然后再转入大肠杆菌感受态DH5a中进行菌液PCR和测序检测。提取测序正确菌株的质粒,进而获得BdDREB1H基因的全长读码框序列。
1.4 BdDREB1H基因生物信息学分析
利用DNAStar软件对测序得到的 BdDREB1H核酸序列进行开放阅读框分析;利用在线分析工具ExPaSy-ProtParam (https://web.expasy.org/protparam/)对BdDREB1H蛋白的理化性质进行预测;利用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和phyre2(sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分别对BdDREB1H蛋白的二级结构和3D模型进行预测;利用MUSCLE进行多序列比对(http://www.drive5.com/muscle/manual/)并利用MEGA 7(https://www.megasoftware.net/) 进行进化分析。
1.5 BdDREB1H基因转录激活活性鉴定
以测序正确的含有BdDREB1H基因的T载体质粒为模板,以表1中CBF1SB和CBF1RB引物进行PCR扩增,然后同BdDREB1H基因克隆的过程类似,进行目的片段的回收、连接、转化、质粒提取、阳性克隆子鉴定与测序,测序正确的质粒命名为DREB1H-T。然后分别对DREB1H-T质粒和酵母pGBKT7载体进行EcoRⅠ和BamHⅠ双酶切、目标片段回收、连接、转化到大肠杆菌DH5α中,PCR和酶切检测后,阳性菌液送往苏州金唯智测序并提取质粒。测序成功的质粒即为用于后续转录激活活性分析的酵母重组表达载体DREB1H-BD。随后将DREB1H-BD、BD 空载(pGBKT7,阴性对照质粒)分别转化酵母菌株AH109 感受态细胞,并涂布于缺陷培养基SD/-Trp 上。30 ℃倒置培养2~3 d 后,挑取单克隆菌落,活化后分别涂布于酵母SD/His-和SD/His-+X-α-gal 培养基上。30 ℃倒置培养2~3 d 后观察菌落生长和显色情况并拍照。
1.6 BdDREB1H基因表达分析
根据测序得到的BdDREB1H基因序列,通过Prime 5软件设计内参基因引物和Real-time PCR引物(表1)。挑选饱满的二穗短柄草种子,剥去表皮播种在润湿的3~4层纱布上,25 ℃培养。定期观察,补充水分,以保持纱布湿润。14~21 d后取生长状态良好的二穗短柄草整株幼苗,一部分不做处理,分别提取根、茎和叶的RNA用于后续组织表达分析;其余的幼苗分别用300 mmol/L NaCl(盐处理)、300 mmol/L 甘露醇(模拟干旱处理)、10 μmol/L H2O2(氧化处理)和4 ℃(冷处理)处理0,1,2,5,24 h,然后分别提取其总RNA,按照南京诺唯赞生物科技有限公司的反转录试剂盒合成cDNA第一链。反转录后采用诺唯赞生物科技有限公司SYBR荧光qPCR试剂盒对BdDREB1H进行表达量检测,特异性引物和内参BdUBC18基因引物见表1。qPCR反应在本研究院的CFX96(Bio-Rad)机器中进行,每个反应设3个生物学重复,程序如下:预变性95 ℃ 1 min;95 ℃ 15 s,60 ℃ 30 s,40个循环。得到的数据采用2-ΔΔCt法进行表达分析,同时利用SPSS软件对数据进行统计学分析,显著水平为0.05。
2 结果与分析
2.1 BdDREB1H基因的克隆
以表1中CB1F1和CB1R1引物对反转录得到的cDNA模板进行PCR扩增,并利用1%的琼脂糖凝胶对扩增产物进行检测,扩增出一条750 bp左右的目的片段(图1-A),获得与预期试验结果一致的目标片段(735 bp)。将目的条带连接到T载体上,测序结果表明,所克隆的基因序列与GenBank 数据库中的DREB1H基因(GenBank accession:XM_010240091.3)的序列一致。
2.2 BdDREB1H基因生物信息学分析
获得的BdDREB1H基因编码框为735 bp,共编码244个氨基酸,含有一个由 74 氨基酸组成的保守的 AP2 结构域。理化性质预测分析表明:BdDREB1H蛋白含量排前三的氨基酸分别为Ala占16.0%、Pro占9.0%、Arg占7.8%;带负电荷氨基酸残基总数(Asp+Glu):29,带正电荷氨基酸残基总数(Arg+Lys):23;分子式:C1156H1777O345S15,分子量:26.34 ku,等电点(PI)5.63;不稳定指数(Ⅱ)计算为64.17,为不稳定蛋白质;总亲水平均值为-0.261,为亲水蛋白。二级结构预测:二级结果预测显示BdDREB1H蛋白质含有29.51%的α-螺旋、9.84%的β-折叠和59.84%无规则卷曲。对BdDREB1H蛋白进行3D模型预测,结果如图1-B,覆盖了BdDREB1H蛋白质序列的第44-118位的氨基酸片段,占整个预测片段的30%,为AP2-ERF保守区。

M.DNA Marker Ⅲ;1-2.DREB1H基因。M.Marker Ⅲ; 1-2.DREB1H gene.
图1 BdDREB1H的基因克隆(A)和蛋白三级结构的预测(B)
Fig.1 The gene cloning (A) and predictive analysis of tertiary structure of BdDREB1H protein
氨基酸序列比对及进化分析:利用MUSCLE (http://www.drive5.com/muscle/)和 MEGA 7 将二穗短柄草DREB1H(XP_010238393.1)的氨基酸序列同黑麦草CBF(Lolium perenne, BAF36841.1)、普通小麦CBF(Triticum aestivum,AFR67799.1)、硬粒小麦CBF(Triticum turgidum subsp. Durum,VAI34800.1)、燕麦CBF(Avena sativa,CAJ21277.1)、普通小麦CBFⅢd-A19 (Triticum aestivum,AEE00133.1)、两芒山羊草CBF5(Aegilops biuncialis,CBX87019.1)、粗山羊草DREB1H-like(Aegilops tauschii subsp. Tauschii,XP_020167751.1)、大麦HvCBF10A (Hordeum vulgare,AAX23710.1)、黑麦CBFⅢc-10 (Secale cereale, ABY59780.1)9个禾本科植物的氨基酸序列进行多序列比对和进化分析。多序列比对结果显示,这10个禾本科作物的AP2/ERF结构域高度保守(图2);且二穗短柄草DREB1H的氨基酸序列与普通小麦CBF、黑麦草CBF、和普通小麦的氨基酸序列具有更高的同源性,同源性分别为64.44%,63.36%,61.54%。进化分析表明,这10个CBF/DEREB蛋白可聚为两大支(图3),其中二穗短柄草DREB1H与普通小麦CBF、黑麦草CBF、燕麦CBF、普通小麦CBFⅢd-A19、两芒山羊草CBF5和DREB1H-like聚为一支(Group 1),硬粒小麦CBF、大麦HvCBF和黑麦CBF聚为一支(Group 2)。相对于Group 2的CBF成员,二穗短柄草DREB1H与Group 1中的CBF成员亲缘关系更近些。
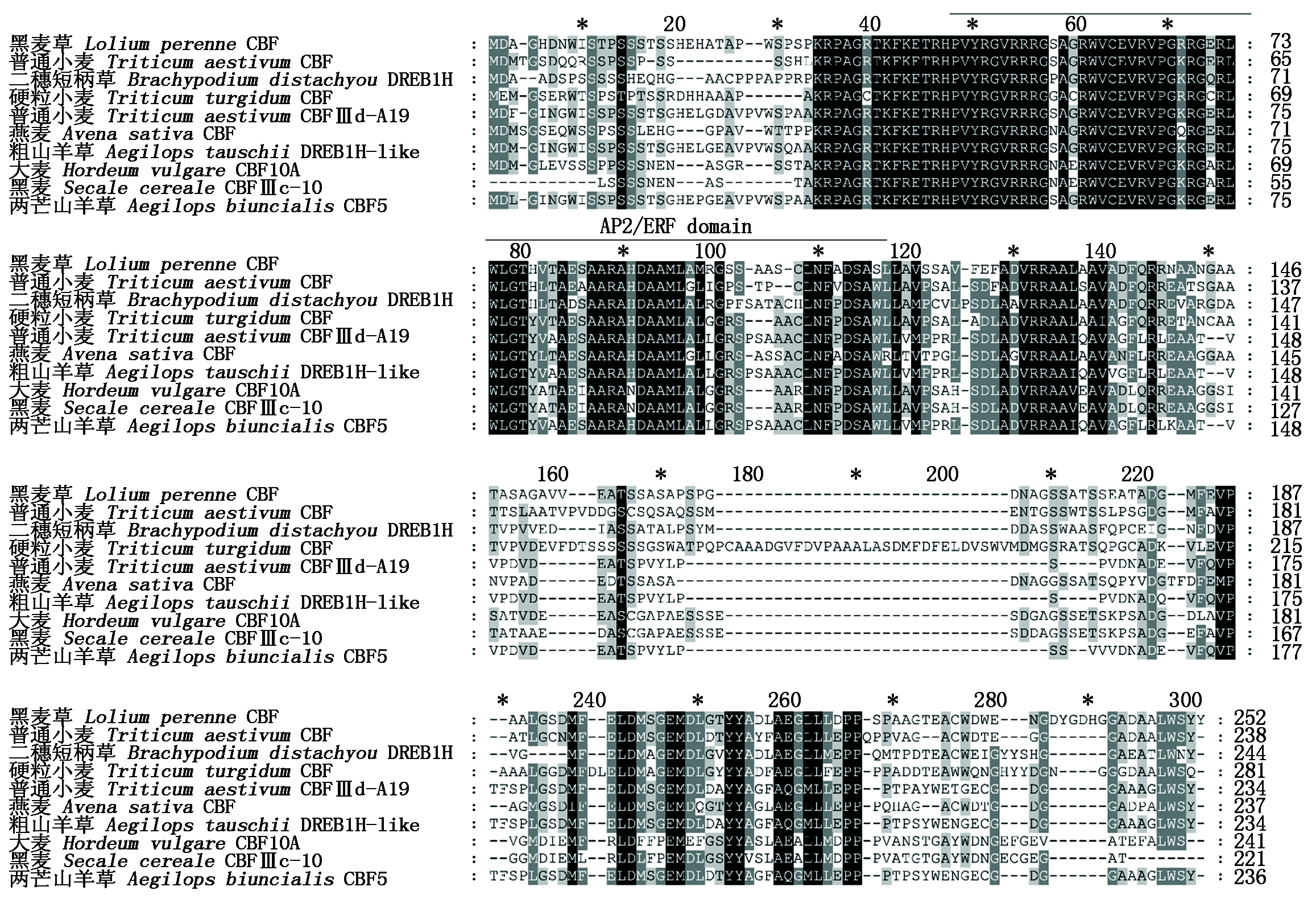
图2 二穗短柄草与其他物种DREB蛋白的多序列比对
Fig.2 Multiple sequence alignment of DREB proteins between Brachypodium distachyon and other species
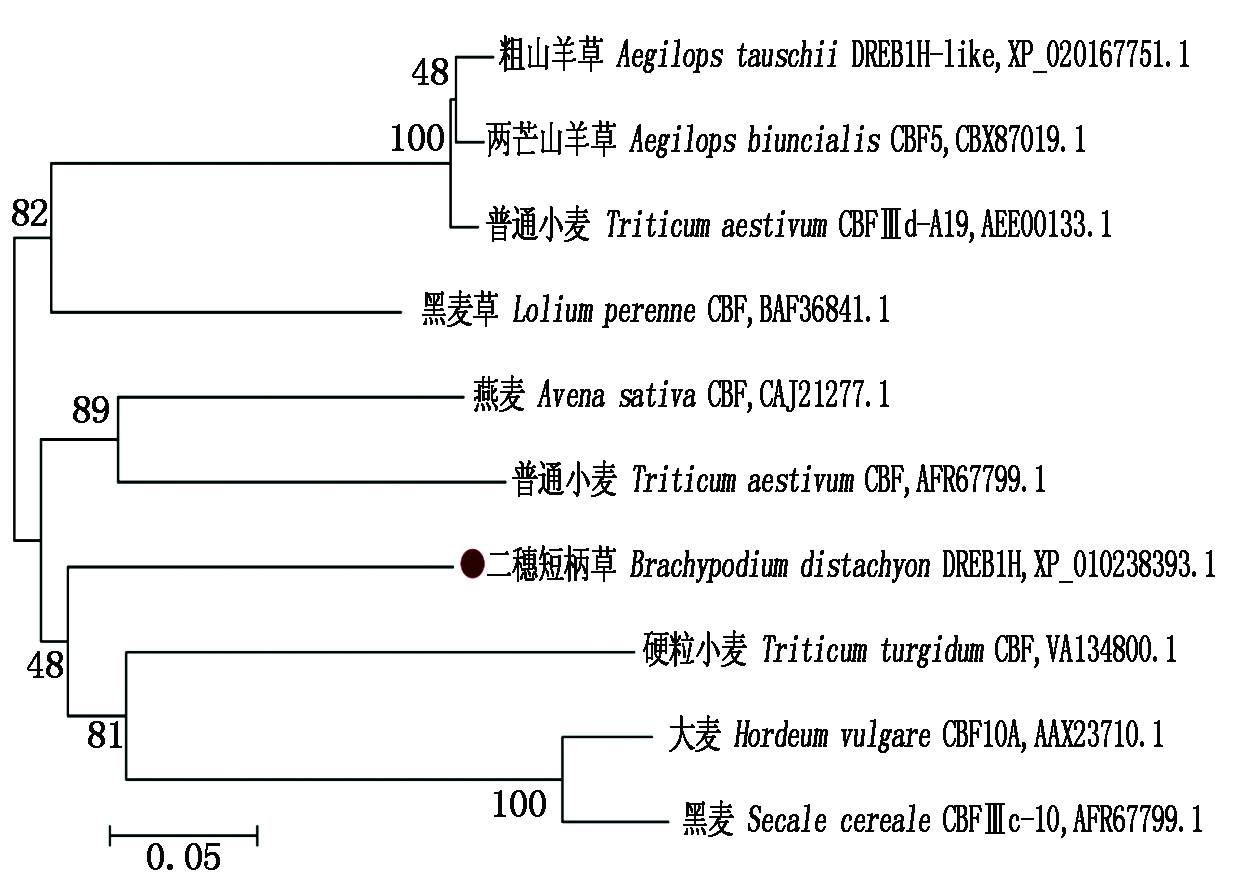
图3 不同物种 DREB/CBF 蛋白的系统进化树
Fig.3 Phylogenetic tree of DREB/CBF proteins from different plant species
2.3 BdDREB1H基因的转录激活分析
为了研究BdDREB1H基因是否具有转录激活活性,将BdDREB1H构建到酵母表达载体pGBKT7(BD)上,构建成功的载体命名为DREB1H-BD。随后将DREB1H-BD、BD 空载体(pGBKT7,阴性对照质粒)分别转入酵母细胞中(图4)。结果显示,转DREB1H-BD和BD 空载的酵母菌均能在色氨酸缺陷型SD培养基上正常生长,表明这2个载体均已转入酵母细胞中。转DREB1H-BD的酵母菌能够在组氨酸缺陷型SD培养基上生长良好,而转BD 空载的阴性对照的酵母却不能生长;并且DREB1H-BD酵母菌能在添加X-α-gal组氨酸缺陷型SD培养基上显蓝色,表明转入DREB1H-BD的酵母菌中的报告基因His和LacZ被激活。这些结果表明,BdDREB1H蛋白具有明显的转录激活活性。

BD.Empty pGBKT7 vector.
图4 BdDREB1H的转录激活活性分析
Fig.4 Transactivation activity analysis of BdDREB1H
2.4 BdDREB1H基因表达分析
以BdUBC18为内参基因,利用内参引物BdUBC18-F/BdUBC18-R和BdDREB1H基因的特异引物qCB1F/qCB1R,对BdDREB1H基因在二穗短柄草根、茎和叶3种组织中的表达量进行了分析。结果表明,BdDREB1H在根、茎和叶中均有表达(图5-A),其中在茎中表达最高,叶中表达量最低。
此外,对二穗短柄草在300 mmol/L 甘露醇(模拟干旱处理)、300 mmol/L NaCl(盐处理)、10 μmol/L H2O2(氧化处理)和4 ℃(冷处理)这4种常见逆境胁迫条件下的表达情况进行了分析。结果表明冷处理后,BdDREB1H的转录水平先升高,在2 h达到最高,是对照的6倍,然后随时间的延长而下降(图5-B)。干旱和氧化处理条件下,BdDREB1H在2 h后转录水平显著高于对照(图5-C、D);而盐胁迫处理条件下,BdDREB1H在处理1 h,表达水平基本无变化,而在2 h后,表达水平显著低于对照(图5-E)。
3 讨论
作物生长过程中的非生物胁迫,如干旱、高盐和温度波动等严重影响着作物的生长与发育,轻则导致作物生产力下降或减产,重则甚至会导致重大的经济损失[19]。研究表明,AP2/EREBP家族成员多、数目庞大,参与调控植物细胞周期、生长发育和环境胁迫等一系列应答过程;它们都含有一个由 60 个左右的氨基酸残基组成的DNA结合区,即AP2/EREBP结合域,在不同的植物中非常保守[20]。其中DREB属于AP2/EREBP超家族的DREB/CBF亚家族。该亚家族主要包括抗冷的DREB1/CBF和抗干旱/盐的DREB2 2个小类[20]。
研究发现,过表达拟南芥DREB1B的转基因丹参增加了对干旱的耐受性但不阻碍其生长[5]。耐寒植物侧金盏花中的AaDREB1转录因子可增强转基因生物对多种非生物胁迫的耐受性[6]。但在拟南芥中过表达DREB基因虽然提高了拟南芥的抗性,但同时却带来了新的问题,如发育畸形、生长矮化、迟缓等[21],这些研究表明,DREB/CBF转录因子在转基因植物中的调控机制是复杂的,所以对DREB基因的深入研究和克隆新的DREB基因是有必要的。此外,目前已有的关于DREB/CBF转录因子的功能验证主要还是集中在模式植物拟南芥中,对于其他植物的研究少之又少[21]。其中短柄草中DREB基因的相关研究报道更少。
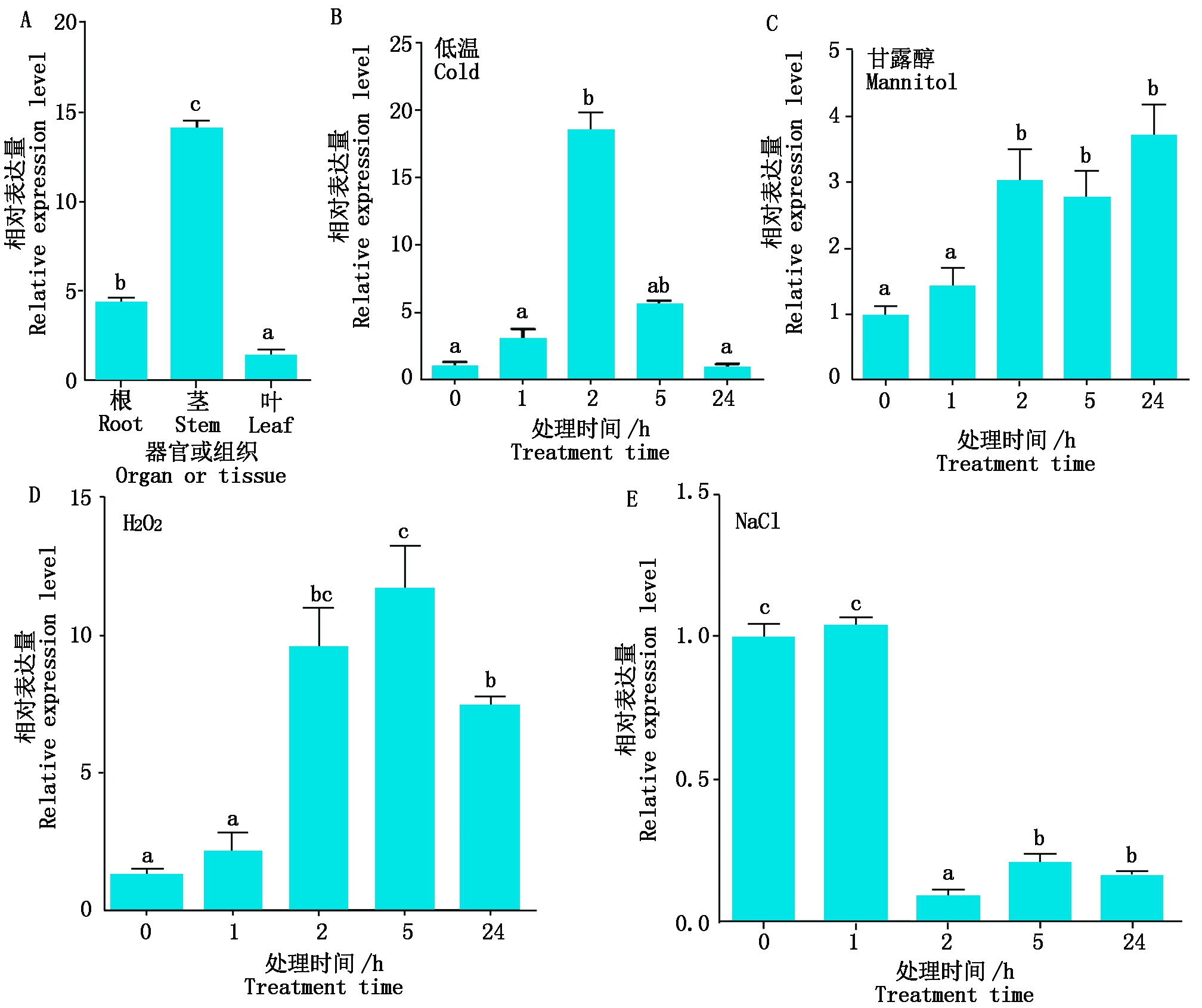
不同字母表示同一胁迫条件下不同植株材料间的差异显著性(显著水平为0.05)。
Different lowercase letters represent the significant differences at the 0.05 level of significance among different plant materials under the same stress condition.
图5 BdDREB1H在不同组织和冷、干旱、氧化、盐胁迫4种胁迫条件下的表达
Fig.5 The expression of BdDREB1H in different organs and under cold,
drought, oxidative or salt stresses
本研究以此为切入点,从二穗短柄草中克隆了一个BdDREB1H 转录因子基因,序列分析表明其编码框为735 bp,编码244个氨基酸。多序列比对和结构域分析表明,BdDREB1H蛋白含有典型的AP2结构域,属于AP2/EREBP超家族中的DREB/CBF家族。进化分析表明,BdDREB1H 转录因子与普通小麦的CBF同源性最高,其次为黑麦草。此外还发现它编码的氨基酸在保守区与其他物种序列同源性非常高,而在非保守区序列变异较大。这种氨基酸组成诠释了DREB/CBF家族成员对靶序列结合的专一性及转录激活功能的多样性。进一步的转录活性分析显示BdDREB1H 转录因子具有明显的转录激活活性。
前人的研究表明,DREB/CBF 家族成员在正常生长条件下,几乎不表达,而在冷、干旱、盐等生物胁迫条件下,表达量变化显著。如水稻DREB1/CBF转录因子参与调控冷信号通路[13];过表达拟南芥DREB1B的丹参提高了植物的耐旱性[5]。异源表达补血草LbDREB提高了植物的耐盐性[22]。本研究通过qRT-PCR分析发现,BdDREB1H基因在不同组织中表达量有显著的差异,其中在根和茎中表达量相对较高。冷处理条件2 h,相对于对照,转录水平上调了6倍,然后随着处理时间的延长,转录水平逐渐下降。干旱和氧化胁迫2 h后,BdDREB1H表达水平显著高于对照组;与之相反,在盐胁迫2 h 后,BdDREB1H转录水平显著下降。因此,推测其在二穗短柄草应对非生物胁迫过程中可能发挥着重要作用。
总之,本研究通过对二穗短柄草BdDREB1H转录因子的克隆、生物信息学分析、表达分析以及转录激活活性等的分析,加深了对BdDREB1H的认识,丰富了植物抗性相关基因的研究内容,为提高麦类、牧草、草坪草等禾本科植物的抗逆分子机制提供了新的研究思路和材料。
[1] 陈军营,李香妞,赵一丹,陈新建. 新型禾本科模式植物——二穗短柄草[J]. 植物生理学通讯,2008,44(4):781-784.
Chen J Y,Li X N,Zhao Y D,Chen X J. A new model plant in Gramineae-Brachypodium distachyon L.[J]. Plant Physiology Communications,2008,44(4):781-784.
[2] 周江鸿,赵素珍,漆小泉. 短柄草与麦类作物的比较基因组学研究进展[J]. 植物生理学报,2011,47(5):421-426. doi:10.13592/j.cnki.ppj.2011.05.001.
Zhou J H ,Zhao S Z ,Qi X Q. Recent progresses in comparative genomics of brachypodium and triticeae crops[J]. Plant Physiology Journal ,2011,47(5):421-426.
[3] Upadhyay R K,Gupta A,Soni D,Garg R,Pathre U V,Nath P,Sane A P. Ectopic expression of a tomato DREB gene affects several ABA processes and influences plant growth and root architecture in an age-dependent manner[J]. Journal of Physiology,2017,214: 97-107. doi:10.1016/j.jplph.2017.04.004.
[4] Kudo M,Kidokoro S,Yoshida T,Mizoi J,Todaka D,Fernie A R,Shinozaki K,Yamaguchi-Shinozaki K. Double overexpression of DREB and PIF transcription factors improves drought stress tolerance and cell elongation in transgenic plants[J]. Plant Biotechnology Journal,2017,15(4):458-471. doi:10.1111/pbi.12644.
[5] Wei T,Deng K J,Gao Y H,Liu Y,Yang M L,Zhang L P,Zheng X L,Wang C G,Song W Q,Chen C B,Zhang Y. Arabidopsis DREB1B in transgenic Salvia miltiorrhiza increased tolerance to drought stress without stunting growth[J]. Plant Physiology and Biochemistry,2016,104:17-28. doi:10.1016/j.plaphy.2016.03.003.
[6] Zong J M,Li X W,Zhou Y H,Wang F W,Wang N,Dong Y Y,Yuan Y X,Chen H,Liu X M,Yao N,Li H Y. The AaDREB1 transcription factor from the cold-tolerant plant Adonis amurensis enhances abiotic stress tolerance in transgenic plant[J]. Int J Mol Sci,2016,17(4):611.doi:10.3390/ijms17040611.
[7] Chen Y X,Huang L K,Yan H D,Zhang X Q,Xu B,Ma X. Cloning and characterization of an ABA-independent DREB transcription factor gene,HcDREB2,in Hemarthria compressa[J]. Hereditas,2016,153:3. doi:10.1186/s41065-016-0008-y.
[8] Liang Y Q,Li X S,Zhang D Y,Gao B,Yang H L,Wang Y C,Guan K Y,Wood A J. ScDREB8,a novel A-5 type of DREB gene in the desert moss Syntrichia caninervis,confers salt tolerance to Arabidopsis[J]. Plant Physiology and Biochemistry,2017,120:242-251. doi:10.1016/j.plaphy.2017.09.014.
[9] Jofuku K D,den Boer B G,Van Montagu M,Okamuro J K. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J]. The Plant Cell,1994,6(9):1211-1225. doi:10.1105/tpc.6.9.1211.
[10] Hao J,Yang J,Dong J,Fei S Z. Characterization of BdCBF genes and genome-wide transcriptome profiling of BdCBF3-dependent and-independent cold stress responses in Brachypodium distachyon[J]. Plant Sci,2017,262(52):52-61. doi:10.1016/j.plantsci.2017.06.001.
[11] Qin F,Sakuma Y,Li J,Liu Q,Li Y Q,Shinozaki K,Yamaguchi-Shinozaki K. Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression in Zea mays L.[J]. Plant and Cell Physiology,2004,45(8):1042-1052. doi:10.1093/pcp/pch118.
[12] Xue G P. The DNA-binding activity of an AP2 transcriptional activator HvCBF2 involved in regulation of low-temperature responsive genes in barley is modulated by temperature[J]. The Plant Journal,2003,33(2):373-383. doi:10.1046/j.1365-313x.2003.01630.x.
[13] Ito Y,Katsura K,Maruyama K,Taji T,Kobayashi M,Seki M,Shinozaki K,Yamaguchi-Shinozaki K. Functional analysis of rice DREB1/CBF-type transcription factors involved in cold-responsive gene expression in transgenic rice[J]. Plant and Cell Physiology,2006,47(1):141-153. doi:10.1093/pcp/pci230.
[14] Shen Y G,Zhang W K,He S J,Zhang J S,Liu Q,Chen S Y.An EREBP/AP2-type protein in Triticum aestivum was a DRE-binding transcription factor induced by cold,dehydration and ABA stress[J]. Theoretical and Applied Genetics,2003,106(5):923-930. doi:10.1007/s00122-002-1131-x.
[15] Novillo F,Medina J,Salinas J. Arabidopsis CBF1 and CBF3 have a different function than CBF2 in cold acclimation and define different gene classes in the CBF regulon[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(52):21002-21007. doi:10.1073/pnas.0705639105.
[16] 高世庆,徐惠君,程宪国,陈明,徐兆师,李连城,杜丽璞,叶兴国,郝晓燕,马有志. 转大豆GmDREB基因增强小麦的耐旱及耐盐性[J]. 科学通报,2005,50(23):2617-2625. doi:10.3321/j.issn:0023-074X.2005.23.010.
Gao S Q,Xu H J,Cheng X G,Chen M,Xu Z S,Li L C,Du L P,Ye X G,Hao X Y,Ma Y Z. Transgenic soybean GmDREB gene enhanced drought and salt tolerance of wheat[J]. Chinese Science Bulletin,2005,50(23):2617-2625.
[17] 宋立立,张亚楠,张兆英,田景汉. 烟草转录因子NtDREB4特性分析及功能鉴定[J]. 分子植物育种,2020,18(15):4918-4923. doi:10.13271/j.mpb.018.004918.
Song L L,Zhang Y N,Zhang Z Y,Tian J H. Characterization and functional identification of tobacco transcription factor NtDREB4[J]. Molecular Plant Breeding,2020,18(15):4918-4923.
[18] 马刘峰,陈芸,任羽,司马义·巴拉提,李玲. 棉花CBF2基因克隆和超表达CBF2棉花增强抗冷性[J]. 植物生理学报,2018,54(2):255-264.doi:10.13592/j.cnki.ppj.2017.0468.
Ma L F,Chen Y,Ren Y,Simayi B L T,Li L. Overexpression of cotton CBF2 gene enhances cold tolerance in transgenic Gossypium hirsutum[J]. Plant Physiology Tournal,2018,54(2):255-264.
[19] Hiraki H,Uemura M,Kawamura Y. Calcium signaling-linked CBF/DREB1 gene expression was induced depending on the temperature fluctuation in the field:Views from the natural condition of cold acclimation[J]. Plant and Cell Physiology,2019,60(2):303-317. doi:10.1093/pcp/pcy210.
[20] Liu Q,Kasuga M,Sakuma Y,Abe H,Miura S,Yamaguchi-Shinozaki K,Shinozaki K. Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,in Arabidopsis[J]. The Plant Cell,1998,10(8):1391-1406. doi:10.1105/tpc.10.8.1391.
[21] 柏星轩,闫雪,要宇晨,宁蕾,王曙光,孙黛珍. DREB/CBF转录因子在植物非生物胁迫中的作用及研究进展[J]. 生物学杂志,2017,34(4):88-93. doi:10.3969/j.issn.2095-1736.2017.04.088.
Bai X X,Yan X,Yao Y C,Ning L,Wang S G,Sun D Z. The role and research progress of DREB/CBF transcription factors in plant abiotic stress[J]. Journal of Biology,2017,34(4):88-93.
[22] Zhao H,Zhao X Y,Li M Y,Jiang Y,Xu J Q,Jin J J,Li K L. Ectopic expression of Limonium bicolor (Bag.) Kuntze DREB (LbDREB) results in enhanced salt stress tolerance of transgenic Populus ussuriensis Kom[J]. Plant Cell,Tissue and Organ Culture ,2018,132:123-136. doi:10.1007/s11240-017-1317-1.