鹿角灵芝(Ganoderma amboinense)隶属于真菌界(Kingdom Fungi) 担子菌纲(Basidiomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceae)灵芝菌属(Ganoderma),多生长在云南的无量山以及海南的尖峰岭、吊罗山等地区,因其菌柄较长,常伴有多个鹿角状分支,无菌盖或偶见小菌盖,表面具漆样光泽、褐红色或紫褐色;鹿角灵芝因生长环境条件变化(如控制CO2的浓度)而形成,自然条件下却极为罕见[1]。鹿角灵芝作为灵芝中的名贵品种,具有抗肿瘤、抗衰老、抑制组织胺释放、增强单核吞噬细胞系与NK细胞功能、护肝、抗HIV病毒以及调节免疫力的作用,其关键药效成分为灵芝三萜和灵芝多糖;试验证明,灵芝三萜类具有迅速提高免疫力的作用,表现在促进淋巴细胞增殖,提高巨噬细胞、NK细胞、T细胞的吞噬能力和杀伤力,并直接和间接毒杀肿瘤细胞[2],同时能够激活化疗药物难以杀死的G0期肿瘤细胞,进行单独和联合毒杀[3];羊毛甾烷型四环三萜的灵芝提取物在研究中显示出对肝恶性肿瘤细胞具有抑制作用,而对正常肝细胞并无抑制效果,其机理为快速降低细胞生长调控蛋白激酶C(Protein kinase C,PKC)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)的活力以及延缓应激活化蛋白激酶(Stress-activated protein kinase,SAPK)的激活[4]。
萜为种类最多的一类天然产物,是异戊二烯聚合物以及其衍生物的总称,分子式为异戊二烯整数倍的烯烃类化合物[5]。萜类在不同物种的生命活动中具有不同的生理功能,如植物激素(脱落酸和赤霉素)、昆虫保幼激素、光合色素(胡萝卜素和叶绿素)、电子载体(质体醌和泛醌)、多糖合成介质(多聚异戊烯磷酸)以及生物膜成分(甾醇),此外,萜类作为次生代谢产物也是鹿角灵芝的关键药效成分[6]。
三萜类物质是由甲羟戊酸途径合成(图1):首先合成活性异戊烯前体,即由三羧酸循环产生的乙酰辅酶A(Acetyl-CoA)与乙酰乙酰辅酶A(Acetoacetyl-CoA)生成3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methylglutary CoA,HMG-CoA),后者还原生成甲羟戊酸(Mevalonic acid,MVA),MVA经数步反应转化成异戊烯基焦磷酸(Isopentenylpyrophosphate,IPP),IPP再经硫氢酶(Sulphydryl enzyme)及异戊烯焦磷酸异构酶(IPP isomerase)转化为二甲基烯丙基焦磷酸(Dimethylallyl pyrophosphate,DMAPP);IPP和DMAPP两者均可转化为半萜,在酶的作用下,头尾相接聚合为牦牛儿焦磷酸(Geranyl pyrophosphate,GPP),GPP经鲨烯合酶(Squalene synthetase,SQS)以法尼酯焦磷酸(Farnesyl pyrophosphate,FPP)为底物,生成鲨烯,进而生成灵芝三萜[7];可见,SQS是生成灵芝三萜的拐点,是催化两分子法尼酯焦磷酸缩合产生鲨烯的关键酶,而鲨烯是生物合成三萜、甾醇、胆固醇等萜烯类重要物质的共同前体,所以SQS是灵芝三萜合成途径的关键酶[8-9]。三萜类物质普遍存在于真核及原核生物的细胞质内,SQS是鹿角灵芝MVA途径中的首个限速酶,目前,已在多个物种中成功克隆并表达,但关于鹿角灵芝三萜代谢调控及合成途径关键酶基因SQS的克隆与表达分析尚未见报道[10]。
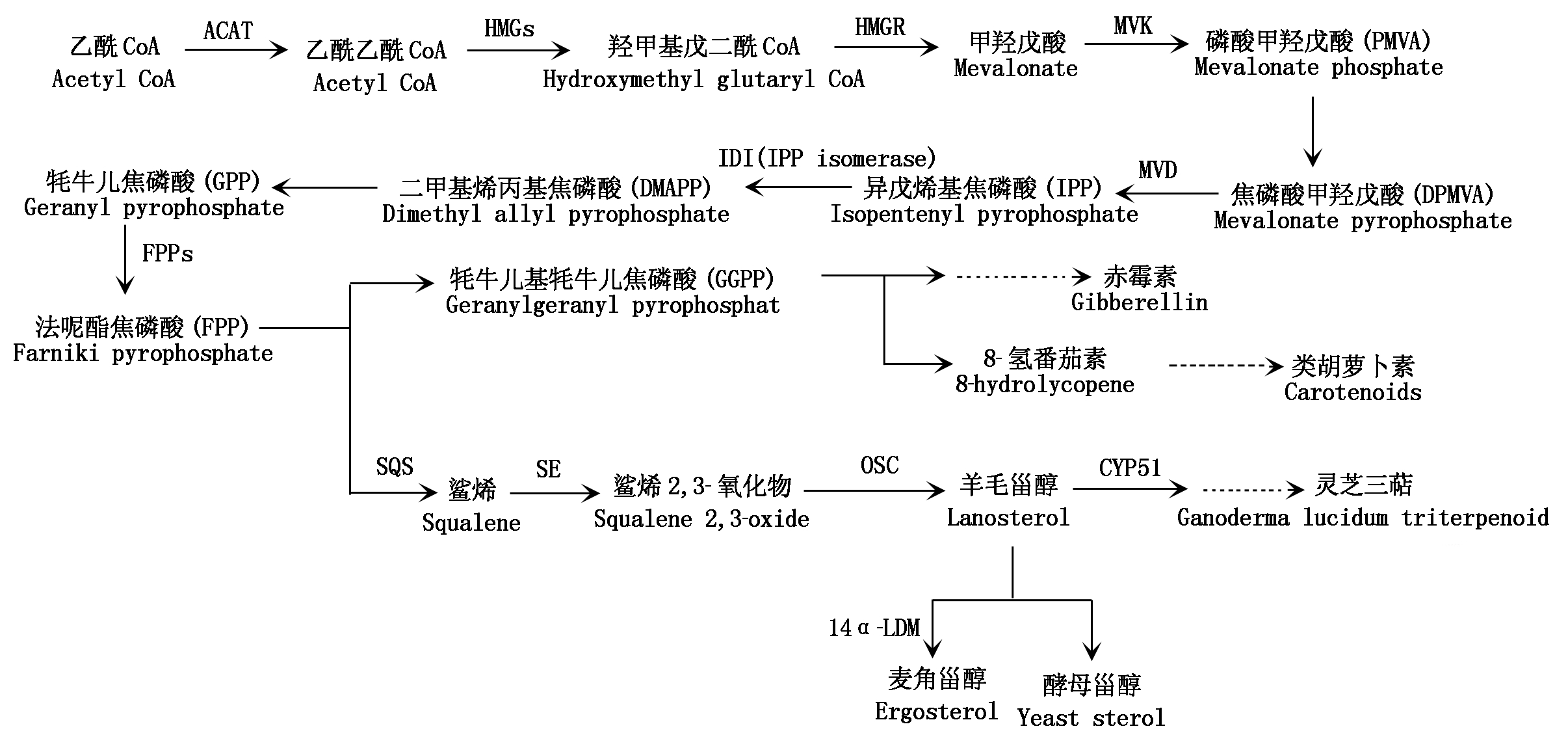
图1 鹿角灵芝三萜合成途径
Fig.1 Biosynthesis of Ganoderma amboinense triterpenoids
目前,对影响鹿角灵芝三萜类化合物含量的研究主要集中在培养基成分上,而合成途径中关键酶基因和药物诱导对灵芝三萜含量的影响未见报道[11]。灵芝三萜含量多少是衡量鹿角灵芝品质的重要指标;本研究参考灵芝(DQ494674.1)的三萜化合物合成关键酶基因SQS,设计引物,采用RT-PCR与RACE技术克隆鹿角灵芝SQS全长基因,命名为GaSQS基因。通过蛋白序列比对、结构域分析、蛋白网络互作以及进化树构建,分析调控灵芝三萜合成的关键酶基因GaSQS的特性,为深入研究GaSQS蛋白的功能,并最终解释鹿角灵芝三萜合成途径的分子机制奠定基础;在鹿角灵芝深层发酵过程中添加外源茉莉酸甲酯(Methyl jasmonate,MeJA),采用qRT-PCR技术分析茉莉酸甲酯在鹿角灵芝生长发育不同时期对灵芝三萜含量诱导影响,有助于揭示鹿角灵芝三萜合成调控的分子机制,以期采用基因工程手段提高鹿角灵芝的药用活性和商品价值打下良好的基础。
1 材料和方法
1.1 试验菌株
鹿角灵芝由辽东学院生物产业研究所提供,鹿角灵芝接种于液体PDA培养基中(250 mL锥形瓶装100 mL PDA培养基),从试管斜面培养的菌株中,挑取5~6块1 cm2菌丝接种到试验培养基中,28 ℃、180 r/min振荡培养8 d,为了研究不同浓度MeJA对GaSQS基因表达的影响,采用乙醇为助溶剂,将MeJA配制成50,100,150,200,250,300 μmol/L,分别加入培养基中诱导12 h,另取一组不加MeJA为对照组[12]。每个处理3个生物学重复,取平均值。
1.2 总RNA提取
收集MeJA诱导后的新鲜菌丝,离心去除上清液,取60~100 mg置于液氮中研磨,研磨彻底成粉末状,按照真菌总 RNA 快速抽提试剂盒(Fungal Total RNA Isolation Kit)步骤抽提鹿角灵芝总RNA,120 V、1%琼脂糖电泳20 min,检测RNA完整性[13]。以鹿角灵芝总RNA为模板,GaSQS1为引物(表1),采用一步法 RT-PCR 扩增试剂盒(M-MuLV)生成cDNA第一链,为克隆鹿角灵芝GaSQS基因核心序列的模板,-20 ℃保存。
表1 引物信息
Tab.1 Primer information

引物名称Primer name 引物序列(5′-3′) Sequence 备注 Note SQS-coreFSQS-coreRGaSQS1-R1GaSQS1-R2GaSQS1-F1GaSQS1-F2GaSQS2-R1GaSQS2-R2GaSQS2-R3GaSQS-FGaSQS-REcoR Ⅰ-GaSQS-FSac Ⅰ-GaSQS-RGaSQS-qFGaSQS-qR18S-RNA-F18S-RNA-RCCGCGTCCTCATCCAATACACTCGCGGAAGTCACGGATAAGAGTGGACAGTTGTCAGCGATTTTTTTTTTTTTTTTTTATGGCCATCGTTTGTGGGATGACTACGCGCATAAAGCAGCCTCGTACAGCTCGTGCATCTGCCTGGACACGATCGAAGATGCTGCTTTATGCGCGTAGTCGTGCGATCCCACAAACGATGGCGCTGCAGAGACGAGTGGGTTCCAGTCTTGTCACGGAGCGGGAATTCGACATGACGCTTCCTGACGAGGGAGCTCCTGCTTTATGCGCGTAGTCGACAGTTGTCAGCGAAGAGCCGTAGTGGCAGTAGAGGTTGTATCGAGTTCTGACTGGGTTGTATCCGTTGCTGAAAGTTGTAT克隆引物RT-PCR特异性引物巢式PCR引物验证引物粗体为酶切位点,下划线为保护碱基基因表达分析内参基因
1.3 鹿角灵芝GaSQS全长基因的克隆
以灵芝(DQ494674.1)SQS基因序列设计引物(表1)SQS-coreF/R,以1.2反转录生成的cDNA为模板,克隆鹿角灵芝SQS基因核心序列,反应体系15 μL,即1 μL cDNA,1.5 μL LA缓冲液 (10×),2.5 μL dNTP Mix,0.5 μL上下游引物(20 μmol/L),0.2 μL LA聚合酶混合液 (5 U/μL),灭菌ddH2O 加至15 μL;PCR反应程序:95 ℃预变性10 min;95 ℃变性10 s,57 ℃退火15 s,72 ℃延伸20 s,40个循环;72 ℃延伸8 min,回收至生工生物工程(上海)股份有限公司测序。以GaSQS核心片段设计GaSQS1-F1/F2特异性正向引物,分别与GaSQS1-R2反向引物组合进行2次巢式PCR,获得鹿角灵芝GaSQS基因3′端;根据GaSQS基因核心片段设计GaSQS2-R1、GaSQS2-R2和GaSQS-R3特异性反向引物,分别与SMARTerTM RACE cDNA Amplication试剂盒中UPM引物组合进行3次巢式PCR,得到GaSQS基因5′端序列,反应条件均同上[14]。
1.4 鹿角灵芝GaSQS全长基因的生物信息学分析
根据GaSQS基因全长序列,采用ORF Finder预测GaSQS基因开放阅读框,在线分析软件Prot Param分析理化特性,Prot Scale分析氨基酸序列的疏水性和亲水性,SWISS MODEL在线软件预测蛋白质三级结构,在String(http://string-db.org/)中预测蛋白互作网络;GenBank数据库BlastP程序预测氨基酸保守域及同源性分析,DNAMAN软件对其同源氨基酸进行多重比对,用ClustalX和MEGA 7.0 软件构建鹿角灵芝GaSQS基因系统进化树[15]。
1.5 茉莉酸甲酯对鹿角灵芝GaSQS基因的诱导表达
采用Primer Premier 6软件设计特异性引物GaSQS-qF/R,以18S-RNA-F/18S-RNA-R为内参引物(表1),通过qRT-PCR对GaSQS基因进行实时荧光定量分析,检测不同浓度MeJA诱导下GaSQS基因表达量的差异[16-17],3次生物学重复取平均值。
2 结果与分析
2.1 鹿角灵芝GaSQS基因cDNA全长克隆
以SQS-coreF/R引物进行RT-PCR扩增,获得972 bp基因片段(图2-A),经BlastP比对表明该片段编码氨基酸与较多多孔科菌类的鲨烯合酶均具较高的同源性(80%~99%),可见,分离得到的片段为鹿角灵芝SQS基因的核心序列;基于SQS基因核心序列,进行5′-RACE与3′-RACE PCR扩增,分别得到676,795 bp的明亮条带(图2-B-C),采用SeqMan程序将5′-RACE、核心序列与3′-RACE 3段DNA序列进行拼接,获得一条长度为1 969 bp的DNA片段。通过ORF Finder 预测SQS基因cDNA为1 515 bp,设计跨ORF引物GaSQS-F/R进行RT-PCR验证,得到约2 000 bp的片段(图2-D),说明该片段包含完整SQS基因的ORF,表明成功获得鹿角灵芝SQS基因的全长序列,即GaSQS。
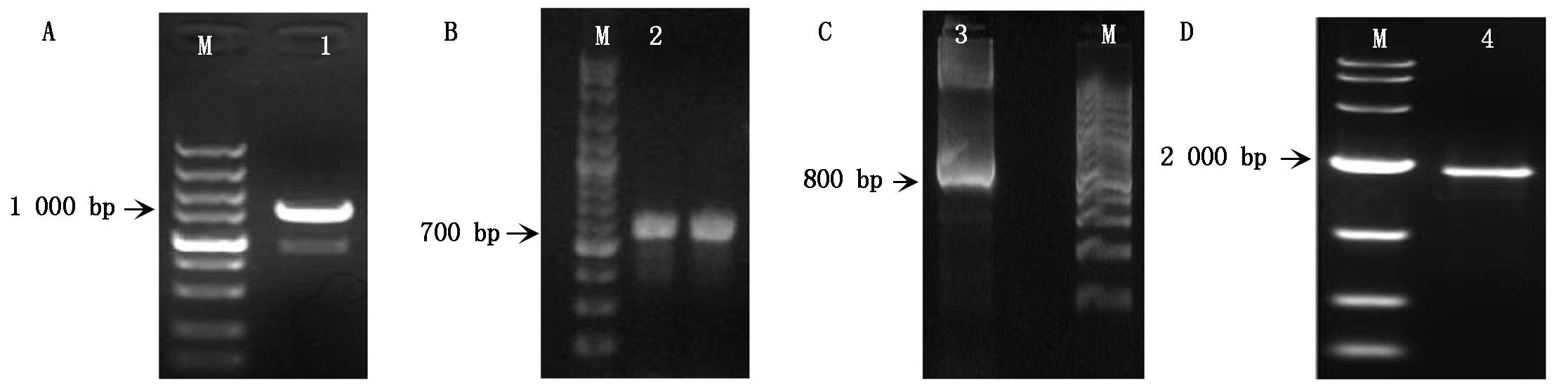
A: M.DL2000 Plus;1.GaSQS基因核心序列;B: M.DL2000 Plus;2.5′-RACE;C: M.DL2000 Plus;
3.3′-RACE;D: M.DL5000;4.跨ORF的GaSQS基因cDNA序列。
A: M.DL2000 Plus;1.Core fragment of GaSQS;B: M.DL2000 Plus;2.5′-RACE fragment of GaSQS;C: M.DL2000 Plus;
3.3′-RACE fragment of GaSQS;D: M.DL5000;4.cDNA fragment of GaSQS containing complete ORF sequence.
图2 GaSQS基因克隆
Fig.2 Cloning of GaSQS gene
2.2 鹿角灵芝GaSQS基因理化特性分析
GaSQS蛋白表达图谱如图3,与2.1预测大小一致。鹿角灵芝GaSQS基因全长为1 969 bp(图4),包含一个1 515 bp的完整开放阅读框(ORF),编码504个氨基酸,其5′-UTR长204 bp,3′-UTR长250 bp,ProtParam 分析表明,GaSQS蛋白质分子式为C2594H4051N735O742S25,含8 147个原子,分子量为58.2 ku,等电点pI为6.62,含有68个带负电荷氨基酸残基,65个带正电荷氨基酸残,亮氨酸(Leu)含量最高(10.3%),半胱氨酸(Leu)含量最高(1.8%),脂肪系数84.98;ProtScale分析表明,GaSQS蛋白亲水性氨基酸数量显著多于疏水性氨基酸数量,242,243位氨基酸残基的亲水性最强(MIN:-2.544),81位的疏水性最强(MAX:3.144),推断GaSQS蛋白为亲水性蛋白;SignalP-4.1预测GaSQS蛋白无信号肽,无剪切位点,说明该蛋白翻译后无需跨膜转运;PSORT Prediction预测蛋白质的亚细胞定位表明,该蛋白质可能存在于细胞质中;Smart在线分析,GaSQS蛋白具有1个跨膜结构域(56~343,9.2e-24);Blast保守结构域预测GaSQS蛋白具有萜类化合物典型的3个保守区:2个酶的底物结合域、底物-Mg2+结合位点与2个富含天冬氨酸域。SOPMA预测GaSQS蛋白二级结构包括α-螺旋(59.52%)、无规则卷曲(28.37%)、延伸链(8.53%)和β-转角(3.57%);SWISS-MODEL预测三级结构(图5)表明,GaSQS蛋白具有由多个α-螺旋形成的中央激活位点空穴区域,符合鲨烯合酶的理化特性,有利于形成底物结合域和催化位点,该区域可与Mg2+结合,而Mg2+又能与底物二磷酸结合,因此,推测该核心部位可能是酶的活性中心。
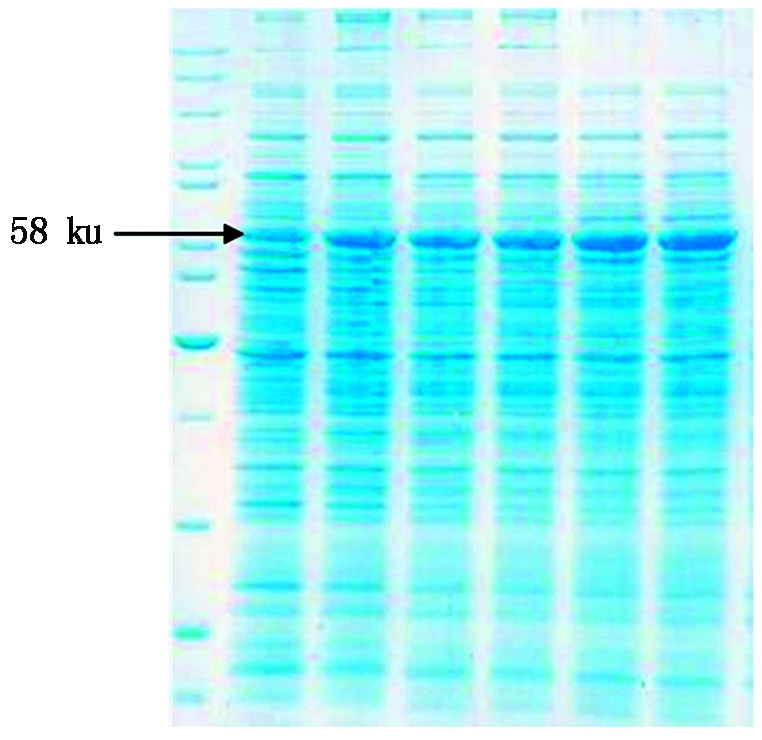
图3 GaSQS 蛋白表达图谱
Fig.3 The picture of GaSQS protein

图4 GaSQS基因的核苷酸序列与氨基酸序列
Fig.4 Nucleotide sequence and amino acid sequence of GaSQS gene
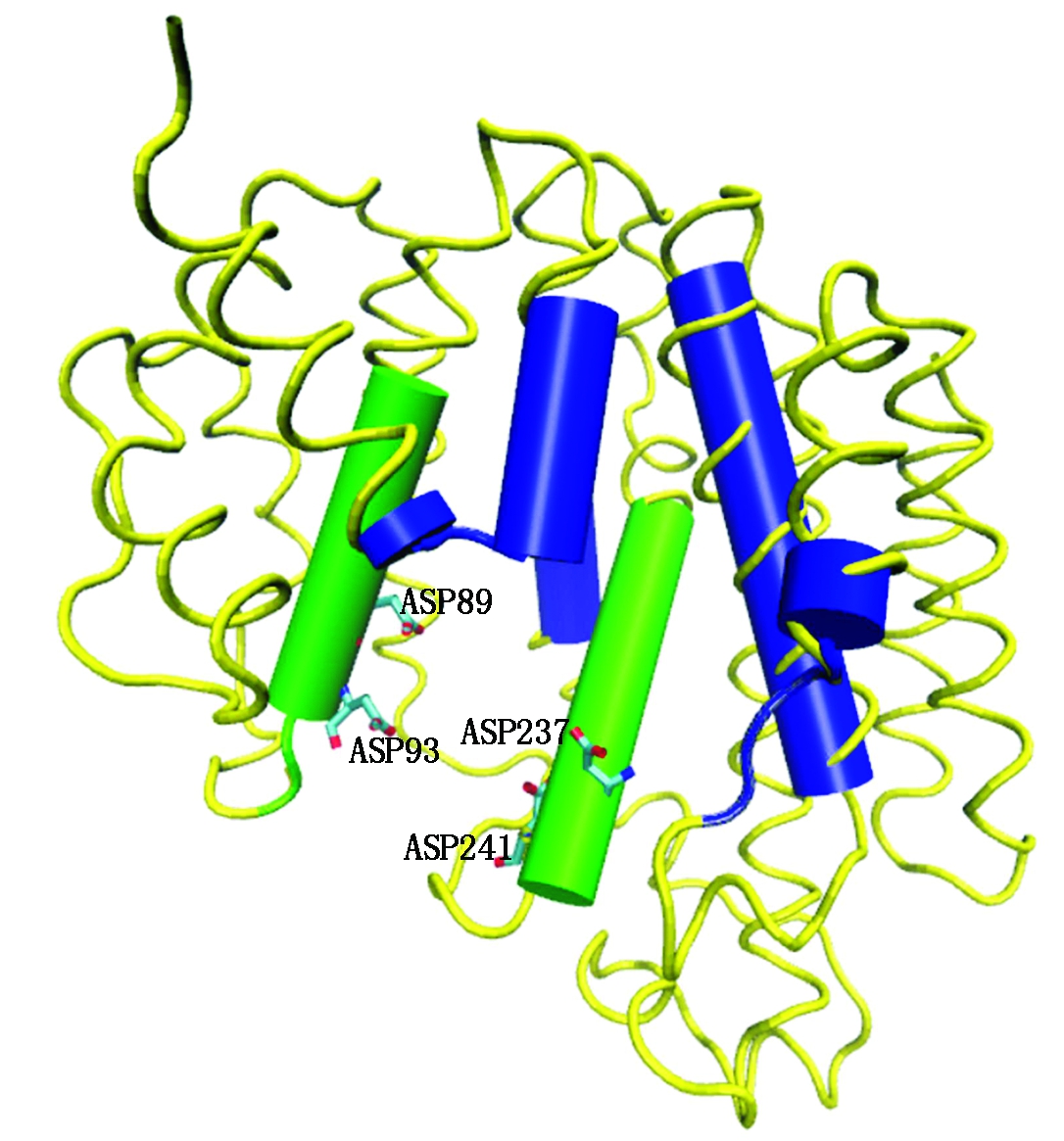
ASP.富含天冬氨酸域;绿色.底物-Mg2+结合位点;
蓝色.酶的底物结合域。
ASP.Rich in aspartic acid region;Green.Substrate-Mg2+ binding site;
Blue.Substrate binding domain of the enzyme.
图5 鹿角灵芝GaSQS蛋白的三级结构
Fig.5 Three-dimensional structure prediction of GaSQS protein
2.3 鹿角灵芝GaSQS蛋白的系统进化分析
经Blast比对,GaSQS蛋白与较多多孔菌科菌类均具有较高同源性(80%~99%),从NCBI 数据库选取16个与GaSQS蛋白高度同源的SQS氨基酸序列,用MEGA 7.0构建SQS蛋白系统进化树(图6)。结果表明,17个SQS氨基酸序列汇聚为两大支,其中木蹄层孔菌(Heliocybe sulcata (TFK48357.1))单独聚为一支,为法呢酯焦磷酸合酶(FPS),另一支均为多孔菌科的鲨烯合酶SQS,鹿角灵芝的GaSQS蛋白与灵芝(Ganoderma lucidum (ABF57213.1))的SQS蛋白表现出较高的同源性(99%),其次是灵芝(AHN91949.1)和紫芝(Ganoderma sinense ZZ0214-1 (PIL24868.1)),三者均属于灵芝属,亲缘关系最为相近,说明该蛋白高度保守。
2.4 鹿角灵芝GaSQS基因表达分析
2.4.1 不同发育阶段GaSQS基因表达水平与含量变化 以GaSQS-qF/R为引物,采用qRT-PCR技术检测GaSQS基因在鹿角灵芝不同发育阶段的相对表达量,即菌丝期、原基期和子实体期。结果表明:GaSQS基因在鹿角灵芝的不同发育阶段表达水平呈动态化波动(图7),菌丝期1~15 d 该基因的表达量有逐渐上升趋势,在原基期达到峰值,子实体期略下降,原基期表达量约为子实体期的1.14倍,约为菌丝期5 d 的4.84倍;提取不同发育阶段的灵芝三萜,在波长551 nm时测定吸光度,并计算灵芝三帖的含量。结果显示,灵芝三帖的含量在原基期最高(4.68 mg/g),约为菌丝期第5天的 3.44倍,与其他发育阶段的含量均存在差异,子实体期三萜含量略有下降趋势,说明鹿角灵芝在原基和子实体初期鲨烯合酶(GaSQS)的表达量与产量均较高。
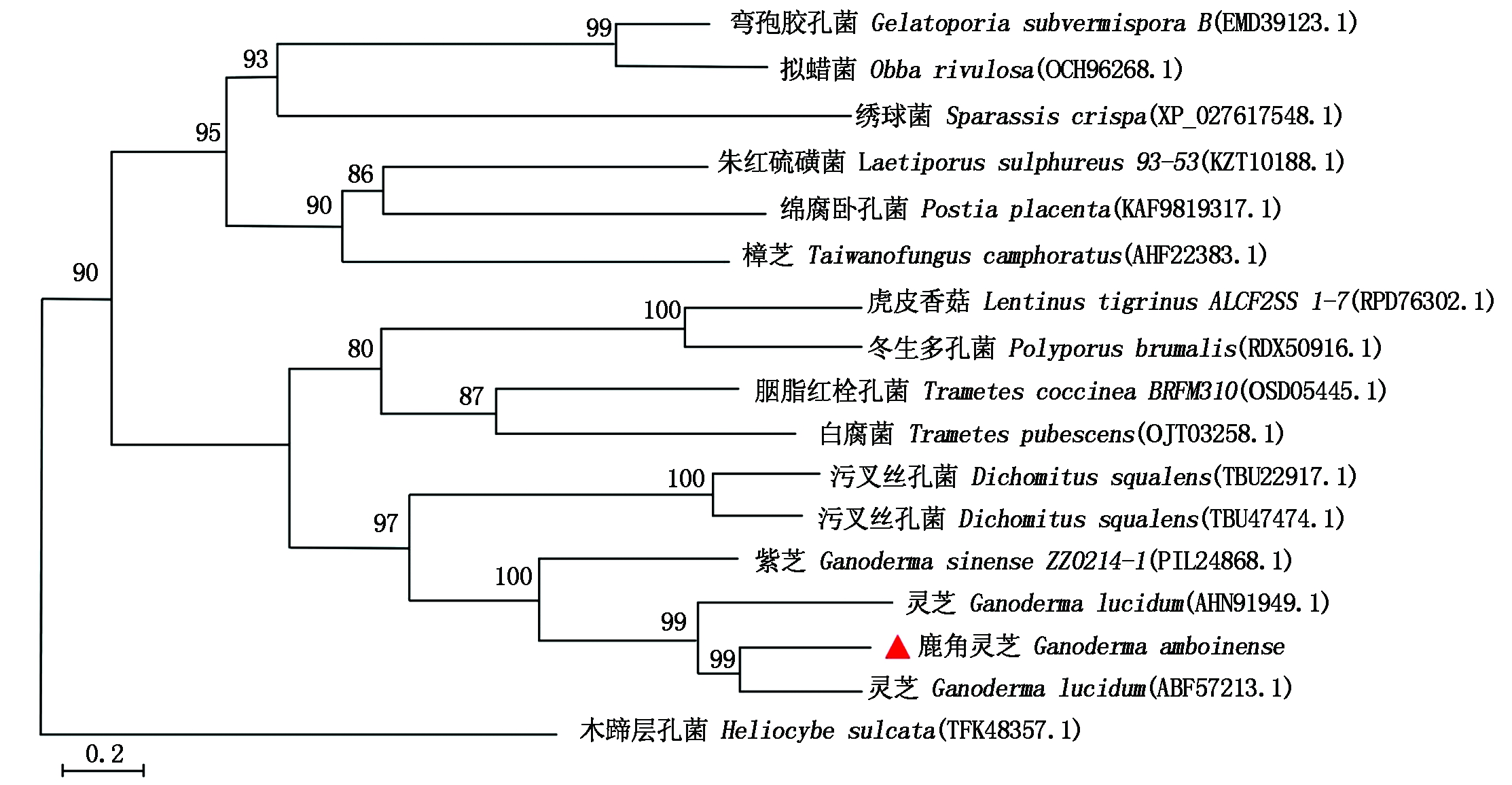
图6 鹿角灵芝GaSQS系统进化关系
Fig.6 Phylogenetic tree analysis of CaSQS in Ganoderma amboinense
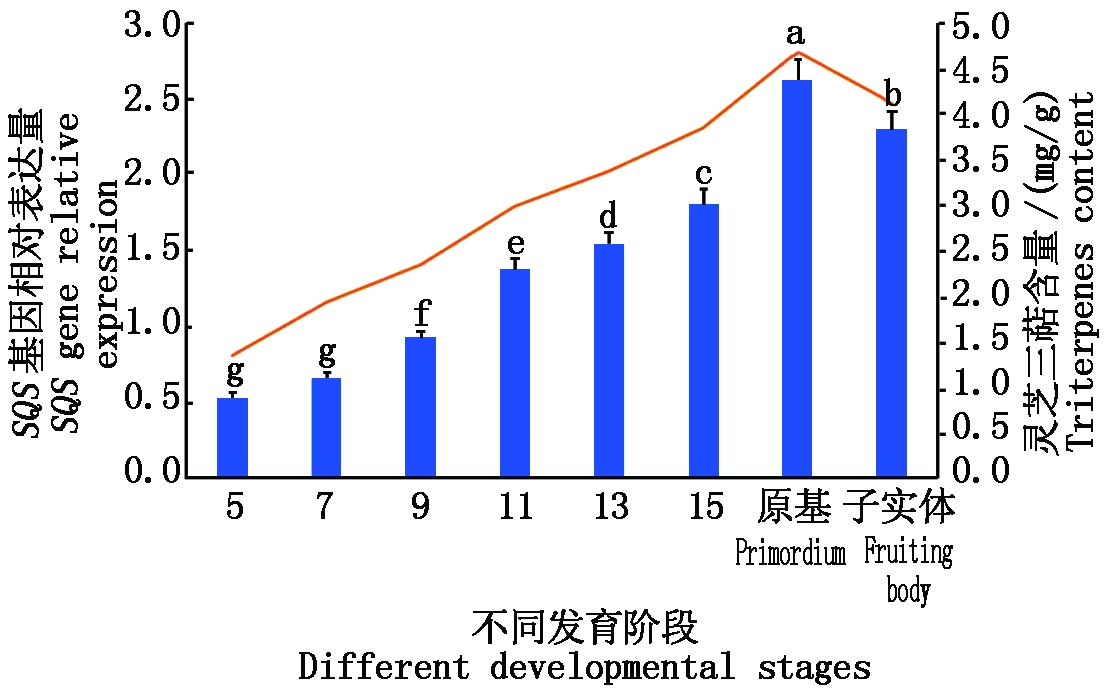
不同小写字母表示处理间差异显著(P<0.05)。图8同。
Different small letters indicate significant difference (P<0.05).
The same as Fig.8.
图7 鹿角灵芝GaSQS基因相对表达量和灵芝三萜含量
Fig.7 Analysis of relative expression of SQS gene and triterpenes content in Ganoderma amboinense
2.4.2 不同浓度茉莉酸甲酯诱导下GaSQS基因表达水平 以浓度为50~300 μmol/L的MeJA处理鹿角灵芝12 h(图8),均能诱导GaSQS基因的高效表达,且相对表达量呈先上升后急剧下降的趋势,其中MeJA的浓度在200 μmol/L时,GaSQS基因的相对表达量达到峰值,约为空白对照组的9.74倍。结果表明,MeJA能诱导灵芝三萜生物合成途径中关键酶GaSQS基因有效表达,提高灵芝三萜产量,当茉莉酸甲酯的浓度为200 μmol/L时诱导表达效果最佳,当浓度大于200 μmol/L时,可能出现抑制作用而诱导效果减弱。
2.5 鹿角灵芝GaSQS蛋白互作网络分析
String蛋白互作网络分析表明,与GaSQS蛋白互作的蛋白质共有10个(图9),即:鲨烯环氧酶、甾醇14α-去甲基化酶、异戊烯基焦磷酸异构酶、甲基固GaSqs.鹿角灵芝鲨烯合酶;Sqle.鲨烯环氧酶;Cyp51.甾醇14α-去甲基化酶; ldi1.异戊烯基焦磷酸异构酶; Msmo1.甲基固醇单加氧酶;Ggps1.牦牛儿基焦磷酸合酶; Lss.羊毛甾醇合酶;Mvd.焦磷酸甲羟戊酸脱羧酶;Sc5d.烯胆固烷醇氧化酶;Fdps.法呢酯焦磷酸合酶;Nsdhl.4α-羧基固醇-3-脱氢酶。
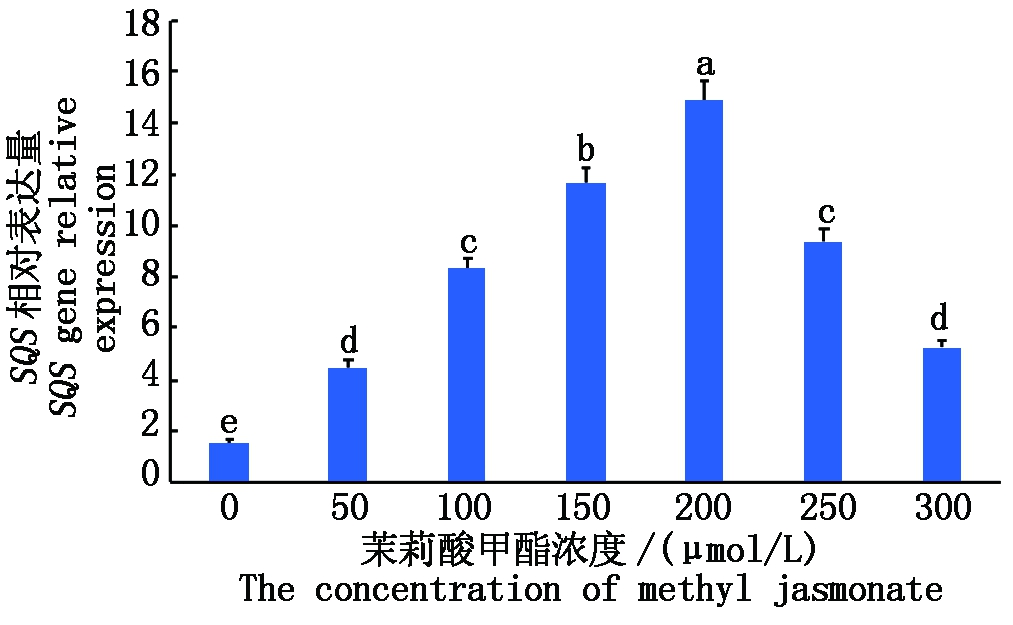
图8 不同浓度MeJA处理鹿角灵芝相对表达量影响
Fig.8 Relative expression level of SQS gene of Ganoderma amboinense in response to different concentration of MeJA
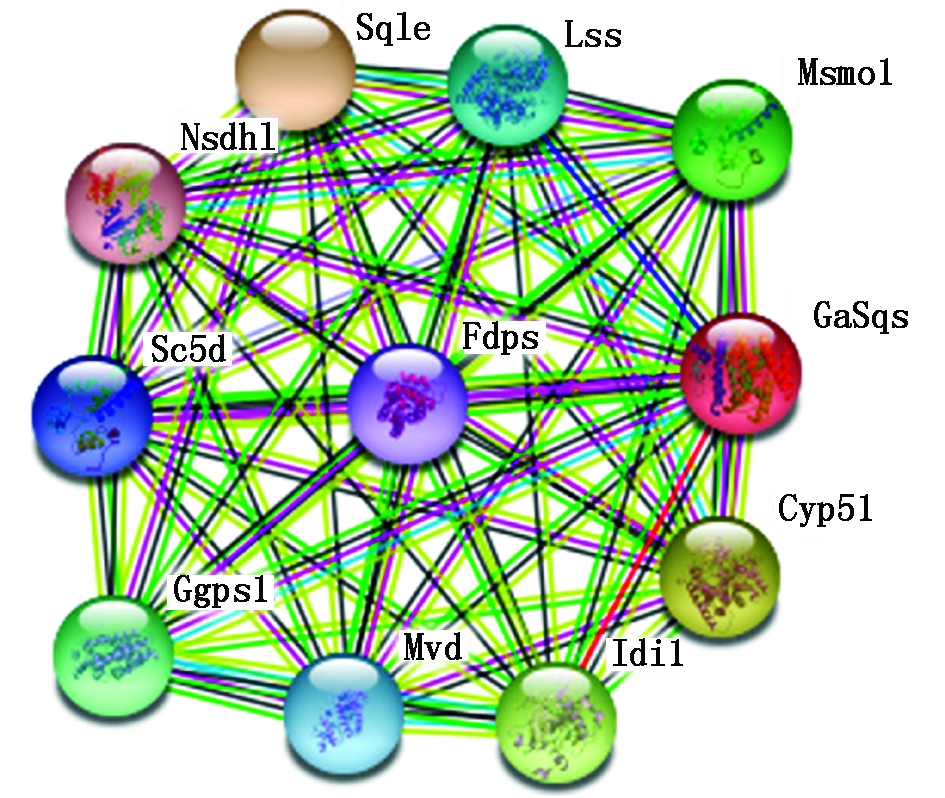
GaSqs. Squalene synthetase of Ganoderma amboinense;Sqle.Squalene monooxygenase;Cyp51.Lanosterol 14-alpha demethylase;Idi1.lsopenteny-diphosphate Delta-isomerase 1;Msmo1.Methylsterol monooxygenase 1;Ggps1.Geranylgerany pyrophosphate synthase;Lss.Lanosterol synthase;Mvd.Diphosphomevalonate decarboxylase;Sc5d.Lathosterol oxidase;Fdps.Farnesyl diphosphate synthase;Nsdhl.Sterol-4-alpha-carboxylate 3-dehydrogenase.
图9 GaSQS蛋白互作网络预测分析
Fig.9 Prediction and analysis of GaSQS interaction protein
醇单加氧酶、牦牛儿基焦磷酸合酶、羊毛甾醇合酶、焦磷酸甲羟戊酸脱羧酶、烯胆固烷醇氧化酶法呢酯焦磷酸合酶和4-羧基固醇3-脱氢酶,这些蛋白均是生物合成三萜、甾醇、胆固醇等萜烯类重要酶类,说明GaSQS是灵芝三萜合成途径中最关键的酶,与灵芝三萜含量的多少有着密切的关系。
3 讨论
近年来,人们对天然药物的需求不断增加,从天然药物中提取高含量、高药效的次生代谢产物已备受关注,萜类次生代谢工程很大程度上解决了药用真菌类天然药物资源短缺的问题,利用次生物质代谢工程调控合成途径的代谢流来提高药效成分的终产量;碍于真菌类生物遗传背景复杂,基因信息挖掘甚少,致使该类生物的次生代谢研究缓慢。随着基因工程与分子生物学技术的不断进步,结合基因组学技术,深入挖掘、分离功能基因,如鹿角灵芝三萜类化合物合成代谢过程中的关键酶基因GaSQS,探究其次生代谢过程,提高灵芝三萜含量具有重要价值,并最终达到调控灵芝三萜合成途径的目的;专家对灵芝三萜具有保肝、抗肿瘤、抗HIV病毒等方面进行了深入的研究,尤其抗肿瘤作用已成为研究的热点,如有效抑制人类肝癌细胞、乳腺癌细胞等多种肿瘤的生长,Gao等[18]发现灵芝三萜可通过抑制血管内皮细胞生长因子的蛋白表达,达到抑制口腔黏膜癌的效果;唐庆九等[19]发现灵芝三萜可导致肠癌细胞凋亡,并对多种肿瘤具有抑制效果;陈洁等[20]发现三萜类化合物对由CCL4导致的小鼠肝脏纤维化抑制明显,并对小鼠肝肉瘤细胞增殖抑制作用较明显,其机制可能是通过降低合成胶原纤维的相关蛋白表达来实现的。本研究通过生物信息学手段挖掘、解析鹿角灵芝功能基因GaSQS的结构与功能,鲨烯合酶(SQS)位于法呢酯焦磷酸(FPP)分支到灵芝三萜合成途径,FPP除了可以被SQS催化生成鲨烯(SQ)外,在其他酶的催化下亦可以生成类胡萝卜素、赤霉素等;可见,SQS是三萜、甾醇、胆固醇等萜烯类生物合成途径中的关键酶,所以SQS的含量与活性决定了后续产物灵芝三萜的产量。本研究通过 RT-PCR与RACE技术克隆了调控灵芝三萜合成限速步骤的关键酶GaSQS全长基因,以期实现利用次生代谢工程手段提高鹿角灵芝有效成分灵芝三萜的含量,以提高鹿角灵芝的品质,为采用分子育种技术改良和培育鹿角灵芝新品种,促进该品种的可持续、优良发展以及次生代谢工程的发展奠定基础。
鹿角灵芝作为大型药用真菌,具有极高的营养价值和保健价值,鹿角灵芝生长的环境条件对灵芝三萜的含量影响显著,通过增加外源诱导物和环境信号作为环境激发子,提高生物合成途径中关键酶的活性和表达量,最终达到提高灵芝三萜产量的目的。MeJA是通过硬脂酸途径产生的脂肪衍生物,存在于大多数植物中,当植物受创后会产生受伤信号,并产生茉莉酸类物质(如MeJA)来提高植物的抗性,所以,MeJA被认为是一种信号分子,能诱导许多植物及真菌类产生生理反应,MeJA对生物体的调节作用主要体现在两方面:一是在转录水平影响次生代谢过程,调节防御系统;二是调控生长发育及衰老等过程。目前,国内外专家致力于将MeJA作为诱导物调控生物次生代谢途径,Lee等[21]研究表明,MeJA可诱导香树素合成酶和鲨烯环氧酶的过表达,提高人参中人参皂苷的含量;Hayashi等[22]研究表明,MeJA不仅能诱导萜烯类化合物大豆皂甙的生物合成,激活氧化鲨烯环化酶和香树素合成酶基因的活性,而且MeJA也可诱导萜类和甾醇类生物合成途径中的关键酶SQS。所以,本试验在鹿角灵芝液体培养条件下,探究添加不同浓度MeJA对灵芝三萜表达量的影响,结果表明,MeJA可以信号分子的形式诱导鹿角灵芝次生代谢物灵芝三萜表达量的增加,调控关键酶基因GaSQS的过表达,提高关键酶的活性,其中当MeJA的浓度为200 μmol/L时,GaSQS基因的相对表达量达到峰值,约为对照组的9.74倍,达到调控灵芝三萜表达的目的。Song等[23]发现MeJA可诱导灵芝细胞内物质运输、蛋白质降解等相关基因的过表达,如SNARE蛋白和泛素连接酶等,SNARE是膜泡运输途径中的关键蛋白,参与真菌产孢和维持细胞壁完整性等过程,推测MeJA可能是通过诱导SNARE蛋白的过表达,进而提高灵芝三萜生物合成途径中GaSQS的转运效率,达到提高灵芝三萜产量的目的,有助于揭示调控灵芝三萜生物合成的分子机制,以期采用基因工程手段提高鹿角灵芝药用成分活性,为其他萜烯类化合物的生物合成调控提供线索与借鉴,此外,深入开展次生代谢产物合成途径的调控研究,有利于培育鹿角灵芝优良品系,为满足市场需求化种植和质量调控提供技术支持,更好地推动中药材品质发展。
[1] 林兴生,林占熺,林辉,林冬梅,罗海凌,胡应平. 菌草鹿角灵芝新菌株栽培特性及活性成分分析[J]. 四川大学学报(自然科学版),2020,57(1):181-185. doi:10.3969/j.issn.0490-6756.2020.01.027.
Lin X S,Lin Z X,Lin H,Lin D M,Luo H L,Hu Y P. Analysis of cultivation characteristics and active components of the new strain of antler-shape Ganoderma lucidum with Juncao[J].Journal of Sichuan University(Natural Science Edition),2020,57(1):181-185.
[2] 夏亚飞,阎姝. 灵芝孢子粉中三萜类化合物的研究进展[J]. 中国中西医结合外科杂志,2020,26(6):1183-1187. doi:10.3969/j.issn.1007-6948.2020.06.033.
Xia Y F,Yan S. Research progress of triterpenoids in Ganoderma lucidum spore powder[J].Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2020,26(6):1183-1187.
[3] Zhang L,Mandry D,Chen B L,Huttin O,Hossu G,Wang H R,Beaumont M,Girerd N,Felblinger J,Odille F. Impact of microvascular obstruction on left ventricular local remodeling after reperfused myocardial infarction[J]. Journal of Magnetic Resonance Imaging,2018,47(2):499-510. doi:10.1002/jmri.25780.
[4] You Y H,Lin Z B. Protective effects of Ganoderma lucidum polysaccharides peptide on injury of macrophages induced by reactive oxygen species[J]. Acta Pharmacologica Sinica,2002,23(9):787-791.
[5] Gimm T,Wiese M,Teschemacher B,Deggerich A,Schödel J,Knaup K X,Hackenbeck T,Hellerbrand C,Amann K,Wiesener M S,Honing S,Eckardt K U,Warnecke C. Hypoxia-inducible protein 2 is a novel lipid droplet protein and a specific target gene of hypoxia-inducible factor-1[J]. The FASEB Journal,2010,24(11):4443-4458. doi:10.1096/fj.10-159806.
[6] Shechter I. The road to squalene synthase[J].Biochemical and Biophysical Research Communications,2002,292(5):1261-1266. doi:10.1006/bbrc.2001.2025.
[7] Nelson D R. Progress in tracing the evolutionary paths of cytochrome P450[J]. Biochimica et Biophysica Acta,2011,1814(1):14-18. doi:10.1016/j.bbapap.2010.08.008.
[8] 孙健,孙婷婷,王旭彤,邹莉. 黑木耳内切葡聚糖酶基因克隆与原核表达[J]. 吉林农业大学学报,2019,41(3):308-315. doi:10.13327/j.jjlau.2019.4587.
Sun J,Sun T T,Wang X T,Zou L. Cloning and prokaryotic expression of endoglucanase gene in Auricularia auricular-judae[J].Journal of Jilin Agricultural University,2019,41(3):308-315.
[9] Shang C H,Shi L,Ren A,Qin L,Zhao M W. Molecular cloning,characterization,and differential expression of a lanosterol synthase gene from Ganoderma lucidum[J].Bioscience,Biotechnology,and Biochemistry,2010,74(5):974-978. doi:10.1271/bbb.90833.
[10] Chen R,Harada Y,Bamba T,Nakazawa Y,Gyokusen K. Overexpression of an isopentenyl diphosphate isomerase gene to enhance trans-polyisoprene production in Eucommia ulmoides Oliver[J].BMC Biotechnology,2012,12(1):78. doi:10.1186/1472-6750-12-78.
[11] Keim V,Manzano D,Fernández F J,Closa M,Andrade P,Caudepón D,Bortolotti C,Vegaó M C,ArróM,Ferrer A. Characterization of Arabidopsis FPS isozymes and FPS gene expression analysis provide insight into the biosynthesis of isoprenoid precursors in seeds[J].PLoS One,2012,7(11):e49109. doi:10.1371/journal.pone.0049109.
[12] Jennings S M,Tsay Y H,Fisch T M,Robinson G W. Molecular cloning and characterization of the yeast gene for squalene synthetase[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(14):6038-6042. doi:10.1073/pnas.88.14.6038.
[13] 王丹丹,鲍佳乐,张雨婷. 朝鲜淫羊藿EkCDPK基因的克隆及表达分析[J]. 西北植物学报,2020(6):918-926.
Wang D D,Bao J L,Zhang Y T. Cloning and expression analysis of EkCDPK gene from Epimedium koreanum nakai[J]. Acta Botanica Boreali-Occidentalia Sinica,2020(6):918-926.
[14] 刘增才,孙婷婷,王世新,马依莎,王旭彤,孙健,邹莉. 暴马桑黄MVD基因cDNA全长克隆及表达特性分析[J]. 南京林业大学学报(自然科学版),2020,44(4):79-85. doi:10.3969/j.issn.1000-2006.201912007.
Liu Z C,Sun T T,Wang S X,Ma Y S,Wang X T,Sun J,Zou L. The cloning and expression analysis of mevalonate pyrophosphate decarboxylase gene cDNA sequence from Sanghuangporus baumii[J].Journal of Nanjing Forestry University(Natural Science Edition),2020,44(4):79-85.
[15] 周琪,刘小萍,薄凯亮,苗晗,董邵云,顾兴芳,张圣平. 黄瓜叶酸合成关键基因克隆与分析[J]. 中国农业科学,2020,53(18):3764-3776.doi:10.3864/j issn.0578-1 752.2020.18.012.
Zhou Q,Liu X P,Bo K L,Miao H,Dong S Y,Gu X F,Zhang S P. Cloning and analysis of folate synthesis key genes in cucumber[J]. Scientia Agricultura Sinica,2020,53(18):3764-3776.
[16] 孙冰沁, 卓晓沁, 何国庆. 油酸诱导对灵芝三萜生物合成途径中关键酶编码基因的影响[J].中国食品学报, 2019, 19(2): 251-257. doi:10.16429/j.1009-7848.2019.02.032.
Sun B Q,Zhuo X Q,He Q G. The effect of oleic acid on biosynthesis of key enzymes of Ganoderma lucidum triterpenoids[J].Journal of Chinese Institute of Food Science and Technology,2019,19(2):251-257.
[17] Kang D,Mutakin M,Levita J. Computational study of triterpenoids of Ganoderma lucidum with aspartic protease enzymes for discovering HIV-1 and plasmepsin inhibitors[J]. International Journal of Chemistry,2015,7(1):62-68.doi:10.5539/ijc.v7nlp62.
[18] Gao Y,Zhang R H,Zhang J,Gao S,Gao W X,Zhang H F,Wang H T,Han B. Study of the extraction process and in vivo inhibitory effect of Ganoderma triterpenes in oral mucosa cancer[J].Molecules,2011,16(7):5315-5332.doi:10.3390/molecules16075315.
[19] 唐庆九,季哲,郝瑞霞,刘艳芳,杨焱,张劲松. 灵芝中性三萜类成分的抗肿瘤作用[J]. 食用菌学报,2010,17(1):60-64.doi:10.3969/j.issn.1005-9873.2010.01.011.
Tang Q J,Ji Z,Hao R X,Liu Y F,Yang Y,Zhang J S. Inhibition of tumor cell proliferation by a neutral triterpenoid fraction from Ganoderma lucidum[J]. Acta Edulis Fungi,2010,17(1):60-64.
[20] 陈洁,史杨娟,罗琳,徐济良. 灵芝三萜对大鼠肝纤维化的保护作用及其机制研究[J]. 中国医院药学杂志,2008,28(9):694-697. doi:10.3321/j.issn:1001-5213.2008.09.004.
Chen J,Shi Y J,Luo L,Xu J L. Protective effect and the mechanism of Ganoderma triterpene on chronic hepatic fibrosis in rats[J].Chinese Journal of Hospital Pharmacy,2008,28(9):694-697.
[21] Lee M E,Singh K,Snider J,Shenoy A,Paumi C M,Stagljar I,Park H O. The Rho1 GTPase acts together with a vacuolar glutathione S-conjugate transporter to protect yeast cells from oxidative stress[J].Genetics,2011,188(4):859-870. doi:10.1534/genetics.111.130724.
[22] Hayashi H,Huang P Y,Inoue K. Up-regulation of soyasaponin biosynthesis by methyl jasmonate in cultured cells of Glycyrrhiza glabra[J]. Plant & Cell Physiology,2003,44(4): 404-411. doi:10.1093/pcp/pcg054.
[23] Song W W,Dou X Y,Qi Z Q,Wang Q,Zhang X,Zhang H F,Guo M,Dong S M,Zhang Z G,Wang P,Zheng X B. R-SNARE homolog MoSec22 is required for conidiogenesis,cell wall integrity,and pathogenesis of Magnaporthe oryzae[J].PLoS One,2010,5(10):e13193.doi:10.1371/journal.pone.0013193.