谷胱甘肽S-转移酶(Glutathione S-transferase,GST)是一类由超基因家族编码的多功能酶,在动植物和微生物中广泛存在[1-3]。其通过催化还原型谷胱甘肽与内源和外来的各种有害物质共价结合,形成复合物,隔离在液泡或转移到质外体,从而将其降解排出,降低其对细胞的损害[1,3-4]。植物GSTs可分为14类:Phi (GSTF)、Tau (GSTU)、DHAR (Dehydroascorbate reductase,脱氢抗坏血酸还原酶,EC 1.8.5.1)、EF1Bγ (Elongationfactor1Bγ)、GHR (Glutathionyl hydroquinone reductase)、Hemerythrin (GSTH)、Iota (GSTI)、Lambda (GSTL)、Theta (GSTT)、Zeta (GSTZ)、mPGES-2 (Microsomal prostaglandin E synthasetype 2)、TCHQD (Tetrachloro hydroquinone dehalogenase)、Ure2p和Metaxin[5]。其中,Phi、Tau、DHAR和Lambda类是植物所特有的[6]。DHAR是抗坏血酸(Ascorbic acid,AsA)-谷胱甘肽循环中的关键酶之一。植物DHAR具有2个典型的结构域:相对保守的GST N-端结构域和变化的GST C-端DHAR结构域,其中N-端结构域是由α螺旋和β折叠组成的类硫氧还原蛋白结构域,C-端DHAR结构域主要由多个α螺旋组成[5,7]。此外,在其N-端结构域中含有一个保守的催化模体CPFS/C[8]。DHAR N-端结构域具有谷胱甘肽特异结合位点,能以谷胱甘肽为还原性底物,催化脱氢抗坏血酸还原成AsA。DHAR能促进AsA再生,对维持植物细胞内AsA的动态平衡具有重要意义[9-10]。
1952年,Yamaguchi和Joslyn[11]首次从豌豆中分离纯化出DHAR。此后,陆续从许多植物中克隆鉴定了DHAR基因,如拟南芥[12]、水稻[13]、玉米[14]和茶树[15]等。研究表明,DHAR除调控植物体内AsA动态平衡外,还调控着植物的活性氧水平、气孔开闭、光合作用和生长发育[16-19]。此外,越来越多的研究证实,DHAR基因在植物非生物胁迫抗性中发挥重要作用[10,20]。Ushimaru等[21]将水稻OsDHAR1转入拟南芥发现,盐胁迫下转基因株系的发芽率和生长情况显著优于非转基因对照,而低温胁迫下转基因株系与非转基因对照表型并无明显差异,表明超量表达OsDHAR1能显著提高转基因植株对盐胁迫的抗性,却未能提高抗寒性。但Le Martret等[22]的研究表明,在烟草中超量表达OsDHAR1同时提高了转基因植株对低温和盐胁迫的抗性。此外,在拟南芥中超量表达油菜BrDHAR基因也显著提高了转基因植株的抗寒性[23]。Eltayeb等[24]将拟南芥AtDHAR1基因转入烟草,发现转基因植株对臭氧、干旱、高盐等非生物胁迫的抗性显著提高。张珊[25]从小麦中克隆了DHAR基因,并在小麦中超量表达该基因,发现转基因植株的DHAR酶活性较非转基因植株显著增加,同时提高了小麦对干旱和氧化胁迫的抗性。
橡胶树(Hevea brasiliensis)作为主要的热带经济作物,是重要工业原料和战略物资天然橡胶的主要来源。我国主要在海南、云南和广东种植橡胶树。这些地区地处热带北缘,属于非传统植胶区,低温、干旱、台风等非生物胁迫严重制约着天然橡胶产业发展。分离鉴定抗逆基因是橡胶树非生物胁迫抗性遗传改良的基础。DHAR基因在植物非生物胁迫抗性中起着重要作用,但迄今为止并未见有关橡胶树DHAR基因的研究报道。本研究克隆了橡胶树HbDHAR2基因,进行了生物信息学和表达模式分析,以期为进一步探究该基因在橡胶树非生物胁迫应答中的功能奠定基础。
1 材料和方法
1.1 植物材料与处理
本研究所用的成熟叶、衰老叶、嫩梢、雌花、雄花、胶乳和树皮组织样品采自中国热带农业科学院试验农场六队的橡胶树品种热研7-33-97,植株2003年种植,2011年开始割胶。根组织样品采自热研7-33-97组培苗,植株已移栽培养8个月。样品采集时,将3株植株的组织样品等量混合作为1次生物学重复,每组织样品采集3次生物学重复。
选取移栽培养8个月的热研7-33-97组培苗健康植株,进行甲基紫精(MV)、过氧化氢(H2O2)、乙烯利(ETH)、水杨酸(SA)、脱落酸(ABA)、茉莉酸甲酯(MeJA)、低温、干旱和高盐处理。其中,MV、ABA和MeJA处理浓度均为200 μmol/L,SA处理浓度为5 mmol/L,ETH处理浓度为10 mmol/L,H2O2处理浓度为20 mmol/L。处理时,将溶液均匀喷洒于植株所有叶片正反面。同时,以喷洒清水的植株作为对照组。低温、PEG (Polyethylene glycol)诱导的干旱及NaCl诱导的盐胁迫处理参照刘辉等[26-27]的方法。4 ℃低温处理在人工气候箱中进行,处理时光照时间为16 h,强度为600 μmol/(m2·s)。PEG6000处理的浓度为20%,NaCl处理的浓度为400 mmol/L,处理时将植株从育苗袋中取出,洗净栽培基质,根部浸没于PEG6000或NaCl 溶液中。在处理0,3,6,12,24,48 h时采集植株第2,3片叶,每处理时间点设3次生物学重复,每重复取自3株植株。样品采集后液氮冻存,用于RNA提取。
1.2 总RNA提取、反转录及目标基因克隆
采用北京百泰克生物技术有限公司的通用植物总RNA提取试剂盒提取叶、嫩梢、雌花、雄花、树皮和根等组织样品总RNA,采用天根生化科技有限公司的多糖多酚植物总RNA 提取试剂盒提取胶乳总RNA,具体提取方法参照试剂盒说明书。采用PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time) (TaKaRa)去除质量检测合格RNA样品中的基因组DNA,并反转录合成第一链cDNA。具体实施方法参照试剂盒说明书。
通过对橡胶树树皮转录组测序数据的注释分析,发现一DHAR基因scaffold0276_83160,以此序列为探针在NCBI数据库中进行Blast,获得该基因的全长序列,GenBank登录号为XM_021823366.1。利用在线程序Primer 3 (http://primer3.ut.ee/)设计扩增该基因完整ORF (Open reading frame,开放阅读框)的引物,正向和反向引物序列分别为5′-TTCCGCTAACCAAGATCACA-3′和5′-TGACAACCACTGGCATACATC-3′。PCR 扩增目标基因,使用的模板为叶片cDNA,PCR反应体系如下:5 μL 5×TransStart® FastPfu Buffer,0.5 μL TransStart® FastPfu DNA Polymerase (2.5 U/μL),2 μL 2.5 mmol/L dNTPs,正、反向引物各0.5 μL(10 μmol/L),2 μL cDNA模板,14.5 μL 灭菌双蒸水。PCR程序设置如下:95 ℃ 3 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。1%琼脂糖凝胶电泳检测PCR产物,并回收纯化目标片段与北京全式金生物技术有限公司的pEASY®-Blunt Simple Cloning Vector连接。连接产物热激转化Trans1-T1 Phage Resistant感受态细胞,并均匀涂于含卡那霉素100 mg/L的LB固体培养基上,37 ℃过夜培养,挑选PCR检测为阳性的单克隆送铂尚生物技术(上海)有限公司进行测序。
1.3 生物信息学分析
利用SoftBerry (http://linux1.softberry.com/)数据库中的FGENESH程序预测基因ORF和编码的氨基酸序列;使用Compute pI/Mw (http://web.expasy.org/compute_pi/)分析HbDHAR2的分子量和等电点;分别采用CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、TMHMM Server v. 2.0 (http://www.cbs.dtu.dk/services/TMHMM/)和ProtScale (http://web.expasy.org/protscale)预测HbDHAR2的保守结构域、跨膜结构域及亲/疏水性;通过NCBI BlastP获取与HbDHAR2同源的其他植物DHAR蛋白序列,利用Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo/)进行多序列比对,并利用MEGA 10.0软件中Neighbor-Joining算法构建系统进化树,Bootstrap重复次数设为1 000。
1.4 实时荧光定量PCR
使用Primer 3设计实时荧光定量PCR (qPCR)分析的HbDHAR2特异引物,正向引物:5′-GATCTCAGGGTGGGAGCCTA-3′,反向引物:5′-CCACTGGCATACATCTCGGT-3′。内参基因选用HbUBC4,正向引物:5′-TCACCCTGAACCTGATAGCC-3′,反向引物:5′-TTTCTTTGGTGACGCTGCAA-3′。qPCR 在Bio-Rad CFX96荧光定量PCR仪上进行,荧光染料采用的是TB Green® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus) (TaKaRa),具体反应体系和反应条件参照试剂说明书实施。采用2-ΔΔCt计算基因相对表达量,结果以3次生物学重复的平均值±标准差表示。使用Excel 2007程序处理试验数据,并制作图表。差异显著性分析采用SAS 8.1软件,显著性检验水平为P<0.05。
2 结果与分析
2.1 HbDHAR2基因克隆及序列分析
从橡胶树HeveaDB数据库(http://hevea.catas.cn/home/index)获取scaffold0276_83160序列,并在NCBI数据库中进行Blast。比对结果表明,该基因序列与GenBank数据库中的XM_021823366.1序列相同。根据该序列设计特异引物,以橡胶树品种热研7-33-97叶片cDNA为模板,采用PCR克隆了该基因(图1)。测序分析表明,扩增获得的基因序列长785 bp,与参考序列完全一致。序列比对结果表明,该基因与其他植物DHAR2基因具有很高的序列一致性,故将该基因命名为HbDHAR2。
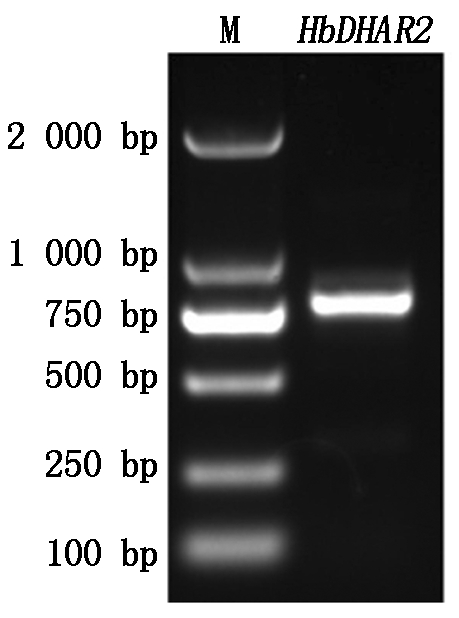
图1 HbDHAR2基因的PCR扩增
Fig.1 PCR amplification of HbDHAR2 gene
基因预测结果表明,HbDHAR2基因ORF长度为639 bp,编码212个氨基酸。预测HbDHAR2蛋白分子量为23.82 ku,理论等电点为5.69。蛋白序列比对及保守结构域预测表明,HbDHAR2蛋白属于GST超家族中的DHAR亚类。HbDHAR2含有2个保守结构域:GST N-端结构域和GST C-端DHAR结构域,分别位于第19-88位和89-209位氨基酸(图2)。此外,在其GST N-端结构域中含有一CPFS/C保守模体(图2)。

图2 HbDHAR2与其他植物DHAR蛋白序列的比对分析
Fig. 2 Multiple sequence alignment of HbDHAR2 and other plant DHAR proteins
TMHMM Server v.2.0预测结果表明,HbDHAR2蛋白不具有跨膜结构域。ProtScale预测结果如图3所示,HbDHAR2氨基酸序列的第9位的丙氨酸分值最大,为1.833,是疏水性最强的氨基酸;第117位的天冬氨酸分值最小,为-2.600,是亲水性最强的氨基酸。HbDHAR2氨基酸序列预测分值为负值的氨基酸数量明显高于分值为正值的氨基酸数量,表明HbDHAR2为亲水性蛋白。
2.2 HbDHAR2蛋白系统进化分析
对橡胶树HbDHAR2、小麦TaDHAR2、水稻OsDHAR1、拟南芥AtDHAR2、棉花GhDHAR2、胡杨PeDHAR2、麻风树JcDHAR2、蓖麻RcDHAR2和木薯MeDHAR2蛋白进行多序列比对分析,结果显示,所分析的DHAR蛋白之间的一致性都在67%以上,说明DHAR在不同植物中较为保守(图2)。HbDHAR2与木薯MeDHAR2 (XP_021624573.1)氨基酸序列一致性最高,达91.94%。其次是蓖麻RcDHAR2 (XP_002523030.1),一致性为85.78% (图2)。进一步构建HbDHAR2与所选其他植物DHAR蛋白的进化树,发现这些DHAR蛋白可分为2组。麻风树JcDHAR2、甜橙CsDHAR2、陆地棉GhDHAR2、雷蒙德氏棉GrDHAR2、榴莲DzDHAR2、亚洲棉GaDHAR2、木槿HsDHAR4聚为一组;橡胶树HbDHAR2与其他8个DHAR蛋白聚为一组,该组又可进一步分为2个亚组。HbDHAR2与木薯MeDHAR2、蓖麻RcDHAR2聚在同一亚组,表明三者亲缘关系最近(图4)。
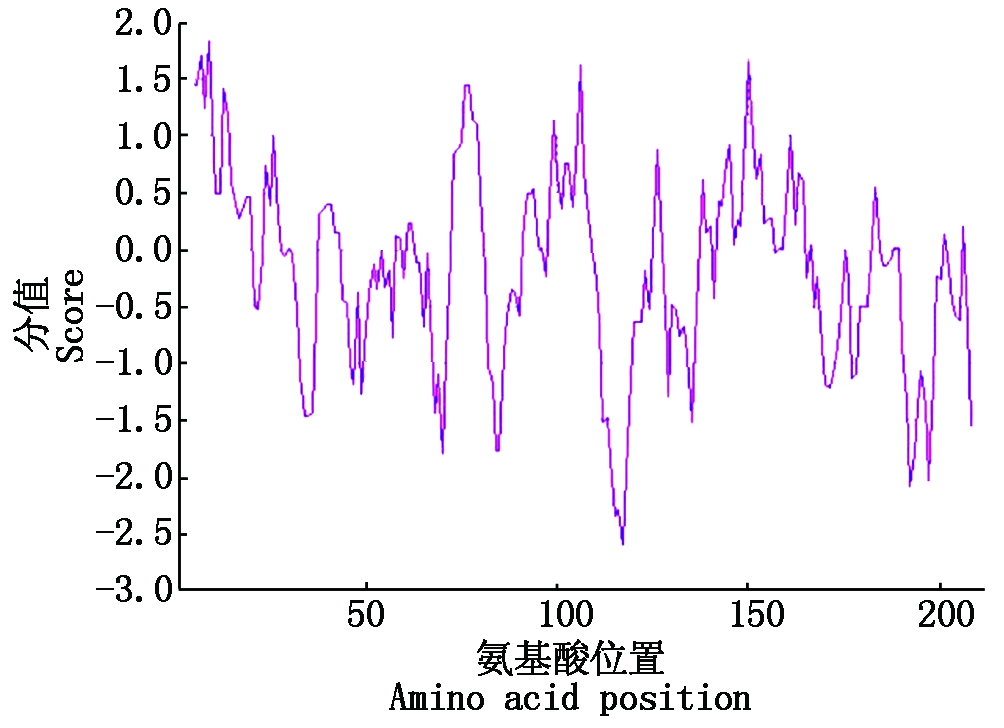
图3 预测HbDHAR2蛋白的亲/疏水性
Fig.3 Predication of hydrophilicity/hydrophobicity of HbDHAR2 protein
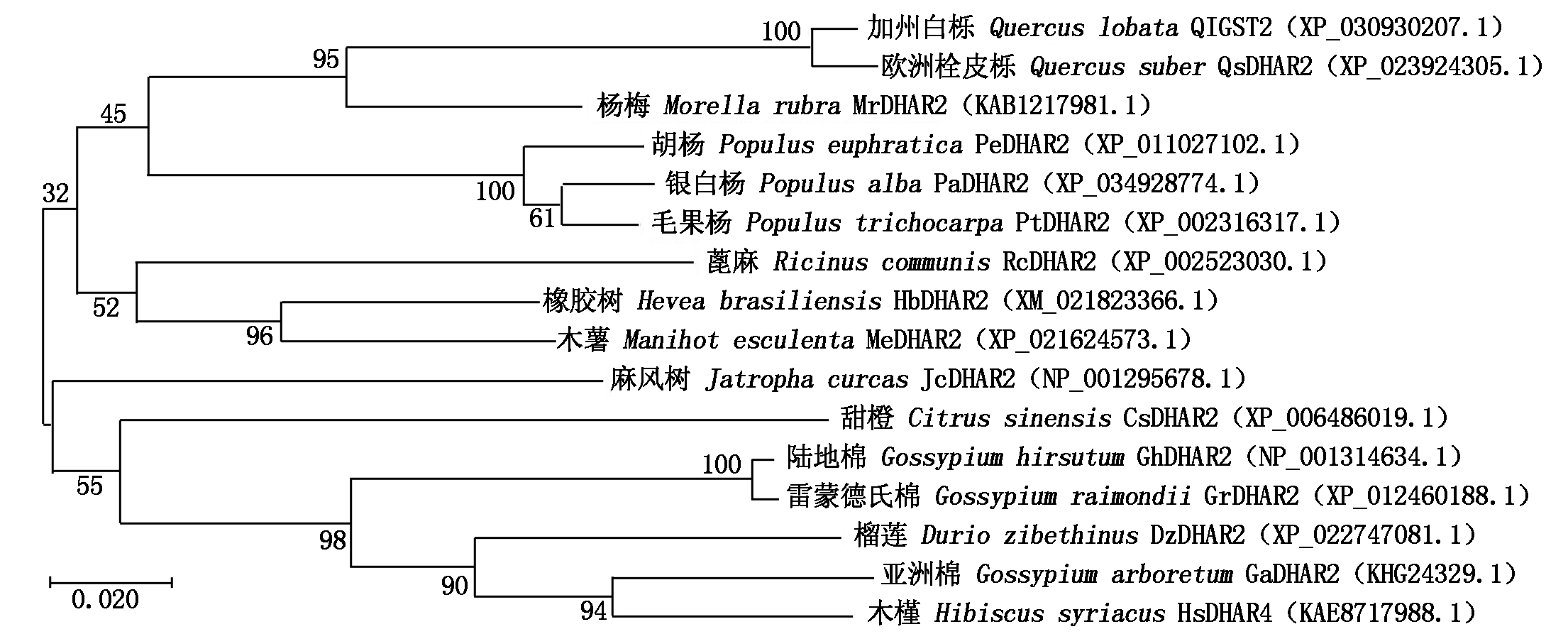
图4 HbDHAR2和其他植物DHAR的系统进化树
Fig.4 Phylogenetic tree of HbDHAR2 and other plant DHAR proteins
2.3 HbDHAR2基因的组织表达模式
如图5所示,在橡胶树根、胶乳、树皮、衰老叶、成熟叶、嫩梢、雄花和雌花中均检测到HbDHAR2基因的表达,但在各组织中的表达量不同,其中,在嫩梢和雌花中的表达量较高,其次是成熟叶,而在胶乳和根中的表达量较低(图5)。比较HbDHAR2基因在衰老叶和成熟叶的表达发现,HbDHAR2在衰老叶中的表达量显著低于成熟叶(P<0.05)。
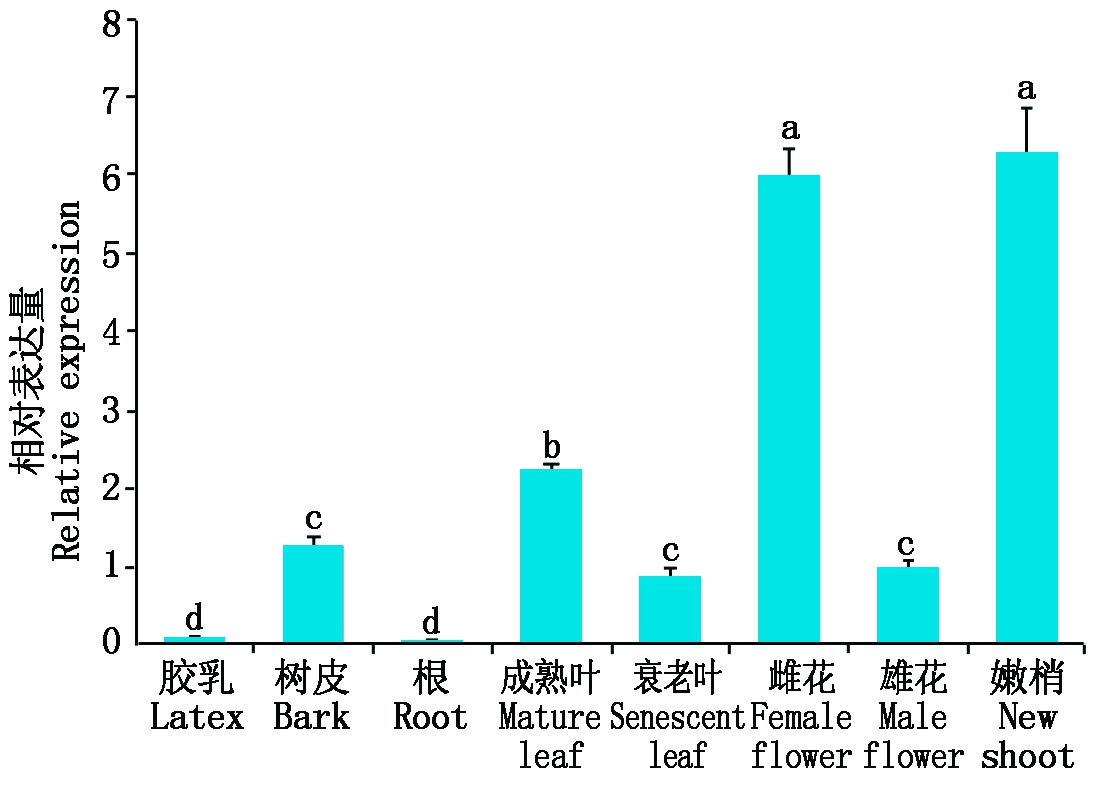
相对表达量的计算以雄花中HbDHAR2的表达量作为对照,其相对表达量为1;不同小写字母表示差异显著(P<0.05)。图6-7同。
The relative expression of HbDHAR2 in various tissues was calculated relative to its expression in male flower,whose expression was designated as 1;Different lowercase letters represent significant difference (P<0.05). The same as Fig.6-7.
图5 HbDHAR2在橡胶树各组织中的表达
Fig.5 Expression of HbDHAR2 in various tissues of Hevea brasiliensis
2.4 激素处理对HbDHAR2基因表达的影响
对照组中,HbDHAR2基因的表达水平基本是稳定的,仅在12 h出现明显下调。ETH、MeJA、SA及ABA处理后,不同时间点叶片中HbDHAR2基因的表达量均显著高于相应对照(P<0.05),说明HbDHAR2的表达受这些激素诱导(图6)。其中,ETH和MeJA处理后,HbDHAR2基因的表达变化趋势相似,均以在处理48 h的表达量最高,分别为对照的9.4,7.6倍,表明在ETH和MeJA处理后期HbDHAR2的响应更强烈。SA处理能快速提高HbDHAR2基因的表达,在处理3 h表达量便达到最高,为对照的7.6倍。ABA处理也能迅速诱导HbDHAR2基因的表达,也以处理3 h的表达量最高,为处理前的6.7倍;此后HbDHAR2基因的表达有所下降,而处理48 h又有所上升,接近3 h的表达量。SA和ABA处理后,HbDHAR2表达量迅速增加,在3 h就达到最大值,表明HbDHAR2基因能快速响应SA和ABA。以上结果表明,ETH、MeJA、SA和ABA处理均能诱导HbDHAR2基因的表达,其中ETH和MeJA处理的诱导效果更明显。
2.5 非生物胁迫下HbDHAR2基因的表达变化
由图7可知,低温胁迫下,叶片中HbDHAR2基因的表达呈先升高后回落趋势,以处理3 hHbDHAR2的表达量最高,是处理前的13.3倍;处理3 h后,HbDHAR2的表达水平逐渐回落,但在3~24 h阶段均显著高于处理前;处理48 h,HbDHAR2的表达量基本回落到处理前正常水平。PEG诱导的干旱和MV诱导的氧化胁迫下,HbDHAR2基因的表达变化趋势相似,处理3 h的表达量较处理前显著上升,6 h明显回落,但处理12 h,表达量再次显著上升,达到最大值,分别为处理前的10.7,6.1倍;处理24 h后,HbDHAR2的表达水平逐步回落,但各处理时间点HbDHAR2的表达量均显著高于处理前。NaCl诱导的高盐胁迫下,HbDHAR2基因的表达量在处理3,6,24 h时均显著高于处理前,其中,处理3,24 h,HbDHAR2基因的表达水平接近,是处理前的3.4倍;而处理48 h,HbDHAR2基因的表达量明显下调,显著低于处理前。H2O2诱导的氧化胁迫下,各处理时间点HbDHAR2基因的表达量均显著高于处理前,其中,处理48 h,HbDHAR2基因的表达量最高,是处理前的4.3倍。上述结果表明,HbDHAR2基因的表达受低温、干旱、高盐和氧化胁迫的诱导,其中受低温和干旱胁迫的诱导表达更强烈。
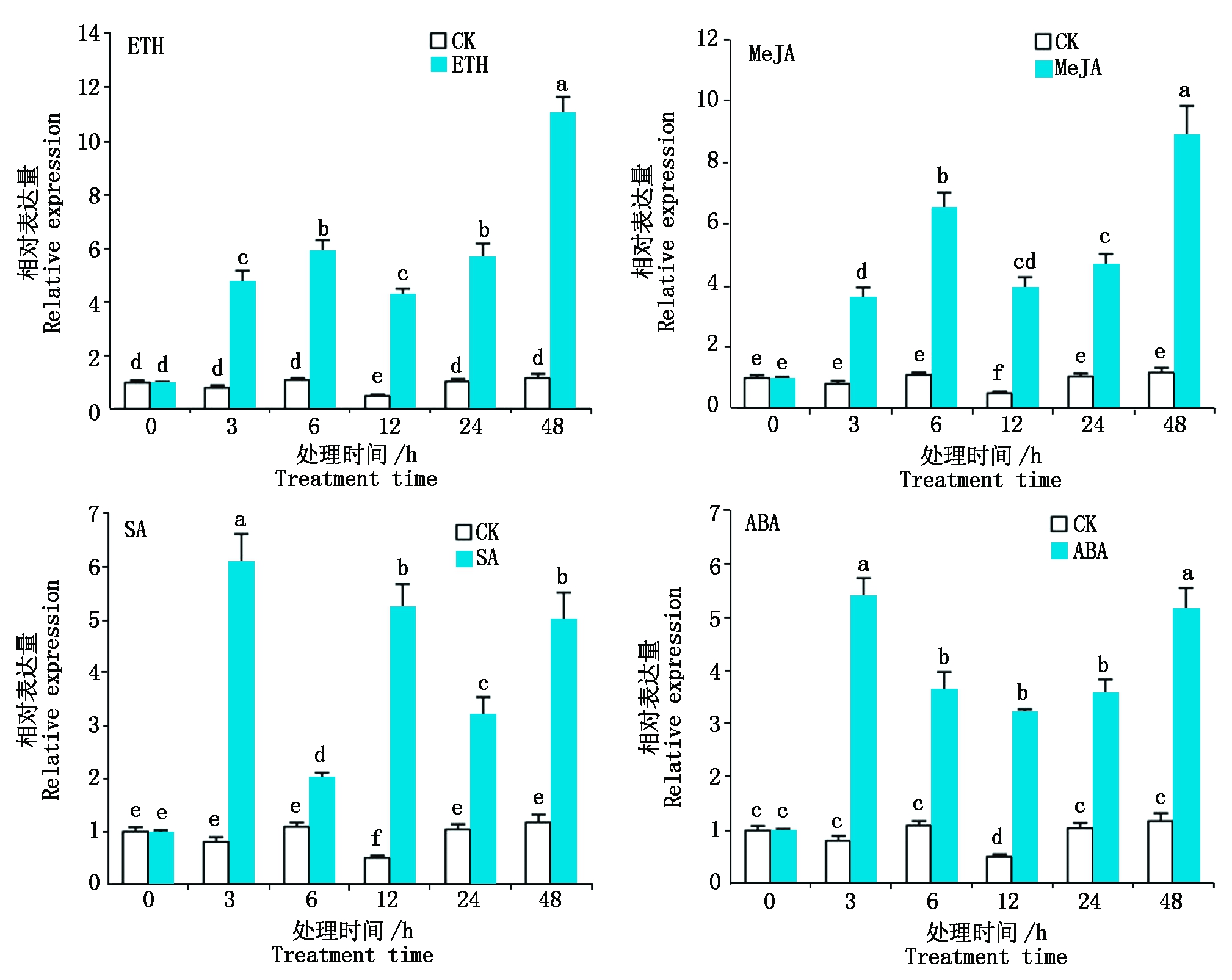
图6 ETH、MeJA、SA和ABA处理后HbDHAR2的表达变化
Fig.6 Expression change of HbDHAR2 after ETH,MeJA,SA and ABA treatments
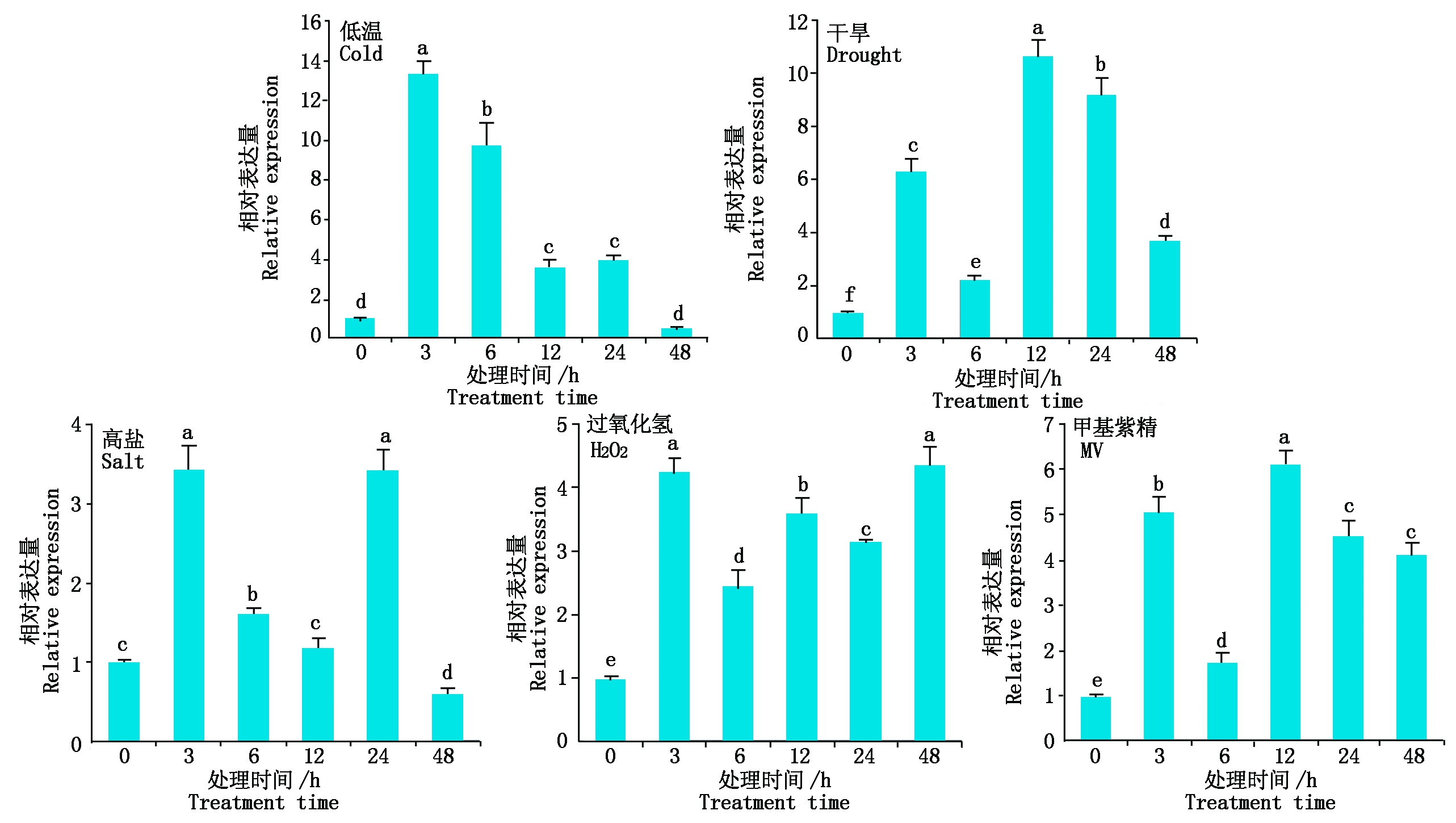
图7 非生物胁迫处理下HbDHAR2的表达变化
Fig.7 Expression change of HbDHAR2 under abiotic stress treatments
3 讨论
本研究从橡胶树中克隆了HbDHAR2基因,保守结构域和序列比对分析表明,HbDHAR2具有典型的GST N-端结构域和GST C-端DHAR结构域,与其他植物DHAR2或DHAR2-like蛋白具有较高的一致性。根据Lallement等[5]对植物GST超家族的分类,HbDHAR2属于GST超家族中的DHAR亚类。在HbDHAR2的GST N-端结构域含有CPFS/C保守基序,该保守基序是所有植物DHAR都具有的[7]。研究表明,CXXS/C基序在氧化还原酶中非常保守,其对于酶氧化还原功能的发挥至关重要[28]。DHAR能将氧化型AsA还原为还原型AsA,是植物AsA再生的关键酶,也是植物体内一种非常重要的抗氧化酶[9-10,18,20]。CXXS/C保守基序可能在DHAR行使功能中扮演着重要角色。
AsA是一种重要的抗氧化剂,能清除植物在光合作用、生物及非生物胁迫等过程中产生的活性氧,从而保护植物细胞免受伤害。除此之外,AsA还调控着植物的生长发育[29]。研究表明,DHAR基因能通过调节AsA水平调控植物细胞的分裂、分化及快速生长[17,30]。本研究通过组织表达谱分析发现,HbDHAR2在橡胶树嫩梢中的表达量最高。嫩梢生长快速,细胞分裂活动旺盛,HbDHAR2在该组织中高表达,推测其可能参与调控枝梢生长发育。此外,HbDHAR2在雌花中也具有很高的表达量,其可能参与了雌花发育调控。Chen和Gallie[17]的研究表明,降低DHAR的表达会加速叶片的衰老,而提高DHAR的表达能减缓叶片衰老。与此相符,本研究发现衰老叶片中HbDHAR2基因的表达水平显著低于成熟叶片,这表明HbDHAR2可能参与调控橡胶树叶片的衰老。
激素在植物对逆境的适应中起着重要作用,其中调控植物生物或非生物胁迫响应的主要激素有ABA、乙烯(ET)、茉莉酸(JA)和SA[31]。当植物受到胁迫刺激后,会激活这些激素信号途径,从而调节下游基因的表达,以抵御逆境胁迫。旨为明确HbDHAR2基因是否受这些激素调控,笔者分析了该基因在ABA、ETH、MeJA和SA处理后的表达变化。结果表明,这些激素处理均能诱导HbDHAR2的表达。ABA是植物抵御非生物胁迫的关键信号分子。在玉米中,ABA处理会快速上调ZmDHAR1基因的表达[14]。与之相似,本研究也发现ABA处理能迅速诱导HbDHAR2的表达,推测HbDHAR2可能通过依赖 ABA的信号途径响应非生物胁迫。除调控非生物胁迫响应外,JA 、SA和ET还是调节植物抗病反应的关键信号分子[31]。HbDHAR2的表达受MeJA、SA和ETH诱导,预示着该基因可能参与了橡胶树对病原菌等生物胁迫的应答。此外,ET对植物的生长发育,特别是植物的成熟和衰老起着非常重要的调节作用。ETH处理后期HbDHAR2具有很高的表达量,结合该基因在嫩梢中高表达而在衰老叶中低表达的特性,推测ETH处理后HbDHAR2的上调表达可能是植株为了延缓ETH诱导的衰老而采取的抵御措施。
非生物胁迫下,DHAR能催化生成更多的AsA,从而有效清除植物体内产生的过量活性氧,提高植物的抗逆性。众多研究表明,植物在遭受非生物胁迫后,DHAR基因的表达会上调[14,15,25]。本研究也发现,低温、PEG诱导的干旱、高盐、MV和H2O2诱导的氧化胁迫均能诱导HbDHAR2的表达,而且在处理3 h就上调很高,这表明该基因能对多种非生物胁迫做出快速应答,HbDHAR2可能在橡胶树响应非生物胁迫中发挥重要的作用。一些研究表明,超量表达DHAR基因能显著提高转基因植株的抗逆性,如水稻OsDHAR1[21-22]、油菜BrDHAR[23]、拟南芥AtDHAR1[24]、小麦DHAR[25]等。超量表达HbDHAR2是否也能提高橡胶树对非生物胁迫的抗性还有待进一步的功能验证分析。
[1] 张雪,陶磊,乔晟,杜秉昊,郭长虹. 谷胱甘肽转移酶在植物抵抗非生物胁迫方面的角色[J]. 中国生物工程杂志,2017,37(3):92-98. doi:10.13523/j.cb.20170313.
Zhang X,Tao L,Qiao S,Du B H,Guo C H. Roles of glutathione S-transferase in plant tolerance to abiotic stresses[J]. China Biotechnology,2017,37(3):92-98.
[2] Edwards R,Dixon D P,Walbot V. Plant glutathione S-transferases:enzymes with multiple functions in sickness and in health[J]. Trends in Plant Science,2000,5(5):193-198. doi:10.1016/s1360-1385(00)01601-0.
[3] Kumar S,Trivedi P K. Glutathione S-transferases:Role in combating abiotic stresses including arsenic detoxification in plants[J]. Frontiers in Plant Science,2018,9:751. doi:10.3389/fpls.2018.00751.
[4] Labrou N E,Papageorgiou A C,Pavli O,Flemetakis E. Plant GSTome:Structure and functional role in xenome network and plant stress response[J]. Current Opinion in Biotechnology,2015,32:186-194. doi:10.1016/j.copbio.2014.12.024.
[5] Lallement P A,Brouwer B,Keech O,Hecker A,Rouhier N. The still mysterious roles of cysteine-containing glutathione transferases in plants[J]. Frontiers in Pharmacology,2014,5:192. doi:10.3389/fphar.2014.00192.
[6] 王俊生,刘红占,范小芳,殷贵鸿,韩玉林,周琳,赵锦慧. 3种小麦DHAR蛋白高级结构建模与功能分析[J]. 分子植物育种,2016,14(9):2472-2480. doi:10.13271/j.mpb.014.002472.
Wang J S,Liu H Z,Fan X F,Yin G H,Han Y L,Zhou L,Zhao J H. Molecular structure and function aanalysis of three DHAR proteins from wheat (Triticum aestivum L.)[J]. Molecular Plant Breeding,2016,14(9):2472-2480.
[7] 成子硕,兰婷,李迪,杨海灵,曾庆银. 江南卷柏脱氢抗坏血酸还原酶的分子特性[J]. 生物工程学报,2011,27(1):76-84. doi:10.13345/j.cjb.2011.01.004.
Cheng Z S,Lan T,Li D,Yang H L,Zeng Q Y. Molecular characterizations of two dehydroascorbate reductases from Selaginella moellendorffii[J]. Chinese Journal of Biotechnology,2011,27(1):76-84.
[8] Liu Y J,Han X M,Ren L L,Yang H L,Zeng Q Y. Functional divergence of the glutathione S-transferase supergene family in Physcomitrella patens reveals complex patterns of large gene family evolution in land plants[J]. Plant Physiology,2013,161(2):773-786. doi:10.1104/pp.112.205815.
[9] 侯艳霞,张文鑫,杨婧,李小艳,郭艳. 植物脱氢抗坏血酸还原酶(DHAR)研究进展[J]. 农业技术与装备,2017 (2):28-29,32. doi:10.3969/j.issn.1673-887X.2017.02.009.
Hou Y X,Zhang W X,Yang J,Li X Y,Guo Y. A review of progress on dehydroascorbate reductase(DHAR) in plants[J]. Agricultural Technology & Equipment,2017(2):28-29,32.
[10] Ding H Y,Wang B P,Han Y,Li S C. The pivotal function of dehydroascorbate reductase in glutathione homeostasis in plants[J]. Journal of Experimental Botany,2020,71(12):3405-3416. doi:10.1093/jxb/eraa107.
[11] Yamaguchi M,Joslyn M A. Purification and properties of dehydroascorbic acid reductase of peas (Pisum sativum)[J]. Archives of Biochemistry and Biophysics,1952,38(1):451-465. doi:10.1016/0003-9861(52)90051-9.
[12] Rahantaniaina M S,Li S C,Chatel-Innocenti G,Tuzet A,Issakidis-Bourguet E,Mhamdi A,Noctor G. Cytosolic and chloroplastic DHARs cooperate in oxidative stress-driven activation of the salicylic acid pathway[J]. Plant Physiology,2017,174(2):956-971. doi:10.1104/pp.17.00317.
[13] Urano J,Nakagawa T,Maki Y,Masumura T,Tanaka K,Murata N,Ushimaru T. Molecular cloning and characterization of a rice dehydroascorbate reductase[J]. FEBS Letters,2000,466(1):107-111. doi:10.1016/s0014-5793(99)01768-8.
[14] 袁进成,马海莲,宋晋辉,宋小青,刘颖慧. 玉米脱氢抗坏血酸还原酶基因的克隆和特性研究[J]. 西北植物学报,2013,33(9):1745-1749.
Yuan J C,Ma H L,Song J H,Song X Q,Liu Y H. Identification and characterization of a dehydroascorbate reductase gene in maize (Zea mays L.)[J]. Acta Botanica Boreali-Occidentalia Sinica,2013,33(9):1745-1749.
[15] 刘婧愉,滕瑞敏,李辉,刘昊,庄静. 茶树DHAR酶基因的克隆与非生物胁迫响应分析[J]. 园艺学报,2020,47(5):983-994. doi:10.16420/j.issn.0513-353x.2019-0684.
Liu J Y,Teng R M,Li H,Liu H,Zhuang J. Cloning and expression analysis under abiotic stress of the DHAR gene in Camellia sinensis[J]. Acta Horticulturae Sinica,2020,47(5):983-994.
[16] Chen Z,Gallie D R. The ascorbic acid redox state controls guard cell signaling and stomatal movement[J]. The Plant Cell,2004,16(5):1143-1162.doi:10.1105/tpc.021584.
[17] Chen Z,Gallie D R. Dehydroascorbate reductase affects leaf growth,development,and function[J]. Plant Physiology,2006,142(2):775-787. doi:10.1104/pp.106.085506.
[18] Terai Y,Ueno H,Ogawa T,Sawa Y,Miyagi A,Kawai-Yamada M,Ishikawa T,Maruta T. Dehydroascorbate reductases and glutathione set a threshold for high-light-induced ascorbate accumulation[J]. Plant Physiology,2020,183(1):112-122. doi:10.1104/pp.19.01556.
[19] Chen Z,Gallie D R. Dehydroascorbate reductase affects non-photochemical quenching and photosynthetic performance[J].The Journal of Biological Chemistry,2008,283(31):21347-21361. doi:10.1074/jbc.M802601200.
[20] Hasanuzzaman M,Bhuyan M H M B,Anee T I,Parvin K,Nahar K,Mahmud J A,Fujita M. Regulation of ascorbate-glutathione pathway in mitigating oxidative damage in plants under abiotic stress[J]. Antioxidants,2019,8(9):384.doi:10.3390/antiox8090384.
[21] Ushimaru T,Nakagawa T,Fujioka Y,Daicho K,Naito M,Yamauchi Y,Nonaka H,Amako K,Yamawaki K,Murata N. Transgenic Arabidopsis plants expressing the rice dehydroascorbate reductase gene are resistant to salt stress[J]. Journal of Plant Physiology,2006,163(11):1179-1184.doi:10.1016/j.jplph.2005.10.002.
[22] Le Martret B,Poage M,Shiel K,Nugent G D,Dix P J. Tobacco chloroplast transformants expressing genes encoding dehydroascorbate reductase,glutathione reductase,and glutathione-S-transferase,exhibit altered anti-oxidant metabolism and improved abiotic stress tolerance[J]. Plant Biotechnology Journal,2011,9(6):661-673. doi:10.1111/j.1467-7652.2011.00611.x.
[23] Shin S Y,Kim M H,Kim Y H,Park H M,Yoon H S. Co-expression of monodehydroascorbate reductase and dehydroascorbate reductase from Brassica rapa effectively confers tolerance to freezing-induced oxidative stress[J]. Molecules and Cells,2013,36(4):304-315. doi:10.1007/s10059-013-0071-4.
[24] Eltayeb A E,Kawano N,Badawi G H,Kaminaka H,Sanekata T,Morishima I,Shibahara T,Inanaga S,Tanaka K. Enhanced tolerance to ozone and drought stresses in transgenic tobacco overexpressing dehydroascorbate reductase in cytosol[J]. Physiologia Plantarum,2006,127(1):57-65. doi:10.1111/j.1399-3054.2006.00624.x.
[25] 张珊. 小麦脱氢抗坏血酸还原酶DHAR基因的克隆与功能分析[D]. 杨凌:西北农林科技大学,2019.
Zhang S. Cloning and functional analysis of dehydroascorbate reductase DHAR gene in wheat[D]. Yangling:Northwest A & F University,2019.
[26] 刘辉,邓治,李德军. 巴西橡胶树HbSAP1基因克隆及表达分析[J]. 热带作物学报,2016,37(3):510-516. doi:10.3969/j.issn.1000-2561.2016.03.014.
Liu H,Deng Z,Li D J. Cloning and expression analysis of HbSAP1 gene in Hevea brasiliensis[J]. Chinese Journal of Tropical Crops,2016,37(3):510-516.
[27] 刘辉,韦永选,邓治,代龙军,杨洪,李德军. 巴西橡胶树WRKY转录因子基因HbWRKY41的克隆与表达分析[J]. 华北农学报,2017,32(5):91-96.doi:10.7668/hbnxb.2017.05.014.
Liu H,Wei Y X,Deng Z,Dai L J,Yang H,Li D J. Cloning and expression analysis of a WRKY transcription factor gene HbWRKY41 in Hevea brasiliensis[J]. Acta Agriculturae Boreali-Sinica,2017,32(5):91-96.
[28] Fomenko D E,Gladyshev V N. CxxS:fold-independent redox motif revealed by genome-wide searches for thiol/disulfide oxidoreductase function[J]. Protein Science,2002,11(10):2285-2296. doi:10.1110/ps.0218302.
[29] Akram N A,Shafiq F,Ashraf M. Ascorbic acid-a potential oxidant scavenger and its role in plant development and abiotic stress tolerance[J]. Frontiers in Plant Science,2017,8:613. doi:10.3389/fpls.2017.00613.
[30] Horemans N,Potters G,De Wilde L,Caubergs R J.Dehydroascorbate uptake activity correlates with cell growth and cell division of tobacco bright yellow-2 cell cultures[J]. Plant Physiology,2003,133(1):361-367. doi:10.1104/pp.103.022673.
[31] Verma V,Ravindran P,Kumar P P. Plant hormone-mediated regulation of stress responses[J]. BMC Plant Biology,2016,16:86. doi:10.1186/s12870-016-0771-y.