由于我国耕地资源短缺,发展设施农业是推进农业结构调整、加快农业供给结构性改革的主要抓手和突破口,也是农民增收、农业增效、农村经济和社会发展的重要推动力。然而,为追求高产,设施蔬菜通常种植指数高、轮作周期短,且水肥、农药投入量高,加上常年处于高温、高湿、高蒸发、无降水淋洗的特殊环境,极易导致土壤酸化、次生盐渍化、土传病害等问题,同时土壤中过量氮磷养分的淋洗会导致水环境污染。这些产区土壤质量退化和生态环境恶化可能进一步影响蔬菜生长过程,不仅导致减产减收,更会威胁食品安全和人类健康[1]。
以往研究中通常使用土壤理化性状来表征或者评估设施栽培条件对土壤质量、蔬菜产量等的影响[2-4]。然而,越来越多的证据表明,传统的理化指标逐渐难以满足对土壤质量与土壤健康研究的需要,而土壤生物学性质则能敏感地反映出土壤环境和健康的变化[5]。土壤微生物是土壤中的关键组分,在促进土壤养分循环利用[6]、保持土壤健康和质量[7]以及污染物降解[8]等过程中发挥着重要作用,是评价土壤质量的重要指标[9]。土壤微生物对环境变化十分敏感,因此,通过土壤微生物性状的变化评估设施土壤质量变化近年来成为研究设施土壤质量保持和功能恢复的热点[10-11]。研究表明,设施农业种植方式显著改变土壤理化性质,进而影响微生物群落,通常表现为多样性随种植年限显著降低[12-13]或者群落组成改变(例如土壤细菌与真菌比值降低、有益菌群减少、病原微生物数量增加等)[10,14-17]。例如,相比于露地蔬菜种植,塑料大棚土壤微生物多样性显著降低,且大棚生产条件增加了微生物的环境胁迫进而导致群落退化[18]。Zhang等[10]在寿光连续11 a试验发现,一年两季番茄栽培使得土壤微生物组成朝着有益菌丰度降低、病原微生物积累的方向演变。大量研究表明,土壤微生物群落失衡是导致设施蔬菜土传病害、连作障碍等加剧的主要原因[19-20]。因此,设施蔬菜种植过程中土壤微生物多样性、群落组成和结构的变化可以作为土壤受损程度和质量变化的重要预警指标,理解土壤微生物及功能群的变化对揭示设施蔬菜栽培条件引起的土壤质量退化微生物学机制及保持设施土壤可持续性具有重要意义。然而,与农田相比,设施土壤微生物研究在我国起步较晚,且多集中在种植年限[10-11,13,15,17,21-22]和施肥[23-25]对设施土壤微生物区系的影响,对不同轮作模式下土壤微生物群落结构与功能变化的认识仍有很大的局限性。
设施番茄是我国主要的蔬菜种植种类,在“菜篮子”工程中占有重要地位;我国是世界上最大的甜瓜生产和消费国,且设施甜瓜种植经济收益较高。因此,番茄-甜瓜轮作可以作为典型的以果实为食用部分的茄科-葫芦科蔬菜轮作模式的代表。该模式已在河北衡水国家农业科技园区广泛推广,周年收益可达到2.8万~3.5万,是当地脱贫致富的重要途径。然而,茄科和葫芦科等茄果类蔬菜的养分和水分需求量明显高于豆科蔬菜和叶菜类作物,“肥大水勤”的管理模式使得氮磷养分投入远超过作物需求,从而导致土壤酸化、地下水污染等环境问题[26]。据估计,西红柿-甜瓜轮作模式下硝态氮和全磷的淋失量每年可分别达到142.7,4.9 kg/hm2 [26]。相比于茄科和葫芦科,豆科蔬菜养分需求量低,这主要是由于豆科植物能够进行固氮作用,从而有助于培肥土壤[27]。因此,引入豆科作物的轮作模式增产[28-29]和环保[30-33]效果已得到广泛认可,然而该体系对土壤微生物群落的影响尚未明确。因此,本研究在河北省饶阳县设施农业定位试验平台,采集西红柿-甜瓜、豆角-甜瓜、西红柿-豆角3种轮作模式下的土壤样品,利用高通量测序技术分析3种模式下土壤微生物多样性、群落组成和结构的差异,并揭示驱动其差异的关键土壤环境因素,以期阐明土壤微生物群落对设施生产条件变化的响应规律,为解析设施土壤质量退化、土壤病害等不利条件的潜在微生物机制,建立作物高产与环境保护协调的养分资源管理体系、维护土壤健康提供科学依据。
本试验在河北衡水国家农业科技园区饶阳县大尹村镇南北岩村(115°50′82″E,38°16′14″N)进行,饶阳县设施蔬菜经过30多年发展,种植规模达千公顷,居全省第一。研究区地属冀中平原黑龙港流域,地貌类型为滹沱河洪积平原,南北岩村设施大棚建于废弃河床之上,土壤类型为潮土,质地为沙壤,地下水埋深3~7 m。年均温12.2 ℃,降雨量552.6 mm,属于温带大陆季风气候。该区典型种植模式为西红柿-甜瓜轮作,秋冬茬为番茄(8-12月),平均产量为67 500~90 000 kg/hm2;冬春茬为甜瓜(1-7月),平均产量约75 000 kg/hm2。
定位试验开始于2018年6月,在典型西红柿-甜瓜轮作中通过引入养分、水分需求量更低的豆角,调整种植制度,共设置3个处理:西红柿-甜瓜、豆角-甜瓜、西红柿-豆角,养分和水分投入量如表1所示,每个处理3次重复,小区面积21.5 m2。试验开始前土壤基础理化性状:容重1.01 g/cm3,黏粒9.6%,砂粒56.6%,有机质45.9 g/kg,NO3--N 147.1 mg/kg,Olsen-P 274.0 mg/kg。
表1 不同轮作模式下周年养分及水分投入量
Tab.1 Annual input of fertilizer and water under different rotation systems

项目 Items 西红柿-甜瓜Tomato-Melon豆角-甜瓜Beans-Melon西红柿-豆角Tomato-BeansN/(kg/hm2)1 583 (775+808)1 244 (437+808)1 212 (775+437)P2O5/(kg/hm2)864 (420+444)845 (401+444)821 (420+401)K2O/(kg/hm2)2 360 (1 162+1 198)1 759 (562+1 198)1 724 (1 162+562)灌溉量/(m3/hm2) Irrigation19 800 (10 800+9 000)13 500 (4 500+9 000)15 300 (10 800+4 500)
注:括号外数据为轮作周年总养分、水分投入量;括号里2个数据分别为轮作体系中2种蔬菜当季投入量。
Note:The data outside parenthesis are annual total nutrient and water input;The data in parenthesis are nutrient and water input in tomato season and melon season,respectively.
土壤样品采集于2020年7月28日西红柿、豆角拉秧并清理完全后进行,每个小区选取3个样方(1 m×1 m),样方间距3 m,每个样方中随机用土钻采集5个表层土壤(0~20 cm)并混合,即每个小区15钻混合为一个样品重复,一共采集9个土壤样品。去除石块、落叶等杂质后充分混匀,分成2份,过2 mm筛,一份用于微生物测定,保存于-20 ℃,一份用于土壤化学性质测定,保存于4 ℃冰箱。
土壤有机质用油浴加热重铬酸钾氧化-容量法测定,土壤全钾用碱熔-火焰光度法测定,土壤总氮用凯氏蒸馏法,土壤硝态氮用紫外分光光度法测定,土壤pH值用1 mol/L KCl浸提(水土比1.0∶2.5)电位法测定,水溶性盐采用电导法测定,土壤总磷用氢氧化钠熔融-钼锑抗比色法,土壤Olsen-P 0.5 mol/L NaHCO3(pH值8.5)溶液浸提(水土比20∶1)钼锑抗比色法测定[26]。
使用OMEGA M5635-02 Soil DNA Kit试剂盒提取土壤DNA,使用NanoDrop ND-2000分光光度计(Thermo Scientific,Wilmington,DE,美国)测定DNA 的质量,送至上海派森诺公司进行Illumina MiSeq高通量测序,使用引物338F(5′-ACTCCTACGGGAGGC
AGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAA
T-3′)对细菌16S rDNA V3V4基因进行扩增,引物ITS5F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS基因进行扩增。测序得到的原始序列经过QⅡME2、DADA2进行质控拼接,去重后得到扩增子序列变异体(Amplicon Sequence Variants,ASV)。采用QⅡME2的classify-sklearn算法对于每个ASV的特征序使用预先训练好的Naive Bayes分类器进行物种注释,得出物种分类水平,对比数据库为Greengenes(Release 13.8,http://greengenes.secondgenome.com/)和UNIT (Release 8.0,https://unite.ut.ee/)。最后对采用QⅡME2的qiime feature-table rarefy功能进行抽平。采用QⅡME2的qiime diversity alpha-rarefaction命令,设置最小抽平深度为10、全体样本中最低测序深度样本序列量的95%,再在这一深度与最小深度之间均匀选取10个深度值,每个深度值抽平10次,计算所选的多样性指数。选取最大抽平深度时的得分平均值作为α-多样性指数。以Chao指数表征丰富度,以Shannon指数表征多样性,以Pielou指数表征均匀度。
使用单因素方差分析(ANOVA)比较3种种植制度下土壤化学性质、微生物α-多样性、细菌及真菌各种群相对丰度的差异,并用Duncan′s multiple range test检验各处理间差异的显著性(P<0.05水平下)。使用Spearman相关性分析土壤微生物多样性指数及各种群相对丰度与土壤化学性质的相关性。方差分析和相关性分析使用IBM SPSS Statistics(v 18.0)进行。不同种植方式下共有/特有的ASV韦恩图计算采用R语言VennDiagram进行。利用随机森林模型(Random Forest)预测显著影响3种轮作模式下土壤微生物群落结构差异的物种(属水平)及其贡献,使用R语言RandomForest进行运算分析,每个物种对预测模型贡献的显著性用软件包rfPermute计算。微生物群落结构及其影响因子使用典型相关分析(Canonical Correlation Analysis,CCA),3种轮作模式下群落结构的差异用PERMANOVA进行检验,使用R语言Vegan包进行。
相比于传统茄科-葫芦科轮作,引入豆科作物的轮作模式每年降低N-P2O5-K2O投入21.38%~23.46%,2.27%~5.04%,25.45%~26.97%,降低水分投入22.73%~31.82%,经过2 a四季肥水管理,不同设施轮作模式主要对土壤硝态氮含量和pH值产生了显著的影响(表2):土壤NO3-N含量在豆角-甜瓜模式下最高,而在西红柿-豆角模式下最低,相比于传统西红柿-甜瓜,西红柿-豆角土壤NO3-N含量降低了65.31%;西红柿豆角模式下土壤pH值显著高于其他2种轮作模式,提高了4.4%~6.8%。
表2 不同轮作模式下土壤化学性质
Tab.2 Soil general properties under different rotations
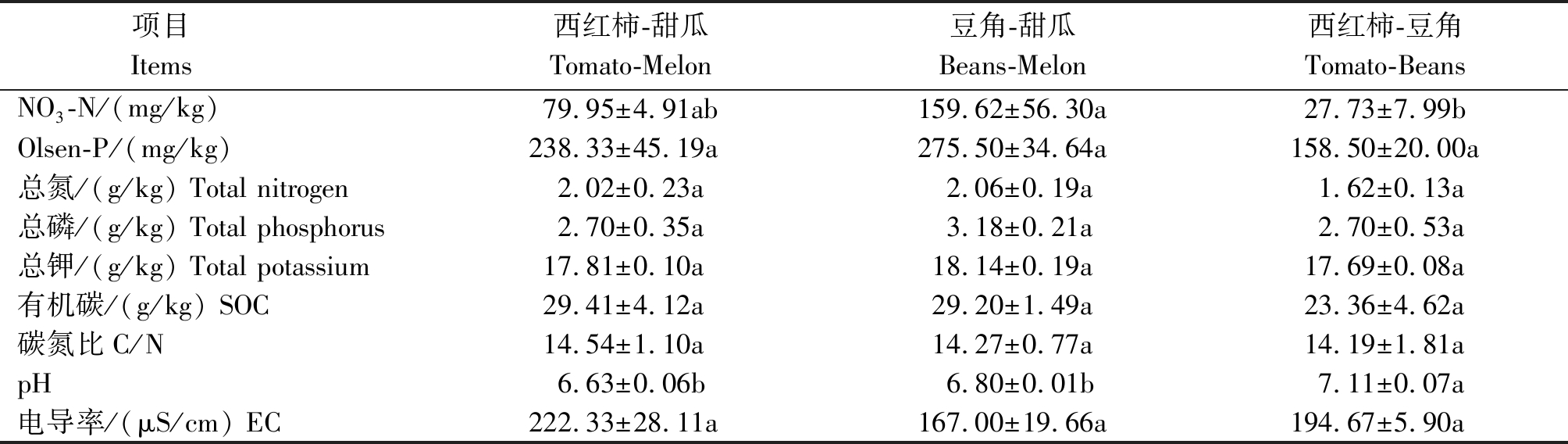
项目 Items 西红柿-甜瓜Tomato-Melon豆角-甜瓜Beans-Melon西红柿-豆角Tomato-BeansNO3-N/(mg/kg)79.95±4.91ab159.62±56.30a27.73±7.99bOlsen-P/(mg/kg)238.33±45.19a275.50±34.64a158.50±20.00a总氮/(g/kg) Total nitrogen2.02±0.23a2.06±0.19a1.62±0.13a总磷/(g/kg) Total phosphorus2.70±0.35a3.18±0.21a2.70±0.53a总钾/(g/kg) Total potassium17.81±0.10a18.14±0.19a17.69±0.08a有机碳/(g/kg) SOC29.41±4.12a29.20±1.49a23.36±4.62a碳氮比C/N14.54±1.10a14.27±0.77a14.19±1.81apH6.63±0.06b6.80±0.01b7.11±0.07a电导率/(μS/cm) EC222.33±28.11a167.00±19.66a194.67±5.90a
注:同行不同字母表示差异显著(P<0.05)。表3同。
Note:Different letters in the same row meant significant difference at 0.05 level.The same as Tab.3.
高通量测序数据经过过滤、去燥、拼接、去除嵌合体及数量为1的序列后,共得到405 515个细菌序列和1 050 999个真菌有效序列。去重后土壤细菌得到9 638个ASVs,不同轮作模式下ASV数量差异不显著(P>0.05)。土壤真菌获得1 146个ASVs,其中西红柿-豆角模式下土壤真菌ASV数量显著低于另2种处理(P<0.05)。
不同轮作模式显著影响土壤微生物α-多样性,但是细菌和真菌的响应特征有区别(表3)。轮作模式显著影响了土壤细菌的均匀度(P<0.05),其Pielou指数在西红柿-甜瓜模式下最高,在豆角-甜瓜模式下最低。而土壤真菌的丰富度对轮作模式有显著响应,其Chao指数在西红柿-豆角模式下显著低于其他2种模式。
表3 不同轮作模式下土壤微生物群落α-多样性指数
Tab.3 Diversity indices of soil microbial community under different rotations
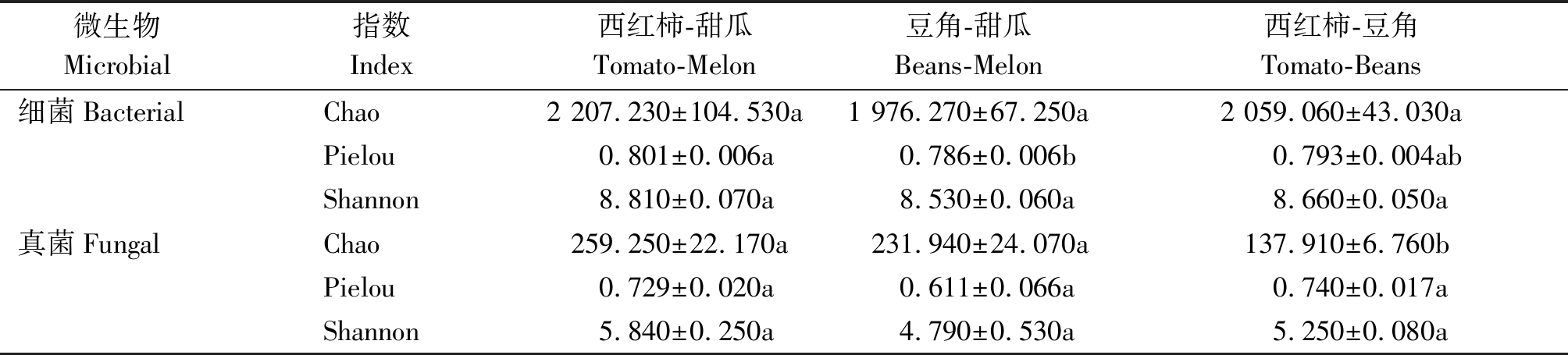
微生物 Microbial指数Index西红柿-甜瓜Tomato-Melon豆角-甜瓜Beans-Melon西红柿-豆角Tomato-Beans细菌BacterialChao2 207.230±104.530a1 976.270±67.250a2 059.060±43.030aPielou0.801±0.006a0.786±0.006b0.793±0.004abShannon 8.810±0.070a8.530±0.060a8.660±0.050a真菌FungalChao259.250±22.170a231.940±24.070a137.910±6.760bPielou0.729±0.020a0.611±0.066a0.740±0.017aShannon5.840±0.250a4.790±0.530a5.250±0.080a
高通量测序获得的土壤细菌ASVs分属于31门100纲231目372科617属,且群落中优势种群(相对丰度大于1%)在不同轮作模式土壤中的分布具有明显差异(图1)。在门水平上,己科河菌门(Rokubacteria)的平均相对丰度在西红柿-豆角模式下((3.15±0.05)%)显著高出西红柿-甜瓜((1.36±0.51)%)和豆角-甜瓜((1.37±0.29)%)约2.3倍。在科水平上,西红柿-豆角土壤中具有显著(P<0.05)较高的亚硝化单胞菌科(Nitrosomonadaceae)((6.20±0.59)%)、Rokubacteriales((3.15±0.29)%)和S085((1.73±0.02)%);西红柿-甜瓜种植制度显著提高了Roseiflexaceae((6.21±0.07)%)和生丝单胞菌科(Hyphomonadaceae)((1.41±0.14)%)的相对丰度;豆角-甜瓜模式则显著提高了甾体杆菌科(Steroidobacteraceae)的相对丰度((1.41±0.27)%)。
土壤真菌ASVs分属于9门28纲55目117科174属,其中子囊菌门(Ascomycota)在3种轮作模式下均是土壤中的优势种群,其平均相对丰度能达到54.37%~69.50%。在门水平下,担子菌门(Basidiomycota)的平均相对丰度在西红柿-豆角种植制度下((13.71±2.50)%)显著最高,分别是西红柿-甜瓜((2.87±0.44)%)和豆角-甜瓜((3.35±0.96)%)的4.8,4.1倍(图2)。土壤真菌优势科中,小不整球壳科(Plectosphaerellaceae)的相对丰度在西红柿-豆角种植制度下显著最高((4.96±0.17)%),是西红柿-甜瓜((1.62±0.93)%)和豆角-甜瓜((1.56±0.51)%)的约3倍。虫草菌科(Cordycipitaceae)和丛赤壳科(Nectriaceae)则在西红柿-豆角种植制度土壤富集,其相对丰度分别是(5.24±1.99)%,(1.34±0.25)%,显著高于其余2种种植制度(分别是虫草菌科(0.52±0.33)%,(0.37±0.19)%和丛赤壳科(0.71±0.36)%,(0.38±0.21)%)。

图1 不同轮作模式下土壤细菌群落组成
Fig.1 Composition of soil bacterial communities under different rotations
韦恩图表明,土壤真菌群落在3种种植制度下的特异性更强(图3)。真菌群落中,3种植制度下共有ASV(66个)占总真菌ASV的5.76%,而共有细菌ASV(1 016个)则占总细菌ASV的10.54%。并且,西红柿-甜瓜、豆角-甜瓜2种种植制度下特有ASV占总ASV的比例均在真菌群落(35.08%,28.45%)大于细菌群落(23.60%,23.27%)。但是在西红柿-豆角模式下真菌特有ASV占总ASV的比例(14.38%)则明显低于细菌(27.43%)。对于2种模式下共有的ASV,无论是细菌还是真菌,均在当季作物相同情况下(即西红柿-甜瓜和豆角-甜瓜,当季为甜瓜)数量最多(细菌652个,真菌107个)。
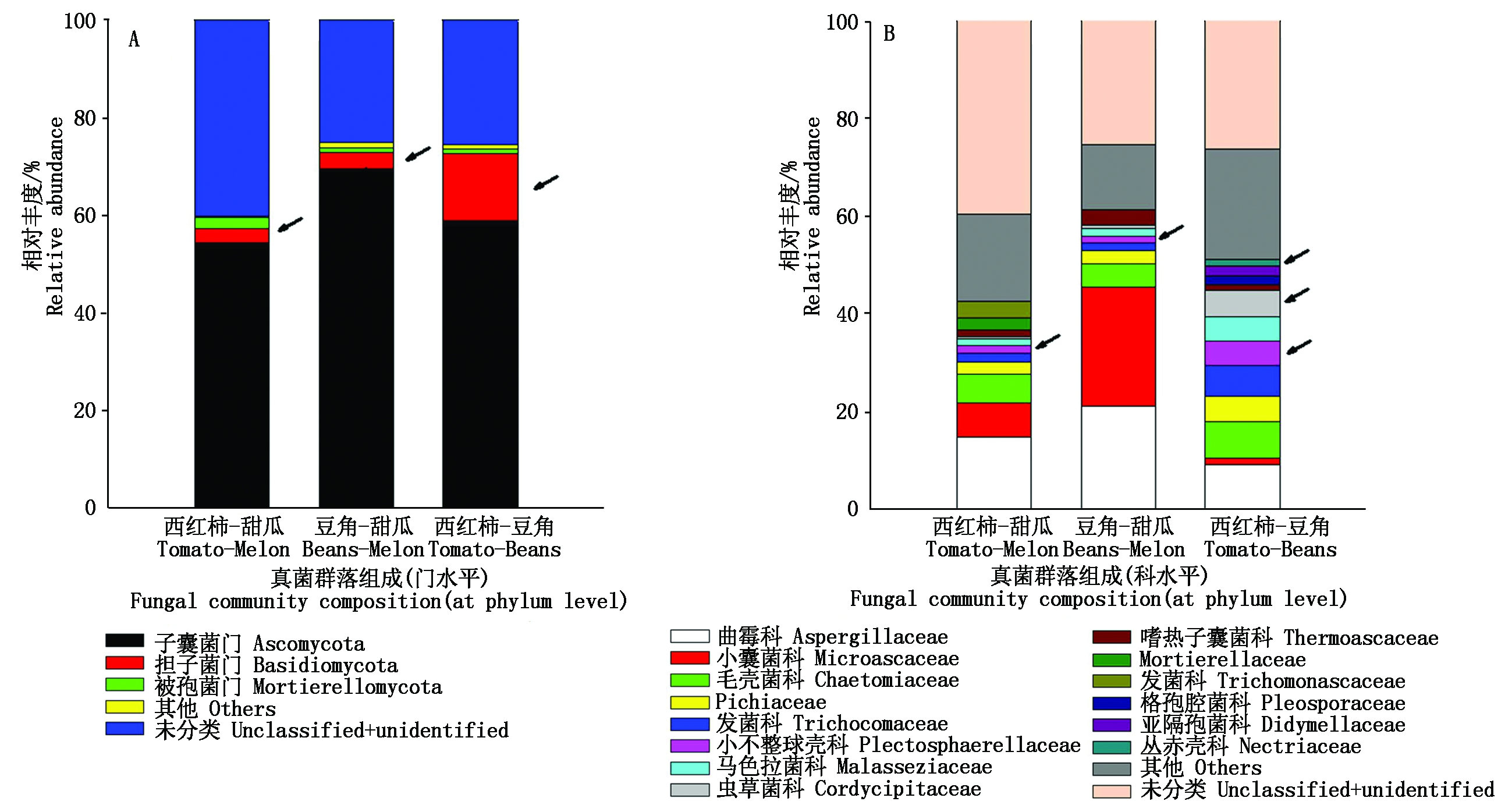
图2 不同轮作模式下土壤真菌群落组成
Fig.2 Composition of soil fungal communities under different rotations
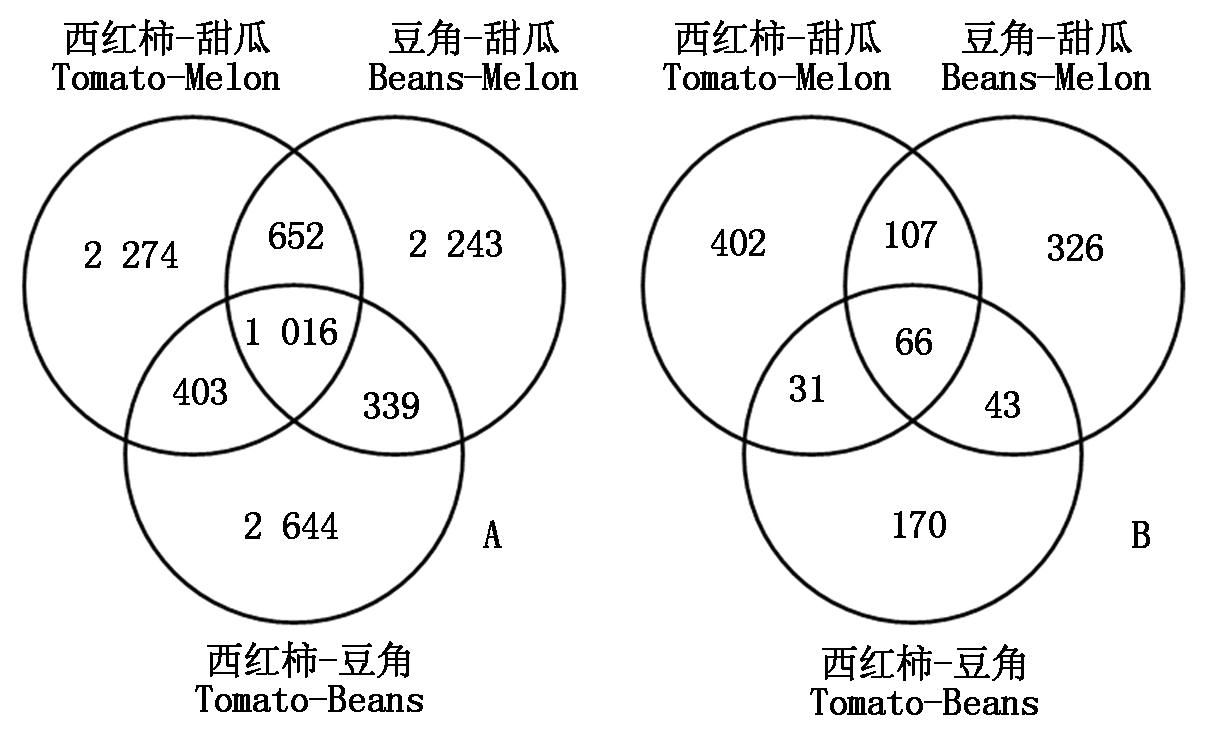
图3 不同轮作模式下土壤细菌(A)和真菌(B)群落韦恩图
Fig.3 Venn diagram of soil bacterial(A)and fungal(B) ASVs under different rotations
随机森林模型揭示了对预测3种种植制度下土壤微生物群落构建差异有显著(P<0.05)贡献的细菌和真菌种群。土壤细菌群落构建在3种种植制度下的差异主要受SWB02(贡献量2.15%)、0319-6G20(1.95%)、Blastocatella(1.95%)、Dokdonella(1.92%)等种群的显著影响,且这些种群大部分属于Proteobacteria、Acidobacteria、Actinobacteria等主要细菌门。其中,Gemmatirosa (Gemmatimonadetes)、SWB02 (Proteobacteria)等种群在西红柿-甜瓜土壤中显著富集;Microbispora (Actinobacteria)、Dokdonella (Proteobacteria)等种群在豆角-甜瓜土壤中显著富集;MND1(Proteobacteria)、IMCC26256 (Acidobacteria)等种群在西红柿-豆角土壤中显著富集(图4)。对于土壤真菌,显著影响不同种植制度下群落构建差异的属主要为Verticillium(贡献量3.20%)、Blastobotrys(3.17%)、Kernia(2.91%)、Dokmaia(2.30%)等8个属,集中在2个门,并且不属于群落中的优势种,相对丰度均低于5%,其中Blastobotrys(Ascomycota)、Kernia(Ascomycota)显著在西红柿-甜瓜土壤中富集;Verticillium (Ascomycota)、Dokmaia(Ascomycota)、Ceriporia (Basidiomycota)显著在西红柿-豆角土壤中富集(图5)。
相关分析表明,土壤pH值与真菌多样性(Chao指数)有极显著负相关性(P<0.01),而细菌多样性指数则与土壤理化性质没有显著相关性(表4)。细菌和真菌优势种群的相对丰度也显著受到土壤理化性质的影响:其中,相对丰度与pH值、NO3-N和土壤总氮的相关性最强,与Olsen-P、土壤总钾和C/N的相关性次之(表4)。大部分细菌种群的相对丰度受到多个土壤性质的综合影响,并且不同种群与土壤因子的相关性有明显区别。例如,Rokubacteriales、OM190与NO3-N显著负相关,与pH值显著正相关;而Roseiflexaceae、链孢囊菌科(Streptosporangiaceae)则与NO3-N显著正相关,与pH值显著负相关。相比于细菌,大部分真菌种群仅受到1~2个土壤因子的影响,并且这些种群相对丰度与土壤因子的相关性基本一致:例如,小不整球壳科(Plectosphaerellaceae)与NO3-N极显著负相关,虫草菌科(Cordycipitaceae)等与NO3-N显著负相关,而与pH值显著正相关。
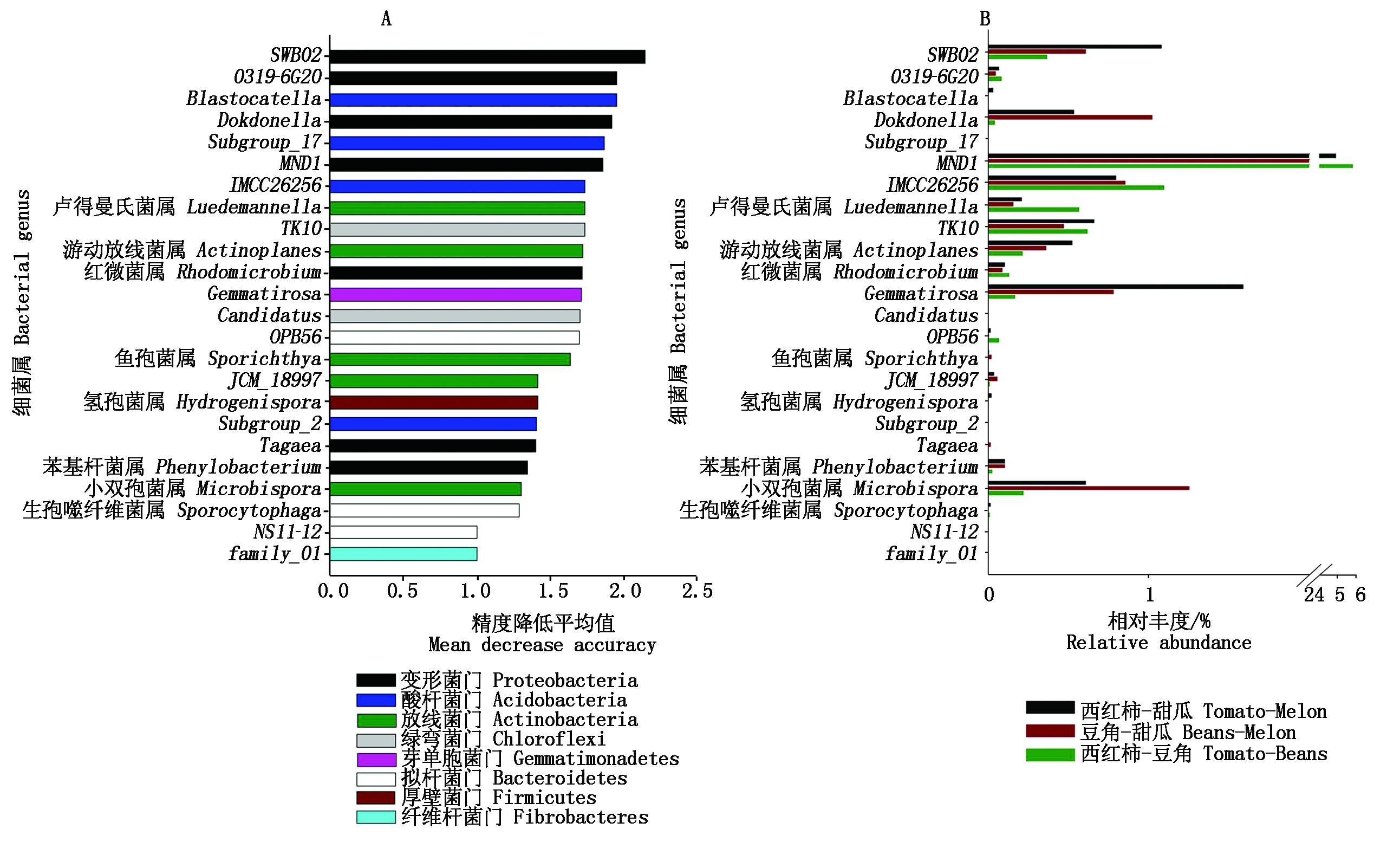
图4 不同轮作模式下土壤细菌群落构建差异的指示种群(属水平)的随机森林预测分析
Fig.4 Results of random forest analyses that identifying the microbial indicators(at genus level)
that can predict the differences in soil bacterial community under different rotations
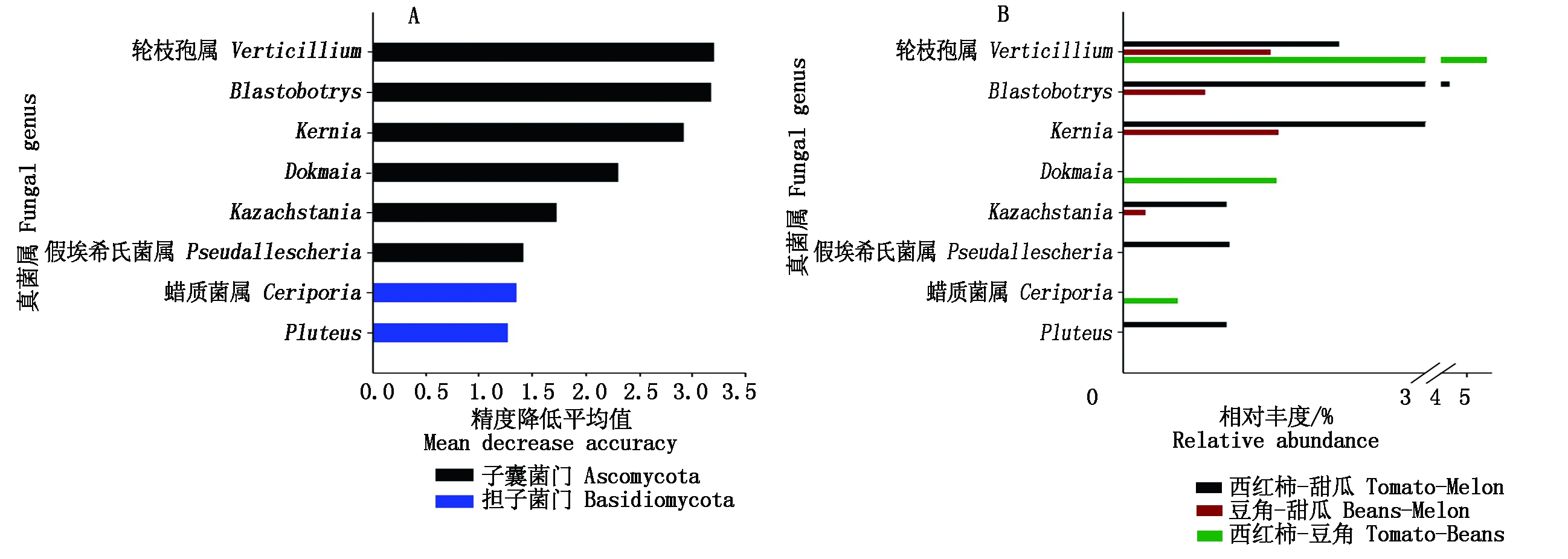
图5 不同轮作模式下土壤真菌群落构建差异的指示种群(属水平)的随机森林预测分析
Fig.5 Results of random forest analyses that identifying the microbial indicators(at genus level)
that can predict the differences in soil fungal community under different rotations
表4 微生物多样性指数及相对丰度与土壤理化学性质的相关性
Tab.4 Spearman correlation coefficients (r) of diversity indices and the relative abundance of microbial taxa with soil general properties
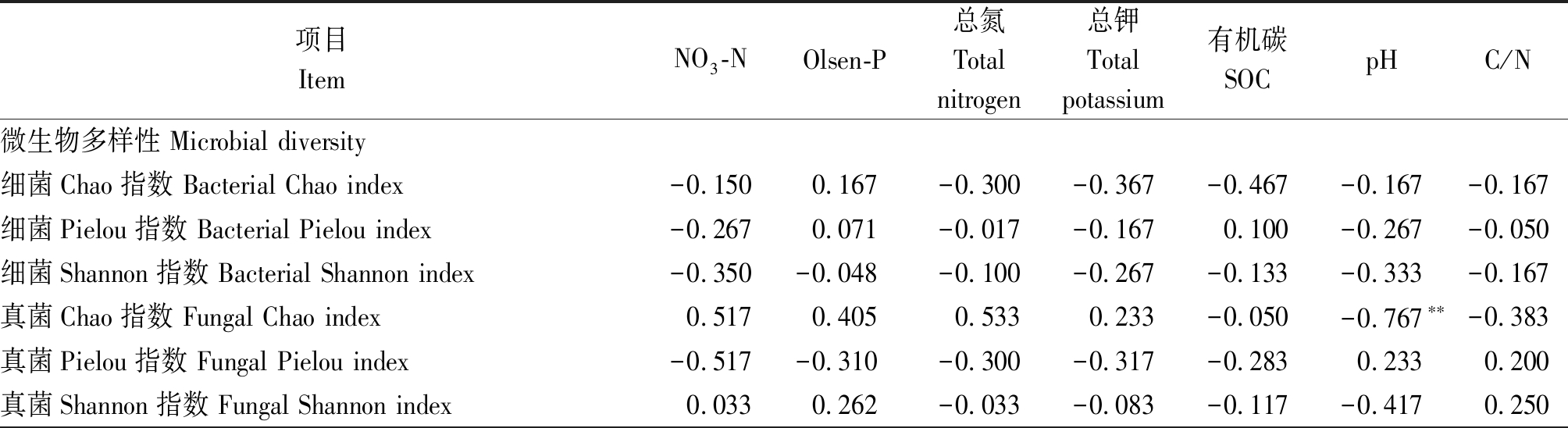
项目ItemNO3-NOlsen-P总氮Total nitrogen总钾Total potassium有机碳SOC pHC/N微生物多样性 Microbial diversity细菌Chao指数 Bacterial Chao index-0.1500.167-0.300-0.367-0.467-0.167-0.167细菌Pielou指数 Bacterial Pielou index-0.2670.071-0.017-0.1670.100-0.267-0.050细菌Shannon指数 Bacterial Shannon index-0.350-0.048-0.100-0.267-0.133-0.333-0.167真菌Chao指数 Fungal Chao index0.5170.4050.5330.233-0.050-0.767∗∗-0.383真菌Pielou指数 Fungal Pielou index-0.517-0.310-0.300-0.317-0.2830.2330.200真菌Shannon指数 Fungal Shannon index0.0330.262-0.033-0.083-0.117-0.4170.250
表4(续)
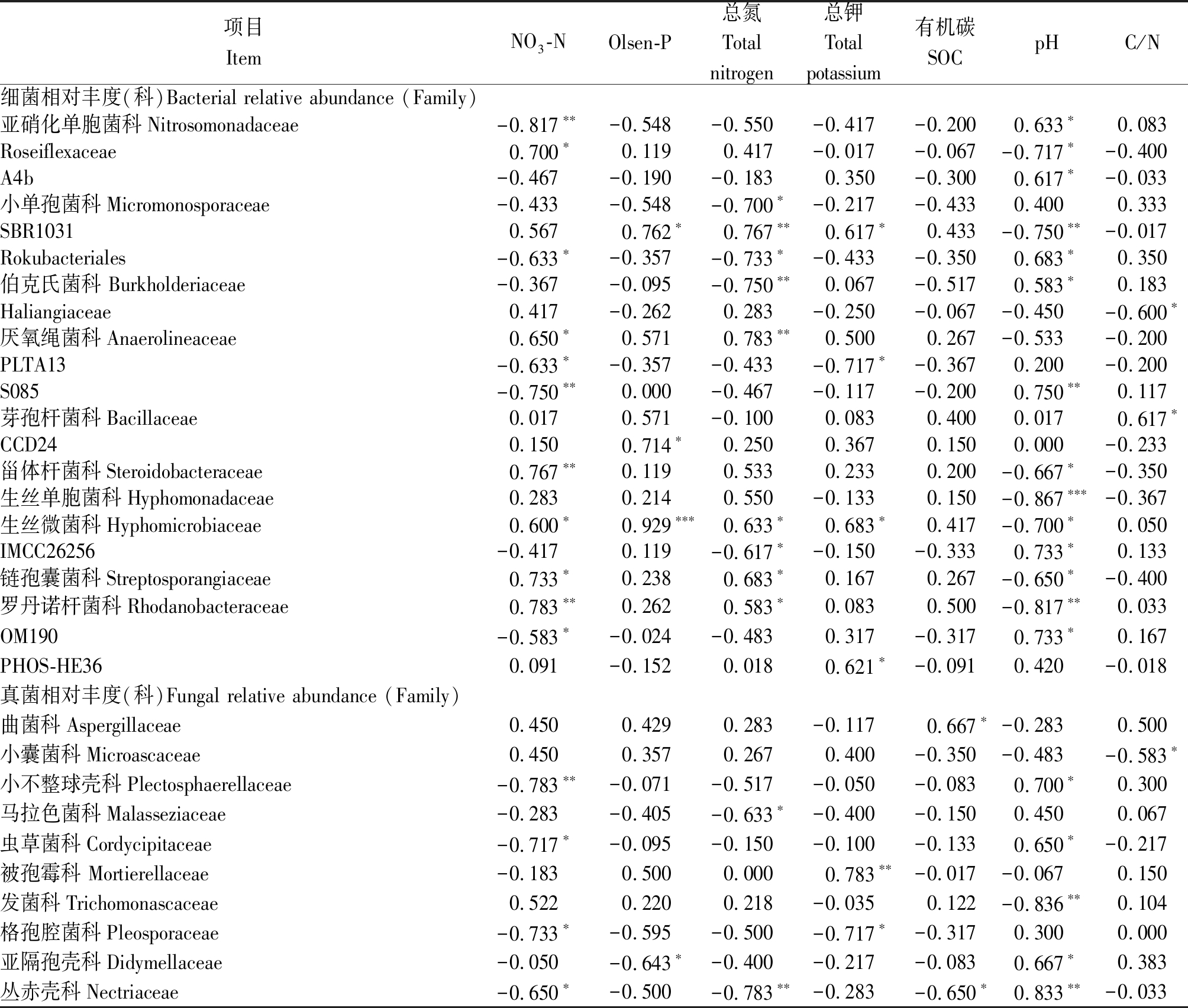
项目ItemNO3-NOlsen-P总氮Total nitrogen总钾Total potassium有机碳SOC pHC/N细菌相对丰度(科)Bacterial relative abundance (Family)亚硝化单胞菌科Nitrosomonadaceae-0.817∗∗-0.548-0.550-0.417-0.2000.633∗0.083Roseiflexaceae0.700∗0.1190.417-0.017-0.067-0.717∗-0.400A4b-0.467-0.190-0.1830.350-0.3000.617∗-0.033小单孢菌科Micromonosporaceae-0.433-0.548-0.700∗-0.217-0.4330.4000.333SBR10310.5670.762∗0.767∗∗0.617∗0.433-0.750∗∗-0.017Rokubacteriales-0.633∗-0.357-0.733∗-0.433-0.3500.683∗0.350伯克氏菌科 Burkholderiaceae-0.367-0.095-0.750∗∗0.067-0.5170.583∗0.183Haliangiaceae0.417-0.2620.283-0.250-0.067-0.450-0.600∗厌氧绳菌科Anaerolineaceae0.650∗0.5710.783∗∗0.5000.267-0.533-0.200PLTA13-0.633∗-0.357-0.433-0.717∗-0.3670.200-0.200S085-0.750∗∗0.000-0.467-0.117-0.2000.750∗∗0.117芽孢杆菌科Bacillaceae0.0170.571-0.1000.0830.4000.0170.617∗CCD240.1500.714∗0.2500.3670.1500.000-0.233甾体杆菌科Steroidobacteraceae0.767∗∗0.1190.5330.2330.200-0.667∗-0.350生丝单胞菌科Hyphomonadaceae0.2830.2140.550-0.1330.150-0.867∗∗∗-0.367生丝微菌科Hyphomicrobiaceae0.600∗0.929∗∗∗0.633∗0.683∗0.417-0.700∗0.050IMCC26256-0.4170.119-0.617∗-0.150-0.3330.733∗0.133链孢囊菌科Streptosporangiaceae0.733∗0.2380.683∗0.1670.267-0.650∗-0.400罗丹诺杆菌科Rhodanobacteraceae0.783∗∗0.2620.583∗0.0830.500-0.817∗∗0.033OM190-0.583∗-0.024-0.4830.317-0.3170.733∗0.167PHOS-HE360.091-0.1520.0180.621∗-0.0910.420-0.018真菌相对丰度(科)Fungal relative abundance (Family)曲菌科Aspergillaceae0.4500.4290.283-0.1170.667∗-0.2830.500小囊菌科Microascaceae0.4500.3570.2670.400-0.350-0.483-0.583∗小不整球壳科Plectosphaerellaceae-0.783∗∗-0.071-0.517-0.050-0.0830.700∗0.300马拉色菌科Malasseziaceae-0.283-0.405-0.633∗-0.400-0.1500.4500.067虫草菌科Cordycipitaceae-0.717∗-0.095-0.150-0.100-0.1330.650∗-0.217被孢霉科 Mortierellaceae-0.1830.5000.0000.783∗∗-0.017-0.0670.150发菌科Trichomonascaceae0.5220.2200.218-0.0350.122-0.836∗∗0.104格孢腔菌科Pleosporaceae-0.733∗-0.595-0.500-0.717∗-0.3170.3000.000亚隔孢壳科Didymellaceae-0.050-0.643∗-0.400-0.217-0.0830.667∗0.383丛赤壳科Nectriaceae-0.650∗-0.500-0.783∗∗-0.283-0.650∗0.833∗∗-0.033
注:*.P< 0.05; **.P< 0.01;***.P< 0.001。
典范对应分析(CCA)进一步揭示了影响土壤微生物群落结构的关键环境因子(图6)。CCA结果表明,土壤因子对细菌和真菌群落变化的解释度分别为33.61%,32.12%。在所有环境因子里,土壤NO3-N和pH值是显著影响细菌和真菌群落结构的关键因子(P<0.05)。此外,当季作物类型也对土壤微生物群落结构有显著影响:PERMANOVA检验结果表明,当季作物为甜瓜的种植制度(西红柿-甜瓜+豆角-甜瓜)下土壤细菌和真菌的群落结构与当季作物为豆角的模式(西红柿-豆角)产生显著差异(细菌F=2.35, P=0.01;真菌F=1.88,P=0.01)。
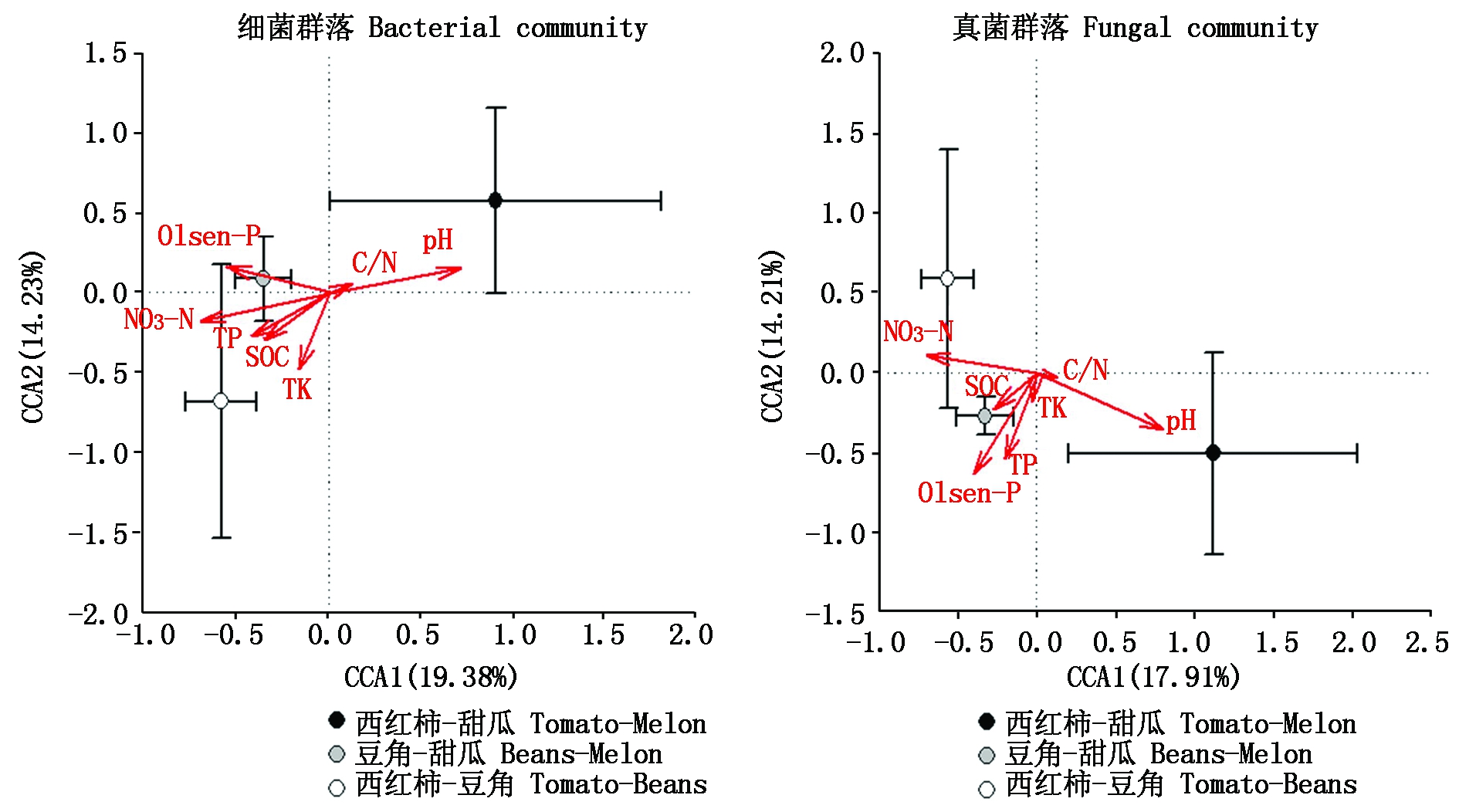
图6 不同轮作模式下土壤细菌和真菌群落结构及关键影响因子的典范对应分析
Fig.6 Canonical correlation analysis on the structure of soil bacterial and fungal communities and the controlling factors under different rotations
设施蔬菜高集约化生产方式及不合理的水肥管理极易造成土壤酸化、次生盐渍化等土壤质量退化,而土壤微生物对环境变化十分敏感,因此,通过土壤微生物性状的变化评估设施土壤质量变化近年来成为研究设施土壤质量保持和功能恢复的热点[10-11]。然而,与农田相比,设施土壤微生物研究在我国起步较晚,且多集中在种植年限[10,11,13,15,17,22]和施肥[23-25]对设施土壤微生物区系的影响,对不同轮作模式下土壤微生物群落结构与功能的变化认识仍有很大的局限性。特别是引入豆科作物的轮作模式,其增产[28-29]和环保[30-33]效果虽得到普遍认可,然而该体系对土壤细菌和真菌群落的综合影响及其驱动因子却鲜有报道。本研究结果发现,设施蔬菜种植中,当季作物种类(豆角/甜瓜)显著影响了土壤微生物多样性、群落组成和结构。Ridl等[34]研究氮磷钾肥料和种植不同作物(辣根、茄子、烟草)对土壤微生物群落的影响时同样指出,作物种类对细菌群落结构产生显著影响,其作用效果甚至大于施肥。而这种差异的主要原因在于,植物与土壤微生物在相互作用过程中会形成植物-微生物协同调控机制:即植物通过分泌碳源物质调控根际土壤微生物的种类和结构;同时,微生物也会通过产生激素类物质、抑制病原菌生长、诱导植物对生物及非生物胁迫产生抗性等方式促进植物的生长[35-36]。引入豆科作物的轮组模式显著改变了碳源底物、并且水肥管理差异也改变了土壤理化性状,从而调控微生物组成和活性。在所有土壤因子中,pH值和NO3-N对土壤微生物群落结构变化的影响最为显著。由于设施环境极端性及复杂性,目前,报道的设施土壤微生物群落组成及结构的驱动因子各不相同,甚至相互矛盾。例如,Song等[17]指出土壤pH值和粘粒含量是影响设施土壤细菌群落的主要因素,而影响真菌群落的主要因素则为pH值和磷含量。Yao等[18]在对比设施及露地蔬菜土壤微生物群落结构时指出设施土壤微生物群落随种植年份发生显著改变,然而,Tian等[11]在调查环渤海区设施土壤微生物后却发现微生物群落与栽培年份关系并不显著,而是与土壤钾含量密切相关。这些明显不同甚至相悖的研究结果表明,对土壤微生物结构与功能的认识还十分有限,特别是显著差别与农田生态系统的设施土壤。
本研究3种轮作模式中,豆角-甜瓜和西红柿-豆角相比于传统西红柿-甜瓜轮作模式分别减少N-P2O5-K2O投入21.38%~23.46%,2.27%~5.04%,25.45%~26.97%,降低水分投入22.73%~31.82%,经过2 a四季肥水管理,西红柿-豆角轮作模式相对于传统西红柿-甜瓜,NO3-N含量显著降低了65.31%。并且由于氮肥减投缓解了土壤酸化,使得pH值相对于传统模式提高了6.8%。本研究结果也表明,正是pH值和NO3-N含量的差异驱动了不同轮作模式下细菌和真菌群落组成和结构的差异。其余土壤养分差异不显著,可能由于试验年份较短。然而,豆角-甜瓜轮作模式下土壤养分含量却与西红柿-甜瓜没有显著差异,这可能与甜瓜季养分投入量远大于西红柿季有关,且甜瓜季温度高于西红柿季,土壤养分矿化加剧,因此,甜瓜季高投入、高矿化使得土壤养分含量激增,掩盖了上一季豆角减投的效果,具体机制还需进一步研究。
对于土壤细菌,结果表明变形菌门(Proteobacteria)在所有轮作模式是中所占比例最大,与以往研究一致[11,17,37],主要原因在于该类型细菌属于典型富养型生物,其生存的r-策略使得它在碳源底物有效性高的设施环境中快速生长,成为优势种群。然而,不同微生物对轮作模式改变及其导致的环境因子变化的响应不同,这取决于不同微生物的生理、生态特性差异。例如,发现亚硝化单胞菌科在西红柿-豆角土壤中显著增加,且与NO3-N含量有极显著负相关(r=0.817,P<0.01)。以往研究也发现,减量施肥显著提高亚硝化单胞菌科(属)的相对丰度[38-39]。另外,亚硝化单胞菌科的相对丰度与pH值具有显著正相关(r=0.667,P<0.05),这与普遍认为的低pH值会限制硝化细菌生长[40]结论一致。在3种轮作模式下,当季豆角种植(西红柿-豆角)的水肥投入量明显低于当季甜瓜种植模式,导致土壤pH值升高、NO3-N下降,因此,有助于该菌群生长。西红柿-豆角轮作模式还显著提高了己科河菌门的相对丰度。作为一种新型土壤细菌,该菌群具有多样的生物次级代谢物基因,可能与抗药性密切相关[41]。本研究发现,土壤NO3-N、总氮和pH值显著影响该类微生物的相对丰度,表明此类细菌对土壤无机氮敏感性很高,并且有研究表明该菌群可以进行反硝化作用[42]。另外,相比于引入豆角的轮作模式(豆角-甜瓜和西红柿-豆角),西红柿-甜瓜土壤中Roseiflexaceae和生丝单胞菌科(Hyphomonadaceae)的相对丰度显著增加。这两类细菌多被发现于高温、高盐分环境中[43]及各种海洋环境中[44],而西红柿-甜瓜土壤具有相对较高的EC值,可能是导致该种群富集的原因。
对于土壤真菌,子囊菌门(Ascomycota)在3种轮作模式中所占比例均最高,达到54.37%~69.50%,与Tian等[16]在环渤海区设施土壤调查结果一致[11]。研究指出设施土壤中子囊菌门丰度增加与其土壤磷含量高密切相关。在3种轮作模式中,担子菌门(Basidiomycota)的相对丰度在西红柿-豆角模式下显著增加,其中银耳纲(Tremellomycetes)和外担菌纲(Exobasidiomycetes)的相对丰度增加程度较高。研究发现,这些真菌可能在抑制植株根部土传病害方面发挥作用,是有效的生防菌[45]。然而,小不整球壳科、虫草菌科和丛赤壳科(Nectriaceae)等具有致病的种群的相对丰度也显著增加。 Bainard等[46]发现,豆科植物轮作频数的增加会导致病原菌数量增加2~3倍,因此,提出应避免连续种植豆科作物,以防根系特异性病原菌累积。土壤中真菌优势科的大部分属于子囊菌门,在群落演替中处于演替前期,与接合菌、细菌等最先侵入枯枝落叶等基质形成优势菌,分解代谢吸收大量糖和NPK等营养物质[47],因此,相对丰度与土壤NO3-N、Olsen-P、总氮、总钾、有机碳、C/N等密切相关。以丛赤壳科为例,NO3-N、总氮、有机碳和pH值显著影响其相对丰度,但具体影响机制仍需进一步研究。近年来,尽管高通量测序技术在各类型生态系统的广泛应用为更好的理解土壤微生物多样性及群落构建提供了丰硕的成果,但仍有相当一部分微生物在生态系统中功能并不十分清楚。
利用随机森林模型,本研究预测出多种能够显著(P<0.05)影响3种轮作模式下群落构建差异的微生物种群。这些种群的相对丰度在3种轮作模式下有显著差异,进而可能导致不同土壤中碳氮循环过程的改变。例如,红微菌属(Rhodomicrobium)是一种需微氧至厌氧的紫色光合细菌,具有极其多样的碳源代谢能力,可代谢几乎所有的发酵产物,包括CO2、小分子有机酸和CH4等,同时是一种自生固氮菌,具有固氮能力[48-49]。发现红微菌属的相对丰度在西红柿-豆角土壤中显著高于其余2种轮作模式,这暗示了共生固氮过程可能是豆角土壤中氮素供应的重要来源或补给。本研究还发现,氢孢菌属(Hydrogenispora)的相对丰度在西红柿-甜瓜土壤中显著高于引入豆角的种植制度。该属的细菌偏好利用糖类底物,如Hydrogenispora ethanolica能发酵葡萄糖、半乳糖、淀粉[50],这表明不同种植制度下土壤有机碳组分可能发生变化。另外,西红柿-豆角土壤中轮枝孢属(Verticillium)相对丰度显著高于其余2种轮作模式,这类真菌会引起枯萎病,但是经过合理轮作,其相对丰度会显著下降,可以看到上一季种植豆角的轮作模式豆角-甜瓜在这一季土壤中该类真菌相对丰度与西红柿-甜瓜差异已经不显著。
除了群落结构,本研究发现土壤真菌的丰富度对于轮作模式及其导致的土壤理化性质的改变更为敏感,而细菌多样性的变化与土壤因子的相关性不显著。3种轮作模式下土壤真菌Chao指数的变化与土壤pH值具有极显著的负相关性(r=-0.767,P <0.01),这与以往研究结果一致[51-52]。目前,研究普遍承认pH值是影响真菌群落多样性的主要化学性质[53-54],不过Bahram等[55]指出全球范围内土壤真菌多样性与pH值相关性较弱。这种差异很可能是由于生物及非生物因素改变,如植被变化、施肥变化等带来的碳源底物、土壤理化性状等环境因子改变综合调控的结果,而非pH值的直接作用引起的变化。总体来说,本研究中轮作模式的改变仅影响到土壤微生物多样性的某个方面(例如丰富度、均匀度),这可能是由于相应的施肥、灌水处理时间尚短。土壤微生物多样性是其发挥生态系统功能的基础[56],后续研究还需长期连续观测,深入研究种植制度改变导致的生物及非生物因素变化对土壤微生物多样性及群落特征的影响,从而揭示其影响设施土壤碳氮循环的机理。
设施农业高集约化生产方式导致土壤理化性质的改变,进而影响土壤微生物的多样性、群落组成及功能。基于豆科作物养分减投的轮作制度调整技术相对于茄科-葫芦科传统轮作模式,经过2 a四季肥水管理显著降低了土壤NO3-N含量并提高pH值。土壤环境的变化显著改变了细菌和真菌的多样性和群落组成,但不同微生物对轮作模式改变引起的环境因子变化的响应不同,主要取决于不同微生物的生理、生态特性差异。在所有土壤因子中,pH值和NO3-N对土壤微生物群落结构变化的影响最为显著,并且当季作物种类(豆科/非豆科)对土壤微生物富集模式有显著作用。此外,土壤细菌对轮作制度调整的响应比真菌敏感,未来应深入研究这种群落变化如何影响设施土壤碳氮循环关键过程。
[1] 王敬国. 设施菜田退化土壤修复与资源高效利用[M]. 北京:中国农业大学出版社,2011:2-5.
Wang J G. Management of degraded vegetable soils in greenhouses[M]. Beijing:China Agricultural University Press,2011:2-5.
[2] 王辉,董元华,李德成,安琼. 不同种植年限大棚蔬菜地土壤养分状况研究[J]. 土壤,2005,37(4):460-462. doi:10.3321/j.issn:0253-9829.2005.04.020.
Wang H,Dong Y H,Li D C,An Q. Nutrient variation inplastic greenhouse soils with the years of cultivation[J]. Soils,2005,37(4):460-462.
[3] 王柳,张福墁,高丽红. 京郊日光温室土壤养分特征的研究[J].中国农业大学学报,2003,8(1):62-66. doi:10.3321/j.issn:1007-4333.2003.01.014.
Wang L,Zhang F M,Gao L H. Characteristics of soil nutrients in solar greenhouse in Beijing suburb[J]. Journal of China Agricultural University,2003,8(1):62-66.
[4] 杜新民,吴忠红,张永清,裴雪霞. 不同种植年限日光温室土壤盐分和养分变化研究[J]. 水土保持学报,2007,21(2):78-80. doi:10.3321/j.issn:1009-2242.2007.02.020.
Du X M,Wu Z H,Zhang Y Q,Pei X X. Study on changes of soil salt and nutrient in greenhouse of different planting years[J]. Journal of Soil and Water Conservation,2007,21(2):78-80.
[5] 张俊伶,张江周,申建波,田静,金可默,张福锁. 土壤健康与农业绿色发展:机遇与对策[J]. 土壤学报,2020,57(4):783-796. doi:10.11766/trxb202002220064.
Zhang J L,Zhang J Z,Shen J B,Tian J,Jin K M,Zhang F S. Soil health and agriculture green development:opportunities and challenges[J]. Acta Pedologica Sinica,2020,57(4):783-796.
[6] Gul S,Whalen J K,Thomas B W,Sachdeva V,Deng H Y. Physico-chemical properties and microbial responses in biochar-biochar-amended soils:Mechanisms and future directions[J].Agriculture Ecosystems and Environment,2015,206:46-59. doi:10.1016/j.agee.2015.03.015.
[7] Mendes L W,Tsai S M,Navarrete A A,de Hollander M,van Veen J A,Kuramae E E. Soil-borne microbiome:Linking diversity to function [J].Microbial Ecology,2015,70(1):255-265.doi:10.1007/s00248-014-0559-2.
[8] Pazos F,Valencia A,De Lorenzo V. The organization of the microbial biodegradation network from a systems-biology perspective[J]. EMBO Reports,2003,4(10):994-999. doi:10.1038/sj.embor.embor933.
[9] Edwards J,Johnson C,Santos-Medelliní C,Lurie E,Podishetty N K,Bhatnagar S,Eisen J A,Sundaresan V. Structure,variation,and assembly of the root-associated microbiomes of rice[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(8):E911-E920. doi:10.1073/pnas.1414592112.
[10] Zhang X M,Zhang Q,Liang B,Li J L. Changes in the abundance and structure of bacterial communities in the greenhouse tomato cultivation system under long-term fertilization treatments[J]. Applied Soil Ecology,2017,121:82-89. doi:10.1016/j.apsoil.2017.08.016.
[11] Tian T,Chen Z Q,Tian Y Q,Gao L H. Microbial diversity in solar greenhouse soils in Round-Bohai Bay-Region,China:The influence of cultivation year and environmental condition[J]. Environmental Science and Pollution Research,2017,24(29):23236-23249. doi:10.1007/s11356-017-9837-0.
[12] Liu X,Zhang J L,Gu T Y,Zhang W M,Shen Q R,Yin S X,Qiu H Z. Microbial community diversities and taxa abundances in soils along a seven-year gradient of potato monoculture using high throughput pyrosequencing approach[J]. PLoS One,2014,9(1):e86610. doi:10.1371/journal.pone.0086610.
[13] 唐小付,刘岳飞,张传进,姚华开,杨尚东. 设施甜瓜种植年限对土壤生物学特性和细菌多样性的影响[J]. 热带作物学报,2018,39(8):1493-1500. doi:10.3969/j.issn.1000-2561.2018.08.004.
Tang X F,Liu Y F,Zhang C J,Yao H K,Yang S D. Effect of different planting years on soil biological properties and bacterial diversity in protected cultivation of Cucumis melo L.[J].Chinese Journal of Tropical Crops,2018,39(8):1493-1500.
[14] Zhou X G,Wu F Z. Dynamics of the diversity of fungal and Fusarium communities during continuous cropping of cucumber in the greenhouse[J]. FEMS Microbiology Ecology,2012,80(2):469-478. doi:10.1111/j.1574-6941.2012.01312.x.
[15] 董艳,董坤,郑毅,田芝花,鲁耀,汤利. 种植年限和种植模式对设施土壤微生物区系和酶活性的影响[J]. 农业环境科学学报,2009,28(3):527-532. doi:10.3321/j.issn:1672-2043.2009.03.020.
Dong Y,Dong K,Zheng Y,Tian Z H,Lu Y,Tang L. Soil microbial community and enzyme activities in greenhouse with different cultivation years and planting system[J]. Journal of Agro-Environment Science,2009,28(3):527-532.
[16] Tian Y Q,Zhang X Y,Wang J G,Gao L H. Soil microbial communities associated with the rhizosphere of cucumber under different summer cover crops and residue management:a 4-year field experiment [J]. Scientia Horticulturae,2013,150:100-109. doi:10.1016/j.scienta.2012.10.025.
[17] Song Y,Xu M,Li X N,Bian Y R,Wang F,Yang X L,Gu C G,Jiang X. Long-Term plastic greenhouse cultivation changes soil microbial community structures:a case study[J]. Journal of Agricultural and Food Chemistry,2018,66(34):8941-8948. doi:10.1021/acs.jafc.8b01829.
[18] Yao Z Y,Xing J J,Gu H P,Wang H Z,Wu J J,Xu J M,Brookes P C.Development of microbial community structure in vegetable growing soils from open-field to plastic-greenhouse cultivation based on the PLFA analysis[J]. Journal of Soils and Sediments,2016,16(8):2041-2049. doi:10.1007/s11368-016-1397-2.
[19] 尚双华. 设施土壤氮素积累条件下番茄枯萎病发生的微生态机制研究[D]. 沈阳:沈阳农业大学,2016.
Shang S H. Mico-ecology mechanism of soil-borne tomato Fusarium wilt in the nitrogen-rich facilities cultivation soil[D].Shenyang:Shenyang Agricultural Univiersity,2016.
[20] 葛晓颖,孙志刚,李涛,欧阳竹. 设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析[J].农业环境科学学报,2016,35(3):514-523. doi:10.11654/jaes.2016.03.015.
Ge X Y,Sun Z G,Li T,Ouyang Z. Soil Pseudomonas spp.,Bacillus spp.,and microbial communities under tomato continuous cropping in greenhouse production[J]. Journal of Agro-Environment Science,2016,35(3):514-523.
[21] Zhang J,Wang P C,Tian H M,Xiao Q Q,Jiang H K. Pyrosequencing-based assessment of soil microbial community structure and analysis of soil properties with vegetable planted at different years under greenhouse conditions[J]. Soil and Tillage Research,2019,187:1-10. doi:10.1016/j.still.2018.11.008.
[22] 赵辉,王喜英,徐仕强,谭智勇. 贵州武陵片区不同种植年限设施菜地土壤微生物群落的结构和功能多样性[J]. 河南农业科学,2021,50(1):81-91.doi:10. 15933/j. cnki. 1004-3268. 2021. 01. 010.
Zhao H,Wang X Y,Xu S Q,Tan Z Y. Soil microbial community structure and functional diversity in vegetable greenhouse for different planting years in Wuling area of Guizhou Province[J].Journal of Henan Agricultural Sciences,2021,50(1):81-91.
[23] 罗佳,刘丽珠,王同,严少华,卢信,范如芹,张振华. 有机肥与化肥配施对黄瓜产量及土壤微生物多样性的影响[J]. 生态与农村环境学报,2016,32(5):774-779. doi:10.11934/j.issn.1673-4831.2016.05.013.
Luo J,Liu L Z,Wang T,Yan S H,Lu X,Fan R Q,Zhang Z H. Effect of combined application of chemical fertilizer with organic manure on cucumber yield and soil micro-bial diversity[J].Journal of Ecology and Rural Environment,2016,32(5):774-779.
[24] 李猛. 有机肥配施氮肥条件下设施菜地硝化菌群多样性研究[D]. 沈阳:沈阳农业大学,2017.
Li M. Effect of combined application of manure with nitrogen fertilizer on the diversity of nitrifier in installed vegetable fields[D].Shenyang:Shenyang Agricultural Univiersity,2017.
[25] 蒋雨含. 长期不同施肥处理对设施番茄生长及丛枝菌根真菌群落的影响[D]. 沈阳:沈阳农业大学,2019.doi:10.27327/d.cnki.gshnu.2019.000224.
Jiang Y H. Effects of long-term fertilization on tomato growth and arbuscular mycorrhizal fungal communities in intensive agroecosystems[D]. Shengyang:Shengyang Agricultural Univiersity,2019.
[26] 刘蕾,王凌,徐万强,张国印,赵欧亚,郜静,李玭. 设施土壤磷素淋失环境阈值及防控措施[J]. 华北农学报,2019,34(S1):197-203. doi:10.7668/hbnxb.20190310.
Liu L,Wang L,Xu W Q,Zhang G Y,Zhao O Y,Gao J,Li P. Environmental threshold and prevention of soil phosphorus leaching in greenhouse soils[J]. Acta Agriculturae Boreali-Sinica,2019,34(S1):197-203.
[27] Salvagiotti F,Cassman K G,Specht J E,Walters D T,Weiss A,Dobermann A. Nitrogen uptake,fixation and response to fertilizer N in soybeans:A review[J]. Field Crops Research,2008,108(1):1-13. doi:10.1016/j.fcr.2008.03.001.
[28] 于慧颖. 轮作方式对黄瓜根际细菌多样性及产量的影响[D]. 哈尔滨:东北农业大学,2008.
Yu H Y. Study on cucumber rhizosphere bacteria diversity and yield of vegetable crops rotation[D]. Harbin:Northeast Agricultural University,2008.
[29] 曹明锋,宁尚辉,祝利,梅光军,彭斯文,卢红玲,张清壮,龙世平. 烟草-早熟食用豆轮作模式研究[J]. 湖南农业科学,2019(12):26-29.doi:10.16498/j.cnki.hnnykx.2019.012.007.
Cao M F,Ning S H,Zhu L,Mei G J,Peng S W,Lu H L,Zhang Q Z,Long S P. Study on rotation mode of tobacco and early maturing edible bean[J].Hunan Agricultural Sciences,2019(12):26-29.
[30] Stagnari F,Maggio A,Galieni A,Pisante M. Multiple benefits of legumes for agriculture sustainability:An overview[J]. Chemical and Biological Technologies in Agriculture,2017,4(1):2. doi:10.1186/s40538-016-0085-1.
[31] Jensen E S,Peoples M B,Boddey R M,Gresshoff P M,Hauggaard-Nielsen H,Alves B J R,Morrison M J. Legumes for mitigation of climate change and the provision of feedstock for biofuels and biorefineries. A review[J]. Agronomy for Sustainable Development,2012,32(2):329-364. doi:10.1007/s13593-011-0056-7.
[32] Fowler D,Pyle J A,Raven J A,Sutton M A. The global nitrogen cycle in the twenty-first century:introduction[J]. Philosophical Transactions of the Royal Society B,Biological Sciences,2013,368(1621):20130165.doi:10.1098/rstb.2013.0165.
[33] Lassaletta L,Billen G,Grizzetti B,Anglade J,Garnier J. 50 year trends in nitrogen use efficiency of world cropping systems:The relationship between yield and nitrogen input to cropland[J]. Environmental Research Letters,2014,9(10):105011. doi:10.1088/1748-9326/9/10/105011.
[34] Ridl J,Kolar M,Strejcek M,Strand H,Stursa P,Paces J,Macek T,Uhlik O. Plants rather than mineral fertilization shape microbial community structure and functional potential in legacy contaminated soil[J]. Frontiers in Microbiology,2016,7(837):995.doi:10.3389/fmicb.2016.00995.
[35] Ahmed A,Hasnain S. Auxins as one of the factors of plant growth improvement by plant growth promoting rhizobacteria[J]. Polish Journal of Microbiology,2014,63(3):261-266. doi:10.33073/pjm-2014-035.
[36] 贾利华,王鑫,张蕊,林德立,邱睿,邢国珍,刘娜,郑文明. 根际微生物群落介导植物磷胁迫应答与免疫调控的整合机制[J].植物营养与肥料学报,2019,25(2):321-327. doi:10.11674/zwyf.17441.
Jia L H,Wang X,Zhang R,Lin D L,Qiu R,Xing G Z,Liu N,Zheng W M. Rhizosphere microbial community mediated a synergism regulatory mechanism of phosphorus stress and immunity in plants by the integrated pathway[J]. Journal of Plant Nutrition and Fertilizers,2019,25(2):321-327.
[37] 曾希柏,王亚男,王玉忠,林志灵,李莲芳,白玲玉,苏世鸣,沈灵凤. 不同施肥模式对设施菜地细菌群落结构及丰度的影响[J].中国农业科学,2013,46(1):69-79. doi:10.3864/j.issn.0578-1752.2013.01.009.
Zeng X B,Wang Y N,Wang Y Z,Lin Z L,Li L F,Bai L Y,Su S M,Shen L F. Effects of different fertilization regimes on abundance and composition of the bacterial community in greenhouse vegetable soils[J].Scientia Agricultura Sinica,2013,46(1):69-79.
[38] 柯超,黄占斌,马筠,钟建,张世伟. 纳米碳保水肥对柑橘田土壤细菌群落结构及柑橘生长的影响[J]. 中国农学通报,2018,34(21):101-107.
Ke C,Huang Z B,Ma Y,Zhong J,Zhang S W. Effects of nano-carbon water-retain fertilizer on soil bacterial community structure and citrus growth in citrus field[J]. Chinese Agricultural Science Bulletin,2018,34(21):101-107.
[39] Wang Y N,Ke X B,Wu L Q,Lu Y H. Community composition of ammonia-oxidizing bacteria and archaea in rice field soil as affected by nitrogen fertilization[J]. Systematic and Applied Microbiology,2009,32(1):27-36. doi:10.1016/j.syapm.2008.09.007.
[40] He J Z,Shen J P,Zhang L M,Zhu Y G,Zheng Y M,Xu M G,Di H J. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[J]. Environmental Microbiology,2007,9(9):2364-2374. doi:10.1111/j.1462-2920.2007.01358.x.
[41] Crits-Christoph A,Diamond S,Butterfield C N,Thomas B C,Banfield J F. Novel soil bacteria possess diverse genes for secondary metabolite biosynthesis[J]. Nature,2018,558(7710):440-444. doi:10.1038/s41586-018-0207-y.
[42] Kroeger M E,Delmont T O,Eren A M,Meyer K M,Guo J R,Khan K,Rodrigues J L M,Bohannan B J M,Tringe S G,Borges C D,Tiedje J M,Tsai S M,Nüsslein K. New biological insights into how deforestation in Amazonia affects soil microbial communities using metagenomics and metagenome-assembled genomes[J]. Frontiers in Microbiology,2018,9:1635.doi:10.3389/fmicb.2018.01635.
[43] Hanada S. The phylum chloroflexi,the family chloroflexaceae,and the related phototrophic families oscillochloridaceae and roseiflexaceae[M]//The Prokaryotes. Heidelberg:Springer,2014:515-532.
[44] Lee K,Lee H K,Choi T H,Cho J C. Robiginitomaculum antarcticum gen. nov.,sp. nov.,a member of the family Hyphomonadaceae,from Antarctic seawater[J]. International Journal of Systematic and Evolutionary Microbiology,2007,57(11):2595-2599. doi:10.1099/ijs.0.65274-0.
[45] Sharma-Poudyal D,Schlatter D,Yin C T,Hulbert S,Paulitz T. Long-term no-till:Amajor driver of fungal communities in dryland wheat cropping systems[J].PLoS One,2017,12(9):e0184611. doi:10.1371/journal.pone.0184611.
[46] Bainard L D,Navarro-Borrell A,Hamel C,Braun K,Hanson K,Gan Y T. Increasing the frequency of pulses in crop rotations reduces soil fungal diversity and increases the proportion of fungal pathotrophs in a semiarid agroecosystem[J].Agriculture,Ecosystems and Environment,2017,240:206-214. doi:10.1016/j.agee.2017.02.020.
[47] 于淑玲. 腐生真菌在有机质分解过程中的作用研究进展[J].河北师范大学学报(自然科学版),2003,27(5):519-522. doi:10.3969/j.issn.1000-5854.2003.05.023.
Yu S L. A study of function that rot tunguses have in the decomposition of organic matter[J].Journal of Hebei Normal University (Natural Science Edition),2003,27(5):519-522.
[48] 廖咏梅,黄元腾吉,韩宁宁,凌展,邹承武,史鼎鼎,蒋代华. 稻鸭共育模式下水稻根际土壤真菌和细菌种群多样性分析[J].南方农业学报,2019,50(1):59-67. doi:10.3969/j.issn.2095-1191.2019.01.09.
Liao Y M,Huang Y T J,Han N N,Ling Z,Zou C W,Shi D D,Jiang D H. Analysis of population diversity of fungi and bacteria in rice rhizosphere soil under rice-duck farming model [J].Journal of Southern Agriculture,2019,50(1):59-67.
[49] 俎千惠,王保战,贾仲君,林先贵,冯有智.水稻土中紫色光合细菌沿纬度梯度的空间分异特征[J].生态学报,2016,36(21):6730-6737. doi:10.5846/stxb201504210819.
Zu Q H,Wang B Z,Jia Z J,Lin X G,Feng Y Z. Spatial shifts in purple photosynthetic bacterial community composition in paddy soils along the latitude[J].Acta Ecologica Sinica,2016,36(21):6730-6737.
[50] Liu Y,Qiao J T,Yuan X Z,Guo R B,Qiu Y L. Hydrogenispora ethanolica gen. nov.,sp. nov.,an anaerobic carbohydrate-fermenting bacterium from anaerobic sludge[J]. International Journal of Systematic and Evolutionary Microbiology,2014,64(5):1756-1762.doi:10.1099/ijs.0.060186-0.
[51] 张旭博,徐梦,史飞. 藏东南林芝地区典型农业土地利用方式对土壤微生物群落特征的影响[J].农业环境科学学报,2020,39(2):331-342.doi:10.11654/jaes.2019-0826.
Zhang X B,Xu M,Shi F. Impact of typical agricultural land use on the characteristics of soil microbial communities in the Nyingchi region of Southeastern Tibet[J]. Journal of Agro-Environment Science,2020,39(2):331-342.
[52] 李皓,董建华,袁紫倩,胡俊靖,赵伟明. 山核桃林地土壤真菌群落结构研究[J].浙江林业科技,2018,38(5):67-72. doi:10.3969/j.issn.1001-3776.2018.05.011.
Li H,Dong J H,Yuan Z Q,Hu J J,Zhao W M. Soil fungi community structure in Carya cathayensis forest[J]. Journal of Zhejiang Forestry Science and Technology,2018,38(5):67-72.
[53] Zhang T,Wang N F,Liu H Y,Zhang Y Q,Yu L Y. Soil pH is a key determinant of soil fungal community composition in the ny-ålesund region,svalbard (high arctic)[J]. Frontiers in Microbiology,2016,7:227.doi:10.3389/fmicb.2016.00227.
[54] Högberg M N,Yarwood S A,Myrold D D. Fungal but not bacterial soil communities recover after termination of decadal nitrogen additions to boreal forest[J]. Soil Biology and Biochemistry,2014,72:35-43. doi:10.1016/j.soilbio.2014.01.014.
[55] Bahram M,Hildebrand F,Forslund S K,Anderson J L,Soudzilovskaia N A,Bodegom P M,et al. Structure and function of the global topsoil microbiome [J].Nature,2018,560:233-237.doi:10.1038/s41586-018-0386-6.
[56] Bardgett R D,van der Putten W H. Belowground biodiversity and ecosystem functioning [J]. Nature,2014,515:505-511. doi:10.1038/nature13855.
张国印(1962-),男,山西陵川人,研究员,硕士,主要从事农业面源污染防控等研究。
马俊贤(1970-),男,河北盐山人,高级经济师,主要从事农业资源管理研究。