黄瓜是我国栽培面积最大的设施蔬菜之一,也是对栽培环境盐渍化较敏感的一种作物。由于设施内的土壤长期处于封闭的环境中,缺少天然雨水的淋溶,作物栽培种类较为单一,长期不合理施肥等生产状况导致设施内的土壤盐渍化程度越来越严重[1-2]。土壤盐渍化对植物的形态发育表现为抑制器官和组织的生长,产量也因此降低[3-4]。有研究发现,在不同的盐处理下黄瓜幼苗的生长均会受到抑制,细胞膜的透性变大,但是对不同保护酶活性的影响存在差异[5]。褪黑素(Melatonin)是存在于众多生物中的一种吲哚类物质[6],具有类似IAA的作用,可以促进种子萌发、植物生长以及不定根的形成[7]。Tan等[8]研究发现,褪黑素处理会影响根系的发育,在玉米收获期,用褪黑素处理玉米植株后会使其根系更加庞大。有研究表明[9],化学药剂胁迫可以诱导大麦根系中褪黑素的合成,使其褪黑素含量显著增加,褪黑素含量的增加可能在防御化学诱导的应激和其他非生物/生物应激中发挥重要的抗氧化作用。外源褪黑素还可以通过提高抗氧化酶活性和抗坏血酸谷胱甘肽循环相关酶的活性缓解高温胁迫对植株生长的抑制[10]。还有研究表明,外源褪黑素可以显著提高番茄的抗氧化酶活性和相关渗透调节物质,提高番茄的耐盐性[11]。褪黑素可以增强盐胁迫下月季月月粉的抗氧化酶活性以及渗透调节物质的质量分数,防止膜脂过氧化[12];还可以促进盐胁迫下香椿种子的萌发,提高香椿幼苗的耐盐性[13]。本试验以黄瓜幼苗为材料,研究不同浓度褪黑素对盐渍环境下黄瓜幼苗的生长指标、渗透调节物质和相关抗氧化酶活等相关特性的影响,旨在为盐渍环境下黄瓜幼苗的栽培提供理论依据。
1 材料和方法
1.1 试验地概况
试验于2019年10月至2020年9月在山西农业大学(山西省农业科学院)太谷校区园艺学院园艺站温室中进行。该地点位于山西省晋中市太谷县(37.42°N,112.58°E),太原盆地中部,属温带大陆性气候,年平均气温9.8 ℃,无霜期为175 d。
1.2 试验材料
供试黄瓜品种为新泰密刺,购自山东省泰安市祥云种业有限公司;供试褪黑素购自北京索莱宝科技有限公司。
1.3 试验设计
将温室内的栽培区划分为9个小区,分别在不同的小区内随机取3份土样,混合后测其土壤含盐量为3%,达到中度盐渍化水平。测所用基质中的含盐量,加入等比例盐溶液模拟温室中土壤的盐渍环境。采用温汤浸种的方式处理种子,播种在5×10孔的穴盘中进行育苗;待黄瓜幼苗长出2片子叶时,挑选长势一致的幼苗分成5组,用不同浓度的褪黑素溶液,即0 (M0),50(M1),100(M2),150(M3),200 μmol/L(M4)喷施在黄瓜幼苗叶片的正反两面,每隔2 d喷施1次,处理时间为20:30,每个褪黑素浓度设置10个重复;至幼苗长至两叶一心时,将幼苗移栽至小花盆(10 cm×10 cm)中,使用盐处理后的基质定植。为了防止基质中盐分流失,在小花盆底部搭配小托盘,将渗出的溶液及时倒回小花盆中。移栽后用褪黑素处理幼苗,方法同上。分别于移栽后的第7,10,15天测定样本的相关生长指标,15 d后取黄瓜幼苗同一叶位的功能叶测定其相关生理指标。
1.4 测定指标及方法
用直尺测定株高(生长点至茎基部)、叶长、叶宽,用游标卡尺测定茎粗;用称重法测定干、鲜质量;用丙酮提取法测定幼苗新鲜叶片的叶绿素含量[14];荧光参数采用手持叶绿素荧光仪测定。
选择1个叶片迅速放入铝盒称出鲜质量(Wf);放入烘箱,于105 ℃下杀青0.5 h,然后于80 ℃下烘至恒质量,称出干质量(Wd),测定相对含水量(Relative water content,RWC)。称鲜质量后将样品浸入水中数小时取出,用吸水纸吸干样品表面水分,称质量;再将样品浸入水中1 h,取出,擦干,称质量,直至样品饱和质量近似,即得到样品饱和质量(Wt);然后烘干,称质量(Wd)。计算水分饱和亏(Water saturation deficit, WSD)。
WSD=((Wt-Wf)/(Wt-Wd))×100%[15]
①
采用氯化三苯基四氮唑(TTC)法测定根系活力;采用电导仪法测定电解质渗透率。
丙二醛(MDA)含量的测定采用硫代巴比妥酸法[16];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法;过氧化物酶(POD)活性的测定采用愈创木酚显色法;可溶性糖含量测定采用硫酸-苯酚法;可溶性蛋白含量测定采用G-250(考马斯亮蓝)法;脯氨酸含量的测定采用磺基水杨酸法,参考植物生理学实验指导[15]。
1.5 数据处理
采用Microsoft Excel 2013软件处理数据,采用SPSS 20.0和SAS 9.0软件对数据进行方差分析和显著性检验。
2 结果与分析
2.1 外源褪黑素对黄瓜生长特性的影响
黄瓜幼苗的株高和茎粗随着生长期逐渐增加;处理7 d时,外源褪黑素处理浓度为M2的幼苗株高最高,并且与其他处理间差异达到显著水平;处理10 d时,外源褪黑素处理浓度为M2和M3的幼苗株高较高,且显著高于M1和M4处理,但与M0处理间差异未达到显著水平;处理15 d时,外源褪黑素处理浓度为M2的黄瓜幼苗株高分别较M0、M1、M3和M4处理高21%,34%,31%和36%,且差异达到显著水平(图1-A)。在不同褪黑素浓度的处理组中,黄瓜幼苗的茎粗呈现稳定增长的趋势,处理组M0、M1、M3和M4中,黄瓜幼苗的茎粗在不同处理阶段均无显著差异;处理15 d后,褪黑素浓度为M2的处理中黄瓜幼苗的茎粗较其他处理组高6%,并且差异达到显著水平。结果表明,褪黑素浓度为M2时,对黄瓜幼苗株高与茎粗的影响较大(图1-B)。
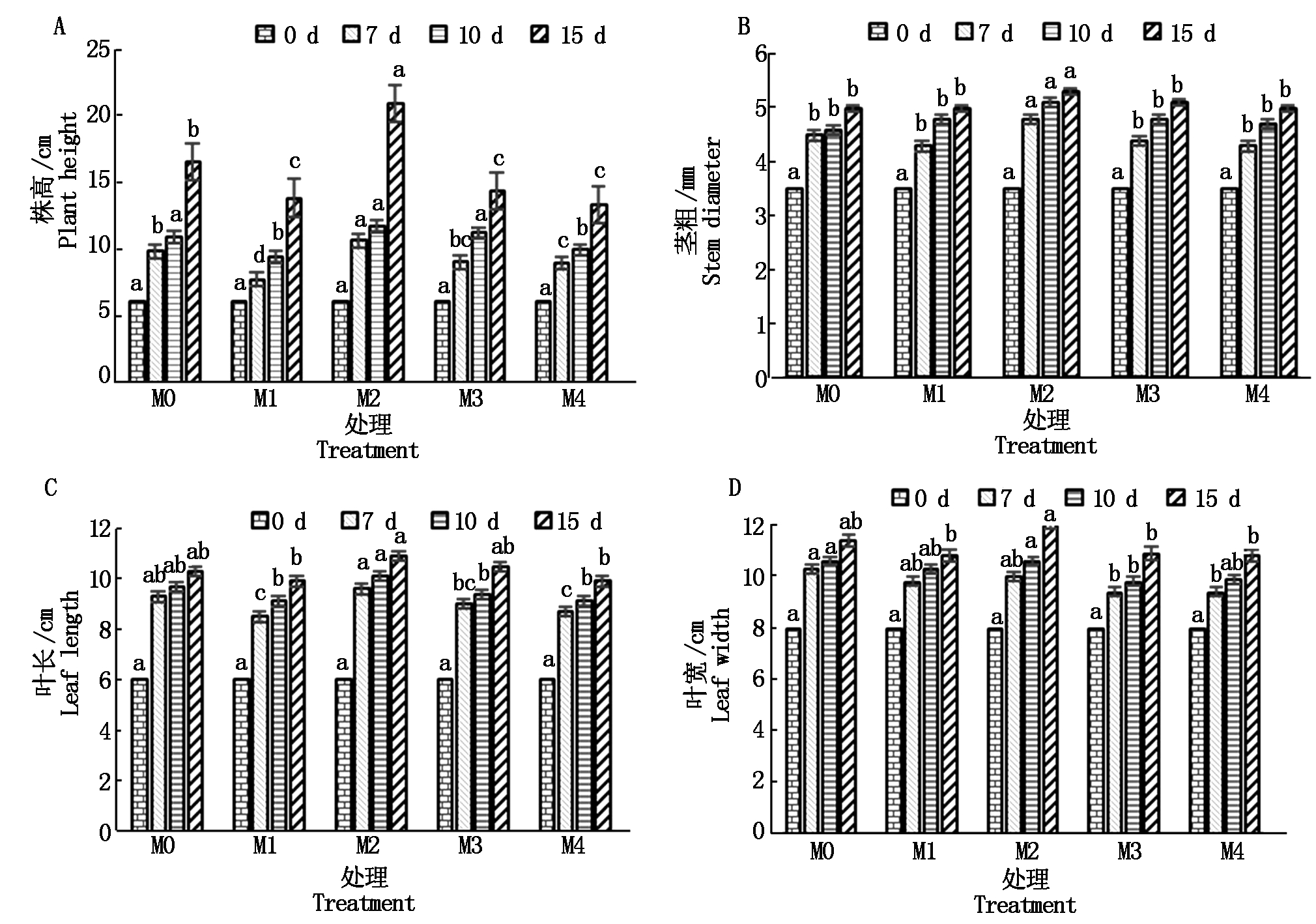
不同小写字母表示同一时期不同处理在0.05水平差异显著。图2-5同。
Different smaller letters mean significant difference at 0.05 level in different treatments in the same period. The same as Fig.2-5.
图1 不同褪黑素处理对黄瓜幼苗生长特性的影响
Fig.1 Effects of different melatonin treatments on the growth characteristics of cucumber seedlings
不同处理下黄瓜幼苗的叶长、叶宽会随着生长期逐渐增长;处理后7,10,15 d时,处理组M2和M3的幼苗叶长高于M0处理,处理M2叶长较M0高5.8%,但差异未达到显著水平;褪黑素浓度为 M1和M4的处理下,黄瓜幼苗的叶长均较M0处理低3.8%,在处理7 d时处理组M1和M4与对照组M0之间的差异达到显著水平,在处理10,15 d时与对照组M0之间的差异未达到显著水平(图1-C)。
处理后7,10 d,不同的处理下黄瓜幼苗的叶宽无显著性差异;在处理15 d后,褪黑素浓度为M2的处理黄瓜幼苗的叶宽较M0处理高6%,但差异未达到显著水平,较其他处理组均高10%左右,且差异达到了显著水平。结果表明,褪黑素浓度为M2的处理下,对黄瓜幼苗叶长、叶宽的生长具有促进作用(图1-D)。
2.2 外源褪黑素对黄瓜幼苗渗透调节物质含量的影响
在盐渍环境下,不同处理中黄瓜幼苗的可溶性糖含量存在显著差异(P<0.05)。褪黑素浓度为M1、M3和M4时,处理组中黄瓜幼苗可溶性糖含量均显著低于M0处理;当外源褪黑素浓度为M2时,黄瓜幼苗中可溶性糖含量最高,较M0处理高3.6%,且差异达到显著水平(图2-A)。结果表明,所施用的外源褪黑素浓度为M2时,对黄瓜幼苗叶片中可溶性糖含量的提高效果最佳。
在盐渍环境下,不同浓度的外源褪黑素处理对黄瓜幼苗的可溶性蛋白含量有不同的影响。当外源褪黑素浓度为M1时,黄瓜幼苗叶片中可溶性蛋白含量较M0处理高18.5%,且差异达到显著水平(P<0.05);当外源褪黑素浓度为M2和M4时,黄瓜幼苗叶片中可溶性蛋白含量之间无显著差异,均较M0处理高13.8%,但与M0处理之间差异不显著;当外源褪黑素浓度为M3时,黄瓜幼苗叶片中可溶性蛋白含量较M0处理低18.6%,且差异达到显著水平(图2-B)。结果表明,外源褪黑素浓度为M1、M2和M4处理时,可以提高盐渍环境下黄瓜幼苗叶片中可溶性蛋白的含量,并且褪黑素处理浓度为M1的提高效果最显著。
植物体内脯氨酸不仅是渗透调节物质,而且还可以作为膜和酶的保护物质以及自由基清除剂,从而对黄瓜在渗透胁迫下的生长起到保护作用。在不同浓度外源褪黑素处理下,黄瓜幼苗的脯氨酸含量均有所提高;褪黑素处理浓度为M2时,脯氨酸含量较M0处理提高了37.5%,且差异达到显著水平(P<0.05);处理组M4的脯氨酸含量较M0处理高50.0%,差异达到显著水平(P<0.05);褪黑素处理浓度为M1和M3时,黄瓜幼苗脯氨酸含量分别提高了25.0%,12.5%,但差异未达到显著水平(图2-C)。结果表明,当外源褪黑素处理浓度为M2和M4时,处理效果较好。
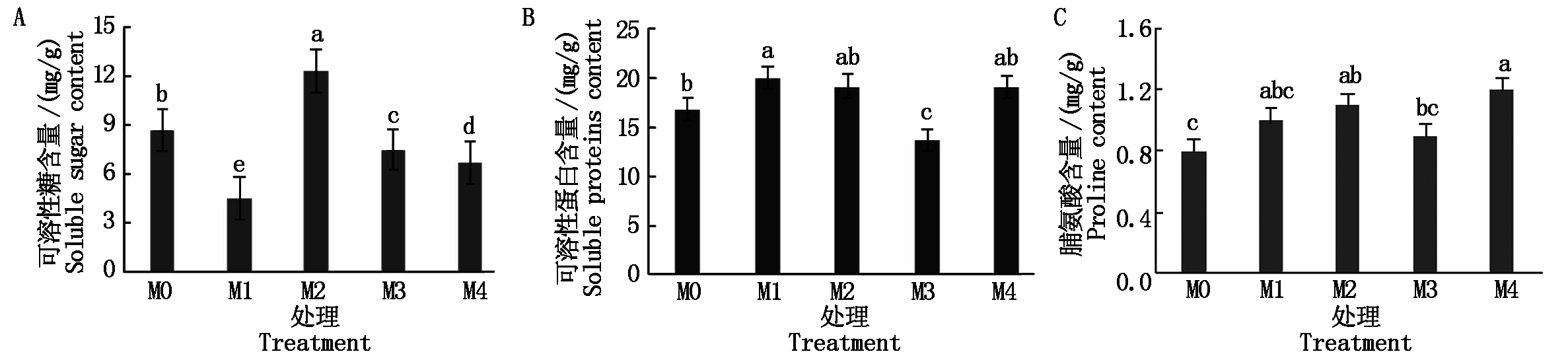
图2 外源褪黑素对黄瓜幼苗渗透调节物质含量的影响
Fig.2 Effects of exogenous melatonin on osmotic regulation substance content in cucumber seedlings
2.3 外源褪黑素对黄瓜幼苗抗氧化酶活性的影响
盐渍环境会导致植物体内抗氧化酶活性提高,从而提高植物抵抗逆境的能力。由图3可知,不同外源褪黑素浓度的M1、M2、M3、M4处理的黄瓜幼苗叶片中SOD活性分别较M0处理提高了1.6%,95.8%,57.3%和37.0%;其中,当外源褪黑素浓度为M1时,与M0处理之间的差异未达到显著水平;当外源褪黑素浓度为M2时,黄瓜幼苗叶片中的SOD活性最高,并且与处理组M0、M1、M3和M4处理之间的差异均达到显著水平;当外源褪黑素浓度为M3和M4的处理中,黄瓜幼苗叶片SOD活性的平均值均较M0处理高37.0%,并且较处理组M2的均值低30.0%,且差异均达到显著水平(P<0.05)(图3-A)。结果表明,当外源褪黑素的处理浓度为M2时,对盐渍环境下黄瓜幼苗叶片中SOD活性的提高效果较好。
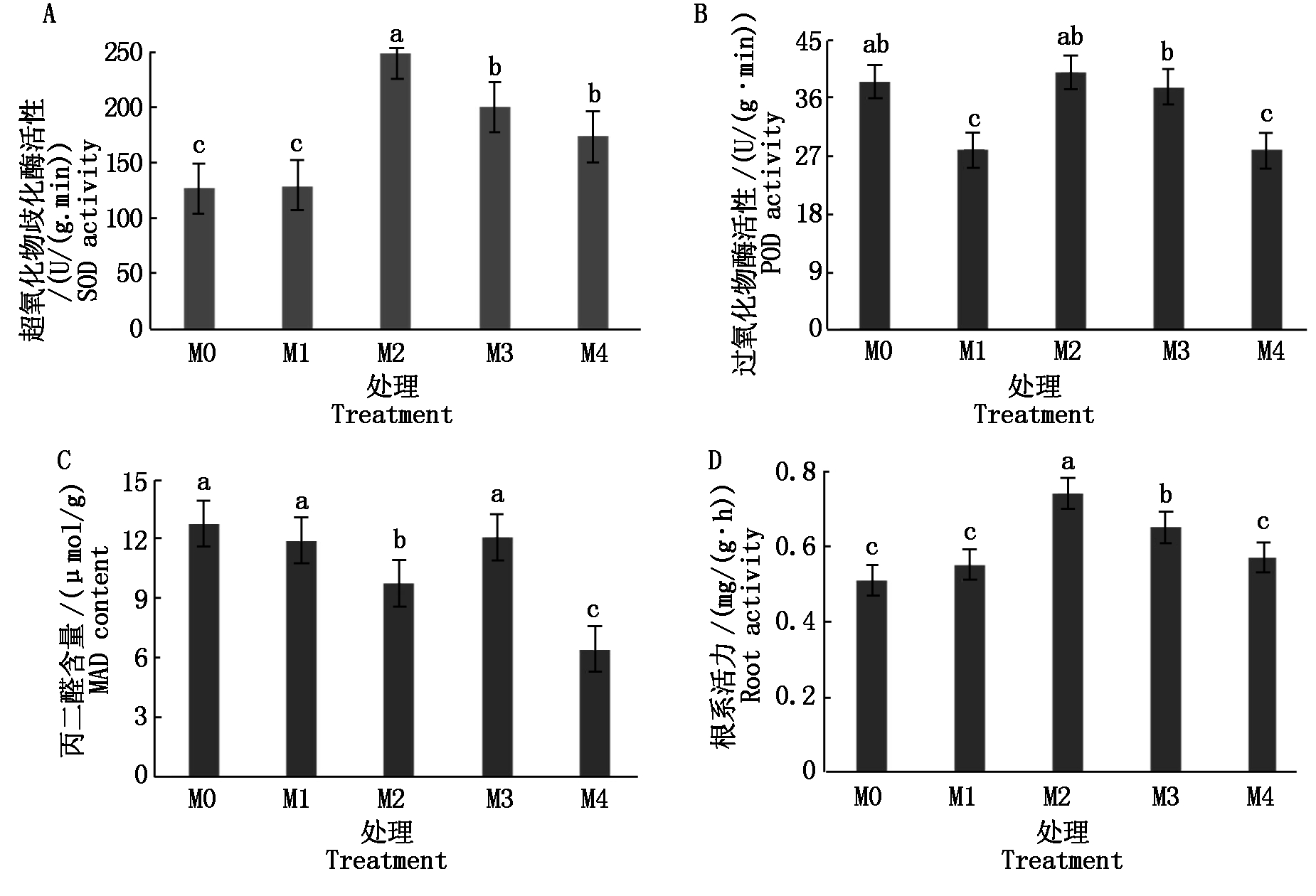
图3 外源褪黑素对黄瓜幼苗抗氧化酶活性和根系活力的影响
Fig.3 Effects of exogenous melatonin on antioxidant enzyme activity and root activity of cucumber seedlings
由图3可知,盐渍环境下,褪黑素处理浓度为M2时,黄瓜幼苗叶片的POD活性较M0处理提高了3.6%,但差异未达到显著水平(P>0.05);褪黑素处理浓度为M1、M3、M4处理时,黄瓜幼苗叶片的POD活性较M0处理分别降低27.7%,2.3%,27.7%,褪黑素浓度为M1与M4的处理与M0处理的差异达到显著水平(P<0.05),褪黑素处理浓度为M3的处理组与M0处理的差异不显著(图3-B)。
盐渍环境下,M0处理黄瓜幼苗叶片的丙二醛(MDA)含量为12.79 μmol/g,在不同浓度外源褪黑素的处理下,MDA含量均有所降低。当褪黑素浓度为M2时,黄瓜幼苗的MDA含量M0处理降低了23.7%,且差异达到显著水平(P<0.05);当褪黑素浓度为M4时,黄瓜幼苗的MDA含量较M0处理降低了49.6%,且差异达到显著水平(P<0.05);褪黑素浓度为M1、M3时,黄瓜幼苗中MDA含量较M0处理分别将低6.9%,4.0%,但差异均未达到显著水平(P>0.05)(图3-C)。
在盐渍环境下,黄瓜幼苗的根系活力受到抑制,在不同浓度外源褪黑素的处理下,幼苗的根系活力较M0处理有相应提高。由图3可知,不同褪黑素浓度M1、M2、M3和M4处理下黄瓜幼苗的根系活力分别较M0处理提高了7.8%,39.2%,27.0%,11.8%,但褪黑素处理浓度为M2和M3的差异达到显著水平,褪黑素处理浓度为M1和M4的差异未达到显著水平(图3-D)。结果表明,施用外源褪黑素能够提高黄瓜幼苗的根系活力,并且在外源褪黑素浓度为M2时的处理效果最佳。
2.4 外源褪黑素对黄瓜幼苗光合色素含量与荧光参数的影响
由表1可知,当外源褪黑素处理浓度为M2时,黄瓜幼苗叶片的叶绿素a含量和叶绿素a/b分别较M0处理高37%,33%,差异达到显著水平;叶绿素b含量较对照组M0高22%,差异未达到显著水平;外源褪黑素浓度为M1和M3时,黄瓜幼苗中各种光合色素含量间差异不显著;处理组M1的叶绿素a含量、叶绿素b含量、类胡萝卜素含量和叶绿素a/b分别较M0处理高17.0%,2.8%,19.3%,13.2%,其中叶绿素a含量与对照组之间的差异达到显著水平;处理组M3的叶绿素a含量、叶绿素b含量、类胡萝卜素含量和叶绿素a/b分别较M0处理高21.4%,12.8%,12.7%,19.1%,叶绿素a含量和叶绿素a/b与对照组之间的差异达到显著水平。结果表明,当外源褪黑素浓度为M2时,对提高黄瓜幼苗光合色素含量的效果较好,并且喷时褪黑素的幼苗叶绿素a含量提高效果最好(F>F0.05(4,10),P<0.05)。
表1 外源褪黑素对黄瓜幼苗光合色素含量的影响
Tab.1 Effects of exogenous melatonin on photosynthetic pigment content in cucumber seedlings mg/g
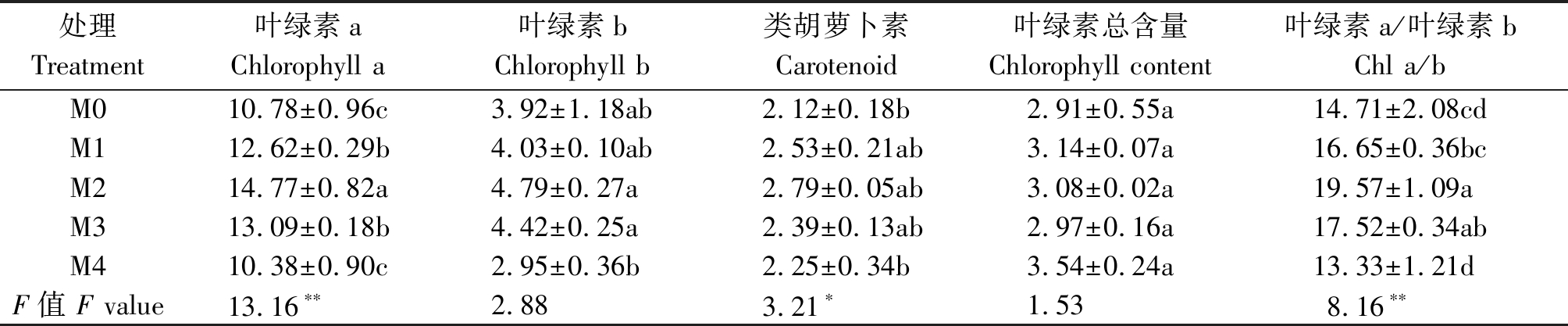
处理Treatment叶绿素aChlorophyll a叶绿素bChlorophyll b类胡萝卜素Carotenoid叶绿素总含量Chlorophyll content叶绿素a/叶绿素bChl a/bM010.78±0.96c3.92±1.18ab2.12±0.18b2.91±0.55a14.71±2.08cdM112.62±0.29b4.03±0.10ab2.53±0.21ab3.14±0.07a16.65±0.36bcM214.77±0.82a4.79±0.27a2.79±0.05ab3.08±0.02a19.57±1.09aM313.09±0.18b4.42±0.25a2.39±0.13ab2.97±0.16a17.52±0.34abM410.38±0.90c2.95±0.36b2.25±0.34b3.54±0.24a13.33±1.21dF值 F value13.16∗∗2.883.21∗1.538.16∗∗
注:表中数据为平均值±标准误;不同小写字母表示同一时期不同处理间差异显著(P<0.05);*、**分别表示方差分析结果在0.05,0.01水平显著。表2同。
Note: Results stand for means ± standard errors; Different lowercase letters indicate significant difference between different treatments in the same period (P<0.05),*,** represents the significantly result at 0.05,0.01 level, respectively. The same as Tab.2.
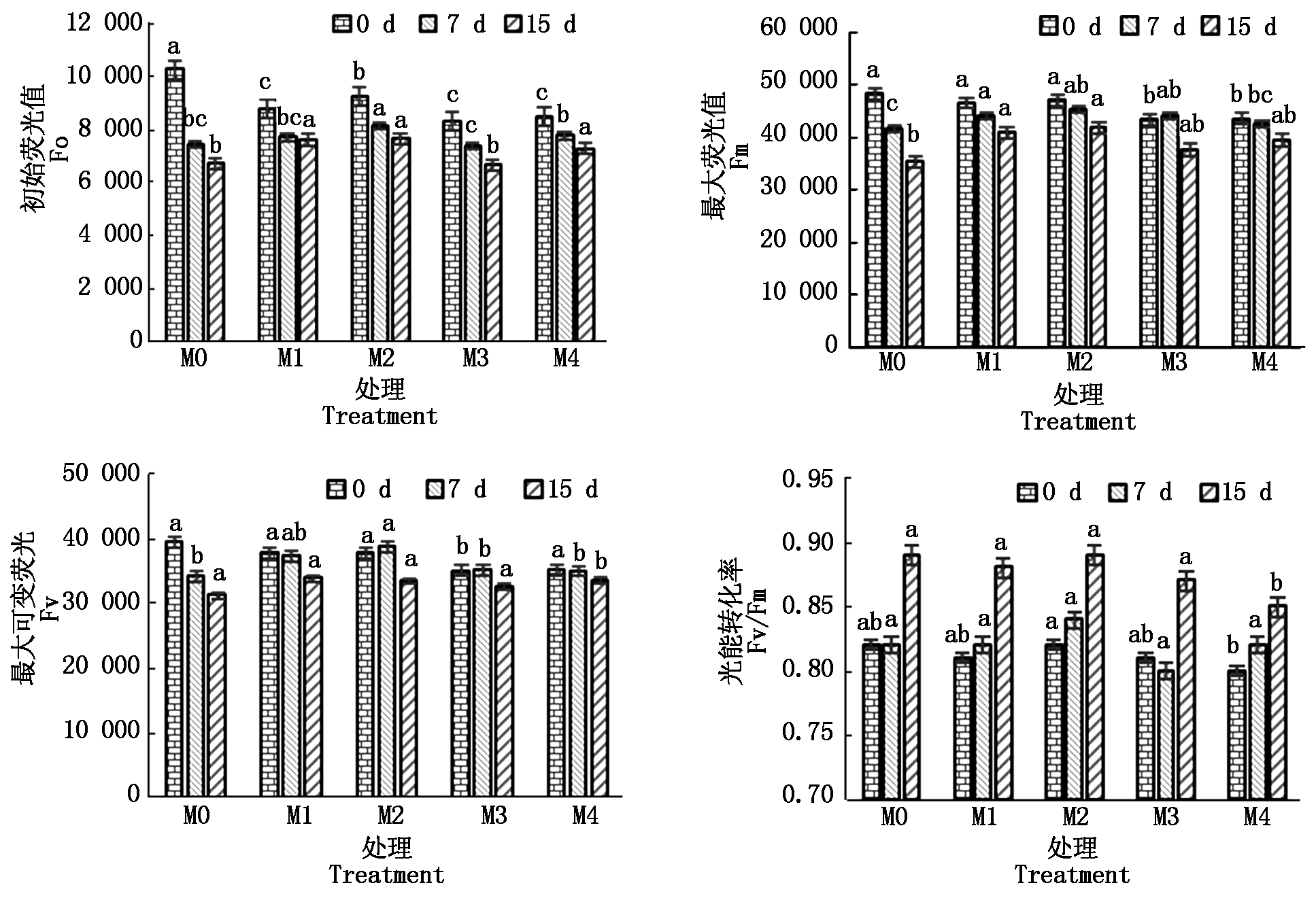
图4 外源褪黑素对黄瓜幼苗荧光参数的影响
Fig.4 Effect of exogenous melatonin on fluorescence parameters of cucumber seedlings
由图4可知,盐渍环境下,不同褪黑素处理的黄瓜幼苗的3个荧光参数(初始荧光值Fo、Fm和Fv)均随着生长期逐渐降低;浓度为M1、M2和M4的外源褪黑素处理幼苗15 d后,其初始荧光值(Fo)分别较M0处理高13.6%,13.9%,8.6%,且差异达到显著水平;褪黑素浓度为M3的处理组与M0处理之间无显著差异。不同处理下,黄瓜幼苗的最大荧光值(Fm)与初始荧光值(Fo)的变化趋势一致,处理7,15 d时,处理组M2幼苗的最大可变荧光分别较M0处理高12.9%,7.0%,差异达到了显著水平。不同处理组黄瓜幼苗的光能转化率在处理15 d后达到最高,并且外源褪黑素浓度为M1、M2和M3处理组幼苗的光能转化率与M0处理之间的差异未达到显著水平;处理组M4中幼苗的光能转化率(Fv/Fm)较M0处理低4.5%,且差异达到了显著水平。
2.5 外源褪黑素对黄瓜幼苗相对含水量及电导率的影响
由表2可知,通过在黄瓜幼苗叶片喷施不同浓度的外源褪黑素,对幼苗叶片的相对含水量和水分饱和亏都具有很大影响。处理15 d后,黄瓜幼苗叶片的相对含水量的平均值变化大小表现为:处理组M0的叶片相对含水量显著高于处理组M2和M4,处理组M1和M3分别较M0处理低7.9%,9.2%,差异未达到显著水平。处理15 d后,处理组M2和M4的水分饱和亏最大,都较M0处理高54.1%,差异达到显著水平;处理组M1和M3的水分饱和亏分别较M0处理高31.2%,36.1%,差异未达到显著水平。说明在幼苗叶片喷施褪黑素的处理降低了幼苗的水分保持能力。
表2 外源褪黑素对黄瓜幼苗相对含水量的影响
Tab.2 Effects of exogenous melatonin on the relative water content of cucumber seedlings %
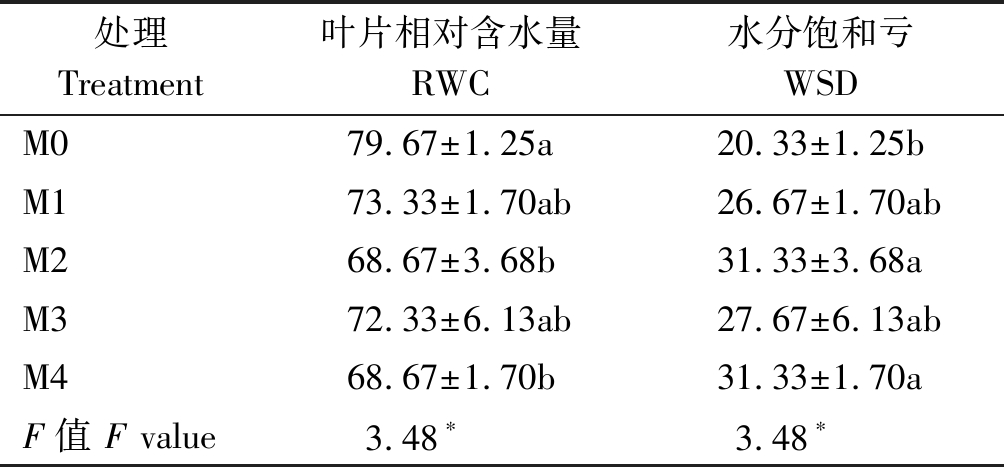
处理 Treatment叶片相对含水量RWC水分饱和亏WSDM079.67±1.25a20.33±1.25bM173.33±1.70ab26.67±1.70abM268.67±3.68b31.33±3.68aM372.33±6.13ab27.67±6.13abM468.67±1.70b31.33±1.70aF值 F value3.48∗3.48∗
盐渍环境下,植物细胞的细胞膜最先受到伤害,细胞膜透性增大,内容物外渗,电解质含量增大。通过外渗液电导率的变化可以反映出细胞膜受伤害的程度。由图5可知,处理组M1、M2、M3和M4幼苗叶片的相对电导率分别较M0处理降低了4,8,6,9百分点,且差异达到显著水平。结果表明,褪黑素浓度为M2和M4时,叶片的相对电导率降低效果较显著。
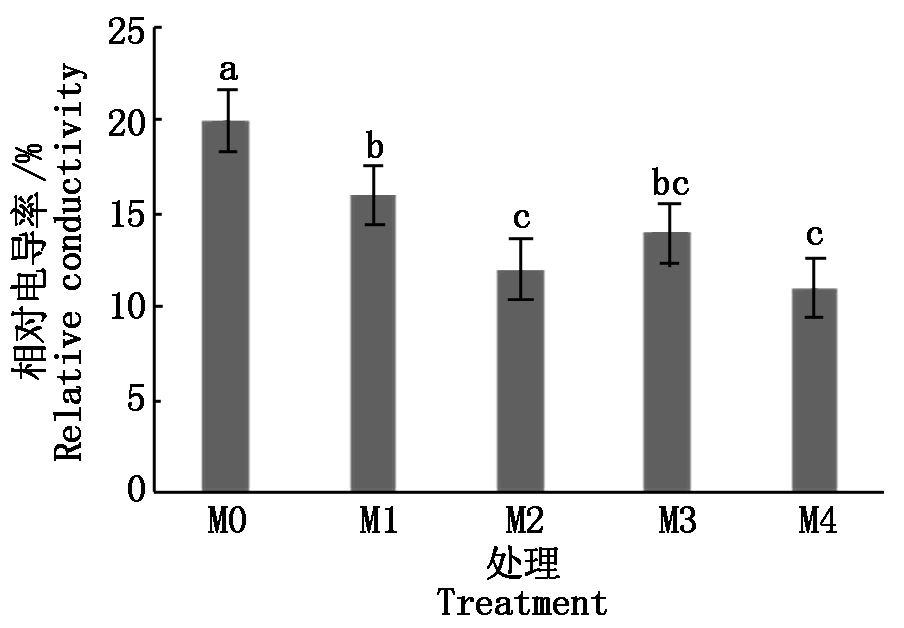
图5 外源褪黑素对黄瓜幼苗相对电导率的影响
Fig.5 Effect of exogenous melatonin on the electrical conductivity of cucumber seedlings
3 结论与讨论
随着我国农业的迅速发展,土地资源的开发强度提高,土壤盐渍化程度日益加剧,其已成为限制我国农业发展的重要因素之一。杨真等[17]研究发现,我国的盐渍土面积在逐渐增大,很多地区也在通过栽培耐盐品种、增施有机肥、覆膜栽培和灌溉压盐等方式改良盐渍土。耐盐品种的培育对盐渍环境在植物的生长也有很重要的作用,通过喷施外源激素提高植株耐盐性的研究逐渐增多。张毅等[18]研究发现,在番茄幼苗表面喷施外源亚精胺可以提高番茄幼苗的耐盐碱性,促进番茄幼苗在盐碱环境下的生长。唐慧玲[19]通过测定干旱胁迫下金莲花的渗透调节物质和膜质过氧化物等指标,结果发现,3种外源激素(脱落酸、细胞分裂素和烯效唑)对干旱胁迫下金莲花均具有不同的缓解效果。李晨智宇[20]研究发现,在用不同浓度褪黑素处理盐胁迫下的苹果植株时,对植株的缓解作用呈现先升高后降低的趋势,其中,100 μmol/L的褪黑素可有效缓解苹果受到的盐胁迫伤害,提高盐胁迫下苹果的抗氧化酶活性和生理活性,这与本研究结果一致。
植株的生长指标是对不同栽培环境下植株生长最直观的特性。孟长军[21]研究发现,盐胁迫会抑制番茄株高、茎粗和叶面积的生长,植株根系的生长受阻[22];宋雪飞[23]研究发现,外源褪黑素可以有效缓解盐胁迫对番茄生长的抑制作用,并且100 μmol/L的褪黑素处理效果最好。徐玉伟等[24]研究发现,盐胁迫会显著降低黄瓜幼苗的株高、茎粗和叶面积等指标。本研究结果发现,不同浓度褪黑素处理黄瓜幼苗后,均可以缓解盐胁迫对其的抑制作用,并且100 μmol/L的外源褪黑素缓解效果最佳,这与宋雪飞[23]的研究结果相似。
植物在逆境下会通过积累渗透调节物质来抵抗逆境胁迫的伤害[25]。可溶性糖、可溶性蛋白和脯氨酸等渗透调节物质,在逆境下会保护植物细胞膜。王明瑶等[26]研究发现,外源褪黑素处理不同盐浓度下生长的大豆,植株体内的渗透调节物质呈现先升高后降低的趋势,说明外源褪黑素可以缓解不同程度盐渍环境对大豆生长的抑制作用。本研究发现,外源褪黑素浓度为100 μmol/L时,会显著提高黄瓜幼苗叶片中渗透调节物质的含量,提高其抗逆性。
植物细胞内自由基的产生与清除在正常生长情况下处于动态平衡,盐渍环境下植株的这种平衡被打破,自由基大量积累引起膜脂过氧化作用,导致细胞膜受损。SOD和POD是植物体自身合成的活性氧清除剂。本研究发现,外源褪黑素处理能够促进盐渍环境下黄瓜幼苗体内抗氧化酶的合成,提高幼苗在逆境下的抗氧化能力。
叶片相对电导率和MDA含量是衡量植物细胞膜脂过氧化的重要指标[27-28]。杨新元[29]研究结果发现,外源褪黑素可以通过提高干旱胁迫下向日葵幼苗的活性氧清除能力和光合作用来缓解胁迫环境对幼苗生长的伤害,从而提高植株的耐旱性。孙常青等[30]研究发现,干旱胁迫下发芽期小麦MDA含量的变化和电导率的变化趋势一致,逆境胁迫导致细胞膜过氧化程度较重时MDA含量增加,引起膜脂过氧化作用,影响细胞电解质渗透,使电导率增加。本试验结果表明,不同浓度的褪黑素处理后,黄瓜幼苗叶片的MDA含量和叶片相对电导率均低于未处理,且在100 μmol/L浓度时的降低效果最明显。说明该浓度的褪黑素能够降低盐渍环境下黄瓜叶片内活性氧的积累,减轻细胞膜的氧化程度。
综上所述,中度盐胁迫会抑制植株体内可溶性蛋白、可溶性糖和脯氨酸等渗透调节物质的合成,通过喷施一定浓度的褪黑素,可以显著提高其渗透调节物质的含量,降低黄瓜幼苗叶片的相对电导率和MDA含量,从而降低细胞膜的膜质过氧化程度,提高植株抗逆性;褪黑素处理后,黄瓜幼苗的SOD、POD和根系活力等抗氧化酶活性提高,促进了植株体内活性氧的清除,增强植物抗逆性,缓解盐渍环境对黄瓜幼苗生长的影响。
[1] 刘维宝,陈新红,周羽,周青. 外源水杨酸对NaCl胁迫下黄瓜种子萌发和幼苗根系生长的影响[J]. 中国农学通报,2013,29(34):166-170.
Liu W B,Chen X H,Zhou Y,Zhou Q. Effect of salicylic acid on cucumber seed germination and seedling root growth under NaCl stress[J]. Chinese Agricultural Science Bulletin,2013,29(34):166-170.
[2] 陈思奇,蒋毓婷. 设施土壤次生盐渍化的成因、危害及治理措施[J]. 辽宁化工,2018,47(11):1146-1148. doi:10.3969/j.issn.1004-0935.2018.11.024.
Chen S Q,Jiang Y T. Causes,harm and control measures of secondary salinization of greenhouse soil[J]. Liaoning Chemical Industry,2018,47(11):1146-1148.
[3] 白龙强,李衍素,于贤昌,郭晓青. 土壤含盐量对有机基质栽培番茄生长、光合特性及产量的影响[J].中国蔬菜,2013(2):41-51. doi:10.3969/j.issn.1000-6346.2013.02.007.
Bai L Q,Li Y S,Yu X C,Guo X Q. Effects of soil salinity on growth,photosynthetic characters and yield of tomato cultivated in organic substrate[J]. China Vegetables,2013(2):41-51.
[4] 罗庆云,於丙军,刘友良. NaCl胁迫下Cl-和Na+对大豆幼苗胁迫作用的比较[J]. 中国农业科学,2003,36(11):1390-1394. doi:10.3321/j.issn:0578-1752.2003.11.028.
Luo Q Y,Yu B J,Liu Y L. The comparison of stress effects between chloridion and sodium ion on Glycine max seedlings under NaCl stress[J]. Scientia Agricultura Sinica,2003,36(11):1390-1394.
[5] 袁颖辉. 腐胺缓解黄瓜植株盐胁迫伤害的生理和蛋白质基础[D]. 南京:南京农业大学,2017.
Yuan Y H. Physiological and proteomic bases of putrescine alleviating salt stress induced injuries in cucumber plants[D]. Nanjing:Nanjing Agricultural University,2017.
[6] Lerner A B,Case J D,Takahashi Y,Lee T H,Mori W. Isolation of melatonin,the pineal gland factor that lightens melanocytes[J]. Journal of the American Chemical Society,1958,80(10):2587. doi:10.1021/ja01543a060.
[7] Arnao M B,Hern ndez-Ruiz J. Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789-797. doi:10.1016/j.tplants.2014.07.006.
ndez-Ruiz J. Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789-797. doi:10.1016/j.tplants.2014.07.006.
[8] Tan D X,Manchester L C,Reiter R J,Plummer B F,Limson J,Weintraub S T,Qi W B. Melatonin directly scavenges hydrogen peroxide:A potentially new metabolic pathway of melatonin biotransformation[J]. Free Radical Biology and Medicine,2000,29(11):1177-1185. doi:10.1016/s0891-5849(00)00435-4.
[9] Arnao M B,Hern ndez-Ruiz J. Chemical stress by different agents affects the melatonin content of barley roots[J]. Journal of Pineal Research,2009,46(3):295-299. doi:10.1111/j.1600-079X.2008.00660.x.
ndez-Ruiz J. Chemical stress by different agents affects the melatonin content of barley roots[J]. Journal of Pineal Research,2009,46(3):295-299. doi:10.1111/j.1600-079X.2008.00660.x.
[10] 周永海,杨丽萍,马荣雪,董亚萍,张显,马建祥,李好,魏春华,杨建强,张勇. 外源褪黑素对高温胁迫下甜瓜幼苗抗氧化特性及其相关基因表达的影响[J]. 西北农业学报,2020,29(5):745-751. doi:10.7606/j.issn.1004-1389.2020.05.011.
Zhou Y H,Yang L P,Ma R X,Dong Y P,Zhang X,Ma J X,Li H,Wei C H,Yang J Q,Zhang Y. Effects of exogenous melatonin on antioxidant properties and related gene expression in Melon seedlings under high temperature stress [J].Acta Agriculturae Boreali-occidentalis Sinica,2020,29(5):745-751.
[11] 杜天浩. 外源褪黑素对NaCl胁迫下番茄幼苗生理代谢和产量及品质的影响[D]. 杨凌:西北农林科技大学,2016.
Du T H. Effects of exogenous melatonin on tomato seeldings physiology and fruit yield and quality under NaCl stress[D]. Yangling:Northwest A and F University,2016.
[12] 刘政,胡孙田,沈晓飞,朱培,褚旭东,李卓娅,罗平. 外源褪黑素处理对月季幼苗盐胁迫的缓解效应[J]. 浙江农林大学学报,2020,37(5):957-962. doi:10.11833/j.issn.2095-0756.20190604.
Liu Z,Hu S T,Shen X F,Zhu P,Chu X D,Li Z Y,Luo P. Alleviation of exogenous melatonin on rose seedlings under salt stress[J].Journal of Zhejiang Agriculture and Forestry University,2020,37(5):957-962.
[13] 刘珂,张嘉欣,杜清洁,刘珂珂,马勇斌,丁新新,肖怀娟. 外源褪黑素对盐胁迫下香椿种子萌发及幼苗生长的影响[J]. 中国瓜菜,2020,33(5):53-58. doi:10.16861/j.cnki.zggc.20200509.001.
Liu K,Zhang J X,Du Q J,Liu K K,Ma Y B,Ding X X,Xiao H J. Effects of exogenous melatonin on seed germination and seeding growth of Toona sinensis under salt stress[J]. China Cucurbits and Vegetables,2020,33(5):53-58.
[14] 李合生,孙群,赵世杰. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
Li H S,Sun Q,Zhao S J. Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2000.
[15] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
Gao J F. Experimental guidance of plant physiology[M]. Beijing:Higher Education Press,2006.
[16] 赵世杰,许长成,邹琦,孟庆伟. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯,1994,30(3):207-210.
Zhao S J,Xu Z C,Zou Q,Meng Q W. Improvements of measurement of malondialdehvde in plant tissue[J]. Plant Physiology Communication,1994,30(3):207-210.
[17] 杨真,王宝山. 中国盐渍土资源现状及改良利用对策[J]. 山东农业科学,2015,47(4):125-130. doi:10.14083/j.issn.1001-4942.2015.04.032.
Yang Z,Wang B S. Present status of saline soil resources and countermeasures for improvement and utilization in China [J].Shandong Agricultural Sciences,2015,47(4):125-130.
[18] 张毅,石玉,胡晓辉.外源亚精胺对盐碱胁迫下番茄幼苗光合特性的影响[J]. 西北农林科技大学学报(自然科学版),2016,44(2):144-150. doi:10.13207/j.cnki.jnwafu.2016.02.020.
Zhang Y,Shi Y,Hu X H. Effects of exogenous spermidine on photosynthetic characteristics of tomato seedlings under salinity-alkalinity stress[J]. Journal of Northwest A and F University(Natural Science Edition),2016,44(2):144-150.
[19] 唐慧玲. 干旱胁迫下外源激素对金莲花幼苗生理特性的影响[J].现代农村科技,2020(1):46,71.
Tang H L. Effects of exogenous hormones on physiological characteristics of Trollius chinensis seedlings under drought stress[J]. Xiandai Nongcun Keji,2020(1):46,71.
[20] 李晨智宇. 外源褪黑素和抗坏血酸对NaCl胁迫下苹果砧木M9T337生理特性的影响[D]. 泰安:山东农业大学,2020. doi:10.27277/d.cnki.gsdnu.2020.000711.
Li C Z Y. Effects of exogenous melatonin and ascorbic acid on physiological characteristics of apple:rootstock M9T337 under Nacl stress[D]. Tai′an:Shandong Agricultural University,2020.
[21] 孟长军. 盐胁迫对樱桃番茄幼苗形态指标的影响[J]. 吉林农业科学,2012,37(3):45-48. doi:10.3969/j.issn.1003-8701.2012.03.013.
Meng C J. Effects of salt stress on morphological index of cherry tomato seedlings[J]. Journal of Jilin Agricultural Sciences,2012,37(3):45-48.
[22] 张培培,杜锦,向春阳,李炎. NaCl胁迫对玉米种子活力及幼苗性状的影响[J]. 中国农学通报,2011,27(30):35-38.
Zhang P P,Du J,Xiang C Y,Li Y. Effects of NaCl stress on the seed vigour and seedling traits of maize[J]. Chinese Agricultural Science Bulletin,2011,27(30):35-38.
[23] 宋雪飞. 褪黑素调控番茄幼苗耐盐性的浓度效应及其生理机制的研究[D]. 扬州:扬州大学,2018.
Song X F. Study on the concentration effect of melatonin on salt tolerance of tomato seedlings and its physiological mechanism[D]. Yangzhou:Yangzhou University,2018.
[24] 徐玉伟,郭世荣,程玉静,熊银锋,黄海桃. Ca(NO3) 2对盐胁迫下黄瓜幼苗生长及膜质过氧化的影响[J].中国蔬菜,2010(4):14-18.
Xu Y W,Guo S R,Cheng Y J,Xiong Y F,Huang H T. Effects of exogenous Ca(NO3)2 of different concentration on growth of cucumber seedlings under salt stress and plant membrane lipid peroxidation[J]. China Vegetables,2010(4):14-18.
[25] 华智锐,李小玲. 盐旱交叉胁迫对小麦幼苗渗透调节能力的影响[J]. 山西农业科学,2017,45(2):166-171. doi:10.3969/j.issn.1002-2481.2017.02.05.
Hua Z R,Li X L. Effects of salt and drought cross stress on osmotic adjustment ability of wheat seedling[J]. Journal of shanxi Agricultural Sciences,2017,45(2):166-171.
[26] 王明瑶,曹亮,于奇,邹京南,何松榆,秦彬,王孟雪,张玉先. 褪黑素浸种对盐碱胁迫下大豆种子萌发的影响[J]. 作物杂志,2019(6):195-202. doi:10.16035/j.issn.1001-7283.2019.06.031.
Wang M Y,Cao L,Yu Q,Zou J N,He S Y,Qin B,Wang M X,Zhang Y X. Effects of melatonin soaking on germination of soybean seeds under saline-alkali stress[J]. Crops,2019(6):195-202.
[27] 李慧,王妙媛,彭立新,林木强,阎国荣. NaCl胁迫对胡卢巴幼苗抗氧化酶活性和丙二醛含量的影响[J]. 华北农学报,2012,27(2):185-188. doi:10.3969/j.issn.1000-7091.2012.02.035.
Li H,Wang M Y,Peng L X,Lin M Q,Yan G R. Effects of NaCl stress on activities of antioxidant enzymes and MDA content in Trigonella foenum-graecum L. seedlings[J]. Acta Agriculturae Boreali-Sinica,2012,27(2):185-188.
[28] 严加坤,周奇,刘莉. 褪黑素处理对干旱胁迫下玉米种子萌发的影响[J]. 山西农业科学,2019,47(2):159-161,193. doi:10.3969/j.issn.1002-2481.2019.02.04.
Yan J K,Zhou Q,Liu L. Effects of melatonin treatment on seed germination of maize under drought stress[J]. Journal of Shanxi Agricultural Sciences,2019,47(2):159-161,193.
[29] 杨新元. 外源褪黑素对干旱胁迫下向日葵幼苗生长、光合及抗氧化系统的影响[J]. 华北农学报,2019,34(4):113-121. doi:10.7668/hbnxb.201751697.
Yang X Y. Effects of exogenous melatonin on growth,photosynthesis and antioxidant system of sunflower seedling under drought stress[J]. Acta Agriculturae Boreali-Sinica,2019,34(4):113-121.
[30] 孙常青,屈非,王晋,韵晓冬,孙丽,郭志利. 不同小麦品种发芽期水分胁迫生理响应机制研究[J]. 山西农业科学,2018,46(10):1598-1601. doi:10.3969/j.issn.1002-2481.2018.10.03.
Sun C Q,Qu F,Wang J,Yun X D,Sun L,Guo Z L. Study on physiological response mechanism of water stress in different wheat varieties during germinating period[J]. Journal of Shanxi Agricultural Sciences,2018,46(10):1598-1601.