水稻属沼泽性植物,具有发达的通气组织,能将氧运输到根部,满足根系对氧的需求并改善根际环境,使其能够适应渍水环境。尽管如此,缺氧仍是影响水稻生长发育的关键因子[1-2]。苗期缺氧毫无疑问会抑制根系有氧呼吸。徐春梅等[3]研究了水稻秧苗对低氧胁迫的响应,表明缺氧显著降低秧苗根系的有氧呼吸作用,减少根系活动所需的能量供给,此外,在很多其他作物如番茄、黄瓜、甜茶、甜瓜、樱桃、牡丹和丝瓜[4-9]上的缺氧栽培中也观察到了根系有氧呼吸活动的急剧降低。根系的呼吸作用集物质代谢与能量代谢为一体,构成了地下部代谢的中心,而植物体内氮的吸收、还原和同化过程需要消耗呼吸作用释放的能量(ATP)和碳架,且碳氮代谢需要共同的还原力,因此,缺氧条件下根系呼吸强度的降低必然会导致根系氮代谢的改变[10-12]。
根际缺氧对于水稻幼苗的影响可能尤为突出,原因在于:在湿润育秧和水育秧中,三叶期前机插水稻育秧土中容易处于低氧或缺氧状态,而此时秧苗植株内尚无畅通的氧气下行通道[13],根区环境氧是根系呼吸代谢氧的重要来源。水稻二叶一心期-三叶一心期时第一节位分蘖芽处于三幼一基期,是分化发育的敏感期[14],根区缺氧对三叶期前水稻幼苗生长发育的重要性应有别于对大田期成苗的重要性。尽管如此,目前关于氧对水稻幼苗氮代谢影响的报道较少。
本研究以水稻幼苗为研究对象,通过在不同叶龄期实施短期的淹水处理,使水稻幼苗遭受短期缺氧胁迫,旨在探索水稻幼苗生长及根系氮代谢关键酶活性对短期缺氧处理的响应及其与叶龄的关系。
1 材料和方法
1.1 供试材料
试验于2017年11月在湖南省长沙市中国农业科学院麻类研究所进行。分别在小拱棚自然光照条件下和人工气候箱中进行。供试水稻品种为黄华占。将取自水稻田的土壤粉碎后作为育秧土,所用的稻田土是典型的粘土,其理化特性如下:有机质24.2 g/kg,全氮1.53 g/kg,全磷0.57 g/kg,全钾59.0 g/kg,水解氮 31.2 mg/kg,速效磷48.4 mg/kg,速效钾107.0 mg/kg。采用市场购买的12穴育苗盒育苗,育苗盒由储水盒和穴孔盘组成,整体尺寸为19 cm(长)×14 cm(宽)×6 cm(高),单个穴孔尺寸为4 cm(长)×4 cm(宽)×5 cm(高)。小拱棚中采用了自动控制地热线,结合主动通风,控制棚内温度为15~30 ℃。人工气候箱光照周期为12 h昼/12 h夜,光强设定为16 000 lx,昼温设定为35 ℃,夜温20 ℃。试验过程中环境温度和光照变化见图1。
1.2 试验方法
1.2.1 处理设置 根据秧苗实施淹水时期的不同,共设置5个处理,分别为全程无淹水处理(CK),一叶一心期至二叶一心期淹水处理(T1),二叶一心期至三叶一心期淹水处理(T2),三叶一心期至四叶一心期淹水处理(T3),全程淹水处理(T4)。每个处理设置3次重复,即使用3盘秧苗。
1.2.2 淹水处理方法 将氮气通入自来水中,并持续曝气10 min,使得自来水中的氧浓度低于1 mg/L,成为低氧水,然后将储水盒装满低氧水,将育苗穴盘慢慢置于储水盒中,使低氧水浸没育秧土,试验过程中每天添加低氧水保持育秧土持续处于淹没状态。
1.2.3 试验过程 2017年11月6日播种,用粉碎的育秧土填充穴孔盘,并在每个穴孔里播种约15粒种子,共播种30盘,置于小拱棚中育苗,期间保持育秧土壤湿润。至11月16日时,此时秧苗已经进入一叶一心期,此时将15盘秧苗转移至人工气候箱,另15盘继续置于小拱棚中。并从此时开始开展淹水试验,其中CK一直未做淹水处理,T1、T2和T3处理分别在11月16日、11月19日、11月22日开始实施淹水处理,并分别在11月19日、11月22日、11月25日结束淹水处理,T4在11月16日开始实施淹水处理,在11月25日结束淹水处理。 试验期间,每隔3天从各处理中取样分析(前期经历理论上完全一致的处理合并取样分析),每次取样时从每个穴盘中随机取2穴秧苗,用于分析测定。从11月16日到12月1日每隔3 d取样一次,共取样6次。

A.自然光照小拱棚;B.人工气候箱。图4-8同。
A.Experiment in the small arch shed under natural light; B. Experiment in the artificial climate chamber.The same as Fig.4-8.
图1 试验过程中环境温度和光照变化
Fig.1 Changes of temperature and light during experiment
1.3 测定指标和方法
1.3.1 秧苗生物量与株高 将秧苗仔细洗去土壤,相互分离,然后用吸水纸吸去植株表面水分,分别测定地上部和地下部单株鲜质量,同时测定秧苗株高(仅人工气候箱试验)。
1.3.2 根系呼吸代谢关键酶活性 将测定完鲜质量的秧苗根系储存于零下4 ℃冰箱中,用以测定根系碳氮代谢关键酶活力。根系氮代谢关键酶包括硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT),上述酶活性均基于分光光度法,采用索莱宝公司生产的试剂盒测定。
1.4 数据处理
采用SAS 8.2和Excel 2013分析数据并制图。
2 结果与分析
2.1 土壤氧浓度
从图2可以看出,在淹水条件下,育秧土中的氧浓度迅速下降,在大约5 h后接近零。此后在淹水过程中,育秧土中持续保持在缺氧状态。撤除淹水处理后,随着土壤中重力水的流失,在不到5 h内,土壤中的氧浓度迅速升高至大气氧浓度状态。
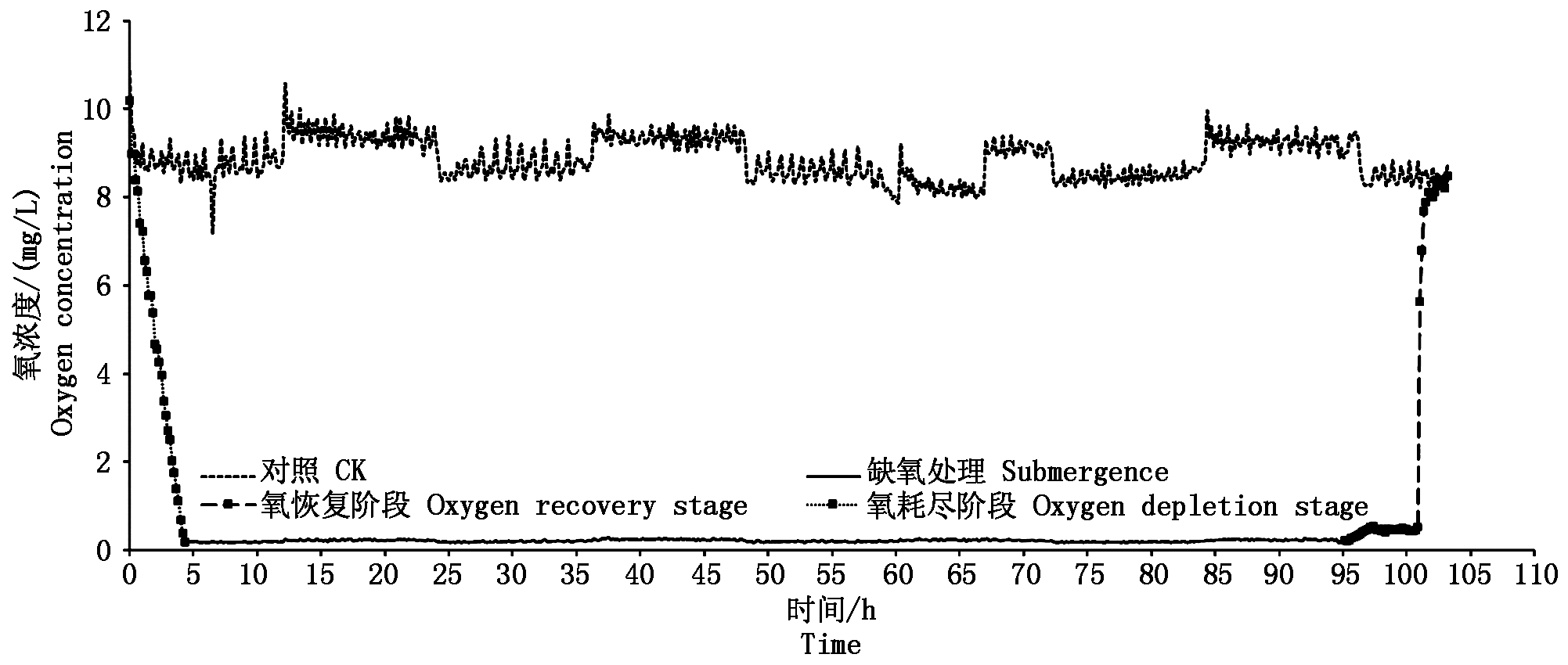
图2 淹水过程中土壤氧浓度的变化
Fig.2 Changes of soil oxygen concentration in the process of submergence
2.2 秧苗株高
在整个试验过程中,秧苗株高持续增加(图3)。不管是在哪个时期实施的短期淹水处理,均促进了地上部生长,这种促进效果在淹水0~6 d内并不明显,在淹水6~9 d后与对照秧苗的株高差异明显,在11月28日取样时,各淹水处理秧苗的株高均显著高于对照,显示淹水处理对秧苗株高的影响具有一定的滞后性。
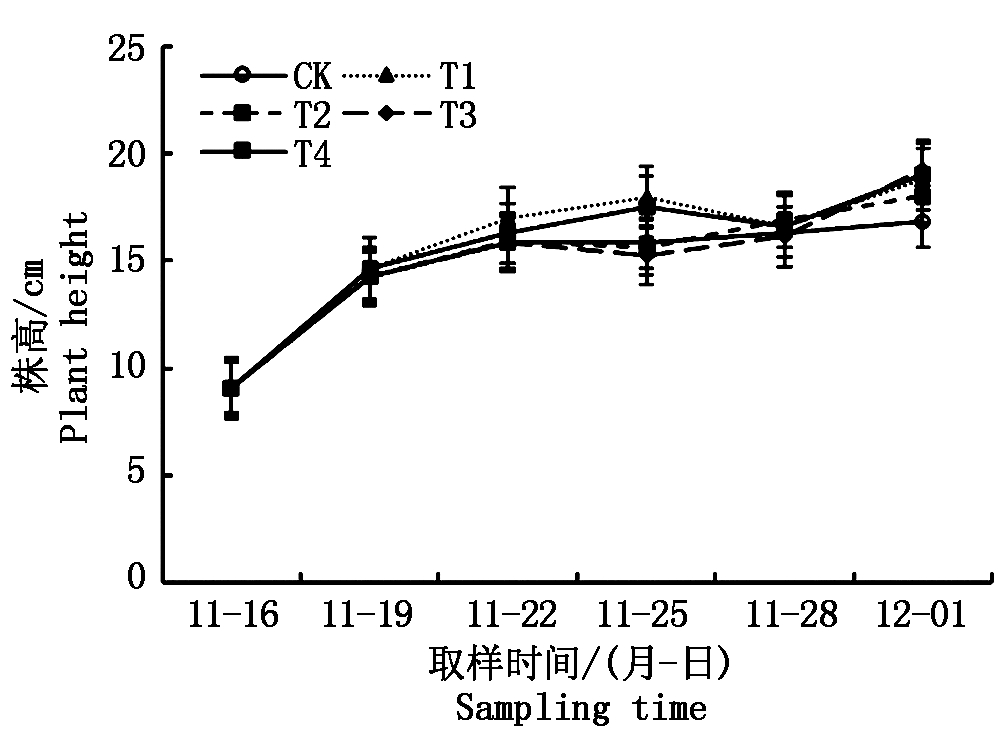
图3 不同淹水处理下秧苗株高的变化(人工气候箱试验)
Fig.3 Change in plant height of rice seedling shoot under
different submergence treatments
(experiment in the artificial climate chamber)
2.3 秧苗生物量
在整个试验过程中,秧苗地上部鲜质量持续增加。不管是在哪个时期实施的短期淹水处理,均在短期内促进了地上部生长,如在自然光照小拱棚试验中(图4-A),从一叶一心期到二叶一心期,CK地上部单株鲜质量提高了3.6 mg/株,同时期T1和T4处理提高了8.3 mg/株;从二叶一心期到三叶一心期,CK地上部单株鲜质量提高了0.5 mg/株,同时期T2和T4处理分别提高了4.2,4.8 mg/株;从三叶一心期到四叶一心期,CK地上部单株鲜质量提高了11.4 mg/株,同时期T3和T4处理分别提高了17.1,11.9 mg/株。人工气候箱试验中秧苗地上部变化规律与小拱棚试验中的基本一致(图4-B)。
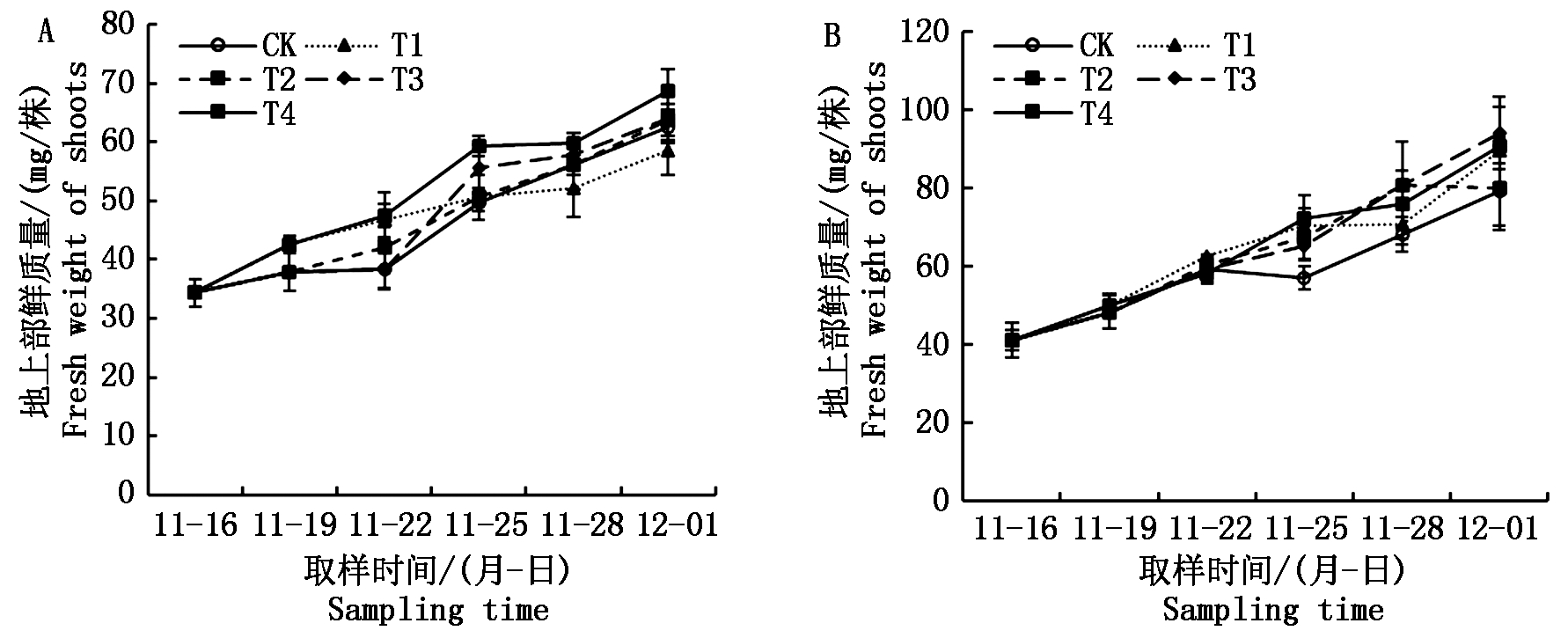
图4 不同淹水处理下秧苗地上部鲜质量的变化
Fig.4 Change in fresh weight of rice seedling shoot under different submergence treatments
在自然光照小拱棚试验中,从二叶一心期到三叶一心期,秧苗根系鲜质量明显降低,除此之外,秧苗根系鲜质量总体上都是随着秧龄增加而增加(图5-A)。不管在哪个时期实施的短期淹水处理,均在短期内促进了根系的生长,如在自然光照小拱棚试验中,从一叶一心期到二叶一心期,CK根系鲜质量基本没变,同时期T1和T4处理提高了1.2 mg/株;从二叶一心期到三叶一心期,CK根系鲜质量降低了4.4 mg/株,同时期T2和T4处理分别只降低了3.0,1.3 mg/株;从三叶一心期到四叶一心期,CK根系鲜质量提高了3.8 mg/株,同时期T3和T4处理分别提高了5.5,5.8 mg/株。在2个试验中,淹水处理对秧苗根系质量的影响基本一致。随着淹水处理的撤除,其对根系的促进效应会继续持续3 d到下一个取样时期,但随后根系的生长会受到持续约6 d的抑制,至第6次取样时,除T4处理外,其余经历淹水处理秧苗的根系质量均接近甚至低于对照(图5-B)。
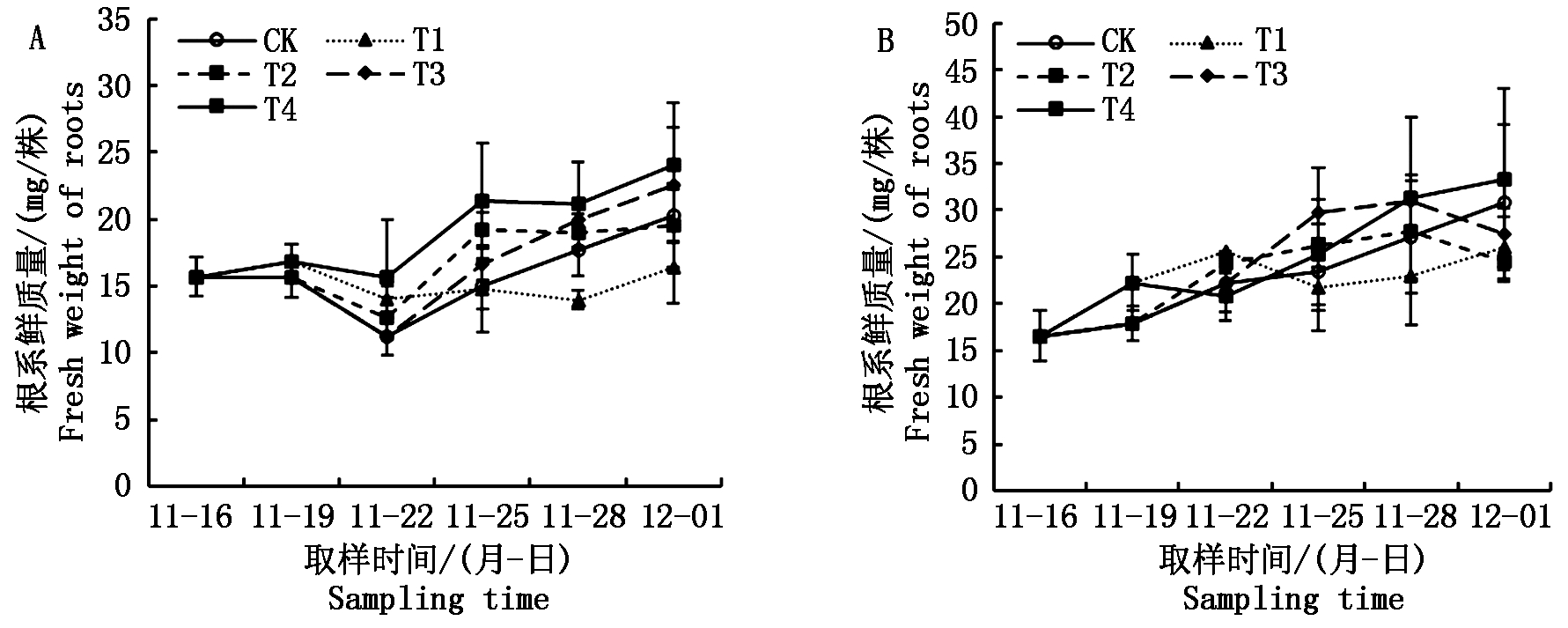
图5 不同淹水处理下秧苗根系鲜质量的变化
Fig.5 Change in fresh weight of rice seedling roots under different submergence treatments
2.4 根系硝酸还原酶活性
在自然光照小拱棚试验中,从一叶一心期到三叶一心期,根系硝酸还原酶活性逐渐升高;三叶一心期后,根系硝酸还原酶活性逐渐降低(图6-A),而在人工气候箱试验期间,根系硝酸还原酶活性整体上呈持续降低趋势(图6-B)。在2个试验中,淹水处理均迅速降低了根系硝酸还原酶活性,如在2个试验中,第2次取样时T1和T4处理均低于CK,第3次取样时,T2处理均低于CK,第4次取样时,T3处理均低于CK。在解除淹水处理之后,淹水处理对根系硝酸还原酶活性的降低效应慢慢消除,淹水处理秧苗的根系硝酸还原酶活性有一个逆势回升过程,具体说来,在自然光照小拱棚试验中,T1和T3处理从第5次取样到第6次取样时根系硝酸还原酶活性提高了,在人工气候箱试验中,T1、T2和T3处理均在淹水处理结束后3~6 d出现了根系硝酸还原酶活性的提高(同时期对照处理在降低)。
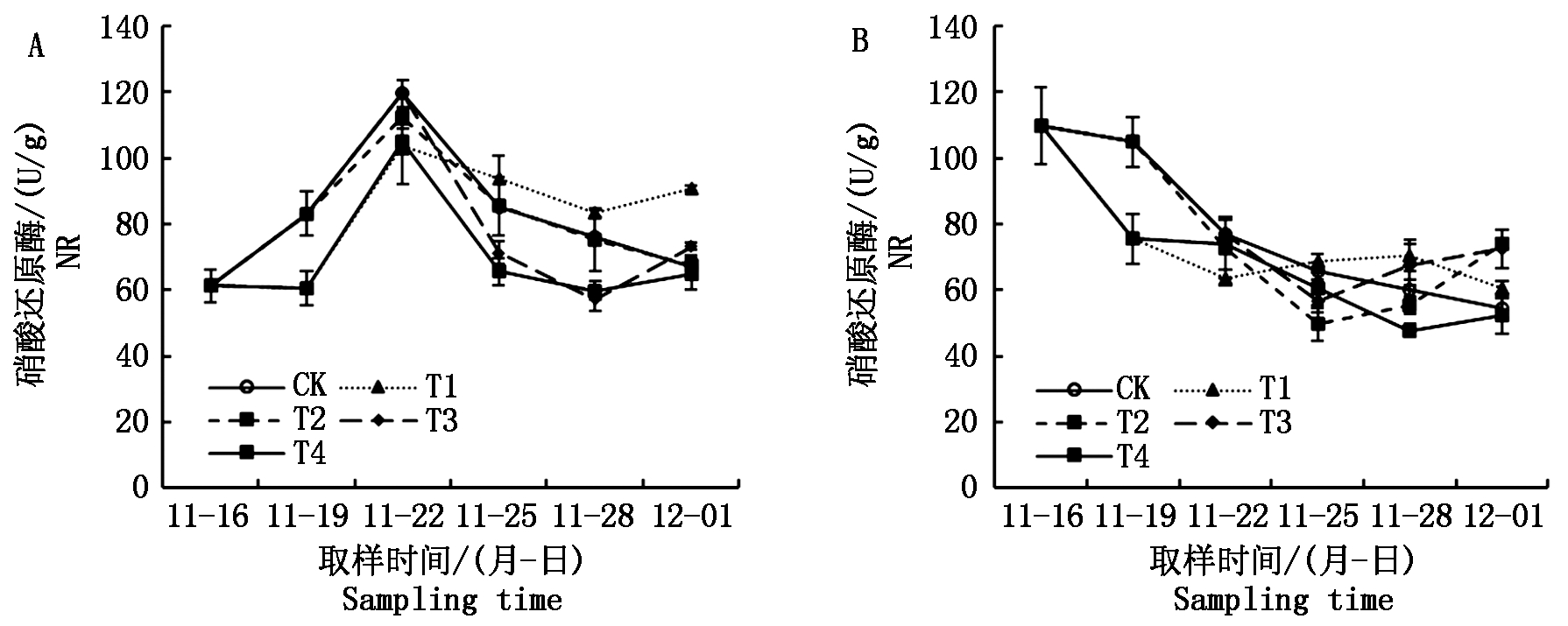
图6 不同淹水处理下秧苗根系硝酸还原酶活性的变化
Fig.6 Change in NR activity of rice seedling root under different submergence treatments
2.5 根系谷氨酰胺合成酶活性
在2个试验中,淹水处理均在多数情况下迅速降低了根系谷氨酰胺合成酶活性(图7),如在自然光照小拱棚试验中,第3次取样时T2和T4处理均低于CK,第4次取样时T3和T4处理均低于CK;在人工气候箱试验中,第2次取样时,T1和T4处理均低于CK,第3次取样时T2和T4处理均低于CK,第4次取样时,T3处理低于CK。类似于硝酸还原酶活性,解除淹水处理后,秧苗的谷氨酰胺合成酶活性有一个迅速反弹过程,这在人工气候箱试验中尤为明显。
2.6 根系谷氨酸合成酶活性
在自然光照小拱棚试验中,从一叶一心期到三叶一心期,CK秧苗根系谷氨酸合成酶活性逐渐升高;三叶一心期后,CK秧苗根系谷氨酸合成酶活性逐渐降低(图8-A),而在人工气候箱试验期间,CK秧苗根系谷氨酸合成酶活性整体上呈持续降低趋势(图8-B),在2个试验中,淹水处理后秧苗根系谷氨酸合成酶活性变化趋势与CK基本一致,但淹水处理的秧苗的谷氨酸合成酶活性在试验后期都呈现了逆势上升趋势,在人工气候箱试验中尤为明显。淹水处理均迅速降低了根系谷氨酸合成酶活性,表现为第2次取样时2个试验的T1和T4处理均低于CK,第3次取样时,人工光照小拱棚试验T2处理低于CK,第4次取样时,2个试验的T3处理均低于CK。
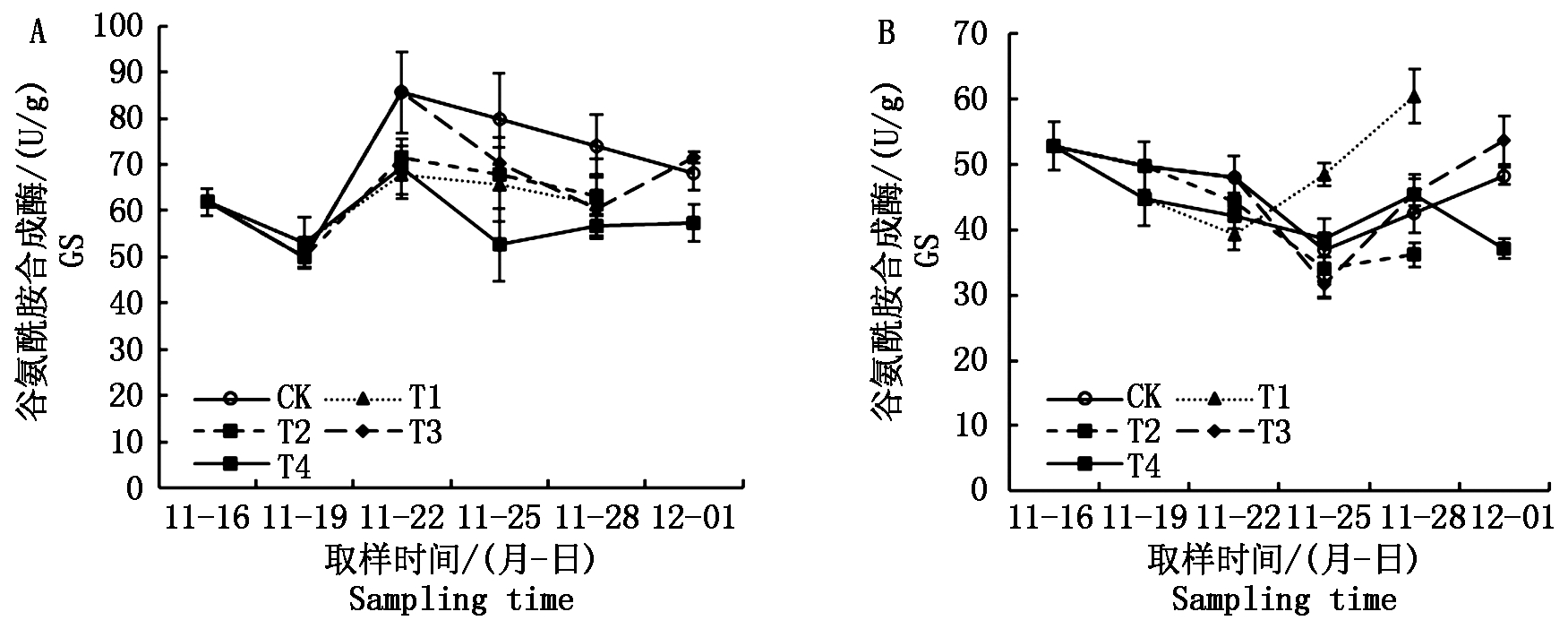
图7 不同淹水处理下秧苗根系谷氨酰胺合成酶活性的变化
Fig.7 Change in GS activity of rice seedling root under different submergence treatments
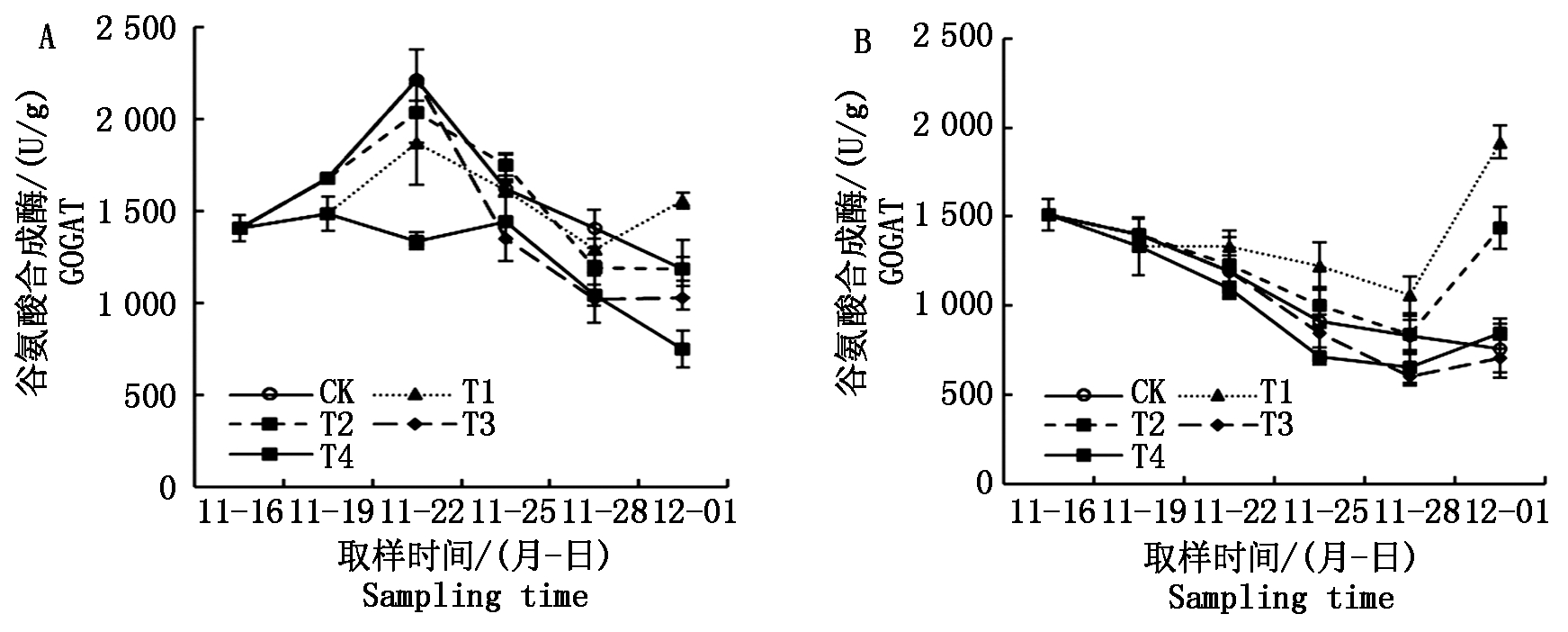
图8 不同淹水处理下秧苗根系谷氨酸合成酶活性的变化
Fig.8 Change in GOGAT activity of rice seedling root under different submergence treatments
2.7 秧苗生物量与根系碳氮代谢酶活性的相关性分析
在自然光照小拱棚试验中,秧苗的地上部鲜质量与谷氨酸合成酶活性存在中等负相关性(r=-0.598 0),根系鲜质量与根系谷氨酰胺合成酶活性、硝酸还原酶活性、谷氨酸合成酶活性均存在负相关性(r=-0.381 0,-0.643 8,-0.824 6),谷氨酸合成酶活性、谷氨酰胺合成酶活性、硝酸还原酶活性之间均存在中等正相关性(图9)。
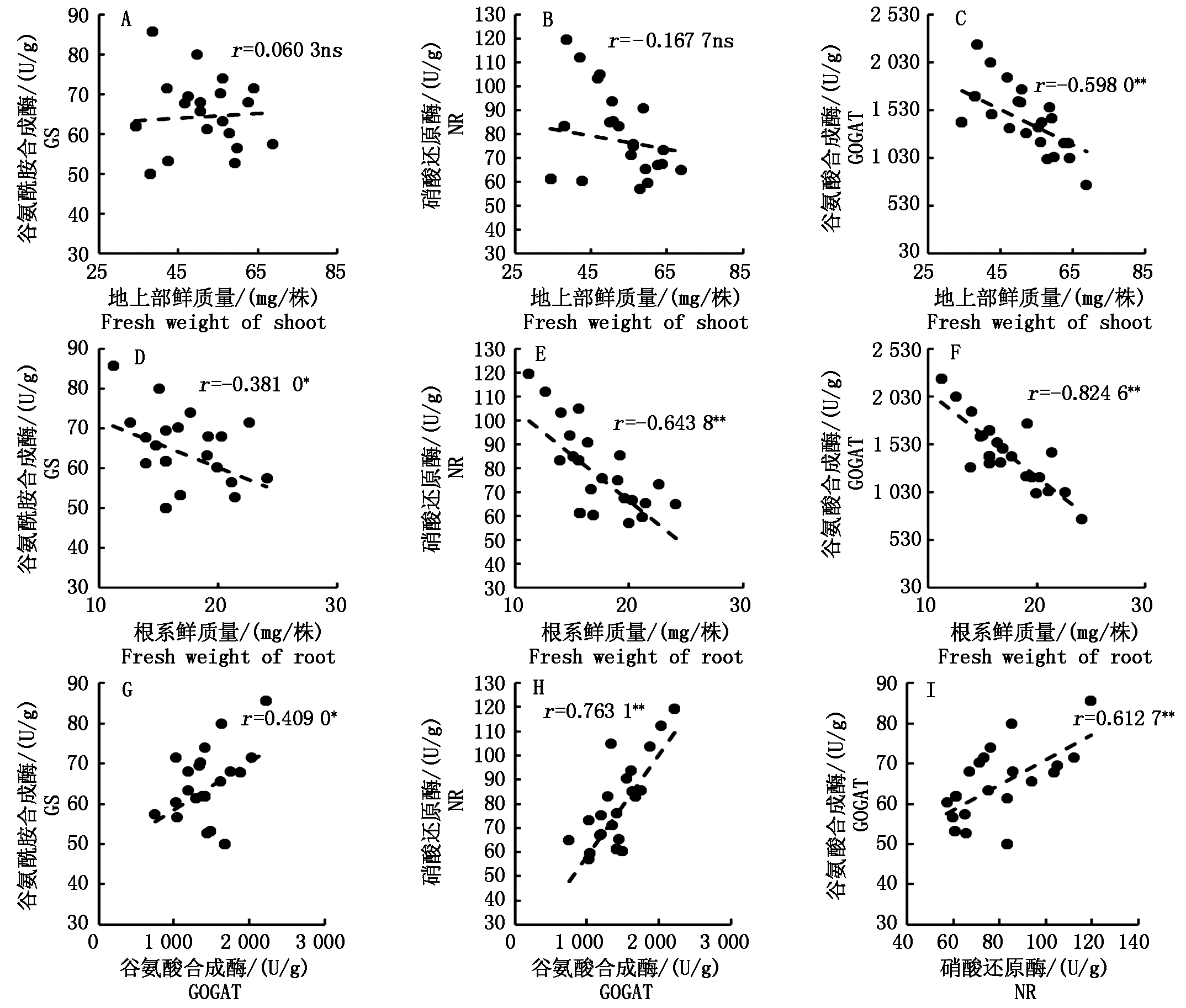
图9 秧苗生物量与根系碳氮代谢酶活性的相关性(自然光照小拱棚试验)
Fig.9 Correlation between seedling biomass and some metabolizing enzyme activity
(experiment in the small arch shed under natural light)
在人工气候箱试验中,秧苗的地上部鲜质量与硝酸还原酶活性和谷氨酸合成酶活性呈负相关性(r=-0.797 7,-0.559 0),根系鲜质量与根系谷氨酰胺合成酶活性、硝酸还原酶活性、谷氨酸合成酶活性均呈负相关性(r分别为-0.572 6,-0.907 0,-0.741 5),谷氨酸合成酶活性、谷氨酰胺合成酶活性、硝酸还原酶活性间呈正相关性(图10)。
3 讨论与结论
3.1 短期淹水处理对秧苗地上部和地下部生长的影响
在本研究的2个试验中,短期淹水处理对秧苗地上部和地下部生长的影响基本一致,短期淹水处理迅速促进了秧苗地上部和地下部的生长,但在撤除淹水处理后,秧苗根系的生长速率会低于同时期对照的,长远看来,淹水处理反倒降低了秧苗根系生物量,相应地降低了秧苗根冠比。马丽峰等[15]对处于二叶一心期的水稻幼苗实施没顶淹水处理,发现淹水处理秧苗的地上部和地下部干质量均增加,根冠比提高,而在撤除淹水处理后,秧苗地上部地下部的生长都出现停滞,根冠比甚至低于对照,这与本研究中观察到的现象完全一致。徐春梅等[3]对三叶一心的水稻秧苗实施连续12 d的低氧处理,最终导致了秧苗地上部、地下部生物量以及根冠比的降低,与本研究中淹水处理最终降低了秧苗生物量的结果一致。大量研究表明,淹水胁迫下,水稻茎秆会迅速伸长,株高增加[3, 16-18],这与本研究中的结果一致。一般认为这是水稻应对淹水胁迫的避逆型策略,通过茎秆伸长使植株上部露出水面,从而进行有氧新陈代谢和光合作用[2, 19]。淹水胁迫下秧苗地上部生物量的增加可能主要是由于茎秆的伸长生长导致的,而根系的快速生长可能是一种与之类似的避逆型策略,即通过根系的快速生长,扩大根系的延伸范围,从而最大可能获得氧气。乙烯被认为是诱导水稻低氧胁迫反应的关键激素。Kende等[20]认为,淹涝促进水稻节间伸长是由于节间组织中低浓度氧诱导ACC(1-氨基环丙烷-1-羧酸)的合成,从而加速乙烯的合成,高浓度乙烯可以改变水稻组织对低浓度内源赤霉素(GA3)反应的临界值和扩大反应的量,提高茎组织对低浓度GA3的响应,促进居间分生组织细胞的分裂活动,增加节间细胞的长度,从而导致稻株的伸长生长。此外,低氧胁迫处理诱导根系乙烯和 ABA含量的增加,从而抑制地上部生长素(IAA)向根部运输,导致地上部 IAA 积累,而茎节基部 IAA 的积累可以促进茎秆徒长[21],这也是短期低氧胁迫处理后水稻幼苗株高反而增加的原因。这种避逆机制在促进秧苗生物迅速增加的过程中消耗大量的能量,导致植株内储存的碳氮物质含量降低[16-17]。此外,缺氧条件下水稻根系的有氧呼吸被严重抑制,大大降低了能量供应,减少根系对营养元素的吸收[3,5],可能正是由于这些原因,使得即使在撤除淹水处理后,秧苗的生长依然会出现一定的停滞,最终使得淹水处理秧苗的生物量接近甚至低于对照。
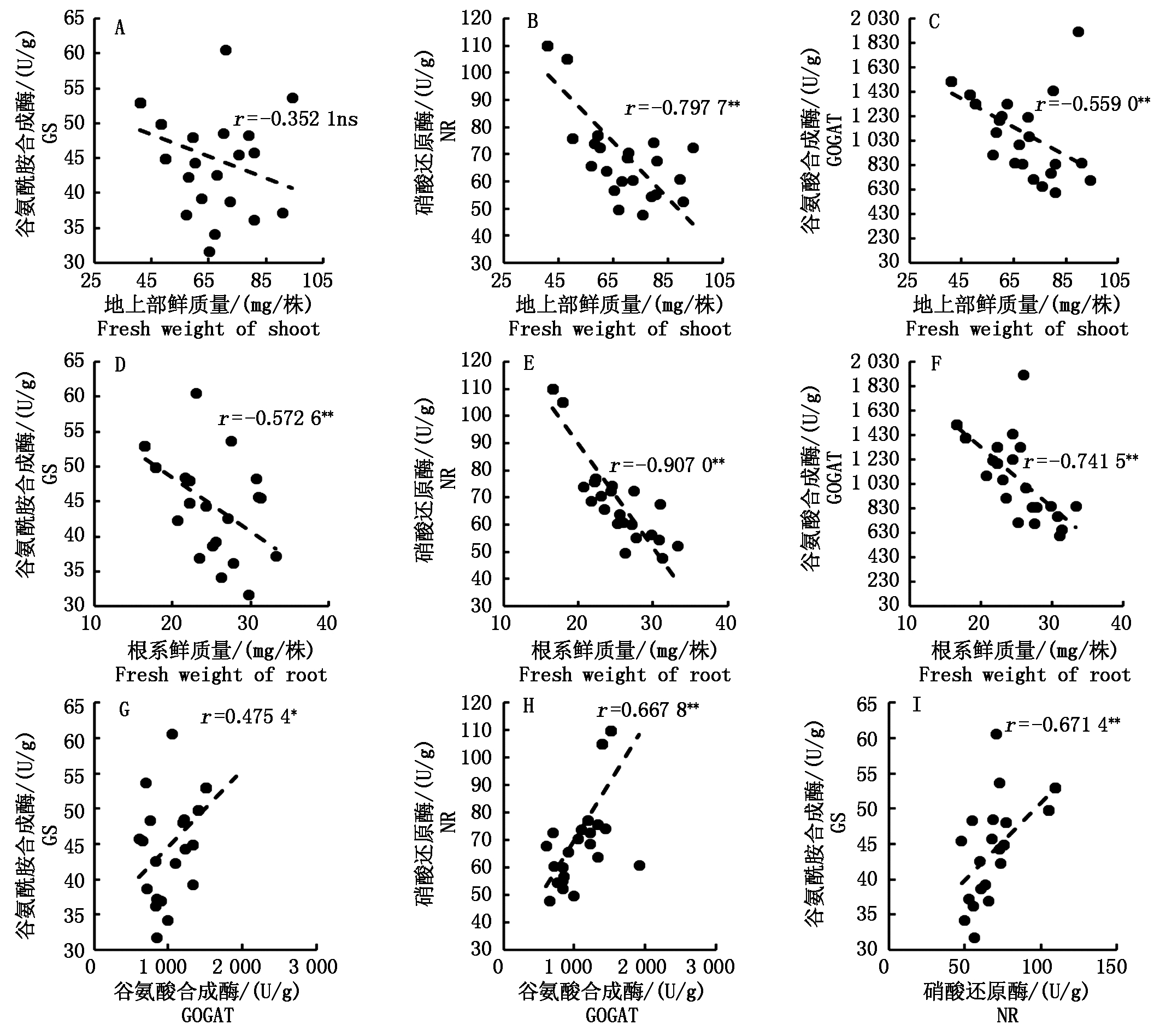
图10 秧苗生物量与根系碳氮代谢酶活性的相关性(人工气候箱试验)
Fig.10 Correlation between seedling biomass and some metabolizing enzyme activity
(experiment in the artificial climate chamber)
3.2 短期淹水处理对秧苗根系NR、GS和GOGAT活性的影响
整体看来,短期淹水处理都降低了根系NR、GS和GOGAT活力,2个试验中,这些根系氮代谢酶活性的变化趋势与秧苗生物量尤其是根系鲜质量的变化趋势刚好相反,这也与相关性分析结果相吻合,即秧苗生物量尤其是根系鲜质量与根系氮代谢关键活力均存在负相关性。这种负相关性可能是由于水稻根系对![]() 和
和![]() 的吸收都是以消耗能量的主动吸收为主[22],淹水胁迫降低了根系呼吸作用,从而减少了根系能量供给,进而会降低水稻根系对
的吸收都是以消耗能量的主动吸收为主[22],淹水胁迫降低了根系呼吸作用,从而减少了根系能量供给,进而会降低水稻根系对![]() 和
和![]() 的吸收[2],与此同时,由于避逆机制,水稻根系鲜质量会迅速增加,产生稀释效应,而NR、GS都是诱导酶,分别受
的吸收[2],与此同时,由于避逆机制,水稻根系鲜质量会迅速增加,产生稀释效应,而NR、GS都是诱导酶,分别受![]() 和
和![]() 的诱导[22],在这些多重作用下,在水稻根系内
的诱导[22],在这些多重作用下,在水稻根系内![]() 的含量都会降低,基于根系鲜质量测定的这些酶的活性也会降低,使得水稻秧苗根系鲜质量与根系氮代谢关键活力表现出了强的负相关性。
的含量都会降低,基于根系鲜质量测定的这些酶的活性也会降低,使得水稻秧苗根系鲜质量与根系氮代谢关键活力表现出了强的负相关性。
一般认为植物可以通过调节氮合成、同化,促进或抑制呼吸作用,从而适应低氧胁迫[3]。在很多园艺植物中,如番茄[4]、甜茶[5]、甜瓜[6]、樱桃[7]中都观察到了低氧胁迫诱导的根系NR、GS和GOGAT活性提高,在水稻秧苗中,徐春梅等[3]对分蘖期水稻实施低氧处理,也观察到了根系NR和GS酶活性的提高,这是由于氧气缺乏时,![]() 在依赖 NADH 的NR作用下可以代替O2作为电子传递链的最终电子受体,使NADH 氧化、线粒体和细胞质中 NAD+得以再生,从而维持植株在低氧逆境下的生存[11]。NR 活性提高促进了
在依赖 NADH 的NR作用下可以代替O2作为电子传递链的最终电子受体,使NADH 氧化、线粒体和细胞质中 NAD+得以再生,从而维持植株在低氧逆境下的生存[11]。NR 活性提高促进了![]() 还原,生成了大量
还原,生成了大量![]() 进而诱导了GS活性增加[23]。本研究中短期低氧胁迫下NR、GS和GOGAT活性的变化与已有研究结论不同,这可能主要是由于秧苗生育时期的差异导致的。已有的研究中缺氧处理基本上是处于分蘖期以后[3],本研究中,低氧胁迫分别发生在一叶一心期、二叶一心期和三叶一心期,这些时期水稻幼苗根内NR和
进而诱导了GS活性增加[23]。本研究中短期低氧胁迫下NR、GS和GOGAT活性的变化与已有研究结论不同,这可能主要是由于秧苗生育时期的差异导致的。已有的研究中缺氧处理基本上是处于分蘖期以后[3],本研究中,低氧胁迫分别发生在一叶一心期、二叶一心期和三叶一心期,这些时期水稻幼苗根内NR和![]() 的总量都很少,呼吸强度降低导致
的总量都很少,呼吸强度降低导致![]() 吸收量的降低更为明显,尤其是根系生物量增加带来的稀释效应非常突出,从而导致NR乃至GS和GOGAT活性的降低。自然光照小拱棚试验中,从二叶一心到三叶一心期水稻秧苗根系鲜质量降低,而NR、GS和GOGAT却增加了,可能正是这种稀释效应的反面体现。
吸收量的降低更为明显,尤其是根系生物量增加带来的稀释效应非常突出,从而导致NR乃至GS和GOGAT活性的降低。自然光照小拱棚试验中,从二叶一心到三叶一心期水稻秧苗根系鲜质量降低,而NR、GS和GOGAT却增加了,可能正是这种稀释效应的反面体现。
3.3 不同叶龄期短期淹水处理对秧苗的影响的差异
从秧苗根系鲜质量的变化来看,不同叶龄期短期淹水处理对秧苗的影响存在一定的差异,一叶一心期的影响似乎更为持久和强烈,表现为在2个试验的后期,一叶一心期淹水处理的秧苗地上部鲜质量和根系鲜质量总体上都是低于其他处理的,根系鲜质量尤为明显,然而,由于本研究试验结束时二叶一心期和三叶一心期淹水处理对根系生物量的抑制作用可能未完全显现,因此,T1处理的秧苗根系鲜质量可能只是临时低于其他淹水处理的。从秧苗根系硝酸还原酶活性、谷氨酰胺合成酶活性以及谷氨酸合成酶活性的变化来看,不同叶龄期短期淹水处理秧苗的这些酶活性在撤销淹水处理后都出现了反弹过程,表明淹水处理的影响是短期的、可恢复的。综上,不同叶龄期短期淹水处理对秧苗的影响可能并无明显差别,尽管如此,根据前面的分析,三叶期前短期缺氧处理对水稻幼苗根系氮代谢酶活性的短期影响还是显著不同于分蘖期及后期短期缺氧处理。
不管是从哪个叶龄期开始,三叶期前短期淹水处理在短期内促进了水稻秧苗生长,其地上部、地下部鲜质量均比对照增加了,但试验后期,水稻秧苗的生物量并未增加,反倒有降低的趋势。不同叶龄期实施的短期淹水处理对各种氮代谢关键酶活性的影响基本一致,多数情况下降低了各种氮代谢酶的活性。不同叶龄期短期淹水处理对秧苗的影响并无明显差别,尽管如此,三叶期前短期缺氧处理对水稻幼苗根系氮代谢酶活性的短期影响不同于分蘖期及后期短期缺氧处理的影响。
[1] 胡志华, 朱练峰, 林育炯, 胡继杰, 张均华, 金千瑜. 水稻氮代谢对根际氧气供应的响应研究[J]. 中国稻米, 2015,21(1):12-17. doi: 10.3969/j.issn.1006-8082.2015.01.003.
Hu Z H, Zhu L F, Lin Y J, Hu J J, Zhang J H, Jin Q Y. Research on rice nitrogen metabolism response to oxygen content in rhizosphere[J]. China Rice, 2015,21(1):12-17.
[2] 赵霞, 杜朝云, 徐春梅, 杨华伟, 吕泽林, 章秀福. 水稻对低氧环境的适应及其机制研究进展[J]. 作物杂志, 2015(3):5-12. doi: 10.16035/j.issn.1001-7283.2015.03.002.
Zhao X, Du C Y, Xu C M, Yang H W, Lü Z L, Zhang X F. Review of acclimating mechanism tohypoxia condition in rice[J]. Crops, 2015(3):5-12.
[3] 徐春梅, 陈丽萍, 王丹英, 陈松, 章秀福, 石庆华. 低氧胁迫对水稻幼苗根系功能和氮代谢相关酶活性的影响[J]. 中国农业科学, 2016,49(8):1625-1634. doi: 10.3864/j.issn.0578-1752.2016.08.020.
Xu C M, Chen L P, Wang D Y, Chen S, Zhang X F, Shi Q H. Effects of low oxygen stress on the root function and enzyme activities related to nitrogen metabolism in roots of rice seedlings[J]. Scientia Agricultura Sinica, 2016,49(8):1625-1634.
[4] 郭世荣. 营养液溶氧浓度对黄瓜和番茄根系呼吸强度的影响[J]. 园艺学报, 2000,27(2):141-142.doi:10.3321/j.issn:0513-353X.2000.02.016.
Guo S R. Effect of dissolved oxygen concentrations in nutrient solution on the respiratory intensity of cucumber and tomato roots[J]. Acta Horticulturae Sinica, 2000,27(2):141-142.
[5] 生利霞, 束怀瑞. 低氧胁迫对平邑甜茶根系活力及氮代谢相关酶活性的影响[J]. 园艺学报, 2008,35(1):7-12.doi:10.3321/j.issn:0513-353X.2008.01.002.
Sheng L X, Shu H R. Effects of hypoxia on the root activity, respiratory rate and the activities of enzymes involved in nitrogen metabolism in roots of Malus hupehensis Rehd[J].Acta Horticulturae Sinica,2008,35(1):7-12.
[6] 刘义玲, 李天来, 孙周平, 陈亚东. 根际低氧胁迫对网纹甜瓜生长、根呼吸代谢及抗氧化酶活性的影响[J]. 应用生态学报, 2010,21(6):1439-1445. doi: 10.13287/j.1001-9332.2010.0227.
Liu Y L,Li T L,Sun Z P,Chen Y D. Impacts of root-zone hypoxia stress on muskmelon growth, its root respiratory metabolism,and antioxidative enzyme activities[J].Chinese Journal of Applied Ecology, 2010,21(6):1439-1445.
[7] 生利霞, 巴金磊, 冯立国, 王猛, 束怀瑞. 低氧胁迫对樱桃根系呼吸功能及氮代谢的影响[J]. 内蒙古农业大学学报(自然科学版), 2012,33(S1):23-27. doi: 10.16853/j.cnki.1009-3575.2012.z1.006.
Sheng L X, Ba J L, Feng L G, Wang M, Shu H R. Effects of hypoxia on the root activity,respiratory rate and the nitrogen metabolism in roots of cherry[J].Journal of Inner Mongolia Agricultural University(Natural Science Edition),2012,33(S1):23-27.
[8] 周勃, 郁敏, 米银法. 根际低氧对不同抗性牡丹植株呼吸代谢的影响[J]. 河南农业大学学报, 2016,50(6):734-738,747. doi: 10.16445/j.cnki.1000-2340.2016.06.005.
Zhou B, Yu M, Mi Y F. Effect of root zone hypoxia stress on respiratory metabolism between two Paeonia suffruticosa varieties[J]. Journal of Henan Agricultural University, 2016,50(6):734-738,747.
[9] 刘晓慧, 伍海兵, 张圣美, 尚静, 张爱冬, 朱宗文, 田守波, 吴雪霞. 淹水胁迫对丝瓜幼苗生长及呼吸酶活性的影响[J]. 江西农业学报, 2020,32(3):48-54. doi: 10.19386/j.cnki.jxnyxb.2020.03.09.
Liu X H, Wu H B, Zhang S M, Shang J, Zhang A D, Zhu Z W, Tian S B, Wu X X. Effects of waterlogging stress on growth and respiratory enzyme activities of luffa seedlings[J]. Acta Agriculturae Jiangxi, 2020,32(3):48-54.
[10] Diab H, Limami A M. Reconfiguration of N metabolism upon hypoxia stress and recovery: roles of alanine aminotransferase (AlaAT) and glutamate dehydrogenase (GDH)[J]. Plants, 2016,5(2):25. doi: 10.3390/plants5020025.
[11] Limami A M.Adaptations of nitrogen metabolism to oxygen deprivation in plants[M]//Low-oxygen stress in plants.Dongen, Francesco Licausi:Springer Vienna, 2014.
[12] Limami A M, Diab H, Lothier J. Nitrogen metabolism in plants under low oxygen stress[J]. Planta, 2014, 239(3):531-541. doi: 10.1007/s00425-013-2015-9.
[13] 王荣栋, 尹经章, 作物栽培学[M]. 2版.北京: 高等教育出版社, 2015.
Wang R D, Yin J Z. Crop cultivation[M]. 2ed.Beijing: Higher Education Press, 2015.
[14] 蒋彭炎, 马跃芳, 洪晓富, 冯来定, 史齐林, 顾宏辉. 水稻分蘖芽的环境敏感期研究[J]. 作物学报, 1994,20(3):290-296.
Jiang P Y, Ma Y F, Hong X F, Feng L D, Shi J L, Gu H H. Studies on the sensitive stage to environment during differentiation and development of tiller buds in rice plant[J]. Acta Agronomic Sinica, 1994,20(3):290-296.
[15] 马丽峰, 李佐同, 杨克军, 赵长江, 徐晶宇, 杨荣斌, 于高波, 赵莹, 石新新, 许艳梅, 刘承, 闫博巍. 没顶淹水对敏感性水稻幼苗生长及抗氧化酶活性的影响[J]. 植物生理学报, 2015,51(7):1082-1090. doi: 10.13592/j.cnki.ppj.2015.0029.
Ma L F,Li Z T,Yang K J,Zhao C J,Xu J Y,Yang R B, Yu G B,Zhao Y,Shi X X,Xu Y M,Liu C,Yan B W. Effects of submergence on growth and antioxidant enzymes activities of sensitive rice (Oryza sativa)seedlings[J].Plant Physiology Communications,2015,51(7):1082-1090.
[16] 武辉, 向镜, 陈惠哲, 张玉屏, 张义凯, 朱德峰. 外源调节剂对淹涝水稻幼苗株高及碳水化合物消耗的影响[J]. 应用生态学报, 2018,29(1):149-157. doi: 10.13287/j.1001-9332.201801.021.
Wu H, Xiang J, Chen H Z, Zhang Y P,Zhang Y K, Zhu D F.Effects of exogenous growth regulators on plant elongation and carbohydrate consumption of rice seedlings under submergence[J].Chinese Journal of Applied Ecology, 2018,29(1):149-157.
[17] 向镜, 陈惠哲, 张玉屏, 张义凯, 朱德峰. 淹涝条件下水温对水稻幼苗形态和生理的影响[J]. 中国水稻科学, 2016,30(5):525-531. doi: 10.16819/j.1001-7216.2016.5183.
Xiang J, Chen H Z, Zhang Y P, Zhang Y K, Zhu D F.Morphological and physiological responses of rice seedlings to water temperature under complete submergence[J].Chinese Rice Sciences, 2016,30(5):525-531.
[18] 王矿, 王友贞, 汤广民. 分蘖期水稻对淹水胁迫的响应规律研究[J]. 灌溉排水学报, 2014,33(6):58-60, 91. doi: 10.13522/j.cnki.ggps.2014.06.013.
Wang K, Wang Y Z, Tang G M. Response of rice to waterlogging stress in tillering stage[J]. Journal of Irrigation and Drainage, 2014,33(6):58-60,91.
[19] Kuroha T, Ashikari M. Molecular mechanisms and future improvement of submergence tolerance in rice[J]. Molecular Breeding, 2020,40(4):1-4.doi:10.1007/s11032-020-01122-y.
[20] Kende H, van der Knaap E, Cho H T.Deepwater rice: a model plant to study stem elongation[J].Plant Physiology,1998,118(4):1105-1110.doi: 10.1104/pp.118.4.1105.
[21] Su P H, Lin C H. Metabolic responses of luffa roots to long-term flooding[J].Journal of Plant Physiology, 1996, 148(6):735-740.doi:10.1016/S0176-1617(96)80376-2.
[22] 张晓果, 王丹英, 计成林, 徐春梅, 陈松, 章秀福. 水稻氮素吸收利用研究进展[J]. 中国稻米, 2015,21(5):13-19. doi: 10.3969/j.issn.1006-8082.2015.05.003.
Zhang X G,Wang D Y,Ji C L,Xu C M,Chen S,Zhang X F.Nitrogen absorption and utilization on rice[J].China Rice, 2015, 21(5):13-19.
[23] Appenroth K J, Meco R, Jourdan V, Lillo C. Phytochrome and post-translational regulation of nitrate reductase in higher plants[J]. Plant Science, 2000,159(1):51-56. doi: 10.1016/S0168-9452(00)00323-X.