近年来,我国受到镉(Cd)、铅(Pb)、铜(Cu)等重金属污染面积较广。Cd是一种剧毒重金属,是生物非必要元素之一,被国际癌症研究中心(IARC)等国际组织列为环境风险首要控制元素之一[1]。Cd作为土壤重金属主要污染控制元素之一,具有较强的毒性,植物根系最先受到重金属毒害而表现为根系生长缓慢、根系发黑等[2-4];同时,干旱、盐碱和高温等其他非生物胁迫因素也严重影响植物的生长发育,引起一系列生理生化变化,严重时容易导致植物的整株死亡,这对农业生产产生了极大影响[5]。干旱是影响植物性状的显著影响因子之一,干旱胁迫对叶相对含水量、叶绿素含量等性状都会产生显著影响[6-8];盐胁迫能够破坏土壤结构,使植物烂根、萎蔫、生长受阻等[9-10]。
糖基转移酶不仅是多糖合成的关键酶,同时也是催化糖基反应的酶,在非生物胁迫下能够起到重要的作用,通过一系列蛋白修饰参与到植物抵抗非生物胁迫反应中[11-12],这些非生物胁迫主要包括干旱、盐、高温等。例如,拟南芥UGT75X能够在干旱、盐胁迫下上调表达[13],拟南芥UGT-LIKE基因在375 mmol/L甘露醇和150 mmol/L NaCl处理下该基因的表达量也明显升高[14],玉米次生代谢糖基转移酶UFGT2通过黄酮醇修饰能够提高植物对非生物胁迫的耐受性[15]。一直以来,对糖基转移酶的研究主要以拟南芥为材料,揭示出它们在植物生命周期中扮演不同的角色[16-17]。
本试验前期通过高通量测序分析筛选获得一个UDP-糖基转移酶基因,番茄镉胁迫下该基因的表达量显著升高,即其参与番茄镉胁迫应答反应,但还需进一步对该基因如何参与番茄镉或其他非生物胁迫反应进行深入研究。UDP-糖基转移酶与植物关系较为亲密[18],能催化多种底物并通过糖基转移酶的糖基化作用来参与植物对非生物胁迫的适应[19-20]。拟南芥UGT85A5基因属于UDPGT超基因家族,在烟草中的外源表达显著提高了烟草对盐胁迫的适应能力[21];花生中克隆AhUGT83A1-like的UDP-葡萄糖基转移酶的基因显示了参与花生对干旱、低温和高盐抗性的调控[22];目前,有关UDP-糖基转移酶的研究主要集中在拟南芥、大豆等植物对干旱、盐胁迫下的表达[23-25],但是研究番茄在非生物胁迫下的表达,特别是对于重金属胁迫的研究较少,而番茄作为世界重要的园艺作物之一,研究其抗逆机理尤为重要。
本试验以番茄(Lycopersicon esculentum Mill.)为试验材料,通过克隆得到UDP-糖基转移酶基因,命名为SlUDP基因,利用生物信息学对其氨基酸序列及系统进化树等进行预测,并通过荧光定量PCR分析该基因在不同组织中的表达特性以及在镉胁迫下番茄根和叶的表达量变化,进一步利用酵母表达系统对SlUDP基因进行转基因酵母功能验证,探究该基因在3种不同非生物胁迫条件下(镉、干旱和盐胁迫)的表达特征,为糖基转移酶基因SlUDP的后续研究提供理论依据。
1 材料和方法
1.1 试验材料
本试验所用的植物材料为番茄常规商品种红罗成,根据植物分子生物学实验室前期的材料筛选,为镉敏感型番茄品种。提取四叶期的番茄根和叶的总RNA,合成番茄总cDNA,用于克隆待用。用50 μmol/L CdCl2对四叶期的番茄苗进行处理,分别在处理后0,1,2,3,4与5 d,剪取根部和叶片各0.1 g,放入-80 ℃冰箱保存,用于表达分析。
菌株材料由上海唯地生物和中宜生物公司提供的酵母感受态INVSC1和大肠杆菌DH5α感受态细胞。
1.2 试验方法
1.2.1 SlUDP基因的克隆 SlUDP通过NCBI中Blast在线查找,GenBank登录号为XM-004249181.3,通过Primer 5.0软件设计SlUDP基因的特异性引物(表1)。试验首先提取番茄叶片总RNA(RNA提取试剂盒由康为世纪公司提供)。反转录合成番茄cDNA。以其为模板,通过PCR扩增得到SlUDP基因cDNA序列,PCR反应体系为9.5 μL ddH2O、1 μL SlUDP-R (10 μmol/L)、1 μL SlUDP-F (10 μmol/L)、12.5 μL 10×PCR Buffer Mix、1 μL cDNA,共25 μL。PCR反应程序:94 ℃ 8 min;94 ℃ 10 s,59 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 5 min。
PCR产物用琼脂糖凝胶电泳分离,用OMEGA Gel Extraction kit凝胶回收试剂盒(OMEGA公司)进行PCR产物纯化。纯化产物克隆入pGM-T (天根公司),并转化到大肠杆菌DH5α感受态细胞中,采用质粒小提试剂盒(康为世纪公司)提取质粒,经双酶切进一步验证后,送上海生工公司测序。
表1 PCR特异性引物序列
Tab.1 PCR specific primer sequences

引物类型Primer type引物名称Primer names引物序列 (5′-3′)Primers sequences实时荧光定量PCR引物SlUDP-FGAGCAACAGTAATGGAGGGAGTGACReal-time fluorescence quantitative PCR primerSlUDP-RTTCTCCGTAAAGTGTTTCCAGGTC目的片段特异性扩增引物SlUDP-MFGGGGTACCAAGTTGCTGTGGTTATGGTGObjective fragment specific amplification primerSlUDP-MRAACTGCAGAAAGGGGTGCCAGTAGG
注:SlUDP-MF下划线为KpnⅠ酶切位点,SlUDP-MR下划线为PstⅠ酶切位点。
Note: SlUDP-MF underline is the cleavage site of KpnⅠand SlUDP-MR underline is the cleavage site of PstⅠ.
1.2.2 SlUDP基因生物信息学分析 根据SlUDP的基因序列,通过NCBI (https://www.ncbi.nlm.nih.gov/)网站进行在线比对;使用ClustalW多重比对软件对氨基酸序列的同源关系进行分析,以及在Neighbor-joining的基础上构建系统进化树;通过Psipred软件对氨基酸二级结构进行预测;通过ORF Finder 分析预测开放阅读框。
1.2.3 SlUDP基因的组织表达特性分析 取生长90 d的同一植株番茄叶、根、主茎、侧茎、花、果实各0.1 g(各组织部位设置3次生物学重复),放入液氮速冻,提取RNA,反转录为cDNA,内参为β-Actin,采用荧光定量PCR进行定量分析,对数据进行统计分析。
1.2.4 镉胁迫下SlUDP基因的表达处理 对3-4叶期番茄幼苗的根和叶用CdCl2(50 μmol/L)处理。每个时间点3次生物学重复,材料放入液氮速冻后于-80 ℃保存待用。提取根和叶的RNA,反转录为cDNA。用Primer 5.0设计所需引物,番茄的内参基因为β-Actin。使用荧光定量PCR进行定量分析,对数据进行统计分析。
1.2.5 SlUDP基因酵母过表达载体的构建 将pGM-T-SlUDP质粒经Xba Ⅰ、Kpn Ⅰ双酶切后,回收片段;酵母表达载体pYES2以Xba Ⅰ、Kpn Ⅰ切开,将回收的片段与之连接,构建重组质粒pYES2-SlUDP,重组质粒及pYES2空载体分别转化酵母INVSC1感受态中,筛选出阳性克隆送样测序。酶切、连接、转化、筛选和鉴定等步骤均按常规分子克隆方法进行。
1.2.6 转SlUDP基因酵母非生物胁迫处理 从酵母pYES2-SlUDP和pYES2转化子中分别挑取单个克隆于SC-U液体培养基(2%葡萄糖)中培养。30 ℃培养16~20 h,5 000 r/min离心1 min,弃上清;5 mL SC-U诱导培养(2%半乳糖)重悬菌体,30 ℃诱导表达24 h,5 000 r/min离心1 min,0.9%NaCl重悬菌体,将菌液OD600调至一致到1.8。
固体培养基:10倍梯度稀释,取2 μL点样于非生物胁迫平板(Cd浓度为0,20,30 μmol/L;NaCl浓度为0,250,350 μmol/L);PEG-6000(浓度为0,20%,25%),30 ℃培养2 d,观察菌落生长情况,每组试验设置3次重复。
液体培养基SC-U(2%葡萄糖);取2 μL菌液接种于0.001 mL培养基中(胁迫条件同上),30 ℃振荡培养36 h,测定菌液OD600值,每组试验设置3次重复,所得数据用SPSS 20进行显著性分析。
2 结果与分析
2.1 SlUDP基因生物信息学分析
2.1.1 SlUDP基因的氨基酸序列比对 通过NCBI,检索序列为番茄SlUDP基因的氨基酸序列,获得在马铃薯(Solanum tuberosum L.)、番茄(Lycopersicon esculentum Mill.)、拟南芥(Arabidopsis thaliala L.Heynh)、水稻(Oryza sativa L.)等不同植物中的同源基因并进行氨基酸序列比对。结果如图1,SlUDP与番茄、大豆、拟南芥等都有高度的一致性,因此说明SlUDP在多种植物中都有高保守性。
2.1.2 SlUDP基因的二级结构预测 通过NCB1来查找SlUDP基因的开放阅读框,其中所翻译的蛋白质有483个氨基酸,编码区长度为1 452 bp,结果如图2所示。将克隆后的SlUDP序列经过生物信息学分析,用SOPMA对SlUDP的蛋白二级结构进行预测,在SlUDP的蛋白二级结构中,α-螺旋占比较高,约为43.06%,延伸链约为13.66%,β-转角比例最少,约为5.8%。
2.1.3 SlUDP基因的系统进化树 根据同源性较高的氨基酸序列构建进化树,通过亲缘关系得到SlUDP和其他植物的同源关系。如图3所示,马铃薯、花叶烟草、番茄、甜辣椒、石竹、紫椴为一支;拟南芥为一支;水稻、大豆、玉米为一支。SlUDP与甜辣椒的亲缘关系最近,其次是马铃薯和花叶烟草,支持率达到98%,与玉米的同源关系最远。
2.2 SlUDP基因的表达特性分析
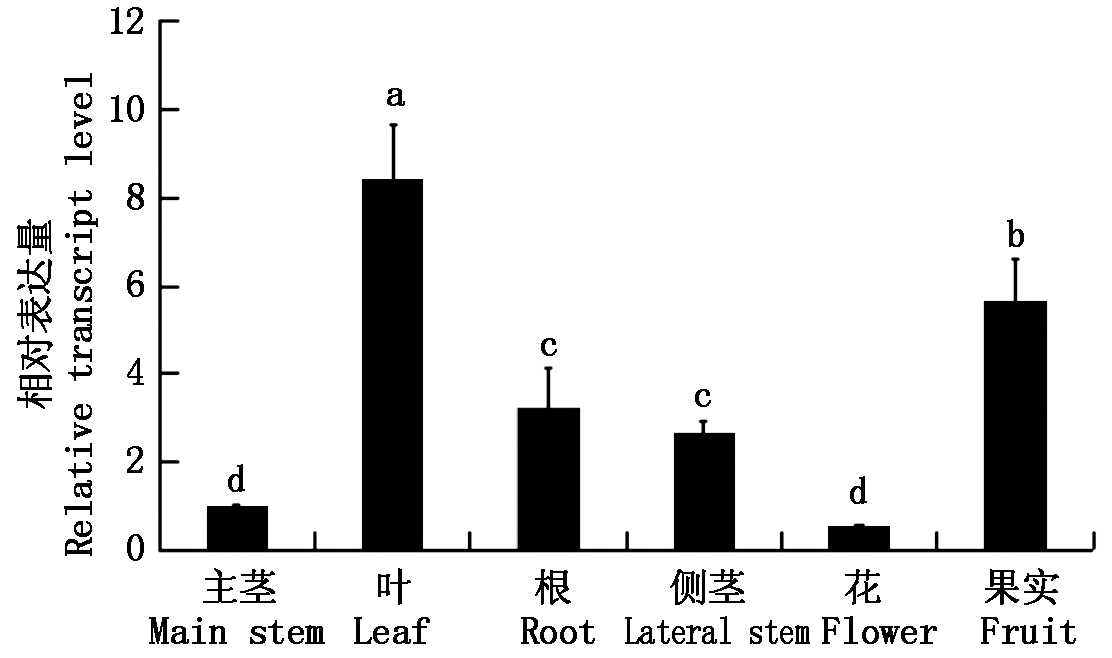
取4月龄番茄的叶、根、主茎、侧茎、花、果实探究SlUDP基因在这些组织中的表达特性。结果如图4,可以看出,SlUDP基因在叶中的表达量是在主茎中表达量的8.4倍,表达量最显著。其次在果实中的表达量是主茎中的5.8倍。根和侧茎的表达量没有显著差异,大约是主茎的3倍。因此,可以看出SlUDP普遍存在于番茄各组织中且存在组织表达差异性,在叶片和果实中表达量较显著,各部位的表达量趋势是叶片>果实>根部>侧茎>主茎>花。

图1 SlUDP与不同植物的氨基酸序列比对
Fig.1 Comparison of amino acid sequences between SlUDP and different plants

图2 SlUDP蛋白二级结构预测
Fig.2 Prediction of secondary structure of SlUDP protein
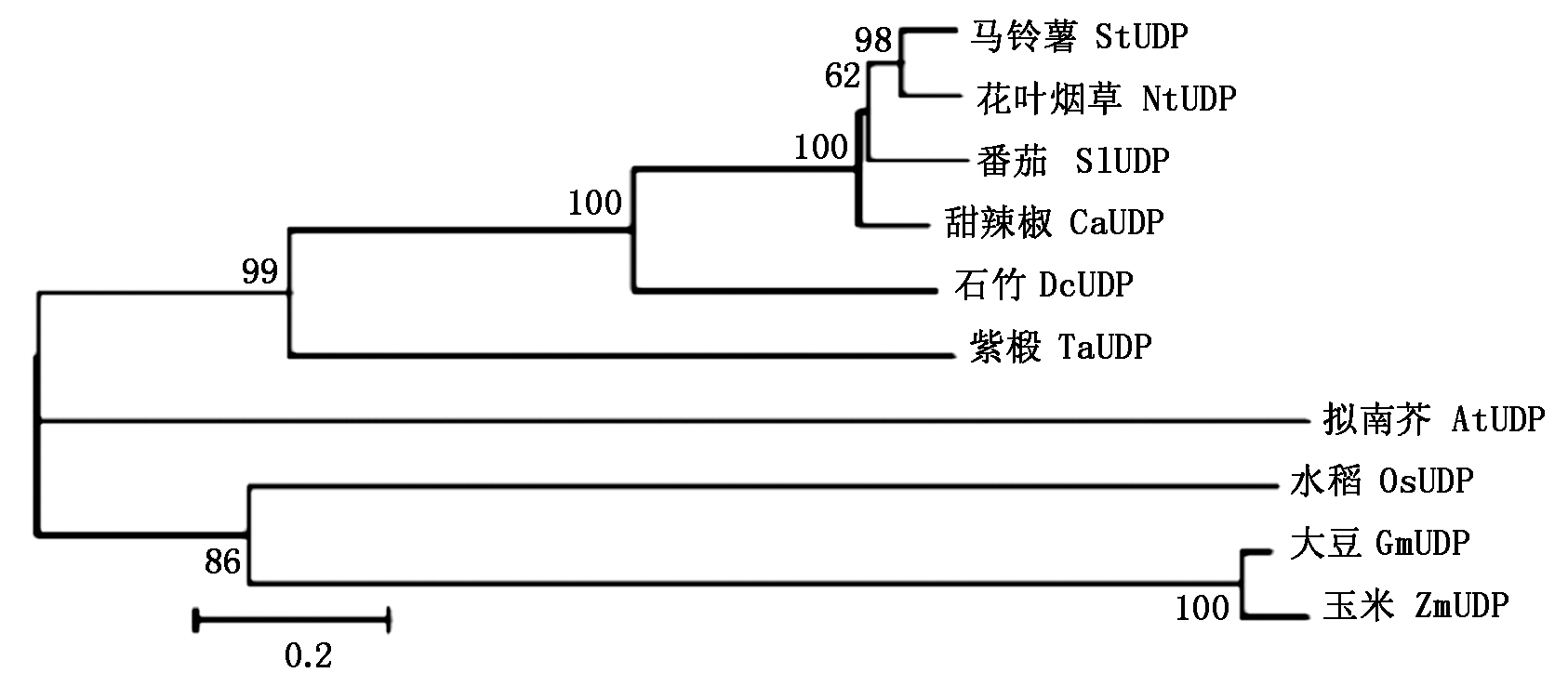
图3 UDP基因在不同物种中的系统进化树分析
Fig.3 Phylogenetic tree of UDP genes in different species
2.3 镉胁迫下SlUDP基因的表达分析
对四叶期番茄进行CdCl2处理,通过荧光定量对SlUDP进行表达量分析。结果如图5所示,随着时间增加,根和叶中SlUDP基因都能响应番茄镉胁迫上调表达。在叶中,与0 d(对照)相比,2 d为对照的17.5倍,最大值为22.1,在5 h出现,上调表达后,除3 d有下降外,其他时间点变化较小。根中SlUDP基因3 d以前表达水平变化不大,4 d以后随时间的增加呈现上升趋势,5 d上升量最为显著,与0 d(对照)相比,为对照的6.2倍。
不同小写字母表示0.05水平差异显著。图5同。
Different small letters mean significant difference
at 0.05 level.The same as Fig.5.
图4 SlUDP基因的组织表达特性分析
Fig.4 Tissue expression characteristics
analysis of SlUDP gene
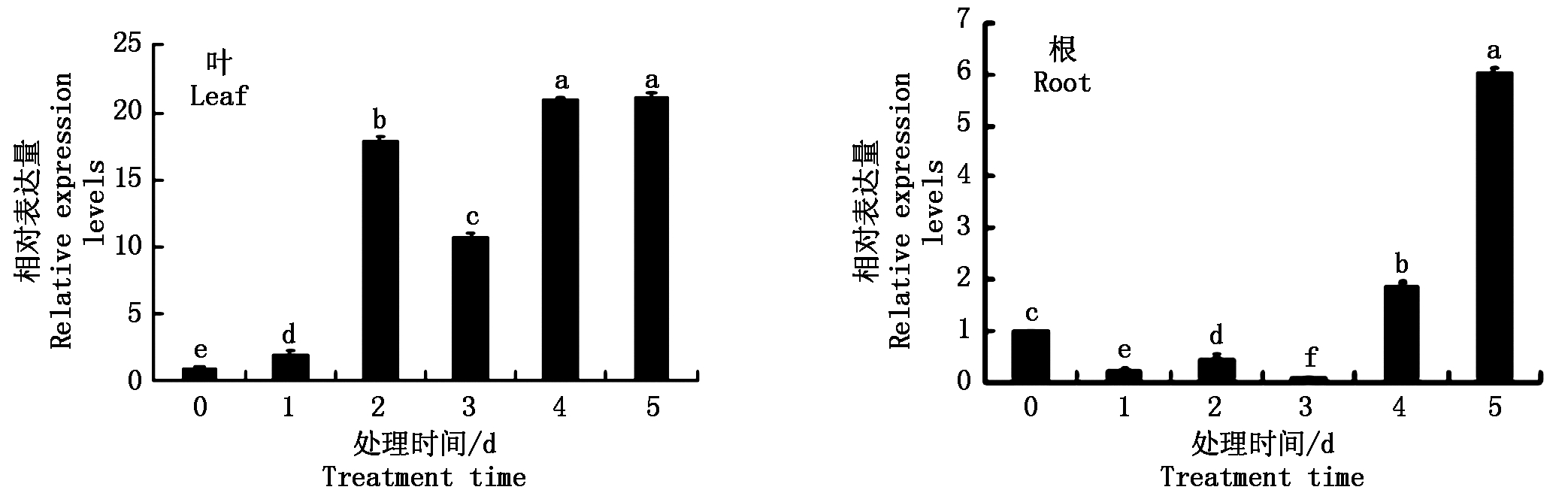
图5 番茄SlUDP基因在不同时间CdCl2处理下叶和根的表达分析
Fig.5 Expression analysis of SlUDP gene in lower leaves and roots of tomato treated with CdCl2 at different times
2.4 番茄SlUDP基因在3种非生物胁迫处理下酵母的表型分析
2.4.1 转SlUDP基因在固体培养基下的酵母表型分析 将pYES2空载体和连接过的含有XbaⅠ、KpnⅠ酶切位点的转SlUDP基因载体分别转入酵母感受态INVSC1中,挑取pYES2-SlUDP和pYES2单菌落于SC-U选择培养基上培养20 h,后转到诱导培养基上振荡培养1 d,将菌液浓度调到OD600=1.8后将稀释倍数不同的菌液点到SC-U培养基上培养,观察其生长情况。结果如图6所示,正常生长情况下,重组酵母和对照酵母的生长无明显差异。Cd处理浓度为30 μmol/L,当菌液浓度稀释到105倍时重组酵母依然能存活而对照不能生长;利用20%,25%PEG-6000处理,20%处理下,重组酵母和对照酵母出现差异,25% PEG-6000处理下,差异更为显著,稀释104时对照酵母不再生长,重组酵母仍有部分存活;NaCl胁迫处理浓度为250,350 μmol/L,重组酵母和对照酵母随着处理浓度的增加都大量死亡,没有表现出显著性差异。由此可见,SlUDP基因能够提高转基因酵母对镉和干旱的耐受性。
2.4.2 转SlUDP基因酵母存活率的测定 进一步对转基因酵母的存活率进行测定,首先挑取酵母感受态细胞INVSC1的pYES2-SlUDP和pYES2单菌落摇菌,对OD600值进行测定,对酵母在Cd、干旱和盐胁迫下进行定量分析。结果如图7所示,随着Cd胁迫浓度的增加,酵母OD600的值不断降低,但pYES2-SlUDP一直高于pYES2,且从高浓度20%开始达到差异显著性。随着Cd胁迫浓度的增加,二者也呈现下降趋势,且pYES2-SlUDP与pYES2相比菌液浓度始终较高,而在不同盐胁迫下,转基因酵母与对照相比存活率的差异不显著。以上结果推测,SlUDP基因可以提高转基因酵母在镉和干旱胁迫下的存活率。
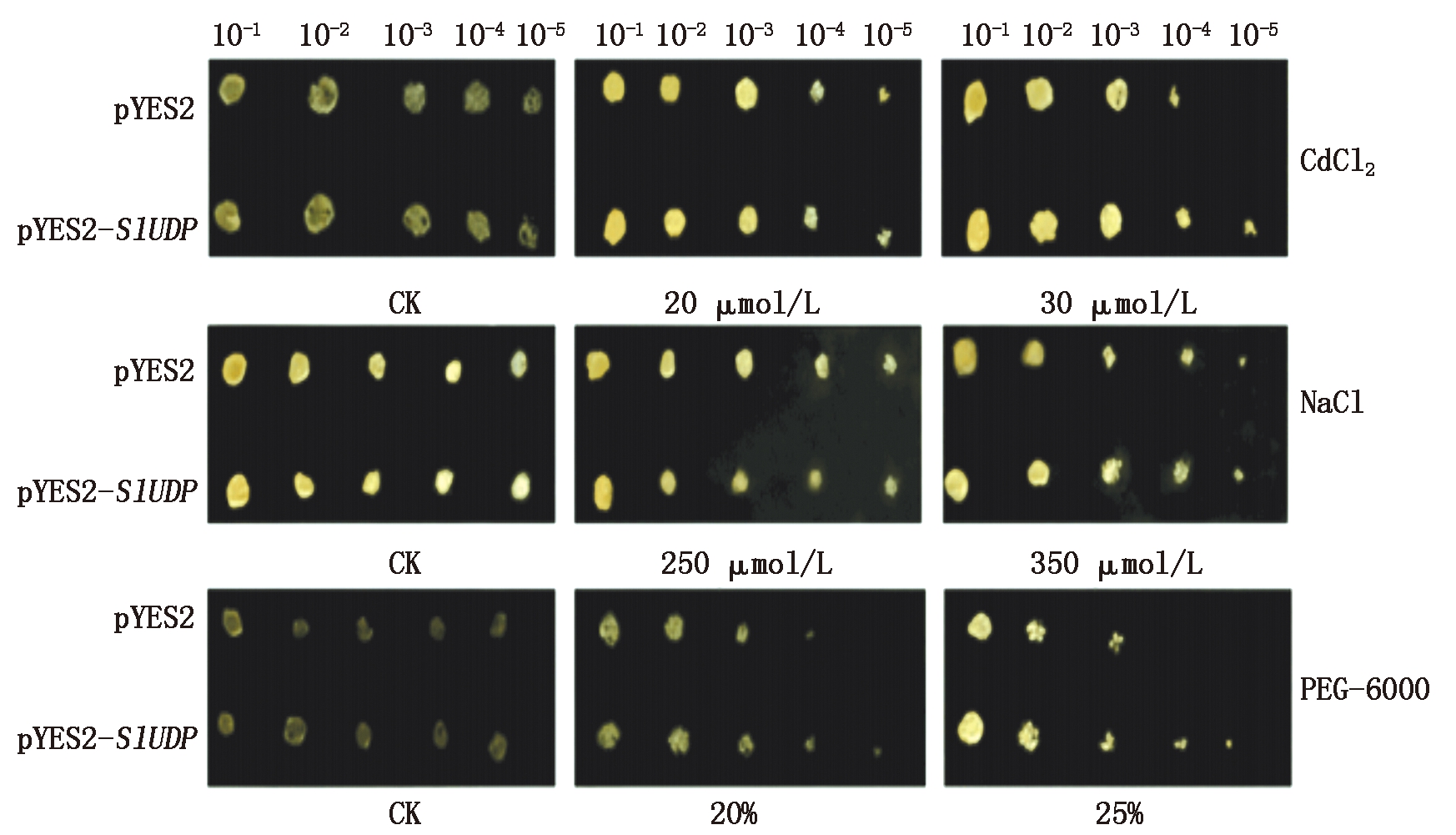
图6 转SlUDP基因酵母在不同胁迫处理后的表型分析
Fig.6 Phenotype analysis of yeast with SlUDP gene after different stress treatments
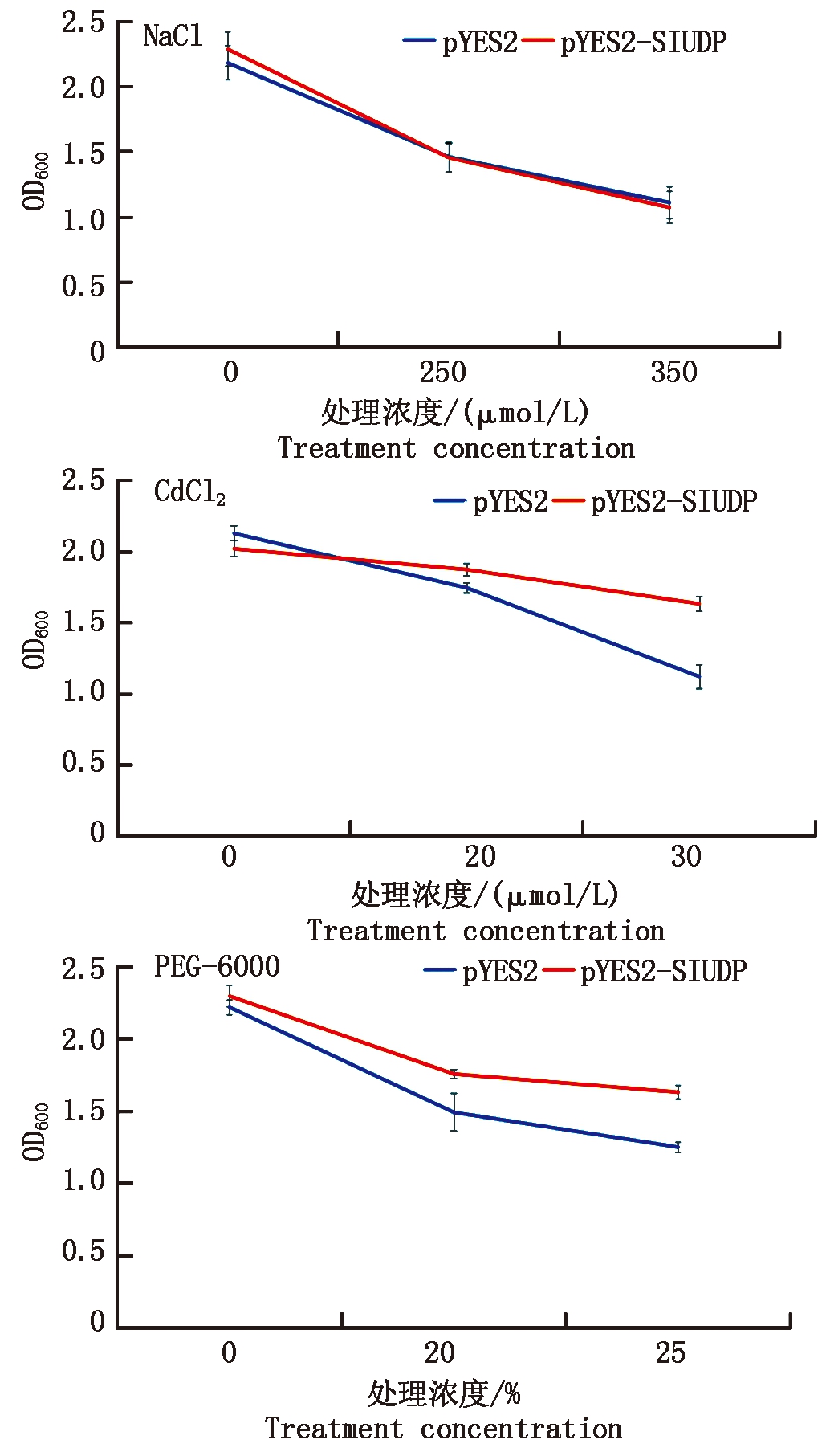
图7 转SlUDP基因酵母在不同胁迫处理后的存活率分析
Fig.7 Survival rate of SlUDP transgenic
yeast under different stress
3 讨论
番茄是一种世界性蔬菜,在重金属胁迫下,番茄幼苗生物量、株高、叶绿素均随处理重金属质量比增大而降低[26],干旱和高盐等非生物胁迫能够影响其萌发、生长发育和产量等[27]。因此,对参与番茄非生物胁迫调控的功能基因进行克隆与鉴定是番茄非生物胁迫研究中的重要组成部分[28]。
本研究从番茄中克隆出UDP-糖基转移酶基因SlUDP。通过荧光定量PCR的分析可以看出SlUDP基因在番茄叶、根、主茎、侧茎、花、果实中存在表达差异性,这与郭军康[1]的研究结果中在番茄根、茎、叶中表达显著一致,而显著部位略有差异。重金属镉处理后通过荧光定量PCR分析结果表明SlUDP基因在叶和根中表达显著,其研究表明SlUDP基因能响应重金属镉胁迫上调表达。本试验通过酵母表达系统结果显示SlUDP基因能响应干旱等非生物胁迫,这与张凤菊[29]研究的糖基转移酶UGT86A1,能够参与干旱胁迫适应,在干旱胁迫下,UGT86A1过表达植株显著上调一致,同时笔者推测SlUDP基因同样能参与番茄抵抗干旱等非生物胁迫。
UDP-糖基转移酶蛋白家族的作用机制和功能是多样的,这是由于作用底物是多样的。酵母表达体系具有较为完善的表达控制系统,能够介导目的蛋白高度表达,由于生物功能进化上的保守性,使其可用于植物、动物、真菌等多种生物基因初步功能验证[30]。通过过表达SlUDP基因于酵母中,观察在固体培养基上菌落的生长,进一步测量液体培养基的OD值,对SlUDP基因在Cd、NaCl和干旱胁迫下的功能进行研究。结果显示,在Cd和干旱胁迫下稀释105倍时对照基本未见菌落生长,而pYES2-SlUDP重组酵母的生长情况较好。这说明SlUDP基因提高了酵母的耐镉和耐干旱胁迫,但是没有提高转基因酵母耐高盐胁迫能力。这与近年来研究的UGT75X[31]、UGT85A5[32]、UGT76C2[33]等均可提高植物耐旱机制一致。由此可见,在不同植物中UDP-糖基转移酶表现相似,能积极响应非生物胁迫。综上,本试验在番茄中克隆得到SlUDP基因,通过荧光定量PCR分析该基因在不同组织中的表达以及在镉胁迫下番茄根和叶的表达特征,最后利用酵母表达系统对SlUDP基因在镉等3种非生物胁迫中的作用进行功能验证,初步阐明了SlUDP基因在镉、NaCl、干旱等方面的功能,为SlUDP基因家族参与抵抗番茄非生物胁迫提供理论依据。
[1] 郭军康. 耐Cd植物促生菌对番茄幼苗生长及Cd吸收转运的影响机制[D]. 天津: 天津大学, 2014.doi: 10.7666/d.D485288.
Guo J K.Effects of Cd-tolerant plant growth promoting rhizobacteria on mechanisms of tomato seedlings growth Cd uptake and transport[D].Tianjin: Tianjin University, 2014.
[2] Kahle H. Response of roots of trees to heavy metals[J].Environmental and Experimental Botany,1993,33(1):99-119.doi:10.1016/0098-8472(93)90059-O.
[3] 赵慧博,李丽丽,梁塔娜,张艳欣,黄凤兰,曹清国.重金属铜、镉胁迫下植物响应的研究进展[J].安徽农业科学,2019,47(21):14-16.doi:10.3969/j.issn.0517-6611.2019.21.005.
Zhao H B, Li L L, Liang T N,Zhang Y X,Huang F L,Cao Q G.Advances in plant response to copper and cadmium stress[J].Journal of Anhui Agricultural Sciences,2019,47(21):14-16.
[4] 陈璐.拟南芥糖基转移酶基因UGT76F1和UGT71C3的功能及分子机制[D].济南:山东大学,2020.doi:10.27272/d.cnki.gshdu.2020.000141.
Chen L.Function and molecular mechanisms of glycosyltransferase genes UGT76F1 and UGT71C3 in Arabidopsis thaliana[D].Jinan: Shandong University, 2020.
[5] 杨桂燕. 柽柳ThVHAc1基因耐盐及抗镉机制研究[D].哈尔滨:东北林业大学,2014.
Yang G Y.Salt and cadium tolerance mechanism analysis of ThVHAc1 from Tamarix hispida[D]. Harbin: Northeast Forestry University,2014.
[6] Xie L P,Hao P F,Cheng Y,Ahmed I M, Cao F B.Effect of combined application of lead, cadmium, chromium and copper on grain, leaf and stem heavy metal contents at different growth stages in rice[J]. Ecotoxicology and Environmental Safety,2018,162(1):71-76.doi:10.1016/j.ecoenv.2018.06.072.
[7] Adhikari S,Ghosh L,Ayyappan S.Combined effects of water pH and alkalinity on the accumulation of lead,cadmium and chromium to Labeo rohita (Hamilton)[J]. International Journal of Environmental Science and Technology,2006,3(3):289-296.doi:10.1007/BF03325936.
[8] 李金航, 齐秀慧, 徐程扬,王畅,刘海轩,孙鹏. 黄栌幼苗叶片气体交换对干旱胁迫的短期响应[J]. 林业科学,2015,51(1):29-41.doi:10.11707/j.1001-7488.20150104.
Li J H, Qi X H,Xu C Y, Wang C, Liu H X, Sun P. Short-Term responses of leaf gas exchange characteristics to drought stress of Cotinus coggygria seedlings[J].Scientia Silvae Sinicae,2015,51(1):29-41.
[9] 张慧蓉, 张建伟, 张兆沛,吴金祥. 盐碱胁迫对野生地肤种子发芽和幼苗生长的影响[J]. 种子,2010,29(1):15-19.doi:10.3969/j.issn.1001-4705.2010.01.005.
Zhang H R, Zhang J W, Zhang Z P, Wu J X. Effects of saline-alkali stress on seed germination and seedling growth of wild wancomponents(Kochia scoparia(L.) schrad)[J].Seed, 2010,29(1):15-19.
[10] 聂惠, 于海峰, 刘浩明. 向日葵对盐胁迫的反应及其抗盐机理的研究进展[J]. 北方农业学报,2008(6):17-19.doi:10.3969/j.issn.1007-0907.2008.06.009.
Nie H, Yu H F, Liu H M.Response of sunflower to salt stress and its salt resistance mechanism[J].Journal of Northern Agriculture,2008(6):17-19.
[11] Macková H, Hronková M, Dobrá J, Turecˇková V, Novák O, Lubovská Z, Motyka V, Haisel D, Hájek T, Prášil I T, Gaudinová A,  torchová H, Ge E, Werner T, Schmülling T, Vanková R. Enhanced drought and heat stress tolerance of tobacco plants with ectopically enhanced cytokinin oxidase/dehydrogenase gene expression[J]. Journal of Experimental Botany,2013,64(10):2805-2815.doi:10.1093/jxb/ert131.
torchová H, Ge E, Werner T, Schmülling T, Vanková R. Enhanced drought and heat stress tolerance of tobacco plants with ectopically enhanced cytokinin oxidase/dehydrogenase gene expression[J]. Journal of Experimental Botany,2013,64(10):2805-2815.doi:10.1093/jxb/ert131.
[12] 张瑞腾, 付秋实, 张磊, 李双桃, 郭仰东, 张红, 李灵芝, 李海平, 王怀松.甜瓜CmGnT基因的克隆及非生物胁迫下的表达分析[J]. 园艺学报,2017,44(7):1379-1387.doi:10.16420/j.issn.0513-353x.2016-0932.
Zhang R T, Fu Q S, Zhang L, Li S T, Guo Y D, Zhang H, Li L Z, Li H P, Wang H S.Cloning and expression analyzing of CmGnT gene in melon under abiotic stresses[J]. Acta Horticulturae Sinica,2017,44(7):1379-1387.
[13] 蒋晓怡. 拟南芥糖基转移酶基因UGT75X参与植物对逆境适应性的作用分析[D]. 济南:山东大学,2017.
Jiang X Y. Function analysis of Arabidopsis glycosyltransferase gene UGT75X in plant adaptation to stresses[D].Jinan: Shandong University,2017.
[14] 刘兆华. 拟南芥中与非生物胁迫相关基因UGT-LIKE、UF1和UF2的初步研究[D].泰安:山东农业大学,2012.
Liu Z H. Researches on UGT-LIKE, UF1 and UF2 of Arabidopsis involved in abiotic stresses tolerance[D].Taian: Shandong Agricultural University,2012.
[15] Li Y J,Li P,Wang T, Zhang F J, Huang X X, Hou B K. The maize secondary metabolism glycosyltransferase UFGT2 modifies flavonols and contributes to plant acclimation to abiotic stresses[J]. Annals of Botany,2018,122(7):1203-1217.doi:10.1093/aob/mcy123.
[16] 张春柳, 赖钟雄. 铁皮石斛原球茎DoGAUT1和DoPGSIP6基因的克隆及其在不同昼夜温差下的表达分析[J]. 热带作物学报,2015,36(3):456-465.doi:10.3969/j.issn.1000-2561.2015.02.003.
Zhang C L, Lai Z X. Cloning DoGAUT1 and DoPGSIP6 from protocorms and the expression analysis by qPCR under day-and-night temperature differences in Dendrobium officinale[J].Chinese Journal of Tropical Crops,2015,36(3):456-465.
[17] Lin F Y, Lu Q X, Xu J H, Shi J R. Cloning and expression analysis of two salt and Fusarium graminearum stress associated UDP-glucosyltransferases genes in wheat[J]. Hereditas,2009,30(12):1608-1614.doi: 10.3724/SP.J.1005.2008.01608.
[18] 秦晶晶, 孙春玉, 张美萍, 王义. 植物UDP-糖基转移酶分类、功能以及进化[J]. 基因组学与应用生物学,2018,37(1):440-450.doi:10.13417/j.gab.037.000440.
Qin J J, Sun C Y, Zhang M P, Wang Y. Classification, function and evolution of plant UDP-glycosyltransferase[J].Genomics and Applied Biology,2018,37(1):440-450.
[19] Bishopp A,Help H, El-Showk S, Weijers D, Scheres B, Friml J, Benkov E, Mähönen A P, Helariutta Y. A mutually inhibitory interaction between auxin and cytokinin specifies vascular pattern in roots[J].Current Biology,2011,21(11):917-926.doi:10.1016/j.cub.2011.04.017.
E, Mähönen A P, Helariutta Y. A mutually inhibitory interaction between auxin and cytokinin specifies vascular pattern in roots[J].Current Biology,2011,21(11):917-926.doi:10.1016/j.cub.2011.04.017.
[20] Yoshida T, Fujita Y, Sayam H, Kidokoro S, Maruyama K, Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AREB1, AREB2, and ABF3 are master transcription factors that cooperatively regulate ABRE-dependent ABA signaling involved in drought stress tolerance and require ABA for full activation[J].The Plant Journal,2010,61(4):672-685.doi:10.1111/j.1365-313X.2009.04092.x.
[21] Von Saint Paul V, Zhang W, Kanawati B, Geist B, Faus-keβler T, Schmitt-kopplin P, Schäffner A R. The Arabidopsis glucosyltransferase UGT76B1 conjugates isoleucic acid and modulates plant defense and senescence[J]. The Plant Cell,2011,23(11):4124-4145.doi:10.1105/tpc.111.088443.
[22] 陈娜, 胡东青, 潘丽娟, 迟晓元, 陈明娜, 王通, 王冕, 杨珍, 禹山林. 花生中UDP-葡萄糖基转移酶基因的克隆及在非生物胁迫下的表达研究[J]. 中国油料作物学报,2014,36(3):308-315.doi:10.7505/j.issn.1007-9084.2014.03.003.
Chen N, Hu D Q, Pan L J, Chi X Y, Chen M N, Wang T, Wang M, Yang Z, Yu S L.Cloning of UDP-glucosyltransferase gene from peanut (Arachis hypogaea L.)and its expression analysis during abiotic stress[J].Chinese Journal of Oil Crops,2014,36(3):308-315.
[23] 李攀. 拟南芥和玉米糖基转移酶基因参与非生物胁迫耐性的功能研究[D].济南:山东大学,2017.
Li P. Functional analysis of glycosyltransferase genes of Arabidopsis thaliana and Zea mays in tolerance to abiotic stresses[D].Jinan:Shandong University,2017.
[24] 董瑞瑞. 拟南芥糖基转移酶基因UGT76E12的克隆及其参与逆境适应性的作用分析[D].济南:山东大学,2015.doi:10.7666/d.Y2794069.
Dong R R. The cloning of Arabidopsis glycosyltransferase gene UGT76E12 and its role in plant adaptation to stress[D]. Jinan:Shandong University,2015.
[25] 狄少康, 尹青岗, 夏亚迎, 庞永珍. 大豆类黄酮糖基转移酶基因UGT73C19的功能研究[J]. 中国农业科学,2019,52(20):3507-3519.doi:10.3864/j.issn.0578-1752.2019.20.002.
Di S K, Yin Q G, Xia Y Y, Pang Y Z. Functional characterization of a UDP: flavonoid glycosyltransferase gene UGT73C19 in Glycine max[J].Agricultural Science of China,2019,52(20):3507-3519.
[26] 赵晓祥,冯璐,王宇晖.锌、镉单一及复合胁迫下番茄幼苗生理响应及联合毒性的研究[J].安全与环境学报,2020,20(3):1176-1184.doi:10.13637/j.issn.1009-6094.2019.0660.
Zhao X X, Feng L, Wang Y H.Physiological response and combined toxicity of tomato seedlings under single and combined stress of zinc and cadmium[J].Journal of Safety and Environment,2020,20(3):1176-1184.
[27] 马洪英, 郭锐, 李洪安, 张远芳. 不同盐胁迫处理下番茄种子萌发期的耐盐性研究[J]. 安徽农业科学, 2008, 36(32): 13947-13948,13956. doi:10.13989/j.cnki.0517-6611.2008.32.106.
Ma H Y,Guo R, Li H A, Zhang Y F. Study on salinity tolerance of tomatoes during seed germination under different salt stress conditions[J]. Journal of Anhui Agricultural Sciences,2008,36(32):13947-13948,13956.
[28] Xie R R, Shang X L, Hai D, Guo F Q. Proteomic analysis of heat stress-responsive proteins during rice grain filling[C]//Abstract book of 2nd international symposium on integrative plant biology. Lanzhou:Annals of Botany,2011.
[29] 张凤菊. 拟南芥糖基转移酶基因UGT86A1参与植物对非生物胁迫耐性的作用研究[D]. 济南:山东大学,2018.
Zhang F J. Functional analysis of Arabidopsis glucosyltransferase gene UGT86A1 in plant adaptation to abiotic stresses[D].Jinan: Shandong University, 2018.
[30] 潘维锋,李师鹏.酵母表达系统在植物功能基因组学研究中应用的局限性[J].植物生理学通讯,2006,42(6):1168-1172.
Pan W F, Li S P.Yeast, a model system to elucidate plant gene function: application and limitation[J]. Plant Physiology Communications,2006,42(6):1168-1172.
[31] El-Showk S, Ruonala R,Helariutta Y. Crossing paths: Cytokinin signalling and crosstalk[J]. Development,2013,140(7):1373-1383.doi:10.1242/dev.086371.
[32] 孙延国. 拟南芥糖基转移酶基因耐逆作用研究[D]. 济南:山东大学,2013.
Sun Y G. Research on the role of Arabidopsis glycosyltransferase genes in abiotic stress tolerance[D]. Jinan:Shandong University,2013.
[33] 于惠敏, 王会勇, 王军, 侯丙凯.拟南芥细胞分裂素糖基转移酶UGT76C2的N端亮氨酸替换对酶活性的影响[J]. 植物生理学报,2014,50(11):1659-1668.doi:10.13592/j.cnki.ppj.2014.0315.
Yu H M, Wang H Y, Wang J, Hou B K.Effect of the N-terminal leucine substitution on the enzyme activity of cytokinin glucosyltransferase UGT76C2 of Arabidopsis thaliana[J].Plant Physiology Journal, 2014, 50(11):1659-1668.