当前,抗生素滥用导致耐药菌的产生及抗生素残留等问题,通过食物链关系间接危害人类健康,因此,寻找理想的替抗物质成为当今科研界的焦点之一。阳离子抗菌肽是机体广泛分布的一种广谱抑菌多肽,是宿主免疫系统发挥防御作用的重要物质,其中包括细菌素、防御素等。其中,由β-防御素(AvBDs)构成的非氧化机制在家禽体内占据主要地位[1],能有效杀灭细菌、真菌、病毒等病原体,具有广谱抗微生物活性,在启动机体天然免疫系统抵御外来病原入侵起到重要作用[2-3],有望作为新一类替抗物质发挥重大价值。
AvBDs在鸡体内共编码14种类型,依次被命名为AvBD1~AvBD14[4-5],其中关于AvBD2的相关资料表明,该防御素在鸡骨髓与脾脏器官中表达量略高,推测AvBD2在机体天然免疫与被动免疫方面发挥重要作用[6]。有文献表明,AvBD2能够有效抑制大肠杆菌和李氏杆菌的增殖[7]。防御素以其独特的杀菌机制优于传统抗生素。传统抗生素通常是通过干扰细菌体内各种代谢反应达到杀灭细菌的目的,因而易造成细菌产生耐药性[8]。而AvBD2主要靶向病原体的细胞膜,产生破坏效果造成膜穿孔,使胞内容物溢出胞外引起细胞死亡,达到抑菌效果[9-11]。因此,AvBD2有望作为新型替抗产品在绿色养殖与提高畜产品质量方面发挥重要功能。
本研究应用慢病毒表达系统,构建重组真核质粒pLOV-eGFP-AvBD2,筛选得到稳定表达AvBD2蛋白的细胞系,用其细胞分泌产物培养耐药菌株,检测抑菌活性。该细胞系的建立为抗生素替代品的开发提供了新思路,同时也为后续探讨AvBD2相关生物学作用奠定基础。
1 材料和方法
1.1 细胞、质粒和菌株
感受态细胞DH5α购于擎科生物科技公司;pET-32a-AvBD2质粒、293T细胞、DF-1细胞、AvBD2抗体均由兽医病理生物学与疫病防控安徽省重点实验室保存;慢病毒载体系统pLOV-CMV-eGFP-EF1a-PuroR、包装质粒pSPAX2、外膜质粒pMD2.G由上海兽医研究所刘光清老师惠赠;禽致病性大肠杆菌AH-25由本实验室分离鉴定并保存,该菌株对氨苄西林、头孢噻肟、氯霉素、强力霉素、卡那霉素和氟苯尼考耐药。
1.2 主要试剂与抗体
Lipo8000转染试剂、ECL发光试剂盒、RNA抽提试剂盒及嘌呤霉素均购自碧云天公司;无内毒素质粒提取试剂盒购于天根生化科技公司;胶回收试剂盒购自上海生工生物工程有限公司;胎牛血清、DMEM培养基购自Thermo Fisher公司;辣根过氧化物酶(HRP)标记兔抗鼠IgG购于武汉博士德公司;M-MLV、ClonExpress Ⅱ One Step Cloning Kit购自诺唯赞生物科技有限公司。
1.3 试验方法
1.3.1 重组真核表达质粒的构建 参考GenBank中禽类AvBD2基因序列(登录号XM_015285091.2),应用同源重组酶设计方法设计引物序列见表1。
表1 引物序列
Tab.1 Sequence of primer
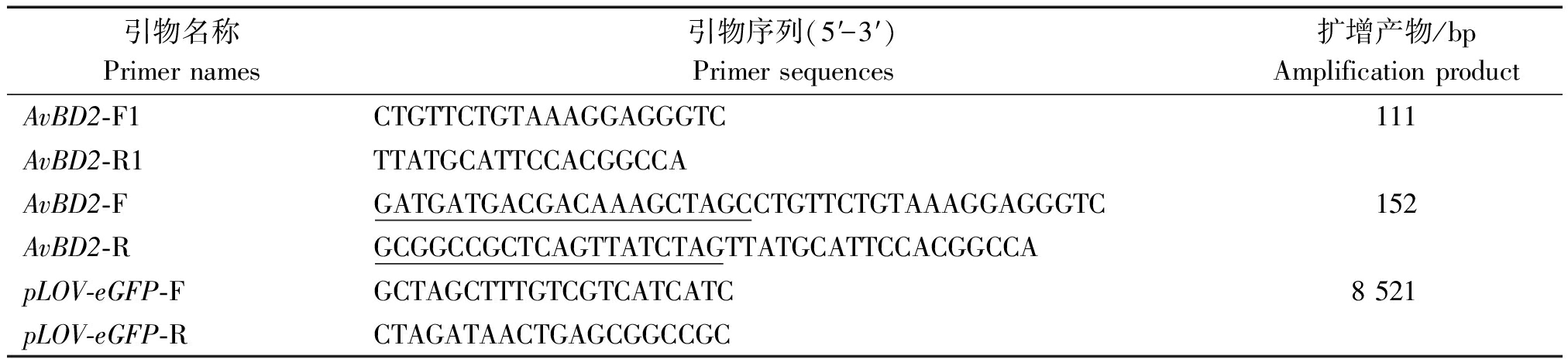
引物名称Primer names引物序列(5′-3′)Primer sequences扩增产物/bpAmplification productAvBD2-F1CTGTTCTGTAAAGGAGGGTC111AvBD2-R1TTATGCATTCCACGGCCAAvBD2-FGATGATGACGACAAAGCTAGCCTGTTCTGTAAAGGAGGGTC152AvBD2-RGCGGCCGCTCAGTTATCTAGTTATGCATTCCACGGCCApLOV-eGFP-FGCTAGCTTTGTCGTCATCATC8 521pLOV-eGFP-RCTAGATAACTGAGCGGCCGC
注:下划线为同源臂序列。
Note:The underlined part represents the sequence of homologous arms.
以本实验室保存的pET-32a-AvBD2质粒为模板,AvBD2-F/R为引物,扩增AvBD2基因;以pLOV-CMV-eGFP-EF1a-PuroR载体为模板,pLOV-eGFP-F/R为引物,将载体线性化,按照同源重组方法将带有同源臂的AvBD2基因与线性化载体进行同源重组,重组产物转化DH5α细胞,将PCR鉴定阳性菌液进行DNA序列测定,获得正确的重组表达质粒pLOV-eGFP-AvBD2。
1.3.2 重组慢病毒的包装 慢病毒包装步骤参照文献[12]。
1.3.3 嘌呤霉素工作浓度的确定 嘌呤霉素工作浓度的筛选参照文献[13]。
1.3.4 慢病毒介导DF-1稳定转染细胞系的筛选 待DF-1细胞培养密度约80%左右,使用1.3.2获得的重组慢病毒进行感染,感染24 h后,重复感染1次。在细胞培养液中加入1 μg/mL 嘌呤霉素进行筛选;间隔1 d更换培养液,对阳性细胞加压筛选3代后,即可得到稳定转染 AvBD2的细胞系,命名为DF-1-AvBD2。
1.3.5 AvBD2基因组mRNA转录水平检测 收取第20代DF-1-AvBD2细胞,抽提细胞RNA并合成cDNA。以cDNA为模板,以AvBD2-F1/R1为引物进行PCR验证,添加空白对照与阴性对照,检测mRNA转录水平。
1.3.6 DF-1-AvBD2细胞系传代稳定性检测 收集第20代DF-1-AvBD2细胞上清液,将蛋白样品及对照组样品处理进行SDS-PAGE,转膜,封闭,一抗以1∶500比例稀释,37 ℃孵育1 h,TBST清洗后,二抗选择HRP标记的IgG,室温孵育后利用ECL显色。
1.3.7 DF-1细胞中AvBD2蛋白抑菌效果检测 收集稳定表达AvBD2蛋白细胞系的培养上清液为试验组,测定其蛋白浓度为32.37 mg/L。药物组为左氧氟沙星(浓度为5 mg/mL),对照组为转染空载体的细胞培养上清液,调整耐药大肠杆菌菌数为1×104 cfu/mL组,取10 μL菌液分别加入试验组和对照组的培养液中,于600 nm波长下,读取37 ℃培养不同时间的吸光数值。计算耐药大肠杆菌的存活率,设置重复试验,进行数据分析。
培养AH-25菌株至对数期,调整其菌数为1×104 cfu/mL,参照文献[14],制备扫描电镜样品,观察细菌状态。
2 结果与分析
2.1 重组质粒pLOV-eGFP-AvBD2的构建
以pET-32a-AvBD2质粒为扩增模板,AvBD2-F/R为上下游引物,经PCR扩增AvBD2基因,结果显示,在约100 bp处出现与预计相符的条带。对载体进行反向PCR扩增,结果显示,在约8 000 bp处存在目的条带,符合预期片段大小(图1)。同时公司测定序列正确,即AvBD2基因片段已正确插入表达载体pLOV-CMV-eGFP-EF1a-PuroR中。
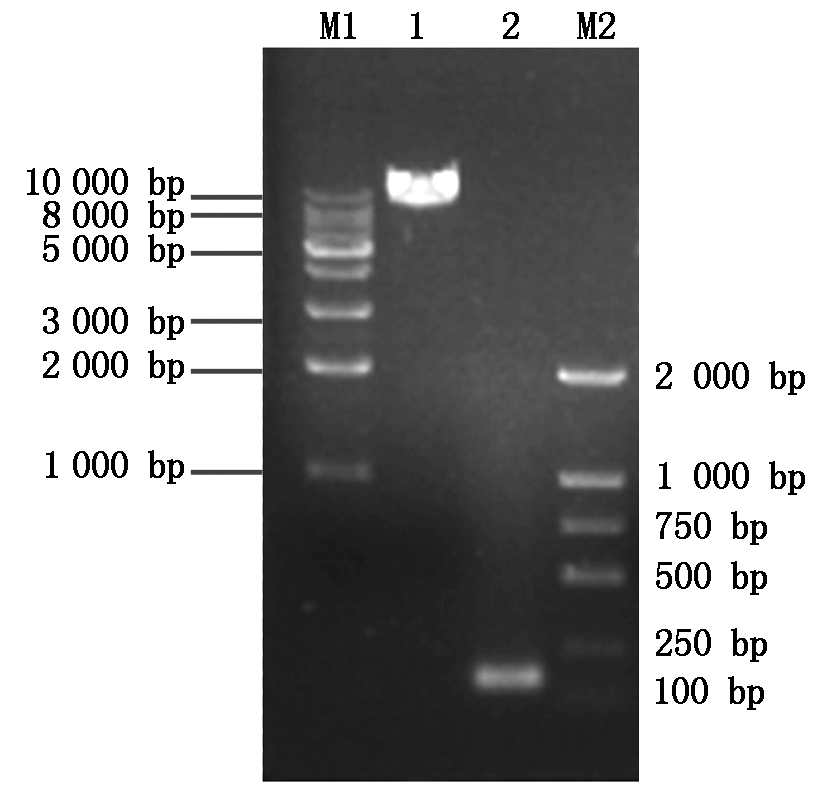
M1.DNA分子质量标准10000 bp;1.pLOV-eGFP载体扩增
结果;2.AvBD2基因扩增结果;M2.DNA分子质量标准2 000 bp。
M1.DNA Marker DL10000;1.pLOV-eGFP vector amplification;
2.AvBD2 gene amplification;M2.DNA Marker DL2000.
图1 重组质粒 pLOV-eGFP-AvBD2 鉴定结果
Fig.1 Identification of recombinant
pLOV-eGFP-AvBD2 plasmid
2.2 嘌呤霉素最适浓度筛选
细胞培养液中添加不同浓度嘌呤霉素24 h后,DF-1-AvBD2细胞出现明显的生长停滞。第3 天时细胞开始大量死亡。当第10天时,1 μg/mL组中仅有极少量细胞存活,而2,3,4,5 μg/mL组中细胞均死亡。因此,本试验中,嘌呤霉素对DF-1-AvBD2细胞的最低致死浓度为2 μg/mL,因此,选择1 μg/mL的嘌呤霉素浓度作为DF-1-AvBD2细胞的最适筛选浓度。
2.3 慢病毒介导DF-1稳定转染细胞系的筛选结果
重组质粒pLOV-eGFP-AvBD2与包装质粒共转染293T细胞后,获得重组慢病毒。慢病毒感染DF-1细胞并经嘌呤霉素抗性连续筛选eGFP表达阳性的DF-1细胞3次,荧光显微镜观察成功转染的细胞呈现绿色荧光,将稳定表达 AvBD2蛋白的单细胞克隆扩大培养,获得DF-1-AvBD2细胞系(图2)。
2.4 细胞基因组中AvBD2 mRNA转录水平的检测
提取第20代DF-1-AvBD2细胞中的总RNA,并反转录合成cDNA。然后以AvBD2-F1/R1为引物,经RT-PCR鉴定AvBD2基因。结果表明,细胞系能检测出AvBD2基因,而DF-1细胞中未检测出(图3)。从而表明,AvBD2基因能在DF-1-AvBD2细胞中转录成mRNA。

A.慢病毒质粒共转染293T细胞荧光图;B.空白对照;C.阴性对照;D.DF-1-AvBD2细胞。
A.Fluorescence map of lentiviral plasmid co-transfected 293T cell;B.Blank control;C.Negative control;D.DF-1-AvBD2 cell.
图2 慢病毒包装及细胞系筛选结果
Fig.2 Lentiviral packaging and cell line screening results
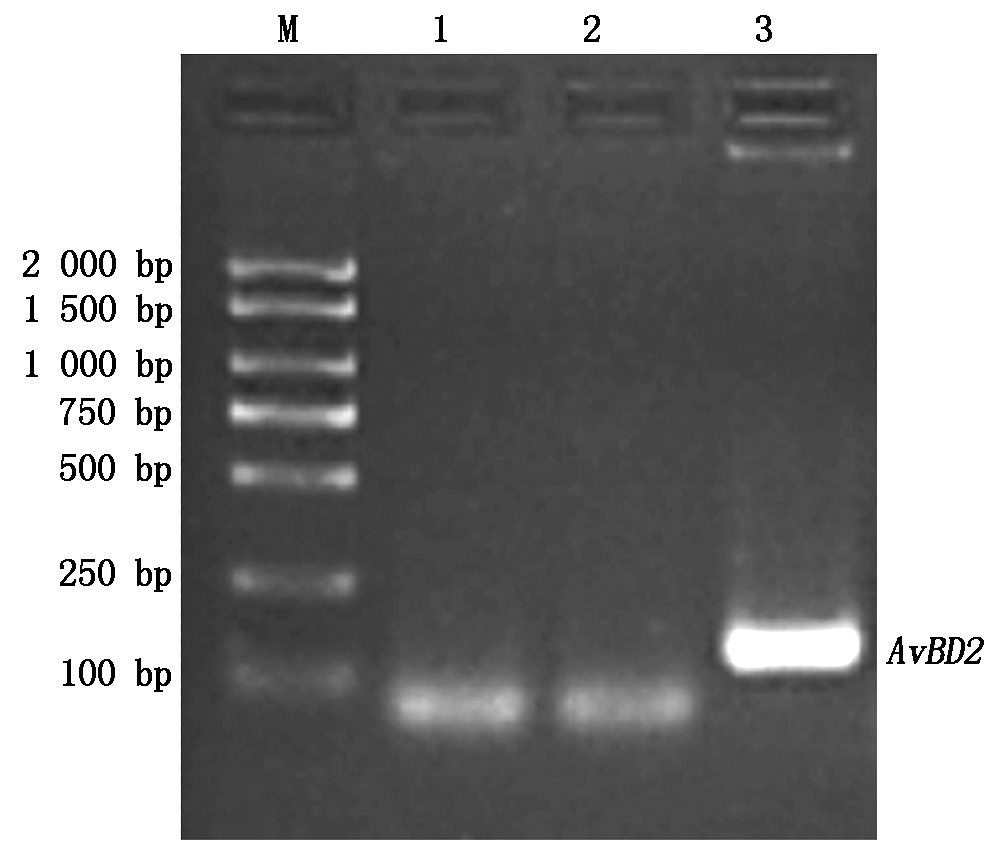
M.DNA分子质量标准;1.空白对照;2.阴性对照;3.DF-1-AvBD2。
M.DNA Marker DL2000;1.Blank control;2.Negative control;
3.DF-1-AvBD2.
图3 DF-1细胞系中的AvBD2基因稳定性鉴定
Fig.3 Identification of AvBD2
gene stability in DF-1 cell line
2.5 AvBD2蛋白在DF-1-AvBD2细胞系的表达
将DF-1-AvBD2细胞传代至第20代,选取第20代的DF-1-AvBD2细胞系上清,Western Blot分析表达情况。结果显示,空白组和阴性对照组细胞上清中未检测到目的蛋白,而DF-1-AvBD2中可见条带清晰的目的蛋白(图4)。从而表明,AvBD2基因在DF-1-AvBD2细胞中传递20代依然能表达蛋白。

M.蛋白分子量标准;1.DF-1-AvBD2;2.阴性对照;3.空白对照。
M.Protein Ladder;1.DF-1-AvBD2;2.Negative control;3.Blank control.
图4 AvBD2 在DF-1 细胞系中表达检测
Fig.4 Identification of AvBD2 expression in DF-1 cell line
2.6 DF-1细胞中AvBD2蛋白抑菌效果的检测
将细胞培养上清液添加至供试菌中培养,酶标仪读取不同时间段吸光值,结果显示,耐药菌的存活率随着培养时间的延长而逐渐降低,在第5 小时供试菌的存活率明显低于50%,但作用6 h后,细菌存活率开始上升(图5),而药物组在6 h,供试菌存活率未出现上升,即在一定时间范围内,AvBD2蛋白的抑菌效果与时间呈正比关系。扫描电镜下观察空白组菌体成短杆状,较完整饱满。而经AvBD2蛋白作用6 h后的菌体出现明显的损伤,细胞皱缩变形,表面凹凸不平(图6)。抑菌曲线及电镜结果共同证实,AvBD2蛋白能破坏AH-25菌株的细胞膜,推测AvBD2蛋白在抑制病原微生物的增殖方面能发挥独特作用。
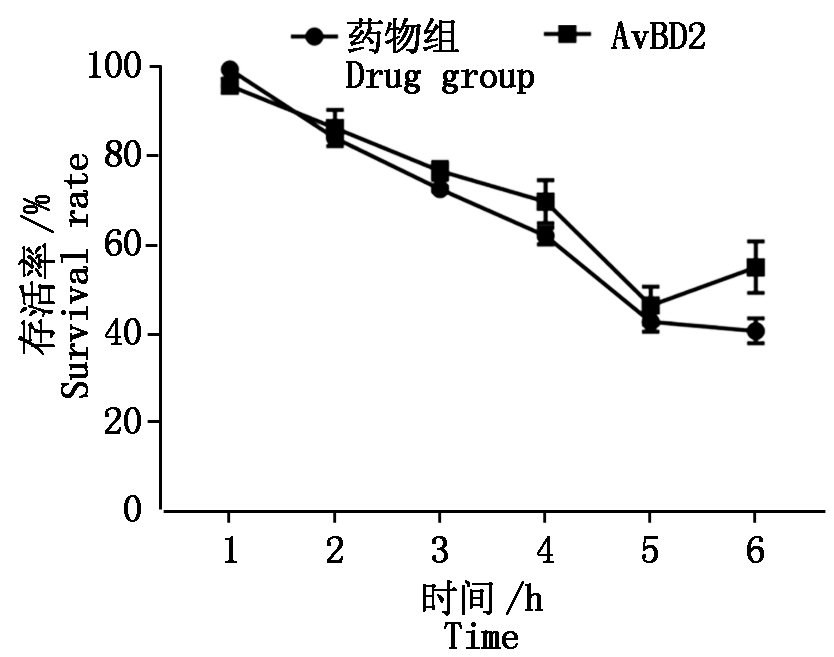
图5 抗菌活性结果
Fig.5 The result of antibacterial activity

A.空白对照组(40.0 k);B.DF-1-AvBD2试验组(40.0 k)。
A. Blank control(40.0 k);B.DF-1-AvBD2(40.0 k).
图6 电镜观察AvBD2蛋白抑菌效果
Fig.6 Electron microscopic observation of antibacterial effect of AvBD2 protein
3 讨论
近年来,我国主要采取集中养殖的家禽饲养模式,容易使家禽大范围地感染疾病。为了降低养殖风险,抗生素被广泛使用,造成了一系列生物安全问题。农业农村部于2018年明确提出了减抗、限抗的时间安排表。因此,关于替抗、无残留添加剂的研究成为当前畜牧养殖业绿色可持续发展的首要任务。防御素以广谱杀菌活性、特殊的作用机理及调节机体免疫系统方面的优势,给人们展现了一条开发理想替抗产品的途径。
然而防御素天然产量低,体外合成或从体内提取步骤复杂、成本较高[15-16]。原核表达系统操作简单,易于大量生产。石水琴等[17]构建出AvBD2大肠杆菌原核表达系统,其纯化蛋白对多种病原菌具有较好的抗菌活性。但原核细胞不具备真核细胞特有的一些稀有密码子,并且原核细胞的蛋白折叠系统缺少相应的分子伴侣、辅酶、辅基等,导致某些蛋白不能正常折叠,失去部分或全部该蛋白应有的功能[18]。王海霞[19]构建出AvBD2毕赤酵母分泌表达系统,其表达上清对预防雏鸡感染常见大肠杆菌病有良好的效果[20]。但真核酵母表达系统存在分泌产物不一致,表达的蛋白易降解及成本高昂等问题,极大地限制了毕赤酵母表达系统的应用。鉴于此,本研究采用慢病毒表达方式,有效解决了上述防御素获取方式的弊端,使目的蛋白高效表达的同时,保证其天然活性。
慢病毒系统以其高效、稳定、精准等特点成为目前细胞分子生物学研究常用的工具之一[21]。慢病毒可将其重组的目的基因插入宿主染色体中持续表达目的蛋白[22]。此外,慢病毒载体含有嘌呤霉素抗性便于细胞系的快速筛选[23]。已有研究表明,多种动物β-防御素基因均通过真核表达载体成功表达,且产物具有较好的天然活性。
本研究利用慢病毒构建重组pLOV-eGFP-AvBD2穿梭载体,荧光观察到细胞颗粒呈现绿色荧光,表明已成功包装出具有活性的慢病毒颗粒,随后进一步利用嘌呤霉素抗性进行筛选,通过在转录水平和蛋白水平检测到AvBD2的表达,最终得到了可持续表达AvBD2蛋白的细胞系。在重组AvBD2抗菌活性检测中,AvBD2蛋白对AH-25菌株具有抑制作用。耐药菌的存活率随着时间的延长而逐渐下降,出现一个作用的最佳时间点,但随着时间的延长,该菌株的存活率又开始上升,表明AvBD2的抗菌效果同时间具有一定的相关性。本研究建立了可稳定持续表达AvBD2蛋白的DF-1细胞系,该细胞系表达的重组蛋白不仅具有与天然AvBD2蛋白相似的功能,还可以应用于抗生素替代品的制备分析,进而为探讨防御素后续的功能研究奠定基础。
[1] Sugiarto H,Yu P L. Identification of three novel ostricacins:an update on the phylogenetic perspective of β-defensins[J]. International Journal of Antimicrobial Agents,2006,27(3):229-235. doi:10.1016/j.ijantimicag.2005.10.013.
[2] 刘璨颖,陈志胜,林裕锋,计慧琴,王丙云,陈胜锋. 猪源 β-防御素2和3的研究进展[J]. 中国畜牧杂志,2019,55(8):30-34. doi:10.19556/j.0258-7033.20190221-03.
Liu C Y,Chen Z S,Lin Y F,Ji H Q,Wang B Y,Chen S F. Research progress and application prospect of porcine β-defensin 2 and β-defensin 3[J]. Chinese Journal of Animal Science,2019,55(8):30-34.
[3] Salzman N H,Ghosh D,Huttner K M,Paterson Y,Bevins C L. Protection against enteric salmonellosis in transgenic mice expressing a human intestinal defensin[J]. Nature,2003,422(6931):522-526. doi:10.1038/nature01520.
[4] Lynn D J,Higgs R,Gaines S,Tierney J,James T,Lloyd A T,Fares M A,Mulcahy G,O′Farrelly C. Bioinformatic discovery and initial characterisation of nine novel antimicrobial peptide genes in the chicken[J]. Immunogenetics,2004,56(3):170-177. doi:10.1007/s00251-004-0675-0.
[5] Xiao Y J,Hughes A L,Ando J,Matsuda Y,Cheng J F,Skinner-Noble D,Zhang G L. A genome-wide screen identifies a single β-defensin gene cluster in the chicken:implications for the origin and evolution of mammalian defensins[J]. BMC Genomics,2004,5(1):56. doi:10.1186/1471-2164-5-56.
[6] 陈燕珊,谢青梅,覃健萍,周庆丰,曹永长. 禽类的重要免疫因子-鸡β 防御素[J]. 生命的化学,2005(6):501-504. doi:10.3969/j.issn.1000-1336.2005.06.024.
Chen Y S,Xie Q M,Qin J P,Zhou Q F,Cao Y C. Avian important immune factors-chicken β defensin[J].Chemistry of Life,2005(6):501-504.
[7] Cuperus T,van Dijk A,Dwars R M,Haagsman H P. Localization and developmental expression of two chicken host defense peptides:cathelicidin-2 and avian β-defensin 9[J]. Developmental and Comparative Immunology,2016,61:48-59. doi:10.1016/j.dci.2016.03.008.
[8] 云骜. 重组禽 β-防御素2和6协同抗禽肿瘤病毒感染研究[D]. 泰安:山东农业大学,2018.
Yun A. Recombinant avian β-defensin 2 and 6 synergistically resist infection of Avian tumor viruses[D]. Taian:Shandong Agricultural University,2018.
[9] Zhao L,Yang M,Zhang M,Zhang S P. Expression,purification,and in vitro comparative characterization of avian beta-defensin-2,-6,and-12[J]. Avian Diseases,2014,58(4):541-549. doi:10.1637/10848-042014-Reg.1.
[10] Ganz T,Lehrer R I. Antibiotic peptides from higher eukaryotes:biology and applications[J]. Trends in Mol Med,1999,5(7):292-297. doi:10.1016/S1357-4310(99)01490-2.
[11] Tonk M, Knorr E, Cabezas-Cruz A, Valdés J J, Kollewe C, Vilcinskas A. Tribolium castaneum defensins are primarily active against Gram-positive bacteria[J]. Journal of Invertebrate Pathology,2015,132:208-215. doi:10.1016/j.jip.2015.10.009.
[12] 朱璐宇,彭丽艳,周雨霞,王喜军,步志高. 稳定表达犬SLAM 受体的Vero 细胞系的建立与应用[J]. 内蒙古农业大学学报(自然科学版),2018,39(6):7-12. doi:10.16853/j.cnki.1009-3575.2018.06.002.
Zhu L Y,Peng L Y,Zhou Y X,Wang X J,Bu Z G. Establishment and application of vero cell line stably expressing dog SLAM[J]. Journal of Inner Mongolia Agricultural University(Natural Science Edition),2018,39(6):7-12.
[13] 李文良,毛立,杨蕾蕾,郝飞,张纹纹,江杰元. 稳定表达猪Viperin 的PK-15 细胞系的构建与鉴定[J]. 江苏农业学报,2016,32(1):128-132. doi:10.3969/j.issn.1000-4440.2016.01.020.
Li W L,Mao L,Yang L L,Hao F,Zhang W W,Jiang J Y. Construction and identification of PK-15 cell line stably expressing porcine viperin[J]. Jiangsu Journal of Agricultural Sciences,2016,32(1):128-132.
[14] 姚羽菲,龙敏,文荟淋,姚刚. 抗铜绿假单胞菌IgY的制备优化及抑菌效果[J]. 检验医学与临床,2018,15(2):202-205,208. doi:10.3969/j.issn.1672-9455.2018.02.018.
Yao Y F,Long M,Wen H L,Yao G. The optimized preparation of IgY against P.aeruginosa and the detection of its antibiotic effect[J]. Laboratory Medicine and Clinic,2018,15(2):202-205,208.
[15] Harmon B G. Avian heterophils in inflammation and disease resistance[J]. Poultry Science,1998,77(7):972-977. doi:10.1093/ps/77.7.972.
[16] Huang G T,Zhang H B,Kim D,Liu L E,Ganz T. A model for antimicrobial gene therapy:demonstration of human β-defensin 2 antimicrobial activities in vivo[J]. Human Gene Therapy,2002,13(17):2017-2025. doi:10.1089/10430340260395875.
[17] 石水琴,魏海婷,祁克宗,涂健,吕小龙,刘红梅,薛挺,周秀红. 鸡 β-防御素2在大肠杆菌中的串联表达及抗菌活性分析[J]. 中国兽医科学,2016,46(4):516-523. doi:10.16656/j.issn.1673-4696.2016.04.020.
Shi S Q,Wei H T,Qi K Z,Tu J,Lü X L,Liu H M,Xue T,Zhou X H. Tandem expression of chicken β-defensin 2 and analysis of its antimicrobial activity[J].Chinese Veterinary Science,2016,46(4):516-523.
[18] 王婷婷,王志浩,米洁兰,王文骞,高玉龙,刘长军,祁小乐,张艳萍,李凯,高立,潘青,王笑梅,崔红玉. 表达禽β-防御素6重组乳酸菌的构建及其免疫调节活性检测[J]. 中国预防兽医学报,2020,42(9):931-937. doi:10.3969/j.issn.1008-0589.201912042.
Wang T T,Wang Z H,Mi J L,Wang W Q,Gao Y L,Liu C J,Qi X L,Zhang Y P,Li K,Gao L,Pan Q,Wang X M,Cui H Y. Construction of recombinant lactic acid bacteria expressing avian β-defensin 6 and detection of its immunomodulatory activity[J]. Chinese Journal of Preventive Veterinary Medicine,2020,42(9):931-937.
[19] 王海霞. 鸡AvBD2 成熟肽在毕赤酵母中的表达及其抗菌活性分析[D]. 合肥:安徽农业大学,2012.
Wang H X. Expression of chicken AvBD2 mature peptide in Pichia pastoris and analysis of antimicrobial activity of the recombinant protein[D]. Hefei:Anhui Agricultural University,2012.
[20] 魏海婷. AvBD2在毕赤酵母中的组成型表达及其发酵条件优化[D]. 合肥:安徽农业大学,2015.
Wei H T. Contitutive expression of AvBD2 in Pichia pastoris and optimization of its fermentation conditions[D]. Hefei:Anhui Agricultural University,2015.
[21] 邹斌,周学亮,詹宇亮,陈紫晴,赖松青,吴霞,刘季春. 慢病毒载体介导HIF1α 稳定表达A549 细胞系构建[J]. 重庆医学,2017,46(20):2744-2746,2750. doi:10.3969/j.issn.1671-8348.2017.20.003.
Zou B,Zhou X L,Zhan Y L,Chen Z Q,Lai S Q,Wu X,Liu J C. Establishment of A549 cell line with stable expression of HIF1α mediated by lentiviral vector[J]. Chongqing Medicine,2017,46(20):2744-2746,2750.
[22] Xu Z Z,Shan F L,Shan F,Meng C,Zhou X H,Zhang X M,Chen X,Chen X N. Generation and application of a 293 cell line stably expressing bovine interferon-gamma[J]. Protein Expression and Purification,2014,99:131-137. doi:10.1016/j.pep.2014.04.012.
[23] 刘燕飞,那雷,王晓钧. 稳定表达Cas9 蛋白的HeLa 细胞系的建立[J]. 中国预防兽医学报,2020,42(9):893-898. doi:10.3969/j.issn.1008-0589.201911023.
Liu Y F,Na L,Wang X J. Establishment of a HeLa cell line stable expressing Cas9 protein[J]. Chinese Journal of Preventive Veterinary Medicine,2020,42(9):893-898.