随着羊肉在人们肉品消费中占据越来越高的地位,人们对羊肉品质的要求也达到了新的水平,影响肉质性状的重要因素是动物体内脂肪组织的分布,而前体脂肪细胞的分化是动物脂肪沉积的主要方式。前体脂肪细胞的分化是一个多转录因子协同作用的复杂生物过程[1],伴随着细胞形态结构和功能的变化,越来越多的研究表明,Krupprl样因子家族(Kruppel-like factors,KLFs)能够独立或者协同其他转录因子调控脂肪细胞分化[2-3]。研究KLFs基因对脂肪细胞分化的调控作用和阐明其影响山羊肉质性状的分子机制具有重要意义。
KLFs是一类在真核生物体内广泛分布的重要锌指蛋白[3-5],其功能复杂多样。目前共发现KLFs家族成员有18个,成员间存在直接或间接相互作用,在不同的生物过程中都发挥重要调控功能[6-7]。已有研究证明KLFs家族有多个成员参与脂肪分化中,并发挥重要的作用[8-10]。KLF6是KLFs家族中的重要一员,最早从小鼠和人的肝脏星形间叶细胞和胎盘中获得[11],KLF6作为转录因子,可能通过结合基因的启动子来调控靶基因的表达[12]。近年在小鼠上研究表明,KLF6参与到前体脂肪细胞分化及脂质代谢过程中[9]。Li等[10]在3T3-L1细胞的研究中发现KLF6可能通过抑制DLK1来促进脂肪细胞分化,Bechmann等[13]研究发现KLF6增加了PPARα的活性,而敲除KLF6则抑制PPARα活性。其中PPARα是参与脂肪细胞分化过程的重要的核受体类转录因子[14]。以上研究皆暗示KLF6在脂肪细胞分化中具有重要的调控作用,然而KLF6在家畜中的相关报道较少,同时西南民族大学现代生物技术国家民委重点实验室前期转录组测序发现KLF6是山羊脂肪细胞分化前后的主要差异基因之一。
本研究克隆得到简州大耳羊KLF6核苷酸序列并利用实时荧光定量PCR(Quantitative real time PCR,qPCR)等技术明确该基因的组织和细胞时序表达模式,本研究结果为最终阐明其对山羊脂肪细胞分化的调控作用提供基础数据。
1 材料和方法
1.1 试验材料
1.1.1 试验动物与组织的采集 试验动物选择生长12月左右(n=4)健康简州大耳羊,自四川省简阳市大哥大牧业有限公司购得。清晨空腹屠宰后,当即剪取心、肝、脾、肺、肾、背最长肌、股二头肌、臂三头肌、皮下脂肪、腹间脂肪、大肠、小肠、瘤胃、胰脏等组织样品,将样品在DEPC水中清洗后,快速用锡纸包好并分装在标好编号的冻存管内置于液氮中保存。
1.1.2 试验材料 TRIzol试剂、pMD-19T Vector载体及SYBR®Premix Ex TaqTM(2×)试剂盒通过TaKaRa公司订购;通过Thermo公司购得反转录(Revert Aid First Strand cDNA SynthesisKit)试剂盒;DH5α感受态细胞与2×GC-rich PCR Master Mix通过北京天根生化科技有限公司购得;AxyPrep DNA Gel Extraction Kit试剂盒通过Axygen公司购得;双抗、PBS、胰蛋白酶及DEME/F12培养基通过Hyclone公司供售;胎牛血清通过Gemini公司购得;油酸通过Sigma公司购得;细胞培养皿等耗材由依科赛生物制品有限公司供售;氯仿、异丙醇、DEPC及其他试剂则为国产生化试剂。
1.2 试验方法
1.2.1 总RNA提取及cDNA合成 按照TRIzol法提取各组织及细胞总RNA,检测RNA完整性、RNA浓度及纯度,利用紫外分光光度计测定OD值在1.8~2.0,符合试验要求。所提取RNA去除基因组DNA并参照反转录试剂盒说明书,反转录得到cDNA,于-20 ℃保存备用。
1.2.2 山羊KLF6基因的克隆测序 根据GenBank上登录的山羊、绵羊、牛的KLF6基因预测序列,利用Primer Primer 5.0软件在其序列比对保守区域,设计得到PCR特异性扩增引物(表1),引物由成都擎科(成都)生物公司合成,并以脂肪组织cDNA为
表1 引物信息
Tab.1 Primers information

目的基因Target gene引物序列(5′-3′)Primer sequence退火温度/℃Tm产物长度/bpProduct length用途UtilizationKLF6F:TGCAGGGGTTACGTTTGCAG601 233RT-PCRR:GTGACTGTTCTCGCCCTCKLF6F:GCCTCTGAGATCAAATTCGACA62189qPCRR:GGAGGACTCGCTGCTCACATTBPF:AACAGCCTCCCACCTTATGC60155qPCRR:TGCTGCTCCTCCAAAATAGACUXTF:GCAAGTGGATTTGGGCTGTAAC60180qPCRR:ATGGAGTCCTTGGTGAGGTTGT
模板克隆KLF6基因PCR反应体系为Tap PCR Master Mix(2×)12.5 μL、Primer F(10 μmoL/L)1.0 μL、Primer R(10 μmoL/L)1.0 μL、模板cDNA 1.0 μL,ddH2O 9.5 μL,反应条件为98 ℃预变性2 min;98 ℃变性10 s,57 ℃退火15 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min,4 ℃保存。利用1%琼脂糖凝胶电泳检测为所需目的条带,并通过AxyPrep DNA Gel Extraction Kit试剂盒回收目的条带,构建PMD-19T-KLF6连接载体,并在DH5α感受态细胞内转化,37 ℃培养13~16 h,挑取阳性克隆,并进行菌落PCR鉴定,最后送成都擎科(成都)公司进行序列测定。
1.2.3 山羊KLF6基因生物信息学分析 利用NCBI 网站上ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析KLF6基因的开放阅读框,通过Blast在线工具进行同源性比较,利用MEGA 7软件进行KLF6基因物种进化树分析;利用ExPASY(http://www.expasy.org)分析推导蛋白质的基本理化性质,利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域,利用SignalP 4.1 Server预测信号肽序列,利用NetPhos 2.0、NetOGlyc 4.0、NetNGlyc 1.0分析预测KLF6蛋白磷酸化位点、O 糖基化位点、N 糖基化位点,通过PSORT II(http://psort.hgc.jp/)对亚细胞定位进行预测,相关蛋白相互作用网络由STRING(http://www.string-db.org/)交互式数据库构建,NPS预测二级结构,SWISS-MODEL(http://swissmodel.expasy.org/)预测三级结构。
1.2.4 山羊KLF6基因组织表达检测 根据克隆获得的山羊KLF6序列设计其定量引物,检测KLF6基因在简州大耳羊各组织(心、肝、脾、肺、肾、背最长肌、股二头肌、臂三头肌、皮下脂肪、腹间脂肪、瘤胃和胰腺)中的表达差异。qPCR反应体系为SYBR®Premix Ex TaqTM(2×)10 μL、Primer F(10 μmoL/L)1.0 μL、Primer R(10 μmoL/L)1.0 μL、模板cDNA 1.0 μL,ddH2O 7 μL,反应条件为95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸15 s,40个循环。试验设置4个生物学及3个技术重复,并设置阴性对照,引物序列见表1。
1.2.5 山羊KLF6基因时序表达检测 取本实验保存[15]的山羊皮下脂肪细胞进行复苏培养,加入适量完全培养基(10%胎牛血清,90%DMEM/F-12基础培养基,10 kU/L青链霉素)培养,按照1∶3传代接种于25 cm2的培养瓶中,在37 ℃、5%CO2的培养箱中培养,隔2 d换一次液。将F3细胞传代至12孔细胞培养板中,待细胞生长至80%时,利用含10 mg/L 胰岛素和150 μmol/L油酸的完全培养基培养至不同时间收集用于检测KLF6基因在分化过程中的表达情况。
1.2.6 数据统计与分析 数据结果用“平均值±标准差”表示,用2-ΔΔCt法[16]对qPCR数据均一化处理,组织表达以心脏组织为对照,以TBP[17]为内参基因,细胞试验以0 d为对照,以UXT[18]为内参基因(表1)。显著性检验利用SPSS 22.0软件中One-way ANOVA分析,当P<0.05,则差异显著,当P<0.01时,则差异极显著。

上行.山羊KLF6核苷酸序列;下行.推测的氨基酸序列;下划线.起始密码子;方框.简单结构域;阴影.C端结构域(C2H2);加粗.磷酸位点;斜体加粗.O糖基位点;△.N糖基位点;*.终止密码子。
The upper line.The nucleotide sequences;The lower line.The deduced amino acid sequences; Underlined. The initial code ATG; Box.The simple domain; Shade.The C-terminal domain (C2H2); Coarsening.Phosphoric acid site; Italic thickening.O glycosyl site;△.Glycosyl site;* .The terminal code TGA.
图1 山羊KLF6基因生物信息学分析
Fig.1 Bioinformatics analysis of KLF6 gene in goat
2 结果与分析
2.1 山羊KLF6基因的克隆及理化性质分析
利用RT-PCR方法,以简州大耳羊脂肪组织cDNA为模板克隆得到KLF6核苷酸序列,序列总长为1 233 bp,其中包含ORF区957 bp,5′UTR序列123 bp,3′UTR序列153 bp,其终止密码子为TGA,编码318个氨基酸残基(图1)。山羊KLF6氨基酸序列的理化性质预测显示,该蛋白分子式为C1532H2354N442O488S16,其蛋白分子量为35.285 17 ku,理论等电点为6.20,不稳定指数为47.72,亲水性总平均值为-0.731,说明该蛋白为亲水酸性蛋白。氨基酸组成显示丝氨酸(Ser)占13.8%,为组成氨基酸比例最高(图2),带负电荷的氨基酸残基(Asp+Glu)总数为42,带正电荷的氨基酸残基(Arg+Lys)总数为36,因此该蛋白整体带负电。

图2 山羊KLF6蛋白氨基酸组成
Fig.2 Amino acid composition of goat KLF6 protein
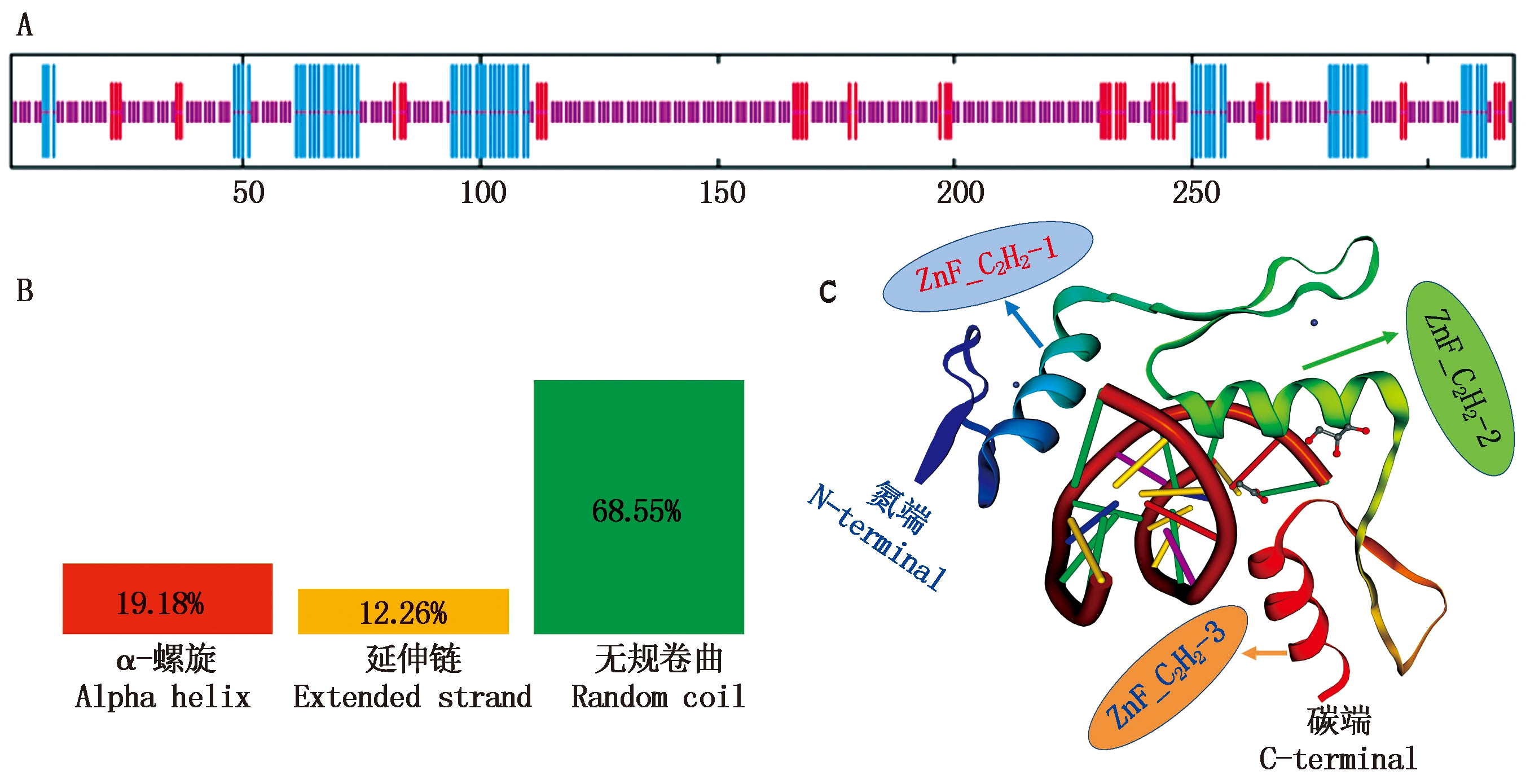
A.KLF6氨基酸序列二级结构预测;长度从长倒短分别代表α-螺旋、延伸链及无规则卷曲;B.山羊KLF6蛋白结构组成特征;C.预测的KLF6蛋白的三级分子模型,N末端和C末端分别代表氨基末端和羧基末端。
A.The secondary structure of the KLF6 amino acid sequence was predicted; The length from long to short represents α-helix, extended chain and irregular crimp, respectively; B. Structural characteristics of KLF6 protein in goat; C. The predicted tertiary molecular model of KLF6 protein where N-terminal and C-terminal represented the aminoterminal and carboxyterminal end, respectively.
图3 山羊KLF6蛋白结构特征
Fig.3 Structural characteristics of KLF6 protein in goat
2.2 山羊KLF6生物信息学分析
磷酸化位点预测结果显示,山羊KLF6蛋白潜在的磷酸化位点共53个,其中酪氨酸(Tyr)、丝氨酸(Ser)及苏氨酸(Thr)磷酸化位点的个数分别为5,37,11,有20个O-糖基化位点,分别为8个苏氨酸糖(Thr)基化位点和12个丝氨酸(Ser)糖基化位点,存在1个N-糖基化位点(图1);同时分析发现山羊KLF6蛋白无信号肽及跨膜结构域,其主要功能位于细胞核(95.7%),其次是液泡(4.3%)。KLF6蛋白结构二级结构预测结果显示(图3-A),其可能由总氨基酸的19.18%(61个氨基酸)形成α-螺旋、12.26%(39个氨基酸)形成延伸链及68.55%(218个氨基酸)形成无规则卷曲(图3-B)。KLF6具有典型的锌指(C2H2)结构域,其锌指结构域由3个锌指残基构成,分别定位于235-259,265-289和295-317(图1),三维结构也显示了锌指家族的典型特征(图3-C)。蛋白相互作用分析发现,KLF6蛋白可能和SART1、JUN、ATF3、RAB5A、PA2G4、ST13、CDK2AP1等蛋白存在相互作用(图4)。
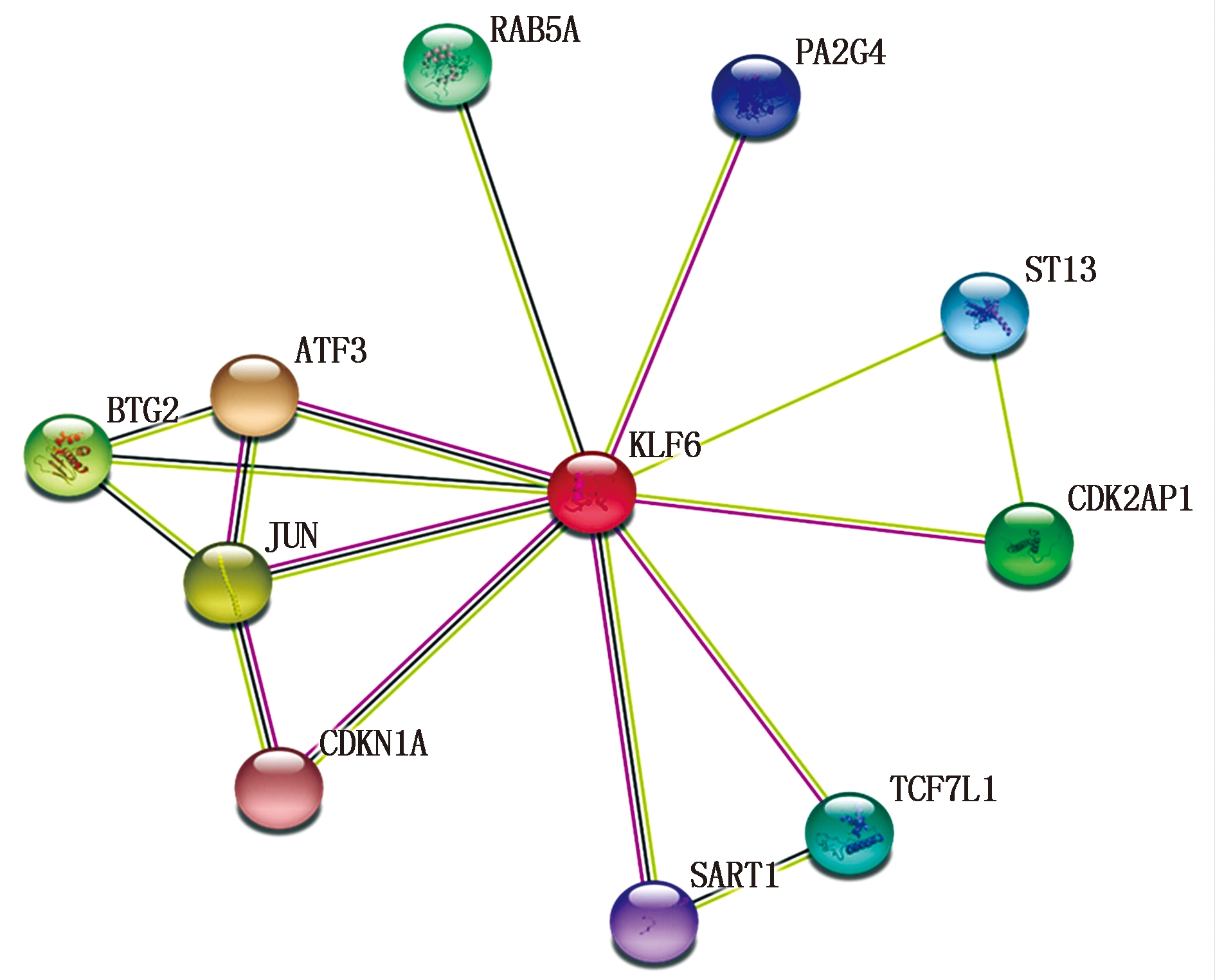
图4 山羊KLF6蛋白与其他蛋白互作网络
Fig.4 The interaction network of
goat KLF6 with other proteins
2.3 山羊KLF6同源比较及进化树构建
利用NCBI在线比对程序Blast,将获得的山羊KLF6核苷酸序列比对发现,山羊KLF6核苷酸序列与绵羊、牛和印度水牛的同源性最高,分别为99.6%,98.5%和98.1%(图5-A)。将获得的山羊KLF6氨基酸序列与其他动物的预测氨基酸序列进行比对,发现与绵羊、牛和印度水牛的氨基酸序列同源性最高,皆达到99.6%以上,而与大鼠、猪、小鼠、野骆驼、马、猕猴、人、鸡的同源性依次是87.4%,86.4%,86.2%,86.1%,85.5%,83.6%,83.3%,77.3%,表明KLF6在哺乳动物中高度保守,同时利用MEGA 7.0软件将各物种的氨基酸序列构建了系统进化树(图5-B)。
2.4 山羊KLF6基因组织表达差异分析
为探讨KLF6基因在山羊组织中的表达情况,本研究利用qPCR技术检测了山羊14个组织中KLF6基因的mRNA表达情况,结果发现(图6),KLF6基因在山羊各组织中广泛表达,并在山羊腹脂中的表达极显著高于其他各个组织(P<0.01),其次是皮脂和肺脏中,而在瘤胃和胰腺中表达最低。
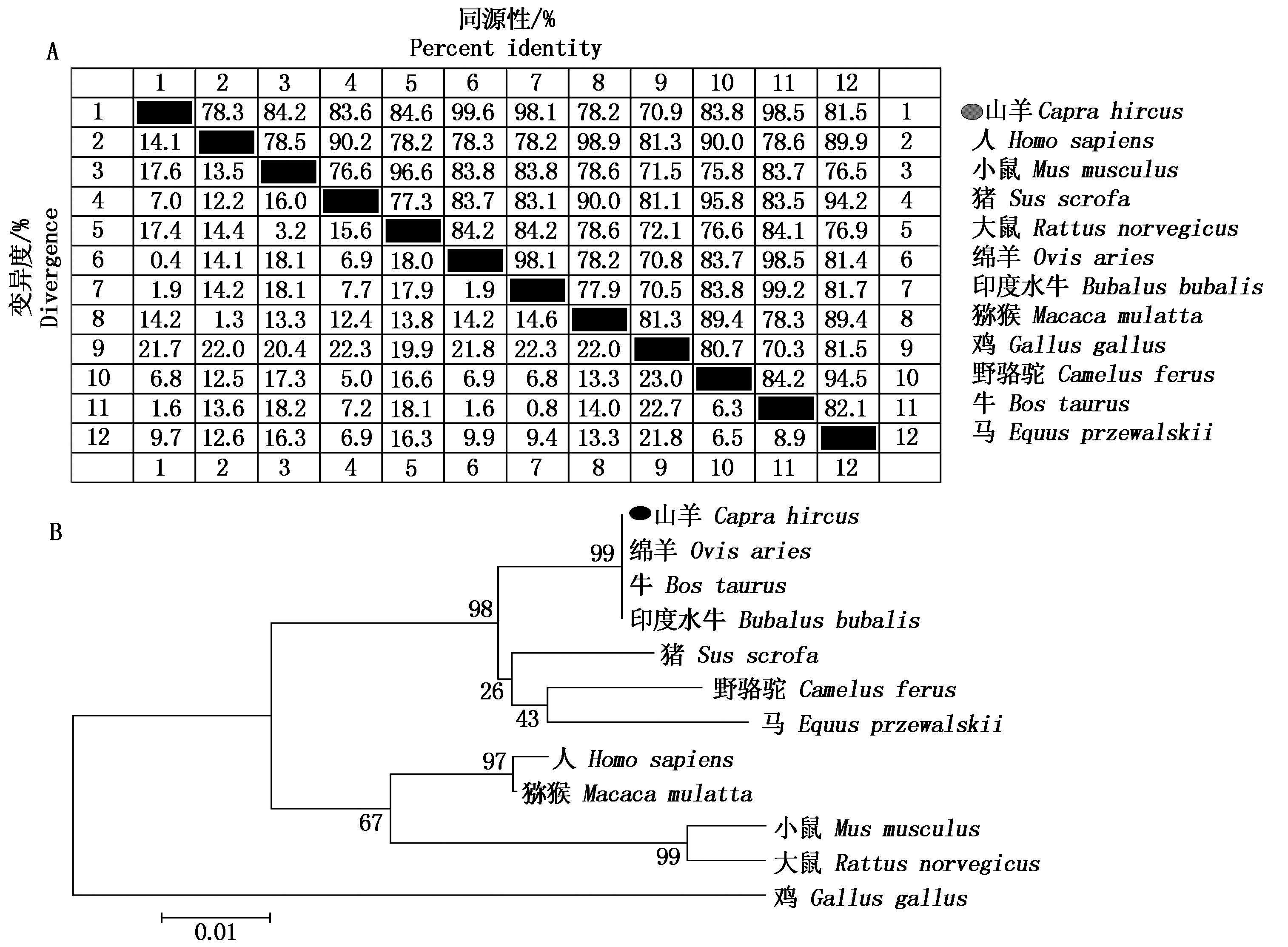
A.山羊KLF6基因与其他物种的同源性比对;B.山羊KLF6氨基酸物种同源进化树;●.目的基因,所引用的序列均来自GenBank数据库。
A. Homology comparison of goat KLF6 gene with other species; B. Homolog evolutionary tree of amino acid species with KLF6;
●.The target gene, the referenced sequences are all from the GenBank database.
图5 山羊KLF6基因同源性比对分析及氨基酸同源进化树构建
Fig 5 Homologous alignment analysis of goat KLF6 gene and construction of amino acid homologous evolutionary tree
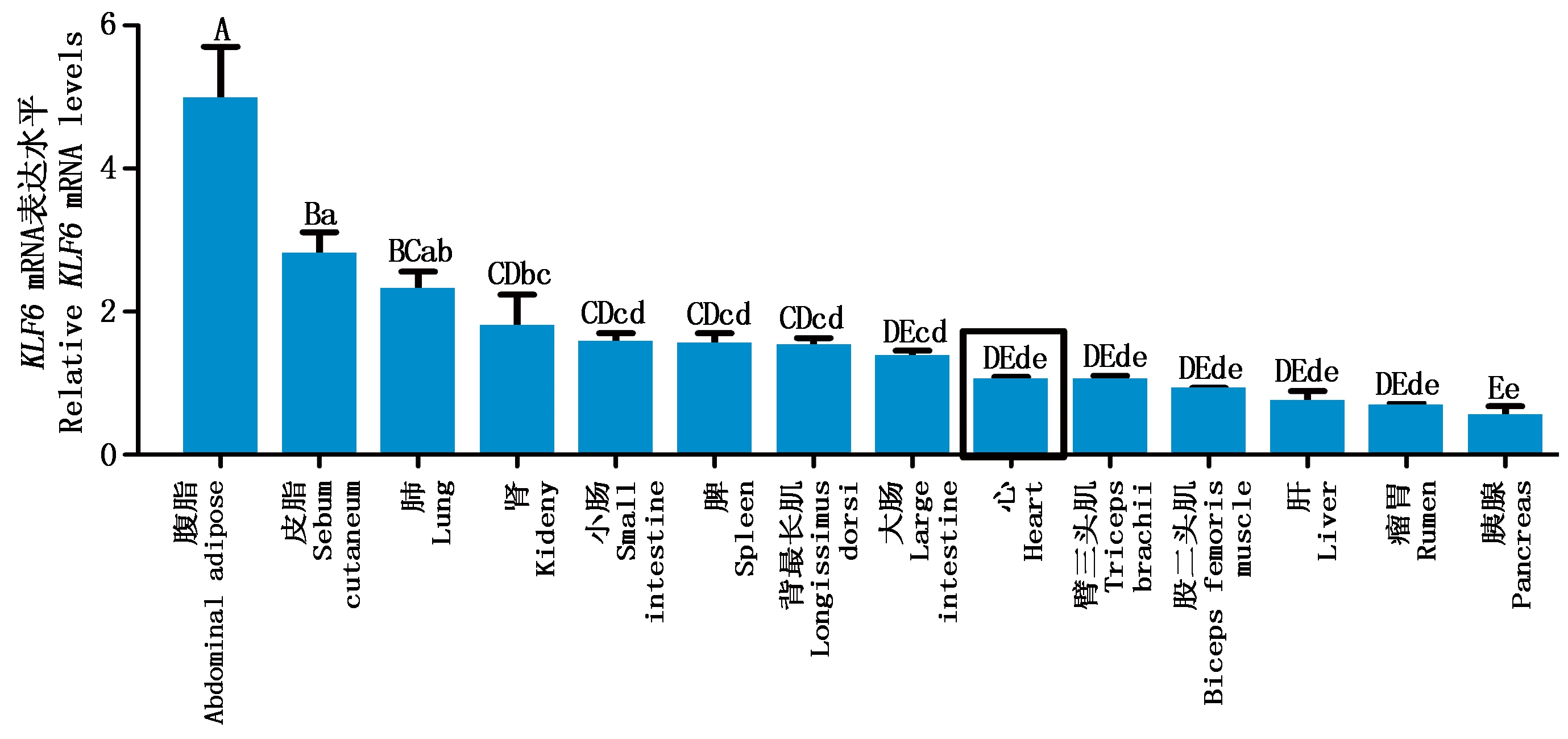
方框标记的为对照。不同大写字母为差异极显著(P<0.01),不同小写字母为差异显著(P<0.05);图7同。
The box marked is control. The difference between the uppercase letters was extremely significant (P<0.01),
and the difference between the lowercase letters was significant (P<0.05); The same as Fig.7.
图6 山羊KLF6基因在不同组织中的相对表达水平
Fig.6 Relative expression levels of goat KLF6 gene in different tissues
2.5 山羊KLF6基因时序表达差异分析
为进一步验证KLF6在脂肪中的调控作用,本研究检测KLF6在山羊皮下脂肪细胞分化不同阶段的mRNA水平,并以0 h的表达为对照,qPCR检测结果显示(图7),在皮下脂肪细胞分化中,KLF6的相对表达量在分化0~24 h变化不显著,在分化24~96 h呈先上升后下降的趋势极显著上升(P<0.01),并在60 h达到峰值。
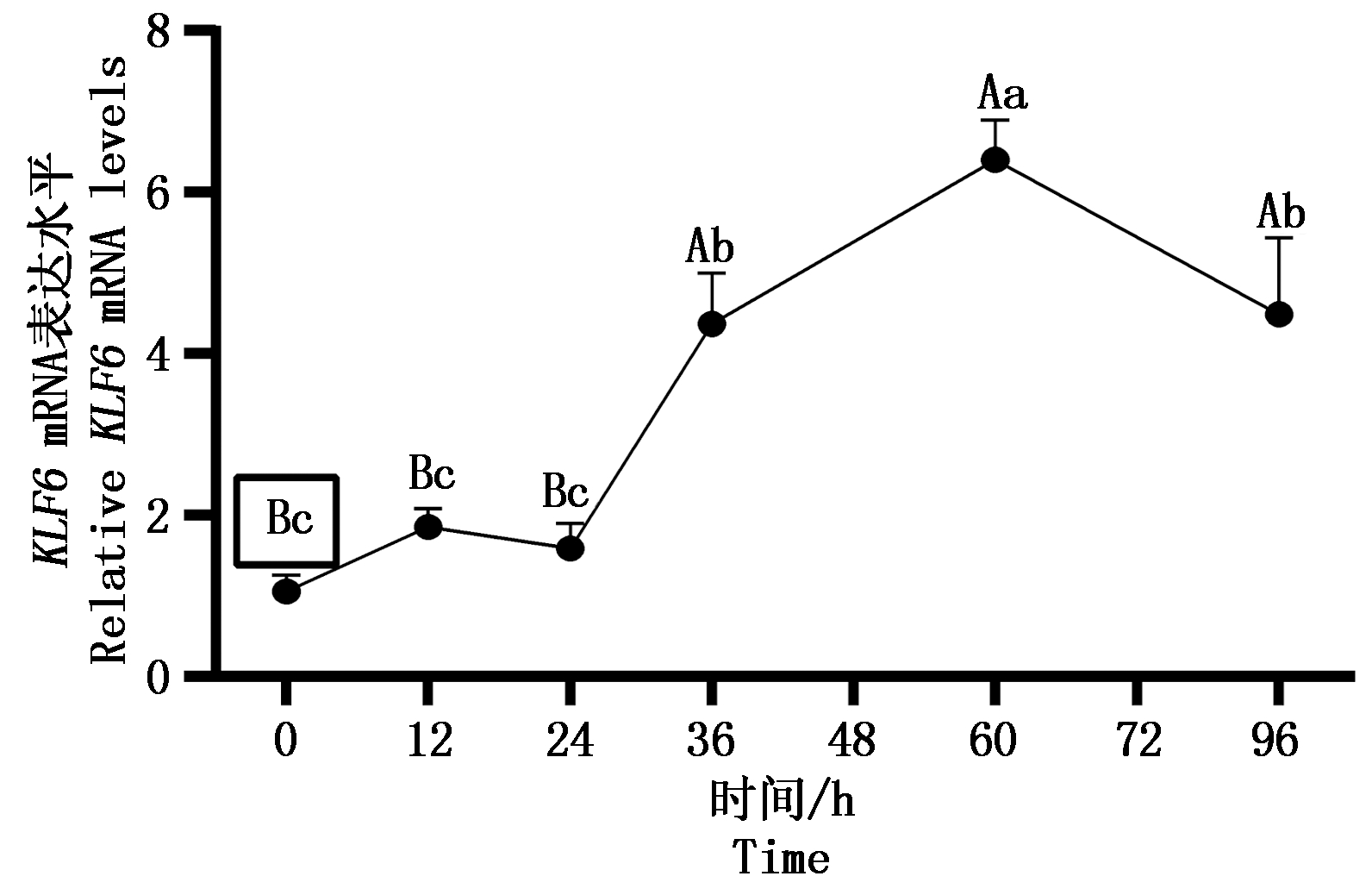
图7 山羊KLF6基因在皮下脂肪细胞中
不同分化阶段的相对表达水平
Fig.7 Relative expression level of KLF6
in subcutaneous adipocytes of goat at different
differentiation stages in adipocytes
3 讨论与结论
KLF6基因作为KLFs中的重要一员,在哺乳动物中KLF6也被确定为调控脂肪分化、脂肪形成和肥胖转录网络的关键组成部分[14],本试验成功克隆获得山羊KLF6基因序列1 233 bp,其中包含CDS区957 bp,编码318个氨基酸,氨基酸序列分析发现其具有多个磷酸位点及糖基化位点,而蛋白质翻译后修饰有磷酸化和糖基化等方式[19],推测这些位点是KLF6蛋白翻译后的关键修饰位点,以保证KLF6蛋白能够发挥正常功能。KLF6蛋白无信号肽剪切点和跨膜结构域,主要在细胞核中发挥生物学作用,这与其调控靶基因转录的发生场所一致。且KLF6蛋白含有3个锌指结构,分别定位在235-259,265-289和295-317位点处,这与KLFs蛋白具有3个高度同源的C-端锌指(C2H2)结构的报道一致[20],有研究表明,这些结构域能够有效地结合DNA分子上富含GC的序列(GC盒或CACCC元件)[21],或者与蛋白质互作发挥转录调节作用[22]。KLF6的核苷酸序列及氨基酸序列与绵羊和牛的亲缘关系最近,其次是猪和大鼠,表明反刍动物KLF6基因的进化来源可能具有同一性,在生物学功能上存在较小的差异。KLF6蛋白相互作用分析预测其可能与ATF3、PA2G4及JUN等蛋白存在相互作用,研究显示KLF6能够直接结合并激活ATF3启动子进而诱导前列腺癌细胞凋亡[23],KLF6还通过ATF4-ATF3-CHOP途径参与细胞增殖和凋亡的调控[24],同时侯巧燕等[25]的研究显示,在抑制癌细胞的增殖过程中KLF6与JUN存在拮抗作用。
本研究进一步明确了KLF6的组织表达规律,结果显示,该基因在山羊组织中广泛表达,并在山羊腹脂中极显著高于其他各个组织,其次是皮脂和肺脏。Chi等[26]在藏鸡中研究发现KLF6在肺脏中高表达,在藏山羊中发现在肺脏、脾脏及脂肪组织中有较高表达[27],朱江江等[28]研究发现,牦牛中KLF6高表达与肺脏和皮下脂肪,这与本研究存在相似及不同之处,该基因在青藏高原物种中的肺组织高表达,推测其可能与高原物种氧浓度适应有关。贾鲁等[29]研究指出,KLF6在大黄鱼的肾、肝组织中高表达,推测该基因的组织表达具有物种差异性。
基于KLF6基因在山羊脂肪组织中高表达的结果,推测其预示着其可能参与脂肪沉积,为了进一步的确定该推测,本研究检测了KLF6在山羊皮下脂肪细胞分化不同阶段的mRNA水平,结果发现山羊KLF6基因在皮下脂肪细胞分化60 h的表达水平极显著高于前体脂肪细胞的表达水平。这与KLF6在3T3-L1前体脂肪细胞分化过程中相似的表达模式[10],根据KLF6在分化前后的山羊皮下脂肪细胞分化中的表达水平及结合在3T3-L1中的研究结果,推测KLF6基因促进山羊脂肪细胞分化。而KLF6对山羊脂肪细胞分化的具体调控作用及调控机制,则需要利用过表达、干扰和信号通路等方法和途径来进一步阐明。
本研究克隆得到山羊KLF6基因序列1 233 bp,其中CDS序列957 bp,编码318个氨基酸残基,具有3个典型锌指。KLF6基因在山羊脂肪组织中高表达。KLF6在分化60 h的山羊皮下脂肪细胞中的表达水平极显著高于前体脂肪细胞中的表达水平。结果将为解析山羊KLF6基因的功能以及其在脂肪细胞分化中的调控作用奠定理论基础。
[1] Stephens J M. The fat controller: adipocyte development[J]. PLoS Biology, 2012, 10(11):e1001436.doi:10.1371/journal.pbio.1001436.
[2] Lee D S, Choi H, Han B S, Kim W K, Lee S C, Oh K J, Bae K H.c-Jun regulates adipocyte differentiation via the KLF15-mediated mode[J]. Biochemical and Biophysical Research Communications, 2016, 469(3):552-558.doi:10.1016/j.bbrc.2015.12.035.
[3] Kaczynski J, Cook T, Urrutia R. Sp1-and Krüppel-like transcription factors[J].Genome Biology, 2003, 4(2):206.doi:10.1186/gb-2003-4-2-206.
[4] Chen Z L, Lei T, Chen X D, Zhang J, Yu A, Long Q J.Long H,Jin D,Gan L,Yang Z Q. Porcine KLF gene family: Structure, mapping, and phylogenetic analysis[J]. Genomics, 2010, 95(2):111-119.doi:10.1016/j.ygeno.2009.11.001.
[5] 熊倩, 张昭军, 方向东. KLFs 对珠蛋白基因表达和红系分化的调控作用[J]. 中国生物化学与分子生物学报, 2011, 27(8):693-699.
Xiong Q, Zhang Z J, Fang X D. Regulation of KLFs on globin expression and erythroid differentiation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2011, 27(8):693-699.
[6] Suske G, Bruford E, Philipsen S. Mammalian SP/KLF transcription factors: Bring in the family[J]. Genomics, 2005, 85(5):551-556.doi:10.1016/j.ygeno.2005.01.005.
[7] Eaton S A, Funnell A P W, Sue N, Nicholas H, Pearson R C M, Crossley M. A network of Krüppel-like factors (Klfs).Klf8 is repressed by Klf3 and activated by klf1 in vivo[J]. Journal of Biological Chemistry, 2008, 283(40):26937-26947.doi:10.1074/jbc.M804831200.
[8] Pei H, Yao Y, Yang Y, Liao K, Wu J R. Krüppel-like factor KLF9 regulates PPARγ transactivation at the middle stage of adipogenesis[J].Cell Death Differ, 2011, 18(2):315-327.doi:10.1038/cdd.2010.100.
[9] Wei S J, Zhang L F, Zhou X, Du M, Jiang Z H, Hausman G J, Bergen W G, Zan L S, Dodson M V. Emerging roles of zinc finger proteins in regulating adipogenesis[J]. Cellular and Molecular Life Sciences CMLS, 2013, 70(23):4569-4584.doi:10.1007/s00018-013-1395-0.
[10] Li D, Yea S, Li S D, Chen Z, Narla G, Banck M, Laborda J, Tan S, Friedman J M, Friedman S L, Walsh M J. Krüppel-like factor-6 promotes preadipocyte differentiation through histone deacetylase 3-dependent repression of DLK1[J]. J Biol Chem, 2005, 280(29):26941-26952.doi:10.1074/jbc.M500463200.
[11] Koritschoner N P, Bocco J L, Panzetta-Dutari G M, Dumur C I, Flury A, Patrito L C. A novel human zinc finger protein that interacts with the core promoter element of a TATA box-less gene[J]. J Biol Chem, 1997, 272(14):9573-9580.doi:10.1074/jbc.272.14.9573.
[12] Takahashi S, Onodera K, Motohashi H, Suwabe N, Hayashi N, Yanai N, Nabesima Y, Yamamoto M. Arrest in primitive erythroid cell development caused by promoter-specific disruption of the GATA-1 gene[J]. The Journal of Biological Chemistry, 1997, 272(19):12611-12615. doi:10.1074/jbc.272.19.12611.
[13] Bechmann L P,Vetter D, Ishida J,Hannivoort R A, Lang U E, Kocabayoglu P, et al. Post-transcriptional activation of PPAR alpha by KLF6 in hepatic steatosis[J].J Hepatol, 2013, 58(5):1000-1006.doi:10.1016/j.jhep.2013.01.020.
[14] Brey C W, Nelder M P, Hailemariam T,Gaugler R, Hashmi S. Krüppel-like family of transcription factors: an emerging new frontier in fat biology[J]. International journal of biological sciences, 2009, 5(6):622-636. doi:10.7150/ijbs.5.622.
[15] 李倩,林亚秋,朱江江,林森,张小玉,王永.山羊FGF21基因克隆及其在肌内脂肪细胞中的表达模式研究[J].畜牧兽医学报,2017,48(1):31-38.doi:10.11843/j.issn.0366-6964.2017.01.004.
Li Q, Lin Y Q, Zhu J J, Lin S, Zhang X Y, Wang Y. Cloning of goat FGF21 gene and its expression pattern in intramuscular adipocyte[J].Acta Veterinaria et Zootechnica Sinica,2017,48(1):31-38.
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4):402-408.doi:10.1006/meth.2001.1262.
[17] 何长晟,王永,许晴,白文林,王江林,朱江江,林亚秋.KLF2对山羊肌内前体脂肪细胞分化的影响[J].畜牧兽医学报,2020,51(1):64-73.doi:10.11843/j.issn.0366-6964.2020.01.008.
He C S, Wang Y, Xu Q, Bai W L, Wang J L,Zhu J J, Lin Y Q.The effect of KLF2 on the differentiation of goat intramuscular preadipocyte[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(1):64-73.
[18] 许晴, 林森, 朱江江, 王永, 林亚秋.山羊肌内前体脂肪细胞诱导分化过程中内参基因的表达稳定性分析[J].畜牧兽医学报, 2018, 49(5):907-918.doi:10.11843/j.issn.0366-6964.2018.05.005.
Xu Q, Lin S, Zhu J J, Wang Y, Lin Y Q. The expression stability analysis of reference genes in the process of goat intramuscular preadipocytes differentiation in goat[J].Acta Veterinaria et Zootechnica Sinica,2018, 49(5):907-918.
[19] Gupta R, Brunak S. Prediction of glycosylation across the human proteome and the correlation to protein function[J]. Pac Symp Biocomput, 2002, 7(3):310-322.doi:10.1142/9789812799623_0029.
[20] Cook T, Gebelein B, Belal M, Mesa K, Urrutia R. Three conserved transcriptional repressor domains are a defining feature of the TIEG subfamily of Sp1-like zinc finger proteins[J].The Journal of Biological Chemistry, 1999, 274(41):29500-29504.doi:10.1074/jbc.274.41.29500.
[21] Pearson R, Fleetwood J, Eaton S, Crossley M, Bao S. Krüppel-like transcription factors:a functional family[J]. The International Journal of Biochemistry & Cell Biology, 2008, 40(10):1996-2001.doi:10.1016/j.biocel.2007.07.018.
[22] Zhang W J, Kadam S, Emerson B M, Bieker J J. Site-specific acetylation by p300 or CREB binding protein regulates erythroid Krüppel-like factor transcriptional activity via its interaction with the SWI-SNF complex[J]. Molecular and Cellular Biology, 2001, 21(7):2413-2422.doi:10.1128/MCB.21.7.2413-2422.2001.
[23] Huang X W, Li X, Guo B. KLF6 induces apoptosis in prostate cancer cells through up-regulation of ATF3[J]. J Biol Chem, 2008, 283(44):29795-29801. doi:10.1074/jbc.m802515200.
[24] Tian F, Zhao J Z, Bu S C, Teng H, Yang J, Zhang X M, Li X R, Dong L J. KLF6 induces apoptosis in human lens epithelial cells through the ATF4-ATF3-CHOP axis[J]. Drug Des Devel Ther, 2020, 14:1041-1055.doi:10.2147/dddt.s218467.
[25] 侯巧燕, 王国华, 黄健,侯菊花. 组织芯片检测舌鳞状细胞癌组织中KLF6、p21及c-Jun的表达[J].中国现代医学杂志, 2010, 20(23):3534-3538. doi:10.3969/j.issn.1005-8982.2010.23.004.
Hou Q Y, Wang G H, Huang J,Hou J H. Determination of expression levels of KLF6, p21 and c-Jun in tongue squamous cell carcinoma by tissue chip and immunohistochemistry[J]China Journal of Modern Medicine, 2010, 20(23):3534-3538.
[26] Chi Y D, Xu Y, Luo F, Lin Y Q,Li Z X. Molecular cloning, expression profiles and associations of KLF6 gene with intramuscular fat in Tibetan chicken[J].Anim Biotechnol, 2020, 31(1):67-75.doi: 10.1080/10495398.2018.1540428.
[27] 池永东, 王永, 朱江江, 林森, 赵越, 林亚秋. 藏山羊KLF6基因克隆及组织表达分析[J]. 基因组学与应用生物学, 2018, 37(8):3282-3286. doi:10.13417/j.gab.037.003282.
Chi Y D, Wang Y, Zhu J J, Lin S, Zhao Y, Lin Y Q. Cloning and tissue expression analysis of KLF6 gene in tibetan goat[J].Genomics and Applied Biology, 2018, 37(8):3282-3286.
[28] 朱江江,林亚秋,左璐璐,王永,柏雪,江明锋. 牦牛KLF5、KLF6、KLF7基因的克隆表达及其与肌内脂肪含量的相关性分析[J].畜牧兽医学报,2017,48(3):416-424. doi:10.11843/j.issn.0366-6964.2017.03.004.
Zhu J J, Lin Y Q, Zuo L L,Bai X, Jiang M F. Molecular cloning, tissue expression of KLF5, KLF6, KLF7 genes, and their correlations with intramuscular fat content in yak[J].Acta Veterinaria et Zootechnica Sinca, 2017,48(3):416-424.
[29] 贾鲁,薛良义,蔡灿,徐镇.大黄鱼KLF6基因分子克隆和特征分析[J].生物学杂志,2012,29(1):5-8 doi:10.3969/j.issn.2095-1736.2012.01.005.
Jia L, Xue L Y, Cai C, Xu Z. Molecular cloning and characterization analysis of Kruppel like factor 6 gene in Larimichthys crocea[J].Journal of Biology, 2012,29(1):5-8.