在传统淹水栽培条件下,80%以上的稻田灌溉水通过地表蒸发及淋失等途径损失,导致水稻水分利用率仅为30%~40% [1]。粤北是广东省重要的水稻生产区,也是华南地区重要的制种基地,但粤北水稻,特别是晚稻经常受到季节性干旱的影响。因此,开展水稻抗旱生理研究,提高植株对水分逆境的适应性,实行节水栽培将是今后粤北水稻生产的重要方向。
局部根系水分胁迫(PRD)是近年发展起来的一种节水灌溉技术[2-4],与全根水分胁迫相比,PRD能够有效恢复供水区根系的吸收功能,激发根系吸收水分和养分的补偿效应[5-6]。氮素形态![]() 和
和![]() 是调控植物生长和水分关系的重要因素。在水分胁迫条件下通过氮素形态的不同配比调控作物生长发育和水分、养分吸收利用的研究近年来受到越来越多学者的关注[1,7-8]。
是调控植物生长和水分关系的重要因素。在水分胁迫条件下通过氮素形态的不同配比调控作物生长发育和水分、养分吸收利用的研究近年来受到越来越多学者的关注[1,7-8]。
研究发现,PRD和氮素的相互作用能够显著改变木质部液流中ABA、K+等的组成和浓度,提高液流pH值,诱导化学信号的产生,促使气孔关闭 [9-11],改善作物的光合生产能力和用水效率[12],促进干物质积累和生长[13-14]。因而有学者认为,在水分胁迫条件下,木质部液流离子组成及浓度变化是所谓的“强离子(K+、Na+)” 差效应, 即由于强离子在细胞膜两端的净迁移, 致使 pH值发生变化,进一步的研究显示,不管是活体植物还是离体的叶片, 其木质部液流pH值和pK的变化动态显著相关, 说明木质部液流pH值受K+浓度的影响[15]。另有研究指出,木质部液流pH值升高也可能归因于有机阴离子的快速输出, 其机制是水分胁迫使木质部液流中Ca2+活性和浓度增强,从而激活了去极化的阴离子通道,致使阴离子浓度下降[16-19]。然而,关于作物的离子胁迫响应信号迄今仍然了解甚少[20]。本研究的切入点是前人对水分胁迫下木质部液流K+、Na+等阳离子浓度变化的研究较多,对磷酸根离子等阴离子的研究较少,而对水分胁迫(特别是局部根系水分胁迫)和氮素结合条件下离子浓度变化的研究更少。本研究针对不同水分胁迫和氮素形态相互作用条件,综合探究水稻木质部液流阴、阳离子含量、植株干物质积累和光合生产能力的变化规律,旨在揭示有利于水稻WUE 提高的木质部液流离子的调控机制。
1 材料和方法
1.1 供试材料及试验设计
供试水稻品种为粤北韶关主栽品种恒丰优华占。试验在广东省土地利用与整治重点实验室韶关学院分室的温室内开展,水稻幼苗采用营养液进行培养。营养液配方参照国际水稻研究所(IRRI)推荐的标准[21],并根据实际环境和作物生长情况进行适当的调整。同时含有铵态氮![]() 和硝态氮
和硝态氮![]() 的混合氮营养液采用硫酸铵与硝酸钙试剂配制。采用5%的聚乙二醇6000(PEG 6000) 模拟水分胁迫,加入量为100 g/L。
的混合氮营养液采用硫酸铵与硝酸钙试剂配制。采用5%的聚乙二醇6000(PEG 6000) 模拟水分胁迫,加入量为100 g/L。
水稻种子先用蒸馏水浸泡8 h,后用30%H2O2溶液浸泡30 min,无菌水冲洗3次,挑选饱满度一致的种子,分散放于铺有湿毛巾的铁盘上,常温培养2 d后挑选露白明显的种子播在珍珠岩∶蛭石∶泥碳=1∶1∶2的基质中,浇透水分,每天观察和记录水稻的生长情况。按照种子的生长发育阶段浇灌不同比例的营养液。初期先用清水浇灌,培养至1叶1心时,开始用1/4剂量的营养液浇灌。水稻生长至2叶期时,进行移苗,并改用1/2剂量的营养液浇灌;3叶期时,用全营养液浇灌;第4叶完全展开后,进行分根和水分胁迫处理。
试验设置非水分胁迫(-PEG)、局部根系水分胁迫(PRD)、全根水分胁迫(+PEG) 3种水分条件及![]() 和
和![]() 在营养液中所占的比例(用
在营养液中所占的比例(用![]() 表示)分别为50/50,100/0,0/100 3种氮素形态配比,共计9个处理,每个处理3次重复。各处理的总氮量相同为40 mg/L。具体处理设置见表1。
表示)分别为50/50,100/0,0/100 3种氮素形态配比,共计9个处理,每个处理3次重复。各处理的总氮量相同为40 mg/L。具体处理设置见表1。
表1 试验处理设置
Tab.1 Treatments of the experiment
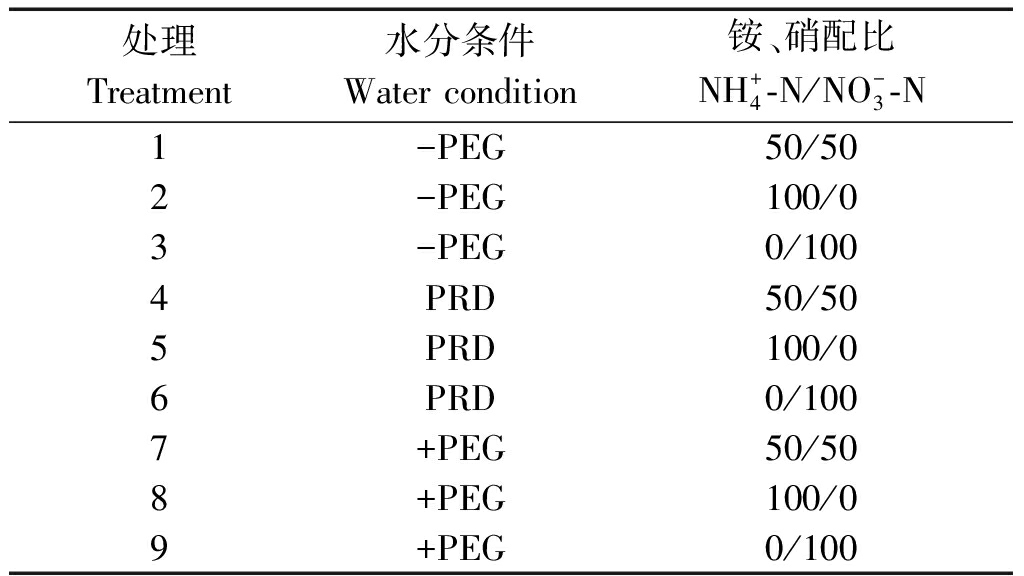
处理Treatment水分条件Water condition铵、硝配比NH+4-N/NO-3-N1-PEG50/502-PEG100/03-PEG0/1004PRD50/505PRD100/06PRD0/1007+PEG50/508+PEG100/09+PEG0/100
试验期间每2 d 更换1次培养液,每天早晚用0.1 mol/L的NaOH溶液将培养液pH值调整到5.5~6.6。分别在水分胁迫处理开始前(处理第1天)8:00和处理第5天18:00取样测定。
1.2 测定项目和方法
1.2.1 植株干、鲜质量 称质量法:采集植株地上部和地下部,称其鲜质量,然后在105~110 ℃杀青0.5 h,再在70~80 ℃烘干,称其干质量。
1.2.2 叶绿素含量 将水稻叶片去除叶脉后剪成小碎片,称取0.05 g放入2 mL离心管中,倒入1.5 mL 80%丙酮浸提液,置于冷冻室4 ℃避光浸泡48 h,期间多次摇动混匀。测量前用高速离心机调至5 000 r/min离心10 min,再取上层浸提液移至光径1 cm的比色皿中,以80%丙酮浸提液为空白对照,用紫外分光光度计分别测定645,663 nm波长下的吸光度值,最后计算叶绿素含量。叶绿素含量的计算公式为:
CT(mg/L)=Ca+Cb=20.2A645+8.02A663
式中:CT为叶绿素含量(总含量),Ca、Cb分别为叶绿素a和叶绿素b的含量,A645和A663分别为在645,663 nm波长下叶绿素溶液的吸光度。
1.2.3 木质部液流收集 在距茎基部2 cm处,用高温消毒的锋利小刀将水稻植株的地上部茎切下,将其顶端20~30 mm部分的皮去掉,以防止被韧皮部汁液污染。然后将切下茎的植株基部放入压力室中,在高于平衡压0.6 MPa的压力下收集木质部液流。将第1滴液流去掉,其余的收集在玻璃试管中,并在-20 ℃下保存。
1.2.4 木质部液流中K+和Ca2+含量 将收集到的木质部液流直接用火焰光度计测定其K+和Ca2+含量。
1.2.5 木质部液流中可溶性P含量 取木质部液流2 mL于20 mL试管中,然后依次加入2 mL钼酸铵溶液、1 mL亚硫酸钠溶液、1 mL对苯二酚溶液,加蒸馏水定容至20 mL,混匀,静置30 min,在波长660 nm处测定其吸光值,并根据测出的吸光值在标准曲线上算得木质部液流的磷含量。
1.3 统计分析
试验数据均采用SPSS 18.0软件进行统计分析,对各处理间的差异进行0.05水平上的显著性检验。
2 结果与分析
2.1 水稻幼苗干质量
从表2可以看出,不同水分条件下,处理5 d后,-PEG植株的干质量最大,其次是PRD植株,+PEG植株最小;在所有处理中,处理1(-PEG+50/50)最大,处理9(+PEG+0/100)最小,两者之间差异显著(P<0.05),前者达到后者的1.6倍。在-PEG条件下,50/50处理最大,0/100处理最小,但50/50与100/0之间差异不显著。在PRD条件下,100/0处理最大,0/100处理最小,50/50处理居中,50/50与100/0之间差异不显著。在+PEG条件下,100/0处理最大,0/100处理最小,后者是前者的88%。
表2 不同水分胁迫和氮素形态对水稻幼苗干质量的影响
Tab.2 Effects of different water stress and N form
on rice seedling dry matter weight g/株
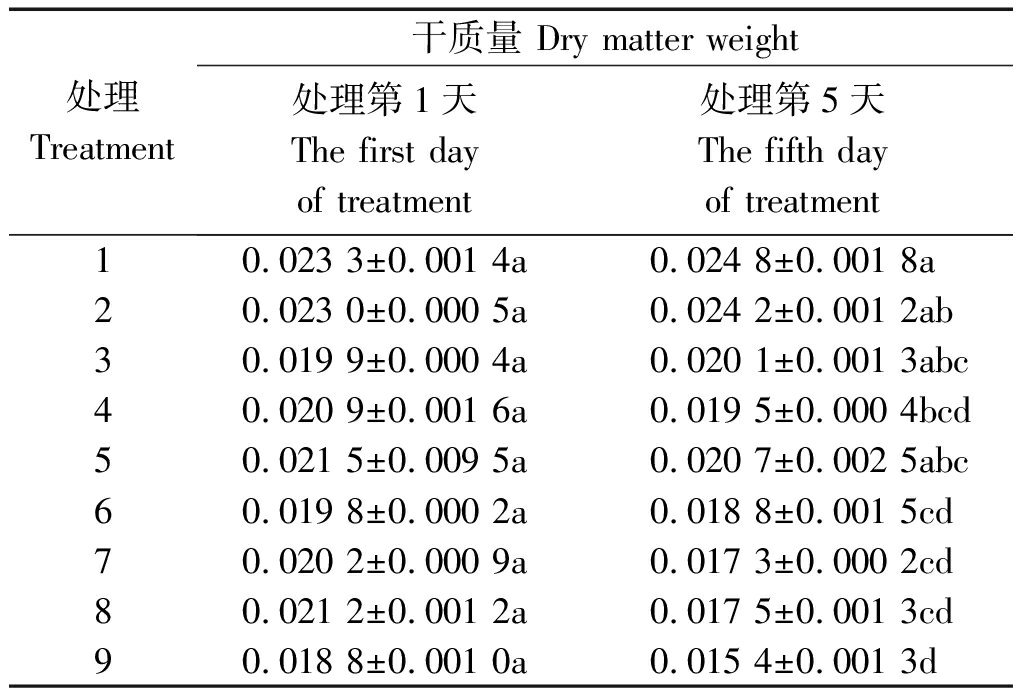
处理Treatment干质量 Dry matter weight处理第1天The first day of treatment处理第5天The fifth day of treatment10.023 3±0.001 4a0.024 8±0.001 8a20.023 0±0.000 5a0.024 2±0.001 2ab30.019 9±0.000 4a0.020 1±0.001 3abc40.020 9±0.001 6a0.019 5±0.000 4bcd50.021 5±0.009 5a0.020 7±0.002 5abc60.019 8±0.000 2a0.018 8±0.001 5cd70.020 2±0.000 9a0.017 3±0.000 2cd80.021 2±0.001 2a0.017 5±0.001 3cd90.018 8±0.001 0a0.015 4±0.001 3d
注:表中不同小写字母代表各处理间差异达0.05显著水平。表3-6同。
Note: Different small letters indicate significant difference among treatments at 0.05 level. The same as Tab.3-6.
对比第1,5天的数据可知,在-PEG条件下,植株干质量上升,其中50/50处理上升最多,为6.29%,0/100处理上升最少,为1.01%。在水分胁迫条件下,植株干物质量均下降,其中+PEG植株显著下降,该条件下0/100处理下降最大,为18.09%,50/50下降最少,为14.36%;PRD植株下降则相对较小,尤其是100/0处理下降最少,仅为3.72%。说明与全根水分胁迫条件相比,局部根系水分胁迫条件可以减缓植株干质量的下降速度,其中以全铵氮素形态处理的减缓作用最显著。
2.2 水稻幼苗叶绿素含量
表3显示,不同水分条件下,处理5 d后,-PEG植株的叶绿素含量最大,其次是PRD植株,+PEG植株最小;在所有处理中,处理2最大,处理9最小,两者之间差异显著(P<0.05),前者达到后者的2.9倍。在-PEG条件下,100/0处理最大,0/100处理最小,两者差异显著,但50/50处理与100/0处理之间差异不显著。在PRD条件下,100/0处理最大,0/100处理最小,前者是后者的1.66倍,差异显著,50/50比100/0略小,但两者之间差异不显著,前者达到后者的92.4%。在+PEG条件下,100/0处理最大,0/100处理最小,两者之间差异扩大,前者是后者的2.42倍,50/50处理与100/0处理差异不显著,前者可达后者的82.7%。
对比处理第1,5天,在-PEG条件下,各处理叶绿素含量分别增加48.1%,60.3%,52.3%;在PRD条件下,50/50和100/0处理分别增加47.9%,56.2%,但0/100处理增加不显著仅0.4%;在+PEG条件下,50/50和100/0处理分别增加29.6%,42.7%,0/100处理则下降了19.0%。由此可见,氮素形态对叶绿素含量的影响较大,其中全铵处理最有利于叶绿素含量的增加,其次是铵、硝配比为50/50处理,全硝处理则不利于叶绿素的合成,特别是在水分胁迫条件下。
表3 不同水分胁迫和氮素形态对
水稻幼苗叶绿素含量的影响
Tab.3 Effects of different water stresses and
N forms on rice seedling chlorophyll content mg/L
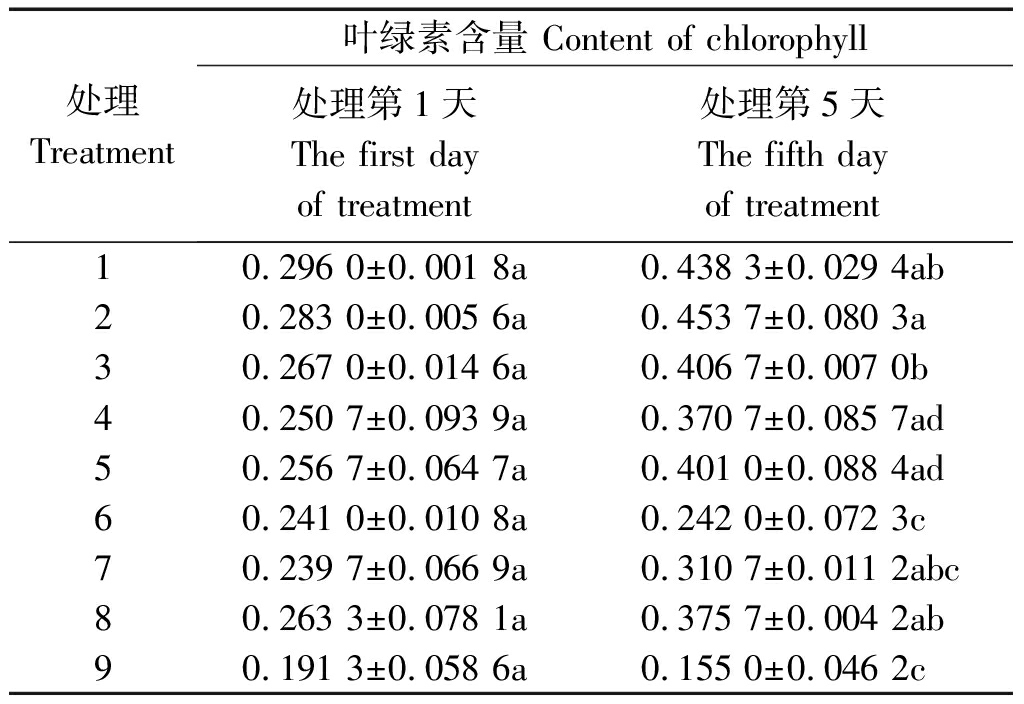
处理Treatment叶绿素含量 Content of chlorophyll处理第1天The first day of treatment处理第5天The fifth day of treatment10.296 0±0.001 8a0.438 3±0.029 4ab20.283 0±0.005 6a0.453 7±0.080 3a30.267 0±0.014 6a0.406 7±0.007 0b40.250 7±0.093 9a0.370 7±0.085 7ad50.256 7±0.064 7a0.401 0±0.088 4ad60.241 0±0.010 8a0.242 0±0.072 3c70.239 7±0.066 9a0.310 7±0.011 2abc80.263 3±0.078 1a0.375 7±0.004 2ab90.191 3±0.058 6a0.155 0±0.046 2c
2.3 水稻幼苗木质部液流离子含量
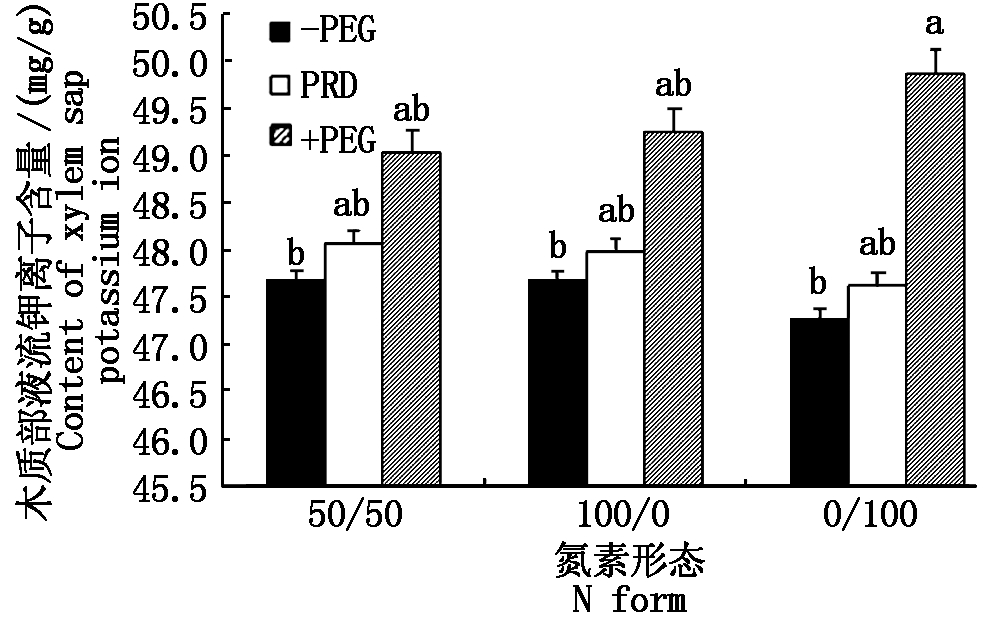
2.3.1 钾离子含量 从表4可以看出,处理5 d后,各处理木质部液流中钾离子含量均增加,其中处理9最大,处理3(-PEG+0/100)最小,两者之间差异显著(P<0.05),前者比后者提高5.48%。在不同水分条件下,-PEG植株增加幅度较小,+PEG和PRD植株增加较多,表现出水分胁迫越重,增加越多的现象。具体来看,与处理第1天相比处理1、处理2、处理3分别增加2.59%,2.65%,1.84%;处理4、处理5、处理6分别增加3.28%,3.79%,2.67%;处理7、处理8、处理9分别增加5.85%,6.35%,6.52%。
表4 不同水分胁迫和氮素形态对水稻幼苗
木质部液流钾离子含量的影响
Tab.4 Effects of different water stress and N form
on content of rice seedling xylem sap K+ mg/g
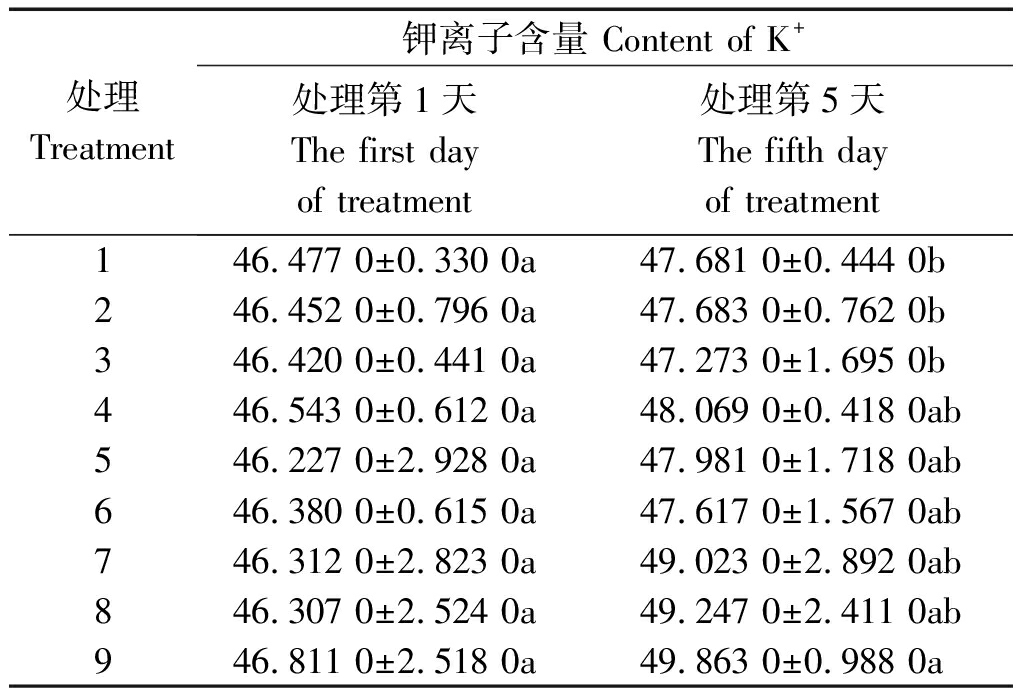
处理Treatment钾离子含量 Content of K+处理第1天The first day of treatment处理第5天The fifth day of treatment146.477 0±0.330 0a47.681 0±0.444 0b246.452 0±0.796 0a47.683 0±0.762 0b346.420 0±0.441 0a47.273 0±1.695 0b446.543 0±0.612 0a48.069 0±0.418 0ab546.227 0±2.928 0a47.981 0±1.718 0ab646.380 0±0.615 0a47.617 0±1.567 0ab746.312 0±2.823 0a49.023 0±2.892 0ab846.307 0±2.524 0a49.247 0±2.411 0ab946.811 0±2.518 0a49.863 0±0.988 0a
在相同氮素形态营养条件下,+PEG植株均为最大,-PEG植株最小。处理5 d后,同为50/50氮素形态营养条件的植株,+PEG比-PEG提高2.81%;同为100/0氮素形态营养条件的植株,+PEG比-PEG提高3.28%;同为0/100氮素形态营养条件的植株,+PEG比-PEG提高5.48%(图1)。上
不同小写字母代表各处理间差异达0.05显著水平。图2-3同。
Different small letters indicate significant difference among
treatments at 0.05 level. The same as Fig.2-3.
图1 相同氮素形态营养条件下不同水分胁迫对
水稻木质部液流钾离子含量的影响
Fig.1 Effects of different water stress on content
of rice xylem sap K+ under the same N form
述现象提示,全根水分胁迫条件对木质部液流中钾离子含量有促进作用,其中0/100处理的促进作用显著,其他处理的促进作用不显著,局部根系水分胁迫条件的促进作用不显著。在相同水分条件下,氮素形态对木质部液流中钾离子含量的影响亦不显著。
2.3.2 钙离子含量 从表5可以看出,处理5 d后,各处理木质部液流中钙离子含量均增加,但与钾离子浓度的变化趋势稍有不同:PRD植株增加最多,其次是+PEG植株,处理1~3分别增加10.63%,9.84%,10.10%;处理4~6分别增加18.41%,16.02%,18.38%;处理7~9分别增加13.92%,12.2%,12.13%。
表5 不同水分胁迫和氮素形态对水稻幼苗
木质部液流钙离子含量的影响
Tab.5 Effects of different water stress and N form on
content of rice seedling xylem sap Ca2+ mg/g
处理Treatment钙离子含量 Content of Ca2+处理第1天The first day of treatment处理第5天The fifth day of treatment16.68±0.199 0a7.39±0.156 0c26.71±0.383 0a7.37±0.376 0c36.73±0.344 0a7.41±0.432 0c46.68±0.279 0a7.91±0.322 0a56.74±0.128 0a7.82±0.366 0ab66.58±0.320 0a7.79±0.187 0b76.75±0.290 0a7.69±0.406 0bc86.72±0.463 0a7.54±0.308 0bc96.68±0.118 0a7.49±0.293 0bc
在相同氮素形态营养条件下,PRD处理植株的钙离子含量均为最大,-PEG处理植株的最小,处理4、处理5和处理6分别比处理1、处理2和处理3增加7.04%,6.11%,5.13%,差异显著;处理7、处理8和处理9分别比处理1、处理2和处理3增加4.01%,2.31%,1.08%,差异不显著(图2)。
由此说明,局部根系水分胁迫条件可以显著提高木质部液流中钙离子的含量,其中铵、硝配比为50/50的氮素形态处理的促进作用最大。
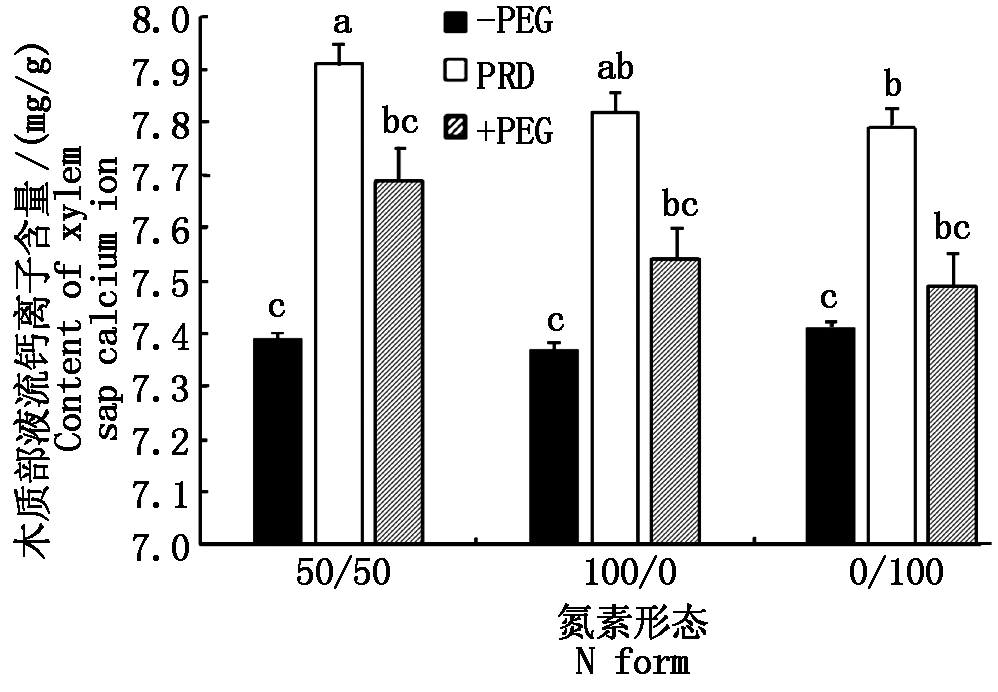
图2 相同氮素营养条件下不同水分胁迫
对水稻木质部液流钙离子含量的影响
Fig.2 Effects of different water stress on content of
rice xylem sap Ca+ under the same N form
2.3.3 水溶性磷含量 从表6可以看出,处理5 d后,各处理木质部液流中水溶性磷含量均降低,但-PEG植株各处理下降1.98%,2.40%,2.72%,下降不显著;PRD植株各处理分别下降5.63%,7.61%,9.45%;+PEG植株各处理分别下降12.15%,15.29%,16.37%,即水分胁迫处理(PRD+PEG)下降显著,水分胁迫愈强(+PEG),降低愈多。处理1~3分别降低到处理前(处理第1天)的98.02%,97.6%,97.28%;处理4~6分别降低到94.37%,92.39%,90.55%;处理7~9分别降低到87.85%,84.71%,83.63%,平均下降了14.6%。在相同水分条件下,50/50处理均为最大,0/100处理均为最小。
表6 不同水分胁迫和氮素形态对水稻幼苗
木质部液流水溶性磷含量的影响
Tab.6 Effects of different water stress and N form on
content of rice seedling xylem sap water-soluble phosphorus mg/g
处理Treatment水溶性磷含量Content of water-soluble phosphorus处理第1天The first day of treatment处理第5天The fifth day of treatment18.33±0.058 0a8.165±0.283 0a28.29±0.241 0a8.091±0.319 0a38.31±0.261 0a8.084±0.294 0a48.23±0.036 0a7.767±0.127 0ab58.27±0.127 0a7.641±0.156 0ab68.31±0.083 0a7.525±0.119 0abc78.11±0.295 0a7.125±0.254 0bcd88.06±0.295 0a6.828±0.218 0cd97.99±0.091 0a6.682±0.232 0d
在相同氮素形态营养条件下,-PEG植株均为最大,+PEG植株均为最小,PRD植株居中。与-PEG条件各处理相比,PRD条件处理(处理4、处理5和处理6)分别降低为-PEG条件处理的95.13%,94.44%,93.09%;+PEG条件处理(处理
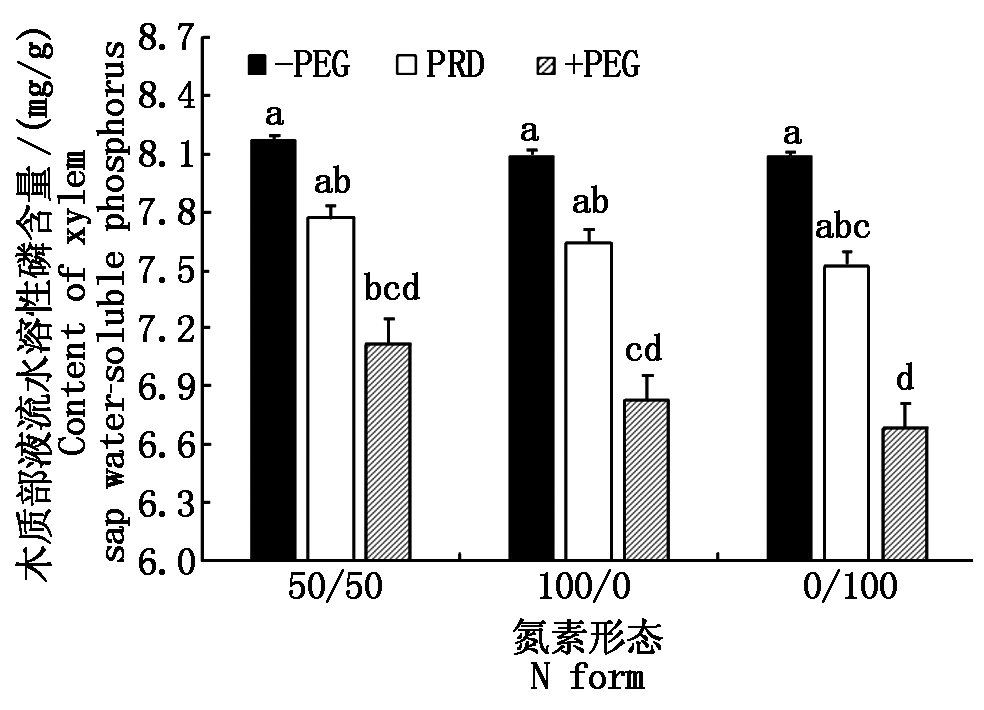
图3 相同氮素营养条件下不同水分胁迫对
水稻木质部液流水溶性磷含量的影响
Fig.3 Effects of different water stress on content of rice
xylem sap water-soluble phosphorus under the same N form
7、处理8和处理9)分别降低为-PEG条件处理的87.26%,84.39%,82.66%,平均下降了14.6%,其中2种水分胁迫条件下,均以50/50处理的降幅最小, 0/100处理的降幅最大(图3)。上述分析表明,全根水分胁迫和局部根系水分胁迫显著降低了木质部液流中水溶性磷的含量。与此同时,在水分胁迫条件下,铵、硝配比为50/50的氮素形态处理可以减缓木质部液流中水溶性磷含量的下降。
3 讨论与结论
3.1 不同水分胁迫和氮素形态对水稻幼苗干质量和叶绿素含量的影响
干物质积累是细胞光合作用和延伸生长的结果,是反映作物生长状况的重要指标。叶绿素是植物进行光合作用的重要物质,叶绿素含量多少可以反映植物光合作用的强弱,决定干物质积累能力。在作物对水分胁迫的生理反应过程中,细胞延伸生长对水分胁迫最敏感,当根系水分条件变差时, 叶片的光合速率下降,延伸速率减慢,干物质积累降低,干质量减少。
氮素营养和水分条件是限制水稻生长的重要因子,合理施用氮素营养不仅能够提高水稻的水分利用效率[22],而且也能促进光合速率,增加干质量。杨秀霞等[23-24]发现,在水分胁迫条件下,铵态氮处理水稻生物量显著高于供硝态氮处理。与非水分胁迫条件相比,水分胁迫条件下供铵态氮处理水稻叶绿素含量没有显著变化,但供硝态氮处理水稻的叶绿素含量显著减少,净光合速率和干质量显著下降。高翠民[25]的研究证实,局部模拟干旱条件下单供铵态氮营养水稻叶片净光合速率和地上部生物量均显著高于单供硝态氮营养水稻。本研究与上述结果基本一致,但略有不同。本研究表明,水分胁迫(PRD+PEG)降低水稻幼苗干质量和叶绿素含量,无论是供铵态氮处理,还是铵、硝营养混合处理和供硝态氮处理,其植株干质量和叶绿素含量均小于非水分胁迫处理。在2种水分胁迫条件下,水稻干质量和叶绿素含量均为100/0处理最大、50/50处理次之、0/100处理的最小,其中100/0处理与0/100处理之间的叶绿素含量差异显著、干质量差异不显著。在非水平胁迫条件下,水稻干质量以50/50处理最大、0/100处理最小,两者之间差异不显著;叶绿素含量以100/0处理最大、0/100处理的最小,两者之间差异显著。由此可见,在同一水分条件下,各处理的叶绿素含量均随铵态氮配比的增加而增加,说明相对于硝态氮,铵态氮更有利于叶绿素的合成。
对比处理前和处理第5天,在PRD条件下,50/50处理和100/0处理的SPAD值分别增加47.9%和56.2%,但0/100处理增加不显著,仅为0.4%;而在+PEG条件下,50/50处理和100/0处理分别增加29.6%和42.7%,0/100处理则下降了19%;同时,在PRD条件下,植株干质量则下降则相对较小,其中100/0处理下降最少,仅为3.72%;而在+PEG条件下,植株干质量则显著下降,其中0/100下降最大,达到18.09%。说明相较于全根水分胁迫条件,局部根系水分胁迫下供应铵态氮可以促进植株的补偿效应,缓解水分胁迫的影响,促进叶绿素合成和干物质积累。
3.2 不同水分胁迫和氮素形态对水稻幼苗木质部液流离子含量的影响
木质部液流中含有包括无机离子等在内的各种成分[26]。已有的研究结果表明,土壤干旱能使木质部液流中pH值升高,但pH值升高的原因至今仍不十分清楚。有研究认为,木质部液流成分受其周围与导管密切相关的薄壁细胞膜上的质子泵(H+-ATPase)控制,干旱会降低ATP 水平, 并导致 H+-ATPase迅速失活,木质部液流的pH值即增加[9]。近年的研究发现, 干旱胁迫能够改变木质部液流的离子组成和含量, 进而影响其pH值[27]。本试验结果似乎验证了上述观点:水分胁迫增加水稻幼苗木质部液流中的钾离子含量,水分条件越差,钾离子含量越高,这与Feng等[17]在大麦、大豆和玉米上的研究结果基本一致,他们均发现,与正常供应水分相比,干旱胁迫显著增加植株木质部液流中的钾离子浓度,且随胁迫时间延长,钾离子浓度增加越多,交替胁迫下钾离子浓度的增加更加明显。但本研究同时也显示,水分胁迫方式对钾离子含量亦有影响,PRD条件的植株钾离子含量小于+PEG条件植株,但氮素形态的影响似乎并不显著。因此,木质部液流中维持适当的钾离子可能是植物适应干旱胁迫的重要反应,钾离子可能是一个作物干旱胁迫响应的关键的化学信号,干旱胁迫下木质部中维持高的钾离子可能有利于叶肉细胞中钾离子的保持[28]。
Ca2+是植物的逆境胁迫信号分子,研究发现,当植物遭遇胁迫环境时,细胞中Ca2+浓度增加,因而Ca2+对于缓解干旱胁迫对植物的伤害具有显著的作用[29-30]。本研究显示,虽然3种水分条件下各处理的木质部液流Ca2+含量均增加,但水分胁迫条件下的处理增加更多,其中PRD条件植株增加最多。在相同水分胁迫条件下,以铵、硝配比为50/50处理的Ca2+含量最大。据此可以推测,在局部根系水分胁迫条件下,通过铵、硝营养的适度配比,作物可以通过Ca2+-ATPase 和 Ca2+/H+ 交换形成有效的Ca运输系统,促使 Ca2+ 从细胞内释放到胞外的木质部和质外体中,增加木质部液流和叶片质外体中Ca2+含量,从而使细胞质内Ca2+浓度保持在一个稳定的、非常低的水平,以适应干旱环境[16]。另一方面,有研究认为木质部液流中Ca2+升高会抑制H+-ATPase 活性,激活阴离子通道[31],本试验中水分胁迫条件处理的木质部液流水溶性磷含量均降低(其中全根水分胁迫条件降低显著,局部根系水分胁迫条件降低不显著)证实了这一点,其中0/100处理的降幅最大,说明铵、硝营养显著影响阴离子的吸收和转运。
在本研究中,处理5 d后,+PEG条件各处理的木质部液流K+含量均大于PRD处理,而其Ca2+含量则小于PRD处理。说明相较于局部根系水分胁迫,全根水分胁迫更容易导致植株细胞向胞外释放K+,或者减少细胞对K+的吸收,增加对Ca2+的吸收,从而影响了水分胁迫信号的转导。
[1] 杨秀霞,燕辉,周春火,郭世伟.水分胁迫下氮形态对水稻根系孔隙度及水分吸收的影响[J].干旱地区农业研究, 2019, 37(2):144-149.doi: 10.7606/j.issn.1000-7601.2019.02.21.
Yang X X,Yan H, Zhou C H,Guo S W.Effects of nitrogen forms on root porosity and water absorption of rice under drought stress[J].Agricultural Research in the Arid Areas, 2019, 37(2):144-149.
[2] Adu M O, Yawson D O, Armah F A, Asare P A, Frimpong K A. Meta-analysis of crop yields of full, deficit, and partial root-zone drying irrigation[J].Agricultural Water Management,2018,197:79-90.doi:10.1016/j.agwat.2017.11.019.
[3] Mehrabi F,Sepaskhah A R. Partialroot zone drying irrigation, planting methods and nitrogen fertilization influence on physiologic and agronomic parameters of winter wheat[J].Agricultural Water Management,2019,223:105688. doi:10.1016/j.agwat.2019.105688.
[4] Gila P M, Lobos P, Durán K, Olguín J, Cea D, Schaffer B. Partial root-zone drying irrigation, shading, or mulching effects on water savings, productivity and quality ofSyrah grapevines[J].Scientia Horticulturae, 2018,240:478-483.doi:10.1016/j.scienta.2018.06.050.
[5] 牛晓丽,胡田田,张富仓,王丽,刘杰,冯璞玉,杨硕欢,宋雪. 局部恢复水氮供应对玉米根系氮素吸收与分配的影响[J]. 中国农业科学,2016,49(14):2737-2750.doi: 10.3864/j.issn.0578-1752.2016.14.008.
Niu X L, Hu T T, Zhang F C, Wang L, Liu J, Feng P Y, Yang S H, Song X.Effects of partial water and nitrogen resupplies on maize root nitrogen absorbing capacity and distribution[J]. Scientia Agricultura Sinica, 2016, 49(14):2737-2750.
[6] Wang C H, Shu L Z, Zhou S L, Yu H M, Zhu P F. Effects of alternate partial root-zone irrigation on the utilization and movement of nitrates in soil by tomato plants[J]. Scientia Horticulturae, 2019,243:41-47.doi:10.1016/j.scienta.2018.08.006.
[7] 陈晨,龚海青,金梦灿,郜红建.不同供氮形态下水稻苗期磷吸收累积与根系形态的关系[J].中国水稻科学, 2019, 33(2):167-175.doi: 10.16819/j.1001-7216.2019.8059.
Chen C, Gong H Q, Jin M C, Gao H J. Correlation between root morphology and accumulation of phosphorus in rice seedlings under different N forms[J]. Chinese Journal Rice Science, 2019, 33(2):167-175.
[8] Zheng E N,Yang H,Zhang Z X.Influence of different nitrogen forms application on rice photosynthesis: fluorescence with water-saving irrigation in black soil region of Songnen Plain, Northeast China[J].Paddy and Water Environment, 2018, 16(4):795-804.doi:10.1007/s10333-018-0670-y.
[9] Li W R, Jia L G, Wang L. Chemical signals and their regulations on the plant growth and water use efficiency of cotton seedlings under partial root-zone drying and different nitrogen applications[J]. Saudi Journal of Biological Sciences,2017,24(3):477-487. doi:10.1016/j.sjbs.2017.01.015.
[10] Wang M, Zheng Q S, Shen Q R, Guo S W. The critical role of potassium in plant stress response[J]. International Journal of Molecular Sciences, 2013,14(4): 7370-7390. doi:10.3390/ijms14047370.
[11] Wu Y, Liu X F, Wang W F, Zhang S Q, Xu B C. Calcium regulates the cell-to-cell water flow pathway in maize roots during variable water conditions[J].Plant Physiology and Biochemistry, 2012, 58:212-219. doi:10.1016/j.plaphy.2012.07.005.
[12] Wei Z H, Du T S, Zhang J, Xu S J, Cambre P J, Davies W J. Carbon isotope discrimination shows a higher water use efficiency under alternate partial root-zone irrigation of field-grown tomato[J]. Agricultural Water Management, 2016,165:33-43. doi:10.1016/j.agwat.2015.11.009.
[13] Nouna B, Rezig M, Bahrouni H, Ammar H. Effect of partial root-zone drying irrigation technique (PRD) on the total dry matter, yield and water use efficiency of potato under Tunisian semi-arid conditions[J]. Journal of Agricultural Science, 2016, 8 (7):129-141.doi:10.5539/jas.v8n7p129.
[14] Adu M O, Yawson D O, Armah F A, Asare P A, Frimpong K A. Meta-analysis of crop yields of full, deficit, and partial root-zone drying irrigation[J]. Agricultural Water Management, 2018,197:79-90. doi:10.1016/j.agwat.2017.11.019.
[15] Felle H H, Herrmann A,Hückelhoven R, Kogel K H. Root-to-shoot signalling: apoplastic alkalinization, a general stress response and defence factor in barley (Hordeum vulgare)[J]. Protoplasma, 2005,227(1):17-24. doi:10.1007/s00709-005-0131-5.
[16] Aasamaa K, Sõber A.Sensitivity of stem and petiole hydraulic conductance of deciduous trees to xylem sap ion concentration[J]. Biologia Plantarum, 2010,54(2):299-307.doi:10.1007/s10535-010-0052-9.
[17] Feng X, Liu W X, Zeng F R, Chen Z H, Zhang G P, Wu F B.K+ Uptake, H+-ATPase pumping activity and Ca2+ efflux mechanism are involved in drought tolerance of barley[J].Environmental and Experimental Botany, 2016,129:57-66.doi:10.1016/j.envexpbot.2015.11.006.
[18] Batool A, Akram N A,Cheng Z G, Lü G C, Ashraf M, Afzal M, Xiong J L, Wang J Y, Xiong Y C. Physiological and biochemical responses of two spring wheat genotypes to non-hydraulic root-to-shoot signalling of partial and full root-zone drought stress[J]. Plant Physiology and Biochemistry, 2019, 139:11-20.doi:10.1016/j.plaphy.2019.03.001.
[19] Batool A, Akram N A, Lü G C, Xiong J L, Tian T, Wang J Y, Cheng Z G, Yi Y, Wen J, Xiong Y C. Root-to-shoot communication and its signal cross talk in plants: a physiological and agronomic perspective[J].Pakistan Journal of Botany, 2018, 50(5):2059-2067.
[20] Howladar S M. Potassium humate improves physio-biochemical attributes, defense systems activities and water-use efficiencies of eggplant under partial root-zone drying[J].Scientia Horticulturae, 2018,240:179-185.doi:10.1016/j.scienta.2018.06.020.
[21] 毛达如.植物营养研究方法[M].北京:北京农业大学出版社,1994.
Mao D R.Research methods of plant nutrition[M].Beijing: Beijing Agricultural University Press,1994.
[22] 周毅,郭世伟,宋娜, 张崇林,李想,沈其荣.供氮形态和水分胁迫对苗期-分蘖期水稻光合与水分利用效率的影响[J].植物营养与肥料学报, 2006, 12(3):334-339,345.doi:10.3321/j.issn:1008-505X.2006.03.008.
Zhou Y, Guo S W, Song N, Zhang C L, Li X, Shen Q R.Effects of nitrogen forms and water stress on photosynthesis and water use efficiency of rice at seedling-tillering stage[J].Plant Nutrition and Fertilizer Science, 2006, 12(3):334-339.
[23] 杨秀霞,燕辉,王小慧,商庆银,郭世伟. 氮素形态及水分胁迫对不同水稻品种苗期生长的影响[J]. 中国农村水利水电,2018(7):39-43.doi:10.3969/j.issn.1007-2284.2018.07.009.
Yang X X, Yan H,Wang X H,Shang Q Y,Guo S W. The effects of nitrogen forms and water stress on the growth of seeding stage among different rice cultivars[J].China Rural Water and Hydropower, 2018(7):39-43.
[24] 杨秀霞,燕辉,商庆银,周春火,郭世伟.氮素形态及水分胁迫对水稻根系水分吸收的影响机制[J]. 湖北农业科学,2018, 57(21):51-56,59.doi:10.14088/j.cnki.issn0439-8114.2018.21.012.
Yang X X, Yan H, Shang Q Y, Zhou C H,Guo S W.Effects of nitrogen forms and water stress on the water absorption of root systems among the different rice cultivars[J].Hubei Agricultural Sciences, 2018, 57(21):51-56,59.
[25] 高翠民.氮素形态影响水稻幼苗抗旱特性及根系通气组织形成机理的研究[D].南京:南京农业大学,2015:1-113.
Gao C M. Effect of nitrogen forms on drought-resistance and mechanism of root aerenchyma formation of rice seedlings[D]. Nanjing:Nanjing Agricultural University, 2015:1-113.
[26] Zheng T, Haider M S, Zhang K K, Jia H F, Fang J G. Biological and functional properties of xylem sap extracted from grapevine (cv. Rosario Bianco)[J]. Scientia Horticulturae, 2020, 272: 109563.doi:10.1016/j.scienta.2020.109563.
[27] Geilfus C M.The pH of the apoplast: Dynamic factor with functional impact under stress[J]. Molecular Plant,2017,10(11):1371-1386.doi:10.1016/j.molp.2017.09.018.
[28] Feng X, Liu W X, Qiu C W, Zeng F R, Wang Y Z, Zhang G P, Chen Z H, Wu F B.HvAKT2 and HvHAK1 confer drought tolerance in barley through enhanced leaf mesophyll H+ homoeostasis[J].Plant Biotechnology Journal,2020,18(8):1683-1696. doi:10.1111/pbi.13332.
[29] Yang L, Yao J, Sun J G, Shi L Q, Chen Y K, Sun J S.The Ca2+ signaling, Glu, and GABA responds to Cd stress in duckweed[J]. Aquatic Toxicology, 2020, 218:105352.doi:10.1016/j.aquatox.2019.105352.
[30] Jiang Z H, Zhou X P, Tao M, Yuan F, Liu L L, Wu F H, et al.Plant cell-surface GIPC sphingolipids sense salt totrigger Ca2+ influx[J]. Nature, 2019,572 (7769):341-346. doi:10.1038/s41586-019-1449-z.
[31] Chen Z H, Hills A, Bätz U, Amtmann A, Lew V L, Blatt M R. Systems dynamic modeling of the stomatal guard cell predicts emergent behaviors in transport, signaling, and volume control[J]. Plant Physiol, 2012,159(3):1235-1251.doi:10.1104/pp.112.197350.