光是影响植物生长最关键的环境条件之一,对植物光合作用、光形态建成等过程有重要的调控作用[1],若植物长期处于弱光环境会导致生长缓慢、产量和品质下降等[2]。随着现代农业技术的突飞猛进,人工光源的运用已成为设施栽培提高产量的重要环节[3]。同时,现代农业的发展所造成的成本输出也大幅度上升,人工光源在植物工厂所消耗的费用占整个运行成本的50%~60%。发光二极管(Light-emitting diode,LED)作为一种新型节能光源得到了广泛关注[4]。LED发光材料选用的是固态半导体芯片,可用作植物生长光源,也可根据生长需要设计出最适合植物生长的波长[5]。利用LED对经济作物进行补光,能有效解决阴天等恶劣环境造成的不利影响[6],是提高作物产量及品质的有效途径。此外,LED发光材料两侧加的是直流电,所以LED不仅可以调节亮度,还可以调节频率和占空比(照光持续时间与其所在的光-暗周期的比值)[7],为脉冲光的研究提供了切实可行的媒介。
脉冲光是一种高频间歇性的光,它通过改变光量子通量密度(Photosynthetic photon flux density,PPFD)、频率和占空比来影响植物的生长发育[8]。换句话说,脉冲光LED相比连续光LED还能进一步节能。研究表明,一定频率和占空比组合下脉冲光几乎不会影响作物的产量,且大幅度地提高了植物的光能利用率。Son等[9]研究发现,75%占空比处理的生菜光合速率与连续光比没有显著性差异。王达菲[10]研究了90%占空比下不同频率(0.1,100.0,100 000.0 Hz)脉冲光对黄瓜幼苗生长的影响,发现频率越高,越有利于增加黄瓜幼苗叶绿素含量和光合作用的顺利进行。王晓旭等[11]研究发现,在不同频率及占空比的光处理下,生菜的形态、品质和净光合速率都有差异。低频率、低占空比的脉冲光虽然耗电量低,但不利于叶绿素的合成与光合作用。Jishi等[12]研究发现,高频、高占空比的脉冲光下生菜CO2吸收速率接近连续光,相反低频率、低占空比下的CO2吸收速率缓慢。本试验在前人关于脉冲光生菜净光合速率影响的研究基础上[13],设定了不同占空比的脉冲光,较全面地测定了不同占空比下生菜的光合参数和叶绿素荧光参数,从光合及荧光的角度进一步探究占空比是如何影响光合作用的,为探寻出适宜生菜生长的最佳LED节能补光灯提供理论基础。
1 材料和方法
1.1 试验材料
试验于2019年9-11月在西北农林科技大学园艺学院实验室进行。供试材料为玻璃生菜(Lactuca sative L.),种子由青县现代农业技术推广中心提供。基质选用内蒙古蒙肥生物科技有限公司提供的蒙大育苗基质。光源由西安因变光电科技有限公司生产的LED灯板和LED控制系统V1.0,灯板尺寸为35 cm×35 cm。
1.2 试验方法
将生菜种子在20 ℃催芽24 h后播于72孔的穴盘中,每孔2~3粒,置于光照培养箱进行育苗,光周期设置为14 h/10 h,白天和夜间温度分别为22,20 ℃,相对湿度控制在65%。待四叶一心时将生菜幼苗定植于营养钵(7 cm×7 cm×7 cm)中,并置于实验室内LED灯板下进行照光处理,灯板距底部起始距离为43 cm,LED光谱如图1所示。
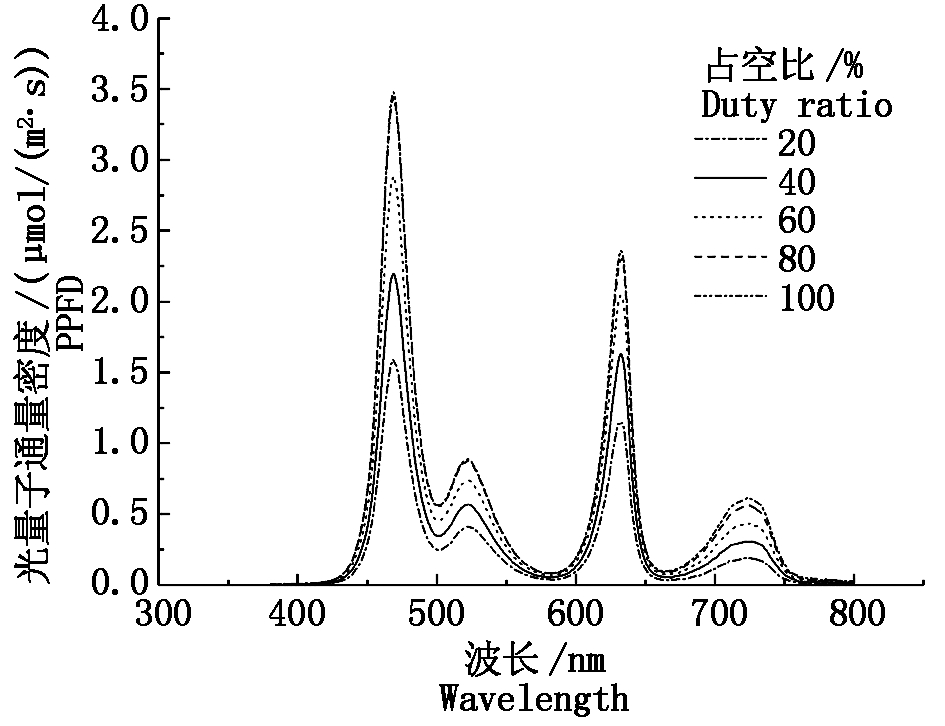
图1 LED的光谱分布
Fig.1 Spectral distribution of LED
1.3 试验设计
根据实验室前期牟孙涛等[13]的研究结果,本试验设置脉冲光频率为128 Hz,5个占空比分别为20%,40%,60%,80%,100%,其中100%占空比作为连续光对照。瞬时光量子通量密度设置为(200±3) μmol/(m2·s),用单相电子式电能表测定LED灯板及控制器日耗电量,具体参数设计及耗电情况如表1。将定植后的植株平均置于5个不同光源的灯板下,连续处理10 d,第11天分别测定相关指标,试验共重复3次。
1.4 项目测定及方法
1.4.1 叶绿素含量及生物量的测定 叶绿素含量用直接浸提法测定[14]。定植第11天时,每个处理随机取样3株,分别选取生长点向下第5片功能叶,用96%的乙醇浸泡24 h后,使用紫外分光光度计测定吸光值,并分别计算各色素含量,结果取平均值。定植第11天时每个处理随机选取5株用CP213电子天平测定地上部和地下部的鲜质量,然后将样品置于烘箱105 ℃杀青30 min,再在65 ℃的温度下烘干至恒质量后,测定其干质量。
表1 不同处理的参数设计及耗电情况
Tab.1 Parameter design and power consumption of different treatments
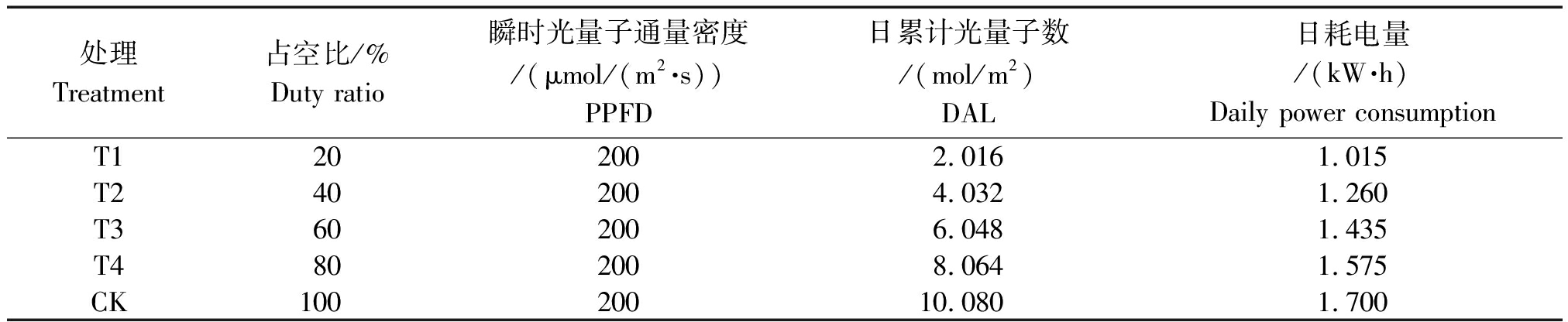
处理Treatment占空比/%Duty ratio瞬时光量子通量密度/(μmol/(m2·s))PPFD日累计光量子数/(mol/m2)DAL日耗电量/(kW·h)Daily power consumptionT1 20200 2.0161.015T2 40200 4.0321.260T3 60200 6.0481.435T4 80200 8.0641.575CK10020010.0801.700
1.4.2 光合参数测定 用LI-6800光合仪(美国 LI-COR 公司)测定光合参数。定植第11天,每个处理随机选5株,选取植株生长点下第5片真叶进行测定。光合仪环境条件设置如下:采用荧光叶室,光强设置为600 μmol/(m2·s),叶室温度设置为24 ℃,CO2浓度为400 μmol/mol,空气湿度为60%。待所有光合参数稳定后记录其净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)。叶片的瞬时光能利用率(Light use efficiency,LUE)参照Long等[15]的方法,LUE=Pn/PPFDave,脉冲光平均光量子通量密度:PPFDave=PPFD×Duty ratio,即脉冲光下叶片的瞬时光能利用率LUE=Pn/(PPFD×Duty ratio)。
1.4.3 叶绿素荧光参数测定 叶绿素荧光参数选用Dual-PAM-100叶绿素荧光仪(德国WALZ)测定。定植第11天时测定相关指标,每处理随机选取5株,选取生长点往下第5片真叶进行测量。测量前先将生菜叶片用DLC-8叶夹暗适应30 min,使得PSⅡ反应中心全部处于开放状态;然后打开测量光,记录暗适应后的最小荧光Fo;紧接着打开一个持续时间1 s的饱和脉冲光,测量并记录暗适应后的最大荧光Fm;饱和脉冲光关闭后荧光迅速回到Fo附近,然后打开光化光,记录叶绿素荧光从黑暗转到光照的响应过程,待荧光曲线达到稳态后关闭光化光,结束整个测量过程,记录并保存荧光数据。荧光测定过程中的测量光、光化光和饱和脉冲光的强度分别为0.5,333.0,16 000.0 μmol/(m2·s)。具体测定的参数及计算公式如表2。其中 Fo、Fm、Fv分别为暗适应下的初始荧光、最大荧光和最大可变荧光;Fo′、Fm′、Fs分别为光下的最小荧光、最大荧光和稳态荧光;c=0.84×0.5,其中0.84表示被吸收的光量子占总辐射的84%,而0.5是指假设激发能量是平均分配给PSⅡ和PSⅠ的[16]。
表2 叶绿素荧光参数及计算公式
Tab.2 Chlorophyll fluorescence parameters and calculation formula

参数Parameter概念描述The concept description计算公式Computational formulaFv/FmPSⅡ最大光量子效率(Fm-Fo)/FmFv′/Fm′PSⅡ有效光量子效率(Fm′-Fo′)/Fm′Y(Ⅱ)光下PSⅡ实际光量子效率(Fm′-Fs)/Fm′ETR光合电子传递速率c·Y(Ⅱ)·PPFDqL光化学淬灭(Fm′-Fs)/(Fm′-Fo′)/(Fo′-Fs)NPQ非光化学淬灭(Fm-Fm′)/Fm′Y(NO)PSⅡ非调节性能量耗散的光量子效率Fs/FmY(NPQ)PSⅡ调节性能量耗散的光量子效率F/Fm′-Fs/Fm
1.4.4 数据分析方法 采用Microsoft Excel 2013进行数据处理,采用SPSS 23.0对数据进行方差分析,用Origin 2017软件进行绘图。
2 结果与分析
2.1 不同占空比脉冲光对生菜叶绿素含量的影响
不同占空比脉冲光对生菜叶绿素含量的影响如表3所示。由表3可以看出,叶绿素a、叶绿素b、叶绿素(a+b)和类胡萝卜素的含量均随着占空比的增加而呈现上升的趋势。与CK相比,T1和T2处理的各叶绿素含量显著降低,叶绿素a分别降低了31.41%,24.36%,叶绿素b 分别降低了32.76%,24.46%,类胡萝卜素分别降低了29.71%,22.46%,而T3和T4处理与CK无显著差异。
表3 不同占空比脉冲光对生菜叶绿素含量的影响
Tab.3 Effect of pulsed light with different duty ratio on chlorophyll content of lettuce mg/g

处理Treatment叶绿素aChl a叶绿素bChl b叶绿素(a+b)Chl(a+b)类胡萝卜素CarT10.428±0.02b0.127±0.01b0.555±0.02b0.097±0.01bT20.472±0.02b0.139±0.02b0.610±0.03b0.107±0.00bT30.590±0.02a0.156±0.01ab0.746±0.03a0.136±0.01aT40.657±0.02a0.181±0.01a0.838±0.02a0.145±0.01aCK0.624±0.03a0.184±0.02a0.808±0.05a0.138±0.01a
注:同列数据后标不同字母者表示差异达显著水平(P<0.05)。表4-5同。
Note:Data in the same column with different letters indicate significant difference(P<0.05).The same as Tab.4-5.
2.2 不同占空比脉冲光对生菜光合特性及生物量的影响
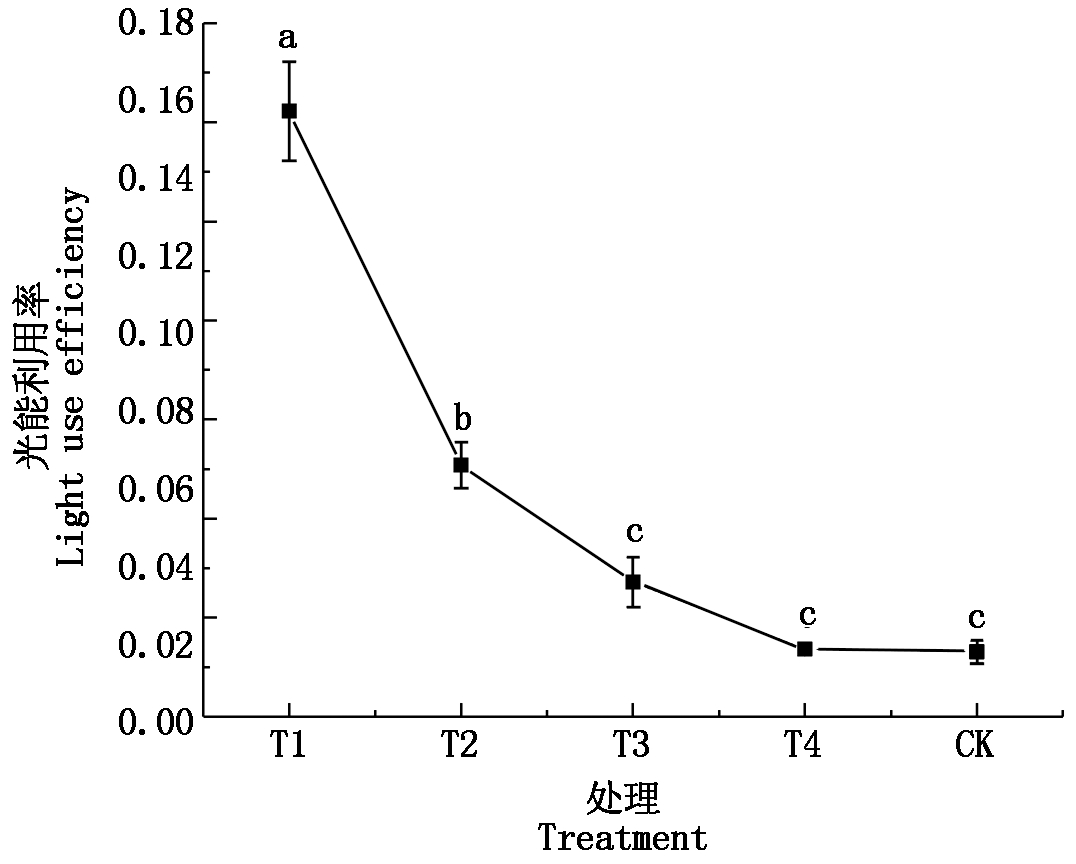
不同占空比对生菜光合参数的影响如表4所示。不同处理的净光合速率随着占空比的增加呈现上升的趋势,且CK处理的净光合速率显著高于其他处理,T1、T2、T3、T4处理相对CK分别降低了38.94%,29.52%,24.16%,19.17%。蒸腾速率和气孔导度方面同为CK最高,其次是T2处理。在胞间CO2浓度上,T1处理相比CK高了22.93%,CK与T2、T3处理之间无显著差异,T4处理的胞间CO2浓度最低。如图2所示,T1处理LUE最高,T1、T2处理的LUE显著高于CK,分别比CK提高了2.06,0.72倍,T3和T4处理与CK无显著差异。
表4 不同占空比处理对生菜光合参数的影响
Tab.4 Effects of different duty ratio treatments on photosynthetic parameters of lettuce
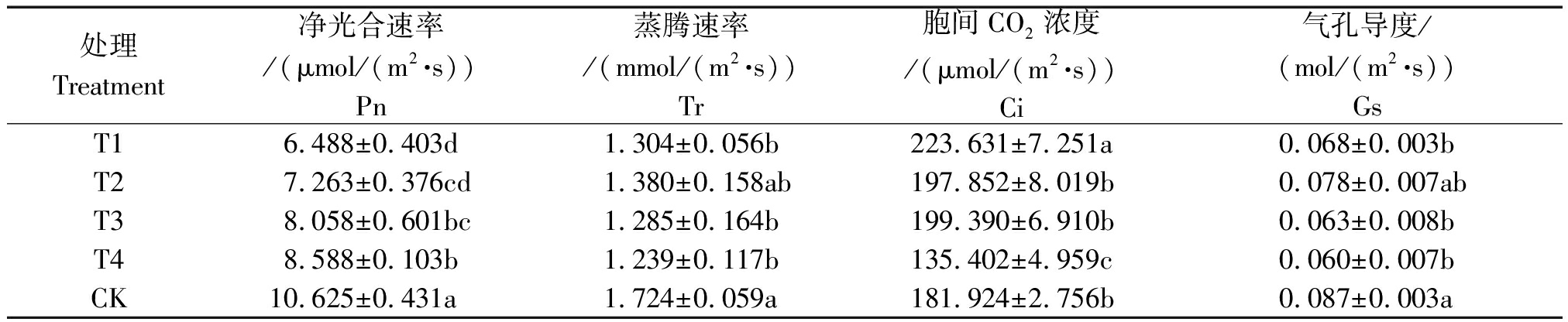
处理Treatment净光合速率/(μmol/(m2·s))Pn蒸腾速率/(mmol/(m2·s))Tr胞间CO2浓度/(μmol/(m2·s))Ci气孔导度/(mol/(m2·s))GsT16.488±0.403d1.304±0.056b223.631±7.251a0.068±0.003bT27.263±0.376cd1.380±0.158ab197.852±8.019b0.078±0.007abT38.058±0.601bc1.285±0.164b199.390±6.910b0.063±0.008bT48.588±0.103b1.239±0.117b135.402±4.959c0.060±0.007bCK10.625±0.431a1.724±0.059a181.924±2.756b0.087±0.003a
不同小写字母表示处理间差异达显著水平(P<0.05)。图3同。
Different lowercase letters indicate significant
difference between treatments at P<0.05.The same as Fig.3.
图2 不同占空比的光能利用效率
Fig.2 Light use efficiency with different duty ratio
不同占空比对生菜生物量的影响如表5所示。由表5可以看出,T1、T2、T3处理的地上部鲜质量显著低于CK,分别降低了31.74%,17.35%,18.74%,而T4处理与CK无显著差异;地下部鲜质量除了T1外,其他均与CK无显著差异。在干质量方面,地上部的T3、T4处理与CK无显著差异,T1、T2要低于CK处理,地下部分除T1外均与CK无显著差异。T3、T4处理的根冠比要比T1高出了76.92%,56.8%,但各处理和CK比均无显著差异。
2.3 不同占空比脉冲光对生菜叶绿素荧光参数的影响
Fv/Fm和Fv′/Fm′分别代表暗适应下的PS Ⅱ最大光化学量子效率和光适应下PS Ⅱ有效光化学量子效率。如图3所示,Fv/Fm在T3处理达到最高,T1、T2相对较低,其他处理与CK没有显著差异。Fv′/Fm′随占空比的增加呈上升趋势,T4处理Fv′/Fm′最高,比CK高出了6.44%,而T1和T2处理显著低于CK。Y(Ⅱ)和ETR分别代表PS Ⅱ实际光化学量子效率和表观光合电子传递速率。从图3可以看出,Y(Ⅱ)和ETR均随占空比的增加而提高,T1处理的Y(Ⅱ)显著低于CK和T4。非光化学淬灭NPQ与PSⅡ调节性能量耗散的光量子效率Y(NPQ)变化趋势一致,即与占空比的增加呈负相关,且NPQ和Y(NPQ)的T4处理分别比CK低了37.08%,33.86%。20%占空比下测得的光化学淬灭qL要低于CK和其他处理,其他处理与CK间无显著差异。PS Ⅱ非调节性能量耗散的光量子效率Y(NO)在T4与T1、T2、T3之间存在显著差异,但各处理与CK差异不显著。
表5 不同占空比处理对生菜生物量的影响
Tab.5 Effects of different duty ratio treatments on the biomass of lettuce
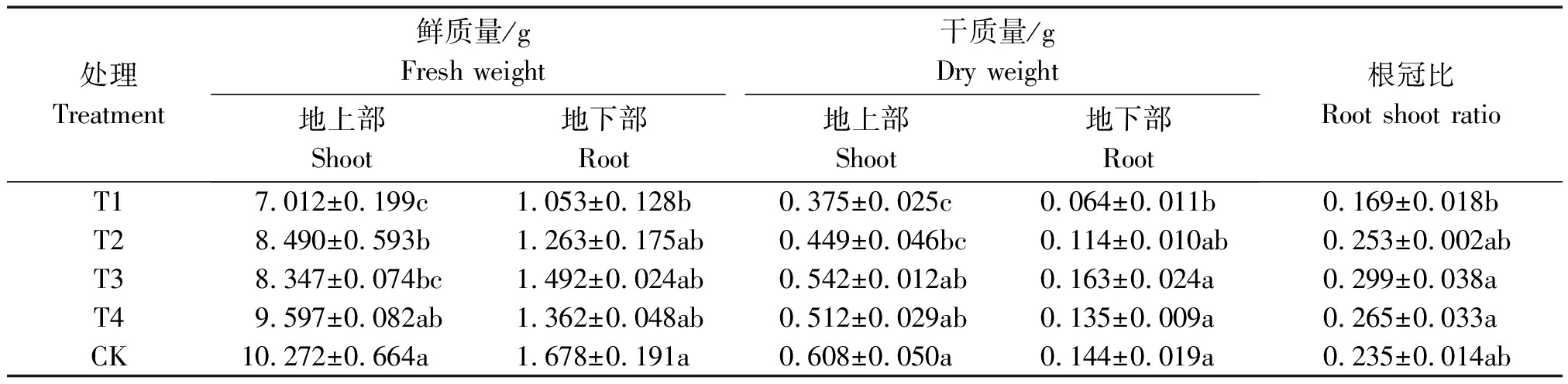
处理Treatment鲜质量/gFresh weight干质量/gDry weight地上部Shoot地下部Root地上部Shoot地下部Root根冠比Root shoot ratioT17.012±0.199c1.053±0.128b0.375±0.025c0.064±0.011b0.169±0.018bT28.490±0.593b1.263±0.175ab0.449±0.046bc0.114±0.010ab0.253±0.002abT38.347±0.074bc1.492±0.024ab0.542±0.012ab0.163±0.024a0.299±0.038aT49.597±0.082ab1.362±0.048ab0.512±0.029ab0.135±0.009a0.265±0.033aCK10.272±0.664a1.678±0.191a0.608±0.050a0.144±0.019a0.235±0.014ab

图3 不同占空比对生菜叶绿素荧光参数的影响
Fig.3 Effects of different duty ratio on chlorophyll fluorescence parameters of lettuce
3 讨论与结论
3.1 占空比对生菜光合色素的影响
叶绿素是植物重要的光合色素,主要功能是参与光能的捕获和驱动电子传递[17]。光照对叶绿素含量及色素蛋白复合体的活性有密切的联系[18]。由本试验结果可看出,低占空比脉冲光的叶绿素含量显著低于连续光,而高占空比的与连续光无显著差异,可能是因为低占空比的脉冲光,暗期在短周期中占比较大,会导致Mg离子螯合酶的活性降低,进而影响了捕光色素蛋白的合成[19]。这与王达菲等[20]的研究结果一致,但与丁娟娟[21]的结果不同,可能是试验设定的频率差别较大。
3.2 占空比对生菜光合、生物量及光能利用率的影响
在本试验中,净光合速率随占空比的增加而提高,且占空比越高Pn越接近连续光。不同占空比Pn低于连续光的原因可能是在每个短周期中光期所提供的光量子不足以支撑整个周期的光合作用。换句话说,光反应阶段形成的NADPH和ATP难以维持整个光合电子传递过程的动态平衡,使得光反应和暗反应阶段的能量稳定性降低,形成一种类似于弱光的环境,从而导致叶片中的RuBP羧化酶含量降低,光合中间产物减少,限制了CO2的同化速率[22-23]。但高占空比的Pn也没达到和连续光差异不显著的水平,这与牟孙涛等[13]的研究结果不一致,原因可能是本试验设计的PPFD高于牟孙涛等[13]的试验。脉冲光对植株Pn的影响取决于频率、占空比和PPFD,在频率和占空比不变的情况下,PPFD越低,植株的Pn越接近相同PPFD下连续光的Pn[7]。不同处理的生菜叶片气孔导度和蒸腾速率与Pn的变化趋势不一致,这表明不同占空比下的Pn不受气孔因素的影响。胞间CO2浓度与占空比呈反比,且80%占空比显著低于连续光处理,说明高占空比有利于刺激细胞对CO2的吸收[24],但这并没有因此使得Pn超越连续光处理,具体原因仍需进一步探究。在生物量方面,60%和80%占空比的干质量已和连续光处理没有显著性差异,说明在128 Hz的频率下,高占空比在干物质积累上已和连续光非常接近了。另外,20%占空比的根冠比要低于其他处理,说明低占空比更有利于生物量向地上部的分配,但总生物量与连续光处理的生菜相比仍有较大差距。
已有研究表明,用脉冲光照射植物是一种能提高植物光能利用率和实现光能高效转化的方法[24]。Xue等[25]发现脉冲光下的钝顶螺旋藻的LUE要高于连续光,且光强越大效果越明显。Klueter 等[26]研究发现,脉冲光的频率越高,黄瓜叶片的光能利用率越低。Jishi等[7]在研究不同脉冲光对生菜光合影响的研究中发现,较高频率下的LUE不会随着频率升高而显著下降,但10 Hz以下,LUE会随着频率的降低而下降。本试验可以明显看出,128 Hz频率下的LUE随着占空比的升高而显著降低,说明占空比越低,光能利用效率就越高,这与Cho等[27]的研究结果一致。
3.3 占空比对生菜叶绿素荧光特性的影响
叶绿素荧光参数是间接反映不同的光对植物光合作用影响的探针[28]。Fv/Fm是植物通过充分暗适应后PSⅡ的光化学量子效率[29],主要被用作植物非生物胁迫的响应指标[30],正常或最佳值会稳定在0.83左右[31]。本试验中,各占空比处理的Fv/Fm在0.819~0.836,与连续光相近,说明在此频率下的脉冲光对生菜的光合系统功能未造成损害。Fv′/Fm′反映的是光下在所有的PS Ⅱ反应中心都开放时的光能转化效率[29]。本试验能明显看出Fv′/Fm′随占空比的变化呈上升的趋势。在所有反应中心都打开时,占空比越高,PS Ⅱ光化学效率越高。
Y(Ⅱ) 表示在光化学中被与PSⅡ相关的叶绿素吸收的光能的比例,该参数和碳固定效率存在很强的线性关系[32]。ETR反映的是实际光强下的线性电子传递速率,且直接依赖于Y(Ⅱ)的线性方程[33]。在 Olvera-González等[34]的研究中,低频率50%占空比下的脉冲光Y(Ⅱ)和ETR显著提高。Dong等[35]发现,70%和80%占空比的脉冲光下小麦植物的Y(Ⅱ)和ETR明显高于连续光。本试验中,随着占空比增加,Y(Ⅱ)和ETR则会提高,且80%占空比高于连续光处理,说明高占空比的脉冲光相比连续光有利于诱导植株叶片的光能转化效率和速率的提升,这与Dong等[35]的研究结果一致。而且叶绿素含量越高,在电子传递效率上越高,本试验测得的ETR和叶绿素含量变化趋势一致。Y(NPQ)是植物光保护的重要指标,在光能的分配方面,Y(NPQ)与Y(Ⅱ)呈负相关[36]。本试验中低占空比处理的Y(NPQ)要明显高于连续光,一方面说明植株接收的光能过剩,过多的光能耗散成了热;另一方面说明,植物本身仍可以通过调节转化过剩的光能来保护自己。Y(NO)与Y(Ⅱ)、Y(NPQ)之和为1。本研究发现,不同占空比脉冲光处理下的Y(NO)与连续光之间并无显著性差异,表明该频率下脉冲光没有超出自我保护能力,未受到光损伤。
qL反映的是PS Ⅱ反应中心的开放比例和原初电子受体QA 的还原状态[37]。本试验中,20%占空比处理的qL值低于连续光和其他较高占空比,说明低占空比会降低PSⅡ反应中心的开放程度,从PSⅡ氧化侧向PSⅡ反应中心的电子流动受到抑制[38]。而其他占空比下的脉冲光qL与连续光没有显著差异,基本没有受影响。非光化学淬灭NPQ表示光合色素吸收的光能无法参与光化学反应而转换成热的部分。本试验中,NPQ随占空比的升高逐渐降低,说明占空比越低,吸收的光能就越多的无法用于光化学反应而转化为了热量。热耗散与叶黄素关系密切,低占空比NPQ高可能是因为植株难以适应这种暗期较长的脉冲光环境,加速了叶黄素循环过程,使得光能向热耗散转化,以保护自身。总体来说,此频率下高占空比的脉冲光对生菜的叶绿素荧光参数产生了同等或优于连续光的效果。而这效果仅限于在128 Hz的频率下,其他频率下不同占空比对叶绿素荧光参数的影响还需进一步探究。
128 Hz频率下不同占空比的脉冲光对生菜的叶绿素、生物量、LUE、光合及荧光特性产生了影响。叶绿素含量、净光合速率、Fv′/Fm′、Y(Ⅱ)、ETR、NPQ均随占空比的增加呈现一定的变化规律。高占空比下的叶绿素含量、干质量、Y(Ⅱ)、ETR、qL和连续光相比已没有显著差异,且80%占空比的Fv′/Fm′、NPQ、Y(NPQ)等参数均优于连续光处理,更有利于植物叶片光能的吸收和转化效率的提高。低占空光能利用率虽然最高,但不利于生菜的光合作用及有机物的积累。
[1] 邵丽,杨小龙,王蕊,须晖. 设施栽培蔬菜光环境及调控研究进展[J]. 中国蔬菜,2018(8):19-26.
Shao L,Yang X L,Wang R,Xu H. Research progress on light environment and regulation for facility vegetables[J]. China Vegetables,2018(8):19-26.
[2] 徐圆圆,覃仪,吕蔓芳,刘旭庆,韦素洁,杨梅. LED光源在植物工厂中的应用[J]. 现代农业科技,2016(6):161-162,170.doi:10.3969/j.issn.1007-5739.2016.06.100.
Xu Y Y,Qin Y,Lü M F,Liu X Q,Wei S J,Yang M. Current status and developmental trends of LED light source utilization in plant factory[J]. Modern Agricultural Science and Technology,2016(6):161-162,170.
[3] 徐永. 光电子农业及其在设施园艺中的应用[J]. 山西农业大学学报(自然科学版),2016,36(2):77-84. doi:10.3969/j.issn.1671-8151.2016.02.001.
Xu Y. Optoelectronic agriculture and its application in facility horticulture[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2016,36(2):77-84.
[4] 张莉,喻晓鹏,黄依婷,袁毅凯,梁丽芳,李程. LED人工补光在植物照明中的应用及发展趋势[J]. 佛山科学技术学院学报(自然科学版),2019,37(1):50-55. doi:10.13797/j.cnki.jfosu.1008-0171.2019.0009.
Zhang L,Yu X P,Huang Y T,Yuan Y K,Liang L F,Li C.Application and development trend of LED artificial light for plant lighting[J]. Journal of Foshan University(Natural Science Edition),2019,37(1):50-55.
[5] Hogewoning S W,Trouwborst G J,Engbers G,Harbinson J,Van Ieperen W,Ruijsch J,Van Kooten O,Schapendonk A H C M,Pot C S. Plant physiological acclimation to irradiation by light-emitting diodes(LEDs)[J]. Acta Horticulturae,2007,761:183-191.doi:10.17660/ActaHortic.2007.761.23.
[6] 耿博,龙家焕,郑梦影,孔乐,尤杰,苗辰. 高压钠灯与LED灯在植物补光中的应用特性分析[J]. 黑龙江农业科学,2018(8):65-69.doi:10.11942/j.issn1002-2767.2018.08.0065.
Geng B,Long J H,Zheng M Y,Kong L,You J,Miao C.Analysis of application characteristics of high pressure sodium lamp and LED lamp in plant light supply[J]. Heilongjiang Agricultural Sciences,2018(8):65-69.
[7] Jishi T,Matsuda R,Fujiwara K. Effects of photosynthetic photon flux density,frequency,duty ratio,and their interactions on net photosynthetic rate of cos lettuce leaves under pulsed light:explanation based on photosynthetic-intermediate pool dynamics[J]. Photosynthesis Research,2018,136(3):371-378. doi:10.1007/s11120-017-0470-z.
[8] Avercheva O V,Berkovich Y A,Konovalova I O,Radchenko S G,Lapach S N,Bassarskaya E M,Kochetova G V,Zhigalova T V,Yakovleva O S,Tarakanov I G. Optimizing LED lighting for space plant growth unit:Joint effects of photon flux density,red to white ratios and intermittent light pulses[J]. Life Sciences in Space Research,2016,11:29-42.doi:10.1016/j.lssr.2016.12.001.
[9] Son K H,Jeon Y M,Oh M M. Application of supplementary white and pulsed light-emitting diodes to lettuce grown in a plant factory with artificial lighting[J]. Horticulture,Environment and Biotechnology,2016,57(6):560-572. doi:10.1007/s13580-016-0068-y.
[10] 王达菲. LED连续光和不同频率间歇光对黄瓜幼苗生长及光合荧光特性的影响[D].杨凌:西北农林科技大学,2016.
Wang D F. Effects of LED continuous light and different frequency intermittent light on growth and photosynthetic fluorescence characteristics of cucumber seedlings[D]. Yangling:Northwest A&F University,2016.
[11] 王晓旭,何蔚,陈丹艳,陈乐涵,胡晓婷,杨振超. 弱光条件下LED补光灯的频率和占空比对生菜生长的影响[J]. 西北农林科技大学学报(自然科学版),2017,45(12):103-111,120. doi:10.13207/j.cnki.jnwafu.2017.12.015.
Wang X X,He W,Chen D Y,Chen L H,Hu X T,Yang Z C. Effect of frequencies and duty ratios of LED on lettuce growth under low photon flux intensity[J]. Journal of Northwest A&F University(Natural Science Edition),2017,45(12):103-111,120.
[12] Jishi T,Fujiwara K,Nishino K,Yano A. Pulsed light at lower duty ratios with lower frequencies is less advantageous than continuous light for CO2 uptake in Cos lettuce[J]. Journal of Light & Visual Environment,2012,36(3):88-93. doi:10.2150/jlve.IEIJ120000482.
[13] 牟孙涛,王嘉萱,辛鑫,杨振超,武勇军. 不同脉冲光对生菜生长、品质及光合特性的影响[J]. 中国农业科技导报,2020,22(5):35-41. doi:10.13304/j.nykjdb.2019.0071.
Mou S T,Wang J X,Xin X,Yang Z C,Wu Y J. Effects of different pulsed light on growth,quality and photosynthetic characteristics of lettuce[J]. Journal of Agricultural Science and Technology,2020,22(5):35-41.
[14] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
Gao J F. Experimental guidance of plant physiology [M]. Beijing:Higher Education Press,2006.
[15] Long S P,Baker N R,Raines C A. Analysing the responses of photosynthetic CO2 assimilation to long-term elevation of atmospheric CO2 concentration[J]. Vegetati,1993,104/105:33-46. doi:10.1007/978-94-011-1797-5_3.
[16] 岑海燕,姚洁妮,翁海勇,徐海霞,朱月明,何勇. 叶绿素荧光技术在植物表型分析的研究进展[J]. 光谱学与光谱分析,2018,38(12):3773-3779.doi:10.3964/j.issn.1000-0593(2018):12-3773-07.
Cen H Y,Yao J N,Weng H Y,Xu H X,Zhu Y M,He Y. Applications of chlorophyll fluorescence in plant phenotyping:a review[J]. Spectroscopy and Spectral Analysis,2008,38(12):3773-3779.
[17] 闫震,聂继云,程杨,关棣锴,李志霞. 水果、蔬菜及其制品中叶绿素含量的测定[J]. 中国果树,2018(2):59-62,72. doi:10.16626/j.cnki.issn1000-8047.2018.02.018.
Yan Z,Nie J Y,Cheng Y,Guan D K,Li Z X.Determination of chlorophyll content in fruits,vegetables and their products[J]. China Fruits,2018(2):59-62,72.
[18] Leong T Y,Anderson J M. Adaptation of the thylakoid membranes of pea chloroplasts to light intensities. I. Study on the distribution of chlorophyll-protein complexes[J]. Photosynthesis Research,1984,5(2):105-115. doi:10.1007/BF00028524.
[19] Cornah J E,Terry M J,Smith A G. Green or red:what stops the traffic in the tetrapyrrole pathway?[J]. Trends in Plant Science,2003,8(5):224-230. doi:10.1016/S1360-1385(03)00064-5.
[20] 王达菲,杨振超,蔡华,王晓旭,何蔚. LED连续光和不同频率间歇光对黄瓜幼苗生长及光合特性的影响[J]. 北方园艺,2016,40(19):55-59. doi:10.11937/bfyy.201619015.
Wang D F,Yang Z C,Cai H,Wang X X,He W. Effect of continuous light and intermittent light with different frequencies of LED on the growth and photosynthesis of cucumber seedlings[J].Northern Horticulture,2016,40(19):55-59.
[21] 丁娟娟. LED不同占空比对生菜生长、产量、品质及光合特性的影响[D].杨凌:西北农林科技大学,2014.
Ding J J. Effects of LED different duty ratio on lettuce growth,yield,quality and photosynthetic characteristics [D]. Yangling:Northwest A&F University,2014.
[22] Syvertsen J P,Smith M L. Light acclimation in citrus leaves.I .Changes in physical characteristics,chlorophyll,and nitrogen content[J]. J Amer Soc Hor Sci,1984,109(6):812-817.
[23] 薛占军,朱翠敏,高志奎,高荣孚. 占空比对频闪光下番茄叶片光合机构的动态影响[J]. 北方园艺,2017,41(13):1-6.doi:10.11937/bfyy.20170782.
Xue Z J,Zhu C M,Gao Z K,Gao R F. Dynamic of photosynthetic apparatus in tomato leaf as a response to duty cycle of pulsed light[J]. Northern Horticulture,2017,41(13):1-6.
[24] 宋阳,杜宪,王鹏,廉博,崔世茂,叶丽红. CO2加富对黄瓜幼苗光合特性及生长发育的影响[J]. 内蒙古农业大学学报(自然科学版),2020,41(2):13-19. doi:10.16853/j.cnki.1009-3575.2020.02.003.
Song Y,Du X,Wang P,Lian B,Cui S M,Ye L H. Effect of CO2 enrichment on growth and photosynthetic characteristic of cucumber seedlings[J].Journal of Inner Mongolia Agricultural University(Natural Science Edition),2020,41(2):13-19.
[25] Xue S Z,Su Z F,Cong W.Growth of Spirulina platensis enhanced under intermittent illumination[J]. Journal of Biotechnology,2011,151(3):271-277.doi:10.1016/j.jbiotec.2010.12.012.
[26] Klueter H H,Bailey W A,Zachariah G L,Peart R M. Photosynthesis in cucumbers with pulsed or continuous light[J]. Transactions of the Asae,1980,23(2):437-442.doi:10.13031/2013.34600.
[27] Cho K J,Cho J Y,Park I S,Kim J,Oh W. The effects of duty ratio and intensity of pulsed LED light on growth and photosynt-hetic rate of lettuce grown in a plant factory system[J]. Journal of Korean Society for People,Plants and Environment,2013,16(6):427-434. doi:10.11628/ksppe.2013.16.6.427.
[28] Rascher U,Liebig M,Lüttge U. Evaluation of instant light-response curves of chlorophyll fluorescence parameters obtained with a portable chlorophyll fluorometer on site in the field[J]. Plant Cell & Environment,2000,23(12):1397-1405. doi:10.1046/j.1365-2000.00650.x.
[29] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.doi:10.3969/j.issn.1674-3466.1999.04.021.
Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].Chinese Bulletin of Botany,1999,16(4):444-448.
[30] Hong S S,Xu D Q. Light-induced increase in initial chlorophyll fluorescence Fo level and the reversible inactivation of PS Ⅱ reaction centers in soybean leaves[J]. Photosynthesis Research,1999,61(3):269-280. doi:10.1023/A:1006357203466.
[31] Maxwell K,Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51(345):659-668. doi:10.1093/jexbot/51.345.659.
[32] 王玉英,白晓云,段正瑞,叶长宁,赵聃,李枝林. 不同LED光源对百合组培苗小子球繁育的影响[J]. 北方园艺,2019(24):68-73.
Wang Y Y,Bai X Y,Duan Z R,Ye C N,Zhao D,Li Z L. Effects of different LED light sources on the breeding of small balls of lily tissue culture seedlings[J]. Northern Horticulture,2019(24):68-73.
[33] Baker N R. Chlorophyll fluorescence:a probe of photosynthesis in vivo[J]. Annu Rev Plant Biol,2008,59:89-113. doi:10.1146/annurev.arplant.59.032607.092759.
[34] Olvera-González E,Alaniz-Lumbreras D,Ivanov-Tsonchev R,Villa-Hernández J,de la Rosa-Vargas I,López-Cruz I,Silos-Espino H,Lara-Herrera A. Chlorophyll fluorescence emission of tomato plants as a response to pulsed light based LEDs[J]. Plant Growth Regulation,2013,69(2):117-123. doi:10.1007/s10725-012-9753-8.
[35] Dong C,Shao L Z,Liu G H,Wang M J,Liu H,Xie B Z,Li B W,Fu Y M,Liu H. Photosynthetic characteristics,antioxidant capacity and biomass yield of wheat exposed to intermittent light irradiation with millisecond-scale periods[J]. Journal of Plant Physiology,2015,184:28-36. doi:10.1016/j.jplph.2015.06.012.
[36] 林琭,汤昀,张纪涛,闫万丽,肖建红,丁超,董川,籍增顺. 不同水势对黄瓜花后叶片气体交换及叶绿素荧光参数的影响[J]. 应用生态学报,2015,26(7):2030-2040. doi:10.13287/j.1001-9332.20150506.026.
Lin L,Shang Y,Zhang J T,Yan W L,Xiao J H,Ding C,Dong C,Ji Z S. Effects of different water potentials on leaf gas exchange and chlorophyll fluorescence parameters of cucumber during post-flowering growth stage[J]. Chinese Journal of Applied Ecology,2015,26(7):2030-2040.
[37] Moreno S G,Perales-Vela H V,Alvarez M O S. La fluorescencia de la clorofila a como herramienta en la investigación de efectos tóxicos en el aparato fotosinté tico de plantas y algas[J]. Revista De Educación Bioquímica,2008,27(4):119-129.
[38] 李泽,谭晓风,卢锟,张琳,龙洪旭,吕佳斌,林青. 干旱胁迫对两种油桐幼苗生长、气体交换及叶绿素荧光参数的影响[J].生态学报,2017,37(5):1515-1524.doi:10.5846/stxb21509201939.
Li Z,Tan X F,Lu K,Zhang L,Long H X,Lü J B,Lin Q. Influence of drought stress on the growth,leaf gas exchange,and chlorophyll fluorescence in two varieties of tung tree seedlings[J]. Acta Ecologica Sinica,2017,37(5):1515-1524.